Клинико-химические, как и все количественные измерения, принципиально отягощены возможностью ошибок. Весь процесс клинического исследования можно разделить на 4 этапа: взятие пробы, хранение пробы, анализ, оценка и выдача результата. Ошибки, возникающие на разных этапах работы, бывают внелабораторного и внутрилабораторного характера.
Внелабораторные ошибки
Существенным источником внелабораторных ошибок является трудность учета времени последнего приема пищи больным. Поэтому следует унифицировать время взятия крови и применять для исследования кровь, взятую натощак. Эмоциональное состояние пациента, время суток, положение тела больного оказывают влияние на количественные и качественные показатели крови.
Все указанные выше факторы погрешностей связаны с состоянием больного. Но нельзя недооценивать и ряд других факторов, которые также отражаются на качестве результатов: техника взятия крови, используемые при этом инструменты, сосуды, в которых хранится кровь. Иглы, применяемые для взятия крови, должны иметь достаточно большой диаметр, чтобы не возникало повреждения эритроцитов. Посуда и инструменты для взятия крови не должны содержать следов моющих средств, должны быть сухими.
Весьма существенной причиной возникновения погрешностей анализа является нарушение условий хранения проб. Уже одно более длительное стояние сыворотки над эритроцитами может привести к изменению концентраций компонентов. Сыворотка должна быть отделена от кровяного сгустка не позднее двух часов после взятия крови.
Упомянутые источники погрешностей не поддаются качественному и количественному контролю, их в большинстве случаев не очень легко распознать, исключить погрешности можно только тщательной и кропотливой работой. Следует добиться стандартизованных условий, обязательных при взятии проб крови. Необходимо регулярное инструктирование персонала клиник и амбулаторий о правилах и условиях сбора и хранения материала для различных клинико-диагностических исследований.
Внутрилабораторные ошибки
Надежность результатов исследования при проведении анализов в лаборатории зависит от целого ряда факторов. Погрешность в аналитическом процессе — это внутрилабораторные ошибки, появление и предупреждение которых зависит только от работников лабораторий.
Результаты анализов в большой мере зависят от индивидуальных способностей лабораторного персонала, важным фактором является и качество применяемых измерительных инструментов. Существенным источником ошибок является приготовление стандартных растворов, который может иметь иную концентрацию, чем должна быть по расчету. Многочисленность применяемых методов, из которых большая часть уже устарела, также является частой причиной многих ненадежных результатов. Помочь этому может последовательное внедрение унифицированных методов.
Наиболее распространена следующая классификация ошибок. Различают три основных вида ошибок: грубые, случайные и систематические.
Грубая ошибка — это одиночное значение исследуемого компонента, выходящее за пределы установленного для данного компонента области (за допустимые пределы погрешности). Причиной грубых ошибок является недостаточная тщательность в работе.
Случайная ошибка — одиночное значение, не выходящее за пределы установленной для данного компонента области. Случайными называются неопределенные по величине и знаку ошибки, в появлении каждой из которых не наблюдается какой-либо закономерности. Эти ошибки происходят при любом аналитическом определении. Наличие их сказывается в том, что повторные определения того или иного компонента в данном образце, выполненные одним и тем же методом, дают как правило несколько различающиеся между собой результаты. Случайные ошибки практически невозможно исключить совсем, они могут возникать из-за негомогенности пробы материала, недостаточно высокого качества оборудования, чаще случайные ошибки вызываются субъективными факторами. Этот вид ошибок можно значительно ограничить после оценки их размера, величина ошибки (разброс данных) является мерилом воспроизводимости лабораторных результатов. Чем меньше величина случайных ошибок, тем лучше воспроизводимость исследований. Распространенным способом характеристики воспроизводимости результатов является величина среднеквадратического отклонения.
Для суждения о правильности анализа совпадение или расхождение результатов параллельных проб не имеет значения. В этом случае на первый план выступают систематические ошибки.
Систематическими ошибками называют погрешности, одинаковые по знаку, имеющие определенную причину, влияющие на результат либо в сторону увеличения, либо в сторону уменьшения его. Систематические ошибки можно обычно предусмотреть или же ввести соответствующие поправки (ошибки методического характера). Систематические ошибки повторяются при каждом измерении, так как они вызываются постоянными причинами, влияют они на всю серию определений. В качестве причин могут выступать ошибки приборов (автоматические анализаторы, фотоэлектроколориметры) и неправильное приготовление реактивов, индивидуальные особенности работника (ошибочное восприятие окраски пробы). С введением биохимических анализаторов и автоматических дозаторов число случайных ошибок (ошибок манипуляций) уменьшается, но возрастает необходимость контроля за появлением систематических ошибок и увеличивается необходимость в контрольных материалах для их обнаружения. Величина систематической ошибки характеризует правильность результатов анализа.
Общепринятым способом выявления случайных ошибок служит постановка анализа в двух и более параллельных пробах. Для исключения случайных ошибок большое значение может иметь последовательная регистрация анализов, проводимых повторно у одного и того же больного. Регистрация и сопоставление результатов с динамикой клинического течения заболеваний позволяет лаборатории своевременно обратить внимание на немотивированный «скачок» того или иного показателя, который мог быть обусловлен случайной ошибкой.
Обнаружение и предупреждение систематических ошибок составляет более сложную задачу. Необходимо тщательное подведение итогов ежедневной работы лаборатории. Если оказывается, что в один из дней все или большинство результатов по данной методике сдвинуты в какую либо сторону, это должно натолкнуть на мысль о систематической ошибке, необходима самая тесная связь с клиникой.
Возникновению ошибок необходимо противопоставить постоянное измерение точности выполнения анализов, надежность работы лаборатории, т.е. контроль качества исследований.
I. Внелабораторные ошибки.
1.
Канцелярские ошибки, ошибки, при взятии
пробы
2.
Ошибочный больной,
3.
Ошибочный образец, ошибочное заполнение
бланка
II. Внутрилабораторные ошибки (аналитические ошибки)
определяемые
или неопределяемые или случайные
систематические
требуют
статистического
(реактивы,
оборудование) анализа для
заключения
I. Внелабораторные ошибки
1.
Ошибочно назван больной.
Два
больного с одинаковой фамилией (записывают
инициалы, возраст). Неправильно выписан
бланк — направление на другого больного
(созвучная фамилия и т.д.)
2. Ошибочно идентифицирован образец.
-
лаборант
берет образец 25 и отливает сыворотку
в пробирку 26 и т.д. -
после
окончания работы лаборант находит 2
образца под одинаковым номером.
3. Ошибочно заполненные бланки
-
в
образце 198 содержание глюкозы 108 мг,
лаборант выписывает величину 198 мг. -
в
сыворотке исследуют кальций и фосфор,
лаборант результат исследования
записывает наоборот.
4. Ошибки при взятии пробы:
Очень
много факторов влияют на результаты
анализов. Поэтому забор материала,
условия транспортировки унифицированы.
На
результаты исследования влияют:
-
Время
забора материала. -
Положение
больного. -
Нервное
возбуждение, физическая нагрузка. -
Время
года, климат, диагностические и лечебные
процедуры, лекарственные вещества. -
Хранение
и доставка материала:
Спинномозговую
жидкость исследуют и доставляют сразу
же. — 1ч. При длительном хранении мочи
изменяются физико-химические свойства.
Мочу нужно хранить в холодильнике. Можно
использовать консерванты:
-
хлороформенная
вода (5-5,7 мл на 1л воды)-20-30 мл хлороформенной
воды на 1 л мочи. -
жидкость
Мюллера — 10,0 г сульфанила,25 г бихромата
калия,100 г воды. На 100 мл мочи 5 мл смеси. -
несколько
кристалликов тимола.
II.Аналитические ошибки Типы аналитических ошибок и частота их возникновения
Технические
ошибки: Частота
(%)
Калибровка 16
Расчеты 2
Приготовление
пробы 11
Техника
исследования 6
Интерпрекация 4
Систематические
ошибки:
Реактивы 9
Аппаратура 24
ГРУБЫЕ
ОШИБКИ:
одиночное значение исследуемого
компонента, выходящее за допустимые
пределы погрешности.
Причины:
недостаточная тщательность в работе
(неправильная дозировка, ошибки в
расчетах, небрежность в методике)
СЛУЧАЙНЫЕ
ОШИБКИ:
одиночное значение не выходящее за
допустимые пределы погрешности, но
стремящиеся к выходу за эти пределы.
Случайная ошибка происходит при всяком
измерении, поэтому при определении
вещества в пробе повторно, получают не
одинаковые, а различающиеся между собой
результаты.
Причины:
-
Неравномерное
перемешивание пробы. -
Нестабильность
приборов, инструментария -
Неточность
работы персонала (ошибки в пепитировании,
неправильное считывание результатов)
Случайные ошибки
невозможно исключить, но можно ограничить.
СИСТЕМАТИЧЕСКИЕ
ОШИБКИ:
погрешности, одинаковые по знаку,
происходящие от определенных причин,
влияющие на результаты, либо в сторону
увеличения, либо в сторону уменьшения.
Наиболее часто встречаются следующие
виды систематических ошибок.
Причины:
-
Методические
ошибки — зависят от особенностей
применяемого метода (наиболее серьезные
причины и устранить их трудно) -
Ошибки,
зависящие от приборов и реактивов. -
Ошибки
оперативные — неправильное или неточное
выполнение аналитических операций. -
Ошибки
индивидуальные.
Последние три
причины систематических ошибок можно
устранить и свести до минимума.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
АННОТАЦИЯ
Процесс клинического лабораторного исследования включает три этапа: преаналитический, аналитический и постаналитический. Несмотря на то, что частота аналитических ошибок в клинических лабораториях существенно снизилась за счет автоматизации и современных технологий, ошибки, связанные с преаналитическим и постаналитическим этапами остаются значительными и требуют внимания специалистов по лабораторной медицине к тому, что происходит за пределами лаборатории. В интересах пациентов необходимо рассматривать любые прямые и косвенные негативные последствия, связанные с лабораторными исследованиями, независимо от того, на каком этапе возникает ошибка.
Введение. Клиническая безопасность пациента определяется правильной и своевременной диагностикой патологии и применением адекватных лечебных мероприятий (при минимальных побочных действиях) с целью достижения благополучного исхода случая заболевания [1] .
Согласно литературным данным на основе результатов лабораторных исследований принимаются до 60-70% клинических решений относительно диагноза заболевания и тактики лечения [2-4].
Как отмечает в своей публикации Меньшиков В.В., «процесс клинического лабораторного исследования – от решения врача назначить анализ до получения им результата анализа – проходит три этапа, в которых соответствующие процедуры выполняет несколько участников. Задача всех участников процесса заключается в том, чтобы как можно меньше изменить состав взятого у пациента образца и в результате анализа отразить с наибольшей точностью те его содержание и свойства, которыми обладает этот материал в организме пациента, и правильно интерпретировать результат, с тем, чтобы получить достоверную лабораторную информацию.
На всех этапах лабораторного процесса могут возникнуть отклонения, приводящие к ошибочному итогу – не вполне достоверной информации».
Автор демонстрирует следующий рисунок этапов клинического лабораторного исследования: до лабораторный, лабораторный и после лабораторный (рисунок 1)
В литературе встречаются и другие названия этапов лабораторного процесса: преаналитический, аналитический и постаналитический.
Следовательно, ошибки, связанные с проведением лабораторных исследований могут быть обусловлены многими причинами на различных этапах проведения: назначением лабораторного теста, не соответствующего клинической задаче; нарушением условий взятия образца биоматериала, его хранения, предварительной обработки и транспортировки; недостаточной квалификацией оператора; недостаточным учетом влияний биологической, ятрогенной, аналитической вариации при оценке результата исследования; неудовлетворительной нозологической интерпретацией результата исследования; задержкой передачи информации о критических изменениях лабораторных показателей и др. Целый комплекс факторов, которые могут оказывать существенное влияние на качество результатов анализов, находится в компетенции врачей-клиницистов и среднего медицинского персонала. Изучение этих факторов будет способствовать обеспечению качества результатов лабораторных исследований.
Целью данного обзора является изучение типов и частоты ошибок в лабораторной медицине на основе анализа международной научной литературы.
Материалы и методы. Были изучены результаты научных исследований в области лабораторной медицины за последние 10 лет. Поиск научных публикаций проводился в базах данных PubMed, Oxford University Press, Google Scholar.
Результаты. Проблема ошибок в клинической лаборатории в последнее время привлекает большое внимание, так как играет ключевую роль для медицинских услуг и может создавать серьезный риск, влияющий на жизнь пациента. Частота лабораторных ошибок значительно варьируется в зависимости от процедур диагностики и этапов всего процесса тестирования [5].
Как отмечают авторы, «частота аналитических ошибок в клинических лабораториях существенно снизилась за последние годы в результате активного движения за безопасность пациентов и внедрения передовых технологий в проведение лабо-
раторных тестов. Однако, по сравнению с медицинскими ошибками других типов, ошибкам в лабораторной медицине уделяется мало внимания. Ошибки в лабораторной медицине трудноопределимы, поскольку их трудно идентифицировать и, даже после обнаружения, понять их причину сложнее, чем в случае медицинских ошибок другого типа. Если сравнивать с неблагоприятными исходами, вызванными хирургическим и другими, зачастую совершенно очевидными, ошибками, совершенными в ходе лечения, лабораторные ошибки имеют тенденцию быть менее явными, указать время и место их совершения непросто» [6].
Традиционно процесс клинического лабораторного исследования подразделяется на 3 этапа:
- — преаналитический этап (назначение определенного исследования, взятие образца биоматериала, его предварительная обработка, хранение и транспортировка к месту проведения собственно анализа);
- — аналитический этап (идентификация образца биоматериала, необходимая обработка для получения аналитической пробы, применение аналитической технологии с использованием соответствующих реагентов и оборудования, получение описательного или количественного результата исследования);
- — постаналитический этап (оценка аналитической, биологической, клинической достоверности результата исследования, его нозологическая интерпретация, доставка результата назначившему исследование персоналу, хранение образца и результатов исследования в условиях и в течение сроков, установленных применительно к данному виду исследования и клинической задаче).
Большинство ошибок происходит на пре- и постаналитическом этапах (таблицы 1,2) [7]. Что касается аналитического этапа, то Lippi и коллеги опубликовали, что общий коэффициент ошибок в процессе тестирования широко варьируется от 0,1% до 3,0% [8]. В исследованиях, проведенных Plebani M., Carraro P., уровень лабораторных ошибок за 10 лет снизился с 0,47% в 1977 году до 0,33% в 2007 году [9-10]. Согласно другим литературным данным (Belk and Sunderman, 1947; Witte, 1997) за период с 1947 по 1997 гг. частота ошибок аналитического этапа снизилась с 162116 на миллион лабораторных тестов (part per million, ppm) до 447 ppm [11-12].
Это произошло благодаря автоматизации, усовершенствованию лабораторных технологий, стандартизации анализа, использованию тщательно разработанных правил внутреннего контроля и эффективных схем обеспечения качества, а также благодаря повышению уровня подготовки персонала.
Однако неудовлетворительное качество остается при выполнении и оценке стандартных клинических биохимических и коагуляционных тестов, гематологических и молекулярно-биологических тестов. В частности, относительно высокая частота аналитических ошибок и связанных с ними неблагоприятных клинических последствий была задокументирована при выполнении иммунохимических исследований.
Таблица 1. Частота встречаемости и типы ошибок на различных этапах аналитического процесса (Mario Plebani, 2007)
|
Типы ошибок |
1996 год |
2000 год |
||
|
ppm |
% |
ppm |
% |
|
|
Общее количество ошибок |
4667 |
100 |
3092 |
100 |
|
Преаналитических |
3186 |
68,3 |
1914 |
61,9 |
|
Аналитических |
617 |
13,2 |
463 |
15,0 |
|
Постаналитических |
864 |
18,5 |
715 |
23,1 |
Таблица 2. Типы ошибок и их частота на различных этапах всего аналитического процесса (Mario Plebani, 2010).
|
Этап общего аналитического процесса |
Тип ошибки |
Относительная частота (%) |
|
Пре-преаналитический |
Ошибка при выборе тестов Ошибка при составлении заявки Неверная идентификация пациентов/ образцов Использование образцов, собранных из канала инфузии Ошибка при сборе образцов (гемолиз, свертывание, недостаточный объем, и т.д.) Использование неподходящей емкости Обращение, хранение и транспортировка |
46,0-68,2% |
|
Преаналитический |
Неправильная сортировка и пересылка образцов Проливание образцов Ошибка при аликвотировании, пипетировании и маркировке Ошибка при центрифугировании (неверное время и/или скорость) |
3,0-5,3% |
|
Аналитический |
Неисправность оборудования Анализ не того образца Интерференция (эндогенная и экзогенная) Невыявленная ошибка контроля качества |
7,0-13,0% |
|
Постаналитический |
Ошибочная валидация данных анализа Несообщение результатов/ передача результатов не тому адресату Слишком большое общее время анализа Неправильный ввод данных и ошибка при записи данных от руки Несообщение/задержка в сообщении о критических значениях |
12,5-20,0% |
|
Пост- постаналитический |
Запоздалая реакция/Отсутствие реакции на лабораторный отчет Неверная интерпретация Неподходящий/неадекватный план диспансерного наблюдения Неназначение необходимой консультации |
25,0-45,5% |
В исследовании, проведенном Laposata M., Dighe A. [13], было установлено, что неправильная интерпретация диагностических и лабораторных тестов врачом, а также неинформирование амбулаторных больных о клинически значимых аномальных результатах, являются довольно широко распространенным явлением, примерно один случай на каждые 14 тестов. Примеры включают пациентов, которых не проинформировали о высоком уровне общего холестерина (8,2 ммоль/л, 318 мг/ дл), низком гематокрите (28,6%) и низком уровне калия (2,6 ммоль/л). Общее количество случаев, когда пациенту не была передана информация или факт передачи информации не был задокументирован, составило 7,1%, а диапазон таких случаев в разных учреждениях от 0% до 26%. Такая ситуация противоречит принципу «солидарной ответственности» и «совместного принятия решения», в рамках которых врач предоставляет пациенту и его семье всю клиническую информацию, включая результаты лабораторных исследований.
Вероятность неблагоприятных последствий лабораторных ошибок и назначения неадекватного лечения варьирует от 2,7% до 12%, но большая доля лабораторных ошибок (от 24,4% до 30%) отвечает за возникновение дополнительных проблем, не сказывающихся прямо на здоровье пациента. В исследованиях сообщается, что ошибки приводили к неадекватному помещению пациентов в отделение интенсивной терапии, ненужному переливанию крови, неверному изменению терапии гепарином и дигоксином. Влияние лабораторных ошибок на дальнейший клинический путь пациента – речь идет о дополнительных ненужных исследованиях (лабораторных, рентгенографических, томографических и т.п.), более инвазивных методах анализа, дополнительных консультациях – гораздо существеннее и, хотя не обязательно причиняет вред, однако доставляет лишнее беспокойство и ведет к дополнительным расходам, как для пациента, так и для системы здравоохранения [14].
Интерес представляют результаты исследования, проведенного в Республике Башкортостан [15]. Данные были собранны из 37 лабораторий медицинских организаций г.Уфы и Республики Башкортостан. Проводился опрос специалистов клинико-диагностических лабораторий государственных медицинских организаций и коммерческих лабораторий, включая заведующих (n=37), биологов (n=351), врачей КДЛ (n=112) по разработанной анкете, которая включала в себя 30 вопросов, касающихся организации работы на преана- литическом этапе лабораторного процесса. Исследования показали, что одной из самых распространенных ошибок на данном этапе является необоснованное назначение лабораторного обследования.
По мнению ряда авторов, на преана- литической фазе происходит большинство лабораторных ошибок [16-20]. В докладе Бонини и его коллег было установлено, что в лаборатории преобладали преданалити- ческие ошибки, варьирующиеся от 31,6% до 75% [21].
В 2008-2009 годах Chawla R. с соавторами определили, что для стационарных больных уровень преаналитической ошибки составил 1,9% (наибольшую частоту составил гемолиз образца – 1,1%), для амбулаторных больных частота ошибок составляла 1,2% (переменная с наивысшей частотой была необоснованность тестирования) [22]. Специалистами было выявлено четырнадцать различных причин преданалитической ошибки, наиболее распространенными из которых были ошибки при заполнении пробирки и идентификации пациента [23- 26].
Заключение. Согласно отчету исследователей из Медицинской школы Университета Джона Хопкинса в Балтиморе, медицинская ошибка является третьей по значимости причиной смерти в США [27]. Безопасность пациентов остается проблемой во многих областях здравоохранения, и лабораторная медицина может стать лидером в снижении ошибок [28].
Содействие эффективному контролю качества и постоянному совершенствованию всего процесса тестирования, включая пре- и постаналитические фазы, является необходимым условием для эффективного лабораторного обслуживания. Медицинские ошибки больше нельзя рассматривать как неизбежные, необходимо их активно оптимизировать и предотвращать [29-30].
СПИСОК ЛИТЕРАТУРЫ
- Меньшиков В.В. Клиническая безопасность пациента и достоверность лабораторной информации (лекция) // Клиническая лабораторная диагностика. -2013. -№6.
- Jordan B., Mitchell C., Anderson A., Farkas N., Batrla R. The Clinical and Health Economic Value of Clinical Laboratory Diagnostics // EJIFCC.-2015.-26(1). -Р.47–62.
- Frank H. Wians. Clinical Laboratory Tests: Which, Why, and What Do The Results Mean? // Laboratory Medicine.-2009.-Volume 40.-Issue 2. -P.105–113.
- Бражникова О.В., Гавеля Н.В., Майкова И.Д. Типичные ошибки на преаналити- ческом этапе проведения лабораторных исследований // Педиатрия. Приложение к журналу Consilium Medicum. -2017. -№4.
- Eng. Wafa’ Al-faraeh, Eng. Mohamed F. Ababeneh. The detection and prevention of errors in Clinical laboratory //International Journal of Scientific and Research Publications.- 2018.-Volume 8, Issue 11.-P.480-486.
- Mario Plebani. Выявление и предотвращение ошибок в лабораторной медицине// Annals of Clinical Biochemistry. -№ 47. -2010.-С. 101-110.
- Plebani M. Laboratory errors: How to improve pre- and post-analytical phases? // Biochem Med. -2007; 17:5-9.
- Lippi G., Plebani M., Šimundić A.M. Quality in laboratory diagnostics: From theory to practice //Biochem Med. -2010; 20:126-130.
- Plebani M., Carraro P. Mistakes in a stat laboratory: Types and frequency//Clin Chem. -1997; 43:1348-1351.
- Carraro P., Plebani M. Errors in a stat laboratory: Types and frequencies 10 years later //Clin Chem. -2007; 53:1338-1342.
- Belk WP, Sunderman FW. A survey of the accuracy of chemical analyses in clinical laboratories// Am J Clin Pathol 1947; 17:853-61.
- Witte VanNess S.A., Angstadt D.S., Pennell B.J. Errors, mistakes, blunders, outliers, or unacceptable results: how many? Clin Chem.-1997; 43:1352-6.
- Laposata M., Dighe A. ‘Pre-pre’ and ‘post-post’ analytic error: high incidence patient safety hazards involving the clinical laboratory //Clin Chem Lab Med.-2007; 45:712–9.
- Plebani M., Piva E. Notification of critical values//Biochem Med. -2010; 20:173-178.
- Аминев Р.А. Билалов Ф. С. Ошибки врача при выборе лабораторного исследования на преаналитическом этапе //Российская академия медицинских наук. Бюллетень Национального научно-исследовательского института общественного здоровья. – 2013. – №. 1. – С. 63-66.
- Fauzia Sadiq and all. Frequency of Errors in Clinical Laboratory Practice//Iranian Journal of Pathology.-2014.-№ 9 (1).-Р.45- 49.
- Sushma B.J., Shrikant C. Study on “Pre-analytical Errors in a Clinical Biochemistry Laboratory”: The Hidden Flaws in Total Testing //Biochem Anal Biochem 8:374.-2019. doi: 10.35248/2161-1009.19.8.374.
- Najat D. Prevalence of Pre-Analytical Errors in Clinical Chemistry Diagnostic Labs in Sulaimani City of Iraqi Kurdistan // PLoS One. -2017; 12(1):e0170211.
- Da Rin G. Pre-analytical workstations: A tool for reducing laboratory errors// Clin Chim Acta. — 2009; 404:68-74.
- Simundic A.M., Topic E., Nikolac N., et al. Hemolysis detection and management of hemolyzed specimens // Biochem Med. -2010;20:154-159.
- Bonini P., Plebani M., Ceriotti F., et al. Errors in laboratory medicine// Clin Chem. -2002; 48:691-698.
- Chawla R., Goswami B., Tayal D., et al. Identification of the types of preanalytical errors in the clinical chemistry laboratory: 1-year study at G.B. Pant Hospital //LabMedicine. — 2010; 41:89-92.
- Bates D.W., Gawande A.A. Improving safety with information technology //N Engl J Med. -2003; 348:2526-2534.
- Plebani M., Bonini P. Wrong biochemistry results. Interdepartmental cooperation may help avoid errors in medical laboratories //BMJ. -2002; 324:423-424.
- Lippi G., Guidi G.C. Risk management in the preanalytical phase of laboratory testing //Clin Chem Lab Med. -2007; 45:720-727.
- Lippi G., Chiozza L., Mattiuzzi C., Plebani M. Patient and Sample Identification. Out of the Maze? //Journal of Medical Biochemistry.-2017. -№36 (2).-Р.107-112.
- Makary M.A., Daniel M. Medical error-the third leading cause of death in the us // BMJ.-2016; 353:i2139.
- Bonini P., Plebani M., Ceriotti F., Rubboli F. Errors in laboratory medicine. Clin Chem.-2002; 48:691-8.
- Julie A. Hammerling, A Review of Medical Errors in Laboratory Diagnostics and Where We Are Today//Laboratory Medicine.-2012.-Volume 43.-Issue 2.-P. 41–44.
- Lippi G., Dimundic A.M., Mattiuzzi C. Overview on patient safety in healthcare and laboratory diagnostics //Biochemia Medica. — 2010; 20:131-143.
Лабораторная диагностика. Выявление и предотвращение ошибок
Обзорная
статья М. Плебани (Mario Plebani) «Выявление и предотвращение ошибок в
лабораторной медицине» в Annals of Clinical Biochemistry, № 47, стр. 101-110, 2010 г.
Марио Плебани,
Отделение лабораторной медицины, Больница при университете Падуи, Падуя, Италия
Резюме
За последние несколько десятилетий частота
аналитических ошибок в клинических лабораториях существенно снизилась. Имеются
факты, показывающие, что пре-и постаналитические этапы аналитического процесса
в целом более подвержены ошибкам, чем аналитический этап. Большая часть ошибок
выявлена на пре-преаналитическом и пост-постаналитическом этапах за пределами
лаборатории. Если при оказании медицинских услуг использовать подход,
ориентированный на пациента, необходимо в рамках всего аналитического процесса
исследовать любой возможный дефект, который способен привести к отрицательному
воздействию на пациента. В интересах пациентов необходимо рассмотреть любые
прямые и непрямые негативные последствия, связанные с лабораторными
исследованиями, независимо от того, на каком этапе возникает ошибка и кто
именно отвечает за ее возникновение: специалист лаборатории (например, при
калибровке/выполнении анализа) или другой сотрудник (например, при выборе
теста, идентификации пациента и/или сборе крови). Неверная идентификация
пациентов и проблемы, связанные с передачей результатов, от которых зависит
постановка диагноза, признаны основными направлениями работы по повышению
качества. Международные инициативы направлены на улучшение именно этих аспектов
медицинской помощи. Создание классификации лабораторных ошибок по степени их
серьезности поможет определить приоритеты, которые позволят улучшить качество
анализа, и будет способствовать целенаправленной разработке
корректирующих/превентивных действий. Важно принимать во внимание не только
реально причиненный пациенту вред, но также возможный наихудший исход в случае
повторения ошибки. Наиболее важные уроки, усвоенные нами, заключаются в том,
что системную теорию также можно использовать для лабораторного анализа и что
ошибки и вредоносные последствия можно предотвратить, перестроив систему таким
образом, чтобы всем работникам сферы здравоохранения было трудно совершать
ошибки.
Введение
За последнее десятилетие, после публикации
отчета Института медицины (Institute of Medicine, IOM), носящего название «To
Err Is Human» (Человеку свойственно ошибаться), безопасность пациентов,
наконец-то, стала объектом медицинского и общественного внимания. Осознание и
понимание причин медицинских ошибок получило быстрое распространение, было
развернуто активное движение за безопасность пациентов, выступающее за
повышение безопасности медицинского обслуживания с помощью «системных» решений.
Это стало возможным благодаря основному «посланию», заключенному в отчете IOM:
причина врачебных ошибок и летальных исходов, которые можно было бы избежать,
заключается не в небрежности и некомпетентности людей, а в плохих системах.
Однако, по сравнению с медицинскими ошибками других типов, ошибкам в
лабораторной медицине уделялось мало внимания, и такому упущению есть несколько
причин, приведенных в таблице 1.
Большая часть самых различных терминов,
используемых в литературе для обозначения ошибок в лабораторной медицине
(например, собственно ошибки, промахи, дефекты, выпадающие значения,
неприемлемые результаты и погрешности качества), оставляют негативное чувство
совершенной человеком ошибки и его вины; но, что хуже, используются в тех
работах, в которых рассматривается ограниченное количество этапов
аналитического процесса. Ключевой шаг навстречу инициативам, направленным на
уменьшение ошибок и улучшение безопасности пациентов в данной сфере, будет
сделан по достижении соглашения о том, что считать ошибками в лабораторном
тестировании.
Ошибки в лабораторной медицине по сути своей
трудноопределимы, поскольку их трудно идентифицировать и, даже после
обнаружения, понять их причину сложнее, чем в случае медицинских ошибок другого
типа. Если сравнивать с неблагоприятными исходами, вызванными хирургическим и
другими, зачастую совершенно очевидными, ошибками, совершенными в ходе лечения,
лабораторные ошибки имеют тенденцию быть менее явными, указать время и место их
совершения непросто. Эти трудности в значительной степени объясняются
многоэтапностью процесса анализа. Во-первых, существует определенный промежуток
времени между выполнением лабораторного анализа, действиями врача и результатом
этих действий. Потенциальные ошибки на этапах, непосредственно предшествующих
воздействию на пациента, фактически, с большей вероятностью могут привести к
травме или нанесению вреда пациенту. Ошибки, совершенные на более ранних
этапах, наиболее вероятно приведут к остановке всего процесса, хотя «активные и
пассивные» защитные барьеры – которые зависят от технологий, человеческого
фактора, используемых процедур и административного контроля – могут смягчить их
потенциальный вред или помешать распознать их воздействие на конечный
неблагоприятный исход. Во-вторых, анализ – это комплексная процедура, состоящая
из большого количества этапов и зависящая от многих факторов, обеспечивающих ее
выполнение. Более того, только аналитическая фаза контролируется лабораторией,
а преаналитический и постаналитический этапы относятся к сфере действия других
ответственных сторон, таких как врачи, медсестры, пациенты и прочие лица,
вовлеченные в идентификацию пациента, ввод данных, сбор и транспортировку
образцов.
Таблица 1. Ошибки в лабораторной
медицине: причины недостаточного внимания к проблеме.
|
1. Различные и двусмысленные |
|
2. Сложности выявления и идентификации |
|
3. Комплексность процесса анализа, |
|
4. Недостаточное осознание врачами и |
|
5. Нежелание лабораторных специалистов |
|
6. Увеличение случаев использования |
На постаналитическом этапе возможна неверная
интерпретация и неадекватное использование полученной лабораторной информации.
Поэтому для детальной оценки всего аналитического процесса необходимы хорошо
спланированные исследования, многосторонний подход и коллективная работа.
В-третьих, врачи, отвечающие за клинические решения, редко рассматривают лабораторные
ошибки как причину неблагоприятного воздействия на пациентов, также они не
осознают, что большая часть недочетов в лабораторной работе может быть
следствием ошибок на преаналитическом и постаналитическом этапах. В-четвертых,
лабораторные специалисты, движимые чувством личной ответственности и вины,
неохотно сообщают информацию о частоте появления ошибок и о том, какие именно
ошибки были выявлены в их лаборатории. Это, в свою очередь, затрудняет оценку
всего аналитического процесса и выработку спецификаций качества для каждого
этапа, что позволило бы выявить недочеты в общей организации и используемых
процедурах и обеспечило бы возможность улучшения качества за счет определения и
приоритезации корректирующих действий. И наконец, теперь анализ проводится не
только в клинических лабораториях: прикроватный мониторинг (в настоящее время
наиболее быстро развивающий сегмент рынка медицинских исследований),
непосредственно рядом с пациентом и самим больным в форме самоконтроля – широко
используемые альтернативные или дополнительные формы анализа.
Таким образом, существует острая необходимость в
оценке ошибок лабораторной медицины в рамках надежной рабочей концепции –
аналитического процесса в целом. С точки зрения пациента, значение имеет
надежность процесса в целом и возможность предотвратить любые ошибки на
преаналитическом, аналитическом и постаналитическом этапе. Поэтому любой
возможный дефект аналитического процесса должен быть исследован. Это позволит
предотвратить или устранить любое негативное воздействие на лечебный процесс,
независимо от этапа, на котором произошла ошибка, и лица, совершившего ошибку,
будь то лабораторный специалист (допустивший ошибку, например, при калибровке
или выполнении анализа) или другой сотрудник (допустивший ошибку, к примеру,
при выборе теста, идентификации пациента, сборе крови и/или интерпретации
результатов).
Определение
ошибки
Различие терминов, синонимично используемых в
литературе для обозначения лабораторных ошибок, является следствием различной
структуры исследований, которая в одних случаях позволяет оценить почти
исключительно аналитические ошибки (выбросы, неприемлемые результаты), а в
других, например, при анализе разделенного на порции образца – нечувствительна
ко многим, особенно начальным и/или конечным, этапам аналитического процесса.
Недавно было высказано интересное предложение: использовать какой-нибудь
нейтральный термин, например «недостаточное обеспечение качества» (quality
failure), который позволит смягчить негативное ощущение, связанное с используемыми
ранее терминами, и возникающее при этом чувство вины за совершенную ошибку. По
мысли автора, этот термином обозначается «любая невозможность соответствовать
конечному качеству, необходимому для оказания пациенту оптимальной медицинской
помощи, на любом этапе аналитического процесса, от выбора тестов до передачи
лечащему врачу отчета с правильной интерпретацией результатов». Это определение
имеет четкую направленность на оказание медицинской помощи пациенту и на
результаты этой помощи, а не на процессы и процедуры. Однако термин «ошибка»
(error) используется в медицинской литературе и, следовательно, должен также
применяться для описания ошибок в лабораторной медицине, в частности из-за
того, что они являются частью более широкого спектра диагностических ошибок. В
Технических спецификациях (Technical Specification), выпущенных Международной
организацией по стандартизации (ISO/TS 22367), лабораторная ошибка определяется
следующим образом:
невозможность выполнить запланированное действие
так, как это было запланировано, или использование неверного плана для
достижения цели на любом этапе лабораторного цикла, начиная с составления
заявки на исследование и заканчивая предоставлением отчета о результатах,
правильной интерпретацией результатов и использованием адекватных действий,
соответствующих полученным результатам.
Данное комплексное определение имеет несколько
достоинств и, в частности, содействует ориентированной на пациента оценке
ошибок, возникающих при лабораторном тестировании. Было подчеркнуто, что развитие
медицинской помощи, центрированной на пациенте, должно быть преобразовано в
требование исследовать любой возможный дефект всего аналитического процесса,
который может привести к негативному воздействию на пациента. При ориентации на
пациента следует принимать во внимание любое прямое или косвенное негативное
последствие, связанное с лабораторным тестированием, независимо от того, где
именно расположен источник последствия: на преаналитическом, аналитическом или
постаналитическом этапе; более того, неважно, кто совершил ошибку: специалист,
работающий в лаборатории (например, ошибку калибровки или анализа) или другой
сотрудник (запросивший, к примеру, не тот тест, неверно идентифицировавший
пациента/образец или неправильно проинтерпретировавший результаты). Таким
образом, аналитический процесс в целом является уникальной рабочей концепцией,
которую можно использовать для изучения и идентификации лабораторных ошибок в
различных условиях: в «стандартных» клинических лабораториях, при анализе по
месту лечения (АПМЛ) и при использовании альтернативных способов анализа (у постели
больного и методом самоконтроля).
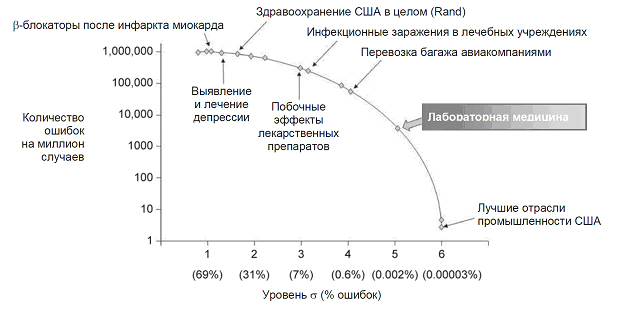
Рис. 1. Частота ошибок в лабораторной
медицине по сравнению с частотой ошибок в других областях деятельности (литературные
данные, с модификациями).
Типы
ошибок в лабораторной медицине и частота их возникновения
Лабораторная медицина, как сфера деятельности, в
которой на первое место ставится контроль качества, всегда была на переднем
фронте борьбы за уменьшение числа ошибок. С точки зрения контроля качества и
уменьшения частоты ошибок, лабораторная медицина имеет гораздо более
впечатляющий послужной список, чем большинство других областей здравоохранения.
В некоторых работах сообщается, что на аналитическом этапе средняя частота
ошибок составляет всего лишь 0.002%; это соответствует работе на уровне пяти
сигма. Для сравнения: частота инфекционных заражений и неблагоприятного
воздействия лекарственных препаратов в результате врачебных ошибок находятся
близко к трем сигма, то есть в этих случаях частота ошибок более чем в 3000 раз
превышает частоту ошибок в клинической лаборатории (рисунок 1). (Концепция
«сигмы», в соответствии со строгим статистическим критерием контроля качества,
заключается в следующем: считается, что процесс находится под контролем, если
вариация показателей процесса – выраженная в виде стандартного отклонения – сигма
– не превышает 1/6 разницы между средними показателями процесса и контрольным
пределом. Процесс, качество которого достигает шести сигма , т.е. процесс с
вариацией показателей 6 сигма, имеет очень мало ошибок: 3,4 ошибки на миллион
случаев).
Однако эти данные выглядят менее впечатляюще,
если рассматривать целиком весь процесс анализа, состоящий из выбора тестов,
составления заявки на исследование, идентификации пациентов, сбора и
транспортировки образцов, выполнения анализа, представления результатов, их
интерпретации и принятия решения на их основе. По словам Марка Грейбера (Mark
Graber), «ошибки, связанные с лабораторным анализом, встречаются очень часто и
составляют значительную часть диагностических ошибок в современной медицине». В
современной клинической медицине лабораторный анализ приобретает особенно
важное значение в диагностическом процессе и при мониторинге эффективности
терапии. Поэтому, даже низкая частота ошибок лабораторного анализа с учетом
миллионов исследований, выполняемых каждый день по всему миру, может оказывать
существенное влияние на здоровье и безопасность пациентов. Данные по частоте
лабораторных ошибок будут самым серьезным образом зависеть от структуры
исследования и, в частности, от исследуемых этапов всего аналитического
процесса. Таким образом, легко понять, почему частота ошибок, согласно
литературным данным, может варьировать: от одной ошибки на 33-50 событий до
одной ошибки на 1000 событий или от одной ошибки на 214 лабораторных
результатов до одной ошибки на 8300 лабораторных результатов.
Аналитические
ошибки
Ранние исследования в области ошибок
лабораторной медицины были посвящены идентификации аналитических ошибок,
поскольку аналитический этап является «сердцем» лабораторной работы и
аналитического процесса, проходящего под контролем лабораторного персонала.
Анализ собранных и представленных литературных данных, начиная с работы Белка и
Сандермана (Belk and Sunderman), опубликованной в 1947 г., продолжая
результатами, собранными Коллегией американских патологов в 90-х и заканчивая
данными, представленными Витте (Witte) с соавторами в 1997 г., показал, что
частота ошибок снизилась с 162116 на миллион лабораторных тестов (part per
million, ppm) до 447 ppm. Это резкое и впечатляющее уменьшение, примерно в 300
раз, произошло благодаря автоматизации, усовершенствованию лабораторных
технологий, стандартизации анализа, использованию тщательно разработанных
правил внутреннего контроля и эффективных схем обеспечения качества, а также
благодаря повышению уровня подготовки персонала. Однако данные, собранные за
последнее время, продемонстрировали, что качество анализа по-прежнему остается
главной проблемой. Вестгард (Westgard) показал, что оценка стандартных
клинических биохимических и коагуляционных тестов по шкале . дает
неудовлетворительные результаты: в лучшем случае от 3 до 4 сигма.
Неудовлетворительное качество анализа было продемонстрировано не только в
области клинической биохимии, но также в области гематологических,
коагуляционных и молекулярно-биологических тестов. В частности, относительно
высокая частота аналитических ошибок и связанных с ними неблагоприятных
клинических последствий была задокументирована при выполнении иммунохимических
исследований. В некоторых случаях аналитическая интерференция в
иммунохимических исследованиях приводит к значительной погрешности результатов.
Недавние данные по интерференции парапротеинов при лабораторном определении
различных аналитов, включая глюкозу, билирубин, С-реактивный белок, креатинин и
альбумин, показали, что частота ошибок данного типа варьирует и, вероятно,
является заниженной. Кроме того, было показано, что гемолиз по-прежнему
вызывает завышение биохимических параметров, что подчеркивает необходимость
более адекватных нормативов для идентификации и подготовки образцов низкого
качества.
Как уже отмечалось ранее, между впечатляющим
уменьшением числа аналитических ошибок за последние десятилетия и тем фактом,
что в настоящее время качество анализа при оценке по шкале сигма нельзя считать
удовлетворительным, нет противоречия. Оценка по шкале шести сигм является одним
из лучших подходов, доступных в данный момент, который обеспечивает получение
объективных количественных показателей и используется в различных отраслях
деятельности. Таким образом, несмотря на впечатляющее улучшение, достигнутое в
качестве анализа, большое количество фактов свидетельствуют о необходимости
дальнейших улучшений. Этого можно добиться, установив и используя в
повседневной практике спецификации качества анализа, основанные на доказанных
фактах; если это будет реализовано, правила внутреннего контроля качества и
процедуры внешней оценки качества станут более адекватными. Более того, имеется
острая необходимость в программах стандартизации, направленных на улучшение
метрологической прослеживаемости и корректирующих отклонения и систематические
ошибки. Наконец, для повышения качества анализа в клинических лабораториях
необходимо ввести более строгую систему количественных показателей, такую как
шкала шести сигм.
Пре-и
постаналитические этапы
Хотя частота лабораторных ошибок сильно
варьирует в зависимости от структуры исследования и рассматриваемых этапов
аналитического процесса, несколько работ, опубликованных между 1989 и 2007 гг.
привлекли внимание лабораторных специалистов к пре-и постаналитическому этапам.
В настоящее время считается, что эти этапы более чувствительны к ошибкам, чем
аналитический этап. Наша группа опубликовала результаты двух работ, в 1997 и
2007 годах, в которых использовалась одна структура исследования, что позволило
нам рассмотреть большую часть этапов всего аналитического процесса в одном и
том же клиническом контексте; в данных работах также использовалось одинаковое
меню срочных лабораторных тестов. Результаты (таблица 2) свидетельствуют о
существенном, хотя и не слишком большом, уменьшении частоты ошибок в 2007 г., при этом
распределение ошибок по этапам оказалось сходным. На преаналитическом этапе
наблюдалась максимальная частота ошибок, чаще всего проблемы возникали из-за
ошибок при заполнении пробирок, вследствие использования неподходящих
контейнеров, а также из-за ошибок при составлении заявок на исследование. В
работе, проведенной в 2007 г.,
была отмечена ошибка идентификации трех пациентов и 14 запланированных для них
тестов (875 ppm). В последней работе наблюдалось значительное снижение доли
неправильно собранных образцов из инфузионного канала. Основными причинами
ошибок на постаналитическом этапе были: в последней работе – слишком большое
общее время анализа, в первой работе – опечатки при вводе с клавиатуры и
отсутствие коррекции ошибочных данных. За счет улучшения процедур обработки
информации, было снижено количество ошибок при вводе заявок на исследование и
идентификации пациентов в больничной палате. Однако и на преаналитическом, и на
постаналитическом этапе появились ошибки нового типа, в частности, ошибки,
связанные с использованием новых информационных систем. Дальнейшие исследования
подтвердили, что пре-и постаналитический этапы гораздо более подвержены
ошибкам, чем аналитический этап.
Пре-пре-и
пост-постаналитические этапы
Несмотря на то, что концепция целостной «петли
интеллекта» (brain-to-brain loop) была разработана Лундбергом еще в 1981 г., лабораторные
специалисты не проявляли сильной обеспокоенности в отношении начальных и
конечных этапов общего аналитического процесса, а именно в отношении выбора
подходящих тестов, правильности идентификации пациентов и образцов,
соответствующей реакции врача на отчет о результатах, правильной интерпретации
и адекватного использования результатов. Однако исследование начальных и
конечных стадий цикла исследования показало, что в настоящее время эти этапы,
выполненные не в клинической лаборатории и не под контролем (по крайней мере,
частичным) лабораторного персонала, более подвержены ошибкам, чем другие.
Недавние данные по ошибкам на пре-преаналитическом этапе – т.е. при выполнении
первоначальных процедур, не в клинической лаборатории и не под контролем (по
крайней мере, частичным) лабораторного персонала – показывают, что ошибки при
выборе необходимых диагностических тестов, включая лабораторные, отвечают за
55% ошибочных и запоздалых диагнозов при амбулаторном наблюдении и 58% ошибок в
отделении неотложной помощи.
Таблица 2. Частота встречаемости и
типы ошибок на различных этапах аналитического процесса (литературные данные).
|
Абсолютная частота (ppm) |
Относительная частота (%) |
|||
|
1996 |
2000 |
1996 |
2000 |
|
|
Общее количество ошибок |
4667 |
3092 |
||
|
Преаналитических |
3186 |
1913 |
62,8 |
61,9 |
|
Аналитических |
617 |
646 |
13,3 |
15,0 |
|
Постаналитических |
864 |
715 |
18,5 |
23,1 |
Было установлено, что на конечных этапах цикла
неправильная интерпретация диагностических и лабораторных тестов отвечает за
большой процент ошибок в амбулаторных условиях, а также в отделениях неотложной
помощи (таблица 3). В одной из недавних работ было установлено, что
неинформирование амбулаторных больных о клинически значимых аномальных
результатах и отсутствие документального подтверждения факта передачи
необходимой информации, является довольно широко распространенным явлением и
происходит один раз на каждые 14 тестов. Примеры включают пациентов,
непроинформированных о высоком уровне общего холестерина (8,2 ммоль/л, 318
мг/дл), низком гематокрите (28,6%) и низком уровне калия (2,6 ммоль/л). Общее
количество случаев, когда пациенту не была передана информация или факт
передачи информации не был задокументирован, составило 7,1%, а диапазон таких
случаев в разных учреждениях от 0% до 26%. Данные сбои при информировании
пациентов о клинически значимых результатах затрудняют переход от традиционной
патерналистской модели взаимодействия врача и пациента к новой модели,
включающей концепцию «совместного принятия решения», в рамках которой врач
предоставляет пациенту и его семье всю клиническую информацию, включая
результаты лабораторных исследований. Другое свидетельство ошибок в действиях
врача в ответ на предоставленные данные лабораторного анализа приводится в
работе, в которой рассматриваются случаи назначения калия, несмотря на наличие
гиперкалиемии. В другом исследовании было установлено, что более 2% (2,6% в 2000 г., 2,1% в 2007 г.) пациентов с уровнем
тиреотропина более 20 мЕ/мл не получили должного наблюдения. И наконец, в
интересном исследовании, проведенном среди стационарных больных, было показано,
что почти у половины из 1095 выписанных пациентов имелись незавершенные
лабораторные и радиологические тесты и результаты 9% этих тестов потенциально
требовали определенных клинических действий. Таким образом, приведенные выше
данные показывают, что начальные и конечные этапы аналитического процесса, в
частности, выбор тестов и действия врачей в ответ на полученные результаты, не
только более подвержены ошибкам, чем все другие этапы, но также более значимы с
точки зрения потенциально неблагоприятного воздействия на пациентов. В таблице
4 приводятся текущие данные об относительной частоте ошибок на различных этапах
аналитического процесса.
Таблица 3. Пост-постаналитические
ошибки: частота неверной интерпретации результатов диагностических тестов в
различных областях медицинской деятельности.
|
Первая помощь |
Лечение внутренних органов |
Неотложная помощь |
|
|
Неверная интерпретация диагностических |
37% |
38% |
37% |
Таблица 4.
Типы
ошибок и их частота на различных этапах всего аналитического процесса (литературные
данные).
|
Этап общего аналитического процесса |
Тип ошибки |
Относительная частота (%) |
|
Пре-преаналитический |
Ошибка при выборе тестов |
46,0-68,2% |
|
Преаналитический |
Неправильная сортировка и пересылка |
3,0-5,3% |
|
Аналитический |
Неисправность оборудования |
7,0-13,0% |
|
Постаналитический |
Ошибочная валидация данных анализа |
12,5-20,0% |
|
Пост-постаналитический |
Запоздалая реакция/Отсутствие реакции |
25,0-45,5% |
Ошибки при
прикроватном мониторинге (РОСТ) и в других альтернативных условиях
Литературных данных об ошибках при РОСТ
недостаточно, основное внимание сосредоточено на аналитических ошибках.
Считается, что преимущество РОСТ, помимо меньшего времени выполнения, заключается
в том, что при РОСТ используется меньше этапов для получения результата. Кроме
того, «существенно уменьшается количество ошибок, возникающих вследствие
транспортировки, постаналитические ошибки практически полностью устраняются,
поскольку результаты предоставляются непосредственно врачу». Это, в свою
очередь, должно привести к уменьшению сопутствующих ошибок. Однако, несмотря на
иллюзию простоты, устройства для РОСТ подвержены влиянию нескольких факторов,
связанных с окружающими условиями и работой оператора. Управление
преаналитическими, аналитическими и постаналитическими процессами – это
основная задача РОСТ, точно так же, как и в централизованных лабораториях.
Недавно мы проанализировали ошибки и проблемы безопасности пациентов, связанные
с РОСТ, использовав модифицированную классификацию ошибок Коста (Kost). В
данной классификации учитываются все этапы процесса анализа. Мы показали, что
РОСТ уменьшает количество ошибок и риск совершения ошибки лишь на нескольких
этапах всего аналитического процесса. Более того, с позиции управления риском,
РОСТ ставит новые серьезные задачи, в частности в отношении компетентности
оператора и точности выполнения процедур. Потенциально более существенная
опасность заключается в том, что быстрая доступность результатов и немедленное
терапевтическое вмешательство могут усилить клиническое воздействие ошибок и
неблагоприятных последствий на пациента. Недавно мы выявили существенное
количество ошибок, возникающих при переписывании данных, полученных с
использованием портативных устройств для определения глюкозы, а также
обнаружили, что часть данных была представлена не полностью, что подчеркивает
уязвимость постаналитической фазы при РОСТ. Хотя эти ошибки совершаются не в
лаборатории (они связаны с использованием результатов медперсоналом), их
следует принимать во внимание в рамках всего аналитического и диагностического
процесса и работать с ними с позиции ориентированного на пациента подхода.
Аналитический процесс в целом, таким образом, обеспечивает уникальную рабочую
концепцию, с помощью которой можно проанализировать ошибки и уменьшить риск их
возникновения не только в «централизованных» лабораториях, но также при
выполнении РОСТ и использовании всех других альтернативных способов анализа.
Последствия
ошибок в лабораторной медицине
Благодаря нескольким барьерам и слоям защиты
между предоставленной лабораторной информацией, процессом принятия решения и
конечным воздействием на пациента, по-видимому, лишь малая доля лабораторных
ошибок действительно приводит к неблагоприятным последствиям и нанесению вреда
пациенту. В таблице 5 представлены литературные данные, касающиеся воздействия
лабораторных ошибок на пациентов.
Вероятность неблагоприятных последствий
лабораторных ошибок и назначения неадекватного лечения варьирует от 2,7% до
12%, но бо.льшая доля лабораторных ошибок (от 24,4% до 30%) отвечает за
возникновение дополнительных проблем, не сказывающихся прямо на здоровье
пациента. В исследованиях, опубликованных нашей группой, ошибки приводили к
неадекватному помещению пациентов в отделение интенсивной терапии, ненужному
переливанию крови, неверному изменению терапии гепарином и дигоксином. Влияние
лабораторных ошибок на дальнейший клинический путь пациента – речь идет о
дополнительных ненужных исследованиях (лабораторных, рентгенографических,
томографических и т.п.), более инвазивных методах анализа, дополнительных
консультациях – гораздо существеннее и, хотя не обязательно причиняет вред,
однако доставляет лишнее беспокойство и ведет к дополнительным расходам, как
для пациента, так и для системы здравоохранения. С точки зрения управления
рисками, подавляющее большинство лабораторных ошибок, имеющих незначительное
прямое влияние на качество предоставляемых медицинских услуг, дают прекрасную
возможность обучения. Фактически, любая ошибка, независимо от ее кажущейся
тривиальности, может указывать на слабые места в общих принципах и в конкретных
лабораторных процедурах. И даже если в данных конкретных обстоятельствах эта
ошибка не имеет вредных последствий, в другой, пусть и незначительно
отличающейся ситуации она может принести вред пациенту.
Таблица 5. Доля ошибок в
лабораторной медицине, оказывающих влияние на пациентов
|
Автор |
Количество ошибок |
Доля ошибок, оказывающих влияние на |
Доля ошибок, имеющих неблагоприятные |
|
Ross, J.W. |
336 |
30 |
7 |
|
Nutting, P.A. |
180 |
27 |
12 |
|
Plebani, M. |
189 |
26 |
6,4 |
|
Carraro, P. |
160 |
24,4 |
2,7 |
Таким образом, система градации лабораторных ошибок
в соответствии с их серьезностью должна помочь идентифицировать приоритетные
направления для работы над улучшением качества медицинской помощи и облегчить
выбор корректирующих/превентивных действий. Система градации позволила бы не
только рассмотреть реальный вред, наносимый пациенту, но также потенциальный,
самый неблагоприятный, исход в случае повторения ошибки. В соответствии с
Техническими спецификациями ISO «Лаборатории медицинские. Уменьшение ошибок
посредством управления рисками и постоянного улучшения» (Medical
laboratories—reduction of
error through risk
management and continual improvement) любая клиническая
лаборатория должна внедрить процедуры, предназначенные для: (a) определения
процессов высокой степени риска, потенциальная ошибка которых может угрожать
безопасности пациентов; (b) для идентификации реальных ситуаций, связанных с
отклонениями от стандартных требований; (c) для оценки сопутствующих угроз
безопасности пациентов; (d) для контроля этих угроз и (e) для мониторинга
эффективности используемого контроля. В дополнение к требованиям ISO/TS 22367
недавно было выдвинуто предложение, обладающее рядом достоинств: для описания
серьезности отдельной лабораторной ошибки использовать пятибалльную систему
актуальных (А) и потенциальных (P) оценок, основанную на конечном клиническом
результате. Более низкая оценка ошибки означает «отсутствие изменений в ведении
пациента; отсутствие неблагоприятных клинических последствий»; а более высокая
– «значительные неблагоприятные клинические последствия». Недавняя работа, в
которой использовалась данная система оценок на протяжении 30-месячного периода
и в которой были рассмотрены 714988 заявок на выполнение лабораторных
исследований, выявила 658 ошибок. 75% ошибок бала присвоена оценка 1 по шкале
«A» (отсутствие неблагоприятных последствий), а 67,9% ошибок была присвоена
оценка 5 по шкале «P» (потенциально значительные неблагоприятные клинические
последствия). Подчеркнем еще раз: эти данные показывают, что лабораторные
ошибки могут играть существенную роль, влияя на общее качество медицинской
помощи, включая безопасность пациентов.
Парадигмы
возникновения ошибок и стратегии, направленные на повышение безопасности
пациентов
Проблема ошибок, совершенных человеком, в
частности ошибок в медицине, может быть рассмотрена тремя способами: в рамках
модели личных ошибок, в рамках модели правовой ответственности и в рамках
системной модели.
Модель
личных ошибок
Давняя и широко распространенная традиция
личного подхода фокусируется на небезопасных действиях, ошибках и процедурных
нарушениях, совершенных людьми, непосредственно задействованными в клиническом
процессе: медсестрами, терапевтами, хирургами, анестезиологами, фармацевтами и,
в редких случаях, сотрудниками лабораторий. В данном подходе причиной
небезопасных действий считаются аберрантные ментальные процессы, такие как
забывчивость, невнимательность, недостаточная мотивация, беспечность,
небрежность и неосторожность. Контрмеры, направленные, главным образом, на
уменьшение нежелательной вариабельности поведения персонала, включают:
дисциплинарные взыскания, угрозу привлечения к суду, потенциальное увольнение,
осуждение и неодобрение. Личный подход, доминирующая традиция в медицине, имеет
серьезные ограничения: он не позволяет подробно проанализировать несчастные
случаи, инциденты, опасные ситуации и рассматривает небезопасные действия вне
их системного контекста, таким образом препятствуя эффективному управлению
рисками.
Модель
правовой ответственности
Согласно этой модели, ответственные
профессиональные работники не должны совершать ошибок, поскольку это является
частью их профессиональных обязанностей. Ошибки случаются редко, но они, тем не
менее, могут привести к неблагоприятному воздействию на пациента. Считается,
что ошибки, имеющие неблагоприятные последствия, совершаются вследствие
халатности и грубой неосторожности, поэтому заслуживают определенных санкций. С
этой позиции доказать связь между первичным действием и плохим конечным
результатом гораздо легче, чем между организационными недостатками и
клиническими решениями. С точки зрения правовой ответственности, удобнее
преследовать индивидуальные ошибки, а не коллективные. Это обстоятельство
усугубляется готовностью профессиональных работников, включая врачей, принять
ответственность за свои действия. Данная модель имеет отрицательные стороны,
включая тот факт, что часто даже самые лучшие специалисты совершают ошибки.
Более того, данная модель препятствует любым попыткам обнародования медицинских
ошибок. Сотрудники опасаются опубликования отчетов, которые могут повредить
репутации лечебного учреждения, привести к потере дохода и вызвать судебное
разбирательство. В то же время эксперты соглашаются, что система добровольного
предоставления информации о медицинских ошибках и неблагоприятных последствиях
имеет огромный потенциал в отношении повышения безопасности медицинского
обслуживания. Более того, модель правовой ответственности способствует развитию
«перестраховочной» медицины, что в рамках лаборатории превращается в проведение
лишних и ненужных исследований и, таким образом, приводит к чрезмерным расходам
и сопутствующей неэффективности.
Системный
подход
Базовое положение системного подхода заключается
в том, что человек свойственно ошибаться и ошибок следует ожидать даже при
самой лучшей организации процесса. Ошибки, рассматриваемые как последствия, а
не причины, берут начало в системных факторах, включая генераторы повторяющихся
ошибок в рабочем пространстве и организационные процессы их вызывающие.
Контрмеры основаны на допущении, что хотя человеческую природу изменить нельзя,
можно улучшить условия, в которых работают люди. В частности, в данном подходе
центральную роль играют средства защиты, барьеры и меры безопасности.
Высокотехнологичные системы, включая клинические лаборатории, имеют много
уровней защиты, но иногда в них появляются дыры, как в кусочках швейцарского
сыра, которые могут на мгновение выстроиться в одну линию, образовав в
многочисленных слоях защиты опасный тоннель, через который вредоносные факторы
способны оказать свое пагубное воздействие. В лабораторной медицине
используются чрезвычайно сложные процедуры. Из факторов, связанных со
сложностью аналитического процесса в целом, вероятно, наиболее значимые факторы
относятся к некоторым этапам и зависят от работников различных специальностей,
задействованных на этих этапах, которые только частично находятся под контролем
лабораторных специалистов. На рисунке 2 показана модель швейцарского сыра,
адаптированная к специфическим условиям лабораторной медицины. В данной модели
рассматриваются наиболее важные проблемы и защитные слои, из которых самыми
эффективными являются идентификация и документирование всех процессов и
процедур, автоматизация и упрощение, адекватное обучение персонала, система
надзора и использование показателей качества. Согласно этой модели, способность
обнаруживать ранние признаки потенциальной ошибки и общее стремление к
внедрению корректирующих мер являются необходимыми условиями создания
эффективной программы управления рисками. Средства управления процессами и
средства анализа потенциальных рисков, такие как FMEA (анализ характера и
последствий отказов), HACCP (анализ рисков и критические точки контроля) и
HAZOP (исследование рисков и работоспособности), уже показали свою
эффективность при идентификации слабых точек лабораторных процессов и
минимизации риска возникновения ошибок.
Рис. 2. Модель швейцарского
сыра, адаптированная к условиям лабораторной медицины: проблемы и защитные
меры. Согласно модели, описанной Reason, наличие бреши в любом защитном слое в
норме не приводит к неблагоприятным последствиям. Обычно это случается только
тогда, когда бреши во многих слоях выстраиваются в одну линию, что создает
канал для потенциально неблагоприятного воздействия.
Процессы,
направленные на уменьшение количества ошибок в лабораторной медицине.
За последние несколько лет, в дополнение к
усилиям, направленным на уменьшение аналитических ошибок и повышение качества
анализа, были достигнуты важные успехи при решении проблемы возникновения
ошибок в лабораторной медицине. Благодаря введению преаналитических рабочих
станций, было достигнуто значительное уменьшение количества преаналитических
ошибок при выполнении автоматизированных процедур, таких как подготовка
образцов, центрифугирование, аликвотирование, пипетирование и сортировка.
Возрастающий интерес к разработке нормативов и стандартных операционных процедур
для идентификации пациентов, для взятия крови, для работы с образцами и для
принятия или отклонения образцов. несомненно, приведет к созданию стандартов
более высокого качества. Также значительные улучшения были введены на
постаналитическом этапе в процедуру записи данных, это стало результатом
внедрения анализаторов, оснащенных протоколами обмена информацией, и
лабораторных информационных систем. Следует подчеркнуть, запись данных является
источником серьезных ошибок, особенно в том случае, когда необходимо вручную
вводить в лабораторный компьютер большое количество чисел и результатов.
Дальнейшие важные улучшения на постаналитическом этапе касаются общих принципов
и процедур, используемых для предоставления отчета о критических значениях, а
также инициатив, направленных на улучшение понимания полученных данных и
повышение эффективности предоставления отчета врачам, запросившим выполнение
исследований. Недавно были разработаны автоматические компьютеризированные
системы передачи информаций, позволившие улучшить своевременность
предоставления данных и избежать потенциальных ошибок за счет контрольного
считывания только что записанного результата. После направления запроса и
подтверждения правильности полученных критических значений лабораторными
специалистами, эти значения автоматически передаются (в режиме реального
времени) врачам, при этом на экране компьютера появляется краткое
информационное или предупреждающее сообщение. Данные информационные системы
(увеличивающие вероятность того, что удастся своевременно связаться с нужным
специалистом), легко адаптировать таким образом, чтобы передавать информацию на
мобильный телефон или настольный компьютер пациента. Это позволит уменьшить
число ошибок или даже полностью устранить ошибки при передаче патологических результатов.
Дальнейшие улучшения касаются введения более эффективных автоматизированных
процедур валидации данных и предоставления отчета, а также внедрения систем
эффективного управления знаниями, предназначенных для интерпретации данных и
принятия клинических решения при прикроватном мониторинге. В самой простой
форма такая система может включать прямые ссылки на лабораторный справочник,
содержащий рекомендации по интерпретации результатов и описание процедур,
необходимых для выполнения конкретных исследований для конкретного пациента.
Аналогичные средства необходимо использовать для того, чтобы уменьшить
количество ошибок при выборе тестов. Точный анализ всех процессов и
задокументированных процедур лабораторного исследования с помощью проактивных
инструментов, таких как FMEA и HAZOP, уже доказал свою эффективность в
уменьшении показателя вероятности риска и, как следствие, в повышении
безопасности пациентов. Данные инструменты упреждающего анализа все чаще и все
более охотно используются лабораторными специалистами и врачами. Данные
инструменты оценивают профессиональную компетенцию через призму позитивного
подхода к существующим проблемам, фокусируясь на исследовании аналитического
процесса в целом, позволяя, таким образом, прогнозировать основные неблагоприятные
последствия и заранее принимать меры для их предотвращения.
Международные
инициативы по снижению количества ошибок в лабораторной медицине
Недавно Всемирный альянс за безопасность
пациентов (World Alliance for Patient Safety) (учрежденный Всемирной ассамблеей
здравоохранения (World Health Assembly) в 2004 г. для улучшения
безопасности пациентов в рамках глобальной инициативы) включил проблему
передачи результатов критически важных тестов в число 23 вопросов, решение
которых потенциально позволит обеспечить безопасность пациентов, признав, таким
образом, важность предотвращения ошибок в лабораторных исследованиях. Вторая
задача, обозначенная в документе «2008 National Patient Safety Goals for
Laboratories» (Обеспечение безопасности пациентов – общенациональные задачи для
лабораторий) Объединенной комиссии (Joint Commission) – это «улучшить
эффективность коммуникации лиц и служб, предоставляющих медицинские услуги»,
первая задача – повысить «точность идентификации пациентов», что подчеркивает
важность начальных и конечных этапов аналитического процесса. Рабочая группа по
лабораторным ошибкам и безопасности пациентов (WG-LEPS) Международной федерации
клинической биохимии и лабораторной медицины (IFCC) разработала проект под
названием «Модель показателей качества» (Model of
quality indicators). Данная модель
основана на идентификации значимых общепринятых показателей качества на всех
этапах аналитического процесса. Вкратце суть дела заключается в следующем:
после обсуждения и анализа предложений, сделанных 26 клиническими
лабораториями, входящими в рабочую группу, были выбраны 25 показателей
качества: 16 для преаналитического, 3 для аналитического и 6 для
постаналитического этапа. В настоящее время, лаборатории, принимающие участие в
данном проекте, могут на специально созданном веб-сайте
(www.3.centroricercabiomedica.it) вводить данные, собранные в их учреждении по
всем показателям качества и по каждому показателю в отдельности. Был сделан
предварительный анализ собранных данных и представлены результаты, однако для
выполнения надежного статистического исследования необходимо собрать
дополнительные данные. В дальнейшем в рамках данного проекта планируется: (a)
определить предварительные спецификации качества для каждого показателя; (b)
оценить данные с использованием предварительных спецификаций качества; (c)
пересмотреть спецификации качества и (d) ввести в действие программу внешней
оценки качества, с помощью которой лаборатории-участники смогут оценивать
качество своей работы, сравнивая полученные результаты с желательными
спецификациями качества для каждого показателя. Глобальная цель данной
программы, таким образом, заключается в том, чтобы побудить клинические
лаборатории оценивать и контролировать качество своей работы не только в ее
аналитическом аспекте, но также на пре-и постаналитических этапах. Кроме того,
благодаря реализации этой программы, появится возможность идентифицировать
ошибки и следить за частотой их появления во всем аналитическом процессе, а
также улучшить этот процесс на основании реальных и желательных спецификаций
качества, установленных научным сообществом.
Еще одно предложение: создать проект,
направленный на идентификацию и использование сигнальных событий в лабораторной
медицине. Сигнальное событие (sentinel event) – это непредвиденный случай,
повлекший смерть или серьезную физическую или психологическую травму, а также
случай, способный привести к таким последствиям. Таким образом, сигнальное
событие сигнализирует о необходимости немедленного расследования и ответных
действий. Термины «сигнальное событие» и «медицинская ошибка» не синонимичны:
не все сигнальные события происходят из-за ошибки и не все ошибки ведут к
сигнальным событиям. Оценка связи клинических последствий с лабораторной
диагностикой является трудной задачей, поэтому возникает еще одна проблема –
идентификация тех лабораторных событий в рамках всего процесса анализа, которые
наиболее тесно связаны с причинением вреда пациенту. Таким образом, на первый
план выдвигается острая потребность в разработке и использовании надежных и
общепринятых показателей качества, которые отражали бы «наилучший способ
осуществления» всего аналитического процесса, а также необходимость
идентификации «лабораторных сигнальных событий», которые способствовали бы
получению дополнительных знаний о непредвиденных случаях. Все это позволило бы
возложить на поставщиков медицинских услуг ответственность за безопасность
пациентов. Имеющиеся в наличии данные указывают, что потенциальные «сигнальные
события» могут включать выбор неподходящих тестов при критических заболеваниях
(например, при инфаркте миокарда, эмболии легочной артерии), неверную
идентификацию пациентов, выполнение неподходящих исследований, серьезные
аналитические ошибки, использование непригодных (гемолизированных, при наличии
сгустка) для выполнения критически важных тестов, предоставление результатов
исследований, несмотря на неудовлетворительные результаты контроля качества,
неинформирование о критических значениях и направление отчета не тому адресату.
И наконец, урок, который мы усвоили, столкнувшись с лабораторной ошибкой,
имевшей самые худшие последствия в Италии (ошибка при записи отчета, которая
привела к заражению ВИЧ трех пациентов, которым произвели пересадку органов):
необходимо избегать переписывания данных от руки. Это трагическое событие,
вызванное человеческой ошибкой, еще раз продемонстрировало наличие слабых мест
в системе и брешей в слоях защиты. В частности, было подчеркнуто, что этот
инцидент произошел вследствие «недостаточного понимания специфики процесса
взятия органов и недооценки последствий для тех пациентов, которым уже
произвели пересадку, и для тех, которые находятся в списках ожидающих, а также
для задействованного персонала» и связанных с этими обстоятельствами процедур.
Принимая во внимание текущие международные инициативы и рекомендации, можно
выделить некоторые приоритетные области, позволяющие повысить безопасность
пациентов и снизить количество ошибок в лабораторной медицине (см. таблицу 6).
Таблица 6. Приоритетные области
лабораторной медицины, позволяющие повысить безопасность пациентов
|
1. Точность идентификации |
|
2. Эффективность передачи лабораторных |
|
3. Передача результатов критически |
|
4. Критерии пригодности и непригодности |
|
5. Правильность выбора тестов; |
|
6. По возможности, исключение |
Заключение
За последние два десятилетия было достигнуто
значительное улучшение в понимании причин возникновения медицинских ошибок и
уменьшении их количества. В конечном итоге, специалисты, занимающиеся этими
вопросами, осознают, что ошибки возникают не из-за «плохих» людей, ошибки – это
показатель недостатков системы, включающей почти все процессы и методы, которые
мы используем для организации и выполнения практически всех действий в медицине,
в том числе, лабораторной медицине. Таким образом, первый урок, который мы
извлекли, заключается в том, что теория системы работает и что ошибки и вредные
последствия можно предотвратить, перестроив систему так, чтобы медицинским
работникам было трудно делать ошибки. В лабораторной медицине анализ процессов,
регистрация/документирование всех процедур и процессов в соответствии со
стандартами качества, в частности ISO 15189: 2007 (стандарт, специально
разработанный для медицинских лабораторий) являются ключевыми инструментами
изменения и улучшения повседневной клинической практики. Тщательный анализ и
контроль всех процедур и процессов, являющихся частью процесса лабораторного
исследования, особенно при использовании эффективных инструментов, таких как
FMEA и HAZOP, могут существенно уменьшить количество слабых сторон и уязвимых
этапов, максимизировав, таким образом, безопасность пациента. Мы убедились, что
аналитический лабораторный процесс, взятый как единое целое – это уникальная
рабочая концепция, позволяющая идентифицировать ошибки и уменьшить их
количество, в том числе на начальных этапах, таких как идентификация пациентов
и выбор тестов, и на конечных этапах, таких как передача и интерпретация
результатов.
Второй урок заключается в том, что коллективная
работа – это квинтэссенция безопасности, особенно, если мы хотим уменьшить
число ошибок при выборе тестов и увеличить количество адекватных реакций на
результаты исследований. Доступность систем поддержки, предоставляющих по месту
лечения информацию о диагностической эффективности и критериях интерпретации,
может играть определенную роль, но кооперация и сотрудничество специалистов
различного профиля является обязательным условием осуществления
ориентированного на пациента подхода к уменьшению количества ошибок.
Международные проекты, направленные на разработку показателей качества для всех
этапов аналитического процесса и установку соответствующих спецификаций
качества, могут дать возможность клиническим лабораториям сравнивать,
контролировать и улучшать качество их повседневной работы, причем не только на
аналитическом этапе. В конечном итоге направления работы, выбранные
международными организациями, такими как Всемирный альянс за безопасность
пациентов (World Alliance for Patient Safety) и Объединенная комиссия (Joint
Commission), должны привести к приоритезации программ повышения качества,
предназначенных для решения общеизвестных критически важных проблем, таких как
идентификация пациентов и передача результатов лабораторных исследований.
Список
литературы
1.
Kohn LT, Corrigan JM, Donaldson MS. To Err is Human: Building A Safer Health
System. Washington, D.C.: National Academies Press, 1999
2. Leape LL. Errors in medicine. Clin Chim Acta 2009;404:2–5
3. Boone DJ. Is it safe to have a laboratory test. Accred Qual Assur
2004;10:5–9
4. O’Kane M. The reporting, classification and grading of quality failures in
the medical laboratories. Clin Chim Acta 2009;404:28–31
5. Plebani M. Errors in clinical laboratories or errors in laboratory medicine?
Clin Chem Lab Med 2006;44:750–9
6. Plebani M. Errors in laboratory medicine and patient safety: the road ahead.
Clin Chem Lab Med 2007;45:700–7
7. Plebani M. Exploring the iceberg of errors in laboratory medicine. Clin Chim
Acta 2009;404:16–23
8. International Organisation for Standardisation/Technical Specification.
Medical laboratories – reduction of error through risk management and continual
improvement. ISO/TS 22367: 2008
9. Hinckley CM. Defining the best quality control systems by design and
inspection. Clin Chem 1997;43:873–9
10. Gras JM, Philippe M. Application of the Six Sigma concept in clinical
laboratories: a review. Clin Chem Lab Med 2007;45:789–96
11. Graber ML. The physician and the laboratory. Partners in reducing
diagnostic error related to laboratory testing. Am J Clin Pathol
2005;124(Suppl. 1):S1–S4
12. McSwiney RR, Woodrow DA. Types of error within a clinical laboratory. J Med
Lab Technol 1969;26:340–6
13. Ross JW, Boone DJ. Institute on Critical Issues in Health Laboratory
Practice. Wilmington, DE: DuPont Press, 1989:173
14. Khoury M, Burnett L, McKay MA. Error rate in Australian chemical pathology
laboratories. Med J Aust 1996;165:128–30
15. Lapworth R, Teal TK. Laboratory blunders revisited. Ann Clin Biochem
1994;31:78–84
16. Bonini P, Plebani M, Ceriotti F, Rubboli F. Errors in laboratory medicine.
Clin Chem 2002;48:691–8
17. Belk WP, Sunderman FW. A survey of the accuracy of chemical analyses in
clinical laboratories. Am J Clin Pathol 1947;17:853–61
18. Steindel SJ, Howanitz PJ, Renner SW. Reasons for proficiency testing
failures in clinical chemistry and blood gas analysis: a College of American
Pathologists Q-Probes study in 665 laboratories.
Arch Pathol Lab Med 1996;120:1094–101
19. Howanitz PJ. Errors in laboratory medicine: practical lessons to improve
patient safety. Arch Pathol Lab Med 2005;129:1252–61
20. Witte VanNess SA, Angstadt DS, Pennell BJ. Errors, mistakes, blunders,
outliers, or unacceptable results: how many? Clin Chem 1997; 43:1352–6
21. Westgard JO, Westgard SA. The quality of laboratory testing today. Am J
Clin Pathol 2006;125:343–54
22. Tate J, Ward G. Interferences in immunoassay. Clin Biochem Rev
2004;25:105–20
23. Ismail AA. Interference from endogenous antibodies in automated
immunoassays: what laboratorians need to know. J Clin Pathol 2009;62:673–8
24. Dalal BI, Bridgen ML. Factidious biochemical measurements resulting from
hematologic conditions. Am J Clin Pathol 2009;131: 195–204
25. Lippi G, Blanckaert N, Bonini P, Green S, Kitchen S, Palicka V, et al.
Haemolysis: an overview of the leading cause of unsuitable specimens in
clinical laboratories. Clin Chem Lab Med 2008;46:764–72
26. Stankovic AK, Romeo P. The role of in vitro diagnostic companies in
reducing laboratory error. Clin Chem Lab Med 2007;45:781–8
27. Plebani M, Carraro P. Mistakes in a stat laboratory: types and frequency.
Clin Chem 1997;43:1348–51
28. Carraro P, Plebani M. Errors in a stat laboratory: types and frequencies 10
years later. Clin Chem 2007;53:1338–42
29. Astion ML, Shojana KG, Hamil TR, Kim S, Ng VL. Classifying laboratory
incidents reports to identify problems that jeopardize patient safety. Am J
Clin Pathol 2003;120:18–26
30. Kalra J. Medical errors: impact on clinical laboratories and other critical
areas. Clin Biochem 2004;37:1052–62
31. Lundberg GD. Acting on significant laboratory results. JAMA 1981;245:1762–3
32. Lundberg GD. The need for an outcome research agenda for clinical
laboratory testing. JAMA 1998;280:565–6
33. Laposata M, Dighe A. ‘Pre–pre’ and ‘post–post’ analytic error: high incidence
patient safety hazards involving the clinical laboratory. Clin Chem Lab Med
2007;45:712–9
34. Stroobants AK, Goldschmidt HM, Plebani M. Error budget
calculations in laboratory medicine: linking the concepts of biological
variation and allowable medical errors. Clin Chim Acta 2003;333:169–76
35. Hickner J, Graham DG, Elder NC, et al. Testing process errors and their
harms and consequences reported from family medicine practices: a study of the American Academy of Family Physicians National
Research Network. Qual Saf Health Care 2008;17:194–200
36. Gandhi TK, Kachalia A, Thomas EJ, et al. Missed and delayed diagnoses in
the ambulatory setting: a study of closed malpractice claims. Ann Intern Med
2006;14&
Авторы: Шаркова В.Е., ЗАО «Алкор Био», Санкт-Петербург,Власов Г.С., НПП «Медицинская лабораторная диагностика», Москва, Свежова Н.В., ЗАО «Алкор Био», Санкт-Петербург
Статья является результатом анализа обращений (рекламаций и вопросов) потребителей в Отдел биологического технологического контроля (ОБТК) ЗАО «Алкор Био», а также обобщения практического опыта при производстве и разработке тест-систем. Возникающие в результате постановки иммуноферментного анализа (ИФА) проблемы можно разделить на 3 группы: 1) несоответствие паспортным данным в части величины сигнала и фона; 2) дефекты калибровочного графика, в том числе непопадание контрольной сыворотки в заявленный диапазон; 3) несоответствие результата анализа клинической картине, то есть обнаружение существенной разницы между измеренной и ожидаемой концентрациями аналита на всем планшете или в индивидуальных образцах. Перечисленные проблемы могут быть как результатом ошибки при проведении ИФА, так и следствием производственного брака. Как правило, выявление брака возможно только при исследовании возвратной продукции предприятием-производителем. Следствием подтверждения наличия брака является замена изготовителем некондиционной продукции. Однако при обращении в ОБТК предприятия клиническая лаборатория должна быть уверена в правильном использовании приобретенного изделия.
Эта статья преследует две цели, с одной стороны проанализировать действия, приводящие к получению неправильных результатов, с другой стороны предложить способы проверки и устранения ситуации, способствующей возникновению неконтролируемых ошибок. Некорректные действия, влекущие за собой получение ошибочного результата, могут быть допущены на любом этапе анализа – преаналитическом, аналитическом или постаналитическом. Данная статья касается преимущественно вопросов исполнения собственно ИФА. Также рассмотрены некоторые действия клинической лаборатории на преаналитическом и постаналитическом этапах, могущие повлечь получение некорректных результатов анализа.
Преаналитический этап
Одной из причин несоответствия результата анализа и клинической картины является способ получения образцов крови пациентов для ИФА. Отсутствие регламентированного официальными документами способа забора и обработки крови с целью получения сыворотки для лабораторных исследований позволяет клиническим учреждениям использовать разнообразные одноразовые системы забора крови широкого ассортимента.
При внешней простоте эти системы устроены весьма сложно: ускорение формирования сгустка обеспечивается добавлением специальных химических реагентов, для подавления гемолиза эритроцитов и для предотвращения адгезии клеток на стенках системы используются химические агенты другой природы; для лучшего разделения жидкой и твердой фаз крови применяются инертные физические агенты. Все эти добавки могут оказывать существенное интерферирующее воздействие на иммуноанализ. Существующие документы, регламентирующие деятельность производителей этих систем, не обязывают последних к исследованию причин и механизмов интерференции. Таким образом, начиная применять в лабораторной практике ту или иную одноразовую систему, потребитель не имеет информации о потенциальном воздействии продукции на результат. Между тем, анализ литературы показывает, что одна и та же система забора может завышать измеряемую концентрацию одного аналита и занижать – другого. Дополнительное влияние на величину интерференции могут оказывать длительность контакта образца с системой, температура окружающей среды, степень перемешивания образца, факт транспортировки (Власов и др., 2006). Возможным вариантом преодоления такой ситуации может быть проведение сравнительных экспериментов с использованием выбранной одноразовой системы забора крови. За контроль в таких опытах принимается ранее принятый в конкретной лаборатории способ получения сывороток. В ходе опыта проводится определение величины и знака систематической погрешности, вносимой одноразовой системой, для каждого аналита. Результатом исследования является уточнение внутрилабораторных диапазонов нормальных значений каждого аналита. Продукция одного и того же производителя с разными номерами по каталогу, может содержать разные химические и физические агенты, следовательно, данные сравнительных экспериментов с использованием одной одноразовой системы забора крови не могут быть перенесены на другую систему.
Отсутствие документов, регламентирующих забор крови для лабораторной диагностики, может приводить к неожиданным, но правомерным вопросам потребителей наборов ИФА. Суть одной из таких претензий состоит в отсутствии в инструкциях диапазонов нормальных значений аналитов в сыворотке, полученной из капиллярной крови. Венозная и капиллярная кровь различна по газовому и биохимическому составу, что может привести к неконтролируемой интерференции в ИФА. При заборе крови из пальца трудно получить образец достаточного объема без разбавления его тканевой жидкостью. Тканевая жидкость является чужеродным матриксом для компонентов тест-системы. Таким образом, вероятность правильной трактовки результата весьма сомнительна.
Несоответствие результата анализа клинической картине может оказаться следствием несоблюдения простых правил. Если образцы были предварительно заморожены, их следует перемешать, чтобы устранить возникающий при заморозке градиент концентраций. При наличии механических включений образец следует отцентрифугировать, чтобы избежать их попадания в наконечник пипетки и, как следствие, изменения объема вносимого в среду инкубации образца. Однако нельзя допускать длительное центрифугирование и центрифугирование при высоких скоростях.
Не следует стабилизировать образцы бактериостатиками во избежание неконтролируемой интерференции в иммуноанализе.
Аналитический этап
Для аналитического этапа существенны общие требования к помещениям, приборам и посуде.
В помещениях следует поддерживать постоянство температуры и влажности. Слишком сухой воздух неизбежно приводит к проявлению краевых эффектов на планшете вследствие неравномерного испарения из лунок. Повышение температуры приводит к увеличению скоростей всех реакций, реализованных в иммуноанализе (преципитации антигена и антитела, ферментативного преобразования хромогена). Это правило справедливо и для диапазона комнатной температуры, указываемого в инструкциях к ручным наборам – 18-25ºС. Несоблюдение температурного режима может привести к получению сигнала, не адекватного спектрофотометру, и даже к изменению кинетических и равновесных параметров реакции антитела и антигена. Наилучшим способом решения проблемы является кондиционирование помещения. Альтернативным вариантом может быть проведение инкубаций ИФА, требующих комнатной температуры, в термостатируемом шейкере.
Полуавтоматические пипетки, спектрофотометры, дозирующие и измерительные части автоматических анализаторов подлежат периодической поверке. Приборы, не подлежащие поверке, могут быть источником ошибочных результатов. К ним относятся промыватели и термостатируемые шейкеры (встряхиватели). Промыватели нуждаются в визуальном контроле точности дозирования и полноты удаления жидкости из лунок, требуют мероприятий по профилактике зароста. Пренебрежение этими простыми правилами влечет появление высокого фона в анализе и высокого коэффициента вариации между дублями, «нерасхождение» калибровочных проб с низкими уровнями аналита, неправильное определение сывороток с низкими концентрациями аналита.
Источником завышения или занижения результатов во всем анализе (на всем планшете) могут быть шейкеры. Известно, что шейкеры разных производителей, настроенные на одинаковую скорость встряхивания, демонстрируют существенные различия в реальной скорости. С той же проблемой можно столкнуться при закупке шейкеров одной марки у одного и того же производителя. Поставив одинаковые анализы на двух разных шейкерах, оператор может обнаружить существенное различие в измеренной концентрации аналита в одном и том же образце пациента. Причиной такого результата часто является зависимость уровня «открытия» образцов от скорости встряхивания планшета во время инкубации. Во избежание получения различающихся результатов анализов при использовании разных единиц одноименного лабораторного оборудования рекомендуется выровнять шейкеры по реальным скоростям с помощью тахометра, зафиксировать скорость каждого прибора, откорректировать внутрилабораторные диапазоны нормальных значений каждого аналита.
При повторном использовании лабораторной посуды при постановке ИФА могут быть обнаружены высокий фон на планшете, «нерасхождение» калибраторов с низкими уровнями аналита, могут быть неправильно определены концентрации аналита в индивидуальных образцах. Причиной зачастую является осаждение белковых компонентов или хромогена на пластик и стекло посуды при предыдущих постановках ИФА или неполное отполаскивание моющих агентов. Использование одноразовых расходных материалов является наиболее простым способом избежать описанных выше проблем.
В клинической лаборатории должны предъявляться особые требования к качеству дистиллированной или деионизованной воды. При разведении концентрированных и реконструкции лиофизованных компонентов набора правильнее пользоваться свежеприготовленной водой, так как при стоянии воды происходит сдвиг рН, выщелачивание стекла емкости, появляется зарост. Необходимое качество воды предъявляет требования к аппаратам для ее получения – требуется периодически убеждаться в отсутствии коррозии металлических частей и проводить профилактику зароста в пластиковых шлангах.
Все реагенты перед проведением анализа должны быть доведены до комнатной температуры. В противном случае можно столкнуться со слабым окрашиванием всего планшета, с усилением краевого эффекта или появлением концентрационного градиента на планшете. Наличие краевого эффекта легко отслеживается при проведении анализа в дублях, в то время как градиент концентраций методами внутрилабораторного контроля качества не выявляется и влечет за собой неправильное измерение аналита в образцах пациентов. В последнем случае при перестановке каких-либо образцов можно сделать неправильный вывод о невоспроизводимости результатов ИФА относительно другой серии того же набора. Разведение концентрированных и реконструкцию лиофизованных компонентов набора следует проводить водой комнатной температуры по тем же причинам.
Сыворотки при необходимости разводят только тем раствором, который предусмотрен инструкцией и физически присутствует в наборе. Использование воды, промывочного буфера или буфера для разведения образцов из набора, предназначенного для определения другого аналита, не допустимо, так как вызывает реструктуризацию матрикса образцов пациентов и приводит к неправильному определению концентрации аналита. Если по косвенным данным в сыворотке ожидается уровень аналита за пределами верхней границы измеряемого диапазона, такую сыворотку следует ставить в ИФА цельной и в нескольких последовательных разведениях. Это позволит избежать занижения реальной концентрации аналита и, как следствие, неправильной трактовки результата. Особое внимание этому правилу следует уделять, если ИФА реализован в одну стадию инкубации, а в инструкции к тест-системе указана граница хук-эффекта.
Реакция преципитации антигена с антителом начинается, как только первый образец, содержащий искомый аналит, попадает в лунку планшета, а не тогда, когда полностью заполненный планшет помещают в термостатируемый шейкер. Следовательно, чем быстрее будет заполнен планшет от первой до последней лунки, тем меньше повлияет разница в длительности инкубации между первой и последней заполненными лунками на результаты анализа. Наличие градиента определяемых концентраций аналита в разных по положению лунках планшета может привести к занижению или завышению истинной концентрации аналита в зависимости от конструкции тест-системы. Это означает запрет на одновременное заполнение нескольких планшетов для постановки одних и тех же сывороток в разных анализах.
При проведении инкубации ИФА при 37ºС следует учесть требования к оборудованию. Замена термошейкера на нетермостатируемый шейкер, помещенный в термостат, не может считаться адекватной. В последнем случае неизбежно усиление краевого эффекта, в разной степени характерного для планшетных анализов. Усиление краевого эффекта является следствием неравномерного нагрева планшета. При постановке анализа в монопликатах выявить краевой эффект не представляется возможным, это неизбежно приводит к неправильному определению концентрации аналита в образцах.
Упомянутое выше произвольное несоответствие задаваемых скоростей встряхивания реальным скоростям в шейкерах разных марок не позволяет производителю иммуноферментных тест-систем жестко задать этот параметр в потребительской инструкции. Клиническая лаборатория вынуждена сама подбирать скорость встряхивания планшета, сообразуясь с параметрами шейкера, диапазоном скоростей, требуемых по инструкции к тест-системе, и здравым смыслом. Интенсивность окрашивания планшета после проведения колориметрической реакции прямо пропорциональна скорости встряхивания планшета в процессе основной инкубации. Слишком низкая или слишком высокая скорость встряхивания может привести к получению общего сигнала на планшете, не соответствующего паспортным данным, при заданном в инструкции времени проведения колориметрической реакции. Кроме того, низкая скорость встряхивания способствует увеличению коэффициента вариации между дубликатами образца и снижению точности определения концентрации аналита. Чтобы избежать влияния скорости встряхивания на уровень «открытия» образцов рекомендуется провести ряд мероприятий, описанных выше при изложении требований к лабораторному оборудованию.
Планшетный анализ характеризуется существенной случайной ошибкой, выраженной как коэффициент вариации анализа – 8% (ГОСТ Р 51352-99). Эта ошибка достаточно велика, ее игнорирование, следствием которого является постановка анализа в монопликатах, может привести к неправильной трактовке результата в сыворотках с пограничными значениями аналита. В случае повторного измерения образцов может возникнуть необоснованное подозрение на внутрисерийную или межсерийную невоспроизводимость ИФА. Постановка калибровочных проб в дубликатах позволяет не удалить явный выброс одного из дублей при построении графика и, используя оставшийся репликат, адекватно построить калибровочный график. По КВ в образцах пациентов оценивается качество всего проведенного анализа, среднее значение из двух дубликатов повышает точность определения концентрации аналита.
Следует ставить в анализ столько калибровочных проб, сколько предусмотрено тест-системой. При производстве тест-систем формирование набора калибровочных проб проводится так, чтобы весь диапазон измерения описывался калибраторами с заданными концентрациями определенным монотонным образом. Произвольное уменьшение их количества (4 или 5 вместо 6), даже на линейном участке кривой, может привести к неадекватной работе расчетной программы, так как число доступных стандартов накладывает ограничения на вид будущей калибровочной кривой.
Важную роль в иммуноанализе играют методы компьютерной обработки данных, так как при неправильном использовании они могут внести существенный вклад в получение ложных результатов. Более 60% обращений потребителей в наш ОБТК связано с неправильным выбором компьютерной программы. Первым указанием на это служит непопадание контрольной сыворотки в заявленный диапазон; может наблюдаться систематическое завышение или занижение уровня аналита на всем планшете или в каком-либо узком диапазоне измеряемых концентраций. Методы компьютерной обработки данных делятся на эмпирические и теоретические; достоинством теоретических методов является частичная автоматическая коррекция случайных отклонений в отдельных точках калибровочного графика. Наиболее распространенными являются 4-параметрическая логарифмическая логистическая модель (4PL) и преобразование logit-log. Однако одного выбора способа расчета недостаточно для получения адекватных результатов. Необходима проверка корректности реализации алгоритмов расчетов, проводимых программой. Большинство специализированных программ позволяют вычислить концентрацию аналита в каждой калибровочной пробе на основании значения сигнала и соответствующих параметров графика. Расчет концентраций происходит по калибровочному графику; калибровочные пробы, по которым построен график, рассматриваются одновременно и как неизвестные образцы. Чем меньше разница между заявленной и расчетной концентрациями, тем правильнее реализован алгоритм обработки данных. Степень близости значений заявленной и расчетной концентраций оценивают в нескольких последовательных экспериментах, ни в коем случае не однократно. После выбора и проверки программы при работе с образцами пациентов рутинно проводят оценку приемлемости полученных результатов на соответствие паспортным данным, по форме калибровочного графика и по материалам контроля качества.
Вынужденное отступление от инструкции, а именно использование оборудования, не соответствующего требованиям производителя, является частным случаем внесения существенных изменений в аналитическую систему и подпадает под действие Приказа №220 (Приказ № 220, Министерство Здравоохранения РФ). Он описывает мероприятия по определению случайной и систематической погрешностей в сериях установочных экспериментов с использованием контрольных материалов. Определяются сходимость, воспроизводимость и точность рутинного количественного метода. В случае вынужденного отступления от инструкции потребитель должен быть готов к тому, что определяемые в установочных экспериментах параметры окажутся хуже, чем заявленные в технической документации производителя (NCCLSEP15-A, 2001). В случае выявления статистически достоверной систематической погрешности относительно диапазона нормальных значений аналита, указанного производителем тест-системы, проводится корректировка собственных внутрилабораторных диапазонов. Подробный план экспериментов и трактовка результатов приведены в документе NCCLSEP9-A2 (2002). Приобретение лабораторией нового оборудования также требует проведения мероприятий в соответствии с Приказом №220.
Инструкциями производителя, как правило, предусмотрено дробное использование наборов ИФА. Остаток комплектующих следует хранить в соответствии с инструкцией, не допуская контаминации растворов, их испарения, обводнения твердой фазы. Запрещается сливать избыток жидких компонентов тест-системы из лабораторной посуды обратно во флаконы, так как при контакте с лабораторной посудой свойства растворов изменяются – из конъюгатов на стекло и пластик высаживаются белковые компоненты, хромоген при контакте с воздухом и под действием света начинает окисляться. Проблемы, возникающие при несоблюдении этих правил, – невоспроизводимость результатов относительно той же серии тест-системы, завышение или занижение уровня аналита.
Под дробным использованием набора ни в коем случае не следует понимать объединение в одном анализе комплектующих разных серий. Условия производства тест-систем таковы, что комплектующие в серии адаптируют друг к другу, в том числе и по сроку годности.
Постаналитический этап
Возможны ситуации, когда обнаруживается длительное завышение или занижение результатов анализа или существенная, не соответствующая технической документации, невоспроизводимость результатов. Наличие проблемы подтверждается анализом контрольных материалов в соответствии с Приказом №220, затем проводится экспертиза рутинных методов исследования (которая может заключаться в обращении к производителю), лабораторного оборудования и расходных материалов. Выявление существенной случайной ошибки анализа, превышающей ее величину, заявленную производителем, как правило, требует оптимизации и стандартизации условий проведения ИФА, то есть, аналитического этапа анализа.
Иногда в клинической лаборатории возникает необходимость переопределить уровень аналита сторонним методом. Само по себе обнаружение существенных различий в уровнях, измеренных рутинным методом и методом сравнения, не должно влечь за собой немедленного отказа от рутинного метода. Тем не менее, бывают случаи предъявления рекламаций со стороны клинической лаборатории, суть которых описывается как невоспроизводимость работы тест-системы относительно набора другого производителя. В таблице приведены данные по измерению аналита СА 125 в сыворотках крови пациентов тремя методами. При достаточно высокой сходимости результатов встречаются сыворотки, измерения которых разными методами существенно различаются. Они выделены жирным шрифтом; значение, резко отличающееся от двух других, обозначено курсивом.
Таблица. Концентрация аналита СА 125 в сыворотках крови пациентов, измеренная тремя методами.
| Номер сывороки | Abbott АхSym | Алкор Био | Elecsys 2010 |
| 619 | 167,4 | 6.2 | 15 |
| 1104 | 13 | 8,7 | 21,4 |
| 1160 | 17,6 | 21,2 | 21,5 |
| 1191 | 24,9 | 23,5 | 30 |
| 501 | 100,3 | 26.6 | 33 |
| 1153 | 24,9 | 26,6 | 29,4 |
| 1503 | 29.5 | 27.3 | 53,9 |
| 1237 | 23,3 | 32,7 | 35,3 |
| 630 | 109,1 | 111,2 | 143,4 |
| 810 | 223,6 | 118,1 | 430 |
| 1591 | 123 | 121,6 | 123,5 |
| 1069 | 120,6 | 134,1 | 136,3 |
| 973 | 152,2 | 132,3 | 169 |
| 1372 | 108,6 | 183,2 | 90 |
| 1511 | 112,5 | 194.4 | 186,1 |
| 961 | 270,3 | 240,4 | 312 |
| 1737 | 376,9 | 414,9 | 447,4 |
Представленные данные показывают, что сравнение уровня аналита в индивидуальной сыворотке двумя методами (тест-системами) не позволяет сделать компетентное заключение о неадекватности или «неправильности» какого-либо из методов, особенно, если идет речь об аналитах гетерогенного состава (аутоантитела, ферритин, тиреоглобулин, онкомаркеры СА 125, СА 15-3, РЭА, СА 19-9). Подбирая рутинный метод исследования образцов пациентов, нужно знать ограничения в применении метода (скрининг, диагностика, мониторинг), структуру и свойства аналита, чтобы иметь предварительное представление о возможной сходимости результатов между разными диагностическими методами. Собственно эксперименты по оценке адекватности количественного метода строятся по специальным схемам, данные обрабатываются методом ROC-анализа, результаты описываются в терминах «диагностическая чувствительность» и «диагностическая специфичность» (Kopere.a., 1997). Неспециализированная клиническая лаборатория вряд ли может выполнить исследование такого рода.
Заключение
Меры по профилактике ошибок ИФА включают в себя расширение знаний в области биологии, химии, физики и информатики; соблюдение инструкции к изделию и обращение к производителю в случае возникновения вопросов по проведению ИФА; соблюдение приказа №220. Выявление случайных погрешностей в ходе выполнения мероприятий по обеспечению контроля качества лабораторных исследований – предмет для оценки точности и воспроизводимости рутинного метода исследования конкретного аналита, проверки оборудования, повышения квалификации персонала. Выявление систематической погрешности не обязательно влечет за собой вопрос о замене рутинного метода, так как она может быть свойством комплекта лабораторного оборудования или свойством конкретного оператора, но ставит клиническую лабораторию перед необходимостью пересмотра диапазона нормальных значений того или иного аналита, относительно диапазона, указанного в инструкции к тест-системе.
При обнаружении ошибки на каком-либо этапе ИФА – преаналитическом, аналитическом, постаналитическом – она устраняется одинаковым образом:
- Выявление, идентификация,
- Расследование (человеческий фактор, неустойчивая работа прибора, загрязнение растворов и т.п.),
- Документирование (причина выбраковки анализа пациента, определение периодичности повторения ошибки и причин ее возникновения),
- Устранение – естественное завершение процесса.
Литература
- Власов Г.С., Пономарева А.М., Полынцев Д.Г. и др. Системы забора крови и интерференция в иммуноанализе. Клиническая лабораторная диагностика, 2006. В печати.
- ГОСТ Р 51352-99. Наборы реагентов для клинической лабораторной диагностики. Методы испытаний. Госстандарт России, Москва, 2000.
- Приказ № 220 от 26 мая 2003 г. Об утверждении отраслевого стандарта «Правила проведения внутрилабораторного контроля качества количественных методов клинических лабораторных исследований с использованием контрольных материалов». Министерство Здравоохранения Российской Федерации, Москва, 2003.
- NCCLS Document EP15-A. User Demonstration of Performance for Precision and Accuracy; Approved Guideline. NCCLS catalog, 2001. Vol. 21,№25.
- NCCLS Document EP9-A2. Method Comparison and Bias Estimation Using Patient Samples; Approved Guideline – Second Edition. NCCLS catalog, 2002. Vol. 22,№19.
- Koper N.P., Thomas C.M., Massuger L.F. e.a. Comparison of four ‘second generation’ immunoassay systems to determine CA 125 in serum by using a graphical approach to method comparison analysis. Eur J Clin Chem Clin Biochem 1997. Vol. 35, № 8. PP. 617-623.
АННОТАЦИЯ
Процесс клинического лабораторного исследования включает три этапа: преаналитический, аналитический и постаналитический. Несмотря на то, что частота аналитических ошибок в клинических лабораториях существенно снизилась за счет автоматизации и современных технологий, ошибки, связанные с преаналитическим и постаналитическим этапами остаются значительными и требуют внимания специалистов по лабораторной медицине к тому, что происходит за пределами лаборатории. В интересах пациентов необходимо рассматривать любые прямые и косвенные негативные последствия, связанные с лабораторными исследованиями, независимо от того, на каком этапе возникает ошибка.
Введение. Клиническая безопасность пациента определяется правильной и своевременной диагностикой патологии и применением адекватных лечебных мероприятий (при минимальных побочных действиях) с целью достижения благополучного исхода случая заболевания [1] .
Согласно литературным данным на основе результатов лабораторных исследований принимаются до 60-70% клинических решений относительно диагноза заболевания и тактики лечения [2-4].
Как отмечает в своей публикации Меньшиков В.В., «процесс клинического лабораторного исследования – от решения врача назначить анализ до получения им результата анализа – проходит три этапа, в которых соответствующие процедуры выполняет несколько участников. Задача всех участников процесса заключается в том, чтобы как можно меньше изменить состав взятого у пациента образца и в результате анализа отразить с наибольшей точностью те его содержание и свойства, которыми обладает этот материал в организме пациента, и правильно интерпретировать результат, с тем, чтобы получить достоверную лабораторную информацию.
На всех этапах лабораторного процесса могут возникнуть отклонения, приводящие к ошибочному итогу – не вполне достоверной информации».
Автор демонстрирует следующий рисунок этапов клинического лабораторного исследования: до лабораторный, лабораторный и после лабораторный (рисунок 1)
В литературе встречаются и другие названия этапов лабораторного процесса: преаналитический, аналитический и постаналитический.
Следовательно, ошибки, связанные с проведением лабораторных исследований могут быть обусловлены многими причинами на различных этапах проведения: назначением лабораторного теста, не соответствующего клинической задаче; нарушением условий взятия образца биоматериала, его хранения, предварительной обработки и транспортировки; недостаточной квалификацией оператора; недостаточным учетом влияний биологической, ятрогенной, аналитической вариации при оценке результата исследования; неудовлетворительной нозологической интерпретацией результата исследования; задержкой передачи информации о критических изменениях лабораторных показателей и др. Целый комплекс факторов, которые могут оказывать существенное влияние на качество результатов анализов, находится в компетенции врачей-клиницистов и среднего медицинского персонала. Изучение этих факторов будет способствовать обеспечению качества результатов лабораторных исследований.
Целью данного обзора является изучение типов и частоты ошибок в лабораторной медицине на основе анализа международной научной литературы.
Материалы и методы. Были изучены результаты научных исследований в области лабораторной медицины за последние 10 лет. Поиск научных публикаций проводился в базах данных PubMed, Oxford University Press, Google Scholar.
Результаты. Проблема ошибок в клинической лаборатории в последнее время привлекает большое внимание, так как играет ключевую роль для медицинских услуг и может создавать серьезный риск, влияющий на жизнь пациента. Частота лабораторных ошибок значительно варьируется в зависимости от процедур диагностики и этапов всего процесса тестирования [5].
Как отмечают авторы, «частота аналитических ошибок в клинических лабораториях существенно снизилась за последние годы в результате активного движения за безопасность пациентов и внедрения передовых технологий в проведение лабо-
раторных тестов. Однако, по сравнению с медицинскими ошибками других типов, ошибкам в лабораторной медицине уделяется мало внимания. Ошибки в лабораторной медицине трудноопределимы, поскольку их трудно идентифицировать и, даже после обнаружения, понять их причину сложнее, чем в случае медицинских ошибок другого типа. Если сравнивать с неблагоприятными исходами, вызванными хирургическим и другими, зачастую совершенно очевидными, ошибками, совершенными в ходе лечения, лабораторные ошибки имеют тенденцию быть менее явными, указать время и место их совершения непросто» [6].
Традиционно процесс клинического лабораторного исследования подразделяется на 3 этапа:
- — преаналитический этап (назначение определенного исследования, взятие образца биоматериала, его предварительная обработка, хранение и транспортировка к месту проведения собственно анализа);
- — аналитический этап (идентификация образца биоматериала, необходимая обработка для получения аналитической пробы, применение аналитической технологии с использованием соответствующих реагентов и оборудования, получение описательного или количественного результата исследования);
- — постаналитический этап (оценка аналитической, биологической, клинической достоверности результата исследования, его нозологическая интерпретация, доставка результата назначившему исследование персоналу, хранение образца и результатов исследования в условиях и в течение сроков, установленных применительно к данному виду исследования и клинической задаче).
Большинство ошибок происходит на пре- и постаналитическом этапах (таблицы 1,2) [7]. Что касается аналитического этапа, то Lippi и коллеги опубликовали, что общий коэффициент ошибок в процессе тестирования широко варьируется от 0,1% до 3,0% [8]. В исследованиях, проведенных Plebani M., Carraro P., уровень лабораторных ошибок за 10 лет снизился с 0,47% в 1977 году до 0,33% в 2007 году [9-10]. Согласно другим литературным данным (Belk and Sunderman, 1947; Witte, 1997) за период с 1947 по 1997 гг. частота ошибок аналитического этапа снизилась с 162116 на миллион лабораторных тестов (part per million, ppm) до 447 ppm [11-12].
Это произошло благодаря автоматизации, усовершенствованию лабораторных технологий, стандартизации анализа, использованию тщательно разработанных правил внутреннего контроля и эффективных схем обеспечения качества, а также благодаря повышению уровня подготовки персонала.
Однако неудовлетворительное качество остается при выполнении и оценке стандартных клинических биохимических и коагуляционных тестов, гематологических и молекулярно-биологических тестов. В частности, относительно высокая частота аналитических ошибок и связанных с ними неблагоприятных клинических последствий была задокументирована при выполнении иммунохимических исследований.
Таблица 1. Частота встречаемости и типы ошибок на различных этапах аналитического процесса (Mario Plebani, 2007)
|
Типы ошибок |
1996 год |
2000 год |
||
|
ppm |
% |
ppm |
% |
|
|
Общее количество ошибок |
4667 |
100 |
3092 |
100 |
|
Преаналитических |
3186 |
68,3 |
1914 |
61,9 |
|
Аналитических |
617 |
13,2 |
463 |
15,0 |
|
Постаналитических |
864 |
18,5 |
715 |
23,1 |
Таблица 2. Типы ошибок и их частота на различных этапах всего аналитического процесса (Mario Plebani, 2010).
|
Этап общего аналитического процесса |
Тип ошибки |
Относительная частота (%) |
|
Пре-преаналитический |
Ошибка при выборе тестов Ошибка при составлении заявки Неверная идентификация пациентов/ образцов Использование образцов, собранных из канала инфузии Ошибка при сборе образцов (гемолиз, свертывание, недостаточный объем, и т.д.) Использование неподходящей емкости Обращение, хранение и транспортировка |
46,0-68,2% |
|
Преаналитический |
Неправильная сортировка и пересылка образцов Проливание образцов Ошибка при аликвотировании, пипетировании и маркировке Ошибка при центрифугировании (неверное время и/или скорость) |
3,0-5,3% |
|
Аналитический |
Неисправность оборудования Анализ не того образца Интерференция (эндогенная и экзогенная) Невыявленная ошибка контроля качества |
7,0-13,0% |
|
Постаналитический |
Ошибочная валидация данных анализа Несообщение результатов/ передача результатов не тому адресату Слишком большое общее время анализа Неправильный ввод данных и ошибка при записи данных от руки Несообщение/задержка в сообщении о критических значениях |
12,5-20,0% |
|
Пост- постаналитический |
Запоздалая реакция/Отсутствие реакции на лабораторный отчет Неверная интерпретация Неподходящий/неадекватный план диспансерного наблюдения Неназначение необходимой консультации |
25,0-45,5% |
В исследовании, проведенном Laposata M., Dighe A. [13], было установлено, что неправильная интерпретация диагностических и лабораторных тестов врачом, а также неинформирование амбулаторных больных о клинически значимых аномальных результатах, являются довольно широко распространенным явлением, примерно один случай на каждые 14 тестов. Примеры включают пациентов, которых не проинформировали о высоком уровне общего холестерина (8,2 ммоль/л, 318 мг/ дл), низком гематокрите (28,6%) и низком уровне калия (2,6 ммоль/л). Общее количество случаев, когда пациенту не была передана информация или факт передачи информации не был задокументирован, составило 7,1%, а диапазон таких случаев в разных учреждениях от 0% до 26%. Такая ситуация противоречит принципу «солидарной ответственности» и «совместного принятия решения», в рамках которых врач предоставляет пациенту и его семье всю клиническую информацию, включая результаты лабораторных исследований.
Вероятность неблагоприятных последствий лабораторных ошибок и назначения неадекватного лечения варьирует от 2,7% до 12%, но большая доля лабораторных ошибок (от 24,4% до 30%) отвечает за возникновение дополнительных проблем, не сказывающихся прямо на здоровье пациента. В исследованиях сообщается, что ошибки приводили к неадекватному помещению пациентов в отделение интенсивной терапии, ненужному переливанию крови, неверному изменению терапии гепарином и дигоксином. Влияние лабораторных ошибок на дальнейший клинический путь пациента – речь идет о дополнительных ненужных исследованиях (лабораторных, рентгенографических, томографических и т.п.), более инвазивных методах анализа, дополнительных консультациях – гораздо существеннее и, хотя не обязательно причиняет вред, однако доставляет лишнее беспокойство и ведет к дополнительным расходам, как для пациента, так и для системы здравоохранения [14].
Интерес представляют результаты исследования, проведенного в Республике Башкортостан [15]. Данные были собранны из 37 лабораторий медицинских организаций г.Уфы и Республики Башкортостан. Проводился опрос специалистов клинико-диагностических лабораторий государственных медицинских организаций и коммерческих лабораторий, включая заведующих (n=37), биологов (n=351), врачей КДЛ (n=112) по разработанной анкете, которая включала в себя 30 вопросов, касающихся организации работы на преана- литическом этапе лабораторного процесса. Исследования показали, что одной из самых распространенных ошибок на данном этапе является необоснованное назначение лабораторного обследования.
По мнению ряда авторов, на преана- литической фазе происходит большинство лабораторных ошибок [16-20]. В докладе Бонини и его коллег было установлено, что в лаборатории преобладали преданалити- ческие ошибки, варьирующиеся от 31,6% до 75% [21].
В 2008-2009 годах Chawla R. с соавторами определили, что для стационарных больных уровень преаналитической ошибки составил 1,9% (наибольшую частоту составил гемолиз образца – 1,1%), для амбулаторных больных частота ошибок составляла 1,2% (переменная с наивысшей частотой была необоснованность тестирования) [22]. Специалистами было выявлено четырнадцать различных причин преданалитической ошибки, наиболее распространенными из которых были ошибки при заполнении пробирки и идентификации пациента [23- 26].
Заключение. Согласно отчету исследователей из Медицинской школы Университета Джона Хопкинса в Балтиморе, медицинская ошибка является третьей по значимости причиной смерти в США [27]. Безопасность пациентов остается проблемой во многих областях здравоохранения, и лабораторная медицина может стать лидером в снижении ошибок [28].
Содействие эффективному контролю качества и постоянному совершенствованию всего процесса тестирования, включая пре- и постаналитические фазы, является необходимым условием для эффективного лабораторного обслуживания. Медицинские ошибки больше нельзя рассматривать как неизбежные, необходимо их активно оптимизировать и предотвращать [29-30].
СПИСОК ЛИТЕРАТУРЫ
- Меньшиков В.В. Клиническая безопасность пациента и достоверность лабораторной информации (лекция) // Клиническая лабораторная диагностика. -2013. -№6.
- Jordan B., Mitchell C., Anderson A., Farkas N., Batrla R. The Clinical and Health Economic Value of Clinical Laboratory Diagnostics // EJIFCC.-2015.-26(1). -Р.47–62.
- Frank H. Wians. Clinical Laboratory Tests: Which, Why, and What Do The Results Mean? // Laboratory Medicine.-2009.-Volume 40.-Issue 2. -P.105–113.
- Бражникова О.В., Гавеля Н.В., Майкова И.Д. Типичные ошибки на преаналити- ческом этапе проведения лабораторных исследований // Педиатрия. Приложение к журналу Consilium Medicum. -2017. -№4.
- Eng. Wafa’ Al-faraeh, Eng. Mohamed F. Ababeneh. The detection and prevention of errors in Clinical laboratory //International Journal of Scientific and Research Publications.- 2018.-Volume 8, Issue 11.-P.480-486.
- Mario Plebani. Выявление и предотвращение ошибок в лабораторной медицине// Annals of Clinical Biochemistry. -№ 47. -2010.-С. 101-110.
- Plebani M. Laboratory errors: How to improve pre- and post-analytical phases? // Biochem Med. -2007; 17:5-9.
- Lippi G., Plebani M., Šimundić A.M. Quality in laboratory diagnostics: From theory to practice //Biochem Med. -2010; 20:126-130.
- Plebani M., Carraro P. Mistakes in a stat laboratory: Types and frequency//Clin Chem. -1997; 43:1348-1351.
- Carraro P., Plebani M. Errors in a stat laboratory: Types and frequencies 10 years later //Clin Chem. -2007; 53:1338-1342.
- Belk WP, Sunderman FW. A survey of the accuracy of chemical analyses in clinical laboratories// Am J Clin Pathol 1947; 17:853-61.
- Witte VanNess S.A., Angstadt D.S., Pennell B.J. Errors, mistakes, blunders, outliers, or unacceptable results: how many? Clin Chem.-1997; 43:1352-6.
- Laposata M., Dighe A. ‘Pre-pre’ and ‘post-post’ analytic error: high incidence patient safety hazards involving the clinical laboratory //Clin Chem Lab Med.-2007; 45:712–9.
- Plebani M., Piva E. Notification of critical values//Biochem Med. -2010; 20:173-178.
- Аминев Р.А. Билалов Ф. С. Ошибки врача при выборе лабораторного исследования на преаналитическом этапе //Российская академия медицинских наук. Бюллетень Национального научно-исследовательского института общественного здоровья. – 2013. – №. 1. – С. 63-66.
- Fauzia Sadiq and all. Frequency of Errors in Clinical Laboratory Practice//Iranian Journal of Pathology.-2014.-№ 9 (1).-Р.45- 49.
- Sushma B.J., Shrikant C. Study on “Pre-analytical Errors in a Clinical Biochemistry Laboratory”: The Hidden Flaws in Total Testing //Biochem Anal Biochem 8:374.-2019. doi: 10.35248/2161-1009.19.8.374.
- Najat D. Prevalence of Pre-Analytical Errors in Clinical Chemistry Diagnostic Labs in Sulaimani City of Iraqi Kurdistan // PLoS One. -2017; 12(1):e0170211.
- Da Rin G. Pre-analytical workstations: A tool for reducing laboratory errors// Clin Chim Acta. — 2009; 404:68-74.
- Simundic A.M., Topic E., Nikolac N., et al. Hemolysis detection and management of hemolyzed specimens // Biochem Med. -2010;20:154-159.
- Bonini P., Plebani M., Ceriotti F., et al. Errors in laboratory medicine// Clin Chem. -2002; 48:691-698.
- Chawla R., Goswami B., Tayal D., et al. Identification of the types of preanalytical errors in the clinical chemistry laboratory: 1-year study at G.B. Pant Hospital //LabMedicine. — 2010; 41:89-92.
- Bates D.W., Gawande A.A. Improving safety with information technology //N Engl J Med. -2003; 348:2526-2534.
- Plebani M., Bonini P. Wrong biochemistry results. Interdepartmental cooperation may help avoid errors in medical laboratories //BMJ. -2002; 324:423-424.
- Lippi G., Guidi G.C. Risk management in the preanalytical phase of laboratory testing //Clin Chem Lab Med. -2007; 45:720-727.
- Lippi G., Chiozza L., Mattiuzzi C., Plebani M. Patient and Sample Identification. Out of the Maze? //Journal of Medical Biochemistry.-2017. -№36 (2).-Р.107-112.
- Makary M.A., Daniel M. Medical error-the third leading cause of death in the us // BMJ.-2016; 353:i2139.
- Bonini P., Plebani M., Ceriotti F., Rubboli F. Errors in laboratory medicine. Clin Chem.-2002; 48:691-8.
- Julie A. Hammerling, A Review of Medical Errors in Laboratory Diagnostics and Where We Are Today//Laboratory Medicine.-2012.-Volume 43.-Issue 2.-P. 41–44.
- Lippi G., Dimundic A.M., Mattiuzzi C. Overview on patient safety in healthcare and laboratory diagnostics //Biochemia Medica. — 2010; 20:131-143.
Типичные ошибки на преаналитическом этапе проведения лабораторных исследований
О.В.Бражникова*12, Н.В.Гавеля2, И.Д.Майкова2
1ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России. 125993, Россия, Москва, ул. Баррикадная, д. 2/1;
2ГБУЗ «Детская городская клиническая больница им. З.А.Башляевой» Департамента здравоохранения
г. Москвы. 125480, Россия, Москва, ул. Героев Панфиловцев, д. 28
нPedlab79@yandex.ru
Представленная статья призвана помочь практикующему врачу в понимании этапов лабораторных исследований и своей роли в преаналитическом этапе. Описаны наиболее часто встречающиеся ошибки при подготовке к лабораторным исследованиям: общему анализу крови, биохимическому исследованию крови, исследованию коагулограммы, кала и мочи. Приведены клинические примеры влияния на результаты исследования внелабораторных ошибок при подготовке проб.
ключевые слова: лабораторные методы исследования, внелабораторные ошибки, преаналитический этап, подготовка пациента к лабораторным исследованиям, интерференция, гемолиз, липемия, иктеричность, исследование кала на скрытую кровь.
для цитирования: Бражникова О.В., Гавеля Н.В., Майкова И.Д. Типичные ошибки на преаналитическом этапе проведения лабораторных исследований. Педиатрия (Прил. к журн. Consilium Medicum). 2017; 4: 84-90.
Typical errors in the preanalytical phase of laboratory
O.V.Brazhnikova*12, N.V.Gavelya2, I.D.Maykova2
1Russian Medical Academy of Continuous Professional Education of the Ministry of Health of the Russian Federation. 125993, Russian Federation, Moscow, ul. Barrikadnaia, d. 2/1;
2Z.A.Bashlyaeva Children City Clinical Hospital of the Department of Health of Moscow. 125480, Russian Federation,
Moscow, ul. Geroev Panfilovtsev, d. 28
*Pedlab79@yandex.ru
Abstract
The article is intended to help the practitioner in understanding the stages of laboratory research and his role in the preanalytical stage. The most common mistakes in preparation for laboratory tests are described: general blood analysis, biochemical blood test, coagulogram, feces and urine studies. Clinical examples of the influence of non-laboratory errors on sample preparation are presented.
Key words: laboratory methods of research, extrabolor errors, preanalytical stage, preparation of the patient for laboratory tests, interference, hemolysis, lipemia, icterism, occult blood feces.
For citation: Brazhnikova O.V., Gavelya N.V., Maykova I.D. Typical errors in the preanalytical phase of laboratory. Pediatrics (Suppl. Consilium Medicum). 2017; 4: 84-90.
К настоящему времени клиническая медицина обогатилась возможностью проведения большого количества новых методов исследования. Их принято делить на лабораторные и инструментальные. Лабораторные методы исследования находят все большее применение в клинической практике. Так за последнее 10-летие введено более 100 новых методов, позволяющих проводить самые современные гематологические, биохимические, микробиологические, иммунологические, генетические, молекулярно-биологические и другие лабораторные исследования.
Современные методы лабораторной диагностики характеризуются высокой чувствительностью и специфичностью, что позволяет объективно отражать различные метаболические и клеточные процессы в организме. При этом благодаря лабораторным исследованиям, проводимым в рамках плановой диспансеризации, удается выявлять патологию на самых ранних этапах заболевания — задолго до клинической манифестации. Особо следует отметить, что лабораторная медицина в настоящее время по количеству представляемой информации является одной из самых объемных и важных отраслей клинической медицины. Согласно данным Всемирной организации здравоохранения (ВОЗ), методы лабораторной диагностики составляют 75-90% от общего числа различных видов исследований, проводимых пациенту в лечебных учреждениях. При этом более 70% врачебных решений принимается на основании полученных результатов лабораторных исследова-
ний. Особо отмечено, что в 65% случаев результаты лабораторных исследований, выполненных по неотложным показаниям, приводят к коренному изменению терапии, что позволяет спасти жизни пациентов [1].
Главная задача клинико-диагностической лаборатории состоит в том, чтобы обеспечить врача-клинициста достоверной информацией о состоянии пациента, необходимой для установления диагноза и назначения адекватного лечения. При этом подавляющее большинство врачей-клиницистов считают, что они не оказывают никакого влияния на качество обследования пациентов и качество результатов исследований. Это одно из самых распространенных заблуждений.
Существует целый комплекс факторов, которые могут оказывать существенное влияние на качество результатов анализов и целиком находятся в компетенции врачей-клиницистов и среднего медицинского персонала. Без понимания этого невозможно обеспечить качество результатов лабораторных исследований. Все ошибки, приводящие к искажению результатов лабораторных исследований, делят на внелабораторные и внутрилабораторные [1]. В данной статье мы рассмотрим только внелабора-торные ошибки.
Процесс проведения лабораторных исследований принято делить на 3 этапа [1]:
1. Преаналитический.
2. Ананалитический.
3. Постаналитический.
Methods for the diagnosis in pediatrics
Преаналитический этап частично проводится вне лаборатории и включает [1]:
• прием пациента врачом и назначение необходимых лабораторных исследований;
• заполнение бланка-заявки на анализы;
• получение пациентом инструкций у врача или медицинской сестры об особенностях подготовки к сдаче анализов или сбору биологического материала;
• взятие проб биологического материала у больного в процедурном кабинете поликлиники или стационара;
• доставку биоматериала в лабораторию.
Эта часть преаналитического этапа полностью находится в компетенции врача-клинициста и медицинской сестры. Преаналитический этап занимает много времени в процессе выполнения лабораторных исследований. Даже незначительные ошибки на преанали-тическом этапе приводят к искажению качества окончательных результатов лабораторных исследований. Как бы хорошо лаборатория ни выполняла исследования, ошибки на преаналитическом этапе не позволят получить достоверные результаты. Показано, что на преаналитический этап приходится от 46 до 68% всех лабораторных ошибок.
Лабораторные ошибки чреваты потерей времени и средств на проведение повторных исследований и могут стать причиной постановки неверного диагноза. Исследования многих лечебно-профилактических учреждений показывают, что вследствие лабораторных ошибок до 6% пациентов могут получать неправильное лечение, а примерно 19% — назначаются ненужные дополнительные исследования, приводящие к удлинению сроков лечения [1].
Ценность взаимодействия лаборатории и клиницистов определяется не только тем, насколько качественно проводятся исследования и насколько широк их спектр, но и тем, насколько верно определены объем и методы обследования, а также корректностью интерпретации полученных результатов. Важную роль играет выбор метода лабораторного исследования. Например, для исследования кала на скрытую кровь существует несколько методик: химические методы (бензидиновая проба или реакция Грегерсона), имму-нохимический метод и двойной иммунохимический метод. Анализ кала на скрытую кровь химическим способом применяется для обнаружения кровотечений во всех отделах желудочно-кишечного тракта (ЖКТ). Так как тест неспецифичен, то перед его проведением требуется специальная подготовка в виде ограничения употребления мясных продуктов, некоторых видов овощей (томатов, огурцов, редиса), фруктов (яблок) и бобовых.
В иммунохимических тестах на скрытую кровь используют антитела к интактному человеческому гемоглобину и глобину (в отличие от пероксидазных проб, гваяковой и бензидиновой, в основе которых лежит реакция с гемом). Поэтому иммунохимический метод, проявляя более высокую чувствительность и специфичность в выявлении кровотечений на уровне ободочной и прямой кишки, в то же время нечувствителен к скрытым кровотечениям в верхних отделах ЖКТ, где белковая часть гемоглобина подвергается перевариванию. Двойной иммунохимический метод -гемоглобин + трансферрин позволяет выявить кровотечение во всех отделах ЖКТ.
Выбор правильного метода исследования позволяет безошибочно диагностировать уровень поражения ЖКТ и свести к минимуму вероятность ложноположи-тельных и ложноотрицательных результатов.
Бессмысленно проводить некоторые исследования при определенных условиях питания. Так питание ребенка безлактозной смесью делает бессмысленным исследование кала на углеводы. А стартовое обследование для постановки диагноза «целиакия» должно быть проведено в активном периоде заболевания до назначения безглютеновой диеты.
Также нецелесообразным является исследование уровня иммуноглобулинов в крови, белковых фракций сразу после терапии иммуноглобулинами или введения плазмы.
Подготовка пациента к лабораторным исследованиям имеет большое значение для получения достоверных результатов анализов.
Следует придерживаться следующих правил взятия крови на исследование [1]:
• оптимальное время взятия крови — с 7-9 ч утра;
• исключение физических нагрузок за 3 дня до исследования концентрации в крови креатинфосфо-киназы (КФК), миоглобина, а также до общего анализа мочи (ОАМ);
• стараться избегать изменений в питании на протяжении 24 ч до взятия крови;
• взятие крови проводить натощак (если нет особых указаний эндокринолога). При исследовании фракций липопротеидов 12-часовой голод, грудные дети 2,5-3 ч;
• необходимо избегать волнений и стрессов;
• по возможности исключить прием лекарственных препаратов (кроме случаев мониторинга лекарственных средств);
• накануне сдачи крови отказаться от алкоголя и курения;
• исследование крови следует проводить до или через несколько дней после рентгенографии, ректального исследования, физиотерапевтических процедур, ультразвукового исследования (УЗИ) и других медицинских манипуляций;
• при проведении гормональных исследований у женщин репродуктивного возраста (примерно с 12-13 лет) на результаты влияют физиологические факторы, связанные со стадией менструального цикла. Поэтому при подготовке к исследованию концентрации гормонов в крови — фолликулости-мулирующего гормона, лютеинизирующего гормона, пролактина, эстриола, эстрадиола, прогестерона — следует указать фазу цикла;
• перед взятием крови можно пить воду (но не кофе или чай).
Врач-клиницист должен владеть информацией о всех нарушениях данных правил.
Важную роль играет не только устное инструктирование пациента или его родителей/опекунов, выдача памятки об особенностях назначенного исследования, но и соблюдение пациентом предписанного ему режима и правил сбора биоматериала (моча, кал и т.д.).
Несоблюдение каждого пункта ведет к искажению результата и, как следствие, к ошибке. Например, сдача нормативов по физкультуре в школе или интенсивная тренировка в спортивной секции накануне диспансеризации может привести к ложной протеинурии, эритроцитурии, изменениям в общем анализе крови, биохимическом анализе крови, повышению уровня КФК и др.
На результаты ряда анализов влияет время суток. Самая высокая концентрация мочевой кислоты в крови приходится на утренние часы, и в течение дня колебания ее содержания могут составлять от +50 до -60%. Для кальция колебания в течение дня могут составлять 80%, от максимальных значений в 20:00 до минимальных — в 3:00. Для стандартизации принято проводить исследования, учитывая эти колебания в утренние часы.
Содержание в крови отдельных гормонов также существенно изменяется в зависимости от времени суток (циркадные ритмы), в связи с чем нормы, представленные в бланках анализов, имеют разные значения и зависят от времени забора крови.
При проведении исследования крови не натощак возможны завышенные показатели концентрации глюкозы, триглицеридов, холестерина, липопротеи-нов. Сыворотка при этом становится хилезной (мутной), что может привести к искажению других исследуемых параметров.
CONSILIUM MEDICUM. Pediatrics 2017 | NO. 4 85
Длительное голодание (дольше 24 ч) также может привести к искажению результатов: снижению концентрации глюкозы, повышению уровня триглицери-дов. Стресс и волнение могут вызвать кратковременный лейкоцитоз, привести к снижению концентрации железа; увеличению концентрации катехоламинов, альдостерона, кортизола, пролактина, ангиотензина, ренина, соматотропного и тиреотропного гормонов, альбумина, глюкозы, фибриногена, инсулина и холестерина. Сильное беспокойство, сопровождаемое гипервентиляцией, может вызвать дисбаланс кислотно-основного состояния, при этом возможно увеличение концентрации лактата и жирных кислот в крови.
Прием лекарственных препаратов может отражаться на количественном содержании в организме целого ряда анализируемых показателей. Например, прием варфарина удлиняет протромбиновое время, а введение гепарина приводит к удлинению активированного частичного тромбопластинового времени (АЧТВ). Прием препаратов, содержащих ацетилсалициловую кислоту, удлиняет кровотечения по Дуке.
При проведении лекарственного мониторинга точное время забора крови является очень важным параметром для правильной интерпретации результатов исследования.
Для контроля за антикоагулянтной терапией важно также исследование параметров коагуляции на пике действия препарата (оценка безопасности) и перед следующим введением (оценка эффективности).
Загрязнение лабораторных проб инфузионными растворами и гепарином является самой частой и распространенной ошибкой в стационарах, особенно в отделениях интенсивной терапии. Пробу крови не следует брать из катетера, в который проводится инфу-зия, а также из сосуда, расположенного проксимально от места стояния катетера.
Не стоит проводить исследование коагулограммы в течение нескольких часов после промывания катетера гепарином. Даже минимальное количество данного антикоагулянта способно значимо удлинять АЧТВ и тромбиновое время.
Алкоголь может повлиять на изменение концентрации в крови таких параметров, как глюкоза, билирубин, мочевая кислота, липиды и холестерин, пролак-тин. Употребление кофе перед забором крови может способствовать ложному снижению концентрации магния и глюкозы в крови, а также повышению концентрации катехоламинов и ренина. Курение приводит к увеличению концентрации гемоглобина, количества эритроцитов, ретикулоцитов, среднего объема эритроцита и снижению количества лейкоцитов. Возможны также изменения в лейкоцитарной формуле: снижение количества эозинофилов, увеличение количества нейтрофилов и моноцитов. Отмечено повышение активности у-глутамилтрансферазы на 10% при выкуривании пачки сигарет в день. Выкуривание сигареты за 1 ч до запланированного забора биоматериала повышает концентрацию в крови адреналина, корти-зола, альдостерона и свободных жирных кислот.
Клиницист должен знать, понимать и учитывать влияние условий забора, хранения, транспортировки проб биоматериала, а также биологических, аналитических и ятрогенных влияний на результаты лабораторных исследований. С другой стороны, его важнейшая обязанность заключается в учете влияния патологических факторов, определяющих отклонение результатов лабораторных исследований, от «нормальных величин» или референтных интервалов.
Рассмотрим значение интерференции, т.е. вмешательства постороннего фактора в результаты анализа. Интерференция может быть вызвана наличием в пробе биоматериала как эндогенного, так и экзогенного вещества. К основным эндогенным интерферирующим факторам относят следующие: гипербилиру-бинемия, гемолиз, липемия [2].
При гипербилирубинемии значительно повышается светопоглощение сыворотки крови, что может приве-
сти к повышению оптической плотности фона и созданию помех при определении целого ряда показателей. Кроме этого, при определении альбумина с использованием связывающих красителей билирубин может конкурировать за связывание с красителем и приводить к ложному занижению концентрации альбумина.
Гемолиз является результатом высвобождения внутриклеточных компонентов из эритроцитов и других клеток крови во внеклеточную жидкость. Внутриклеточная концентрация некоторых клеточных компонентов в 10 раз выше их внеклеточной концентрации, поэтому в гемолизной сыворотке всегда будет увеличен уровень калия.
Компоненты разрушенных клеток крови могут прямо или косвенно влиять на концентрацию в сыворотке крови различных биохимических показателей. Так, аденилаткиназа, высвобождающаяся из эритроцитов, может стать причиной увеличения активности КФК и ее фракции КФК-МВ. Псевдопероксидазная активность свободного гемоглобина служит помехой при измерении концентрации билирубина.
Высвобождение протеаз из клеток крови снижает активность коагулирующих факторов и может увеличить образование продуктов деградации фибрина [2].
Гемолиз в плазме/сыворотке служит причиной увеличения концентрации калия, лактатдегидрогиназы (ЛДГ), аспартатаминотрансферазы (АСТ), искажает процентное соотношение белковых фракций. Принято оценивать степень гемолиза «+», «++», «+++», «++++» или «лаковая» кровь. При высокой степени гемолиза исследования не проводятся, а кровь бракуется. При легком гемолизе лаборатория делает пометку на бланке с указанием степени гемолиза в «+» для того, чтобы клиницист учитывал влияние интерферирующего вещества на результаты исследования.
Рассмотрим на клиническом примере, как меняются показатели биохимического исследования крови при гемолизе «+++».
клинический пример 1
Отделение реанимации и интенсивной терапии. Ребенок 3 лет с диагнозом: острая кишечная инфекция; сахарный диабет типа 1, декомпенсация.
После центрифугирования крови — гемолиз «+++», о чем сообщено в отделение. В течение 30 мин произведен повторный забор материала — после центрифугирования сыворотка нормального цвета. Для того чтобы показать, насколько велико влияние гемолиза на результаты биохимических исследований крови, произведено исследование обеих сывороток (табл. 1).
В гемолизной пробе ЛДГ повышена в 3 раза, К+ -в 2 раза, С-реактивный белок — в 30 раз, завышены уровни магния, АСТ, общего белка, КФК.
Липемия определяется как мутность, видимая невооруженным глазом в исследуемых образцах. Наиболее частой причиной липемии является повышенная концентрация триглицеридов. Липемические образцы неизбежно встречаются в практике, так как повышенная концентрация липидов нередко является производной разных болезненных состояний, таких как: сахарный диабет, употребление алкоголя, нефротиче-ский синдром, хроническая почечная недостаточность, панкреатит и т.д.
Механизмы влияния липемии
на достоверность лабораторных
исследований
Липемия создает помехи путем рассеяния света и нарушения его поглощения при прохождении через реакционную смесь. В образце присутствует ряд жиросо-держащих компонентов, которые, рассеивая свет, образуют молочный или мутный вид сыворотки/плазмы. При сильной мутности никакие измерения невозможны в силу ограниченной линейности спектрофотометра [3].
АЦЦ®. НЕТ ПРИЧИНЫ КАШЛЯТЬ
1 Ацеталцистеин включен в стандарты терапии ОРИ и гриппа у детей и взросл ы*//Сгандарты медико-санитарной и специализированной медицинской помощи. Класс X. Болезни органов дыхания (JDD-J99). www.rosninzdrav.ru | 1 АЦЦ® разжижает мокрое и облегчает ее отхождение, в результате дыхательные пути освобождаются от мокроты. Кашель как симптом заболеваний органов дыхания, сопровождающихся образованием вязкой мокроты. 3 Симонова О.И. Простые ответы на сложные вопросы о муколигаках для детей. Вопросы современной педиатрии. 2015, №14(4]. с. 509-513. |
* Амноксидантное действие ацепмщипеина повышает защиту клеток от повреждающего действия свободнорадикального окисления, свойственного интенсивной воспалительной реакции. ТОРГОВОЕ НАИМЕНОВАНИЕ: АЦЦ® сироп 20 мг/мл РЕГИСТРАЦИОННЫЙ НОМЕР: ЛП-002668 МЕЖДУНАРОДНОЕ НЕПАТЕНТОВАННОЕ НАЗВАНИЕ: ацетилцистеин (acetylcysteine]
ПОКАЗАНИЯ К ПРИМЕНЕНИЮ: Заболевания органов дыхания, сопровождающиеся образованием вязкой трудноотдеяяемой мокроты: острые и хронические бронхиты, обструктивный бронхит, трахеит, ларинготрахеит, пневмония, абсцесс легкого, бронхоэктатическая болезнь, бронхиальная астма, хроническая обструктивная болезнь легких, бронхиолиты, муковисцидоэ. Острые и хронические синуситы, воспаления среднего уха (средний отит]. ПРОТИВОПОКАЗАНИЯ: повышенная чувствительность к ацетилцисгеину или другим компонентам препарата, язвенная болезнь желудка и двенадцатиперстной кишки в стадии обострения, беременность и период лактации, кровохарканье, легочное кровотечение, детский возраст до 2 лет. С ОСТОРОЖНОСТЬЮ: язвенная болезнь желудка и двенадцатиперстной кишки в анамнезе, бронхиальная астма, печеночная и/или почечная недостаточность, непереносимость гистамина (следует избегать длительного приема препарата), варикозное расширение вен пищевода, заболевания надпочечников, артериальная гипергензия. ОСОБЫЕ УКАЗАНИЯ: Пациентам, соблюдающими диету, направленную на ограничение потребления натрия необходимо учитывать, что 1 мл сиропа содержит^ ,02 мг натрия. При применении ацетилцистеина очень редко сообщалось о случаях развития тяжелых аллергических реакций, таких как синдром Стивенса-Джонсона и синдром Лайелла. Возможны взаимодействия с другими средствами (см. соответствующий раздел инструкции]. ПОБОЧНЫЕ ЭФФЕКТЫ: Нечасто (>1/1000, <1/100] наблюдаются реакции гиперчувствительности, кожный зуд, сыпь, экзантема, крапивница, ангионевротический отек, снижение артериального давления, тахикардия; стоматит, боль в животе, тошнота, рвота, диарея, шум в ушах, головная боль, лихорадка.
Материал предназначен для медицинских и фармацевтических работников.
RU1711743914
ЗАО «Сандоз», 125315, Москва, Ленинградский проспект, д. 72, корп. 3, тел.
«■7 (495) 660-75-09; www.sandoz.iu
SANDOZANovartis
Division
ПЕРЕД НАЗНАЧЕНИЕМ ПРЕПАРАТА. ПОЖАЛУЙСТА, ОЗНАКОМЬТЕСЬ С ПОЛНОЙ ИНСТРУКЦИЕЙ
Включен в стандарты Минздрава РФ1
ОБЛЕГЧАЕТ
ОТХОЖДЕНИЕ
МОКРОТЫ
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
«ЬЩГЧАЕТ
ОТКОЖДВМ!
МОКРОТЫ
МГЧГЧАП «ождсние wxeoiu
0 Воздействуя на мокроту, АЦЦ® очищает бронхи и помогает избавиться от кашля
0 Антиоксидантное
и противовоспалительное действие
0 Нормализует мукоцилиарный клиренс3 и защищает бронхи4
таблица 1. результаты первичного (на фоне гемолиза) и повторного биохимического анализа крови
параметр Гемолизная кровь повторное взятие
К+, ммоль/л 7,36 4,16
Na+, ммоль/л 128,4 132,5
Ca2+, ммоль/л 1,13 1,22
ACT, Е/л 79 50
ЛДГ, Е/л 1121 412
Щелочная фосфатаза, Е/л 0 358
КФК, Е/л 128 76
Общий белок, г/л 66 59
Альбумин, г/л 46 38
Мочевина, ммоль/л 6,1 5,5
Креатинин, мколь/л 49 53
Кальций, ммоль/л 2 2,2
Магний, ммоль/л 0,73 0,59
Глюкоза, ммоль/л 14,5 11,6
С-реактивный белок, мг/л 68,7 1,8
таблица 2. Сроки доставки проб в лабораторию (D.Garza, K.Becan-McBride, 1989)
исследования максимально допустимое время с момента забора материала, мин
Микроскопия мочи 90
Кал на амебиаз Немедленно
Общеклинический анализ крови 60
Биохимический анализ крови на глюкозу на ферменты 20 30
Микроскопия мочи 90
на К+, Nа+, С1-, НСО-3 30
Свертываемость крови 45
Чтобы избежать влияния временного фактора на результаты анализов, доставку материала в лабораторию необходимо производить как можно быстрее (табл. 2). Чем раньше сыворотка отделена от эритроцитов, тем меньше влияние гликолиза (значит, меньшим будет влияние на концентрацию глюкозы, фосфора, кальция и активность некоторых ферментов). Концентрация билирубина в крови снижается под воздействием света (особенно яркого солнечного). Действие света также повышает активность щелочной фосфатазы. Время доставки биоматериала в лабораторию должно укладываться в четкие временные интервалы. При их соблюдении удается максимально снизить негативное влия-
ние временного фактора на результаты лабораторных исследований [4].
Сложность идентификации дизентерийной амебы может быть связана как с наслоением побочного действия антидиарейных и противомикробных препаратов, так и с присутствием в кишечнике других амеб, идентичных (Entamoeba dispar, E. moshkovskii) или сходных (Entamoebacoli, Entamoebahartmanni) с E. histolytica. Вегетативные формы амеб значительно варьируют в размерах: от 8-10 мкм (E. hartmanni, E. nana) до 18-20 мкм и выше (Escherichia coli). Сходный размер с просветной формой E. histolytica (13-18 мкм) имеют только Jodamoebabuetschlii и Di-entamoebafragilis, однако они резко различаются по строению ядер. Таким образом, тканевая и просвет-ная формы дизентерийной амебы могут быть идентифицированы [5]. В цистной форме идентифицировать паразита намного сложнее, поэтому исследование проводится в свежевыделенном, теплом кале, где присутствуют тканевые и просветные формы дизентерийной амебы.
Объемы исследуемой крови также имеют значение. Современные методики, лабораторная посуда, автоматизация лабораторных исследований позволяют использовать небольшое количество крови для проведения необходимых исследований. При взятии крови важно знать максимальные ее объемы (особенно у детей), которые можно брать однократно и за все время госпитализации (табл. 3). Игнорирование этих норм приводит к ятрогенным осложнениям — развитию вначале латентного железодефицита, а затем и железо-дефицитной анемии из-за избыточных и неоправданно частых заборов крови для лабораторных исследований.
Коагулограмма проводится для определения состояния плазменного звена гемостаза. Отмечено, что при исследовании коагулограммы выявляется наиболее высокий уровень внелабораторных ошибок.
Выделяют следующие ошибки при заборе крови для выполнения коагулограммы [1]:
• увеличение длительности наложения манжеты;
• слишком быстрое или слишком медленное взятие крови;
• использование пробирки без антикоагулянта или с антикоагулянтом, не применяемым в коагуологии;
• взятие крови из катетера, сразу после введения антикоагулянтов или после массивной инфузии;
• нарушение соотношения кровь/антикоагулянт;
• отсутствие перемешивания крови сразу после взятия и, как следствие, образование сгустка в пробирке;
• сильное встряхивание пробирки, вспенивание;
• гемолиз;
• доставка в лабораторию позднее, чем через 45 мин;
• несоблюдение температурного режима при транспортировке.
Нарушение этих правил приводит к значительным разнонаправленным изменениям параметров коагуло-граммы.
таблица 3. максимальные нормы взятия крови за 1 раз и за все время госпитализации у детей до 14 лет [1]
масса тела пациента, кг максимальная норма взятия крови за 1 раз, мл максимальная норма взятия крови за весь период госпитализации, мл масса тела пациента, кг максимальная норма взятия крови за 1 раз, мл максимальная норма взятия крови за весь период госпитализации, мл
2,7-3,6 2,5 23 27,7-29,5 25 220
3,6-4,5 3,5 30 30-31,8 30 240
4,5-6,8 5 40 32,3-34,1 30 250
7,3-9,1 10 60 34,5-36,4 30 270
9,5-18,2 10 130 36,8-38,6 30 290
18,6-20,5 20 140 39,1-40,9 30 310
20,9-25,5 20 180 41,4-43,2 30 330
25,5-27,3 20 200 43,6-45,5 30 350
Methods for the diagnosis in pediatrics
Рассмотрим на клиническом примере, как меняются показатели коагулогического исследования крови при образовании сгустка в пробирке.
клинический пример 2
Пациент отделения патологии новорожденных. Диагноз: внутриутробная пневмония.
При взятии крови из-за плохого перемешивания пробы с антикоагулянтом образовался небольшой фибриновый сгусток. Проба была забракована. Через 30 мин произведен успешный повторный забор крови. Для демонстрации влияния небольшого сгустка в пробе на результаты коагулограммы были проведены параллельные исследования проб (табл. 4).
В пробирке со сгустком снижено количество фибриногена, так как он уже участвовал в образовании сгустка, и, как следствие, удлинено АЧТВ и тромбино-вое время.
При исследовании ОАМ также необходимо придерживаться ряда правил [1]:
1. Для ОАМ рекомендуется использовать утреннюю, самую концентрированную порцию мочи.
2. Собирается моча сразу после сна. Предыдущее мочеиспускание желательно не позже, чем в 2:00 ч ночи (взрослые дети).
3. Для сбора мочи используется чистая емкость с крышкой.
4. Лучше всего собирать мочу сразу в посуду, в которой она будет доставлена в лабораторию.
5. Из судна, горшка брать нельзя, так как сохраняется осадок фосфатов, способствующих разложению мочи.
6. Перед сбором мочи необходимо проводить тщательный туалет наружных половых органов.
7. Интервал между сбором мочи и доставкой в лабораторию должен быть как можно меньше (не более 1,5-2 ч, хранение обязательно в прохладном месте).
8. Во время менструаций у женщин и девушек мочу не исследуют.
9. После цистоскопии анализ мочи назначается не ранее чем через 5-7 сут.
10. Если на исследование доставляется не вся собранная моча, то перед сливанием необходимо тщательное взбалтывание, чтобы осадок, содержащий форменные элементы и кристаллы, не был утрачен [6].
Изменения со стороны наружных половых органов, такие как вульвит, синехии вульвы, баланит, баланопо-стит, также оказывают влияние на результаты ОАМ. При изменениях в ОАМ следует тщательно осмотреть наружные половые органы ребенка для исключения контаминации мочи лейкоцитами и клетками слущен-ного эпителия. Влияние на изменения в ОАМ воспалительных заболеваний наружных половых органов у детей можно рассмотреть на клинических примерах.
клинический пример 3
Девочка 2 года. Жалоб нет. Во время диспансеризации выполнен общий анализ крови:
Гемоглобин — 128 г/л, лейкоциты — 5,6х109/л, СОЭ -4 мм/ч, палочкоядерные — 1%, сегментоядерные — 34%, эозинофилы — 2%, лимфоциты — 55%, моноциты — 8%.
Выполнен ОАМ: плоский эпителий — 10-12 в поле зрения (п. зр.), лейкоциты — 25-30 в п. зр, эритроциты -2-3 в п. зр., бактерии — нет.
Осмотр наружных половых органов: гиперемия в области вульвы, синехии вульвы.
УЗИ органов мочевой системы: патологии не выявлено.
Гинекологический мазок: плоский эпителий — 15-18 в п. зр., лейкоциты — 30-40 в п. зр., флора — кокковая, споры дрожжевых грибов.
Исследование ОАМ после лечения у гинеколога: плоский эпителий — 2-3 в п. зр., лейкоциты — 2-3 в п. зр., эритроциты и бактерии — нет.
Осмотр наружных половых органов после лечения: без патологии.
Гинекологический мазок после лечения: плоский эпителий — 3-4 в п. зр., лейкоциты — 3-5 в п. зр., флора — кокковая.
клинический пример 4
Мальчик 6 мес во время плановой диспансеризации.
Проведены исследования.
Общий анализ крови: гемоглобин — 132 г/л, лейкоциты — 6,9х109/л, СОЭ — 2 мм/ч, палочкоядерные — нет, сегментоядерные — 25%, эозинофилы — 3%, лимфоциты — 62%, моноциты — 10%.
ОАМ: плоский эпителий — 8-10 в п. зр., лейкоциты -20-25 в п. зр., эритроциты — 1-2 в п. зр., бактерии нет.
Осмотр наружных половых органов: гиперемия в области головки полового члена.
УЗИ органов мочевой системы: без патологии.
После лечения у педиатра (ванночки с фурацили-ном, местно — антибактериальная мазь).
ОАМ: плоский эпителий — 1-2 в п. зр., лейкоциты -1-2 в п. зр., эритроциты — нет, бактерии — нет.
Осмотр наружных половых органов: без патологии.
Исследование кала также требует соблюдения ряда правил [1]:
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
• для копрологического исследования требуется не менее 5 г кала, для паразитологического — 50 г;
• кал собирается из 4-5 мест и обязательно из конца испражнений;
• при подозрении на амебиаз необходимо проводить исследование сразу после испражнения;
• посуда, в которой кал доставляется и хранится, должна быть одноразовой, изготовлена из прозрачного материала (стекла или пластика), с плотно завинчивающейся крышкой, не должна содержать остатков моющих средств;
• не допускаются сбор кала в посуду с узким горлом, использование картонных коробок, открытых емкостей;
• при невозможности немедленного исследования материал можно сохранять в холодильнике (4-5°С) не дольше 6 ч;
• для копрологического и паразитологического исследования более взрослый пациент должен 2-3 дня находиться на определенной диете: исключить из рациона грубую клетчатку (бананы, картофель, капусту); выпечку с маком, кунжутом, тмином, другими семенами; не принимать антациды, сорбенты, слабительные, препараты железа, висмута, алюминия; исключить инвазивные процедуры на ЖКТ;
• нежелательно использовать очистительную клизму.
Перианальный соскоб на энтеробиоз проводится с учетом знаний о жизненном цикле остриц. Цикл развития остриц составляет около 30 дней, место обитания — прямая кишка, где проходят их рост и развитие. Оплодотворение самки происходит в толстой кишке, после чего она движется к выходу из прямой кишки для откладывания яиц, так как для их созревания необходимо присутствие кислорода. Самка выползает из прямой кишки (в ночные часы), когда макси-
таблица 4. влияние сгустка в пробе на результаты коагулограммы
показатели тестов нормальный забор Сгусток в пробирке
Протромбин, % 97,5 95,8
Фибриноген, г/л 3,08 1,67
АЧТВ, с 38,9 55,6
Тромбиновое время, с 15,4 19,5
Антитромбин III, % 48,6 39,2
CONSILIUM MEDICUM. Pediatrics 2017 | NO. 4 89
мально расслаблена мускулатура анального жома, и откладывает яйца (до 20 тыс. от 1 особи) в кожных складках в области анального отверстия, где оптимальные условия для развития личинок: тепло, влажность, наличие кислорода. Соскоб с перианальных складок делают рано утром до дефекации, без проведения мероприятий по личной гигиене. Соблюдение этих правил позволяет свести к минимуму количество ложноотрица-тельных результатов.
Таким образом, преаналитика является очень важным этапом лабораторных исследований, строгое соблюдение правил которого позволяет корректно провести лабораторное тестирование, что, в совокупности с результатами других диагностических методов обследования дает возможность получить адекватную информацию о состоянии здоровья пациента.
Литература/References
1. Кишкун А. А., Гильманов АЖ., Долгих Т.И. и др. Организация преаналитиче-ского этапа при централизации лабораторных исследований. Методические
рекомендации. Поликлиника. 2013; 2: 6-27. / Kishkun A.A., Gil’manov AZh, Dol-gikh T.I. i dr. Organizatsiia preanaliticheskogo etapa pri tsentralizatsii laboratornykh issledovanii. Metodicheskie rekomendatsii. Poliklinika. 2013; 2: 6-27. [in Russian]
2. Guder W, da Fonseca-Wollheim F, Heil W et al. The Hemolytic, Icteric and Lipemic Sample Recommendations Regarding their Recognition and prevention of Clinically Relevant Interferences. J LabMed 2000; 24: 357-64.
3. Becan-McBride K. Laboratory sampling. Does the process affect the outcome? J In-traven Nurs 1999; 22 (3): 137-42.
4. Кишкун А.А. Руководство по лабораторным методам диагностики. М.: ГЭОТАР-Медиа, 2007. / Kishkun A.A. Rukovodstvo po laboratornym metodam diagnostiki. M.: GEOTAR-Media, 2007. [in Russian]
5. Методы контроля. Биологические и микробиологические факторы. Лабораторная диагностика гельминтозов и протозоозов. Методические указания. 2013. http://www.hemltd.ru/export/sites/HemLtd/.galleries/publications_nd_mi-cro_kdl/MUK_4_2_3145_13.pdf / Metody kontrolia. Biologicheskie i mikrobio-logicheskie faktory. Laboratornaia diagnostika gel’mintozov i protozoozov. Metodicheskie ukazaniia. 2013. http://www.hemltd.ru/export/sites/HemLtd/.gal-leries/publications_nd_micro_kdl/MUK_4_2_3145_13.pdf [in Russian]
6. Петухова М.А Преаналитический этап лабораторных исследований (учебное пособие). Екатеринбург: УГМУ 2014. / Petukhova M.A Preanaliticheskii etap laboratornykh issledovanii (uchebnoe posobie). Ekaterinburg: UGMU, 2014. [in Russian]
Сведения об авторах
Бражникова оксана владимировна — аспирант каф. педиатрии с курсом поликлинической педиатрии им. Г.Н.Сперанского ФГБОУ ДПО РМАНПО, ГБУЗ «ДГКБ им. З.А.Башляевой». E-mail: pedlab79@yandex.ru
Гавеля наталия вячеславовна — зав. клинико-диагностической лаб. ГБУЗ «ДГКБ им. З.А.Башляевой»
майкова ирина дмитриевна — канд. мед. наук, зам. глав. врача по медицинской части ГБУЗ «ДГКБ им. З.А.Башляевой»
Общество детских гастроэнтерологов, гепатологов и нутрициологов
XXV конгресс детских гастроэнтерологов россии и стран снг
(«Актуальные вопросы абдоминальной патологии у детей») Москва — 13-14 марта 2018 г.
Глубокоуважаемые коллеги!
В марте 2018 года в Москве состоится Юбилейный XXV Конгресс, посвященный актуальным проблемам гастроэнтерологии детского возраста. Оргкомитет приглашает всех желающих принять участие в его работе. На Конгрессе будут обсуждаться научные и практические вопросы, связанные с изучением этиологии и патогенеза, разработкой методов диагностики, консервативного и оперативного лечения заболеваний пищевода, желудка, кишечника, поджелудочной железы и печени у детей, а также вопросы детской диетологии. участие в конгрессе и публикация тезисов бесплатные!
место проведения: Москва, гостиница «Салют». Адрес: Москва, Ленинский проспект, д. 158.
Проезд от станции метро «Юго-Западная» автобусом №720 до остановки «Гостиница Салют». Далее пройти 50 метров до шлагбаума (центральный въезд в гостиницу). От аэропорта «Внуково» автобусом №611 (кроме автобуса-экспресс) или на маршрутном такси №45 до остановки гостиница «Салют».
При бронировании номеров в гостинице «Салют» участникам конгресса предоставляется скидка. Условия предоставления скидки будут
представлены в дальнейшей информации.
конгресс включен в систему нмо
информация на сайтах odgru.ru, www.gastroportal.ru
тезисы и Статьи для публикации в сборнике и журнале «вопросы детской диетологии» принимаются по ВСЕМ темам абдоминальной патологии и нутрициологии до 10 ЯНВАРЯ 2018 г. ТОЛЬКО в электронном виде в формате Word for Windows или rtf через 1,5 интервала объемом до 2 страниц машинописного текста каждый (размер шрифта — 12 пунктов) по E-mail: congresspg@gmail.com обязательно (!) вложенным документом (attachment). Тезисы будут опубликованы отдельным сборником и в журнале «Вопросы детской диетологии» (ВАК, SCOPUS).
Формат заголовка:
Название И.О.Фамилия, … Учреждение, Город
Предлагаем Вам также присылать статьи для публикации в журнале «Вопросы детской диетологии» по всем проблемам детской диетологии и гастроэнтерологии. Ваши статьи будут опубликованы в ближайших номерах журнала. Журнал входит в список ВАК и SCOPUS.
все вопросы по поводу участия можно согласовать по E-mail: congresspg@gmail.com оргкомитет конгресса
6
Содержание
- 4. Ошибки при проведении лабораторных исследований.
- Факторы, приводящие к ошибке перед проведением исследования
- Виды ошибок исследований
- Внелабораторные ошибки
- Внутрилабораторные ошибки
- Источники ошибок при лабораторных исследованиях их классификация способы преодоления
- Юлия Ярец, заведующая клинико-диагностической лабораторией РНПЦ радиационной медицины и экологии человека, кандидат мед. наук, доцент Важная составляющая
- Рекомендации
- Внутренний стандарт
4. Ошибки при проведении лабораторных исследований.
В ходе лабораторных исследований возможны ошибки. Окончательный результат каждого определения состоит из действительных величин и определенной ошибки исследования, являющейся его составной частью. Оценка достоверности результата и его клиническая оценка требуют знания видов ошибок, которые могут возникать в течение исследования. Ошибки клинических исследований можно классифицировать следующим образом:
— ошибка предшествующая исследованию;
— аналитическая ошибка (лабораторная);
1. Ошибка перед проведением исследования. Эта ошибка охватывает группу факторов, которые связаны с подготовкой больного к обследованию, с забором и хранением материала до начала анализа.
Факторы, приводящие к ошибке перед проведением исследования
при подготовке пациента к исследованию: нестандартное время суток, неучтённые диета или приём лекарств и т.д.;
при заборе материала: недостаточная асептика, неправильно подготовленная посуда для материала, гемолиз крови и т.д.;
при хранении материала: время, температура, стерильность, раздельное хранение различных образцов.
2. Аналитическая ошибка (лабораторная). Эта ошибка связана с ходом исследования биологического материала в лаборатории. Выделяют несколько видов такой ошибки.
Систематическая ошибка (точность) выражает разницу между полученной и действительной величинами. Источником систематической ошибки являются особенности метода или способы его реализации.
В процессе лабораторных исследований выявляют постоянно повторяющуюся неточность. Она может касаться каждого этапа процесса (производство идентификаторов, приготовление и определение стандарта) или может быть связана с лабораторным оборудованием.
Примером систематической ошибки метода может быть определение концентрации глюкозы по методу Хагедорна-Енсена. Этот метод базируется на редуцирующих свойствах глюкозы. Другие присутствующие в крови вещества, имеющие редуцирующие свойства, также принимают участие в реакции. Поэтому результат определения глюкозы этим методом будет завышенным.
Случайная ошибка (повторяемость) характеризует воспроизводимость результатов между параллельными пробами в данных условиях.
3. Ошибка интерпретации результата. Использование единичного результата лабораторного анализа при диагностике заболевания или мониторинге во время лечения могут быть источником многочисленных ошибок. Например, физиологические колебания некоторых показателей являются иногда довольно значительными и могут влиять на клиническую интерпретацию полученного результата. Эти изменения могут быть циклическими: часовые, дневные, сезонные. В таких случаях требуется проведение дополнительных исследований.
При интерпретации результата всегда необходимо учитывать влияние употребляемых лекарств. Существует два основных механизма такого влияния.
Первый механизм состоит во взаимодействии лекарств или их продуктов с исследуемым материалом и реактивами для анализа.
Второй механизм состоит в фармакологическом действии лекарств на организм пациента, которые приводит к изменениям биохимических показателей, не связанным с болезнью.
Таким образом, каждый этап биохимического исследования может быть источником ошибки. Устранение основных причин ошибок помогает свести их к минимуму и позволяет грамотно интерпретировать результаты анализов, а следовательно, правильно использовать полученную информацию для выявления, профилактики и лечения заболеваний.
Источник
Виды ошибок исследований
Клинико-химические, как и все количественные измерения, принципиально отягощены возможностью ошибок. Весь процесс клинического исследования можно разделить на 4 этапа: взятие пробы, хранение пробы, анализ, оценка и выдача результата. Ошибки, возникающие на разных этапах работы, бывают внелабораторного и внутрилабораторного характера.
Внелабораторные ошибки
Существенным источником внелабораторных ошибок является трудность учета времени последнего приема пищи больным. Поэтому следует унифицировать время взятия крови и применять для исследования кровь, взятую натощак. Эмоциональное состояние пациента, время суток, положение тела больного оказывают влияние на количественные и качественные показатели крови.
Все указанные выше факторы погрешностей связаны с состоянием больного. Но нельзя недооценивать и ряд других факторов, которые также отражаются на качестве результатов: техника взятия крови, используемые при этом инструменты, сосуды, в которых хранится кровь. Иглы, применяемые для взятия крови, должны иметь достаточно большой диаметр, чтобы не возникало повреждения эритроцитов. Посуда и инструменты для взятия крови не должны содержать следов моющих средств, должны быть сухими.
Весьма существенной причиной возникновения погрешностей анализа является нарушение условий хранения проб. Уже одно более длительное стояние сыворотки над эритроцитами может привести к изменению концентраций компонентов. Сыворотка должна быть отделена от кровяного сгустка не позднее двух часов после взятия крови.
Упомянутые источники погрешностей не поддаются качественному и количественному контролю, их в большинстве случаев не очень легко распознать, исключить погрешности можно только тщательной и кропотливой работой. Следует добиться стандартизованных условий, обязательных при взятии проб крови. Необходимо регулярное инструктирование персонала клиник и амбулаторий о правилах и условиях сбора и хранения материала для различных клинико-диагностических исследований.
Внутрилабораторные ошибки
Надежность результатов исследования при проведении анализов в лаборатории зависит от целого ряда факторов. Погрешность в аналитическом процессе — это внутрилабораторные ошибки, появление и предупреждение которых зависит только от работников лабораторий.
Результаты анализов в большой мере зависят от индивидуальных способностей лабораторного персонала, важным фактором является и качество применяемых измерительных инструментов. Существенным источником ошибок является приготовление стандартных растворов, который может иметь иную концентрацию, чем должна быть по расчету. Многочисленность применяемых методов, из которых большая часть уже устарела, также является частой причиной многих ненадежных результатов. Помочь этому может последовательное внедрение унифицированных методов.
Наиболее распространена следующая классификация ошибок. Различают три основных вида ошибок: грубые, случайные и систематические.
Грубая ошибка — это одиночное значение исследуемого компонента, выходящее за пределы установленного для данного компонента области (за допустимые пределы погрешности). Причиной грубых ошибок является недостаточная тщательность в работе.
Случайная ошибка — одиночное значение, не выходящее за пределы установленной для данного компонента области. Случайными называются неопределенные по величине и знаку ошибки, в появлении каждой из которых не наблюдается какой-либо закономерности. Эти ошибки происходят при любом аналитическом определении. Наличие их сказывается в том, что повторные определения того или иного компонента в данном образце, выполненные одним и тем же методом, дают как правило несколько различающиеся между собой результаты. Случайные ошибки практически невозможно исключить совсем, они могут возникать из-за негомогенности пробы материала, недостаточно высокого качества оборудования, чаще случайные ошибки вызываются субъективными факторами. Этот вид ошибок можно значительно ограничить после оценки их размера, величина ошибки (разброс данных) является мерилом воспроизводимости лабораторных результатов. Чем меньше величина случайных ошибок, тем лучше воспроизводимость исследований. Распространенным способом характеристики воспроизводимости результатов является величина среднеквадратического отклонения.
Для суждения о правильности анализа совпадение или расхождение результатов параллельных проб не имеет значения. В этом случае на первый план выступают систематические ошибки.
Систематическими ошибками называют погрешности, одинаковые по знаку, имеющие определенную причину, влияющие на результат либо в сторону увеличения, либо в сторону уменьшения его. Систематические ошибки можно обычно предусмотреть или же ввести соответствующие поправки (ошибки методического характера). Систематические ошибки повторяются при каждом измерении, так как они вызываются постоянными причинами, влияют они на всю серию определений. В качестве причин могут выступать ошибки приборов (автоматические анализаторы, фотоэлектроколориметры) и неправильное приготовление реактивов, индивидуальные особенности работника (ошибочное восприятие окраски пробы). С введением биохимических анализаторов и автоматических дозаторов число случайных ошибок (ошибок манипуляций) уменьшается, но возрастает необходимость контроля за появлением систематических ошибок и увеличивается необходимость в контрольных материалах для их обнаружения. Величина систематической ошибки характеризует правильность результатов анализа.
Общепринятым способом выявления случайных ошибок служит постановка анализа в двух и более параллельных пробах. Для исключения случайных ошибок большое значение может иметь последовательная регистрация анализов, проводимых повторно у одного и того же больного. Регистрация и сопоставление результатов с динамикой клинического течения заболеваний позволяет лаборатории своевременно обратить внимание на немотивированный «скачок» того или иного показателя, который мог быть обусловлен случайной ошибкой.
Обнаружение и предупреждение систематических ошибок составляет более сложную задачу. Необходимо тщательное подведение итогов ежедневной работы лаборатории. Если оказывается, что в один из дней все или большинство результатов по данной методике сдвинуты в какую либо сторону, это должно натолкнуть на мысль о систематической ошибке, необходима самая тесная связь с клиникой.
Возникновению ошибок необходимо противопоставить постоянное измерение точности выполнения анализов, надежность работы лаборатории, т.е. контроль качества исследований.
Источник
Источники ошибок при лабораторных исследованиях их классификация способы преодоления
Согласно данным ВОЗ, удельный вес лабораторных анализов составляет 75–80 % от общего числа диагностических исследований, выполняемых в медорганизациях. Служба значительно эволюционировала: если раньше лаборатория была придатком в поиске факторов риска, постановке диагноза, назначении лечения, то сегодня она является объединяющим механизмом на всех этапах взаимодействия врача и пациента. Централизация лабораторных исследований — мировая тенденция реформирования клинической лабдиагностики. Особое значение имеет преаналитический этап клинических лабораторных исследований.
Юлия Ярец, заведующая клинико-диагностической лабораторией РНПЦ радиационной медицины и экологии человека, кандидат мед. наук, доцент Важная составляющая
Основной целью централизации лабораторных исследований является повышение эффективности лечебно-диагностического процесса за счет расширения объема лабораторной, диагностически значимой информации, которая поступает лечащим врачам из централизованной лаборатории.
Согласно постановлению коллегии Минздрава от 25.07.2018 № 14.4 «О совершенствовании работы службы лабораторной диагностики», централизация лабораторий, направленная на увеличение доступности лабораторных исследований, определена основным стратегическим моментом развития службы клинической лабораторной диагностики страны.
Важнейшей составляющей централизации является процесс взаимодействия с внешним заказчиком (медучреждением) на преаналитическом этапе оказания лабораторных услуг. Преаналитический этап включает прием пациента врачом, назначение лабораторных исследований, заполнение бланка направления, получение пациентом инструкций об особенностях подготовки к сдаче анализов или сбору биологического материала, взятие проб, доставку материала в лабораторию.
При централизации для лаборатории существенно увеличивается число пунктов сбора проб биологического материала, значительно расширяется спектр заказываемых тестов, изменяется структура проб биологического материала, ритм и временной период их поступления в лабораторию.
Взаимодействие централизованной лаборатории с заказчиком на преаналитическом этапе предполагает обучение врачей, медсестер, курьеров, обеспечение их инструкциями по подготовке пациентов к лабораторным исследованиям, правилам взятия, сбора и подготовки проб к транспортировке, организацию логистики доставки. Порядок организации взятия проб биологического материала и доставки его в централизованную лабораторию является одним из важнейших моментов обеспечения правильного взаимодействия лаборатории и учреждения здравоохранения.
Централизация лабораторных исследований предусматривает особые требования к организации преаналитического этапа, строгое выполнение которых позволит обеспечить получение качественных результатов. Любые неточности на этапе назначения лабораторных исследований будут существенным образом снижать эффективность лечебно-диагностического процесса.
Большинство ошибок в процессе лабораторного анализа — от назначения теста до интерпретации результатов — происходит до того, как образец попал в лабораторию, т. е. вне прямого контроля лаборатории. По данным различных исследований, на преаналитический этап приходится от 46 % до 68 % всех лабораторных ошибок.
Наиболее частые ошибки преаналитического этапа:
- отсутствие образца или перечня назначенных исследований;
- ошибки идентификации образца (этикетка,сопроводительный документ);
- гемолиз in vitro (в пробирке);
- сгустки в образце крови/плазмы;
- неправильная пробирка/контейнер;
- недостаточное количество образца (объем пробы);
- неправильное соотношение кровь/антикоагулянт;
- недостаточное перемешивание образца после взятия;
- неадекватные условия хранения и транспортировки;
- неправильный режим центрифугирования (время/скорость).
Рекомендации
При определении приемлемости выявленных ошибок рекомендуется использовать целевые уровни индикаторов качества преаналитического этапа, установленные Международной федерацией клинической химии и лабораторной медицины (IFCC). Ошибки преаналитического этапа могут существенно исказить состав или свойства биологического материала и таким образом существенно снизить диагностическую ценность результата лабораторного исследования. Частота таких ошибок зависит от уровня технологической дисциплины в направляющей организации здравоохранения, качества администрирования этого этапа.
Основные причины большого количества ошибок:
- отсутствие стандартов качества выполнения процедур преаналитического этапа;
- неиспользование для взятия и сбора биоматериала одноразовых безопасных приспособлений по причине существующего ложного представления об их высокой стоимости;
- недостаточные знания и качество обучения среднего медперсонала правилам и технике выполнения процедур преаналитического этапа.
Прогресс лабораторных технологий, оснащение медицинской лаборатории современными автоматическими анализаторами позволили получать существенно более точные результаты анализов. Новые автоматические анализаторы весьма чувствительны к качеству исследуемого биоматериала, что предъявляет более высокие требования к условиям взятия, хранения и срокам доставки проб.
Согласно приказу Минздрава от 18.04.2019 № 466 «О совершенствовании деятельности службы лабораторной диагностики Республики Беларусь», обеспечение качества преаналитического этапа лабораторных исследований является зоной ответственности клинических специалистов. В стандарте СТБ ISO 15189-2015 «Медицинские лаборатории. Требования к качеству и компетенции» требуется установление индикаторов качества с целью мониторинга и оценки работы по всем критическим аспектам преаналитического этапа. Их внедрение в лабораторную практику и систематический сбор данных позволят обеспечить надежность результатов лабораторного тестирования.
Внутренний стандарт
Клинико-диагностическая лаборатория (КДЛ) РНПЦ РМиЭЧ является многопрофильной, с 2016 года выполняет централизованные исследования для взрослых и детей Новобелицкого и Советского районов Гомеля. Заказчиками являются 10 поликлиник. Исследования включают широкий спектр биохимических (специфических белков и метаболитов), иммунохимических (гормоны, онкомаркеры, витамины и др.), коагулологических (коагулограмма, агрегатограмма, факторы свертывания и антикоагулянты, D-димеры и др.) лабораторных тестов.
Разработан внутренний стандарт, который был включен в текст совместного приказа РНПЦ РМиЭЧ и ГУЗО Гомельского облисполкома (№ 117 и № 167 от 05.02.2019) «О централизации лабораторных исследований». Определена схема проведения централизованных лабораторных исследований.
Для обеспечения доступности для врачей-клиницистов информации о полном спектре выполняемых тестов сотрудниками лаборатории разработаны бланки направлений.
Для обеспечения контроля качества выполнения централизованных исследований лаборатория постоянно анализирует результаты применения основных индикаторов качества преаналитического этапа:
- ошибки идентификации и транскрипции тестов;
- несоответствие направления установленной форме;
- неверный тип, недостаточный объем образца;
- повреждение образца/направления в ходе транспортировки;
- образец, направление для образца не получены;
- сгусток в образце.
По результатам анализа, проведенного КДЛ РНПЦ РМиЭЧ, несоответствия в целом выявляются для 1,3 % доставленных образцов сыворотки/плазмы. Среди индикаторов с наибольшей частотой встречаются ошибки транскрипции тестов, составляющие 1 %:
- отсутствие отметок о необходимых тестах;
- нечеткий запрос на исследование;
- незаполненные/не полностью заполненные паспортные данные пациента (не обозначен пол, возраст, не указан диагноз, отсутствует печать врача).
Реже определяются ошибки идентификации пробы — нарушение маркировки, в т. ч. расхождения между нумерацией направления и пробы. В 0,34 % случаев пробы не доставлялись в лабораторию, в 0,3 % — для проб отсутствовали направления на исследования. Несмотря на то что выбраковка по причине гемолиза определена на этапе взятия крови и первичной пробоподготовки, в лабораторию в 0,31 % случаев доставляются гемолизированные образцы. В 0,5–1 % случаев в пробах сыворотки встречаются нити фибрина, сгустки, осадок эритроцитов. Регистрируются случаи доставки количества сыворотки, недостаточного для выполнения назначенных тестов. Такие несоответствия являлись результатом неполного соблюдения поликлиниками правил пробоподготовки: выдержки необходимого времени сворачивания крови, соблюдения режима центрифугирования крови и пипетирования сыворотки.
Для образцов сыворотки с выявленными ошибками транскрипции тестов лаборатория выясняет необходимую информацию по телефону, после чего образцы, как правило, принимаются в работу. Указанные действия позволили минимизировать потери образцов по причине нарушений правил преаналитики. Выбраковка с оформлением акта отказа в приеме биологического материала с объяснением причин проводится для гемолизированных образцов либо для случаев, когда доставляется только проба сыворотки без направления и наоборот. Пробы сыворотки со сгустками, эритроцитами подвергаются повторному центрифугированию, после чего выполняются исследования.
Источник