При транскрипции, так же как и при любом
матричном процессе происходят ошибки.
Их называют ошибки спаривания. Эти
ошибки происходят с частотой – одна
ошибка на 2 х 104включённых
нуклеотидов. Как мы отмечали при
репликации ошибки возникают намного
реже – одна на 1010 включений. При
ошибках спаривания в растущую нить
РНК включаются «не правильные»
основания. Это может
Терминатор
Инвертированные
последовательности

А
РНК-полимераза

Б
В
5’
Рис. 57. Терминация. Образование
«шпильки» на РНК при считывании
инвертированных повторов на матричной
нити ДНК. А – РНК-полимераза «подходит»
к области терминатора. У последнего
имеется инвертированный повтор. Б –
РНК-полимераза синтезировала РНК, в
которой имеется последовательности
комплементарные инвертированному
повтору на матричной нити ДНК. В –
нуклеотиды инвертированного повтора
на РНК сформировали связи, что привело
к образованию «шпильки». Транскрипция
прекратилась.
привести к изменению структуры кодирующего
нуклеотида. Если это касается рРНК или
тРНК то, как правило, такие «дефектные»
РНК перестают выполнять свои функции
– формирование рибосом и транспорт
аминокислот. Но это практически не
отражается на здоровье человека, т.к.
появление одной «дефектной» молекулы
РНК приходится на несколько тысяч
нормальных молекул, к тому же ошибочное
спаривание очень редкое явление. Более
неблагоприятный прогноз бывает связан
с появлением ошибки спаривания в иРНК
– молекуле несущей информацию об
аминокислотной последовательности
белка. В этом случае вероятность
реализации генетического дефекта в
фенотипический определяется характером
нуклеотида образованного при ошибке
спаривания. Хорошо если в результате
«вырожденности» третьего основания
триплета, новый кодон кодирует ту же
аминокислоту. Такая ошибка фенотипически
не проявляется. (см. раздел 3.1.). Подсчитано,
что в 67% смысл кодона не меняется при
замене нуклеотида в третьем положении
кодона. Хуже когда сформированный на
основании ошибки спаривания кодон
меняет смысл и начинает кодировать
другую аминокислоту. Это приводит к
появлению в белке новой аминокислоты,
которая может изменить функциональные
свойства белка и последний выключится
из клеточного метаболизма. Но и в этом
случае новая аминокислота может по
физико-химическим свойствам (например,
растворимости) быть сравнима с заменённой.
В этом случае фенотипические последствия
такой замены менее опасны.
Но в целом необходимо отметить, что
ошибки спаривания на уровне транскрипции
менее опасны, чем на уровне репликации.
Транскрипцию могут ингибировать
различные соединения. Так например,
очень опасный шляпочный гриб бледная
поганка содержит токсин альфа-аманитин.
Три характерных признака этого гриба
необходимо помнить – бледный цвет,
«юбочка» на ножке и булавовидное
утолщение в нижней части ножки.
Этот токсин прочно связывается с
РНК-полимеразой IIу
эукариот, которая транскрибирует иРНК.
В результате блокируется транскрипция
многих генов.
Другой токсин – актиномицин Д, является
антибиотиком и прочно связывается с
ГЦ-богатыми участками ДНК. А поскольку
такими участками обогащены рРНК и
терминаторы многих генов, то эти структуры
страдают в первую очередь.
Как мы отмечали ранее некоторые
противоопухолевые препараты, например
дауномицин и некоторые другие содержат
в своей молекуле плоскую циклическую
структуру, которая встраивается
(интеркалируется) между парами оснований.
Это ведёт к локальному изменению
структуры ДНК, в результате чего ферменты
транскрипции прекращают свою работу.
Некоторые алкилирующие вещества –
тиофосфамид и др. модифицируют основания
в ДНК путём присоединениё к ним алкильных
группировок. Если ферменты транскрипции
встречают такие основания, их работа
прекращается.
Ингибитор ДНК-топоизомеразы – новобиоцин,
вмешиваясь в работу фермента прекращая
деспирализацию ДНК, а следовательно и
синтез РНК.
Антибиотик рифампицин – ингибируют
только РНК-полимеразу бактерий,
препятствуя инициации транскрипции.
Применяют его при различных заболевания,
так как он не действуют на ядерную
РНК-полимеразу соматических клеток
человека. К сожалению, в последнее время
обнаружено действие рифампицина на
РНК-полимеразу митохондрий, где также
осуществляется транскрипция митохондральных
РНК. Это является ещё одним подтверждением
версии о том, что митохондрии являются
потомками вирусных или иных
субмикроскопических структур внедрившихся
в клетки эукариот и адаптировавшихся
к их метаболизму так, что стали его
полноправными участниками.
МЗ. Транскрипция –первый этап экспрессии
генов и заключается в синтезе РНК на
одной нити ДНК ферментом ДНК-зависимой
РНК-полимеразой (РНК-полимеразой). Состоит
из трёх этапов – инициации, элонгации
и терминации. Во время инициации
формируется инициаторный комплекс,
состоящий белка прикреплённого к
промотору, РНК-полимеразы и нескольких
факторов инициации. Одновременно
формируется транскрипционный «глазок».
Во время элонгации происходит наращивание
нити РНК в соответствии с комплементарными
нуклеотидами на матричной (антисмысловой)
цепочки ДНК. Сигналом терминации является
определённая последовательность
нуклеотидов в матричной цепочки ДНК.
При транскрипции чаще, чем при репликации
возникают ошибки при спаривании
нуклеотидов.
Соседние файлы в папке лекции по биологии
- #
- #
- #
- #
- #
- #
- #
Транскрипционные факторы не только регулируют работу генов, но могут обладать и другими, порой неожиданными и даже нежелательными функциями. В этой статье — рассказ о такой функции, когда транскрипционный фактор C/EBP крепко связывается с частично поврежденной ДНК и не позволяет системе репарации починить спрятанный под собой участок ДНК. А что он спрятал и почему — сейчас и расскажем!
Долгое время было принято считать, что самую важную роль в геноме, то есть в ДНК, играют только белок-кодирующие участки — гены, кодирующие последовательности белков. Которые, к слову, у человека занимают лишь 1–2% от длины генома [1], [2]. Остальную часть генома называли темной материей, или мусорной ДНК, — разумеется, ошибочно. Но сегодня научные исследования, посвященные некодирующим участкам ДНК и их функциональной роли, расцветают все ярче и ярче.
Действительно, некодирующая ДНК способна на многое.
Первое, о чем обычно вспоминают, — повторяющиеся последовательности [3]. Правда, полезных их функций нам известно маловато.
Затем — гены некодирующих РНК, которые самостоятельно или при участии белков выполняют различную работу в клетке [4]. Систематическим изучением таких РНК занимается, например, международный консорциум FANTOM6.
Но и помимо повторов и РНК-генов, некодирующие участки генома содержат много интересного. Например, в них находятся регуляторные элементы (промоторы и энхансеры), которые определяют активность генов — как кодирующих, так и не кодирующих белки, — в различных типах клеток и в разных условиях. Работают они за счет привлечения специальных белков — факторов транскрипции, — которые способны распознать в ДНК сравнительно короткие, но характерные, паттерны (мотивы). В пределах регуляторных районов генома эти факторы связывают подходящие участки ДНК, а затем образуют белок-белковые комплексы друг с другом и с компонентами молекулярной машины, осуществляющей транскрипцию генов, — то есть непосредственно синтез РНК. Именно участками посадки факторов транскрипции (так называемыми ДНК-сайтами связывания, или просто сайтами связывания) мы, то есть наш дружный коллектив соавторов теперь уже опубликованной статьи [5], занимаемся уже больше 10 лет. Кстати, о компьютерном предсказании сайтов связывания в масштабе полного генома (на основе нашей работы) можно прочитать в статье «Биомолекулы» «Мечту вызывали?» [6].
Участки ДНК, непосредственно взаимодействующие с факторами транскрипции в геноме человека, сравнительно коротки — 10–20 нуклеотидов. Сила взаимодействия фактора транскрипции с ДНК (и как следствие, активность зависимого от него гена) может существенно меняться даже при замене всего одного нуклеотида-«буквы» (например, это приводит к аллель-специфичному связыванию участков [7], различающихся между материнской и отцовской хромосомами). То есть даже однонуклеотидные мутации могут вызывать серьезные нарушения генной регуляции: влиять на судьбу клеток и осложнять течение заболеваний. В частности, такие мутации способны превращать стволовые клетки человека в опухолевые или приводить к болезням, связанным с неправильной дифференцировкой клеток. Во многих опухолях часто находят специфичные мутации в промоторе гена теломеразы TERT [8]. Этот фермент необходим для репликации концов хромосом во время деления клеток. Логично, что в соматических клетках, которые не делятся, ген теломеразы находится в неактивном состоянии. Но если в промоторе этого гена происходят указанные выше специфичные мутации, то факторы транскрипции вновь начинают связываться с промотором, тем самым активируя ген теломеразы. Это позволяет клетке активно делиться, а эта способность, как мы знаем, — важное свойство опухолевых клеток [9].
Мутации, происходящие в соматических клетках (то есть во всех, кроме половых), называют соматическими. Обычно их изучают в опухолевых клетках, где часто затруднена работа систем репарации, а потому мутации накапливаются с высокой скоростью. На возникновение и частоту мутаций в популяции раковых клеток влияет сразу множество факторов: и отбор (как положительный, так и отрицательный), и активность процессов, напрямую вызывающих повреждения ДНК, и различная эффективность систем репарации. В общем, целый клубок, который достаточно сложно расплести, а результаты анализа, в итоге, сложно однозначно интерпретировать. Мы решили зайти с другой стороны и использовали опубликованные данные по мутагенезу соматических стволовых клеток взрослых и здоровых людей, где основной вклад в накопление мутаций вносят непосредственно мутационные процессы, без поломки репарационных систем и следов естественного отбора.
Для начала мы разделили мутации на группы, соответствующие известным мутационным процессам: например, вызванные влиянием активных форм кислорода или дезаминированием 5-метилцитозина. Затем мы наложили координаты мутаций на геномную карту всех известных участков связывания транскрипционных факторов. Оказалось, что как минимум треть мутаций расположена недалеко от участков связывания. Теперь имело смысл внимательно посмотреть на районы работы конкретных факторов транскрипции по отдельности.
Мы сопоставили паттерны в ДНК, узнаваемые определенными факторами транскрипции, с точным положением мутаций в пределах небольших «окошек» в геноме (не далее 50 нуклеотидов от мутации). Выяснилось, что мутации CpG-динуклеотидов вида [C>T]G, вызываемые дезаминированием 5-метилцитозина, неожиданно часто попадают точно в центр участков связывания белков C/EBP. Интересно, что этот эффект ранее обнаруживали для опухолевых клеток [10], но не смогли интерпретировать.
C/EPB: что за зверь?
Факторы транскрипции семейства C/EBP (CCAAT/enhancer-binding proteins) необходимы для нормальной дифференцировки различных типов клеток. Они активируют различные гены, взаимодействуя с их промоторами, а также могут взаимодействовать с белками клеточного цикла. Интересно, что белки этого семейства могут как подавлять переход соматических клеток в опухолевые, так и активировать его [11].
Чаще всего метилирование ДНК осуществляется по цитозину в динуклеотидах CpG. Это она из наиболее распространенных эпигенетических модификаций . Повышенная частота мутаций метилированных CpG-динуклеотидов за счет дезаминирования метилцитозина известна очень давно, но почему же участки связывания C/EBP мутируют еще в 2–4 раза чаще, чем ожидается? Могут ли транскрипционные факторы напрямую провоцировать дезаминирование цитозина в метилированных CpG в пределах своих сайтов? Эта гипотеза первой приходит в голову, но, сразу скажем, она слишком фантастическая. Ведь прочное связывание фактора транскрипции, наоборот, должно бы приводить к дополнительной защите ДНК от изменений.
Более обстоятельно с эпигенетикой вы можете познакомиться в одноименном спецпроекте «Биомолекулы», — в частности, в статье «Молекулы и эпигеном» [12].
Второй вариант, который мы рассматривали, был такой: может ли быть так, что транскрипционный фактор не дает возможности репарационной машине добраться до неспаренного основания и починить его? Например, из-за избыточно крепкой связи с таким «несовершенным» участком двойной спирали. Эта возможность — прочное связывание конкретных вариантов сайтов с неспаренными основаниями — недавно была показана для многих транскрипционных факторов. Но не для белков C/EBP, что тоже наталкивало на сомнения в «работоспособности» предположения, но мы решили его проверить.
Беспечный ездок
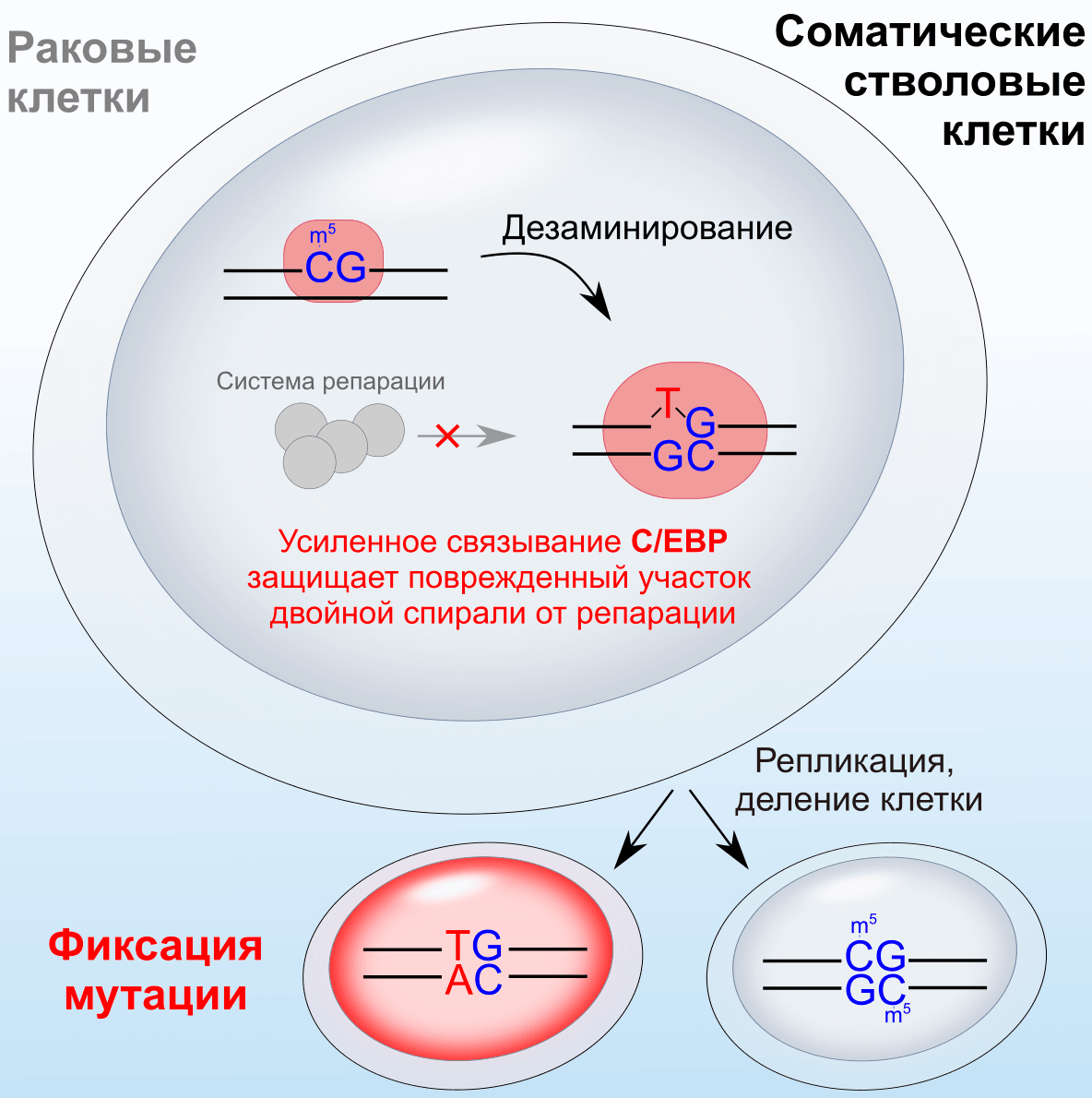
Один из широкого изучаемых белков семейства C/EBP — C/EBPβ. Для него в банке данных PDB доступны закристаллизованные комплексы ДНК-связывающего домена с каноническим (наилучшим возможным) ДНК-сайтом. За помощью мы обратились к коллегам (а они, забегая вперед в нашем рассказе, стали соавторами этой статьи), которые на основе этих структур провели моделирование комплекса белка C/EBPβ с различными вариантами участков ДНК. В одном случае, вместо цитозина в CpG-пару по одной из цепей вводили тимин, оставляя гуанин на противоположной цепи (тем самым образуя неверно спаренные нуклеотиды; см. рис. 1 для подробностей). А в другом случае вместе с заменой цитозина на тимин поменяли еще и гуанин на аденин, чтобы была сформирована каноническая пара — такая, какой она будет в одной из дочерних клеток после репликации ДНК и деления клетки с мутацией. И вот что интересно: наибольшее сродство к белку было у фрагмента ДНК, содержащего неканоническое спаривание нуклеотидов!
Рисунок 1. Предложенная модель фиксации мутаций ([C>T]G), вызванных дезаминированием метилцитозина и повышенным сродством белков C/EBP к «поврежденным» сайтам в ДНК. А сродство белка к ДНК повышается благодаря одноцепочечной замене в центре сайта связывания.
Выходит, идея о том, что транскрипционный фактор мешает системе репарации, действительно может работать! Но расскажем о структурном моделировании до конца: если ранжировать по силе связи, то после этой последовательности (с неидеальной спиралью и наибольшим сродством к C/EBPβ-белку) шла каноническая форма, и только затем — та, где цитозин мутировал в тимин, а гуанин — в аденин. То есть и каноничный комплекс со спариванием G·C, и комплекс после мутации и репликации с A·T, не могут тягаться по силе с тем, как тяготеет транскрипционный фактор к неспаренным основаниям G·T. Здесь интересно, что мутировавший сайт c TG-, вместо CG-динуклеотида, существенно хуже связывает C/EBP. То есть в отсутствие давления естественного отбора геном мог бы постепенно лишиться всех сильных сайтов C/EBP. Судя по всему, сайты действительно постепенно теряются, но отбор «старается» сохранить полноценный сайт хотя бы на одной из парных хромосом, ведь гетерозиготные сайты C/EBP часто являются именно парой из CG- и TG-сайтов, как мы видели в работе [5].
Такая неожиданная согласованность результатов, пришедших и из статистического анализа мутаций, и из структурного моделирования, мотивировала нас проверить, как поведет себя комплекс в реальном мире. Ведь хотелось не только моделей, но и эксперимента.
Поэтому мы провели анализ электрофоретической подвижности в геле методом EMSA для точно таких же фрагментов ДНК, ровно как и в структурном моделировании (канонический участок связывания, фрагмент с неверно спаренными G·T-нуклеотидами и фрагмент «после репликации» со спариванием A·T). И эксперимент EMSA подтвердил высокое сродство комплекса именно с вариантом с неверно спаренными нуклеотидами.
В этом эксперименте мы «следили» за радиоактивно меченым фрагментом ДНК, в котором участок связывания был каноническим. Когда формируется комплекс с белком, подвижность ДНК в геле замедляется. Чтобы узнать о том, как мутации влияют на связывание C/EBPβ, и как при этом изменяется подвижность в геле, была устроена конкуренция между радиоактивно меченым каноническим (видимым) и немеченными (невидимыми) участками связывания ДНК. То есть мы устроили соревнование между каноническим участком связывания, фрагментом с неверно спаренными G·T-нуклеотидами и фрагментом «после репликации» со спариванием A·T. И что же получилось? А получилось, что победил в соревновании фрагмент ДНК с мутацией [C>T]pG! Он вытеснял белок C/EBPβ из комплекса даже лучше, чем канонический участок связывания!
Таким образом, мы сначала предсказали, а затем подтвердили — C/EBP чрезвычайно прочно связывает сайты ДНК после спонтанного дезаминирования метилцитозина в тимин. И, соответственно, система репарации не может добраться до замены и восстановить правильное их спаривание. А модель закрепления мутаций и общее описание проделанной работы можно изучить на рис. 1 и 2.
Рисунок 2. Краткое визуальное описание результата исследования
Печальная и поучительная история о конкуренции в науке
И, в завершение, короткая и немного грустная история о первенстве и конкуренции в науке. Год назад мы опубликовали препринт этой работы [13] на сервере bioRxiv. Затем статья некоторое время искала «свой журнал», а потом довольно долго находилась на рецензии в Cell Reports. И вроде бы, по меркам нашей науки, не так много времени ушло на рецензирование и ответы редактора, но пару месяцев назад, уже на финальной стадии, мы неожиданно обнаружили — вышла аналогичная работа в журнале Nucleic Acids Research, в которой показано примерно то же самое [14]. Причем на сложный путь от первоначальной подачи статьи в журнал до итоговой публикации авторам потребовалось всего лишь полтора месяца!
Совпадение? В научном мире в популярной теме, можно сказать, находящейся «на передовой», это не редкость. Может быть, авторы прочитали, но почему-то не стали цитировать наш прошлогодний препринт? Может быть, статью опубликовали так быстро, потому что один из авторов еще и редактор этого журнала? Можем ли мы вообще называть себя «первооткрывателями» интересного феномена? Ведь до нас успели опубликовать практически идентичные результаты, а наша статья все еще находилась на рассмотрении. К счастью, после связи с редакцией Cell Reports процесс публикации нашей статьи ускорился, и вот, 8 июня 2021 года, и наша статья [5], наконец, вышла.
Стоит ли возмущаться такой ситуацией, стоит ли винить рецензентов, которые незлонамеренно затягивали рецензирование? Является ли опубликованный в открытом доступе препринт гарантией научного первенства? Мы не знаем ответов на эти вопросы, но сама история может быть любопытной для тех, кому интересны разные грани работы ученых в современном мире, даже разочаровывающие. Но в науке, как и везде, где есть конкуренция, такие истории всегда будут случаться, и самое главное — не переживать и продолжать копать что-нибудь интересное.
Авторы выражают благодарность Марине Фридман и Алле Федоровой за помощь в работе над текстом.
- Геном человека: полезная книга, или глянцевый журнал?;
- Сколько сора в нашей ДНК;
- Повтор, еще повтор!;
- Обо всех РНК на свете, больших и малых;
- Anna S. Ershova, Irina A. Eliseeva, Oleg S. Nikonov, Alla D. Fedorova, Ilya E. Vorontsov, et. al.. (2021). Enhanced C/EBP binding to G·T mismatches facilitates fixation of CpG mutations in cancer and adult stem cells. Cell Reports. 35, 109221;
- Мечту вызывали?;
- Мухина В. (2021). Аллели регуляторных областей ДНК повлияли на поведение транскрипционных факторов. N+1;
- Rebecca C Hennessey, Kevin M Brown. (2021). Cancer regulatory variation. Current Opinion in Genetics & Development. 66, 41-49;
- François Hafezi, Danielle Perez Bercoff. (2020). The Solo Play of TERT Promoter Mutations. Cells. 9, 749;
- Collin Melton, Jason A Reuter, Damek V Spacek, Michael Snyder. (2015). Recurrent somatic mutations in regulatory regions of human cancer genomes. Nat Genet. 47, 710-716;
- Manlio Tolomeo, Stefania Grimaudo. (2020). The “Janus” Role of C/EBPs Family Members in Cancer Progression. IJMS. 21, 4308;
- Молекулы и эпигеном ;
- Ershova A.S., Eliseeva I.A., Nikonov O.S., Fedorova A.D. et al. (2020). Enhanced C/EBPs binding to C>T mismatches facilitates fixation of CpG mutations. bioRxiv;
- Jie Yang, John R Horton, Kadir C Akdemir, Jia Li, Yun Huang, et. al.. (2021). Preferential CEBP binding to T:G mismatches and increased C-to-T human somatic mutations. Nucleic Acids Research. 49, 5084-5094.
Очень важно отметить, что процесс репликации протекает со значительно более высокой степенью точности, чем процессы транскрипции и трансляции. Частые ошибки в репликации подвергли бы большому риску сохранность видов [c.908]
Обнаруженные при трансляции ошибки исправляются с помощью корректировочных операторов или путем замены отдельных участков программы. После этого программа вновь транслируется в итоге получают программу в коде машины. [c.44]
Большинство ошибок программирования, связанных с нарушением синтаксиса языка, выявляется на этапе трансляции и информация о них выдается в виде диагностических сообщений. Определенные трудности могут возникнуть при выявлении механических ошибок — пропуск символов, неправильная запись операций, т. е. ошибок, которые не воспринимаются как синтаксические, но которые наверняка приведут к неверному результату. К таким ошибкам нужно быть внимательным их проявление может поколебать уверенность разработчика, например, в правильности выбора метода. [c.42]
События, влияющие на транскрипцию и трансляцию. Могут происходить ошибки как на уровне транскрипции, так и на уровне трансляции. [c.42]
Задание может быть разделено на шаги задания, которые выполняются последовательно, причем выполнение последующего шага может зависеть от результата предыдущего. Например, если задание состоит из двух шагов — трансляции и редактирования, т. е. подготовки к выполнению, то редактирование может быть осуществлено лишь после успешного завершения трансляции, а следовательно, при отсутствии ошибок в исходной программе. При обнаружении ошибки на одном из шагов задания выполнение последнего прекращается и все последующие шаги игнорируются. В конечном итоге это задание снимается, о чем выдается сообщение оператору, и операционная система переходит к выполнению следующего задания. Очевидно, если программы или действия независимы друг от друга, то их целесообраз- [c.195]
Во время трансляции производится анализ исходной программы с целью обнаружения синтаксических ошибок, которые могут быть допущены при ее написании или перфорации. Информация об ошибках может быть выдана на печать с указанием оператора исходной программы, в котором допущена ошибка. Исправление программ производится с помощью специальных операторов (стр. 157), которые вводятся в машину с перфоленты перед повторным вводом исходной программы. [c.474]
Полный текст транслируемой программы или любой отдельной ее части, оформленной в виде подпрограммы, вводится Системой с перфоленты в машину только один раз, после чего он заносится на отладочную ленту, откуда считывается по мере необходимости. Если в транслируемой программе обнаружены ошибки, Система, указав на них оператору, может но соответствующей директиве начать или продолжить работу с другой программой. Подготовив необходимые исправления и соответствующую директиву, оператор может по запросу Системой директивы ввести исправления в машину и продолжить трансляцию этой программы. [c.475]
Диагностическая информация об ошибках во входной программе. Транслятор выявляет все синтаксические и многие семантические ошибки. Некоторые типы ошибок могут быть вызваны особенностями трансляции программы, хотя с точки зрения эталонного уровня они отсутствуют. Например, использование обращений к процедурам раньше их описания. Это обстоятельство особенно важно в том случае, если в процедуре производится обращение к другой процедуре, описанной ниже в программе. [c.478]
Спонтанные генные мутации определяются ошибками при репликации ДНК, возникающими вследствие теплового движе-иия атомов и молекул. Очевидно, что ошибки транскрипции и трансляции не наследуются. [c.283]
Как отмечает Везе, существенны не столько ошибки в трансляции, сколько биологическая значимость этих ошибок [121]. Безе предполагает, что код примитивной клетки был весьма неоднозначен, различал не отдельные аминокислоты, но их функциональные или нефункциональные группы. В дальнейшем код совершенствовался таким образом, чтобы свести ошибки при трансляции и их влияние к минимуму. Имеется и ряд других спекулятивных соображений (см. [5,7]). Крик подверг эти гипотезы критике, отметив невозможность их экспериментальной Проверки [122]. Сегодня установлены важные особенности кода, [c.594]
Спонтанные генные мутации определяются ошибками, возникающими вследствие теплового движения атомов и молекул при редупликации ДНК. Очевидно, что ошибки при транскрипции и трансляции не наследуются. [c.600]
Из всех рассмотренных результатов, по-видимому, вытекает, что специфическое взаимодействие между ттг-РНК и s-PHK, которое можно назвать трансляцией на уровне кода, предшествует собственно образованию пептидной связи и не зависит от этого последнего. Поэтому многие случаи включения неправильных аминокислот следует, вероятно, объяснить ошибками именно на этом уровне. [c.529]
Вообще говоря, неупорядоченность этого типа может носить как статистический, так и динамический характер. В первом случае речь идет об ошибках упаковки пачек колонок, возникающих из-за смещения колонок на половину трансляции в упорядоченной структуре. Во втором случае [c.85]
Написать и отладить программу на языке верхнего уровня значительно проще, так как он близок к естественному языку, на котором оформляет решение своих задач инженер. Но такую программу надо перевести на язык ЭВМ. Написанная программа в символах этого языка переносится на машинный носитель (перфокарту) и вводится в ЭВМ. Программа автоматически переводится (транслируется) на язык машины. Перевод программы осуществляется самой вычислительной машиной. Для перевода используется специальная программа-транслятор. Это достаточно сложная программа, поэтому набор трансляторов в ЭВМ обычно ограничен. Трансляторы входят в состав операционных систем (ОС и ДОС). При трансляции ЭВМ выявляет некоторые (обычно простейшие) ошибки программиста. [c.386]
Это позволяет начать трансляцию с другого гена-гена лизиса. Инициирующий кодон этого гена лежит впереди по ходу трансляции. Таким образом, терминация трансляции, связанная со сдвигом рамки считывания, необходима для последующего взаимодействия рибосомы с инициирующим кодоном гена, ответственного за лизис. Поэтому редко происходящие ошибки считывания на самом деле могут являться важным компонентом естественного процесса трансляции. [c.101]
Является. ли процесс помехоустойчивым, иными словами, сколь существенную роль играют мутации и возможные ошибки в трансляции и репродукции [c.31]
Таким образом, ошибки трансляции, усиливающиеся при некоторых внешних воздействиях, характерны как для прокариот, так и для эукариот и могут быть причиной модификационных изменений — фенокопии нормы. [c.448]
На специфическом подавлении отдельных стадий биосинтеза белка основано действие ряда антибиотиков (разд. 2.3.5). Так, актиномицин интер-коляцией и рифамицин селективным подавлением РНК-полимеразы нарушают процесс транскрипции. Хлорамфеникол нарушает трансляцию, блокируя реакцию переноса пептидила в рибосоме. Стрептомицин ассоциирует с 30 8-субъединицей рибосомы и ведет к ошибкам в переносе, а очень похожий на аминоацильный конец тРНК пуромицин вызывает преждевременный обрыв синтезируемой цепи. [c.398]
В процессе трансляции возможны ошибки в специфичности аминоацил-тРНК-синтетаз, которые присоединяют другие аминокислоты. Присутствие орнитина в некоторых арабиногалакто-протеинах может обусловливаться явлением именно этого типа. Кроме того, ошибочное аминоацилирование наблюдалось как результат структурных видоизменений аминоацил-тРНК-синтетаз или транспортных РНК [53]. [c.42]
Противотуберкулезные и антибактериальные антибиотики, в частности стрептомицин и неомицин, действуют на белоксинтезирующий аппарат чувствительных к ним штаммов бактерий. Было высказано предположение, что эти антибиотики обусловливают ошибки в трансляции мРНК, приводящие к нарушению соответствия между кодонами и включаемыми аминокислотами например, кодон УУУ вместо фенилаланина начинает кодировать лейцин, в результате чего образуется аномальный белок, что приводит к гибели бактерий. [c.542]
Бесцв. призмы. 340 (разл.). Раств-сть р. шел. 0,06 Н2О о.п.р. ЕЮН, эф., кисл. Аналог урацила. Включается в РНК, но не в ДНК. Вызывает ошибки при трансляции мРНК в белок. [c.224]
Хотя механизм трансляции отличается высокой точностью, вероятность ошибки в целом выше, чем в случае синтеза молекул ДНК и РНК. Наиболее уязвимый этап — узнавание с помощью фермента аминокислоты соответствующей молекулой тРНК. По имеющимся данным, частота возникновения ошибок на этом этапе порядка 10″ , что и определяет, возможно, уровень точности процесса синтеза белка в целом. Однако, как и в случае синтеза РНК, ошибки в процессе трансляции, приводящие к синтезу измененной молекулы белка, не воспроизводятся, если они не закодированы исходно в генетическом материале. [c.143]
Идентификация антикодона в тРНК проведена весьма убедительными экспериментами. Получены мутанты, содержаш,ие мутационную ошибку в самом антикодоне определенной тРНК. Затем путем полного химич. анализа цепи тРНК показано, какой именно нуклеотид оказался замененным. Здесь и находился антикодон. Связь кодон — антикодон осуществляется тремя нуклеотидами, а не длинной цепочкой. Поэтому возможность ошибок, или уровень шумов , в процессе трансляции (так называют синтез белка) выше, чем при редупликации ДНК или транскрипции РНК. Вероятность ошибки при наборе белковой цепи достигает 10 (вместо 10 при матричном синтезе дезоксирибонуклеиновой кислоты). [c.196]
Супрессия. При исследовании реверсии к дикому типу (т. е. возврата к прототрофности) в различных системах было показано, что в действительности повторная мутация происходит не в месте первичной мутации, а в другом участке хромосомы. В результате этой так называемой супрессорной мутации также наблюдается реверсия. Некоторые случаи такой псевдореверсии можно объяснить исходя из уже рассмотренных нами представлений. Возвратимся к фиг. 160 (вариант 4) и к обсуждению вопроса об ошибках в трансляции, вызванных мутациями со сдвигом рамки (стр. 491). Посмотрим, что произойдет, если вблизи первичной делеции нуклеотида возникнет вторая делеция (или вблизи первичной вставки нуклеотида возникнет вторая вставка) Легко видеть, что последовательность, возникающая после выпадения второго нуклеотида, например у +1, остается все еще дефектной [c.495]
Мутации в четырех кластерах непосредственно влияют на активность белка-цитохрома Ь. Все мутанты такого рода синтезируют нормальную мРНК. Мутации проявляются на уровне трансляции и выражаются в считывании матрицы с ошибками типа миссенс или нонсенс . Ни одна из таких мутаций не комплементирует какую-либо другую в том же или другом кластере. По этому критерию все они находятся в одном и том же гене. Кластеры соответствуют некоторым экзонам, а именно box 4 = Bl, box 8 = ВЗ, box 1 = В4, box 6 = В6 (рис. 20.22). В двух других экзонах мутации не обнаружены, возможно вследствие их малых размеров (В2 = = 14п.н., В5=51 H.H.). Рассмотренные группы мутаций проявляют в точности такие же свойства, какие можно ожидать от прерывистых генов. Фактически это един- [c.258]
Точность процесса репликации зависит от тех же причин, которые мы уже обсуждали при рассмотрении процесса трансляции. Она определяется специфичностью спаривания оснований. Ожидаемая при этом частота встречаемости ошибок находится в пределах от 10 » до 10 на реплицируемую пару оснований. Действительная частота ошибок в клетках Е. oli или при репликации ДНК фага Т4 колеблется в пределах от 10 до 10 на реплицируемую пару оснований. (Это соответствует приблизительно одной ошибке на 1000 репликационных циклов [c.414]
Феномен старения и смерти живого организма предопределен биологически и обеспечивает общее эволюционное развитие живой природы. В соответствии с законом естественного отбора в ходе эволюции не только расширяются метаболические (трофические) связи живых систем с окружающей средой, но и увеличивается информационное содержание этих связей. Информационное обеспечение в свою очередь повышает надежность функционирования каждого живого организма и его соответствие окружающей среде на данном этапе эволюции (Шмальгаузен, 1961). Таким образом, изменчивость, вариабельность, накопление новых биологических свойств позволяют живым системам приспосабливаться к изменениям окружающей среды, однако трансляция этих изменений в последующие поколения строго Офаничена консерватизмом генетического аппарата. Старение организма определяется понижением информационной надежности генетического аппарата живых клеток в результате накопления ошибок при репликации ДНК и транскрипции генетической информации, что в свою очередь приводит к ошибкам при синтезе и процессинге полипептидов и белков (Бриллюэн, 1966 Сьяксте, Будылин, 1992). Стратегия биологической эволюции заключается в том, что организм, в котором накопление молекулярных дефектов генетического аппарата достигло критического уровня, изымается из популяции. Иными словами, наряду с этапами зачатия, роста и развития организма старение является эндогенно обусловленным, т. е. естественным, терминальным этапом. Оно начинается периодом стабилизации жизненных функций, угасанием репродуктивного потенциала, постепенным замедлением метаболизма и завершается периодом снижения активности и отмиранием отдельных клеточных систем и тканей. Отказ одних систем организма, как пра- [c.159]
Одно из проявлений соответствия между нуклеотидами и белковыми (аминокислотными) структурами следует усматривать в супрессии бессмысленных мутаций у бактерий. Механизм супрессии состоит в нивелировке мутаций, приводящих к вклиниванию бессмысленного кодона в структурный ген. В результате мутаций тРНК-адаптор, содержащий антикодон с бессмысленным триплетом, начинает транспортировать нужную аминокислоту в нужное место при синтезе белка. Казалось бы ошибка в= адаптере исправляется на уровне адаптора же. Но на пути трансляции аминокислоты имеется специфический фермент тРНК-синтетаза—именно в этом месте, видимо, работает механизм непосредственной связи между нуклеотидной и аминокислотной последовательностью . [c.58]
При проверке, так же как и при обучении программ, необходимо уделять самое пристальное внимание формированию выборок сайтов и несайтов. Для обучения программ и получения чисел, характеризующих качество распознавания, необходимо выбирать правильное соотношение сайтов и несайтов. Что означает ошибка 37%, полученная в работе Голованова Действительно ли взяв 100 белок-кодирующих последовательностей и применив к ним программу распознавания RBS, мы у 37 из них получим неправильное место инициации трансляции [c.151]
From Wikipedia, the free encyclopedia
Genetic incompatibility describes the process by which mating yields offspring that are nonviable, prone to disease, or genetically defective in some way. In nature, animals can ill afford to devote costly resources for little or no reward, ergo, mating strategies have evolved to allow females to choose or otherwise determine mates which are more likely to result in viable offspring.
Polyandry, for instance, when a female mates with two or more males during a period of sexual receptivity, reduces the chance that a singular mate is genetically incompatible. Exactly how females determine compatible genes prior to mating is not completely understood, but various mechanisms have been proposed, such as pheromones and male appearance and/or courtship behavior.
It is also surmised that sexual selection can continue after copulation, the so called ‘cryptic female choice’, so named because it takes place within the body and cannot be directly observed. In this scenario, incompatible male sperm can be rejected by the female.
Genetic incompatibility can be engineered by scientists in order to control pests such as mosquitos and fruit flies.
Infertility[edit]
Introduced to the scientific community in the early 1990s, the concept of cryptic female choice is complicated and offers a new explanation for infertility.[1] Non-additive genetic effects have been thought of to be the main reason for reproductive isolation between species.[2] More recent studies have concluded that in comparison to additive genetic effects, non-additive genetic effects have a more important role in fertility and embryo survival.[2][3][4][5][6] As a result, some scientists have concluded that rather than the genes of the female alone or the genes of the male alone being the reason for the pair to be infertile, it is a result of the relationship and compatibility of their genes.[2] Thus, some male genotypes may have a higher success rate of fertilization with some female genotypes rather than others.[2]
Certain alleles being paired together can lead to complete reproductive failure/incompatibility as a result of differential compatibility between different variants.[2] Another contributing factor to incompatibility is based on the surface carbohydrates of the gametes.[2] Multiple studies have shown that the physical contact between the sperm and the egg can cause a chemical reaction in the female.[2] This reaction occurs when the egg comes in contact with non-compatible surface glycans and can impact the sperm’s potential for fertilization by causing structural changes in the sperm’s surface glycans.[2]
Fruit Flies[edit]
There are numerous other factors that can likewise contribute to the incompatibility of male and female haplotypes within an embryo.[7] For example, certain male Drosophila melanogaster (Fruit Flies) carry a drive allele that on average results in them producing 50% less viable sperm than their counterparts who are not heterozygous for the allele.[7] Not only are offspring of heterozygous males less genetically competitive, if both the male and female are heterozygous, their offspring will be either inviable or infertile[7]
Rose Bitterlings[edit]
One example of how indirect non additive genes impact fertility comes from a team of researchers who investigated how female Rhodeus Ocellatus (Rose Bitterlings) employ mate choice and the role of the MHC gene in that decision.[3] After allowing females and males to mate, they collected DNA from all the adult bitterlings as well as their offspring.[3] The data showed that females were more likely to choose males whose MHC gene was dissimilar to theirs.[3] The offspring that came from a pair who had dissimilar MHC genes had higher survival rates.[3] Although these researchers did not test this theory, they speculated that perhaps during the male’s courtship, he dissipates odor cues from the MHC gene that assist the female in her decision-making process[3]
Mice[edit]
DDK is a lethal phenotype in Mus Domesticus (house mice) that leads to developmental abnormalities and eventually deterioration of the embryo when females with the phenotype mate with males who carry other inbred strains.[8] Scientists have discovered that expression of this incompatibility within the embryo depends on the paternal allele of the DDK syndrome.[8] If the paternal allele is compatible, meaning the male is not carrying an inbred strain (ex. DDK female x non-DDK male), the embryo will survive.[8] However if the male carries the incompatible allele, the embryo will not survive.[8]
Sympatric Color Morphs[edit]
Genetic color polymorphisms are genetically defined color forms between animals of the same species.[9] For the most part, color morphs within a population can interbreed without any issues. However, evidence shows that in certain cases, the viability of interbred color morph offspring is drastically lower than those that present the same color.[9] While coloration is the most pronounced exhibition of a certain phenotype as individuals can be easily and quickly differentiated to the human eye, there are other factors that may be affected but not as easily identified.[10]
Gouldian Finches[edit]
A group of researchers investigated how the survival rates of offspring of Erythrura Gouldiae (Gouldian finch) are impacted when the mating pair have genes for different colors.[9] They bred both pure and mixed pairs of the finches (in this species the gene for producing a red-headed finch is dominant to the one that produces a black headed finch).[9] After incubation, eggs that were produced from mixed pairs were 34.3% less likely to hatch compared to those that were produced from pure pairs.[9] The mixed-pair offspring that did survive the incubation stage were still at a disadvantage, being burdened with a 32.1% increase in mortality between the time that they hatched and 60 days after (during which time they were still in the care of parents).[9] Even after becoming independent, the offspring mortality of mixed pairs was still higher. Specifically the rate of mortality of daughters from mixed-genotypes was much higher.[9]
Female Polyandry and Genetic Incompatibility[edit]
Polyandry is a mating pattern that is identified in species when a female mates with two or more males during a period of sexual receptivity.[11] Females may engage in this behavior in the event that their singular mate is a genetically incompatible match.[12] If that were to be the case, she would lose the chance to become pregnant during that season and not be able to try again until the next mating window.[12]
Creating offspring requires the female to allocate a large portion of her resources to both the formation of the embryo.[7] Partaking in polyandry allows her to ensure that the offspring that she will be providing for is going to be viable, and not be a waste of her time, energy, and resources.[7]
Another experiment was done with Gouldian finches, during which researchers wanted to determine the effect of compatibility and incompatibility on the relationship between socially monogamous pairs of finches.[13] They discovered that by participating in «extra-pair» mating relationships, the females were able to more accurately target compatible genes, thus increasing the amount of viable offspring that they produce.[13] Researchers paired females with both compatible and incompatible males as their social partner. However, they also made available both compatible and incompatible males as the extra-pair partner.[13] The data collected revealed that 77.5% of the females mated outside of their pairs. If their extra-pair was compatible (unlike their social partner), the female experienced a 38.9% increase in offspring survival.[13] Although females are unable to tell the difference between compatible and incompatible partners, by participating in polyandry, their likelihood of yielding more and healthier offspring is increased.[13]
Selfish Genetic Elements[edit]
Selfish genetic elements are genes that will use various methods to ensure that they are transferred on to new generations.[14] Selfish elements have the potential to create genetic incompatibilities because their effects frequently depend on interactions with the host genotype and according to whether selfish elements are present in both parents.[15] There has been some debate over whether these selfish genetic elements can actually influence the post-copulatory sperm selection that some females go through in order to determine the best (most compatible) match for her genes.[14]
Mice, carry a particular type of selfish genetic element known as a segregation distorter.[16] This specific classification is able to establish themselves in over 50% of offspring after the meiosis period.[16] Specific to mice, the distorter that they can carry is known as the t-complex.[17] This specific allele is recessive lethal, meaning that it can have a serious effect on the fitness of offspring as well and is most likely deadly.[17] After multiple experiments, it was found that both males and females will avoid mating with those of the opposite sex who are heterozygous for the allele but showed a strong preference for those that were not carriers of the allele.[17] If they were to mate with a heterozygous partner, it could potentially lead to half of their offspring dying as a result of the lethal allele[17]
Engineered Genetic Incompatibility[18][edit]
Engineered Genetic Incompatibility (EGI) is a technique that is being developed to manufacture incompatibility between species in order to aid in population suppression.[18] Mimicking the Sterile Insect Technique, by introducing EGI males into a population, a sex-sorting incompatible male system is generated.[18] Males that have been genetically modified are able to compete for the attention of females at the same level as those that have not been modified.[18] Because the EGI males are equal rivals to their wild counterparts, they are able to use the female’s time and energy reproducing but only to create non-viable offspring.[18]
A team of researchers from the University of Minnesota were successful in genetically engineering a population of fruit flies that would not be able to generate viable progeny when mating with wild-types specifically.[18] The researchers manufactured flies that would express a dCas9-based programmable transcription activator or PTA.[18] By this method, the promoter of any gene could be affected.[18] When the EGI flies mate with each other, they are able to avoid the negative effects the PTA generates because they were also given the gene for a mutation that could combat the overexpression of the gene.[18] Their offspring would go on to carry the same incompatibilities to the next generation, furthering the impact on the population.[18] However, the offspring that are produced by hybrid pairs (one EGI and one wild type) have a heterozygous pair of both the PTA and resistance genes and do not survive long after hatching, if they ever do as a result of the PTA’s disabling effect on the gene promoter.[18]
Mosquitoes[edit]
A great deal of research has gone into trying to use this technology as a tool in order to try and control the spread of diseases that are carried by mosquitoes such as Dengue, Zika, and Chikungunya.[19] Because of the successful research done on fruit flies, a team of researchers was able to manipulate some aspects of the experiment and effectively control a simulated population of Aedes aegypti (mosquitoes).[19] For their experiment, they used female lethality meaning that the engineered female mosquitoes will not survive the initial stages of their lives.[19] The researchers titled this new approach the Self-Sorting Incompatible Male System (SSIMS).[19] They observed an increase in population suppression as they increased the number of SSIMS mosquitoes released because the offspring conceived from the SSIMS males were inviable.[19] After this success, a new strategy was modeled, Field-Amplified Male Sterility System (FAMSS).[19] This led to an even bigger impact on population control as the offspring were viable but sterile.[19]
References[edit]
- ^ Løvlie, Hanne (2016). Cryptic Female Choice. Jonathan B. Losos. [New York]: Oxford Bibliographies. ISBN 978-0-19-994172-8. OCLC 892340929.
- ^ a b c d e f g h Kekäläinen, Jukka (2021-11-18). «Genetic incompatibility of the reproductive partners: an evolutionary perspective on infertility». Human Reproduction. 36 (12): 3028–3035. doi:10.1093/humrep/deab221. ISSN 0268-1161. PMC 8600657. PMID 34580729.
- ^ a b c d e f Agbali, Muna; Reichard, Martin; Bryjová, Anna; Bryja, Josef; Smith, Carl (June 2010). «Mate Choice for Nonadditive Genetic Benefits Correlate with MHC Dissimilarity in the Rose Bitterling (Rhodeus Ocellatus)». Evolution. 64 (6): 1683–1696. doi:10.1111/j.1558-5646.2010.00961.x. PMID 20148959. S2CID 27918567.
- ^ Palucci, Valentina; Schaeffer, Lawrence R.; Miglior, Filippo; Osborne, Vern (April 2007). «Non-additive genetic effects for fertility traits in Canadian Holstein cattle (Open Access publication )». Genetics Selection Evolution. 39 (2): 181–193. doi:10.1186/1297-9686-39-2-181. ISSN 1297-9686. PMC 2682836. PMID 17306200. S2CID 13790033.
- ^ Dziminski, Martin A.; Roberts, J. Dale; Simmons, Leigh W. (April 2008). «Fitness Consequences of Parental Compatibility in the Frogcrinia Georgiana». Evolution. 62 (4): 879–886. doi:10.1111/j.1558-5646.2008.00328.x. PMID 18208566. S2CID 27154568.
- ^ Rodríguez-Muñoz, Rolando; Tregenza, Tom (2009-04-23). «Genetic compatibility and hatching success in the sea lamprey ( Petromyzon marinus )». Biology Letters. 5 (2): 286–288. doi:10.1098/rsbl.2008.0650. ISSN 1744-9561. PMC 2665819. PMID 19049954.
- ^ a b c d e Zeh, Jeanne A.; Zeh, David W. (1997-01-22). «The evolution of polyandry II: post–copulatory defenses against genetic incompatibility». Proceedings of the Royal Society of London. Series B: Biological Sciences. 264 (1378): 69–75. doi:10.1098/rspb.1997.0010. ISSN 0962-8452. PMC 1688229.
- ^ a b c d Ideraabdullah, Folami Y.; Kim, Kuikwon; Pomp, Daniel; Moran, Jennifer L.; Beier, David; Villena, Fernando Pardo-Manuel de (2007-02-01). «Rescue of the Mouse DDK Syndrome by Parent-of-Origin-Dependent Modifiers1». Biology of Reproduction. 76 (2): 286–293. doi:10.1095/biolreprod.106.056739. ISSN 0006-3363. PMID 17050856. S2CID 11489468.
- ^ a b c d e f g Pryke, Sarah R.; Griffith, Simon C. (March 2009). «Postzygotic Genetic Incompatibility Between Sympatric Color Morphs». Evolution. 63 (3): 793–798. doi:10.1111/j.1558-5646.2008.00584.x. PMID 19087185. S2CID 24657339.
- ^ McLean, Claire A.; Stuart-Fox, Devi (2014-02-14). «Geographic variation in animal colour polymorphisms and its role in speciation». Biological Reviews. 89 (4): 860–873. doi:10.1111/brv.12083. ISSN 1464-7931. PMID 24528520. S2CID 4664660.
- ^ Hoogland, John L.; Trott, Regina; Keller, Stephen R. (2019-02-19). «Polyandry and Polygyny in a Social Rodent: An Integrative Perspective Based on Social Organization, Copulations, and Genetics». Frontiers in Ecology and Evolution. 7: 3. doi:10.3389/fevo.2019.00003. ISSN 2296-701X.
- ^ a b «The evolution of polyandry I: intragenomic conflict and genetic incompatibility». Proceedings of the Royal Society of London. Series B: Biological Sciences. 263 (1377): 1711–1717. 1996-12-22. doi:10.1098/rspb.1996.0250. ISSN 0962-8452. S2CID 84171994.
- ^ a b c d e Pryke, Sarah R.; Rollins, Lee A.; Griffith, Simon C. (2010-08-20). «Females Use Multiple Mating and Genetically Loaded Sperm Competition to Target Compatible Genes». Science. 329 (5994): 964–967. Bibcode:2010Sci…329..964P. doi:10.1126/science.1192407. ISSN 0036-8075. PMID 20724639. S2CID 12282609.
- ^ a b Price, Tom A. R.; Wedell, Nina (September 2008). «Selfish genetic elements and sexual selection: their impact on male fertility». Genetica. 134 (1): 99–111. doi:10.1007/s10709-008-9253-y. ISSN 0016-6707. PMID 18327647. S2CID 20975113.
- ^ Tregenza, T.; Wedell, N. (August 2000). «Genetic compatibility, mate choice and patterns of parentage: Invited Review». Molecular Ecology. 9 (8): 1013–1027. doi:10.1046/j.1365-294x.2000.00964.x. PMID 10964221. S2CID 9367945.
- ^ a b Price, Tom A. R.; Wedell, Nina (2008-03-08). «Selfish genetic elements and sexual selection: their impact on male fertility». Genetica. 134 (1): 99–111. doi:10.1007/s10709-008-9253-y. ISSN 0016-6707. PMID 18327647. S2CID 20975113.
- ^ a b c d Lenington, Sarah (1983). «Social preferences for partners carrying ‘good genes’ in wild house mice». Animal Behaviour. 31 (2): 325–333. doi:10.1016/S0003-3472(83)80050-5. S2CID 54273728 – via ScienceDirect.
- ^ a b c d e f g h i j k Upadhyay, Ambuj; Feltman, Nathan R; Sychla, Adam; Janzen, Anna; Das, Siba R; Maselko, Maciej; Smanski, Michael (2022-02-02). Messer, Philipp W; Weigel, Detlef; Yan, Ying (eds.). «Genetically engineered insects with sex-selection and genetic incompatibility enable population suppression». eLife. 11: e71230. doi:10.7554/eLife.71230. ISSN 2050-084X. PMC 8860436. PMID 35108195.
- ^ a b c d e f g Maselko, Maciej; Heinsch, Stephen; Das, Siba; Smanski, Michael J. (2018-05-07). «Genetic incompatibility combined with female-lethality is effective and robust in simulations of Aedes aegypti population control». bioRxiv: 316406. doi:10.1101/316406. S2CID 90799017.







![Предложенная модель фиксации мутаций ([C>T]G) Предложенная модель фиксации мутаций ([C>T]G)](https://biomolecula.ru/img/content/3187/3187-01.model-fiksacii-mutacij.png)