Возможно, вы только что узнали о своей беременности. Врач говорит, что скоро нужно будет пройти какой-то скрининг, а еще давным-давно вы читали статью о том, что на свете есть особые дети, и вот именно сейчас в сердце закралась тревога.
А может быть, вы уже сделали скрининг, и врач говорит, что у малыша, скорее всего, синдром Дауна. Что делать дальше? Какие еще исследования пройти?
Или же вы только планируете беременность и вас растревожили сообщениями о том, что есть такая «болезнь» – синдром Дауна. Поневоле возникают мысли: вдруг и у нас будет такой малыш?
Кто бы вы ни были, эта статья – для вас. Надеемся, она поможет вам сориентироваться в вопросах пренатальной диагностики и даст понимание, куда двигаться дальше.
Что такое пренатальная диагностика?
Во время беременности каждой женщине предлагают пройти комплексную диагностику. С ее помощью можно определить, могут ли у будущего малыша быть проблемы со здоровьем или генетические отклонения, в том числе синдром Дауна. Эти исследования дают информацию, которая помогает семье принять взвешенное решение о судьбе своего будущего ребенка.
Очень важно вовремя встать на учет по беременности, для того чтобы не пропустить важные исследования, так как все они проводятся на определенных сроках беременности.
Выделяют два типа пренатальной диагностики: скрининговую и подтверждающую. Само слово «скрининг» переводится как «просеивание», потому что это массовое исследование – все беременные женщины могут пройти его бесплатно, в рамках финансирования ОМС.
Скрининговые тесты помогают определить группу будущих мам, у которых есть высокая вероятность развития хромосомных отклонений у плода, – в этом случае назначаются дополнительные подтверждающие исследования.
Одновременно с этим анализы выявляют те беременности, для которых повышенной угрозы нет. В этом случае их результаты отрицательные, и необходимости в дополнительных исследованиях (кроме скринингов, проводимых 1 раз в триместр) – нет.
Первый скрининг при беременности проводят между 11 и 13 неделями. Исследование включает в себя УЗИ и анализ крови.
Второй скрининг при беременности проводят на сроке 18–20 недель. В него включены те же два этапа – УЗИ и анализ крови, однако последний сдается только в том случае, если женщина не делала первый скрининг.
Третий скрининг при беременности проводят на 30–34 неделе. Основа третьего скрининга – УЗИ, основная цель которого – определить стратегию родов.
По результатам скринингов в случае необходимости могут назначаться дополнительные исследования.
Как понять, возможен ли у будущего ребенка синдром Дауна?
Есть несколько методов пренатальной диагностики, которые могут дать ответ, родится малыш с синдромом Дауна или нет. Они бывают неинвазивными и инвазивными. Анализ крови и УЗИ – это неинвазивные методы, т.к. их проведение не требует особого вмешательства в организм матери. Никакого риска для будущего ребенка они не несут. Но их результатам далеко не всегда можно доверять. Если вам по результатам УЗИ сказали, что у малыша возможен синдром Дауна, – не воспринимайте это как окончательный диагноз. Это лишь сигнал, что желательно провести дополнительные инвазивные исследования. Их смысл – получить для исследования клетки самого плода. Врачи-генетики, рассматривая эти клетки в микроскоп, смогут увидеть в них лишнюю хромосому и тогда уже поставить точный диагноз – есть ли у будущего малыша синдром Дауна или нет.
Как получить клетки эмбриона? Они есть в околоплодных водах. Чтобы их исследовать, нужно сделать прокол оболочки околоплодного пузыря. Такая медицинская процедура, к сожалению, бывает довольно дискомфортна для мамы, а кроме того, она может быть опасной и для малыша, ведь в результате ее проведения возрастает вероятность выкидыша.
Дальше мы подробнее ответим на вопросы о каждом методе пренатальной диагностики.
Первый скрининг предлагают пройти в первом триместре, в период с 11 до 13 недель и 6 дней беременности. У будущей мамы берут кровь для анализа (измеряют уровень определенных биологических маркеров) и делают УЗИ (оценивают анатомию плода). В результате врач может понять, есть ли у плода риск каких-то болезней и отклонений, в том числе синдрома Дауна. Обратите внимание: результат первого скрининга – это только оценка рисков, а ни в коем случае не окончательный диагноз! Это лишь первое предположение, что, возможно, что-то может пойти не так. По статистике, ребенок с синдромом Дауна появляется лишь в одном из 150 случаев «беременности высокого риска».
Что оценивает врач в процессе первого скрининга, чтобы не пропустить синдром Дауна?
Врач во время УЗИ визуально оценивает некоторые показатели: в первую очередь, есть ли у плода увеличенная воротниковая зона и гипоплазия (укороченность, недоразвитие) носовой кости. Подробнее про определение толщины воротникового пространства вы можете прочитать по ссылке. Если коротко, то на задней поверхности шеи любого малыша есть скопление подкожной жидкости, но у многих детей с синдромом Дауна ее количество сильно увеличено. Понятно, что этот показатель не может говорить о точном диагнозе «синдром Дауна», – он лишь помогает определить, нужно ли назначить более глубокие исследования. Что касается гипоплазии носовой кости (уменьшение размеров косточки носа), то этот показатель тоже выступает лишь сигналом о возможных проблемах.
Кроме УЗИ плода, скрининг включает в себя и анализ крови матери. Врач обращает внимание на значения белков материнской сыворотки. При этом он также учитывает такие факторы, как возраст матери (чем она старше, тем риск больше) и историю беременностей (если таковые уже были). Результаты УЗИ и анализа крови врач анализирует комплексно – так результаты будут точнее.
Если первый скрининг показал, что повышен риск рождения ребенка с синдромом Дауна, – что делать дальше?
Может оказаться, что беременная женщина по результатам скрининга попадает в так называемую группу риска. Это сигнал, что желательно провести дальнейшие исследования, чтобы точно установить диагноз. На данном этапе важно, какую позицию занимает консультирующий врач. Именно он должен объяснить женщине и ее семье ситуацию и риски, правильно сориентировать и помочь выбрать тактику дальнейших действий. Кто-то из беременных этой группы предпочитает оставить всё как есть, не проводить дополнительных исследований и ожидать рождения малыша, а кто-то соглашается на инвазивную процедуру.
Что такое инвазивная процедура? Это опасно?
Инвазивная процедура – это метод, позволяющий с высокой степенью точности ответить на вопрос: есть у малыша синдром Дауна или нет. Инвазивные тесты позволяют практически в 99 % случаев выявить хромосомные аномалии у плода.
Существует несколько инвазивных процедур, из которых самые распространенные – биопсия ворсин хориона и амниоцентез. Подробно о каждом из них вы можете прочитать по ссылкам ниже, а здесь мы обозначим их сущность вкратце.
Для проведения амниоцентеза
из матки женщины берется для исследования образец околоплодной жидкости. Зачем это делается? Дело в том, что в этой жидкости находятся клетки эмбриона, т.е. врач через микроскоп видит клетки будущего ребенка и может определить, есть ли в них дополнительная хромосома, которая говорит о наличии синдрома Дауна.
Биопсия ворсин хориона (БВХ) – это анализ эмбриональной ткани (хориона). Процедура похожа на амниоцентез и тоже предполагает прокол стенки матки. В отличие от амниоцентеза, биопсию хориона проводят несколько раньше по срокам.
Решение о том, делать ли инвазивные исследования, могут принять только сами будущие родители, т.к. эти процедуры сопровождаются риском выкидыша.
Что такое «тест на синдром Дауна по крови»?
Так иногда называют новый метод неинвазивного пренатального тестирования (НИПТ). Это анализ крови матери, но не тот, который делают при обычном скрининге. Дело в том, что в конце XX века ученые обнаружили, что в крови беременной женщины обязательно есть фрагменты ДНК ее будущего ребенка – так называемая внеклеточная ДНК. Суть НИПТа проста – эта внеклеточная ДНК выделяется из крови матери и затем «читается» с помощью сложных компьютерных программ. Этот метод тестирования сейчас активно развивается, и у него очень высокая точность – до 99 % и даже более.
Если этот анализ дает такой точный результат, почему его не делают всем?
Основная причина в том, что НИПТ – довольно дорогостоящий анализ. Кроме того, одни лаборатории имеют необходимое для него оборудование (сложное и очень дорогостоящее), а другие выступают как посредники, которые отсылают биоматериал для проведения анализа за границу.
К тому же НИПТ является скрининговым методом, и в случае выявления высокого риска хромосомной патологии у плода всё равно потребуется проведение уточняющей инвазивной диагностики.
Если я сделаю НИПТ, какие возможны варианты действий дальше?
Ситуации возможны разные.
Если у женщины отрицательный результат по НИПТ, это говорит о низких рисках с вероятностью до 97 %, но не исключает синдром Дауна полностью. Поскольку НИПТ – это неинвазивный тест (для него не используют ни биопсию ворсин хориона, ни амниоцентез), то, несмотря на статистическую точность, следует иметь в виду, что это всё-таки расчетные, а не объективные данные.
Если по предыдущим неинвазивным скринингам риск наличия синдрома Дауна выше, чем 1:100, НИПТ не показан, поскольку в этом случае также не стоит надеяться на расчетные данные. Велика вероятность ошибки: возможны не только ложноотрицательные, но и ложноположительные результаты, что повлечет за собой опасность избавиться от здорового плода.
Еще одна сложность при использовании НИПТ заключается в следующем: если тест проводился после 12 недель беременности и показывает положительный результат – это не будет считаться основанием для перывания беременности. В таком случае для принятия решения всё-таки придется сделать инвазивный тест.
С другой стороны, результаты НИПТ достаточно точные, и в тех случаях, когда предыдущие неинвазивные тесты показывают риск ниже, чем 1:100, женщина для собственного спокойствия может пройти это исследование.
Можно ли отказаться от всех скринингов и исследований?
Да, можно. Будущей маме лишь рекомендуется сделать скрининг – обязанности у нее нет. Врач не может заставить вас делать те или иные тесты и анализы.
Зачем мне заранее знать, будет ли у моего ребенка синдром Дауна или нет?
Все решения, которые касаются судьбы будущего ребенка, принимают исключительно его родители. Ни ваш гинеколог, ни генетик, ни родственники – никто не имеет права склонять вас к тому или иному решению. Но при этом семье очень важно владеть достоверной информацией. Зная, что у будущего малыша, вероятнее всего, синдром Дауна, родители могут поступить по-разному. Кто-то принимает решение о прерывании беременности. Кто-то старается узнать побольше о синдроме, чтобы подготовиться к рождению особого малыша и сразу оказать ему необходимую помощь – и медицинскую, если это нужно, и педагогическую. Кто-то ищет и находит семьи, в которых растут дети с синдромом Дауна, знакомится с ними, общается, заранее занимается поиском профильных организаций и получает там полезную информацию и поддержку. В таком случае рождение особого ребенка не становится для семьи неожиданным ударом, а остается запланированным и таким же долгожданным событием, как рождение любого ребенка, – просто уже с учетом его особенности. Знание о диагнозе малыша помогает будущим родителям перестать жить в пассивной тревоге и отчаянии: ведь когда ты знаешь, чего ожидать, ты можешь начать действовать.
У кого больше всего вероятность родить ребенка с синдромом Дауна?
Ребенок с синдромом Дауна может появиться в любой семье. В данном случае не имеют значения ни социальное положение родителей, ни их состояние здоровья, ни экономическое благополучие, ни национальность, ни место проживания, ни что-либо другое. Единственное, что считается фактором риска для рождения ребенка с синдромом Дауна, – это возраст матери. Чем старше женщина, тем выше вероятность, что у нее может появиться ребенок с синдромом Дауна. Поэтому женщинам старше 35 лет настоятельно рекомендуется проходить пренатальную диагностику. Впрочем, не стоит забывать о том, что дети с синдромом Дауна рождаются у женщин любого возраста.
Можно ли еще до наступления беременности узнать, есть ли вероятность генетических нарушений у будущего ребенка?
В подавляющем большинстве случаев синдром Дауна – это генетическая случайность, но бывают случаи сбалансированной хромосомной перестройки (транслокация, инверсия) или мозаичный кариотип (наличие клеточного клона с аномальным числом хромосом) у кого-либо из родителей. Их поможет обнаружить генетическое исследование
Врач предлагает мне сделать аборт, потому что у малыша синдром Дауна. Он прав?
Еще раз подчеркнем, что решение о судьбе будущего ребенка могут принимать только его родители. Никто не имеет права склонять вас к прерыванию беременности. Единственная задача специалистов, будь то гинеколог, генетик, психолог и т.д., – дать вам достоверную информацию: рассказать обо всех возможных трудностях и радостях жизни с особым ребенком и показать возможные пути действий – ведь у родителей всегда есть возможность выбора. К сожалению, до сих пор многие врачи не могут избежать оценочных высказываний; в ряде случаев они могут навязывать будущим родителям свою точку зрения, рассказывая о жизни с ребенком с синдромом Дауна только с негативной стороны. Знайте, что такие врачи нарушают этические нормы своей профессии! В целом ряде российских регионов существуют официальные протоколы сообщения диагноза ребенка будущим родителям, которые запрещают врачам склонять семью к проведению аборта и оказывать психологическое давление. Если врач убеждает вас сделать аборт, а вы этому сопротивляетесь, – смело меняйте врача!
Мы надеемся, что эта краткая информация в форме ответов на самые частые вопросы, которые задают родители, поможет вам разобраться в тех тестах, которые вы уже прошли или только собираетесь пройти.
Содержание
«Такие множественные пороки — это, скорее всего, генетика»
Что такое синдром Эдвардса
Как диагностируют синдром Эдвардса
«Моя дочь растет, развивается, она личность и просто ребенок»
Программа перинатальной паллиативной помощи
Светлая печаль, как сама жизнь
У меня еще есть время, чтобы быть рядом
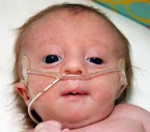
Информация про синдром Эдвардса на всех медицинских ресурсах неутешительная: прогноз для этого заболевания весьма неблагоприятный. Но вопреки заложенному сценарию развития заболевания многие дети при хорошем уходе и паллиативной помощи живут довольно долго. Лекарство от заболевания одно — родительская любовь.
«Такие множественные пороки — это, скорее всего, генетика»
Саше Глаголевой поставили синдром Эдвардса вскоре после рождения. Сейчас Саше 8 лет, хотя во всех медицинских справочниках написано, что девочки с таким заболеванием живут в среднем около 10 месяцев, а мальчики от двух до трех месяцев, и вообще около 90% детей с синдромом Эдвардса умирают в течение первого года жизни.
Саша родилась со множественными пороками развития, и врачи в реанимации сразу предположили генетическое заболевание.
Родители не могли поверить, ведь и сами они были здоровы, и у них уже был совершенно здоровый ребенок, но врачи объяснили, что дети с генетическими проблемами иногда появляются из-за спонтанной мутация в генах или хромосомах, а не только из-за наследственности.
На третий день генетический тест подтвердил предположение врачей — синдром Эдвардса.
Что такое синдром Эдвардса
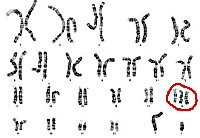
Синдром Эдвардса, или трисомияXтрисомияТрисомия означает вариант хромосомной мутации, при которой в клетках человека содержится не 46, а 47 хромосом. по 18-ой хромосоме — это генетическое заболевание, при котором ребенок наследует три восемнадцатых хромосомы вместо двух. Мутация происходит в результате нерасхождения 18-ой хромосомы во время деления клеток.
В описаниях заболевания сказано, что в 60% случаях из-за пороков, несовместимых с жизнью, дети с синдромом Эдвардса погибают внутриутробно. В группе трисомий только в трех случаях — при синдроме Эдвардса, синдроме Дауна (трисомия 21-ой хромосомы) и синдроме Патау (трисомия 13-ой хромосомы) возможно рождение живого ребенка и его дальнейшее, хоть и осложненное, развитие. При других вариантах добавочных хромосом патология несовместима с жизнью.
Распространенность синдрома Эдвардса в мире составляет один случай на 3 000-7 000 новорожденных, определенной зависимости от региона или расы нет. Чаще синдром встречается у девочек. Ребенок с трисомией 18-ой хромосомы может родиться у любой женщины, но считается, что риск усиливается с возрастом матери. А некоторые исследования показали, что в последние годы синдром Эдвардса имеет тенденцию к увеличению. Возможно, это связано с улучшением диагностики и с повышением возраста рожающих женщин.
Хотя основные симптомы заболевания описаны еще в начале XX века, первый полный обзор синдрома и его основной причины — появление лишней 18-ой хромосомы — был сделан только в 1960 году британским медицинским генетиком Джоном Эдвардсом, в честь которого и назвали эту патологию.
Заболевание сопровождается многочисленными нарушениями в развитии систем органов, но если лишняя 18-ая хромосома находится не в каждой клетке организма, что встречается у 5% людей с этой патологией и называется мозаицизмом, синдром Эдвардса может быть более легкой формы.
Как и другие заболевания с хромосомными мутациями, синдром Эдвардса неизлечим. В настоящее время лечение состоит, в основном, из паллиативной помощи.
Как диагностируют синдром Эдвардса
Заподозрить наличие синдрома Эдвардса можно на УЗИ плода и допплерографии по косвенным признакам: недоразвитию одной из пупочных артерий, многоводию, уменьшению размеров плаценты. Но ультразвуковое исследование может показать только характерные признаки патологии, оно не может подтвердить, что есть именно этот синдром.
Эпоха АлександрыЕвгений Глаголев, отец тяжелобольной девочки рассказывает о том, как изменилась жизнь его семьи, почему он решил сменить профессию и зачем родителям время от времени выезжать куда-то вдвоем
Вообще, для диагностики заболевания большое значение имеет совокупность факторов: результаты лабораторного скрининга, данные УЗИ, срок беременности и возраст матери. Если есть сразу несколько симптомов необходимо провести дополнительные инвазивные исследования — биопсию ворсин хориона (анализ клеток эмбриональной ткани), амниоцентез (взятие на анализ околоплодных вод) или кордоцентез (взятие анализа крови из пуповины). Полученный в ходе процедур материал плода отправляется на кариотипирование — анализ на выявление нарушений хромосомного набора.
У новорожденного ребенка для определения точной причины врожденных дефектов тоже должно быть проведено хромосомное исследование с помощью анализа крови.
«Моя дочь растет, развивается, она личность и просто ребенок»
Екатерина С., мама восьмилетней дочери с полной формой трисомии по 18-ой хромосоме считает, что и медики, и генетики очень мало знают о жизни и развитии детей с этим диагнозом.
После того, как ее дочери поставили синдром Эдвардса, Екатерина оказалась буквально в информационном вакууме, и все, что она прочитала о болезни, было очень пессимистичным относительно прогноза жизни таких детей. Она начала общаться с другими родителями детей с трисомией и решила объединить их в сообщество, в котором сейчас более 40 семей.
По ее мнению, данные в справочниках по генетике по этому заболеванию устарели — они написаны 20-30 лет назад, а ведь за это время медицина шагнула далеко вперед, и выхаживание детей с синдромом Эдвардса стало возможным. Она понимает, что вылечить синдром нереально, но уверена, что облегчить состояние ребенка можно.
Екатерина рассказывает, что в регистре их сообщества 79% детей с полной трисомией и 21% с мозаичной формой, их возраст — от года до 10 лет. Также она сообщила, что по данным исследований группы ученых во главе с американским профессором Робертом Мейером (Robert E Meyer), около 12,3% детей с трисомией по 18-ой хромосоме доживают до пяти лет.
Каждая секунда имеет значение и смыслИстория Ани и Славы Черепановых. Родителей, потерявших двоих детей
По мнению Екатерины, это свидетельствует о том, что несмотря на тяжесть состояния и высокую смертность, синдром Эдвардса некорректно рассматривать как летальное и несовместимое с жизнью заболевание: «Моя дочь растет, развивается, она личность и просто ребенок, хоть и не нормотипичный, но со своим характером и потребностями».
Программа перинатальной паллиативной помощи
Если диагноз трисомии поставлен до рождения ребенка, у родителей есть выбор — прервать беременность или родить неизлечимо больного ребенка. Семьи, которые считают прерывание беременности недопустимым, поддерживает Детский хоспис «Дом с маяком». Специалисты хосписа находятся рядом с родителями при родах и потом все время, пока паллиативный ребенок дома, сопровождают семью.
Хоспис обеспечивает такие семьи необходимым оборудованием, расходными материалами, лекарствами, специальным питанием, обучает родителей навыкам ухода за малышом. Кроме того, семью курируют врачи, психологи, социальные работники. Еще есть программа социальной передышки — можно оставить ребенка в стационаре на две недели в году, чтобы родители могли отдохнуть.
Первым ребенком, рожденным под опекой «Дома с маяком», была Маруся. Ее мама написала, что ей было очень сложно получить хоть какую-то информацию о том, какими рождаются дети с синдромом Эдвардса: «Я пересмотрела и перечитала терабайты историй западных семей с такими детьми, и они были очень светлыми, несмотря на весь мрак ситуации, я знала, что дети с синдромом Эдвардса бывают весьма крепкими, что совсем необязательно там будет страшный болевой синдром, судороги и асфиксия, что у них может быть короткая, но полная любви и заботы жизнь, однако как реализовать это в наших условиях, я не понимала. Результаты моих обследований говорили о том, что у Маруси были высокие шансы на благополучное рождение и хороший светлый промежуток».
Женщина обратилась в Детский хоспис. Потом она познакомилась с семьей Глаголевых, а Вероника Машкова рассказала ей, каким был ее сын Коля.
«Три месяца мы жили почти обычной жизнью. Маруся была очень славной, почти обычной девочкой. Мы начали гулять. Я строила планы лечения и реабилитации. Последний месяц был сложнее. За три дня произошло резкое ухудшение. Мне до сих пор сложно дается осознание того, что же все-таки произошло. Я не хотела верить, что наше время вышло, и здесь очень четко сработал врач «Дома с маяком»».
Маленький добрый гном…О мальчике, который прожил три месяца и изменил всех вокруг
Светлая печаль, как сама жизнь
Сын Вероники Машковой прожил три месяца. Коля тоже родился с синдромом Эдвардса. Вероника часто делится опытом переживания потери на встречах с родителями, потерявшими детей.
«Каждый раз возникает какое-то движение. Сначала приходит родитель, который вообще не может говорить, просто давится слезами, которые даже не текут. А со временем это живой, разговорчивый, общительный человек — да, плачущий, но это добрые слезы. Да, это потеря, это боль, ее стоит выплакать».
Вероника рассказывает, что сначала на этих встречах обычно просто молча слушала всех, кто пришел. Могла сказать что-то в конце, что отозвалось. Но часто поражалась: «Я не раз видела это чудо: родители приходили раздавленными, а поднимались распрямившимися и окрыленными, супруги приходили порознь, а уходили за руку…
Да, у нас тоже бывает печаль, но она светлая, как сама жизнь. Это ведь радость, что наши дети у нас были, и мы смогли это время вместе с ними прожить. А меня очень сильно поддерживало то, что все было не напрасно, что жизнь Коли и его история нужны людям».
У меня еще есть время, чтобы быть рядом
«Нам очень много помогал и помогает фонд «Вера», — рассказывает Екатерина Глаголева, — На момент, когда мы выписались первый раз из больницы, мы не знали ничего — что и как с Сашей делать. Фонд нас очень быстро «подхватил» — приехала медсестра, привезли кислородный концентратор, отсос, расходные материалы, нас научили, куда что вставлять. И стало не так страшно. Чувствовалась настоящая поддержка. Особенно актуальная на фоне округляющихся глаз врачей, которые наблюдают Сашу в районной поликлинике. Хотя у нас очень хороший участковый педиатр, но она сама признает, что таких детишек на участке больше нет, и она не знает, что делать в той или иной ситуации».
«Только молока прибавилось, как Тата от нас ушла»Какой ошибки удалось избежать и почему сейчас — не стыдно
И все же, чтобы принять диагноз Саши, родителям понадобилось больше года. Евгений Глаголев признается: «Ты оказываешься в ситуации, когда вообще не знаешь, что делать». Он уверен, что важно показать — вот, есть такие люди, кто через это прошел и справился, и готов делиться опытом, советом, помощью.
«Хочется сказать другим родителям, что первое ощущение, что у тебя нет опыта и в тебе только страх, потом пройдет. Это неизбежно. Это просто отсутствие информации. Как только она появится, сразу станет легче… Важно не забывать о себе. А родители всегда забывают о себе, они героически ухаживают за ребенком, но заканчивается это одинаково: без себя ты теряешь себя. И быстро. А потом уходит ощущение жизни. Ты в вечном подвиге, но подвиг вечным быть не может».
Родители Саши говорят, что состояние девочки постоянно очень тяжелое, у нее случаются боли неврологического характера, которые не купируются обычными анальгетиками. Иногда приступ удается снять только при помощи морфина. Но врачи часто считают, что детям такие лекарства противопоказаны. И однажды из-за того, что долго не снимался болевой синдром, у девочки произошел регресс состояния, начались приступы эпилепсии.
Но ребенок все равно ребенок, и Глаголевы замечают у дочери много забавного: «Наша Сашенька по характеру — настоящая маленькая женщина и это видно во всем ее поведении, манерах. Она очень смешно закрывает рукой глаза, это выглядит как «я устала, все свободны». Если она чего-нибудь не хочет, вы от нее не добьетесь этого».
Евгений Глаголев не задается вопросом, сколько времени отведено Саше: «Мы думали об этом, но это гадание на кофейной гуще. Если Саша уйдет — значит, наша жизнь будет какой-то другой».
Он написал в своем блоге:
«Мне близка мысль, что у каждого на этой земле своя миссия. И когда она закончена, тогда человек умирает. Неважно, молодой ты или старый: если все что мог/нужно было сделать — сделано, значит «пора-пора». Саша много раз могла умереть. Но сегодня мы проводим нашу девятую осень вместе. В сентябре всей семьей пережили ковид. Когда он нагрянул в 2020 году, внутри пробежало: «Неужели?!». Ведь очевидно, что Саша со своими больными легкими не перенесет его. Но нет. Улыбаюсь в очередной раз. И не могу не думать про только Ее миссию. Значит вот так. И у меня еще есть время, чтобы быть рядом. И любить здесь».
Вам может быть интересно:




Перепечатка материала в сети интернет возможна только при наличии активной гиперссылки на оригинал материала на сайте pro-palliativ.ru
Материал подготовлен с использованием гранта Президента Российской Федерации, предоставленного Фондом президентских грантов.
Использовано стоковое изображение от Depositphotos.
Синдром Эдвардса
Синдром Эдвардса — хромосомное заболевание, обусловленное трисомией по 18-ой хромосоме и сопровождающееся множественными пороками развития. Для синдрома Эдвардса характерны своеобразные фенотипические признаки (долихоцефалическая форма черепа, микрофтальмия, недоразвитие ушных раковин, микроретрогнатия и др.), аномалии опорно-двигательной, сердечно-сосудистой, пищеварительной, мочеполовой системы, ЦНС. Синдром Эдвардса может быть диагностирован на этапе беременности (УЗИ-скрининг, инвазивная пренатальная диагностика) либо уже после рождения ребенка на основании внешних признаков и цитогенетического исследования. Дети с синдромом Эдвардса нуждаются в симптоматическом лечении и хорошем уходе.
Общие сведения
Синдром Эдвардса – количественная хромосомная аберрация, при которой имеет место частичная или полная трисомия по 18 аутосоме. Синдром получил название по имени генетика J. Edwards, подробно описавшего заболевание в 1960 г. и выделившего свыше 130 характерных для данной патологии симптоматических дефектов. Синдром Эдвардса – второе по распространенности хромосомное заболевание после синдрома Дауна; частота рождения детей с синдромом Эдвардса составляет 1:5000-7000. Примерно три четверти всех больных синдромом Эдвардса – девочки; предполагается, что большая часть беременностей плодом мужского пола заканчивается внутриутробной гибелью и самопроизвольным абортом.
Синдром Эдвардса
Причины синдрома Эдвардса
Развитие синдрома Эдвардса объясняется хромосомными нарушениями, происходящими на стадии гаметогенеза (овогенеза или сперматогенеза) либо дробления зиготы и приводящими к увеличению числа хромосом 18-й пары. В 80-90% случаев цитогенетические варианты синдрома Эдвардса представлены простой трисомией 18, реже — мозаичной формой или несбалансированными перестройками (транслокациями).
Причиной полной трисомии служит мейотическое нерасхождение хромосом. Практически во всех случаях лишняя хромосома является материнской по происхождению. Этот вариант синдрома Эдвардса является наиболее тяжелым по своим проявлениям и неблагоприятным в плане прогноза. Возникновение мозаицизма связано с нерасхождением хромосом на ранней стадии дробления зиготы. В этом случае лишнюю хромосому будут содержать не все клетки плода, а лишь их часть. Транслокация – присоединение части 18-ой хромосомы к другой паре может произойти как в процессе созревания гамет, так и после оплодотворения. При этом клетки организма содержат две гомологичные 18-е хромосомы и ее дополнительную часть, прикрепленную к другой хромосоме.
Как и в случае с синдромом Дауна, возраст матери является наиболее значимым риск-фактором рождения ребенка с синдромом Эдвардса. В редких случаях у родителей может выявляться носительство сбалансированной транслокации.
Симптомы синдрома Эдвардса
Во время беременности наблюдается многоводие, слабая активность плода, маленькая плацента, единственная пупочная артерия. Ребенок с синдромом Эдвардса рождается с низкой массой тела (около 2170 г) и пренатальной гипотрофией при доношенной или даже переношенной беременности. У части детей определяется состояние асфиксии при рождении.
У новорожденных с синдромом Эдвардса имеются характерные фенотипические признаки, позволяющие предположить данную хромосомную патологию. В первую очередь обращает на себя внимание долихоцефалическая форма черепа с преобладанием продольного размера над поперечным, низкий лоб, выступающий затылок, микрогнатия, маленький рот, микрофтальмия. У детей с синдромом Эдвардса часто встречаются расщелины верхней губы и нёба, эпикант, птоз, экзофтальм, косоглазие, короткая шея с избыточной кожной складкой. Типичные деформации ушных раковин включают маленькие мочки, отсутствие козелков, узкие слуховые проходы, низкое расположение ушей.
Внешний облик детей дополняется характерными для синдрома Эдвардса деформациями скелета — скрещенными пальцами кистей, укороченной грудиной, аномалиями ребер, врожденным вывихом бедра, косолапостью, «стопой-качалкой», синдактилией стоп и пр. У многих детей имеются гемангиомы и папилломы кожи.
При синдроме Эдвардса имеются множественные тяжелые аномалии со стороны практически всех систем организма. Врожденные пороки сердца могут быть представлены дефектами межжелудочковой и межпредсердной перегородок, коарктацией аорты, транспозицией магистральных сосудов, дисплазией клапанов, тетрадой Фалло, аномальным дренажом легочных вен, декстракардией и др. При синдроме Эдвардса может выявляться патология развития желудочно-кишечного тракта: диафрагмальные, пупочные и паховые грыжи, дивертикул Меккеля, трахеопищеводные свищи, пилоростеноз, атрезия подвздошной кишки и ануса. Наиболее частыми аномалиями мочеполовой системы у детей с синдромом Эдвардса служат подковообразная почка, гидронефроз, дивертикулы мочевого пузыря, гипоспадия и крипторхизм (у мальчиков), двурогая матка, внутриматочная перегородка и гипертрофия клитора (у девочек).
Пороки развития центральной нервной системы характеризуются наличием микроцефалии, менингомиелоцеле, гидроцефалии, аномалии Арнольда-Киари, кист арахноидального сплетения, гипоплазии мозжечка и мозолистого тела. У всех выживших детей с синдромом Эдвардса имеются интеллектуальные нарушения — олигофрения в степени глубокой имбецильности или идиотии.
Новорожденные с синдромом Эдвардса испытывают трудности с сосанием, глотанием и дыханием, из-за чего им требуется зондовое питание или длительная ИВЛ. Дети с синдромом Эдвардса, как правило, погибают на первом году жизни из-за тяжелых врожденных пороков развития и связанных с ними осложнений (сердечно-сосудистой и дыхательной недостаточности, пневмонии, кишечной непроходимости и т. д.).
Диагностика синдрома Эдвардса
Важнейшей задачей диагностики служит антенатальное выявление синдрома Эдвардса у плода, поскольку данная патология является медицинским показанием для искусственного прерывания беременности. Заподозрить наличие синдрома Эдвардса можно в процессе УЗИ плода и допплерографии маточно-плацентарного кровотока по косвенным признакам (множественным аномалиям развития плода, агенезии пупочной артерии, малой величине плаценты, многоводию и пр.).
Наибольшую диагностическую значимость имеет стандартный пренатальный скрининг, включающий анализ крови на сывороточные маркеры: βХГЧ и PAPP на 11-13 неделе беременности; βХГЧ, альфа-фетопротеин и свободный эстриола на 20-24 неделе гестации.
При оценке степени риска рождения ребенка с синдромом Эдвардса учитываются данные биохимического и ультразвукового скрининга, срок беременности, возраст и масса тела женщины. Беременным, попадающим в группу высокого риска, предлагается проведение инвазивной дородовой диагностики (биопсии хориона, амниоцентеза, кордоцентеза) с последующим кариотипированием плода.
В случае рождения живого ребенка с синдромом Эдвардса необходимо как можно более раннее всестороннее обследование, направленное на выявление тяжелых пороков развития. Новорожденный с синдромом Эдвардса должен быть осмотрен неонатологом, детским кардиологом, детским неврологом, детским хирургом, детским ортопедом, детским урологом и др. Наиболее важными диагностическими исследованиями, которые должны быть выполнены ребенку с синдромом Эдвардса в первые часы жизни, служат эхокардиография, УЗИ органов брюшной полости и УЗИ почек.
Лечение синдрома Эдвардса
Поскольку в большинстве случаев аномалии развития оказываются несовместимыми с жизнью, лечение детей с синдромом Эдвардса сводится к оказанию симптоматической помощи, направленной на поддержание физиологических функций, продление жизни и улучшение ее качества. Хирургическая коррекция врожденных пороков, как правило, является рискованной и неоправданной.
Поскольку дети с синдромом Эдвардса ослаблены и подвержены частой заболеваемости инфекциями мочевыводящих путей, средним отитом, конъюнктивитом, синуситами, пневмониями и пр., они нуждаются в тщательно организованном уходе, полноценном питании, регулярном наблюдении со стороны педиатра.
Прогноз и профилактика синдрома Эдвардса
Во всех случаях прогноз при синдроме Эдвардса крайне неблагоприятный: в среднем мальчики живут 2-3 месяца, девочки – 10 месяцев. До 1 года доживает лишь 10% больных, до 10 лет – не более 1%. Относительно благоприятные шансы в отношении выживания имеют дети с мозаичной формой синдрома Эдвардса.
Риск рождения ребенка с синдром Эдвардса теоретически существует в любой супружеской паре; известно, что такая вероятность выше у возрастных родителей (для женщин старше 45 лет – 0,7%). С целью своевременного выявления хромосомной патологии у плода не следует пренебрегать антенатальным скринингом, входящим в программу введения беременности.
Синдром Эдвардса — лечение в Москве
Синдром Ретта: причины появления, симптомы, диагностика и способы лечения.
Определение
Синдром Ретта – наследственное заболевание, распространенное среди девочек и относящееся к формам умственной отсталости. Свое название синдром получил благодаря педиатру Андреасу Ретту, который впервые описал его в 1966 году. В большинстве случаев заболевание приводит к глубокой инвалидности и нарушению связи с окружающим миром.

Причина синдрома Ретта – мутация гена-регулятора транскрипции МЕСР2, которая имеет место преимущественно у девочек. Большинство описанных в мире случаев — спорадические и менее 1% — семейные. У мальчиков синдром Ретта встречается крайне редко и, как правило, эти дети нежизнеспособны.
По мнению ученых, в основе заболевания лежит поражение коры головного мозга, возникающее на самых ранних этапах развития ребенка.
Патология определяется грубым нарушением лобных долей головного мозга и выпадением их влияния на остальные структуры. Как следствие, страдает психомоторное развитие ребенка, происходит регресс эмоциональных, интеллектуальных и физических достижений. Кроме того, наблюдаются нарушения функционирования других органов и систем организма.
Классификация заболевания
Классификации синдрома Ретта нет, хотя выделяют типичное и атипичное течение заболевания.
Симптомы синдрома Ретта
В типичных случаях дебют заболевания приходится на период от 6 до 20 месяцев после рождения. В атипичных случаях первые симптомы могут появиться в возрасте 3 месяцев и после двух лет, но всегда не позднее 3 лет. В большинстве случаев у детей с синдромом Ретта отмечается нормальное психомоторное развитие до момента начала заболевания.
Клиническое течение синдрома Ретта условно делят на 4 стадии:
- 1-я стадия – стагнация. Она характеризуется потерей интереса к играм, замедлением психомоторного развития и темпов роста головы, а также диффузной мышечной гипотонией;
- 2-я стадия, регрессивная, примечательна тем, что к симптомам добавляются приступы беспокойства ребенка, нарушается сон. За короткий период ребенок теряет приобретенные навыки (целенаправленные движения рук и речь). При этом появляются стереотипные движения, которые напоминают мытье рук.
У многих детей наблюдаются апноэ (остановки дыхания). Дыхательные нарушения отмечаются в период бодрствования и отсутствуют во время сна. Появляются судороги.
На этой стадии заболевания происходит потеря контакта с окружающими;
- 3-я фаза – период, включающий в себя дошкольный и ранний школьный возраст: отмечается умственная отсталость, судорожные припадки, дистония и атаксия мышц. В то же время проходят приступы беспокойства, улучшается сон, становится возможным эмоциональный контакт с ребенком;
- 4-я стадия характеризуется прогрессированием двигательных нарушений и проявляется к концу первых десяти лет жизни ребенка. Наблюдаются мышечные атрофии, вторичные ортопедические деформации (сколиоз), дети теряют способность двигаться самостоятельно. Наблюдается отставание в росте, но без задержки полового созревания. В то же время урежаются судорожные припадки, а эмоциональная связь с пациентом увеличивается.
На этой стадии пациенты могут пребывать в течение многих лет.
Итак, можно выделить следующие характерные симптомы синдрома Ретта:
- остановка и регресс развития ребенка после 6–18 месяцев жизни;
- постепенная утрата ловкости рук и способности разговаривать, хаотичные движения рук;
- мышечный тремор и судороги;
- замедление роста;
- атаксия движений;
- проблемы с социальными контактами, избегание зрительного контакта, приступы паники;
- умственная отсталость;
- эпилептические припадки (наблюдается в 81% случаев);
- боковое искривление позвоночника;
- желудочно-кишечные и дыхательные проблемы.
Диагностика синдрома Ретта
Диагноз синдрома Ретта основывается на распознавании характерной клинической картины, инструментальных и лабораторных исследованиях.
Лабораторные методы диагностики:
- точную диагностическую информацию дает исследование мутаций гена MECP2 или прямое секвенирование его последовательности для определения мутаций . Такое подтверждение синдрома Ретта возможно и в рамках пренатальной (дородовой) диагностики генетических заболеваний.
Синдром Ретта MECP2 м.
Исследование мутаций гена MECP2.
Тип наследования.
X-сцепленный доминантный. Случаи синдрома Ретта, как правило, носят спорадический характер, представ…
Инструментальные методы диагностики:
- МРТ головного мозга обнаруживает нечеткую дифференциацию серого и белого вещества, базальных ганглиев, снижение складчатости коры больших полушарий;
Электроэнцефалография
ЭЭГ — безопасный и безболезненный метод исследования функционального состояния головного мозга.
К каким врачам обращаться
Диагностикой и лечением синдрома Ретта занимается
педиатр
. Как правило, требуется наблюдение у психиатра.
Лечение синдрома Ретта
Методов лечения синдрома Ретта на сегодняшний день не существует. Интенсивная реабилитация, которая включает образовательные мероприятия (должны соответствовать возможностям ребенка), работу логопеда и детского психолога, способна обеспечить самостоятельное существование лишь 2-15% пациенток.
При появлении эпилептических припадков возникает необходимость назначения противосудорожной терапии, хотя ее эффективность ограничена.
Лечебная физкультура — один из оптимальных способов коррекции двигательных расстройств. Она включает упражнения, направленные на поддержание гибкости, амплитуды движений конечностей и как можно более длительное сохранение навыка ходьбы.
Предлагаются психологические программы максимального развития оставшихся сохранными двигательных навыков и формирования на их основе способностей взаимодействия с окружающим миром. Используется также музыкальная терапия – она оказывает благоприятный успокаивающий эффект на детей и частично компенсирует нарушение контакта с окружающим миром.
Осложнения
У пациентов с синдромом Ретта часто наблюдаются желудочно-кишечные и дыхательные проблемы Но самое основное осложнение – потеря способности к движению и полная зависимость от окружающих.
Причиной смерти больных синдромом Ретта обычно становятся интеркуррентные заболевания (заболевания, осложняющие течение основной болезни), дыхательные расстройства и полиорганная недостаточность.
Профилактика синдрома Ретта
Единственный способ – выявление синдрома Ретта на стадии пренатальной (дородовой) диагностики.
Источники:
- Клинические рекомендации «Расстройства аутического спектра» Дети. Разраб.: Ассоциация психиатров и психологов за научно-обоснованную практику. – 2020.
- К.Ю. Мухин. Синдром Ретта // Российский журнал детской неврологии. — 2015 — № 10 — С. 43–51.
- Боровикова Н.Ю., Бобылова М.Ю. Современные подходы к терапии синдрома Ретта (обзор литературы) // Русский журнал детской неврологии. – 2015. – № 4. – С. 43-46.
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Для корректной оценки результатов ваших анализов в динамике предпочтительно делать исследования в одной и той же лаборатории, так как в разных лабораториях для выполнения одноименных анализов могут применяться разные методы исследования и единицы измерения.
Информация проверена экспертом

Лишова Екатерина Александровна
Высшее медицинское образование, опыт работы — 19 лет
Поделитесь этой статьей сейчас
Еще в 1866 году Лэнгдон Даун заметил, что у пациентов с синдромом, которые получил название по фамилии ученого, маленький нос, плоское широкое лицо, толстая шейная складка. С возникновением ультразвука стали появляться более глубокие исследования в этой области, и диагностировать синдром Дауна стало возможным уже у эмбрионов. Главный врач Клиники МАМА Виктория Викторовна ЗАЛЕТОВА рассказывает об истории этих исследований и новейших достижениях.
Врачи всего мира работают в условиях определенной догматики: стопроцентной методики дородовой диагностики синдрома Дауна на данный момент не существует. Фактор риска присутствует всегда. И усилия специалистов разных областей во многих странах направлены на то, чтобы сделать его минимальным.
Одним из важнейших критериев — или ультразвуковых маркеров — при диагностировании синдрома Дауна у эмбрионов является толщина воротникового пространства (ТВП). У любого плода на сроке 11-14 недель можно ее измерить. Было замечено, что у 75% эмбрионов с синдромом Дауна ТВП больше, чем у обычных плодов. Позже были открыты не менее важные ультразвуковые маркеры: длина носовых костей, оценка кровотока в венозном протоке и на трикуспидальном клапане.
Риск, что у ребенка будут присутствовать какие-либо хромосомные аномалии, есть всегда. По синдрому Дауна он составляет порядка 1 на 500. Чем старше мама, тем больше риск (риск резко возрастает после 35 лет).
Доктор Николаидес, основатель Фонда Медицины Плода, и его коллеги в Лондоне в первом триместре беременности выявляют до 95% плодов с синдромом Дауна. Но есть так называемые «нечувствительные дауны» — они «нечувствительны» к этой диагностике. Их количество по данным Фонда Медицины Плода порядка 5%. Это те эмбрионы, которые пройдя биохимический и ультразвуковой скрининг показали абсолютно нормальные значения.
В последние годы пренатальная диагностика хромосомных патологий плода совершенствуется. Был разработан метод ДНК секвенирования клеток плода из крови матери. На 9-ой—10-ой неделе беременности пациентка сдает кровь, из которой «вылавливаются» клеточки эмбриона. И эти клетки анализируются на присутствие основных хромосомных патологий. Данный метод тоже имеет погрешность и не может поставить окончательный диагноз. Но ДНК секвенирование позволяет определить необходимость инвазивной диагностики.
Проведение преимплантационной генетической диагностики эмбрионов (ПГД) в рамках программ ЭКО так же является высокотехнологичной методикой выявления основных хромосомных аномалий, в том числе синдрома Дауна. Исследование позволяет заподозрить проблему на самом раннем этапе и не переносить в полость матки эмбрионы с заведомо лишней хромосомой. Но ПГД как и ДНК-секвенирование имеет свой процент ложно-положительных и ложно-отрицательных результатов. Поэтому в последствии для исключения риска хромосомных патологий требуется проведение комбинированного скрининга с дальнейшей инвазивной диагностикой. Инвазивная методика несет определенные риски по потере беременности, но только это исследование дает более точные результаты.
Комбинированный скрининг в первом триместре позволяет заподозрить патологию плода. Это вспомогательный метод, целью которого является выявление группы риска на основе ультразвуковых и биохимических маркеров. У 75% плодов с синдромом Дауна может быть расширено воротниковое пространство, у 25% оно будет нормальное. У 35-40% плодов с хромосомной патологией наблюдается аномальный венозный кровоток — у остальных он будет нормальный. Поэтому нужна комплексная оценка. Чем больше маркеров рассматривается, тем больше вероятность правильного заключения по этому эмбриону. По-прежнему во всем мире идет поиск новых маркеров. Все врачи пренатальной ультразвуковой диагностики очень этим озабочены, каждый год появляются новые исследования на эту тему.
На основе первого скрининга формируется группа риска. Но это еще не означает наличие синдрома Дауна у эмбриона, речь о подозрении. При расчете индивидуального риска отнесение к группе с высокой вероятностью присутствия заболевания в том числе может произойти из-за возрастного фактора, могли сказаться сывороточные маркеры, отражающие гормональный фон. Что касается расширения воротникового пространства, помимо синдрома Дауна, порядка 50-ти патологий сопровождаются этим признаком.
Практика такова: ложно-положительные и ложно-отрицательные результаты присущи любому скрининговому исследованию. Стопроцентная точность невозможна, это вспомогательный метод для выявления группы риска. Последующие исследования — консультация генетика, инвазивные методики и консилиум врачей разных специальностей — дают возможность подтвердить или опровергнуть диагноз.
У специалистов в этой области существует профессиональное определение «российские плоды с синдромом Дауна очень сложны для диагностики». В отличие от европейских плодов с синдромом Дауна они очень часто попадают в окно нормальных значений толщины воротникового пространства, длины носовой кости и пр. Их сложно выявить. Дело в том, что на территории нашей страны смешалось много наций. В наших жилах течет очень разная кровь, велико присутствие генов монголоидной расы. А при анализе ультразвуковой картины учитываются национальные особенности. И зачастую отклонение от нормативных значений можно принять за этнические черты.
Статистически в популяции на 100 000 плодов только 200 будут иметь синдром Дауна. При этом еще 200 будут иметь другие хромосомные дефекты и 99 600 будут иметь нормальный набор хромосом. Таким образом у порядка 5% эмбрионов воротниковое пространство, как ключевой показатель, будет выше нормативных значений.
Акушер-гинеколог, ведущий беременность, основываясь только на данных ультразвукового исследования и на уровне биохимических маркеров, не может судить, есть ли у плода синдром Дауна. После комбинированного скрининга пациентка направляется в медико-генетический центр. Для подтверждения или опровержения диагноза потребуется консультация врача-генетика и инвазивная пренатальная диагностика.
Врач-генетик анализирует уровень сывороточных маркеров, собирает анамнез, анализирует ультразвуковое исследование и, возможно, назначает повторный ультразвук у врача экспертного уровня. Если высокий риск присутствия хромосомной патологии подтверждается, следующий этап — это инвазивная пренатальная диагностика. В зависимости от срока беременности выделяют хорионбиопсию (на сроке от 11 до 15 недель) и амниоцентез.
Хорион — это будущая плацента, для анализа берут ее образец, в этом материале выявляют клетки плода и исследуют их ДНК. Амниоцентез выполняется после 15 недель — для анализа берется амниотическая жидкость (жидкость, в которой находится плод), в ней также выделяются клетки плода.
Инвазивное исследование назначается только при выявлении высокого риска по результатам комбинированного скрининга — 1:100 и выше (1:50, 1:20). Дело в том, что у каждой инвазивной методики есть процент потерь беременности. Он приблизительно равен 1%. То есть после проведения процедуры одна из ста пациенток может потерять беременность. Поэтому проведение инвазивного исследования должно быть оправдано высокими рисками появления ребенка с хромосомными аномалиями.
Инвазивные методы исследование дают порядка 90-99% точности в определении хромосомной патологии плода. Проводить или не проводить инвазивный тест, оставлять или прерывать беременность после подтверждения подозрений — окончательное решение остается за будущими родителями. Им предстоит оценить все риски, возможные последствия и принять итоговое решение. Долг врача — предоставить пациентке максимально полную информацию, дать предполагаемый прогноз. Но решение судьбы беременности и ответственность за будущее ребенка все-таки лежит на его родителях.
В 21 веке планирование и рождение детей происходит в принципиально изменившихся реалиях. Новые возможности медицины по диагностике, ухудшение экологической ситуации, повышение возраста первой беременности. Все эти факторы значительно меняют сам подход к рождению детей. Сегодня вынашивание ребенка требует от женщины достаточно высокой компетентности в медицинских, социальных и даже правовых вопросах. Все большее значение приобретает подготовка к зачатию. Поэтому мировая медицина однозначна в своих рекомендациях: планирование любой беременности стоит начинать с консультации репродуктолога. Обращаясь в Клинику МАМА, вы можете быть уверены, что получите полный цикл диагностических и лечебных услуг европейского уровня.
или позвоните +7 495 921-34-26 8 800 550-05-33 бесплатный телефон по России info@ma-ma.ru