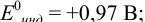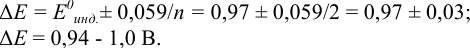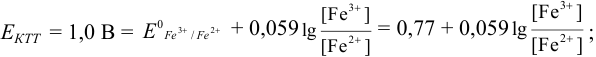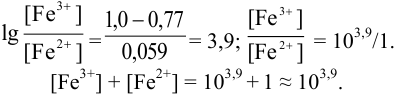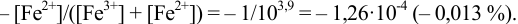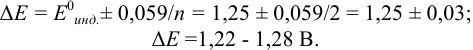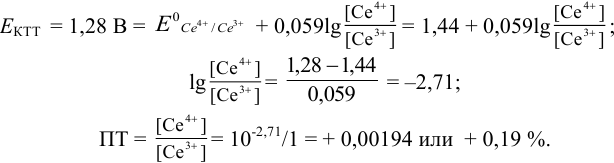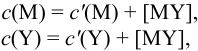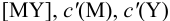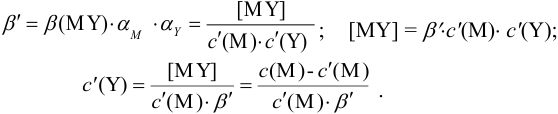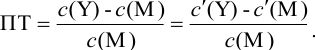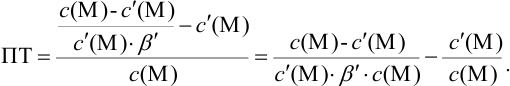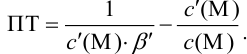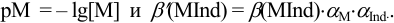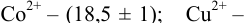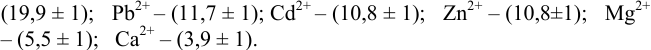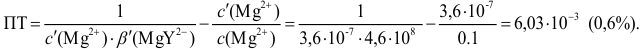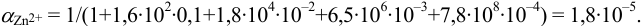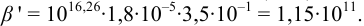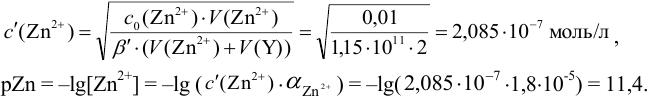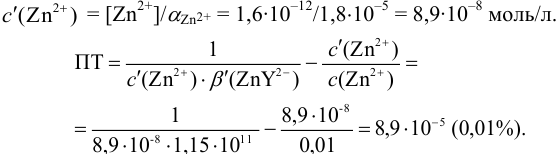В протолитометрии
различают 4 вида индикаторных
ошибок: водородная, гидроксильная,
кислотная и основная.
-
Водородная
(Н+) ошибка
возникает при титровании сильных
электролитов (сильное – сильное)
и обусловлена избытком протонов в
растворе. Эта ошибка имеет место, если
сильная кислота
недотитрована, а сильное основание
– перетитровано. -
Гидроксильная
(ОН–) ошибка
также характерна для титрования
системы сильное – сильное и возникает
при избытке гидроксо—групп
в растворе. Сильная кислота при этом
будет перетитрована, а сильное
основание – недотитровано. -
Кислотная
ошибка проявляется при титровании
слабой кислоты сильным основанием,
в том случае, когда слабая кислота
недотитрована и в растворе избыток
протонов. -
Основная ошибка
характеризует систему слабое
основание
сильная кислота в момент, когда
слабое основание недотитровано, т.е.
при избытке в растворе гидроксо-групп.
Так как при
титровании слабых электролитов в
качестве титранта обычно используют
сильный электролит (щелочь или кислоту),
то в перетитрованном растворе
избыток титранта создает погрешность
1-го или 2-го типа: водородную или
гидроксильную ошибку.
Главным критерием
применимости того или иного индикатора
является значение индикаторной ошибки,
которая не должна превышать 0,5%. Если
погрешность выше, то такой индикатор
применять нельзя.
4.3. Методы и способы титрования. Титр, титр по определяемому веществу
Аналитическая
характеристика каждого титриметрического
метода включает наиболее существенные
его особенности: приготовление и свойства
рабочих растворов, виды кривых титрования,
погрешности определения, способы
индикации точки эквивалентности и
практическое применение. На основании
этого все методы титрования
классифицируют
по 2-м признакам: типу
реакции,
лежащей в основе
метода
и способу проведения анализа.
Каждый вид титрования имеет свои
особенности и закономерности и может
осуществляться различными способами.
Как видно из схемы (рис. 4.9), в зависимости
от типа
реакции,
лежащей в основе метода, различают 4-ре
вида
титрования:
-
кислотно-основное
или метод нейтрализации (протолитометрия); -
окислительно-восстановительное
(редоксиметрия); -
комплексометрическое;
-
осадительное
(метод седиментации).

Рисунок
4.9 – Классификация методов титрования
в соответствии с типом химической
реакции (где L
– комплексный ион; МеL
– образовавшийся комплекс; А – осаждаемое
вещество, В – титрант, АВ – осадок).
4.3.1 Способы титрования.
Так как напрямую,
реакцией с титрантом, можно анализировать
далеко не любое вещество, особенно, если
оно неустойчиво на воздухе, то для
решения подобных задач было разработано
несколько приемов
(способов)
проведения анализа. Они
позволяют заменять неустойчивые,
в данных условиях соединения,
на эквивалентное количество более
устойчивого, которое не подвергается
гидролизу или окислению. Известны
следующие основные способы
проведения титриметрического анализа:
-
прямое
титрование; -
реверсивное;
-
обратное титрование
или титрование по остатку; -
косвенное
титрование или по замещению (по
заместителю).
В таблице 4.1 показаны
области применения различных способов
в зависимости от вида титрования.
Таблица 4.1 –
Применение различных видов и способов
титрования.
|
название метода |
частное название метода; (рабочий раствор) |
вещества, |
||
|
прямым |
обратным |
косвенным |
||
|
Протолито-метрия |
Ацидиметрия
(кислоты: |
основания;
соли, образован-ные сильным |
соли слабых оснований и сильных кислот; органические соединения |
|
|
Алкалиметрия
(щелочи: |
кислоты;
соли, образован-ные слабым |
|
|
|
|
Редокси-метрия |
Перманганато-метрия |
восстановители |
окислители |
вещества, реагирующие с восстанови-телями |
|
Иодометрия
( и |
восстановители |
восстановители |
окислители; кислоты |
|
|
Комплексо-метрия |
Комплексоно- метрия (ЭДТА) |
катионы, образующие с ЭДТА комплексы |
катионы в водо-нерастворимых катионы,
для которых отсутствует |
катионы, образующие с ЭДТА |
|
Метод |
Аргентометрия
( |
Анионы, образую-щие с |
катионы, образующие |
|
Рассмотрим подробнее
суть различных способов титрования.
1. Прямое
титрование заключается в
непосредственном взаимодействии
титранта и титруемого вещества. В
процессе титрования к аликвоте или
навеске вещества постепенно добавляют
раствор титранта, объем которого точно
фиксируют в Т. Э. В качестве титранта
используют рабочий раствор известной
концентрации. Расчет содержания вещества
в образце выполняют по закону эквивалентов:
=
(4.1)
где
– количество моль-эквивалентов
анализируемого вещества в титруемом
образце; а
количество
моль-эквивалентов титранта, вступившего
в реакцию с определяемым компонентом
А.
Концентрацию
компонента А в растворе вычисляют
по формуле:
(4.2)
где
– молярная концентрация эквивалента
(нормальность) титруемого раствора
(определяемого компонента), моль-экв/л;
– объем аликвоты титруемого раствора,
мл;
–
концентрация и
объем титранта в
точке эквивалентности. При титровании
методом отдельных навесок формула
(4.2) преобразуется в выражение (4.3):
(4.3)
Метод применяется
во всех случаях, когда нет каких-либо
ограничений. Например, при анализе
кислот, определении жесткости воды.
2. Реверсивное
титрование – это разновидность
прямого титрования, когда рабочий и
титруемый растворы меняют местами. В
этом случае для анализа отбирают
аликвоты рабочего раствора, а в Т.Э.
измеряют израсходованный на
титрование объем анализируемого
раствора. Вычисления проводят также,
как и в прямом титровании, по формулам
(4.2) или (4.3). Метод позволяет ограничить
площадь поверхности раствора,
контактирующей с воздухом, при
стандартизации относительно неустойчивых
соединений, как например NaOH.
Титрование по
заместителю (косвенное) и титрование
по остатку (обратное) основаны
на использовании вспомогательного
раствора, взаимодействующего с
определяемым компонентом. Такой прием
позволяет выполнять анализ химически
нестойких объектов или же при отсутствии
подходящего индикатора.
В косвенном
титровании сначала осуществляют
реакцию определяемого вещества
А со вспомогательным раствором
В, а затем титруют
эквивалентное количество
образовавшегося продукта реакции
С (заместитель). Этот способ
можно представить в виде схемы: А + В
С + (т-т) , исходя из которой запишем
выражение для закона эквивалентов:
=
=
.
(4.4)
Из равенства (4.4)
следует, что
=
и расчет можно также выполнять по
формулам (4.2) и (4.3), используемых для
прямого титрования. Для полноты реакции
вспомогательный раствор всегда берут
с небольшим избытком. Такой метод
титрования реализуется в йодометрии.
В обратном
титровании также сначала протекает
реакция между определяемым
веществом А и
взятым в избытке вспомогательным
раствором В, но затем титруют
остаток не прореагировавшего
вспомогательного раствора. Поэтому
необходимо точно знать концентрацию
вспомогательного раствора В и его
объем, взятый для анализа. Определение
компонента А выполняется согласно
схеме: А + В
Вост + (т-т). Исходя из
условий титрования, закон эквивалентов
можно записать в виде:
–
=
.
(4.5)
Откуда имеем:
=
.
(4.6)
Если все вещества
взяты в виде растворов, то формула (4.6)
примет вид
(4.7)
Если хотя бы одно
из веществ взято в сухом виде (известна
его масса), то следует воспользоваться
выражением (4.6) и записать значение
для каждого из веществ индивидуально.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
В протолитометрии
различают 4 вида индикаторных
ошибок: водородная, гидроксильная,
кислотная и основная.
-
Водородная
(Н+) ошибка
возникает при титровании сильных
электролитов (сильное – сильное)
и обусловлена избытком протонов в
растворе. Эта ошибка имеет место, если
сильная кислота
недотитрована, а сильное основание
– перетитровано. -
Гидроксильная
(ОН–) ошибка
также характерна для титрования
системы сильное – сильное и возникает
при избытке гидроксо—групп
в растворе. Сильная кислота при этом
будет перетитрована, а сильное
основание – недотитровано. -
Кислотная
ошибка проявляется при титровании
слабой кислоты сильным основанием,
в том случае, когда слабая кислота
недотитрована и в растворе избыток
протонов. -
Основная ошибка
характеризует систему слабое
основание
сильная кислота в момент, когда
слабое основание недотитровано, т.е.
при избытке в растворе гидроксо-групп.
Так как при
титровании слабых электролитов в
качестве титранта обычно используют
сильный электролит (щелочь или кислоту),
то в перетитрованном растворе
избыток титранта создает погрешность
1-го или 2-го типа: водородную или
гидроксильную ошибку.
Главным критерием
применимости того или иного индикатора
является значение индикаторной ошибки,
которая не должна превышать 0,5%. Если
погрешность выше, то такой индикатор
применять нельзя.
4.3. Методы и способы титрования. Титр, титр по определяемому веществу
Аналитическая
характеристика каждого титриметрического
метода включает наиболее существенные
его особенности: приготовление и свойства
рабочих растворов, виды кривых титрования,
погрешности определения, способы
индикации точки эквивалентности и
практическое применение. На основании
этого все методы титрования
классифицируют
по 2-м признакам: типу
реакции,
лежащей в основе
метода
и способу проведения анализа.
Каждый вид титрования имеет свои
особенности и закономерности и может
осуществляться различными способами.
Как видно из схемы (рис. 4.9), в зависимости
от типа
реакции,
лежащей в основе метода, различают 4-ре
вида
титрования:
-
кислотно-основное
или метод нейтрализации (протолитометрия); -
окислительно-восстановительное
(редоксиметрия); -
комплексометрическое;
-
осадительное
(метод седиментации).

Рисунок
4.9 – Классификация методов титрования
в соответствии с типом химической
реакции (где L
– комплексный ион; МеL
– образовавшийся комплекс; А – осаждаемое
вещество, В – титрант, АВ – осадок).
4.3.1 Способы титрования.
Так как напрямую,
реакцией с титрантом, можно анализировать
далеко не любое вещество, особенно, если
оно неустойчиво на воздухе, то для
решения подобных задач было разработано
несколько приемов
(способов)
проведения анализа. Они
позволяют заменять неустойчивые,
в данных условиях соединения,
на эквивалентное количество более
устойчивого, которое не подвергается
гидролизу или окислению. Известны
следующие основные способы
проведения титриметрического анализа:
-
прямое
титрование; -
реверсивное;
-
обратное титрование
или титрование по остатку; -
косвенное
титрование или по замещению (по
заместителю).
В таблице 4.1 показаны
области применения различных способов
в зависимости от вида титрования.
Таблица 4.1 –
Применение различных видов и способов
титрования.
|
название метода |
частное название метода; (рабочий раствор) |
вещества, |
||
|
прямым |
обратным |
косвенным |
||
|
Протолито-метрия |
Ацидиметрия
(кислоты: |
основания;
соли, образован-ные сильным |
соли слабых оснований и сильных кислот; органические соединения |
|
|
Алкалиметрия
(щелочи: |
кислоты;
соли, образован-ные слабым |
|
|
|
|
Редокси-метрия |
Перманганато-метрия |
восстановители |
окислители |
вещества, реагирующие с восстанови-телями |
|
Иодометрия
( и |
восстановители |
восстановители |
окислители; кислоты |
|
|
Комплексо-метрия |
Комплексоно- метрия (ЭДТА) |
катионы, образующие с ЭДТА комплексы |
катионы в водо-нерастворимых катионы,
для которых отсутствует |
катионы, образующие с ЭДТА |
|
Метод |
Аргентометрия
( |
Анионы, образую-щие с |
катионы, образующие |
|
Рассмотрим подробнее
суть различных способов титрования.
1. Прямое
титрование заключается в
непосредственном взаимодействии
титранта и титруемого вещества. В
процессе титрования к аликвоте или
навеске вещества постепенно добавляют
раствор титранта, объем которого точно
фиксируют в Т. Э. В качестве титранта
используют рабочий раствор известной
концентрации. Расчет содержания вещества
в образце выполняют по закону эквивалентов:
=
(4.1)
где
– количество моль-эквивалентов
анализируемого вещества в титруемом
образце; а
количество
моль-эквивалентов титранта, вступившего
в реакцию с определяемым компонентом
А.
Концентрацию
компонента А в растворе вычисляют
по формуле:
(4.2)
где
– молярная концентрация эквивалента
(нормальность) титруемого раствора
(определяемого компонента), моль-экв/л;
– объем аликвоты титруемого раствора,
мл;
–
концентрация и
объем титранта в
точке эквивалентности. При титровании
методом отдельных навесок формула
(4.2) преобразуется в выражение (4.3):
(4.3)
Метод применяется
во всех случаях, когда нет каких-либо
ограничений. Например, при анализе
кислот, определении жесткости воды.
2. Реверсивное
титрование – это разновидность
прямого титрования, когда рабочий и
титруемый растворы меняют местами. В
этом случае для анализа отбирают
аликвоты рабочего раствора, а в Т.Э.
измеряют израсходованный на
титрование объем анализируемого
раствора. Вычисления проводят также,
как и в прямом титровании, по формулам
(4.2) или (4.3). Метод позволяет ограничить
площадь поверхности раствора,
контактирующей с воздухом, при
стандартизации относительно неустойчивых
соединений, как например NaOH.
Титрование по
заместителю (косвенное) и титрование
по остатку (обратное) основаны
на использовании вспомогательного
раствора, взаимодействующего с
определяемым компонентом. Такой прием
позволяет выполнять анализ химически
нестойких объектов или же при отсутствии
подходящего индикатора.
В косвенном
титровании сначала осуществляют
реакцию определяемого вещества
А со вспомогательным раствором
В, а затем титруют
эквивалентное количество
образовавшегося продукта реакции
С (заместитель). Этот способ
можно представить в виде схемы: А + В
С + (т-т) , исходя из которой запишем
выражение для закона эквивалентов:
=
=
.
(4.4)
Из равенства (4.4)
следует, что
=
и расчет можно также выполнять по
формулам (4.2) и (4.3), используемых для
прямого титрования. Для полноты реакции
вспомогательный раствор всегда берут
с небольшим избытком. Такой метод
титрования реализуется в йодометрии.
В обратном
титровании также сначала протекает
реакция между определяемым
веществом А и
взятым в избытке вспомогательным
раствором В, но затем титруют
остаток не прореагировавшего
вспомогательного раствора. Поэтому
необходимо точно знать концентрацию
вспомогательного раствора В и его
объем, взятый для анализа. Определение
компонента А выполняется согласно
схеме: А + В
Вост + (т-т). Исходя из
условий титрования, закон эквивалентов
можно записать в виде:
–
=
.
(4.5)
Откуда имеем:
=
.
(4.6)
Если все вещества
взяты в виде растворов, то формула (4.6)
примет вид
(4.7)
Если хотя бы одно
из веществ взято в сухом виде (известна
его масса), то следует воспользоваться
выражением (4.6) и записать значение
для каждого из веществ индивидуально.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Расчет индикаторных погрешностей кислотно-основного титрования
Согласно ионно-хромофорной теории индикаторов, интервал перехода окраски индикатора 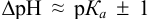
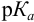
Таблица 8.12
Важнейшие кислотно-основные индикаторы
При правильно выбранном индикаторе индикаторная ПТ не должна превышать заданную погрешность измерения объема раствора в титриметрии. Типы (виды) индикаторных ПТ кислотно-осиовиого титрования и названия, встречающиеся в разных учебниках и сборниках задач, происхождение погрешностей и формулы для расчета приведены в табл. 8.13. Формулы легко выводятся из определения погрешности титрования как отношения недотитро-ванного или перетитрованного количества кислоты или основания к первоначально взятому для титрования (то есть к произведению 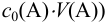
Таблица 8.13
Индикаторные погрешности кислотно-основного титрования
Пример 8.28.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании а) 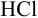
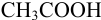
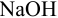
Решение:
а). Как следует из табл. 8.4 и рис. 8.1(1), для случая титрования 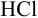

Однако используемые для расчета ПТ формулы показывают, что чем ближе рТ и 

Рассчитаем величину ПТ с двумя индикаторами: с рТ < 

С индикатором метиловым красным (рТ 5,5 < 
С индикатором фенолфталеином (рТ 9,0 > 
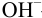
В данном случае оба индикатора пригодны, поскольку вычисленные значения ПТ не превышают заданную погрешность титрования (0,4%), но с метиловым красным систематическая индикаторная погрешность меньше.
б). При титровании 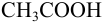



Например, при выборе фенолфталеина (рТ = 9,0):
а при выборе тимолфталеина (рТ = 10,0) погрешность возрастает в 10 раз:
Выбор фенолфталеина приводит к меньшей индикаторной погрешности титрования 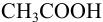
При титровании с индикаторами, для которых рТ < рНтэ, в растворе остается неоттитрованная слабая кислота, т. е. присутствует НА-ошибка (кислотная) со знаком «-» (см. табл. 8.13). Если использовать индикатор бромтимоловый синий (рТ 7,0), то вычисленная ПТ не удовлетворяет заданной точности, индикатор не пригоден:
или при проведении расчета по приближенной формуле:
Пример 8.29.
Какой индикатор позволяет оттитровать 0,1000 М гидразин 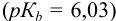
Решение:
Реакция титрования:
приводит к образованию слабой сопряженной кислоты 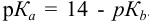
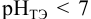
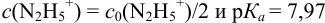
Сравнивая рТ индикаторов и 
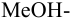
и с метиловым красным (рТ 5,5):
Из предложенных индикаторов метиловый красный позволяет провести титрование гидразина с меньшей погрешностью.
Расчет индикаторных погрешностей окислительно-восстановительного титрования
При использовании окислительно-восстановительных (редокс) индикаторов потенциал в ТЭ 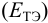
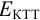
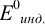
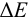
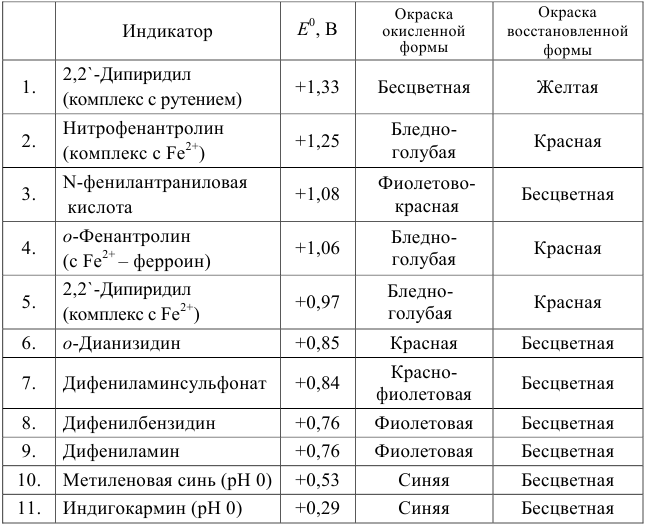
Таблица 8.14
Примеры распространенных окислительно-восстановительных индикаторов
Полуреакция восстановления и интервал перехода индикатора:
Наиболее часто в полуреакции восстановления (окисления) индикатора участвуют 2 электрона. Для индикаторов №1 — №6 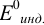
- сравнить
для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.
Например, если 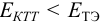
Сумма числителя и знаменателя здесь составляет 100 % титруемого вещества. Индикатор считается пригодным, если ПТ не превышает 0,1 -0,2%.
Пример 8.30.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании раствора соли 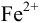
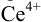
Решение:
Как следует из табл. 8.8 и рис. 8.3 (кривая 1, пример 8.25), область скачка (при относительной погрешности измерения объема 0,1 %) на кривой титрования 0,95 — 1,26 В, а 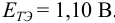
Выберем для рассмотрения порядка расчета два индикатора:
а) с 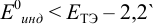
б) с 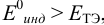
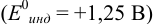
В случае а) интервал перехода индикатора:
Изменение окраски заканчивается при 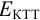
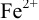
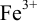
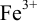
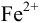
Тогда: ПТ =
В случае б) интервал перехода индикатора нитрофенантролина в виде комплекса с 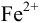
Изменение окраски заканчивается при 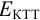
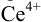
Тогда количество 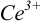
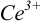
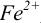
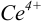
Таким образом, оба выбранных индикатора оказались приемлемыми.
Расчет индикаторных погрешностей комплексонометрического титрования
В конечной точке титрования общие концентрации определяемого иона с(М) и титранта c(Y) можно представить выражениями {для упрощения записи в общем виде упустим заряды ионов):
где 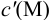
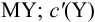
Условные константы устойчивости (см. выражение 8.16) связывают
Отсюда относительная погрешность титрования (ПТ) определяется выражением (с учетом (8.18) и (8.19)):
Подставляем в это уравнение выражение для 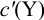
Вблизи ТЭ 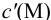
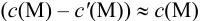
следовательно:
Выражение (8.21) тождественно выражению: 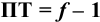
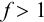
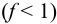
Конечная точка титрования определяется интервалом перехода окраски индикатора (интервалом рМ, в котором индикатор меняет свою окраску):
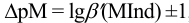
Интервал перехода окраски 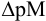
Пример 8.31.
Рассчитайте погрешность титрования 0,1 ОМ раствора 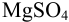

Решение:
В данных условиях 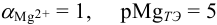
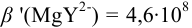
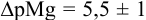
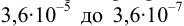
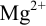
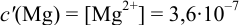
Погрешность титрования 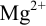
Пример 8.32.
Докажите возможность использования индикатора эриохром черный Т для титрования 0,010 М раствора 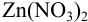

Решение:
1. Рассчитаем условную константу 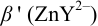
Общие константы устойчивости для аммиачных комплексов 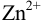
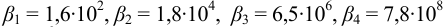
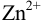
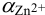
По табл. 7 и табл. 4 приложения находим 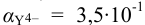
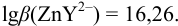
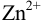
В точке эквивалентности:
Интервал перехода окраски индикатора эриохром черный Т в случае титрования ионов цинка при pH 10: 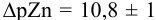
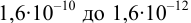
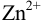
2. Конечная точка титрования наступает при [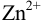
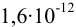
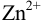
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:
В университете на практическом курсе аналитической химии мне приходилось много титровать. Я помню осторожное дозирование титранта стеклянной бюреткой, неудобный процесс повторного наполнения бюретки и постоянное опасение, что я неправильно выбрала конечную точку.
Все студенты в группе получали разные результаты, но мы так и не поняли почему. В те годы у меня было мало знаний. Сейчас, после 10 лет опыта титрования, я поняла, что результаты ручного титрования очень сильно зависят от человека, который проводит анализ. Ниже я перечислю основные источники ошибок, и как вы можете их избежать.

Правильный выбор индикатора
Значение pH конечной точки титрования зависит от константы кислотной диссоциации (Ka) используемых кислоты и основания. Если сильное основание титруют сильной кислотой, значение pH в конечной точке составляет около 7. Титрование сильного основания слабой кислотой смещает конечную точку в сторону диапазона щелочи. Титрование сильной кислоты слабым основанием – в зону кислот. Это объясняет, почему при кислотно-щелочном титровании используются несколько разных индикаторов. Какой мы выберем?
На приведенной выше диаграмме показаны самые популярные pH индикаторы. Из графика видно, что не получите правильных результатов при pH конечной точки = 7, если в качестве индикатора вы используете кристаллический фиолетовый или метиловый оранжевый. К счастью, в большинстве стандартов и в стандартных методиках работы индикатор уже указан. Если будете следовать инструкциям, все будет хорошо!

Субъективность распознавания конечной точки
Проблемы начинаются в процессе определения конечной точки. Вы когда-нибудь задумывались о тонкостях изменения цвета?
На рисунке вы видите пять стадий кислотно-щелочного титрования c(HCl) = 1 моль/л с c(NaOH) = 1 моль/л. Единственная разница между соседними фотографиями заключается в одной капле титранта. На каком из них истинная конечная точка?
Может это конечная точка на рисунке 1 с бледно-розовым оттенком? Или на картинке под номером 3 с более интенсивным цветом? Или даже на картинке 5, где розовый цвет наиболее яркий? Между 1 и 5 было добавлено всего четыре капли титранта. Одна капля – это 50 мкл, а добавленный в сумме объем составляет 200 мкл титранта или примерно 7,3 мг соляной кислоты. Для фармацевтического анализа – это колоссальная ошибка.

Считываем объем на бюретке
Вы помните, как правильно считывать значения на бюретке? Нужно убедиться, что фиксируете значение мениска четко по горизонтали. Знаете почему?
Значение объема зависит от угла, под которым вы смотрите на бюретку. На данном рисунке данные отличаются от фактического значения до 0,2 мл (200 мкл) в зависимости от угла обзора. Чем больше ваш ракурс отклоняется от горизонтали, тем более неточными будут значения и сам результат. Вы можете допустить среднюю ошибку 200 мкл. Но для титрования это недопустимо много, на предыдущем примере я рассказала почему.
Повышаем объективность и точность оценки
Как можно исключить эти ошибки? Легче всего просто обойти возможную неточность. Решением станет использование электронной бюретки. Все, что вам нужно сделать, это заполнить ее титрантом, а затем нажать кнопку. Устройство автоматически измерит объем и выдаст оцифрованный результат. Использование электронной бюретки уже обеспечит высокий уровень объективности ваших результатов.
Электронная бюретка также повысит и точность данных. Мне не нужно рассказывать вам, насколько важна точность в аналитической химии, но я приведу пример. Представьте, что вы определили чистоту золота в 90%, а на самом деле оно чистое на 99%. Вы бы потеряли много денег, продавая свое золото с этой иллюзией!
Ранее я показала, что визуальное распознавание конечной точки с цветовым индикаторам может привести к ошибкам до 200 мкл. Неточность ручной бюретки может вызвать погрешность в дополнительных 200 мкл. Хотя электронная бюретка не помогает добиться лучшей объективизации при распознавании конечной точки, она добавляет куда меньший объем титранта: вместо прежних 50 мкл на каплю, всего 0,25 мкл в зависимости от объема используемой бюретки. Это существенно снизит ошибку при распознавании конечной точки. Самые распространенные бюретки описаны ниже:
| Объем цилиндра бюретки (мл) | Мин. добавляемый объем (µл) |
| 5 | 0.25 |
| 10 | 0.50 |
| 20 | 1.00 |
| 50 | 2.50 |
Следующий шаг: автоматическое титрование
Если вы хотите закрыть все источники ошибок, про которые мы говорили, вам придется перейти на автоматическое титрование или автотитрование. В этом случае вы будете использовать электрод для анализа изменения pH в образце и математический алгоритм для детектирования конечной точки — индикатор вам больше не потребуется. Кроме того, вы получите ту же точность, что и с электронной бюреткой.
Ознакомьтесь с соответствующей записью в блоге для получения дополнительной информации.
How to Transfer Manual Titration to Autotitration
Author

Iris Kalkman
Product Specialist TitrationMetrohm International Headquarters, Herisau, Switzerland

Индикаторные ошибки кислотно-основного титрования 1

Водородная ошибка возникает, когда недотитрована сильная кислота, перетитровано сильное или слабое основание Водородная ошибка – отношение количества ионов водорода n(H+) в конце титрования к первоначально взятому количеству вещества n(X) n(H+)к. т. X(H+) = ———— · 100% n(X) 2

n(X) = С(1/z Х) · V(X) С(1/z Х) – молярная концентрация эквивалента первоначально взятого вещества V(X) – объем первоначально взятого вещества n(H+)к. т. = [H+]к. т. · Vк. т. – объем в конце титрования Vк. т. = V(X) + V(Т) 3
![[H+]к. т. · (V(X) + V(Т)) X(H+) = —————— · 100% С(1/z Х) · [H+]к. т. · (V(X) + V(Т)) X(H+) = —————— · 100% С(1/z Х) ·](https://present5.com/presentation/3/139200531_169966086.pdf-img/139200531_169966086.pdf-4.jpg)
[H+]к. т. · (V(X) + V(Т)) X(H+) = —————— · 100% С(1/z Х) · V(X) р. Нк. т. = р. ТInd [H+]к. т = 10–р. Н = 10–р. Т · (V(X) + V(Т)) X(H+) = ————— · 100% С(1/z Х) · V(X) 4

Гидроксильная ошибка обусловлена наличием гидроксид-ионов в конце титрования и возникает, когда недотитровано сильное основание, перетитрована сильная или слабая кислота n(OH–)к. т. X(OH–) = ———— · 100% n(X) n(OH–)к. т = [OH–]к. т. · (V(X) + V(Т)) n(X) = С(1/z Х) · V(X) [OH–]к. т. · (V(X) + V(Т)) X(OH–) = ————— · 100% С(1/z Х) · V(X) 5
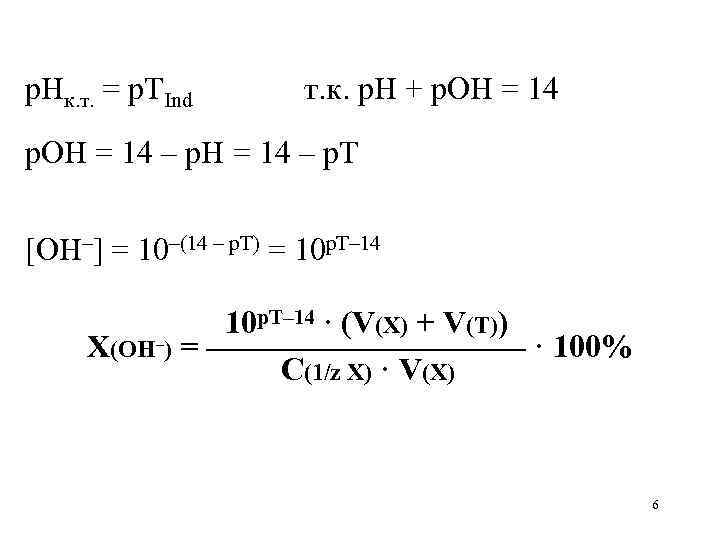
р. Нк. т. = р. ТInd т. к. р. Н + р. ОН = 14 – р. Т [OH–] = 10–(14 – р. Т) = 10 р. Т– 14 · (V(X) + V(Т)) X(OH–) = ————— · 100% С(1/z Х) · V(X) 6

Кислотная ошибка возникает, когда остается недотитрованной слабая кислота Кислотная ошибка – отношение концентрации недотитрованной кислоты в конце титрования к ее оттитрованной части HA + KOH H 2 O + KA [HA]к. т. X(HA) = ———— · 100% [A–]к. т. Оттитрованная часть кислоты будет определяться анионами соли 7
![HAк. т. H+к. т. + A–к. т. [H+]к. т. · [A–]к. т. Kк-ты = HAк. т. H+к. т. + A–к. т. [H+]к. т. · [A–]к. т. Kк-ты =](https://present5.com/presentation/3/139200531_169966086.pdf-img/139200531_169966086.pdf-8.jpg)
HAк. т. H+к. т. + A–к. т. [H+]к. т. · [A–]к. т. Kк-ты = ——————— [HA]к. т. [H+]к. т. ———= ——— [A–]к. т. Kк-ты [H+]к. т. X(HA) = ———— · 100% Kк-ты 8
![р. Нк. т. = р. ТInd [H+]к. т = 10–р. Н = 10–р. Т р. Нк. т. = р. ТInd [H+]к. т = 10–р. Н = 10–р. Т](https://present5.com/presentation/3/139200531_169966086.pdf-img/139200531_169966086.pdf-9.jpg)
р. Нк. т. = р. ТInd [H+]к. т = 10–р. Н = 10–р. Т Kк-ты = 10–р. К 10–р. Т X(HA) = ———— · 100% 10–р. Кк-ты X(HA) =10 р. Кк-ты–р. Т · 100% 9

Основная ошибка возникает, когда остается недотитрованным слабое основание Основная ошибка – отношение концентрации неоттитрованного основания в конце титрования к его оттитрованной части [BOH]к. т. X(BOH) = ———— · 100% [B+]к. т. 10
![Аналогично с кислотной ошибкой можно показать [BOH]к. т. [OH–]к. т. ————— = ————— [B+]к. Аналогично с кислотной ошибкой можно показать [BOH]к. т. [OH–]к. т. ————— = ————— [B+]к.](https://present5.com/presentation/3/139200531_169966086.pdf-img/139200531_169966086.pdf-11.jpg)
Аналогично с кислотной ошибкой можно показать [BOH]к. т. [OH–]к. т. ————— = ————— [B+]к. т. Kосн [OH–]к. т. X(BOH) = ———— · 100% Kосн Т. к. [OH–]к. т. = 10 р. Т– 14 Kосн = 10–р. Косн 11
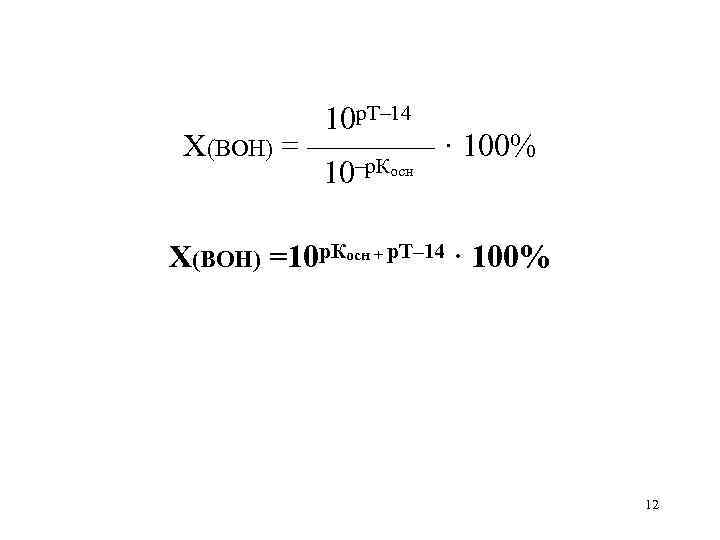
10 р. Т– 14 X(BOH) = ———— · 100% 10–р. Косн X(BOH) =10 р. Косн + р. Т– 14 · 100% 12

Вычислить ошибку титрования 0, 2 н. раствора HCl 0, 2 н. раствором Na. OH с индикатором метиловым оранжевым. р. Т(м/о) = 4 ошибка водородная 10–р. Т · (V(X) + V(Т)) X(H+) = ————— · 100% С(1/z Х) · V(X) 10– 4 · (10 + 10) X(H+) = ——————— · 100 = 0, 1% 0, 2 · 10 Индикаторная ошибка должна быть 0, 1% 13

Вычислить индикаторную ошибку титрования 0, 2 н. раствора HCl 0, 2 н. раствором Na. OH с индикатором фенолфталеином р. Т(ф/ф) = 9 ошибка гидроксильная 10 р. Т– 14 · (V(X) + V(Т)) X(OH–) = ————— · 100% С(1/z Х) · V(X) 109– 14 · (10 + 10) X(OH–) = ——————— · 100 = 0, 01 % 0, 2 · 10 14

Вычислить ошибку титрования 0, 1 н. раствора муравьиной кислоты 0, 1 н. раствором сильного основания с индикатором метиловым красным р. Т(м/к) = 5 р. К(HCOOH) = 3, 76 р. Нт. э. = 7 + ½ р. Кк-ты + ½ lg Cсоли = 8, 38 Раствор недотитрован ошибка кислотная 15

X(HA) =10 р. Кк-ты–р. Т · 100% X(HA) =103, 76– 5 · 100 = 5, 7 % Индикатор использовать нельзя. 16

Чему равна ошибка титрования 0, 1 н. раствора аммиака 0, 1 н. раствором HCl с индикатором крезоловым пурпуровым р. Т(к/п) = 8 р. К(NH 4 OH) = 4, 75 р. Нт. э. = 7 – ½ р. Косн – ½ lg Cсоли = 5, 10 Раствор недотитрован ошибка основная X(BOH) =10 р. Косн + р. Т– 14 · 100% X(BOH) =104, 75 + 8– 14 · 100 = 5, 6% 17
В методах кислотно-основного титрования точка эквивалентности может находиться в нейтральной, кислой или щелочной среде в зависимости от природы определяемого вещества. Для того чтобы правильно выбрать индикатор, нужно знать, как изменяется рН в процессе титрования, и какое значение рН имеет раствор непосредственно в точке эквивалентности. Для этого строят кривые титрования. Кривые титрования в методе нейтрализации (кислотно-основного титрования) – это графическая зависимость изменения рН раствора от объема добавленного титранта.
Для построения кривой титрования рассчитывают значения рН:
- до точки эквивалентности;
- в точке эквивалентности;
- после точки эквивалентности.
Кривая титрования сильного основания сильной кислотой
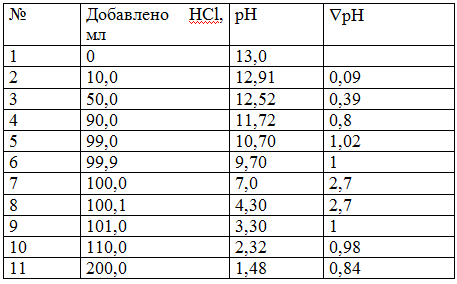
Задача: Построить кривую титрования 100,0 мл раствора гидроксида натрия NaOH с молярной концентрацией эквивалента C(1/z)=0,1 моль/л раствором хлороводородной кислоты HCl с молярной концентрацией эквивалента C(1/z)=0,1 моль/л.
1 этап – до точки эквивалентности
Расчет кривой титрования начинают с расчета рН исходного раствора.
1.1 Пусть добавлено 0 мл раствора HCl. Гидроксид натрия NaOH – сильное основание и в растворе диссоциирует полностью:
NaOH ⇔ Na+ + ОН—
Так как NaOH – бинарное соединение, то концентрация гидроксил-ионов равна молярной концентрации гидроксида натрия:
[OH—] = C(NaOH)
Так как z = 1, то C(1/z, NaOH) = C( NaOH) = 0,1 = 10-1 моль/л
рОН = — lg10-1 = 1
Ионное произведение воды равно рН + рОН = 14, отсюда
рН = 14 – рОН = 14-1 = 13,0
Значения рН раствора до точки эквивалентности определяется концентрацией не оттитрованного гидроксида натрия.
1.2 Добавлено 10,0 мл раствора HCl. В растворе протекает реакция нейтрализации:
NaOH + HCl ⇔ NaCl + Н2О
Определяем, сколько NaOH вступило в реакцию и сколько NaOH осталось в растворе. По закону эквивалентов:
С(1/z, NaOH) * V (NaOH) = С(1/z, HCl) * V (HCl)
С(1/z, HCl) * V (HCl) = 0,1 * 10
V (NaOH) = С(1/z, NaOH) = 0,1 = 10 мл NaOH
израсходовано (вступило в реакцию); осталось NaOH (100 — 10) = 90 мл. Концентрация NaOH уменьшилась. Определяем новую концентрацию NaOH, учитывая разбавление раствора:
С(NaOH) = (90 * 0,1) / (100 + 10) = 9 / 110 = 0,0818 моль/л
[OH—] = 8,18 * 10-2 моль/л
рОН = — lg8,18*10-2 = 2 – 0,9128 = 1,0872
рН = 14 – 1,0872 = 12,9128 = 12,91
1.3 Добавлено 50,0 мл раствора HCl. В реакцию вступило NaOH (0,1*50)/0,1 = 50,0 мл. Осталось в растворе NaOH (100 — 50) = 50,0 мл. Новая концентрация NaOH :
С(NaOH) = (50 * 0,1) / (100 + 50) = 5 / 150 = 0,0333 моль/л
[OH-] = 3,33 * 10-2 моль/л
рОН = — lg 3,33 * 10-2 = 2 – 0,5224 = 1,4776
рН = 14 – 1,4776 = 12,5224 = 12,52
1.4 Добавлено 90,0 мл раствора HCl. В реакцию вступило NaOH (0,1*90)/0,1 = 90,0 мл. Осталось в растворе NaOH (100 — 90) = 10,0 мл. Новая концентрация NaOH :
С(NaOH) = (10 * 0,1) / (100 + 90) = 1 / 190 = 0,00526 моль/л
[OH-] = 5,26 * 10-3 моль/л
рОН = — lg 5,26 * 10-3 = 3 – 0,7210 = 2,279
рН = 14 – 2,279 = 11,721 = 11,72
1.5 Добавлено 99,0 мл раствора HCl. В реакцию вступило NaOH (0,1*99)/0,1 = 99,0 мл. Осталось в растворе NaOH (100 — 99) = 1 мл. Новая концентрация NaOH :
С(NaOH) = (1 * 0,1) / (100 + 99) = 0,1 / 199 = 0,0005025 моль/л
[OH-] = 5,03 * 10-4 моль/л
рОН = — lg 5,03 * 10-4 = 4 – 0,7016 = 3,2984
рН = 14 – 3,2984 = 10,7016 = 10,70
1.6 Добавлено 99,9 мл раствора HCl. В реакцию вступило NaOH (0,1*99,9)/0,1 = 99,9 мл. Осталось в растворе NaOH (100 – 99,9) = 0,1 мл. Новая концентрация NaOH :
С(NaOH) = (0,1 * 0,1) / (100 + 99,9) = 0,01 / 199,9 = 0,00005 моль/л
[OH-] = 5 * 10-5 моль/л
рОН = — lg 5 * 10-5 = 5 – 0,6990 = 4,301
рН = 14 – 4,301 = 9,699 = 9,70
2 этап – точка эквивалентности
Добавлено 100,0 мл раствора HCl. В этот момент NaOH полностью (весь) прореагирует с кислотой HCl. В растворе будут присутствовать соль – хлорид натрия NaCl и вода. Хлорид натрия не подвергается гидролизу, потому, что образована сильным основанием (NaOH) и сильной кислотой (HCl). рН раствора будет определяться автопротолизом воды:
Kw = [H+] * [OH—] = 10-14
[H+] = [OH—]*[H+] = √Kw = √10-14 = 10-7
рН = — lg10-7 = 7,0
3 этап – после точки эквивалентности
рН раствора будет определяться количеством добавленной кислоты. Концентрация Н+ — ионов растет пропорционально количеству добавленной HCl. Хлороводородная кислота — сильная, в растворе она диссоциирует полностью:
HCl ⇔ Н+ + Cl—
Концентрация Н+ — ионов равна молярной концентрации HCl.
3.1 Добавлено 100,1 мл раствора HCl. Избыток кислоты будет 100,1 – 100 = 0,1 мл.
Концентрация хлороводородной кислоты:
С(HCl)= (0,1*0,1)/(100+100,1)= 0,01 / 200,1 = 0,0000499 моль/л
[H+] = 4,99 * 10-5 моль/л
рН = — lg 4,99 * 10-5 = 5 – 0,6981 = 4,3019 = 4,30
3.2 Добавлено 101,0 мл раствора HCl.
Избыток кислоты будет
101 – 100 = 1 мл.
Концентрация хлороводородной кислоты:
С(HCl)= (1*0,1)/(100+101)= 0,1 / 201 = 0,0004975 моль/л
[H+] = 4,98 * 10-4 моль/л
рН = — lg 4,98 * 10-4 = 4 – 0,6972 = 3,3028 = 3,30
3.3 Добавлено 110,0 мл раствора HCl.
Избыток кислоты будет 110 – 100 = 10 мл.
Концентрация хлороводородной кислоты:
С(HCl)= (10*0,1)/(100+110)= 1 / 210 = 0,00476 моль/л
[H+] = 4,76 * 10-3 моль/л
рН = — lg 4,76 * 10-3 = 3 – 0,6776 = 2,3224 = 2,32
3.4 Добавлено 200,0 мл раствора HCl.
Избыток кислоты будет 200 – 100 =100 мл.
Концентрация хлороводородной кислоты: С(HCl)= (100*0,1)/(100+200)= 10 / 300 = 0,0333 моль/л
[H+] = 3,33 * 10-2 моль/л
рН = — lg 3,33 * 10-2 = 2 – 0,5224 = 1,4776 = 1,48
Полученные данные помещаем в таблицу.
Строим график в координатах: ось у (ординат ) – значения рН; ось х (абсцисс – объем добавленной HCl, мл.
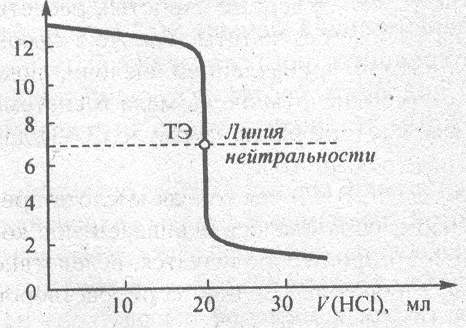
Прямая параллельная оси х и при рН = 7, пересекающая ось у – называют линией нейтральности. В начале титрования рН изменяется очень медленно. Если оттитровать половину (50 %) гидроксида натрия, то рН раствора изменится на 0,48 единиц (рН 13 – 12,52 = 0,48). Затем рН раствора изменяется более резко. Титрование последнего 0,1 мл NaOH изменяет рН на 2,7 единицы. Добавление избытка кислоты в 0,1 мл также изменяет рН раствора на 2,7 единицы.
Резкое изменение рН в области точки эквивалентности называют скачком титрования. Это наиболее важная часть кривой титрования, так как по ней производят выбор индикатора. Интервал перехода индикатора должен входить или захватывать скачок титрования. В данном случае при титровании сильного основания сильной кислотой скачок титрования большой – (9,7 – 4,3) = 5,4 единицы рН. В качестве индикаторов можно использовать: метилоранж (3,1 – 4,4; рТ = 4), метиловый красный (4,2 – 6,2; рТ= 5), фенолфталеин (8,2-10; рТ=9).
Прямую, параллельную оси абсцисс и при рН 7,0 пересекающую ось ординат, называют линией нейтральности.
Прямую, параллельную оси ординат и пересекающую ось абсцисс при V (NaOH) = 100,0 мл, называют линией эквивалентности. Левее этой прямой находится раствор, содержащий избыток кислоты, правее – раствор, содержащий избыток щелочи.
Точку пересечения кривой титрования с линией эквивалентности называют точкой эквивалентности, а точку пересечения кривой титрования с линией нейтральности называют точкой нейтральности. При титровании сильной кислоты сильным основанием точка эквивалентности и точка нейтральности совпадают.



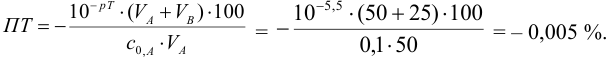
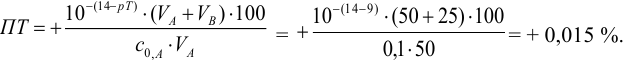
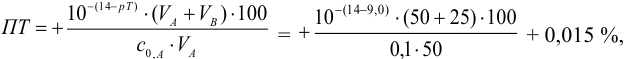
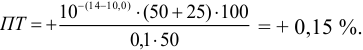
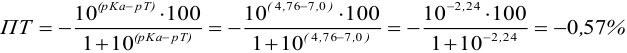
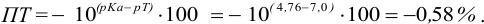
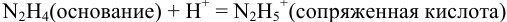
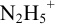
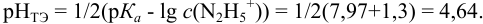
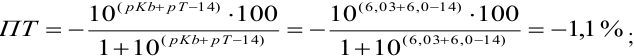
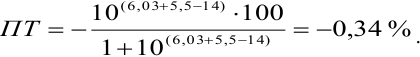

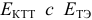 для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.
для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.