Преаналитический этап занимает в среднем до 58% от общего времени, требующегося на проведение анализа (от назначения до интерпретации результатов), и включает в себя несколько стадий:
- Назначение исследования;
- Подготовку пациента;
- Взятие пробы;
- Предварительную пробоподготовку;
- Хранение и транспортировку пробы;
- Подготовку пробы в лаборатории непосредственно перед проведением анализа.
На успех каждой стадии преаналитического этапа влияют разнообразные факторы, и основная задача специалистов, ответственных за его проведение, — помнить про эти факторы и исключить ошибки, которые в итоге могут привести к некорректным результатам лабораторных анализов.
Рассмотрим критерии в отказе к приему проб биоматериала лабораторией:
- Гемолиз/хилез (за исключением исследований, на которые наличие гемолиза/хилеза не влияет).
Гемолиз — это процесс разрушения эритроцитов в следствие воздействия физических факторов и выход гемоглобина в сыворотку крови. В итоге сыворотка окрашивается после центрифугирования пробы от светло-розового до красного, зависит от степени разрушения эритроцитов.
Хилез – лабораторное понятие, которое характеризует молочный окрас пробы биологического материала вследствие большого содержания микрочастиц жира в сыворотке крови. - Расхождение между данными заявки и этикетки (штрихкод);
- Отсутствие этикетки с данными пациента или штрихкодом на пробирке;
- Не корректная маркировка пробирки штрихкодом;
- Невозможность прочесть паспортные данные пациента на заявке или этикетке пробирки;
- Отсутствие названия отделения, номера истории болезни, фамилии лечащего врача, подписи процедурной сестры, четкого перечня необходимых исследований;
- Недостаточное количество биоматериала (не до метки), нарушение соотношения кровь/реагент в пробирках с антикоагулянтами;
- Взятый биоматериал находится не в той пробирке (например, для клинического анализа крови не хватило биоматериала и в пробирку с лиловой крышкой перелили кровь из пробирки на биохимию). Данный способ категорически запрещен, т. к. происходит смешивание реагентов исследовать данный образец становится невозможно;
- Наличие сгустков в пробирках с антикоагулянтами (лиловая, зеленая, голубая крышки);
- Биоматериал взят в просроченные пробирки.
Все вышеизложенные причины должны отслеживаться и фиксироваться в лаборатории ее сотрудниками.
Как медицинскому персоналу избежать данных ошибок при проведении процедуры венепункции:
Предотвращение гемолиза:
- Исключите получение проб крови из гематомы;
- Не используйте иглы маленького калибра на стандартных, пальпирующихся, с тонусом венах;
- Не прикасаясь к выбранному участку прокола, убедитесь, что он сухой, после обработки места венепункции антисептиком;
- Медленные “начало и конец” получения проб крови могут стать причиной гемолиза;
- Не набирайте пробы крови через шприц с последующим переливанием в пробирки. Данный метод механически воздействует на пробу разрушая клетки крови;
- Не стучите по вене, если не можете ее прощупать. Поищите другое место прокола, попросите пациента выпить стакан воды перед венепункцией, используйте поглаживающие, но с усилием движения ладонью от кисти к локтевому сгибу или приложите теплый компресс на место предполагаемой пункции;
- Не накладывайте жгут слишком туго;
- Ослабляйте или снимайте жгут после попадания иглой в вену;
- Не трясите полученные пробы, используйте правильную технику перемешивания (плавные движения с поворотом на 180 градусов 3–5 раз);
- Не храните пробы крови у отопительных приборов, не храните пробы крови в морозильном отделении холодильника;
- Соблюдайте правила транспортировки биоматериала в соответствии с временем года.
Предотвращение появления сгустков в пробах:
- Хорошо перемешивайте пробы с фиолетовой и голубой крышками, используя правильную технику перемешивания;
- Добирайте строго до метки пробы с голубой и фиолетовой, зеленой крышками;
- Не набирайте пробы крови в шприц, он не обработан реагентами в отличие от вакуумной пробирки. Ввиду отсутствия моментального смешения крови и реагента при использовании шприца образуются микро и макросгустки, которые не должны присутствовать в пробирках с антикоагулянтами.
Предотвращение не правильного формирования сгустка в пробирках на биохимию
- В момент взятия пробы крови пробирки с желтой/красной крышками необходимо сразу ставить в штатив;
- Перед транспортировкой пробирок с желтой/красной крышками необходимо чтобы они отстоялись 30 минут.
Предотвращения появления хилеза проб
- Всегда уточняйте до получения проб крови соблюдал ли пациент правила подготовки перед процедурой венепункции.
В любом лечебно-диагностическом учреждении должен присутствовать СОП (стандарт проведения операционной процедуры). Он поможет избежать многих ошибок преаналитического этапа, в том числе и вышеизложенных, регламентирует работу среднего медицинского персонала и лаборатории и поможет зафиксировать правила работы на административном уровне.

Ошибки ПЦР
4. Ошибки ПЦР
Выделяют три основных этапа при подготовке и проведении анализа методом ПЦР, в которых наиболее часто допускают ошибки, приводящие к получению ложноположительных и ложноотрицательных результатов:
zПреаналитический этап
zАналитический этап
zПостаналитический этап
4.1.Ошибки преаналитического этапа
Данный этап включает взятие биоматериала, его хранение и транспортировку, пробоподготовку (СП 1.2.036-95, СП 1.3.1285-03 и СП 1.3.2322-08).
4.1.1. Место взятия биологического материала
Впервую очередь, необходимо правильно определить место взятия биологического материала для исследования, а именно: место предполагаемой локализации инфекционного процесса.
Впервую очередь, это касается тех микроорганизмов, для которых известна тропность ко многим видам тканей, например, M.tuberculosis (обусловливает развитие внелегочных форм туберкулеза, в том числе: органов пищеварительной и мочеполовой систем; центральной нервной системы и мозговых оболочек; костей и суставов; кожи; глаз); C.trachomatis (вызывает воспалительные заболевания экстрагенитальной локализации – воспалительные заболевания органов малого таза и брюшины, и восходящий инфекционный процесс – поражения слизистой оболочки матки, труб, яичников, околоматочных связок). Исходя из этого, выбор универсального материала, например, мокроты для выявления кислотоустойчивых микобактерий, либо соскоба из влагалища, цервикального или мочеиспускательного каналов для выявления C.trachomatis может привести к ложноотрицательным результатам в ПЦР.
Кроме того, распространенным, но при этом ошибочным является подход к выявлению спектра патогенных микроорганизмов, особенно возбудителей инфекций, передающихся половым путем (ИППП), в крови пациента. Необходимо учитывать, что для большинства возбудителей ИППП гематогенный путь распространения не является основным, либо не доказан, соответственно, кровь, как материал для исследования, не является пригодной.
Кроме того, даже в случае присутствия в крови отдельных клеток микроорганизмов – возбудителей ИППП, вероятность их обнаружения крайне мала, поскольку оказывается ниже предела чувстви-
тельности стандартных тест-систем.
4.1.2. Правильность взятия биологического материала
Второй распространенной ошибкой преаналитического этапа является неправильное взятие материала на исследование. Даже при правильном определении места взятия материала необходимо учитывать тот факт, что он должен содержать максимальную концентрацию искомых микроорганизмов, а также быть лишен нежелательных примесей, ингибирующих ПЦР.
29

Основы полимеразной цепной реакции (ПЦР)
Так при исследовании на наличие внутриклеточных патогенов, проба должна содержать максимальное количество клеток, например, эпителиальных для выявления C.trachomatis, ВПЧ. Для выяв-
ления вируса Эпштейн-Барр (ВЭБ) и цитомегаловируса (ЦМВ) целесообразно использовать лейкоцитарную массу крови. Принципиальным является также стадия заболевания, а именно: осуществляется ли взятие материала в период ремиссии или обострения, что напрямую влияет на концентрацию искомых микроорганизмов в пробе.
Кроме того, необходимо минимизировать количество примесей в пробе, например, слизи, гноя и крови в эпителиальном соскобе, для чего их избыток необходимо удалить стерильным ватным тампоном непосредственно перед взятием образца.
Таким образом, следующей распространенной ошибкой может стать неправильная обработка материала.
4.1.3. Обработка биологического материала
При работе с кровью важно учитывать тот факт, что для предотвращения ее свертывания в процессе доставки необходимо использовать антикоагулянты. Однако, наиболее распространенный антикоагулянт – гепарин является мощным ингибитором ПЦР, поэтому его использование в данном случае недопустимо.
Относительно гепарина следует заметить, что его присутствие в крови у пациентов, находящихся на антикоагулянтной терапии, также может привести к получению недостоверных результатов в ПЦР, поэтому забор крови у таких пациентов рекомендовано проводить до очередного введения препарата.
При необходимости использовать в качестве материала для исследования мочу (клеточный осадок первой порции утренней мочи) важно тщательно промыть пробу физиологическим раствором. Это обусловлено тем, что осадок содержит большое количество солей и мочевины, которые, при ис-
пользовании технологий флуоресцентной детекции, денатурируют зонды, приводя к ложноположительным результатам.
4.1.4. Хранение биологического материала
Принципиальным для получения адекватных результатов ПЦР является хранение биологического материала.
Необходимо помнить о температуре хранения биологического материала, а также сроках и способах его доставки в ПЦР-лабораторию в случае, если транспортировка требует значительного времени. При нарушении сроков хранения или транспортировки биоматериала ДНК или РНК возбудителя могут разрушаться, что приведет к ложноотрицательным результатам. Образцы рекомендуется хранить при температуре от 2 до 8°С в течение 24-48 часов, для более длительного хранения необходимо заморажива-
ние. Единственное исключение – цельная кровь, которая не подлежит замораживанию.
При проведении исследований на наличие вирусов гепатитов В и С, ВИЧ и т.д. необходимо получение плазмы крови, и в этом случае возможно однократное замораживание пробы.
В настоящее время, процессы взятия материала, его предварительной обработки, хранения и перевозки, передачи исследуемого материала в другие организации осуществляются согласно
инструктивно-методическим документам, регламентирующим выполнение исследований для каждого вида возбудителя инфекций, инструкциям к наборам реагентов и в соответствии с СП 1.2.036-95, СП 1.3.1285-03 и СП 1.3.2322-08.
30

Ошибки ПЦР
4.2. Ошибки аналитического этапа
4.2.1. Выбор системы пробоподготовки
Проведение собственно лабораторного исследования также может сопровождаться рядом ошибок, среди которых одной из основных является неправильный выбор системы пробоподготовки.
Возвращаясь к сказанному выше, наиболее часто в лаборатории используют следующие варианты пробоподготовки:
zЭкспресс-методы – упрощенные методики, основанные на кипячении, протеолизе
zСорбентные методы
zМетоды одновременного выделения ДНК/РНК, выделение из цельной крови
Выбор метода выделения должен определяться характером биоматериала, степенью его загрязнения потенциальными ингибиторами ПЦР.
Использование экспресс-методов существенно сокращает время пробоподготовки, делает минимальными потери ДНК в процессе выделения и существенно сокращает риск кроссконтаминации, что представляется весьма привлекательным для рутинного использования в лаборатории.
Однако, существенным недостатком данной группы методов является низкая степень очистки пробы от ингибиторов, следствием чего 3-5% образцов дают недостоверные результаты в ПЦР.
При необходимости использования экспресс-методов со «сложными» образцами возможно введение дополнительных способов очистки и концентрации материала, например, в случае избытка слизи в пробе (для мокроты и эякулята, бронхоальвеолярного лаважа, промывных вод бронхов, трахеального смыва, синовиальной и плевральной жидкости) целесообразным является ее предварительная обработка муколитиками, типа муколизина.
Тем не менее, даже предварительная обработка материала не подходит для бактерий с крепкой клеточной стенкой и может привести к ложноотрицательным результатам в ПЦР.
Вслучае исследования крови на наличие вирусов, особенно относящихся к группе РНКсодержащих (ВИЧ, гепатит С и т.д.), вероятность получения ложноотрицательных результатов велика по следующим причинам: исходно низкая вирусная нагрузка и течение болезни в периоде ремиссии (концентрация вирусных частиц ниже предела чувствительности тест-системы); неравномерное распределение материала по пробиркам в дублях; нестабильность исходно выделяемой РНК; большие потери материала на этапе пробоподготовки. Повышение эффективности выделения и получение адекватных результатов ПЦР возможно при использовании гемолитика для пред-
варительной обработки цельной крови и увеличения выхода осадка лейкоцитов.
Вданном случае экспресс-методы проявляют крайне низкую эффективность, и наиболее правильным представляется использование сорбентных методов выделения или методов, позволяющих одновременно выделять ДНК/РНК. Данные методы можно определить как «универсальные». Однако для них характерно:
|
– длительное время выделения; |
– опасность кросс-контаминации; |
|
– потери ДНК с сорбентом; |
– зависимость от качества сорбента. |
31

Основы полимеразной цепной реакции (ПЦР)
4.2.2. Генетическая изменчивость микроорганизмов
Вероятность получения ложноотрицательного результата может быть обусловлена изменчивостью микроорганизмов. При конструировании тест-системы в качестве мишени используется высоко консервативный участок генома. Однако изменчивость микроорганизмов может приводить к тому, что некоторые генотипы или штаммы исследуемого возбудителя могут приобретать мутации в амплифицируемом участке ДНК и становиться недоступными для анализа данной тест-системой.
Например, у 30% пациентов с установленным диагнозом «хламидиоз», обусловленным С.trachomatis, при проведении исследований методом ПЦР результат анализа был отрицательным при полном соблюдении технологии. Это обусловлено тем, что часть коммерческих тест-систем в качестве мишени использовали плазмиду патогена, тогда как патологический процесс был связан с бесплазмидными штаммами бактерий.
4.2.3. Технологические ошибки
Основной ошибкой аналитического этапа при реализации метода ПЦР с детекцией результатов с помощью гель-электрофореза является риск принять неспецифичные фрагменты за специфичные, если они близки по длине и нет возможности сравнить с К+ и маркером длин фрагментов.
Проблемой, наиболее актуальной для лабораторий, работающих с ПЦР в формате FLASH, является неправильное приготовление фоновых пробирок. В первую очередь, это связано с тем, что в разных сериях реактивов могут отличаться концентрации компонентов реакционной смеси, поэтому высока вероятность различного уровня флуоресценции. Приготовление фоновых пробирок без учета серии тест-системы может привести к большому количеству недостоверных результатов.
Кроме того, при приготовлении фонов необходимо исключить добавление в них полимеразы, так
как, если в тест-систему входит внутренний контроль и/или отрицательный образец проходит стадию выделения, все отрицательные значения будут недостоверными.
Еще одним фактором возникновения ложноположительных и ложноотрицательных результатов в ПЦР с детекцией по конечной точке может быть неправильное хранение фоновых пробирок. Это объясняется тем, что при неправильном хранении зонды в фоновых пробирках могут разрушаться, и нормировочные значения существенно увеличиваются за срок от нескольких часов до нескольких дней, при этом значения флуоресценции в образцах оказываются в большей или меньшей степени занижены.
Главным критерием достоверности полученных результатов в данном случае могут служить отрицательные пробы. При отсутствии расхождений между фоновыми и амплификационными пробирками отрицательные образцы имеют значения флуоресценции близкие к 1 или, в редких случаях, незначительно выше.
Если значения флуоресценции в одном или нескольких образцах или отрицательном контроле существенно ниже 1, с большой долей вероятности можно утверждать, что фоновые пробирки не соответствуют данному исследованию, в этом случае необходимо их поменять.
В случае неправильного хранения амплификационных пробирок (длительное пребывание пробирок при комнатной температуре) фоновая флуоресценция в них возрастает, в то время как в фоновых пробирках флуоресценция остается неизменной. В этом случае увеличивается
32

Ошибки ПЦР
содержание положительных результатов с низкими значениями флуоресценции. Результаты при этом получаются такие же, как при контаминации в лаборатории, однако в данном случае все низ-
кие значения флуоресценции будут примерно одинаковы, что в случае контаминации встречается достаточно редко, поскольку маловероятно, что во все отрицательные пробирки попадет равное количество постороннего материала.
Несмотря на очевидные преимущества метода ПЦР с детекцией результатов в режиме реального времени, возможны ошибки аналитического этапа, обусловленные следующим: колебанием флуоресценции в приборе, которое может быть зафиксировано программой, как ложноположительный или ложноотрицательный результат. В этом случае необходимо провести анализ индивидуальной кривой. Пороговая линия должна пересекать индивидуальную кривую в области начала экспоненциального роста флуоресценции.
4.3. Ошибки постаналитического этапа
Основной проблемой постаналитического этапа является неверная интерпретация врачом результатов ПЦР-анализа вследствие ошибочных представлений об инфекционном агенте или о возможностях метода.
4.3.1. Ошибки интерпретации результатов ПЦР
Одной из наиболее распространенных ошибок при интерпретации результатов ПЦР-анализа является не принятие во внимание особенностей персистенции и элиминации возбудителя. Например, назначение контрольного исследования через 1 неделю после окончания курса антибиотико-
терапии ряда инфекционного заболеваний. В подавляющем большинстве случаев результат анализа на выявление микроорганизма – возбудителя инфекции будет положительным. Из этого можно сделать вывод о неэффективности проведенной терапии. Такое заключение ошибочно в силу того, что ДНК микроорганизма может сохраняться в течение нескольких недель после его элиминации и не свидетельствует о жизнеспособности. Если речь идет о микроорганизмах, ассоциированных с эпителием, окончательный вывод об излеченности, можно сделать не ранее, чем через 5-6 недель после курса антибиотикотерапии. Это срок необходим для смены эпителиального слоя.
С другой стороны, если целью анализа является оценка состояния микрофлоры урогенитального или желудочно-кишечного трактов, то назначение исследования через 1-2 недели на фоне проведенной антибактериальной терапии, скорее всего, приведет к отрицательному результату в ПЦР. В случае сбалансированной и устойчивой системы, ее самовосстановление произойдет не ранее 2 нед. – 1
месяца, тогда проведение ПЦР анализа будет информативным и позволит оценить динамику состояния, либо определить меры коррекции.
Другая ошибка – клиническая оценка положительного результата ПЦР, определение его прогностической значимости. Показано, что только у 40% – 60% лиц с обнаруженной в крови методом ПЦР ДНК цитомегаловируса клинически может развиться заболевание. В данной ситуации при
оценке результатов исследования, совершается типичная ошибка, заключающаяся в отождествлении двух принципиально различных понятий – «инфицированность» и «инфекционный процесс».
33

Основы полимеразной цепной реакции (ПЦР)
То же можно сказать и про ПЦР – диагностику инфекций, обусловленных ВПЧ. Метод ПЦР крайне важен с точки зрения возможности идентифицировать отдельные типы ВПЧ (высокого и низкого
онкогенного риска). Однако существует большой риск интерпретировать положительный результат с точки зрения прогноза развития неопластических процессов шейки матки, хотя в 80-90 % случаев инфицирование ВПЧ носит кратковременный характер и заканчивается спонтанной элиминацией вируса (через 6-24 месяца). Положительный результат при лабораторном исследовании имеет значимость, если на фоне ВПЧ – инфекции имеется картина неоплазии эпителия шейки матки, что позволяет прогнозировать степень канцерогенного риска.
Еще одной ошибкой является неверная интерпретация результатов количественного ПЦРанализа. В этом случае необходимо четко определить цель назначения данного вида исследования.
Например, опубликованный в 2010 г УДК [616.36-002.12:578.891]-07/08 «Протокол диагностики и лечения больных вирусными гепатитами В и С» регламентирует количественные исследования ДНК вирусного гепатита В и, в соответствии с рекомендациями Европейской ассоциации по изучению печени 2009 г. (EASL Clinical Practice Guidelines 2009), определяет показания для проведения противовирусной терапии HBV при наличии уровня ДНК HBV в крови более 10 000 копий/мл (2000 ME/мл). Сероконверсия по HBeAg в сочетании со снижением уровня ДНК HBV ниже 2000 МЕ/мл (104 копий/мл) расценивается как достижение эффекта терапии.
Однако, проведение количественных исследований методом ПЦР для целого спектра бактериальных и вирусных инфекций на данный момент не регламентировано и не определены критерии диагностической и клинической значимости получаемых результатов. В связи с этим, интерпретация результатов исследования может носить субъективный характер и определять неверную тактику ведения пациента.
Например, количественный анализ отдельных представителей условно-патогенной флоры урогенитального тракта (Ureaplasma, Gardnerella) без учета количественных показателей ведущего пред-
ставителя нормофлоры – бактерий рода Lactobacillus (обусловливает колонизационную резистентность, поддерживает кислую реакцию среды), а так же при отсутствии клинических проявлений воспаления, дисбиоза и жалоб пациента, может привести к гипердиагностике и необоснованному назначению антибактериальной терапии. Как следствие: стремительный рост антибиотикорезистентности, увеличение числа случаев рецидивирующего бактериального вагиноза и дисбиоза.
Аналогичная ситуация складывается и при интерпретации результатов количественного исследования ВПЧ высокого онкогенного риска. На сегодняшний день отсутствует прямое доказательство роли исходной вирусной нагрузки в развитии неопластических процессов шейки матки и прогнозировании их исхода.
Кроме того, на этапе анализа и интерпретации результатов ПЦР возникают и другие проблемы, которые можно обозначить, как несовпадение результатов при использовании различных методов
исследования (например, ПЦР и ИФА, ПЦР и бактериальный посев, ПЦР и микроскопические методы исследования).
4.3.2. Сравнение результатов ПЦР и ИФА
В случае сравнения результатов, полученных в ИФА и ПЦР, несовпадения могут быть следующими:
zположительный результат в ПЦР и отрицательный результат в ИФА;
zотрицательный результат ПЦР и положительный результат ИФА.
34

Ошибки ПЦР
В первом случае, и это наиболее актуально для выявления вирусов гепатита С и иммунодефицита человека, данный факт может быть обусловлен наличием «серологического окна». В усло-
виях постоянно повышающихся концентраций антигена в результате репродукции вируса происходит активное снижение концентрации антител за счёт включения их в состав иммунных комплексов «антиген-антитело». Также происходит подавление гуморального звена иммунного ответа в результате синтеза набора цитокинов, стимулирующих клеточное звено иммунитета. Как следствие, в течение инфекционного процесса наблюдается длительное «серологическое окно» от момента заражения до сероконверсии.
Обычно заметное количество антител к ВИЧ появляется в крови через 2-10 недель после заражения, однако разброс во времени может быть весьма велик. Так, у 90-95 % зараженных они обнаруживаются в течение 3-х месяцев после заражения, у 5-9 % – через 6 месяцев, а у 0,5-1 % – и в более поздние сроки.
Выявление ДНК/РНК вируса методом ПЦР позволяет уменьшить продолжительность «серологического окна» в среднем на 11 дней и обнаружить патогена уже через 1-2 недели после заражения.
Проведение ПЦР позволяет выявить РНК вируса гепатита С не только в сыворотке крови, но и в биоптате печени, что важно при подтверждении роли вируса гепатита С в формировании гепатоцеллюлярной карциномы. У подобных больных РНК вируса гепатита С регистрируется в гепатоцитах и при отсутствии anti-HCV и РНК вируса гепатита С – в сыворотке крови. У ряда больных с самоограничивающимся течением инфекции anti-HCV не появляются никогда.
Кроме того, отсутствие положительных результатов ИФА на фоне положительного результата в ПЦР может наблюдаться у иммуносупрессированных пациентов и новорожденных с перинатальной инфекцией (нетипичная картина, связанная с антителами матери). Так, при хроническом хламидиозе до 5% больных имеют титр антихламидийных антител, не превышающий критическо-
го уровня.
Аналогичная проблема может возникнуть при диагностике сифилиса, в том случае, если заболевание проходит стадию первичного серонегативного сифилиса, когда стандартные серологические реакции крови еще отрицательные (первые 3-4 недели от возникновения твердого шанкра).
При заболеваниях, передающихся половым путем, скрытый период инфекции, когда уровень иммуноглобулинов не больше нормы, составляет в среднем 14 дней.
Кроме того, важно учитывать возможность высокой генетической изменчивости микроорганизмов, которая приводит к формированию серонегативных штаммов.
При обследовании новорожденных на наличие внутриутробных инфекций может быть получен ложноотрицательный результат серологического исследования не только вследствие влияния высокой концентрации материнских антител класса IgG (маскируют наличие IgM у ребенка), но и развития иммунологической толерантности.
Иммунологическая толерантность – неспособность организма к иммунному ответу на определенный антиген. Сроки ее формирования варьируют от нескольких часов до нескольких суток, а ее длительность зависит от персистенции антигена в организме и скорости образования иммунокомпетент-
ных клеток из их предшественников. Индукции толерантности способствует неспецифическая иммунодепрессия (в том числе, под влиянием лекарственных препаратов).
35

Основы полимеразной цепной реакции (ПЦР)
Генетически обусловленная серонегативность ряда заболеваний делает их недоступными для анализа стандартными серологическими методами, а при исследовании методом ПЦР обеспечивается положительный результат, например, серонегативные спондилоартриты (ССА) – заболевания, которые характеризуются поражением крестцово-подвздошных сочленений и имеют тенденцию к семейной агрегации. В группу ССА включают 10 заболеваний: идиопатический анкилозирующий спондилоартрит, псориатический артрит, болезнь Рейтера, язвенный колит, болезнь Крона, болезнь Уиппла, ювенильный хронический артрит, реактивный артрит (иерсиниозный, шигеллезный, сальмонеллезный), острый передний увеит, синдром Бехчета, объединенных наличием при обследовании HLA-B27 – антигена.
Еще один вариант несовпадения результатов ПЦР и ИФА (отрицательный результат в ПЦР и положительный результат в ИФА) может быть обусловлен выявлением «иммунологического следа» – остаточный уровень IgG после ранее перенесенной инфекции. У некоторых людей повышенный уровень антител может сохраняться многие месяцы и годы после полного выздоровления, что связано с индивидуальными особенностями иммунной системы.
Другой причиной расхождения результатов может стать использование родоспецифических тест-систем для ИФА.
Например, в случае подозрений на атипичную пневмонию выбор тест-системы, выявляющей несколько видов хламидий, в первую очередь, респираторных (С. pneumonia, C. pecorum, C. рsitaci), определяет получение положительного результата. При этом, направление на анализ методом ПЦР с указанием только наиболее распространенного этиологического агента хламидийной пневмонии – С. рneumonia может привести к получению отрицательного результата. Это будет связано с использованием видоспецифической тест-системы, направленной на выявление только указанного вида микроорганизма, тогда как возбудителем инфекционного процес-
са может быть C. рsitaci.
Еще одним фактором несовпадения данных ПЦР и ИФА является зависимость результатов анализа методом ПЦР от используемого материала.
Материал для ПЦР должен быть получен из места предполагаемой локализации инфекционного и/или неинфекционного воспалительного процесса, а для получения достоверного результата ИФА данный подход не является критичным.
Например, при хламидийном сальпингите (воспаление маточной трубы) в крови пациентов будет определяться устойчивый уровень специфических антител, тогда как при анализе соскобного материала из влагалища или шейки матки методом ПЦР хламидии обнаружены не будут. Учитывая тот факт, что в 50% случаев заболевание протекает атипично интерпретация результата ПЦР как отрицательного, может привести к тяжелым последствиям, поэтому для подтверждения положительного результата ИФА и постановки диагноза показана лапароскопия (гидросальпинкс).
Тем не менее, сравнивая возможности ИФА и ПЦР в диагностике заболеваний, следует отметить, что метод ПЦР не позволяет установить стадию инфекционного процесса. В связи с этим, роль ИФА в интерпретации результатов исследования может быть весьма существенной, поскольку данный метод позволяет определить авидность антител.
36

Ошибки ПЦР
Авидность – это прочность связи между антителом и антигеном, которая отражает сроки заражения и длительность инфекционного процесса. Определение индекса авидности (ИА) ниже 30-35%
указывает на свежую первичную инфекцию, показатель авидности, равный или превышающий 40%, указывает на то, что в сыворотке содержатся анамнестические высоко-авидные антитела, свидетельствующие об инфекции в прошлом. ИА в интервале 31-39% может свидетельствовать о поздней стадии первичной инфекции или недавно перенесенной инфекции только при условии выявления антител в высокой концентрации.
4.3.3. Сравнение результатов ПЦР и микроскопии
На данный момент микроскопические методы исследования широко применяют в диагностике инфекционных болезней бактериальной этиологии, паразитарных и (реже) вирусных заболеваний.
В повседневной практике лаборатории микроскопическое исследование, как правило, используют для ускоренной ориентировочной диагностики.
Основные задачи микроскопии:
zвыявление возбудителя в клиническом материале;
zориентировочная идентификация на основе определения характерных морфологических и тинкториальных признаков микроорганизмов;
zизучение окрашенных мазков из колоний чистых культур.
Этот метод рассматривается, как самый быстрый и дешевый, его использование связано с мини-
мальными требованиями к организации лаборатории.
Тем не менее, существует ряд ограничений в использования микроскопии для диагностики инфекционных заболеваний:
zнизкая чувствительность;
zсубъективность оценки результатов;
zограниченный спектр выявляемых микроорганизмов;
zприблизительная количественная оценка.
Так, при диагностике трихомониаза микроскопический метод имеет самую низкую чувствительность: в среднем – 30% (для женщин – 50-60%, для мужчин – 10-12%), тогда как метод ПЦР достоверно определяет возбудителя в 90-96% случаев. Такие показатели микроскопии обусловлены потерей микроорганизмом характерной подвижности после извлечения во внешнюю среду.
Особенно затруднительна диагностика в случае низкотитражных препаратов или препаратов, содержащих значительное количество клеток эпителия и лейкоцитов. В очаге воспаления трихомонада часто представлена округлыми формами, напоминающими полиморфноядерные лейкоциты, кро-
ме того, типичные морфологические признаки теряются во время фиксации и окрашивания, создавая трудность для этиологической идентификации.
Сравнение чувствительности микроскопических методов исследования и ПЦР применительно к таким микроорганизмам, как N.gonorhoeae и C.trachomatis, свидетельствует, что в первом случае частота выявляемости патогена в микроскопии у мужчин – 80-95%, у женщин – 30-50%, а во вто-
ром – 10-12%. При этом, использование метода ПЦР дает возможность определять указанные микроорганизмы с чувствительность более 95%.
37
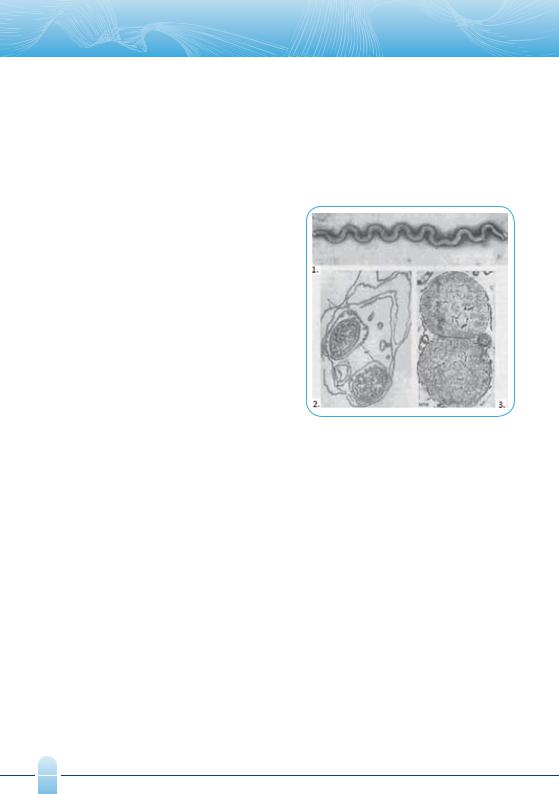
Основы полимеразной цепной реакции (ПЦР)
Микроскопия микроорганизмов в нативном состоянии (главным образом фазово-контрастная) имеет ограниченное применение, главным образом, при выявлении их подвижности и изучении мор-
фологии микроорганизмов, лишенных клеточной стенки (микоплазм и L-форм бактерий).
L-формы – бактерии, частично или полностью лишённые клеточной стенки, но сохранившие способность к развитию. Возникают спонтанно или индуцировано – под воздействием агентов, блокирующих синтез клеточной стенки: антибиотиков, ферментов, ультрафиолетовых и рентгеновских лучей,
|
аминокислоты глицина. |
|
|
L-форма обнаружена у патогенных видов холер- |
|
|
ного вибриона, токсигенных штаммов Clostridium |
|
|
tetani, Treponema pallidum (рис. 9). L-формы неред- |
|
|
ко обнаруживаются в организме при таких длитель- |
|
|
но протекающих патологических процессах, как бру- |
|
|
целлез, септический эндокардит. |
|
|
Важно учитывать, что существенным ограничени- |
|
|
ем микроскопических исследований является также |
|
|
использование их для количественного анализа. На- |
|
|
пример, анализ состояния биоценоза урогенитально- |
|
|
го тракта предусматривает количественное опреде- |
|
|
ление широкого спектра условно-патогенных аэроб- |
|
|
ных и анаэробных микроорганизмов, для которых |
|
|
доказана роль в развитии воспалительных процес- |
Рис. 9. Treponema pallidum, |
|
сов органов малого таза на фоне снижения количе- |
|
|
ства ключевого представителя нормофлоры – бакте- |
штамм Никольса (1), |
|
рий рода Lactobacillus. |
инцистированная трепонема (2), |
|
Традиционно при световой микроскопии выяв- |
ультраструктура L-форм трепонемы (3). |
|
ляют не более 10 морфотипов: Lactobacillus spp., |
Gardnerella vaginalis, Bacteroides spp., Mobiluncus spp., Fusobacterium spp., Leptotrihia spp., Veillonella spp., Candida spp. При этом морфотипы факультативно-анаэробных бактерий, обнаруживаемых в мазках, морфологически однотипны у многих видов и родов бактерий – колиформные палочки или грамположительные кокки.
Например, Atopobium vaginae не имеет специфических микроскопических признаков, как G.vaginalis и Mobiluncus spp., и выглядит под микроскопом как обычная коринобактерия, довольно часто встречающаяся у здоровых женщин. При этом данный микроорганизм является одним из основных факторов развития рецидивирующего бактериального вагиноза и его осложнений.
Кроме того, при микроскопии мазков можно выявить микроорганизмы, присутствующие в биоматериале в количестве, обычно превышающем 105 КОЕ/мл, тогда как многие факультативноанаэробные и аэробные бактерии могут проявлять патогенный эффект при сравнительно неболь-
шом их количестве (до 104 КОЕ/мл), которое не выявляется при микроскопии. Поэтому диагностическая ценность микроскопического исследования вагинального отделяемого резко снижается.
38
Соседние файлы в предмете Молекулярная биология
- #
- #
19.10.202028.35 Mб32Льюин Б. — Гены (2012, 9-е издание)_copy.djvu
- #
- #
- #
16.09.202019.92 Mб66Попов В.В. Геномика с молекулярно-генетическими основами.pdf
- #
Согласно данным ВОЗ, удельный вес лабораторных анализов составляет 75–80 % от общего числа диагностических исследований, выполняемых в медорганизациях.
Служба значительно эволюционировала: если раньше лаборатория была придатком в поиске факторов риска, постановке диагноза, назначении лечения, то сегодня она является объединяющим механизмом на всех этапах взаимодействия врача и пациента. Централизация лабораторных исследований — мировая тенденция реформирования клинической лабдиагностики. Особое значение имеет преаналитический этап клинических лабораторных исследований.
Лабораторная диагностика
Важная составляющая
Основной целью централизации лабораторных исследований является повышение эффективности лечебно-диагностического процесса за счет расширения объема лабораторной, диагностически значимой информации, которая поступает лечащим врачам из централизованной лаборатории.
Согласно постановлению коллегии Минздрава от 25.07.2018 № 14.4 «О совершенствовании работы службы лабораторной диагностики», централизация лабораторий, направленная на увеличение доступности лабораторных исследований, определена основным стратегическим моментом развития службы клинической лабораторной диагностики страны.
Важнейшей составляющей централизации является процесс взаимодействия с внешним заказчиком (медучреждением) на преаналитическом этапе оказания лабораторных услуг. Преаналитический этап включает прием пациента врачом, назначение лабораторных исследований, заполнение бланка направления, получение пациентом инструкций об особенностях подготовки к сдаче анализов или сбору биологического материала, взятие проб, доставку материала в лабораторию.
При централизации для лаборатории существенно увеличивается число пунктов сбора проб биологического материала, значительно расширяется спектр заказываемых тестов, изменяется структура проб биологического материала, ритм и временной период их поступления в лабораторию.
Взаимодействие централизованной лаборатории с заказчиком на преаналитическом этапе предполагает обучение врачей, медсестер, курьеров, обеспечение их инструкциями по подготовке пациентов к лабораторным исследованиям, правилам взятия, сбора и подготовки проб к транспортировке, организацию логистики доставки. Порядок организации взятия проб биологического материала и доставки его в централизованную лабораторию является одним из важнейших моментов обеспечения правильного взаимодействия лаборатории и учреждения здравоохранения.
Централизация лабораторных исследований предусматривает особые требования к организации преаналитического этапа, строгое выполнение которых позволит обеспечить получение качественных результатов. Любые неточности на этапе назначения лабораторных исследований будут существенным образом снижать эффективность лечебно-диагностического процесса.
Большинство ошибок в процессе лабораторного анализа — от назначения теста до интерпретации результатов — происходит до того, как образец попал в лабораторию, т. е. вне прямого контроля лаборатории. По данным различных исследований, на преаналитический этап приходится от 46 % до 68 % всех лабораторных ошибок.
Наиболее частые ошибки преаналитического этапа:
- отсутствие образца или перечня назначенных исследований;
- ошибки идентификации образца (этикетка,сопроводительный документ);
- гемолиз in vitro (в пробирке);
- сгустки в образце крови/плазмы;
- неправильная пробирка/контейнер;
- недостаточное количество образца (объем пробы);
- неправильное соотношение кровь/антикоагулянт;
- недостаточное перемешивание образца после взятия;
- неадекватные условия хранения и транспортировки;
- неправильный режим центрифугирования (время/скорость).
Рекомендации
При определении приемлемости выявленных ошибок рекомендуется использовать целевые уровни индикаторов качества преаналитического этапа, установленные Международной федерацией клинической химии и лабораторной медицины (IFCC). Ошибки преаналитического этапа могут существенно исказить состав или свойства биологического материала и таким образом существенно снизить диагностическую ценность результата лабораторного исследования. Частота таких ошибок зависит от уровня технологической дисциплины в направляющей организации здравоохранения, качества администрирования этого этапа.
Основные причины большого количества ошибок:
- отсутствие стандартов качества выполнения процедур преаналитического этапа;
- неиспользование для взятия и сбора биоматериала одноразовых безопасных приспособлений по причине существующего ложного представления об их высокой стоимости;
- недостаточные знания и качество обучения среднего медперсонала правилам и технике выполнения процедур преаналитического этапа.
Прогресс лабораторных технологий, оснащение медицинской лаборатории современными автоматическими анализаторами позволили получать существенно более точные результаты анализов. Новые автоматические анализаторы весьма чувствительны к качеству исследуемого биоматериала, что предъявляет более высокие требования к условиям взятия, хранения и срокам доставки проб.
Согласно приказу Минздрава от 18.04.2019 № 466 «О совершенствовании деятельности службы лабораторной диагностики Республики Беларусь», обеспечение качества преаналитического этапа лабораторных исследований является зоной ответственности клинических специалистов. В стандарте СТБ ISO 15189-2015 «Медицинские лаборатории. Требования к качеству и компетенции» требуется установление индикаторов качества с целью мониторинга и оценки работы по всем критическим аспектам преаналитического этапа. Их внедрение в лабораторную практику и систематический сбор данных позволят обеспечить надежность результатов лабораторного тестирования.
Внутренний стандарт
Клинико-диагностическая лаборатория (КДЛ) РНПЦ РМиЭЧ является многопрофильной, с 2016 года выполняет централизованные исследования для взрослых и детей Новобелицкого и Советского районов Гомеля. Заказчиками являются 10 поликлиник. Исследования включают широкий спектр биохимических (специфических белков и метаболитов), иммунохимических (гормоны, онкомаркеры, витамины и др.), коагулологических (коагулограмма, агрегатограмма, факторы свертывания и антикоагулянты, D-димеры и др.) лабораторных тестов.
Разработан внутренний стандарт, который был включен в текст совместного приказа РНПЦ РМиЭЧ и ГУЗО Гомельского облисполкома (№ 117 и № 167 от 05.02.2019) «О централизации лабораторных исследований». Определена схема проведения централизованных лабораторных исследований.
Для обеспечения доступности для врачей-клиницистов информации о полном спектре выполняемых тестов сотрудниками лаборатории разработаны бланки направлений.
Для обеспечения контроля качества выполнения централизованных исследований лаборатория постоянно анализирует результаты применения основных индикаторов качества преаналитического этапа:
- ошибки идентификации и транскрипции тестов;
- несоответствие направления установленной форме;
- неверный тип, недостаточный объем образца;
- повреждение образца/направления в ходе транспортировки;
- образец, направление для образца не получены;
- сгусток в образце.
По результатам анализа, проведенного КДЛ РНПЦ РМиЭЧ, несоответствия в целом выявляются для 1,3 % доставленных образцов сыворотки/плазмы. Среди индикаторов с наибольшей частотой встречаются ошибки транскрипции тестов, составляющие 1 %:
- отсутствие отметок о необходимых тестах;
- нечеткий запрос на исследование;
- незаполненные/не полностью заполненные паспортные данные пациента (не обозначен пол, возраст, не указан диагноз, отсутствует печать врача).
Реже определяются ошибки идентификации пробы — нарушение маркировки, в т. ч. расхождения между нумерацией направления и пробы. В 0,34 % случаев пробы не доставлялись в лабораторию, в 0,3 % — для проб отсутствовали направления на исследования. Несмотря на то что выбраковка по причине гемолиза определена на этапе взятия крови и первичной пробоподготовки, в лабораторию в 0,31 % случаев доставляются гемолизированные образцы. В 0,5–1 % случаев в пробах сыворотки встречаются нити фибрина, сгустки, осадок эритроцитов. Регистрируются случаи доставки количества сыворотки, недостаточного для выполнения назначенных тестов. Такие несоответствия являлись результатом неполного соблюдения поликлиниками правил пробоподготовки: выдержки необходимого времени сворачивания крови, соблюдения режима центрифугирования крови и пипетирования сыворотки.
Для образцов сыворотки с выявленными ошибками транскрипции тестов лаборатория выясняет необходимую информацию по телефону, после чего образцы, как правило, принимаются в работу. Указанные действия позволили минимизировать потери образцов по причине нарушений правил преаналитики. Выбраковка с оформлением акта отказа в приеме биологического материала с объяснением причин проводится для гемолизированных образцов либо для случаев, когда доставляется только проба сыворотки без направления и наоборот. Пробы сыворотки со сгустками, эритроцитами подвергаются повторному центрифугированию, после чего выполняются исследования.
Пробоподготовка. Характеристика биологических объектов.
Пробоподготовка. Стадия включает очистку от примесей и загрязнений, которые не следует отбрасывать, так как они могут быть источником дополнительной информации. Пробоподготовка – стадия риска потерять анализируемое вещество и объект. Поэтому все предпринимаемые действия должны быть логически оправданы и направлены на сохранение образцов, отобранных для анализа, для дальнейшего исследования.
Моча – наиболее распространенный объект исследования на лекарственные токсичные соединения и наиболее простой биообъект для анализа вследствие низкого содержания белковых компонентов.
Важным показателем мочи как биообьекта является рН, поэтому работа с ней требует постоянного внимания к изменению рН. Величина рН мочи повышается со временем из-за действия бактериальной флоры, выделяющей аммиак. Такое увеличение можно предотвратить путем хранения ее при пониженных температурах (при анализе очень лабильных веществ – в замороженном виде).
Необходимо учитывать также, что при хранении мочи в холодильнике в ней происходит новообразование этанола до концентрации 0,5 ‰. При сахарном диабете новообразование этанола в моче, хранящейся в холодильнике, доходит до 1,1‰. Вместе с тем следует помнить, что при большом объеме воздушного слоя во флаконе над кровью или мочой происходит окисление алкоголя и снижение его содержания в объекте.
Действие бактериальной флоры можно замедлить добавлением натрия фторида, кислоты борной и других бактериостатических препаратов, однако надо учитывать их дальнейшее участие в экстракции и образовании фона. Мочу можно лиофилизировать, предварительно переведя летучие соединения в соответствующие соли.
При анализе мочи и других биологических объектов на содержание одурманивающих веществ необходимо обращать внимание на потенциальные фоновые соединения как эндогенного, так и экзогенного характера, присутствие которых в анализируемом образце неизбежно при любом способе пробоподготовки.
Из потенциальных эндогенных соединений необходимо отметить присутствие низкомолекулярных продуктов метаболизма аминокислот и сахаров (амины, мочевина, карбоновые кислоты, соли карбоновых кислот и др.), небольших количеств пептидов и сахаров (в норме), стероидов, пигмента уробилина, окрашивающего мочу в желтый цвет и других веществ.
К фоновым экзогенным соединениям относятся продукты биотрансформации веществ, поступивших с пищей, и различных лекарственных веществ, используемых наркоманами для усиления наркотического эффекта, снятия синдрома абстиненции, смягчения “выхода” из состояния наркотического опьянения (барбитураты, производные 1,4-бензодиазепина), а также метаболиты других химических веществ, попавших в организм (красители, антиоксиданты, продукты табакокурения и т.д.).
На содержание эндогенных и экзогенных компонентов в пробе влияют:
- возраст, пол и вес человека, определяющие во многом распределение яда и его метаболизм;
- параллельное присутствие других экзогенных химических веществ (лекарственные средства, кофеин, табак, алкоголь и др.), изменяющих фармакокинетические и фармакодинамические параметры яда;
- диета – свободные жирные кислоты связываются с альбуминами и конкурируют на этапе связывания яда с белком;
- генетический фактор – отдельные индивидуумы обладают повышенной толерантностью к действию некоторых химических агентов; если для одних доза введенного яда является смертельной, то для других эта же доза относительно безвредна (или не вызывает летального исхода);
- другие факторы, действие которых необходимо предусматривать, болезнь (может дать повышенный фон некоторых эндогенных соединений), работа с соединениями бытовой или индустриальной химии (повышенный фон эндо- и экзогенных веществ).
Пробоподготовка мочи
Может состоять из различных операций: прямое концентрирование (упаривание некоторого количества мочи до небольшого объёма на водяной бане либо роторном испарителе), экстракция растворителями, лиофилизация, хроматографическое разделение или сорбция на твердом сорбенте или комбинация различных операций (концентрирование – экстракция, лиофилизация – экстракция и др.).
Пробоподготовка крови.
Уровень токсических веществ и их метаболитов у живых объектов и в крови трупа неодинаков вследствие биохимических изменений. Содержание токсического вещества в артериальной или венозной крови также будет различным. Даже положение тела у живого пациента – стоя, сидя или лежа – влияет на биохимический состав пробы, так как в этом случае меняется содержание белков в крови, что особенно важно для токсических веществ, в значительной степени связывающихся с белками.
Обработке экстракцией может быть подвергнута цельная кровь, плазма или сыворотка. Если для предотвращения свертывания крови использовались антикоагулянты, то необходимо учитывать, что гепарин вытесняет жирные кислоты из мест их связывания с альбумином.
Это влияет, с одной стороны, на увеличение связывания токсических веществ с белками, с другой – на переход жирных кислот в органический растворитель при экстракции. Для уменьшения энзиматической активности кровь рекомендуется хранить в холодильнике в замороженном виде.
Поскольку стеклянные стенки посуды содержат большое количество свободных гидроксильных групп, возможно связывание полярных токсических соединений стенками посуды за счет образования водородной связи. Это явление особенно важно учитывать при анализе следовых количеств вещества.
Предварительное силилирование стенок посуды позволяет свести это явление к минимуму. Альтернативой является использование посуды из полипропилена или тефлона, хотя при этом необходимо считаться с загрязнением пробы мономерами смолы.
Из эндогенных соединений помимо жирных кислот в экстрактах из крови встречаются различные стероидные гормоны (тестостерон и др.), холестерин, которые в крови находятся в связанном состоянии с протеинами плазмы. При хранении крови более суток при комнатной температуре происходит новообразование алкоголя, достигая концентрации 1 ‰.
Пробоподготовка слюны
Слюна является продуктом секреции желез ротовой полости. Отобранную пробу центрифугируют и для хранения замораживают, чтобы замедлить активность ферментов. Хранить лучше всего слюну в склянках из тефлона или полипропилена, чтобы избежать поглощения следовых количеств анализируемого вещества стенками стеклянной посуды.
Установлено, что неионизированные формы токсического вещества, находящиеся в водном растворе плазмы, пассивно диффундируют в слюну, так что существует прямая зависимость между концентрацией анализируемого вещества в слюне и его концентрацией в крови.
Пробоподготовка волос
Волосы представляют относительно гомогенный (с точки зрения агрегатного состояния) биологический субстрат. Являясь легкодоступным для отбора, они представляют значительный интерес в качестве объекта при проведении химико-токсикологического анализа как на неорганические, так и на органические вещества.
При анализе волос наркотики могут быть обнаружены в отдаленные сроки после окончания их приема и в тех случаях, когда анализ биожидкостей дает отрицательный результат. Использование волос в качестве объекта исследования позволяет проследить динамику поступления наркотического вещества в организм человека. Анализ волос длиной 6-8 см (6-8 месяцев) позволяет судить о степени наркотической зависимости.
По сравнению с биожидкостями, исследование твердых кожных образований имеет целый ряд отличительных особенностей, которые накладывают отпечаток на все этапы проведения работ.
Исследование волос включает в себя две принципиально важные с точки зрения интерпретации результатов стадии:
- предварительное исследование поверхности волос на присутствие анализируемых веществ
- проведение очистки указанной поверхности от мешающих дальнейшему исследованию веществ с обязательной проверкой эффективности данной операции.
Основные методы разрушения волос:
- экстракция органическими растворителями
- кислотный или щелочной гидролиз
- энзиматическое разрушение
- экстракция органическими растворителями при сверхкритических условиях
- термическое разложение объектов.
Пробоподготовка желчи
Желчь является продуктом секреторной деятельности печени, желчного пузыря и двенадцатиперстной кишки. Эта жидкость содержит большое количество воды, эндогенных веществ, подобных тем, которые находятся в крови, плазме и сыворотке, а также желчные кислоты и пигменты.
Желчь различается по величине рН (в пределах 6,7-8,3), что заставляет контролировать рН в ходе подготовки к экстракции, а при необходимости использовать подходящий буфер. Рекомендуется пробу также центрифугировать при низких скоростях (для удаления холестерина) и осадить белки добавлением смеси хлороформ – метанол (2:1) или хлороформ – изопропанол (9:2).
Пробоподготовка печени
Печень представляет собой центральный орган химического гомеостаза. В печени находится большое разнообразие экзогенных и эндогенных веществ: продукты белкового, углеводного, жирового обменов, продукты биотрансформации экзогенных, в том числе токсических веществ.
С точки зрения присутствия эндогенных и экзогенных веществ в экстракте из печени этот объект является самым неудобным вследствие их большого разнообразия. Даже самая длительная и многоэтапная экстракция, например, кислых лекарственных средств дает в хлороформном экстракте до восьми разнообразных эндогенных соединений.
Команда «Биокор Текнолоджи» разрабатывает тест-системы и наборы для молекулярной диагностики методом ПЦР, и расскажет в этом материале, на какие детали стоит обратить внимание для предотвращения ложноположительных и ложноотрицательных результатов.
ПЦР является универсальным методом лабораторной диагностики, позволяющим идентифицировать даже не собственно вирус или бактерию в биологическом материале, а участки их РНК или ДНК.
Чувствительность ПЦР-анализа приближается к 10-100 копиям генетического материала возбудителя на реакцию. Для сравнения, если человек находится в активной фазе развития заболевания, то его биологический материал содержит миллионы геномов возбудителя на миллилитр, что, после выделения нуклеиновой кислоты будет равно нескольким тысячам копий на реакцию.
В мире, и в Украине в частности, с начала эпидемии COVID-19 ведутся дискуссии относительно того, насколько надежной является такая методика. Одни источники говорят, что ошибочным может быть каждый четвертый тест, другие указывают, что количество ложноположительных и ложноотрицательных результатов составляет лишь несколько процентов. Учитывая актуальность темы, рассмотрим на примере ПЦР для диагностики COVID-19 по каким причинам могут возникать сомнительные или ошибочные результаты. Большинство указанных аспектов имеет место и в случае с ПЦР-тестированием других инфекционных заболеваний человека.
Особенности выбора места для взятия биологического материала
Такие возбудители, как SARS-CoV-2, способны поражать значительное количество органов. Для исследования на COVID-19 обычно берутся мазки из горла или носоглотки, где возбудитель в большом количестве находится ограниченное время — на 5-10 день от начала инфицирования, далее он спускается ниже — к бронхам и легким. Поэтому отрицательный результат ПЦР-теста не может исключать факта инфицирования пациента COVID-19.
С одной стороны, риски получить ложноотрицательный результат ПЦР-теста несколько возрастают на 1-7 день от начала инфицирования, когда количество вируса мало, а также на 10-30 день, когда, во-первых, COVID-19 уже «ушел» ниже, и, во-вторых, в организме уже присутствуют в достаточном количестве антитела, и размножение вируса более или менее эффективно сдерживается иммунной системой. С другой стороны, в некоторых случаях, мы можем получить сомнительно положительный результат ПЦР-теста даже на 60-й день от начала инфицирования, когда человек уже переболел, но в ее биологическом материале все еще можно найти обломки вируса. Все вышесказанное касается только некоторых отдельных случаев и не имеет характера «абсолютной закономерности».
Алгоритм тестирования регламентирован на государственном уровне и, если существует обоснованное подозрение на инфицирование COVID-19, для уточнения диагноза могут проводить ПЦР-анализ повторно.
Неправильное взятие биологического материала
Во избежание ложноположительных результатов вследствие загрязнения — попадание молекул ДНК/РНК из внешней среды, — клинический материал необходимо отбирать стерильными одноразовыми инструментами в одноразовые стерильные пробирки согласно установленным стандартам МОЗ. Взятие материала должны проводить медицинские работники, одетые в средства индивидуальной защиты.
Недостаточное количество биологического материала может привести к ложноотрицательным результатам исследования. В некоторых случаях, эту проблему можно отследить на этапе выделения нуклеиновых кислот или в процессе амплификации (при условии использованием в диагностических наборах для обнаружения SARS-CoV-2 внутреннего контроля, то есть фрагмента генома человека).
Несоблюдение температуры и сроков хранения
Учитывая возможность распада РНК в клиническом материале, сроки хранения и транспортировки должны быть минимальными. В идеальном случае все мазки нужно транспортировать в лабораторию в течение 24-48 часов с момента взятия в специальном транспортной среде при температуре плюс 4 °C. Транспортная среда должна содержать специальные реагенты — муколитики, обеспечивающие разрушение слизи, которая подавляет ПЦР. Если отсутствует возможность своевременно доставить образцы материалов в лабораторию, их можно замораживать до минус 70 °C, используя для этого твердую углекислоту — «сухой лед». Образцы можно хранить в лаборатории в течение недели при температуре минус 20 °C, или до месяца при температуре минус 70 °C. Критическим моментом является количество замораживаний/размораживаний образца: чем их больше, тем ниже качество образца и, вследствие этого, и чувствительность метода в целом.
В результате нахождения образцов в транспортной среде больше срока, рекомендованного производителем, происходит рост естественной бактериальной микрофлоры, которая обычно находится в ротовой полости человека, и разрушение молекул вирусной РНК в образце. При использовании специальных консервантов и стабилизаторов, биоматериал может храниться в температурном диапазоне в соответствии с инструкцией производителя сроком до месяца.
Выделение нуклеиновых кислот
ПЦР-исследование не проводится непосредственно на биологических образцах и требует предварительной пробоподготовки. На этом этапе большое значение имеет качество наборов для экстракции нуклеиновых кислот, которые должны обеспечить выделение образца соответствующей концентрации и степени очистки от примесей, подавляющие ПЦР. Из-за неправильного выбора набора также может быть потеряна часть или даже все РНК возбудителя, что может приводить к ложноотрицательным результатам. Качество и чистоту нуклеиновых кислот можно проверить с помощью специального аналитического прибора — спектрофотометра. Он есть во многих лабораториях, осуществляющих ПЦР-исследования.
Выделенную из образцов РНК можно хранить при температуре минус 20 °C до недели. Для более длительного хранения нужна температура минус 70 °C. Также можно использовать специальные реагенты, стабилизирующие РНК и предупреждают ее деградации (например, DEPC — диэтилпирокарбонат).
Амплификация
Процесс амплификации (увеличение копий участков ДНК, которые обычно содержат необходимые фрагменты целевых генов) может включать до 45 циклов, во время каждого из них количество копий удваивается. Он обеспечивается реагентами, которые входят в диагностические наборы для выявления SARS-CoV-2, и приборами, обеспечивающими циклическую смену температур — амплификаторами.
Для обеспечения корректных результатов, качество диагностических наборов является первоочередным требованием. Также лаборатории должны проводить процедуру их верификации, проведя сравнительные испытания с собственными панелями референтных образцов и решениями от других производителей. Наборы должны поступать в лаборатории в термобоксах с холодовыми блоками и храниться при температуре минус 20 °C. Несоблюдение условий их транспортировки или хранения приводит к повреждению компонентов наборов, и, вследствие того, к ложноотрицательным результатам. Чтобы предупредить эту ошибку, в состав каждого диагностического набора входит положительный контрольный образец, задачей которого является установление работоспособности реагентов.
Диагностические наборы должны быть совместимыми с амплификаторами, используемыми в лаборатории. Реагенты, входящие в состав набора, меченные различными флуоресцентными красителями. Детекция флуоресцентного сигнала от каждого красителя происходит в определенном диапазоне (на определенном «канале»). Если прибор имеет слабую чувствительность по определенным флуоресцентным каналам, это может приводить к ошибочным результатам. Во избежание ошибок работники лабораторий должны проверять исправность работы приборов, а также настройки параметров работы и протоколов амплификации.
Контаминация образцов
При несоблюдении мер безопасности в помещениях лаборатории могут накапливаться продукты амплификации. Это приводит к контаминации образцов, и, в общем итоге, к ложноположительным результатам. Для подтверждения отсутствия загрязнения, каждую серию ПЦР-исследований нужно сопровождать постановкой негативных контрольных образцов, включенных в состав диагностических наборов для выявления SARS-CoV-2.
Перекрестная контаминация может возникать из-за попадания аэрозольных частиц от соседнего образца, содержащего вирусную РНК, при внесении образцов в ПЦР-смесь. На этапе амплификации контаминированный образец издает слабый положительный результат, который означает, что в исследуемой пробе обнаружено очень малое количество вируса. Но такой результат также может указывать, что человека тестировали до наступления полного выздоровления и уровень вируса в его организме был низким.
Способы предупреждения контаминации — использование наконечников с фильтрами, химическая и ультрафиолетовая дезинфекция всех рабочих поверхностей, наличие отдельных наборов дозаторов, оборудования, халатов и перчаток для каждой зоны, проведения внутрилабораторного и внешнего контроля качества исследований — регламентированы на государственном уровне.
Другими эффективными, однако дорогостоящими мероприятиями для предотвращения контаминации является автоматизация этапов выделения нуклеиновых кислот и амплификации, а также двойной контроль — постановка каждого образца в двух параллельных реакциях.
Ошибки обработки данных
Расчеты результатов ПЦР в реальном времени проводятся с использованием компьютерных программ. Амплификатор в автоматическом режиме измеряет интенсивность флуоресценции в образцах на каждом цикле. Кривая амплификации имеет так называемую фазу экспоненциального роста, после которой следует фаза плато. Автоматическая интерпретация результатов не всегда дает правильный результат, поэтому рекомендуется проводить анализ кривых амплификации на предмет пересечения пороговых значений, и корректировать задачи пороговых значений по мере необходимости. Для большей достоверности можно сравнить такую сомнительную кривую с кривой подтвержденного положительного образца.
Подытожим
На каждом этапе исследования являются условия, несоблюдение которых может привести к недостоверным результатам. Некоторые из потенциальных ошибок являются общими для большинства видов лабораторной диагностики (например, ошибки при взятии и хранения образца, настройка оборудования), тогда как другие являются специфическими только для этого вида исследования (например, контаминация образцов, низкое качество выделенных нуклеиновых кислот).
ПЦР — многостадийный метод, и для получения максимально достоверных и воспроизводимых результатов необходимо надлежащее выполнение каждого этапа процесса в соответствии со стандартами МОЗ и инструкциями производителей. Вторым важным условием является качество всех реагентов и расходных материалов, используемых в ПЦР: систем для сбора биологических материалов, наборов для выделения нуклеиновых кислот, диагностических наборов для выявления SARS-CoV-2.

