Согласно И.В. Давыдовскому, «врачебные ошибки – род добросовестных заблуждений врача в его суждениях и действиях при исполнении им тех или иных специальных врачебных обязанностей». Сегодня врачебная ошибка трактуется как неправильные действия или бездействие врача при исполнении им своих профессиональных обязанностей, не являющиеся следствием его недобросовестности и не содержащие состава преступления или признаков проступка.
Согласно И.В. Давыдовскому, «врачебные ошибки – род добросовестных заблуждений врача в его суждениях и действиях при исполнении им тех или иных специальных врачебных обязанностей». Сегодня врачебная ошибка трактуется как неправильные действия или бездействие врача при исполнении им своих профессиональных обязанностей, не являющиеся следствием его недобросовестности и не содержащие состава преступления или признаков проступка.
Врачебные ошибки могут быть нескольких видов. 1. Диагностические, т.е. связанные с постановкой диагноза. 2. Лечебно–тактические: сюда входят ошибки в выборе методов исследования и в оценке их результатов. 3. Лечебно–технические: это неполное обследование больного и ошибки диагностических или лечебных манипуляций. 4. Организационные: сюда включаются неправильная организация рабочего места и лечебного процесса. 5. Ошибки ведения медицинской документации. 6. Ошибки поведения медицинского персонала.
Практически все виды вышеперечисленных ошибок совершаются врачом на различных этапах курации больных внебольничной пневмонией (ВП) – заболеванием потенциально курабельным, но тем не менее являющимся причиной летального исхода у 5–30% заболевших. По данным ВОЗ, пневмония занимает 4–е место в структуре причин смертности. В США ежегодно регистрируют от 5 до 6 млн случаев этого заболевания у взрослых. По данным официальной статистики по РФ, формирующейся на основании анализа отчетов лечебных учреждений, заболеваемость ВП среди взрослых несколько превышает 400 тыс. случаев, что скорее всего значительно ниже реальной заболеваемости. Согласно расчетным данным, ежегодно в РФ возникает не менее 1,5 млн случаев ВП, хотя вполне вероятно, что это тоже далеко от истинной ситуации.
Основные ошибки ведения пациентов с пневмонией могут быть сведены к следующим:
– диагностика и верификация пневмонии;
– оценка тяжести заболевания;
– выбор антибактериального препарата;
– оценка эффективности назначенного антибактериального препарата;
– коррекция антибактериальной терапии;
– длительность антибактериальной терапии;
– полипрагмазия при лечении больных пневмонией.
Диагностика и верификация пневмонии
Уже при первом контакте с больным врача подстерегают опасности совершения ошибок, связанных с диагностикой пневмонии в качестве основной нозологической формы. По мнению академика РАМН проф. А.Г. Чучалина, «процент врачебных ошибок в России очень высок, более 30%. Так, например, из 1,5 млн заболеваний пневмонией диагностируется не более 500 тыс. Причин тому несколько, в том числе и полное отсутствие в стране системы контроля качества оказания врачебной помощи».
Диагностика ВП основывается на умении врача своевременно выявлять и правильно трактовать ряд признаков, являющихся критериями и составляющих так называемый золотой стандарт диагностики ВП – кашель, лихорадка (свыше 3 суток), клинические признаки легочного инфильтрата, лейкоцитоз, рентгенологические признаки легочного инфильтрата. Поскольку последние два признака не могут быть оценены при первичном осмотре, то, по мнению экспертов Британского торакального общества, для своевременной диагностики ВП может быть достаточно трех других признаков. Несмотря на, казалось бы, однозначность и доступность вышеуказанных диагностических критериев диагностика ВП, прежде всего в системе первичного звена (врач–терапевт), остается в настоящее время несовершенной. Около 30% случаев пневмонии диагностируются поздно или вообще не диагностируются. Причины поздней или ошибочной диагностики ВП можно условно разделить на объективные и субъективные. Так, несвоевременное обращение больного к врачу в силу различных причин может быть одной из причин поздней диагностики. С другой стороны, возможно атипичное течение пневмонии, при котором на первый план выступает внелегочная симптоматика, признаки декомпенсации сопутствующей патологии (сердечная недостаточность, сахарный диабет и др.). Такие ситуации нередко встречаются у лиц пожилого и старческого возраста, а также у больных, страдающих различными хроническими заболеваниями. Однако основным источником ошибок в диагностике ВП является недостаточная компетентность врача, которая сказывается в несовершенстве умения и навыков выявления клинических признаков (перкуторных, аускультативных) легочного инфильтрата, неправильной трактовке выявленных симптомов, затянувшемся обследовании больного. Основными дифференциально–диагностическими проблемами остаются заболевания с синдромно сходной симптоматикой (туберкулез, опухолевые заболевания, пневмониты неинфекционной природы, интерстициальные заболевания легких, ТЭЛА и некоторые другие). Невыполнение рекомендаций, возведенных в ранг стандартов диагностики пневмонии, само по себе считается ошибкой (лечебно–технические ошибки в виде неполного обследования больного по И.В. Давыдовскому). К таким диагностическим стандартам относится рентгенологическое исследование грудной клетки у больных с подозрением на пневмонию до начала лечения. Между тем анализ качества диагностики пневмонии в различных регионах России свидетельствует о том, что данное исследование проводилось лишь у незначительного количества больных до начала антибактериальной терапии (АТ) [1]. К этой же категории ошибок на этапе диагностики заболевания относится отсутствие бактериологического исследования мокроты и крови у госпитализированных больных пневмонией.
Таким образом, врачи не всегда следуют имеющимся клиническим рекомендациям по диагностике пневмонии, что может быть обусловлено недостаточным знакомством или вообще незнанием и игнорированием таковых.
Оценка тяжести ВП и принятие решения о месте лечения больного
Ошибки в определении тяжести ВП не позволяют адекватно оценить прогноз заболевания у больного и обосновать тактику лечения. Прежде всего, тяжесть пневмонии определяет место пребывания пациента с ВП (амбулаторное или стационарное лечение). Более того, в случае необходимости госпитализации степень тяжести заболевания позволяет врачу принять решение о переводе больного в ОРИТ. Общепринятыми показаниями для госпитализации больных ВП являются наличие дыхательной недостаточности, декомпенсация сопутствующей патологии (сердечная недостаточность, сахарный диабет и др.), невозможность обеспечить адекватное лечение и уход в домашних условиях
Тяжесть пневмонии является одним из клинических ориентиров для выбора антибактериального препарата (АП), адекватного данной ситуации. Практически все рекомендации по антибактериальной терапии ВП приводятся с учетом тяжести течения заболевания.
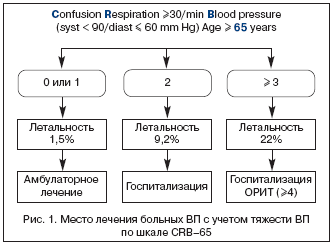
Предложены различные системы–шкалы, позволяющие оценить тяжесть пневмонии (РОRT, PSI, CURB, CURB–65). Некоторые шкалы громоздки, трудны для быстрой оценки и принятия решения. Наиболее практически приемлемой для оценки тяжести ВП можно считать шкалу СURB–65 (Confusion – спутанность, Urea – уровень мочевины в крови, Respiration – число дыханий/мин. – >30/мин., Blood pressure – артериальное давление: систолическое ≤90 мм рт. ст., диастолическое ≤60 мм рт. ст. Age >65 лет), однако она требует определения показателя мочевины в крови, что практически малореально в условиях первичного врачебного звена. С учетом этого можно использовать шкалу CRB–65, позволяющую прогнозировать летальность и, следовательно, определять показания к госпитализации либо в общетерапевтические отделения, либо в ОРИТ (рис. 1).
Антибактериальная терапия внебольничной пневмонии
Пожалуй, на этапе принятия решения о назначении АТ больным пневмонией совершается наибольшее число ошибок, касающихся различных аспектов АТ. К таким ошибкам относятся:
– своевременность начала АТ;
– выбор АП (доза, режим дозирования, путь введения и др.);
– оценка первоначальной эффективности АП;
– необходимость коррекции АТ;
– длительность АТ.
Сроки начала АТ пневмонии являются одним из факторов, влияющих на конечные результаты лечения. Особенно важным является как можно более раннее назначение АП больным пожилого и старческого возраста в связи с более тяжелым течением пневмонии и худшим прогнозом. Показано, что смертность в первые 30 дней среди больных тяжелой пневмонией в возрасте старше 65 лет, у которых АТ была начата в первые 8 ч с момента поступления, была значительно ниже по сравнению с больными, которым антибиотик назначался в более поздние сроки [2]. В другом исследовании отмечено значительное снижение смертности среди больных пневмонией, госпитализированных в отделение интенсивной терапии, у которых АТ начиналась в течение 4 ч с момента поступления по сравнении с более поздним началом лечения [3]
Несвоевременное начало АТ у госпитализированных больных ВП было отмечено при анализе качества ведения больных ВП в некоторых регионах России [1].
Выбор АП. Наиболее важным и ответственным решением, от которого во многом зависит эффективность лечения и исход заболевания, является выбор первоначального АП.
Между тем обращает на себя внимание частое несоответствие стартового АП принятым клиническим рекомендациям, составляющее, по некоторым данным, 22,8%, а также недостаточная суточная доза АП (18,6%) или неадекватный режим дозирования (5,6%) [4]. По данным НИИ АХ СГМУ (2007), у 85% больных тяжелой ВП стартовый АП не соответствовал клиническим рекомендациям, внутривенное введение АП назначалось только в 59% случаев, а у большинства пациентов (68%) АТ проводилась в режиме монотерапии. Несмотря на достаточную осведомленность врачей о препаратах выбора при лечении ВП в реальной амбулаторной практике назначение АП не всегда соответствует современным рекомендациям (высокая частота назначения ципрофлоксацина, цефазолина, парентеральных цефалоспоринов III поколения, «увлечение» макролидами в ущерб b–лактамам). Если для врача основными критериями выбора АП является эффективность и удобный режим приема, то для пациентов это эффективность и возможность перорального приема [1].
Ошибочным следует считать назначение больным ВП следующих АП:
• цефалоспорины I поколения;
• аминогликозиды (гентамицин);
• ранние фторхинолоны (ципрофлоксацин);
• тетрациклины (высокий уровень устойчивости);
• ко–тримоксазол (высокий уровень устойчивости, побочные эффекты);
• ампициллин внутрь (низкая биодоступность);
• ампиокс;
• клиндамицин.
Тем не менее, по данным Л.В. Юдиной [4], цефалоспорины I поколения при лечении ВП назначались 12,4% больным, фторхинолоны II поколения (главным образом ципрофлоксацин) – 17,4%, аминогликозиды – 7,4%, ко–тримоксазол – 6,6%, рифампицин и доксициклин – по 4,1%, линкомицин – 1,7%
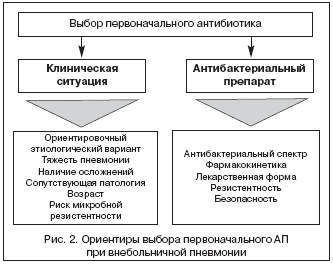
В подавляющем большинстве случаев врач принимает решение о выборе первоначального антибиотика, не имея данных о характере возбудителя пневмонии, а зачастую и перспектив получения таких данных. С учетом этого АТ носит не целенаправленный, а эмпирический характер, в чем должен отдавать себе отчет врач, курирующий больного ВП. В реальной клинической практике выбор первоначального АП для лечения больных ВП должен определяться, с одной стороны, клинической ситуацией, а с другой – свойствами самого АП (рис. 2).
При амбулаторном ведении больных ВП, согласно рекомендациям Российского респираторного общества, следует выделять две группы пациентов:
1–я группа – больные в возрасте до 60 лет без сопутствующей патологии;
2–я группа – больные старше 60 лет с наличием различной сопутствующей патологии (ХОБЛ, сахарный диабет, хроническая алкогольная интоксикация и др.), которая с одной стороны может определять этиологический вариант (риск наличия грамотрицательной флоры) ВП, а с другой – прогноз заболевания. У больных этой группы выше риск антибиотикорезистентности микроорганизмов (пенициллинорезистентность S. pneumoniae, выработка b–лактамаз грамнегативными микроорганизмами).
Больным 1–й группы рекомендовано назначение внутрь амоксициллина или макролидов с оптимальной фармакокинетикой (азитромицин, кларитромицин). Макролиды предпочтительнее при непереносимости β–лактамных антибиотиков или при подозрении на ВП, вызванную атипичными микроорганизмами (микоплазма, хламидия). В качестве альтернативных АП у этой группы больных возможно назначение внутрь респираторных фторхинолонов (Таваник, моксифлоксацин, гемифлоксацин). Несмотря на неактивность аминопенициллинов в отношении атипичных возбудителей, клинические исследования не выявили различия в эффективности между аминопенициллинами, различными макролидами и респираторными фторхинолонами [5].
Больным 2–й группы также рекомендуется АТ внутрь с использованием защищенных пенициллинов (амоксициллин/клавуланат, амоксициллин/сульбактам), комбинация защищенных пенициллинов с макролидами или респираторные фторхинолоны в режиме монотерапии. Преимущество парентерального введения АП в амбулаторном лечении ВП не доказано.
Госпитализированным больным с более тяжелым течением заболевания следует назначать АП парентерально. Общепринято применение β–лактамов (амоксициллин, защищенные пенициллины, цефалоспорины II–III поколений) в сочетании с макролидами (азитромицин, кларитромицин). Летальность при внебольничных пневмониях, особенно среди больных пожилого возраста, ниже при назначении комбинированной терапии цефалоспоринами II–III поколения в сочетании с макролидами по сравнению с монотерапией цефалоспоринами III поколения. Доказано, что комбинированная АТ β–лактамами и макролидами улучшает прогноз больных ВП, сокращает сроки пребывания в стационаре, что делает оправданной подобную комбинацию [6]. Альтернативными АП могут быть респираторные фторхинолоны (левофлоксацин – Таваник, моксифлоксацин). Имеются данные о том, что Таваник в режиме монотерапии оказывает клинический и бактериологический эффект, сравнимый с комбинацией β–лактамов и макролидов [7–9].
В одном из последних метаанализов сравнивалась эффективность комбинированной АТ β–лактамами и макролидами с респираторными фторхинолонами (Таваник) в режиме монотерапии [10]. Анализу были подвергнуты результаты 23 рандомизированных контролируемых исследований, включивших 7885 больных. По результатам проведенного метаанализа было установлена более высокая клиническая эффективность респираторных фторхинолонов по сравнению с комбинированной АТ больных тяжелой ВП. В то же время при лечении пациентов с нетяжелой пневмонией респираторные фторхинолоны не имели преимуществ перед комбинированной АТ. Если у госпитализированных больных (тяжелая ВП) при приеме респираторных фторхинолонов внутрь не отмечено различий между двумя исследуемыми группами, то при внутривенном введении респираторные фторхинолоны оказывали более выраженный клинический и бактериологический эффект по сравнению с комбинацией β–лактамов и макролидов. Кроме того, по результатам метаанализа, побочные эффекты, особенно со стороны желудочно–кишечного тракта, регистрировались достоверно реже. Следует отметить, что в большинстве исследований, включенных в метаанализ, левофлоксацин (Таваник) применялся в суточной дозе 500 мг.
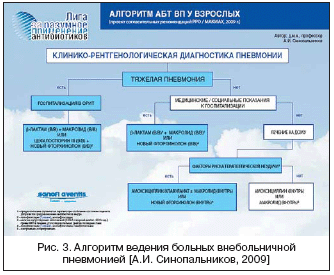
На рисунке 3 представлен алгоритм АТ больных ВП в соответствии с последними рекомендациями Российского респираторного общества и МАКМАХ.
Дозирование АП. Нередко встречаются ошибки в выборе дозы назначенного АП без учета тяжести пневмонии. В недостаточной суточной дозе АП назначался у 18,6% больных ВП [11].
Стандартные дозы β–лактамов и других АП у больных тяжелой ВП могут оказаться недостаточно эффективными. Наличие признаков сепсиса и септического шока при тяжелой ВП требует назначения более высоких доз β–лактамов (амоксициллин/клавуланат 1,2–2,4 г 2–3 раза/сут.; цефотаксим 2–3 г 2–3 раза/сут.) или Таваника (500 мг/сут.). При тяжелой ВП дозирование АП имеет свои особенности в отношении как суточных доз, так и кратности введения. Предпочтительным путем введения АП у данной категории пациентов является внутривенное введение.
Путь введения АП определяется многими факторами, в том числе тяжестью пневмонии, состоянием больного, фармакокинетической характеристикой АП и др. Если в целом ряде ситуаций при инфекциях нижних дыхательных путей парентеральный путь введения не имеет альтернативы (нарушение сознания, стволовые расстройства с нарушением глотания, патология кишечника и др.), то в остальных случаях парентеральная АТ требует определенных показаний и должна быть обоснованной, а не произвольной. При достижении клинического эффекта от парентеральной АТ рекомендуется переход на оральную форму того же или сходного по антимикробному спектру другого антибиотика (ступенчатая терапия). Критериями для перехода с парентерального на оральный путь введения антибиотиков следует считать нормальные показатели температуры на протяжении 2–кратного измерения за последние 16 ч, нормальное количество лейкоцитов или тенденция к нормализации, субъективное улучшение (уменьшение кашля, одышки), стабилизация показателей дыхания и гемодинамики, отсутствие признаков нарушения всасывания [12]. Оптимальными сроками перехода с парентеральной на оральную терапию являются 48–72 ч. Для обеспечения комплайентности следует отдавать предпочтение антибиотикам с высокой биодоступностью и удобным режимом дозирования (1–2 раза/сут.). Таким требованиям отвечают современные респираторные фторхинолоны (Таваник, моксифлоксацин).
В то же время ошибочным является назначение АП внутрь с целью «облегчить и упростить» лечение как для больного, так и для среднего медперсонала без учета конкретной клинической ситуации и фармакокинетики АП. У больных с тяжелой пневмонией это может стать одной из причин недостаточного эффекта или вообще неэффективности лечения. Не следует назначать АП внутрь при тяжелых пневмониях, особенно препараты с низкой биодоступностью (ампициллин, цефуроксим аксетил), что не позволяет достигать оптимальной концентрации АП в крови. В то же время у больных нетяжелой ВП при отсутствии осложнений и фоновой патологии допустима оральная АТ. В подобных ситуациях парентеральный путь введения АП оказывается не только необоснованным, но и более дорогостоящим.
Оценка эффективности первоначального АП. При амбулаторном ведении больного ВП обязательной является оценка эффективности и переносимости назначенного АП (правило второго визита) через 48–72 ч. АТ внебольничной пневмонии следует считать неэффективной, если отсутствуют признаки клинической стабилизации, которыми считаются:
– температура – < 37,8 °С
– ЧСС <100 уд./ мин.
– систолическое АД >90 мм рт. ст.
– ЧД < 24 /мин.
– Sa02 > 90%
При анализе ведения больных ВП приходится нередко сталкиваться с такими ошибками, когда больной продолжает получать назначенный АП в течение недели и более, несмотря на отсутствие очевидного клинического эффекта. Необоснованно длительная АТ при отсутствии эффекта и необходимость смены АП наблюдалась у 20,6% [11]. Ошибочность подобной практики имеет немало негативных последствий. Во–первых, затягивается назначение другого, более адекватного АП, что способствует прогрессированию легочного воспаления (особенно важно при тяжелых пневмониях, у больных с сопутствующей патологией), развитию осложнений, удлинению сроков лечения. Кроме того, повышается риск возникновения побочных (токсических) эффектов АТ, развития антибиотикорезистентности. Не следует игнорировать и значение негативного влияния неэффективности проводимой терапии на больного и его родственников, влекущего за собой утрату доверия к врачу и потерю комплайенса. Очевидна и неэкономичность такой ошибочной тактики АТ (напрасный расход неэффективного АП, задержка пребывания больного в стационаре, дополнительные затраты на лечение токсических эффектов и др.).
При отсутствии эффекта в указанные сроки следует пересмотреть тактику АТ (замена амоксициллина на Таваник или добавление последнего к β–лактамному АП) или решить вопрос о госпитализации пациента.
Коррекция АТ. Наряду с серией ошибок при оценке эффективности АП встречаются ошибки при коррекции АТ, т.е. смене одного АП на другой. При отсутствии данных микробиологического исследования принцип выбора АП остается тем же самым, т.е. ориентировка на клиническую ситуацию с учетом, однако, неэффективности первоначального АП и других дополнительных признаков. Отсутствие эффекта от первоначального АП в известной степени должно быть дополнительным ориентиром, позволяющим обосновать выбор второго АП. Так, отсутствие эффекта от β–лактамных АП (пенициллины, цефалоспорины) у больного ВП позволяет предполагать или делает более вероятным предположение о легионелезной или микоплазменной пневмонии (с учетом, разумеется, других признаков). В свою очередь, это делает обоснованным назначение АП из группы макролидов (азитромицин, кларитромицин и др.) или респираторных фторхинолонов (Таваник, моксифлоксацин).
Во избежание ошибок при коррекции АТ следует иметь в виду возможные причины неэффективности АП, к которым относятся:
– неправильный диагноз (туберкулез, опухоль, отек легких и др.);
– наличие осложнений (легочные, внелегочные);
– тяжелая сопутствующая и фоновая патология;
– неадекватный первоначальный АП;
– неадекватный режим дозирования АП;
– антибиотикорезистентность;
– поздно начатая АТ.
Длительность АТ. По различным данным, необоснованно длительная антибиотикотерапия проводится у 11,5% [11]. Согласно рекомендациям IDSA/ATS (2007), больной ВП должен лечиться как минимум в течение 5 дней (уровень доказательности I), лихорадка должна стойко отсутствовать в течение 48–72 ч, при этом не должно быть более 1 признака клинической нестабильности (уровень доказательности II). При высокой вероятности «атипичной» пневмонии рекомендуется более продолжительная АТ, до 14 дней, хотя имеются данные об эффективности и более коротких курсов в подобных клинико–эпидемиологических ситуациях. Наличие таких признаков, как астения, субфебрилитет, неполное рентгенологическое разрешение пневмонии, отсутствие полного рентгенологического разрешения пневмонии и нормализации показателей СОЭ не должны являться показанием для продолжения АТ и тем более для назначения другого АП.
Полипрагмазия. Среди большинства врачей укоренилось ошибочное мнение о необходимости назначения больным ВП наряду с АП различных лекарственных средств (антигистаминные, иммуномодуляторы, витамины, НПВП, противогрибковые препараты и др.). Подобная полипрагмазия не имеет достаточной доказательной основы, а только лишь удорожает лечение и повышает риск побочных эффектов лекарственного лечения.
Так, например, одной из распространенных ошибок при проведении АТ пневмонии является назначение одновременно с АП противогрибковых средств с целью как профилактики грибковых осложнений, так и «лечения» кандидоза в случаях обнаружения в полости рта грибков из рода Сandida. Обычно назначается нистатин внутрь, что трудно объяснимо с позиций его фармакокинетики: этот АП обладает весьма низкой биодоступностью и практически не всасывается из ЖКТ. Действие нистатина в основном местное. Кроме того, врач при назначении нистатина ориентируется лишь на данные микробиологического исследования и не учитывает наличие или отсутствие симптомов кандидоза и факторов риска развития грибковой инфекции (тяжелый иммунодефицит и др.). В свое время Б.Е. Вотчал писал: «…кандидамикоз – это не грибки, а болезнь, т.е. должны быть не только грибки в мазке, но и симптомы кандидамикоза».
Учет различных клинических ситуаций. В повседневной клинической практике при назначении любого медикаментозного средства, в том числе и АП, приходиться учитывать многочисленные факторы конкретной клинической ситуации (возраст, сопутствующая патология, прием других медикаментов и т.д.), определяющей тактику АТ и ее особенности. Недоучет всех факторов и неадекватная оценка особенностей данной ситуации влечет за собой ошибки в АТ, наиболее часто встречающиеся при следующих ситуациях:
• возраст больных (дети, старики);
• беременность;
• тяжелая сопутствующая патология с функциональными нарушениями различных органов и систем;
• медикаментозная терапия сопутствующих заболеваний;
• аллергические реакции на различные АП.
Ошибочно назначение беременным фторхинолонов, клиндамицина, метронидазола для лечения пневмонии. Кроме того, с осторожностью должны назначаться аминогликозиды, ванкомицин, имипенем.
Наличие сопутствующей патологии в ряде случаев создает сложности в проведении АТ, что может приводить и к ошибкам в выборе АП, его дозировки, путях введения, длительности АТ и т.д. При этом в основе ошибок может лежать либо невыявление сопутствующей патологии, либо ее недооценка в отношении токсического влияния АП, либо, наконец, недостаточное знание фармакокинетических особенностей выбранного АП. При наличии у больного почечной недостаточности следует отдавать предпочтение выбору АП с преимущественно внепочечным выведением (цефоперазон) или с двойным путем элиминации (ципрофлоксацин). Ошибочно назначение потенциально нефротоксичных АП (аминогликозиты, карбапенемы) без корректировки дозы у больных с сопутствующей почечной недостаточностью. Опасно также в подобных ситуациях сочетание АП, обладающих нефротоксическими свойствами (аминогликозиды и цефалоспорины, за исключением цефоперазона).
Особенно следует учитывать наличие сопутствующей, нередко множественной патологии с функциональными нарушениями органов и систем у больных пожилого и старческого возраста. Возрастное снижение показателей клубочковой фильтрации наряду с высокой частотой нефроангиосклероза у пожилых должны быть одним из факторов, влияющих на выбор АП, что, к сожалению, не всегда учитывается в клинической практике.
При наличии достоверно установленной гиперчувствительности к пенициллину ошибочно назначение других b–лактамных АП (цефалоспорины, карбаменемы). Альтернативными АП могут быть фторхинолоны, макролиды. Однако следует иметь в виду, что нередко за «аллергию на антибиотики» принимаются реакции другого происхождения (сосудистые, вегетативные и др.), в связи с чем следует критически оценивать указания больных на такую «непереносимость» и более тщательно анализировать имеющуюся ситуацию. Вместе с тем опасны внутрикожные пробы на АП, поскольку существует такая же опасность тяжелых анафилактических реакций.
По данным исследования С.А. Рачиной и соавт. [1] об индикаторах качества ведения больных ВП, основные ошибки ведения госпитализированных больных ВП сводятся к следующим:
• рентгенологическое исследование позже 24 ч с момента поступления;
• отсутствие бактериологического исследования мокроты и крови (при тяжелых ВП) до назначения АП;
• задержка начала АТ более 8 ч с момента верификации диагноза;
• несоответствие режима АТ национальным рекомендациям;
• недостаточное использование режима ступенчатой терапии;
• отсутствие профилактики у пациентов из группы риска.
Современная ситуация, свидетельствующая об ошибках диагностики и ведения больных ВП, обусловлена многими причинами, и прежде всего недостаточным следованием клиническим рекомендациям (КР). Основными барьерами на пути внедрения КР по ведению больных ВП в практику врача–терапевта являются следующие [13]:
• недостаточная осведомленность врачей о существовании КР;
• недостаточное знакомство и знания КР;
• консервативность клинического менталитета врача;
• отсутствие у врачей мотивации;
• невозможность контроля преимущества следования КР в лечении больных ВП;
• неуверенность в улучшении исходов ВП в случаях следования КР.
В то же время следование КР способствуют повышению эффективности лечения и благоприятному исходу заболевания, а также уменьшают риск принятия ошибочных решений при ведении больных ВП. Имеются доказательные данные о том, что, если врач следует клиническим рекомендациям, доля неэффективной терапии уменьшается на 35–40%, а вероятность летального исхода – на 45% [14]. Таким образом, основными реальными путями, которые позволят избежать или по крайней мере минимизировать ошибки ведения больных ВП является строгое следование КР. С учетом этого первоочередной задачей органов здравоохранения и постдипломного обучения следует считать внедрение КР в практику врачей первичного звена здравоохранения, и прежде всего врачей–терапевтов [15].
Внебольничная пневмония (ВП) занимает первое место в структуре заболеваемости и смертности от инфекционных болезней [1–3]. Количество случаев ВП в Российской Федерации составляет 1,5 млн в год [2]. Число пациентов с ВП увеличивается в периоды подъема заболеваемости ОРВИ. Наиболее распространенной причиной ВП у взрослых является инфекция Streptococcus pneumoniae [4].
Высокие уровни заболеваемости и смертности населения России от пневмонии указывают на необходимость адекватных мер на федеральном и региональном уровнях: повышения качества первичной медицинской помощи, улучшения профилактики, увеличения объема вакцинации против респираторных инфекций в группах риска [5]. Больные тяжелой пневмонией нуждаются в лечении в условиях стационара, поэтому от первоначальной оценки тяжести ВП врачом первичного звена зависит решение о тактике ведения пациента и режиме антимикробной терапии. Вместе с тем промедление с направлением пациента с тяжелой ВП в стационар ухудшает течение и прогноз заболевания [6]. Для повышения эффективности диагностики и лечения ВП в некоторых странах, в том числе в Российской Федерации, разработаны национальные клинические рекомендации, неукоснительное соблюдение которых позволяет снизить социальноэкономические потери от пневмонии [7, 8].
Цель исследования: анализ ошибок при диагностике и лечении ВП врачами первичного звена в районах Краснодарского края.
МАТЕРИАЛЫ И МЕТОДЫ
Проведен ретроспективный анализ 1500 медицинских карт амбулаторных и стационарных пациентов из 45 муниципальных территорий Краснодарского края и г. Краснодара с оценкой выполнения национальных клинических рекомендаций по диагностике и лечению ВП врачами первичного звена. Работа выполнена в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинской декларации. Протокол исследования одобрен локальным Этическим комитетом.
Статистическую обработку данных проводили с помощью программы Statistica 7.0.
РЕЗУЛЬТАТЫ
Анализ 1500 медицинских карт больных ВП, в том числе 974 (64,9%) амбулаторных и 526 (35,1%) стационарных пациентов, обнаружил несколько системных ошибок при оказании лечебнодиагностической помощи врачами первичного звена. Национальные стандарты ведения пациентов с тяжелой ВП не соблюдали в 71,3% случаев.
При диагностике и лечении больных тяжелой ВП на амбулаторном этапе также отмечены некоторые недостатки. В 42,2% случаев врачитерапевты поликлинического звена недооценивали тяжесть пневмонии, поскольку не использовали клиниколабораторные критерии ее классификации по тяжести, разработанные экспертами Российского респираторного общества и Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии [1, 2], и прогностическую шкалу CURB65 [7, 8]. Пульсоксиметрия для оценки тяжести дыхательной недостаточности не была выполнена у 45,1% больных тяжелой ВП.
Рентгенография органов грудной клетки с целью верификации диагноза пневмонии проведена только у 60,7% (n = 591) всех больных пневмонией, обратившихся в поликлинику. В этих случаях диагноз ВП устанавливал врач на основании жалоб и данных физикального обследования пациента. Кроме того, врачи первичного звена в амбулаторных условиях несвоевременно выполняли рентгенографию органов грудной клетки в двух проекциях.
При первичном обращении больного направляли на флюорографию для уточнения присутствия инфильтрата в легком, и только через 6 ± 4 дня после начала болезни ему выполняли рентгенографию органов грудной клетки в одной проекции. Эти действия не согласуются с современными стандартами диагностики ВП, где единственным методом первичной лучевой диагностики пневмонии служит рентгенография органов грудной клетки в двух проекциях. Данная ошибка привела к увеличению времени верификации диагноза пневмонии, усугублению тяжести состояния пациента, позднему началу антимикробной терапии.
Частота таких неправильных действий на амбулаторном этапе составила 12,4% (n = 121). Неверная интерпретация результатов рентгенографии врачомрентгенологом поликлиники и дальнейшая ошибочная маршрутизация пациентов с ВП зарегистрированы у 18 (1,8%) человек. В большинстве случаев (60,5%) врачи не использовали пульсоксиметры для выявления дыхательной недостаточности при осмотре пациентов с ВП на дому.
Не всем больным ВП антимикробную терапию проводили в соответствии с национальными клиническими рекомендациями. В рамках амбулаторного лечения 521 (53,5%) пациенту был назначен цефтриаксон в/м в дозе 1 г 2 раза в день. Однако данная схема лечения нерациональна и приводит к увеличению числа осложнений в амбулаторных условиях. В настоящее время, согласно национальным рекомендациям по диагностике и лечению ВП, всем больным, оставленным на амбулаторное лечение, показана терапия антимикробными препаратами для приема внутрь. Кроме того, признано ошибочным назначение таких антибиотиков, как гентамицин (5,9%), цефазолин (7,8%), ципрофлоксацин (7,1%), неэффективных в отношении основных возбудителей ВП. Безосновательное использование таких устаревших лекарственных препаратов, как аскорбиновая кислота, глюконат кальция, кокарбоксилаза и т. д., зарегистрировано в 482 (49,5%) проанализированных случаях.
Вместе с тем отмечена и недостаточная осведомленность пациентов о последствиях самолечения ВП. Так, большинство больных (n = 695; 71,4%) поздно (позднее 24 ч) обращались за помощью к амбулаторному врачу.
Основной ошибкой оказания медицинской помощи в стационаре было невыполнение пульсоксиметрии с целью определения тяжести дыхательной недостаточности у пациентов с тяжелой пневмонией (n = 452; 85,9%) на этапе приемного отделения. Недооценена тяжесть состояния 78,5% больных, так как врачи стационара не использовали прогностические шкалы. Эти недостатки привели к несвоевременному переводу пациентов с жизнеугрожающей дыхательной недостаточностью в отделение реанимации и интенсивной терапии (ОРИТ) (n = 421; 80,0%). Вместе с тем хорошо известно, что адекватную интенсивную терапию пациенты с ВП и жизнеугрожающей дыхательной недостаточностью могут получить только в условиях ОРИТ.
Наряду с недооценкой тяжести состояния обнаружены ошибки и в назначении медикаментозной терапии. Так, устаревшие схемы антимикробной терапии, не соответствующие современным клиническим рекомендациям, использованы у 16,1% пациентов с тяжелой ВП. Нерациональные режимы дозирования антибиотиков (например, цефтриаксон по 1 г/сут, левофлоксацин по 500 мг/сут) зафиксированы в 101 (19,2%) случае. К сожалению, врачи попрежнему назначают антимикробные препараты, неэффективные в отношении основных возбудителей ВП, в том числе ципрофлоксацин (n = 14; 2,6%), гентамицин (n = 9; 1,7%), цефазолин (n = 15; 2,9%).
В качестве иллюстрации нерациональной тактики ведения пациентов с ВП приводим два клинических примера.
Больная Г., 44 лет, доставлена 02.07.2017 г. по линии санитарной авиации в пульмонологическое отделение ГБУЗ «НИИККБ № 1 им. проф. С. В. Очаповского» с диагнозом «двусторонняя пневмония, острая дыхательная недостаточность III степени, ИВЛ»; по тяжести состояния госпитализирована в анестезиологореанимационное отделение № 8.
При анализе медицинской документации выявлены следующие недостатки ведения больной по месту жительства. При поступлении пациентки в стационар 24.06.2017 г. сильно недооценена степень тяжести заболевания: при признаках дыхательной недостаточности (SpO2 на воздухе — 88%) и артериальной гипотензии до шоковых значений (АД 90/60 мм рт. ст.) пациентка не переведена в ОРИТ, что ухудшило прогноз заболевания.
Назначенная терапия при установленном диагнозе не соответствовала стандартам оказания медицинской помощи пациентам с пневмонией, принятым в национальных клинических рекомендациях. Стартовое антимикробное лечение состояло в монотерапии цефтриаксоном, что следует считать грубой ошибкой, так как стартовая терапия при диагнозе «двусторонняя пневмония, тяжелое течение», требующем госпитализации в ОРИТ, должна включать парентеральное введение двух антимикробных препаратов. С целью коррекции АД проводили парентеральную инфузию преднизолона, что также является грубой ошибкой, так как преднизолон не входит в схему лечения артериальной гипотензии, обусловленной тяжелой инфекционной патологией.
Через 48 ч от момента поступления в стационар по месту жительства 29.06.2017 г. ввиду нарастания явлений дыхательной недостаточности пациентке однократно в/в введен метронидазол, а затем офлоксацин, что тоже надо признать серьезной ошибкой, так как ни метронидазол, ни офлоксацин не рекомендованы для лечения ВП. В связи с прогрессированием дыхательной недостаточности 30.06.2017 г. пациентка была переведена в ОРИТ центральной районной больницы (ЦРБ).
В условиях ОРИТ антибиотик поменяли на меропенем по 2 г/сут, что меньше терапевтической дозы данного препарата, в комбинации с ципрофлоксацином по 200 мг/сут в/в (также меньше терапевтической дозы), кроме того, ципрофлоксацин не рекомендован для лечения ВП ввиду низкой чувствительности ее возбудителей к этому противомикробному средству.
Изложенные ошибки в лечении привели к прогрессированию дыхательной недостаточности, что потребовало экстренного перевода пациентки в ГБУЗ «НИИККБ № 1 им. проф. С. В. Очаповского».
Больной И., 82 лет, поступил в терапевтическое отделение ЦРБ 27.03.2014 г. в тяжелом состоянии с явлениями энцефалопатии и психомоторного возбуждения. Госпитализирован в неврологическое отделение. По результатам рентгенографии органов грудной клетки заподозрена пневмония. Лейкоцитоз — 23 × 109/л. Пульсоксиметрию на протяжении всей госпитализации ни разу не проводили. Начата неадекватная стартовая терапия цефтриаксоном по 2 г/сут в режиме монотерапии. Необоснованно назначены аскорбиновая кислота, метамизол натрия, дифенгидрамин, папаверин. Психомоторное возбуждение лечащий врач расценил как проявление хронической ишемии мозга.
На 2й день для исключения ОНМК выполнили КТ головного мозга, а КТ органов грудной клетки не сделали. Несмотря на психомоторное возбуждение, пациента для динамического наблюдения не перевели в ОРИТ, не контролировали диурез и витальные функции. Больного на протяжении 3 дней пребывания в стационаре четырежды консультировал невролог, однократно психиатр.
Состояние пациента ввиду неадекватной антимикробной терапии прогрессивно ухудшалось вследствие нарастания интоксикации и дыхательной недостаточности. На 3й день пребывания в отделении во время планового обхода терапевт в истории болезни зафиксировал показатели АД 60/0 мм рт. ст.Несмотря на инфекционнотоксический шок, пациента в ОРИТ не перевели, назначили преднизолон. Через 2 ч врач констатировал смерть больного.
При патологоанатомическом исследовании обнаружены тотальная левосторонняя пневмония, левосторонний гнойнофибринозный плеврит. Приведенный пример демонстрирует грубую недооценку тяжести состояния больного, отсутствие должного динамического наблюдения, неадекватную антимикробную терапию, полипрагмазию. Неврологические симптомы появились у пациента не вследствие хронической ишемии мозга, а от тяжелой интоксикации, развившейся на фоне тяжелой ВП.
ОБСУЖДЕНИЕ
Несмотря на существование национальных клинических рекомендаций, отмечены ошибки при диагностике и лечении ВП в виде недооценки тяжести состояния больных и назначения нерациональной антимикробной терапии. Аналогичные данные получены и в других исследованиях. Так, С. А. Рачиной и соавт. [9] выявлена низкая частота использования прогностических шкал при диагностике ВП в клинической практике, а также определенное недоверие к ним врачейтерапевтов. По мнению нескольких экспертов, основной системный недостаток при оказании помощи пациентам с ВП состоит в несоблюдении национальных клинических рекомендаций [1, 2]. Полученные нами данные согласуются и с результатами исследования Р. И. Хамитова, проведенного в Казани [10].
Согласно нашим результатам, ошибки при диагностике и лечении пациентов с ВП обусловлены как недостатками организации первичной медицинской помощи (отсутствием пульсоксиметров в амбулаторных и стационарных учреждениях), так и недостаточной квалификацией врачей первичного звена (недооценка тяжести состояния пациента, выполнение флюорографии органов грудной клетки или рентгенографии органов грудной клетки в одной проекции, невыполнение пульсоксиметрии, нерациональная антимикробная терапия).
ЗАКЛЮЧЕНИЕ
Неукоснительное выполнение национальных клинических рекомендаций по диагностике и стартовой эмпирической антимикробной терапии позволит значительно уменьшить число ошибок при диагностике и лечении пациентов с внебольничной пневмонией и улучшить прогноз заболевания.
Ошибки в антибактериальной терапии инфекций дыхательных путей в амбулаторной практике
Статьи
Опубликовано в журнале:
Лечащий врач, 2003, №8 Л. И. Дворецкий, доктор медицинских наук, профессор
С. В. Яковлев, доктор медицинских наук, профессор
ММА им. И. М. Сеченова, Москва
Проблема рациональной антибактериальной терапии инфекций дыхательных путей не теряет актуальности и в настоящее время. Наличие большого арсенала антибактериальных препаратов, с одной стороны, расширяет возможности лечения различных инфекций, а с другой — требует от врача-клинициста осведомленности о многочисленных антибиотиках и их свойствах (спектр действия, фармакокинетика, побочные эффекты и т. д.), умения ориентироваться в вопросах микробиологии, клинической фармакологии и других смежных дисциплинах.
Согласно И. В. Давыдовскому, «врачебные ошибки — род добросовестных заблуждений врача в его суждениях и действиях при исполнении им тех или иных специальных врачебных обязанностей». Ошибки в антибактериальной терапии инфекций дыхательных путей имеют наибольший удельный вес в структуре всех лечебно-тактических ошибок, совершаемых в пульмонологической практике, и оказывают существенное влияние на исход заболевания. Кроме того, неправильное назначение антибактериальной терапии может иметь не только медицинские, но и различные социальные, деонтологические, экономические и другие последствия.
При выборе способа антибактериальной терапии в амбулаторной практике необходимо учитывать и решать как тактические, так и стратегические задачи. К тактическим задачам антибиотикотерапии относится рациональный выбор антибактериального препарата, обладающего наибольшим терапевтическим и наименьшим токсическим воздействием.
Стратегическая задача антибиотикотерапии в амбулаторной практике может быть сформулирована как уменьшение селекции и распространения резистентных штаммов микроорганизмов в популяции.
В соответствии с этими положениями следует выделять тактические и стратегические ошибки при проведении антибактериальной терапии инфекций дыхательных путей в амбулаторной практике (см. таблицу 1).
Таблица 1. Ошибки антибактериальной терапии в амбулаторной практике.
| Тактические ошибки | Стратегические ошибки |
|
|
|
Тактические ошибки антибактериальной терапии
1. Необоснованное назначение антибактериальных средств
Особую категорию ошибок представляет неоправданное применение антибактериальных препаратов (АП) в тех ситуациях, когда их назначение не показано.
Показанием для назначения антибактериального препарата является диагностированная или предполагаемая бактериальная инфекция.
Наиболее распространенная ошибка в амбулаторной практике — назначение антибактериальных препаратов при острых респираторных вирусных инфекциях (ОРВИ), имеющее место как в терапевтической, так и в педиатрической практике. При этом ошибки могут быть обусловлены как неправильной трактовкой симптоматики (врач принимает ОРВИ за бактериальную бронхолегочную инфекцию в виде пневмонии или бронхита), так и стремлением предотвратить бактериальные осложнения ОРВИ.
При всех трудностях принятия решения в подобных ситуациях необходимо отдавать себе отчет в том, что антибактериальные препараты не оказывают влияния на течение вирусной инфекции и, следовательно, их назначение при ОРВИ не оправдано (см. таблицу 2). В то же время предполагаемая возможность предотвращения бактериальных осложнений вирусных инфекций с помощью назначения антибактериальных препаратов не находит себе подтверждения в клинической практике. Кроме того, очевидно, что широкое неоправданное применение антибактериальных препаратов при ОРВИ чревато формированием лекарственной устойчивости и повышением риска возникновения нежелательных реакций у пациента.
Таблица 2. Инфекционные заболевания дыхательных путей преимущественно вирусной этиологии
и не требующие антибактериальной терапии.
|
Инфекции верхних дыхательных путей |
Инфекции нижних дыхательных путей |
|
|
|
Одной из распространенных ошибок при проведении антибактериальной терапии является назначение одновременно с антибиотиком противогрибковых средств с целью профилактики грибковых осложнений и дисбактериоза. Следует подчеркнуть, что при применении современных антибактериальных средств у иммунокомпетентных пациентов риск развития грибковой суперинфекции минимален, поэтому одновременное назначение антимикотиков в этом случае не оправдано. Комбинация антибиотика с противогрибковым средством целесообразна только у больных, получающих цитостатическую или противоопухолевую терапию или у ВИЧ-инфицированных пациентов. В этих случаях оправдано профилактическое назначение антимикотиков системного действия (кетоконазол, миконазол, флуконазол), но не нистатина. Последний практически не всасывается в желудочно-кишечном тракте и не способен предотвратить грибковую суперинфекцию иной локализации — полости рта, дыхательных или мочевыводящих путей, половых органов. Часто практикующееся назначение нистатина с целью профилактики дисбактериоза кишечника вообще не находит логического объяснения.
Часто врач назначает нистатин или другой антимикотик в случае обнаружения в полости рта или в моче грибов рода Candida. При этом он ориентируется лишь на данные микробиологического исследования и не учитывает наличие или отсутствие симптомов кандидоза, а также факторов риска развития грибковой инфекции (тяжелый иммунодефицит и др.).
Выделение грибов рода Candida из полости рта или мочевых путей пациентов в большинстве случаев служит свидетельством бессимптомной колонизации, не требующей коррегирующей противогрибковой терапии.
II. Ошибки в выборе антибактериального препарата
Пожалуй, наибольшее число ошибок, возникающих в амбулаторной практике, связано с выбором антибактериального средства. Выбор антибиотика должен производиться с учетом следующих основных критериев:
| Тонзиллофарингит | Острый средний отит | Синусит | Обострение хронического бронхита | Пневмония |
| Streptococcus pyogenes | Streptococcus pneumoniae Haemophilus influenzae |
Streptococcus pneumoniae Haemophilus influenzae Moraxella catarrhalis в ассоциации с анаэробами |
Haemophilus influenzae Streptococcus pneumoniae Moraxella catarrhalis; У пожилых: + Staphylococcus aureus |
Streptococcus pneumoniae Haemophilus influenzae Mycoplasma pneumoniae Chlamydia pneumoniae, реже — Enterobacteriaceae Staphylococcus aureus Klebsiella pneumoniae Legionella pneumophila |
Кроме того, при выборе препарата следует учитывать уровень приобретенной резистентности возбудителей в популяции. Основные тенденции, касающиеся резистентности возбудителей, отмеченной в последние годы, отражены в таблице 4. Таблица 4. Современные проблемы резистентности наиболее частых возбудителей внебольничных инфекций дыхательных путей.
| Микроорганизмы | Современные проблемы лечения |
| Streptococcus pneumoniae | Снижение чувствительности к бета-лактамам; устойчивость в пенициллину в России не превышает 2%, но штаммы с умеренной чувствительностью составляют 10 — 20%. b-лактамы (амоксициллин, ампициллин, цефалоспорины III-IV поколения, карбапенемы) сохраняют полную клиническую эффективность в отношении пенициллинрезистентных пневмококков, в то же время эффективность цефалоспоринов I-II поколения может быть снижена. Низкая природная активность пероральных цефалоспоринов III поколения, прежде всего цефтибутена. Рост устойчивости к макролидам: в Европе от 8 до 35%, в России — около 12%; устойчивость ассоциируется с клиническим неуспехом терапии. Высокая частота резистентности в России к ко-тримоксазолу и тетрациклинам (>50%). Низкая природная активность ранних фторхинолонов, в последние годы отмечено увеличение частоты резистентных штаммов; высокая активность новых фторхинолонов — резистентность минимальная. |
| Streptococcus pyogenes | Возрастание устойчивости к макролидам: в Европе до 50%, в России 10-20%. Рост устойчивости прямо связан с увеличением частоты потребления макролидов, главным образом пролонгированных препаратов (азитромицин, кларитромицин). Высокая устойчивость к тетрациклинам (>50%). Низкая природная активность ранних фторхинолоно в. Устойчивость к пенициллину и другим b-лактамам не описана. |
| Haemophilus influenzae | Продукция b-лактамаз в 1 — 40%, в России не превышает 10%; клинически амоксициллин не уступает защищенным пенициллинам. Практически не наблюдается устойчивости к амоксициллину/клавуланату, цефалоспоринам II-IV поколений, фторхинолонам. Цефалоспорины I поколения не активны. Природная активность макролидов низкая, риск бактериологического неуспеха лечения высокий. Устойчивость к ко-тримоксазолу в России около 20%. |
Наиболее значимые проблемы, связанные с применением основных антибактериальных средств при инфекциях дыхательных путей, могут быть сформулированы следующим образом. b-лактамы:
| Рекомендуются | Не рекомендуются |
|
Пенициллины Амоксициллин Амоксициллин/клавуланат Пероральные цефалослорины II поколения Цефуроксим аксетил Новые фторхинолоны Левофлоксацин Моксифлоксацин Макролиды (только при атипичной пневмонии) Доксициклин (только при атипичной пневмонии) |
Ко-тримоксазол Ампиокс Аминогликозиды Гентамицин Ранние фторхинолоны Ципрофлоксацин Офлоксацин Пефлоксацин Ломефлоксацин Цефалоспорины I поколения Цефазолин Цефалексин Цефрадин Цефаклор Пероральные цефалоспорины III поколения Цефтибутен |
Следует подчеркнуть, что назначение некоторых антибактериальных препаратов, применяемое в амбулаторной практике при респираторных инфекциях, нельзя признать рациональным. К таким препаратам прежде всего относятся:
| Тонзиллофарингит | Острый средний отит | Синусит | Хронический бронхит | Пневмония |
| Амоксициллин Амоксициллин/клавуланат1 Феноксиметилпенициллин Бензатин пенициллин Цефадроксил Цефуроксим аксетил1 Линкомицин1 Клиндамицин1 |
Амоксициллин Амоксициллин/клавуланат Цефуроксим аксетил Цефтриаксон |
Амоксициллин/клавуланат Цефуроксим аксетил Левофлоксацин Моксифлоксацин Клиндамицин |
Амоксициллин/клавуланат Амоксициллин Цефуроксим аксетил Левофлоксацин Моксифлоксацин |
Амоксициллин Амоксициллин/клавуланат Макролиды2 Доксициклин2 Левофлоксацин Моксифлоксацин |
1 Преимущественно при рецидивирующем течении
2При атипичной этиологии (Mycoplasma pneumoniae, Chlamydia pneumoniae, Legionella pneumopriila) Представленные рекомендации имеют наиболее общий характер. В то же время с практических позиций выбор оптимального антибактериального препарата также должен осуществляться с учетом особенностей пациента и заболевания. Так, например, у больных пневмонией молодого и среднего возраста без отягощающих факторов терапевтический эффект оказывают амоксициллин, макролиды, защищенные пенициллины и новые фторхинолоны. Однако у больных пожилого возраста в этиологии заболевания большее значение приобретают S. aureus и грамотрицательные бактерии, что объясняет снижение эффективности амоксициллина и макролидов у этой категории больных. Также распространенной во врачебной практике ошибкой является отказ от назначения антибактериальной терапии при пневмонии беременным женщинам из-за опасения негативного влияния препаратов на плод. Следует отметить, что перечень антибактериальных препаратов, прием которых нежелателен во время беременности из-за риска эмбриотоксического действия, ограничен — тетрациклины, хлорамфеникол, сульфаниламиды, ко-тримоксазол, фторхинолоны, аминогликозиды. Другие антибиотики, в частности b-лактамы, макролиды, могут применяться у беременных женщин. Другие возможные факторы, влияющие на выбор антибактериального препарата, представлены в таблице 7. Таблица 7. Особые клинические ситуации при внебольничных инфекциях нижних дыхательных путей.
| Ситуация | Возбудители | Наиболее надежные препараты |
| Алкоголизм, сахарный диабет | Enterobacteriaceae S. aureus S. pneumoniae |
Амоксициллин/клавуланат Левофлоксацин Моксифлоксацин |
| Деструкция, абсцедирование | S. aureus Анаэробы К. pneumoniae |
Амоксициллин/клавуланат Клиндамицин + цефалоспорин I II поколения Фторхинолон + метронидазол Имипенем Меропенем |
| Бронхоэктазы, муковисцидоз | P. aeruginosa S. aureus |
Ципрофлоксацин Цефтазидим Меропенем |
| ВИЧ | P. carinii Enterobacteriaceae |
Ко-тримоксазол + фторхинолон |
Нередки ошибки при выборе антибактериального препарата в случае неэффективности первоначального. Здесь необходимо также остановиться на ошибках антибактериальной терапии, которые касаются несвоевременной оценки неэффективности первоначального антибиотика. Общепринятым критическим сроком оценки эффективности (или неэффективности) антибактериальной терапии считаются 48-72 ч с момента его назначения. К сожалению, приходится нередко сталкиваться с такими случаями, когда больной продолжает получать назначенный антибиотик в течение недели и более, несмотря на отсутствие очевидного клинического эффекта. Обычно критерием эффективности антибактериальной терапии является снижение или нормализация температуры тела больного, уменьшение признаков интоксикации. В тех случаях (не столь частых), когда лихорадка с самого начала заболевания отсутствует, приходится ориентироваться на другие признаки интоксикации (головная боль, анорексия, общемозговая симптоматика и т. д.), а также на отсутствие прогрессирования заболевания за период проводимого лечения. Продолжение антибактериальной терапии, невзирая на ее неэффективность, имеет немало негативных последствий. При этом затягивается назначение другого, более адекватного антибиотика, что ведет к прогрессированию воспаления (особенно важно при тяжелых пневмониях, у больных с сопутствующей патологией) и развитию осложнений, а также удлиняет сроки лечения. Кроме того, повышается риск возникновения побочных (токсических) эффектов препаратов, а также развития и усиления антибиотикорезистентности. Продолжение лечения, несмотря на неэффективность проводимой терапии, подрывает доверие больного и его родственников к лечащему врачу. Очевидна и неэкономичность такой ошибочной тактики антибактериальной терапии (напрасный расход неэффективного АП, дополнительные затраты на лечение токсических эффектов и др.). Кроме того, ошибки встречаются при замене неэффективного антибиотика на другой, т. е. при смене препарата. При этом врач забывает, что принцип выбора антибактериального препарата остается прежним, т. е. ориентироваться следует на клиническую ситуацию с учетом, однако, неэффективности первоначального препарата и ряда других дополнительных признаков. Отсутствие эффекта от первоначально назначенного антибиотика в известной степени должно служить дополнительным ориентиром, позволяющим обосновать выбор второго препарата. Так, например, отсутствие эффекта от применения b-лактамных антибиотиков (пенициллины, цефалоспорины) у больного с внебольничной пневмонией позволяет предполагать атипичную этиологию пневмонии (микоплазменной, хламидийной или легионеллезной) с учетом, разумеется, других клинических признаков. Клинические признаки атипичной пневмонии, вызванной Mycoplasma pneumoniae или Chlamydia pneumonias:
| Примеры | Целесообразно |
| Амоксициллин внутрь 0,75-1 г в сутки | 0,5-1 г три раза в сутки |
| Ампициллин в/в 2 г в сутки | 1 г четыре раза в сутки |
| Амоксициллин/клавуланат внутрь 0,375 г три раза в сутки |
0,625 г три раза в сутки или 1 г два раза в сутки |
| Цефуроксим аксетил внутрь 0,5 г в сутки | 0,5 г два раза в сутки |
| Эритромицин внутрь 1 г в сутки | 0,5 г четыре раза в сутки |
| Кларитромицин внутрь 0,5 г в сутки | 0,5 г два раза в сутки |
| Ципрофлоксацин внутрь 0,5 г в сутки | 0,5-0,75 г два раза в сутки |
| Оксациллин внутрь 1-1,5 г в сутки | Не рекомендуется |
| Ампиокс внутрь 0,25-0,5 г три раза в сутки | Не рекомендуется |
Неправильный выбор интервалов между введениями антибактериальных препаратов обычно обусловлен не столько сложностями парентерального введения препаратов в амбулаторных условиях или негативным настроем больных, сколько неосведомленностью практикующих врачей о некоторых фармакодинамических и фармакокинетических особенностях препаратов, которые должны определять режим их дозирования. Типичной ошибкой является назначение в амбулаторной педиатрической практике при пневмонии бензилпенициллина с кратностью введения два раза в сутки, так как более частое его введение неудобно для пациента. Следует отметить, что при нетяжелом течении пневмонии вряд ли оправдано стремление некоторых врачей к обязательному назначению парентеральных антибиотиков. Современные антибактериальные препараты характеризуются хорошей биодоступностью при приеме внутрь, а также одинаковой клинической эффективностью с парентеральными препаратами, поэтому в подавляющем большинстве случаев оправдано лечение пероральными препаратами. Если назначение парентеральных антибиотиков действительно необходимо, следует выбрать препарат с длительным периодом полувыведения (например, цефтриаксон), что позволяет назначать его один раз в сутки. IV. Ошибки при комбинированном назначении антибиотиков Одной из ошибок антибактериальной терапии внебольничных респираторных инфекций является необоснованное назначение комбинации антибиотиков. Врачи старших поколений помнят то время (50-70-е гг. прошлого столетия), когда при лечении пневмонии обязательным считалось назначение пенициллина и стрептомицина, о чем свидетельствовали многие учебные пособия и руководства. Это был своеобразный стандарт лечения пневмоний для того времени. Несколько позднее одновременно с антибиотиками рекомендовалось назначение сульфаниламидов, с учетом полученных в свое время 3.В.Ермольевой данных о химиотерапевтическом синергизме сульфаниламидов и пенициллина. В современной ситуации, при наличии большого арсенала высокоэффективных антибактериальных препаратов широкого спектра, показания к комбинированной антибактериальной терапии значительно сужены, и приоритет в лечении респираторных инфекций остается за монотерапией. В многочисленных контролируемых исследованиях показана высокая клиническая и бактериологическая эффективность адекватных антибактериальных средств при лечении респираторных инфекций в режиме монотерапии (амоксициллин, амоксициллин/клавуланат, цефалоспорины II — III поколений, новые фторхинолоны). Комбинированная антибактериальная терапия не имеет реальных преимуществ ни в выраженности эффекта, ни в предотвращении развития резистентных штаммов. Основными показаниями к комбинированной антибактериальной терапии являются тяжелое течение пневмонии — в этом случае общепринятым стандартом лечения становится комбинированное назначение парентерального цефалоспорина III поколения (цефотаксим или цефтриаксон) и парентерального макролидного антибиотика (эритромицин, или кларитромицин, или спирамицин); последние включаются в комбинацию для воздействия на вероятных атипичных микроорганизмов (легионелла или микоплазма). Следует отметить, что в настоящее время в клинической практике появились новые антибактериальные препараты (левофлоксацин, моксифлоксацин) с высокой активностью в отношении как типичных, так и атипичных возбудителей, что позволяет назначать их в режиме монотерапии даже при тяжелой пневмонии. Другой клинической ситуацией, оправдывающей комбинированное назначение антибиотиков, является пневмония у иммунокомпрометированных пациентов (лечение цитостатиками, СПИД), при которой имеется высокая вероятность ассоциации возбудителей (см. таблицу 7). К сожалению, часто в амбулаторной практике приходится сталкиваться с ситуациями, при которых больным с нетяжелым течением пневмонии, при отсутствии осложнений, тяжелой фоновой патологии назначается два антибиотика. Логичного обоснования этой тактики лечения нет, при этом следует учитывать возможный антагонизм препаратов, более высокий риск нежелательных реакций и увеличение стоимости лечения. Следует отметить, что нерациональные комбинации антибактериальных препаратов имеют и официальные лекарственные формы, которые выпускаются отечественной фармацевтической промышленностью, например ампиокс, олететрин. Разумеется, применение таких препаратов недопустимо. V. Ошибки, связанные с длительностью антибактериальной терапии и критериями клинической эффективности В некоторых случаях проводится необоснованно длительная антибактериальная терапия. Такая ошибочная тактика обусловлена, прежде всего, недостаточным пониманием цели самой антибактериальной терапии, которая сводится прежде всего к эрадикации возбудителя или подавлению его дальнейшего роста, т. е. направлена на подавление микробной агрессии. Собственно воспалительная реакция легочной ткани, которая проявляется различными клинико-рентгенологическими признаками (аускультативная картина, сохраняющаяся рентгенологическая инфильтрация, ускорение СОЭ) регрессирует медленнее и не требует продолжения антибактериальной терапии (см. таблицу 9). В связи с этим следует считать ошибочной тактику, согласно которой у больного с сохраняющимися рентгенологическими признаками легочной инфильтрации, крепитирующими хрипами (crepitacio redux), увеличением СОЭ при нормализации температуры тела и исчезновении (или уменьшении) признаков интоксикации продолжают проводить антибактериальную терапию. Таблица 9. Сроки исчезновения симптомов при эффективной антибактериальной терапии внебольничной пневмонии.
| Симптомы и признаки | Сроки исчезновения |
| Интоксикация | 24-48 ч |
| Отрицательная гемокультура | 24-72 ч |
| Лихорадка | 2 — 5 дней |
| Лейкоцитоз | 5- 10 дней |
| Хрипы в легких | 1 — 3 недели |
| Сухой кашель | 2 — 8 недель |
| Инфильтрация на рентгенограмме | 2 — 8 недель |
Еще более ошибочна тактика замены одного антибиотика на другой в подобных ситуациях, расцениваемых врачом как неэффективность назначенной антибактериальной терапии. У некоторых больных после исчезновения признаков интоксикации и даже регрессии воспалительных изменений в легких в течение длительного времени может сохраняться слабость, потливость, субфебрильная температура. Последняя расценивается врачом как проявление не полностью купированной бронхолегочной инфекции, что «подтверждается» рентгенологическими данными в виде изменения легочного рисунка или «остаточными явлениями пневмонии» и обычно влечет за собой назначение антибактериального препарата, несмотря на отсутствие изменений со стороны крови. Между тем подобная клиническая ситуация часто обусловлена вегетативной дисфункцией после легочной инфекции (постинфекционная астения) и не требует антибактериальной терапии, хотя, разумеется, в каждом конкретном случае необходимы тщательное обследование больного и расшифровка всей имеющейся симптоматики. Рекомендованная длительность применения антибактериальных препаратов при бронхолегочных инфекциях приведена в таблице 10. Таблица 10. Длительность антибактериальной терапии бактериальных респираторных инфекций в амбулаторной практике.
| Заболевания | Рекомендованная длительность терапии (дни) |
| Стрептококковый тонзиллофарингит | 10* |
| Острый средний отит | 5-7** |
| Острый синусит | 10-14 |
| Обострение хронического бронхита | 7-10*** |
| Пневмония | 5-7**** |
| * | Показана эффективность цефуроксим аксетила, телитромицина и азитромицина при пятидневных курсах; бензатинпенициллин вводится однократно внутримышечно |
| ** | Показана эффективность цефтриаксона (50 мг/кг в сутки) в течение трех дней |
| *** | Показана эффективность новых фторхинолонов (левофлоксацин, моксифлоксацин) при пятидневных курсах |
| **** | Обычно рекомендуемые сроки леченая составляют три-четыре дня после нормализации температуры; средние сроки лечения — пять-десять дней. При стафилококковой этиологии пневмонии рекомендуется более длительный курс антибактериальной терапии — две-три недели; при атипичной пневмонии (микоплазменная, хламидийная, легионеллезная) предполагаемая длительность антибактериальной терапии составляет 10-14 дней. |
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Пневмония — острое инфекционное заболевание, преимущественно бактериальной этиологии, характеризующееся очаговым поражением респираторных отделов легких, наличием внутриальвеолярной экссудации, выявляемой при физикальном и/или инструментальном исследовании, и выраженными в разной степени лихорадочной реакцией и интоксикацией.
С учетом условий развития болезни, особенностей инфицирования и состояния иммунологической реактивности макроорганизма общепризнанным считается выделение следующих видов пневмонии:
— внебольничная (домашняя, амбулаторная);
— госпитальная (нозокомиальная, внутрибольничная);
— аспирационная;
— пневмония у лиц с иммунодефицитными состояниями.
Диагноз внебольничной пневмонии (ВП) у 30–40 % заболевших устанавливается лишь в конце 1-й недели болезни, обычно по результатам рентгенологического исследования. Диагностические ошибки чаще встречаются в случаях заболевания лиц пожилого и старческого возраста. Это в немалой степени обусловлено имеющимся полиморбидным фоном, свойственным лицам старше 60 лет. ВП у них обычно развивается на фоне серьезной предшествующей патологии: хронической обструктивной болезни легких (ХОБЛ), ишемической болезни сердца, застойной сердечной недостаточности, новообразований, сахарного диабета, почечной недостаточности, цирроза печени, что обусловливает атипичное течение заболевания.
Причины ошибок
Гипердиагностика
Анализ собственных 2000 наблюдений показывает, что у врачей общей практики доминирует гипердиагностика ВП. Ошибочный диагноз нередко устанавливается при лихорадочном синдроме, который может быть проявлением гриппа, пиелонефрита, холецистита, сальмонеллеза, рожи, онкологических заболеваний.
Гипердиагностика возможна при неправильной интерпретации аускультативных данных при застойной сердечной недостаточности, альвеолитах. Ошибки в диагностике могут возникнуть по вине не только клинициста, но и рентгенолога, когда изменения, обусловленные застойной сердечной недостаточностью, онкологической патологией или туберкулезным процессом, оцениваются как пневмоническая инфильтрация.
Осложнения
Трудности диагностики могут быть обусловлены и развитием осложнений, симптоматика которых в ряде случаев начинает доминировать в клинической картине болезни. Чаще всего причиной таких ошибок является интенсивный плевральный болевой сидром, который влечет за собой ошибочные диагнозы инфаркта миокарда, холецистита, перфоративной язвы, кишечной непроходимости.
Плевральный болевой синдром. Для дифференциации плевральной боли важно оценить ее связь с дыханием. Плевральная боль усиливается на вдохе. Для уменьшения боли пациенты нередко принимают вынужденное положение на боку, на стороне поражения, что уменьшает глубину дыхания. Диагноз фибринозного плеврита становится несомненным, если удается выслушать шум трения плевры.
Инфаркт миокарда. При болях в левой половине грудной клетки необходимый стандарт обследования включает проведение электрокардиографии для исключения инфаркта миокарда.
Мозговой инсульт. Декомпенсация дисциркуляторной энцефалопатии вследствие тяжелой интоксикации при пневмонии у стариков иногда ведет к установлению трагически ошибочного диагноза инсульта.
Острые респираторные вирусные инфекции (ОРВИ). Наиболее частой ошибкой в диагностике ВП являются ситуации, когда появление лихорадки и симптомов интоксикации расценивается как ОРВИ и, соответственно, назначаются противовирусные и жаропонижающие средства. Итог: установление правильного диагноза только на 5–7-е сутки болезни, что приводит к поздней госпитализации и запоздалой патогенетической терапии.
Это приходилось наблюдать в конце 2009 г., в период эпидемической вспышки гриппа A2 (H1N1 Калифорния). У ряда пациентов на амбулаторном этапе диагностировался грипп и применялась противовирусная терапия и лишь в случае значительного ухудшения состояния устанавливался правильный диагноз пневмонии. При поступлении у таких пациентов диагностировались критически тяжелые полисегментарные и многодолевые пневмонии, что требовало проведения массивной системной терапии и применения искусственной вентиляции легких в связи с развитием тяжелой дыхательной недостаточности.
Клинико-диагностические особенности
Диагностика пневмонии обычно основывается на следующих признаках:
— повышение температуры до фебрильных или субфебрильных цифр;
— кашель (чаще с отделением мокроты);
— озноб;
— плевральная боль;
— одышка.
При долевых пневмониях выявляются признаки консолидации легочной ткани — укорочение перкуторного звука, бронхиальное дыхание, усиление голосового дрожания. Наиболее часто при аускультации выявляются локальные мелкопузырчатые хрипы или характерный феномен крепитации. У лиц пожилого и старческого возраста может не быть классических проявлений пневмонии. Возможны лихорадка или, напротив, гипотермия; спутанность сознания; одышка (или сочетание этих симптомов).
В общем анализе крови выявляются:
— лейкоцитоз более 10,0 х 1000/мкл;
— сдвиг лейкоцитарной формулы влево;
— токсическая зернистость нейтрофилов.
Роль атипичных возбудителей
Объяснить необычно высокую частоту диагностических ошибок можно и возросшей ролью в этиологии таких агентов, как микоплазма и хламидии. Клиническая картина пневмонии, вызванной этими возбудителями, отличается от характерных проявлений классической крупозной пневмонии пневмококковой природы.
При так называемых атипичных пневмониях, вызванных микоплазмой (Mycoplasma pneumoniae) или хламидиями (Chlamydia pneumoniae и Chlamydia psittachi), заболевание обычно начинается с респираторной инфекции верхних дыхательных путей по типу фарингита, ларинготрахеита. Кашель обычно малопродуктивный или сухой. Характерны приступы мучительного коклюшеподобного сухого кашля необычно низкого тембра. Иногда во время пароксизма кашля затруднен вдох. Эта симтпоматика обусловлена феноменом трахеобронхиальной дискинезии — патологической подвижностью мембранной части трахеи. Описанный феномен отмечается более чем у 1/2 больных атипичными пневмониями. Для микоплазменных пневмоний характерны миалгии в начале болезни, сильная потливость и астенический синдром, которые отмечаются даже при низком субфебрилитете. При пневмонии, вызванной этими внутриклеточными агентами, нередко в лейкоцитарной формуле не фиксируются характерные воспалительные сдвиги.
Рентгенологическое исследование
Для установления диагноза пневмонии доказательным является рентгенологическое исследование. Рентгенография легких также выявляет такие осложнения, как абсцедирование, экссудативный плеврит. Рентгенологические изменения при пневмонии могут отсутствовать. Это бывает в самом начале болезни, при дегидратации, тяжелой нейтропении, а также при пневмоцистной этиологии заболевания. Рентгенологические данные обеспечивают и уточнение клинических ситуаций, обусловленных болями в грудной клетке неуточненной природы, таких как пневмоторакс, экссудативный перикардит, расслаивающая аневризма грудного отдела аорты. Рентгенография легких снижает частоту диагностических ошибок в 10(!) раз. Компьютерная томография (КТ) легких оправдана лишь при проведении дифференциальной диагностики, если обычная рентгенограмма малоинформативна, и для более точной оценки возможных осложнений. КТ позволяет выявлять ранние инфильтративные и интерстициальные изменения, когда стандартная рентгенография еще не демонстративна. Четко определяются полости, лимфаденопатии, плевральный выпот и многоочаговые изменения.
Лабораторная диагностика
Этиологический диагноз пневмонии, являющийся гарантом успешной терапии, обычно основывается на бактериологическом исследовании мокроты, которое не всегда информативно. Наиболее доказательным подтверждением генерализации инфекции является выделение гемокультуры, однако посевы крови могут быть положительными только при бактериемии и при условии, что кровь на стерильность взята до начала химиотерапии. Проводимое лечение не влияет на результаты некультуральных исследований, которые используются для этиологической расшифровки микоплазменных, хламидийных и легионеллезных инфекций.
Специфические антитела к этим возбудителям определяются с помощью реакции непрямой иммунофлюоресценции или более современных методик — теста ELISA (антитела к микоплазме и хламидиям) и определения антигена в моче (легионелла). Ни один из перечисленных методов (кроме определения антигена легионеллы в моче) не обеспечивает расшифровку возбудителя в ранние сроки, и поэтому решение о выборе антибиотика для начальной терапии практически всегда принимается эмпирически. В амбулаторной практике выявить этиологически значимый возбудитель пневмонии у конкретного пациента весьма затруднительно.
Анализ данных
Представляет интерес сопоставление рентгеноморфологических данных с этиологическими агентами пневмоний.
Так, долевые и многодолевые паренхиматозные инфильтрации характерны для пневмококковой и легионеллезной пневмонии. Очагово-сливные двусторонние инфильтрации могут быть гриппозной, пневмококковой, стафилококковой и легионеллезной природы. Гомогенные очаговые инфильтрации характерны для пневмококковой и легионеллезной инфекции, в то время как негомогенные очаговые инфильтрации более типичны для вирусной, стафилококковой и микоплазменной природы. Сочетание инфильтративных и интерстициальных изменений типично для поражений вирусами, микоплазмой, пневмоцистами. Пневмонии, проявляющиеся милиарными интерстициальными изменениями, характерны для сальмонелл, микобактерий туберкулеза, грибов. Вирусы, микоплазма, хламидии, грибы нередко вызывают пневмонии, рентгенологически проявляющиеся сетчатыми интерстициальными изменениями. Пневмония, проявляющаяся инфильтративными или интерстициальными изменениями в сочетании с увеличением лимфатических узлов средостения, чаще вызывается микобактериями туберкулеза, микоплазмой, хламидиями, грибами.
Деструктивные пневмонии с развитием множественных перибронхиальных абсцессов обычны при стафилококковой инфекции, в то время как единичные крупные абсцессы более типичны для пневмоний, вызванных клебсиеллой.
Антимикробная терапия
Установление диагноза пневмонии является абсолютным показанием к назначению антибактериальной терапии. Несмотря на существование многочисленных руководств, национальных рекомендаций по антибактериальной терапии ВП, в клинической практике, тем не менее, имеют место разные стратегические и тактические ошибки.
Ошибки в выборе антибактериальных средств могут быть обусловлены:
— незнанием врача эпидемиологического анамнеза;
— неверной оценкой потенциальных этиологических агентов;
— недооценкой аллергологического анамнеза;
— недостаточной ориентацией врача в лекарственных препаратах-генериках.
Наиболее частыми и типичными ошибками при выборе средств антибактериальной терапии пневмонии в условиях амбулаторной практики можно считать:
— применение гентамицина (аминогликозиды не активны в отношении пневмококков и атипичных возбудителей);
— применение фторхинолонов II поколения (низкая активность в отношении пневмококков);
— использование недостаточных доз ингибиторозащищенных аминопенициллинов (недооценка степени тяжести состояния);
— использование коротких курсов (3–5 дней) макролидов при микоплазменной и хламидийной инфекции.
Неадекватный режим назначения и дозирования антимикробных препаратов
Продолжает действовать и многолетний стереотип назначения лекарственных препаратов «по 1 таблетке 3 раза в день». Так, самая частая ошибка при назначении защищенных пенициллинов — применение препарата амоксиклав (амоксициллин 250 мг + клавулановая кислота 125 мг) в дозе 3 таблетки в сутки. Такой режим дозирования неэффективен из-за малой суточной дозы амоксициллина, которая должна быть более 1,5 г/сут. Ошибка в режиме дозирования левофлоксацина или моксифлоксацина «по 1 таблетке 3 раза в день» означает превышение суточной дозировки препарата в 3 раза. Выбор лекарственной формы и, соответственно, пути введения антибактериального препарата определяются многими факторами: степенью тяжести заболевания, состоянием пациента, фармакологическими особенностями лекарственного препарата. Стремление врача сделать процесс лечения более комфортным или менее нагрузочным для пациента, назначение антибактериального препарата внутрь без учета конкретной клинической ситуации и пренебрежение фармакокинетическими свойствами препарата могут стать одной из причин недостаточного эффекта или неэффективности лечения в целом. Не следует назначать антибактериальные препараты внутрь при тяжелых пневмониях (особенно препараты с низкой биодоступностью), что не позволяет достигать оптимальной концентрации препарата в крови. В то же время при пневмонии легкого и среднетяжелого течения, отсутствии осложнений и серьезной фоновой патологии допустимо и целесообразно проведение антибактериальной терапии препаратами для приема внутрь.
Рекомендации
Выбор препарата
В рутинной практике типичной является ситуация, когда возбудитель неизвестен и выбор антибиотика первого ряда проводится исключительно эмпирически. Планирование эмпирической терапии основывается на вероятной этиологии пневмонии и данных о подтвержденной в контролируемых клинических испытаниях эффективности тех или иных препаратов при пневмонии известной этиологии.
В соответствии с принятыми стандартами большинство пациентов с диагностированной ВП легкого и среднетяжелого течения могут проходить лечение в амбулаторных условиях. При нетяжелой ВП предпочтение отдается пероральным формам антимикробных препаратов. Парентеральная терапия чаще используется у лиц пожилого возраста и пациентов со среднетяжелым/тяжелым течением заболевания.
Федеральный формуляр (2004–2006 гг.) амбулаторного лечения ВП предусматривает назначение антибактериальных препаратов следующих групп:
— макролиды (азитромицин, кларитромицин);
— ингибиторозащищенные аминопенициллины (амоксициллин/клавулановая кислота);
— «респираторные» фторхинолоны (моксифлоксацин);
— цефалоспорины III поколения (цефотаксим).
Особое место среди приведенных групп антимикробных лекарственных препаратов занимают ингибиторозащищенные аминопенициллины.
Роль аминопенициллинов в лечении ВП определяется их активностью против продуцирующих b-лактамазы H.influenzae, S.аureus, энтеробактерий (K.pneumoniae, E.coli), вероятность этиологической роли которых увеличивается при более тяжелом течении заболевания.
Несмотря на то что препараты этой группы не перекрывают весь спектр потенциальных возбудителей ВП, в ходе клинических исследований не удалось выявить различий в клинической эффективности ингибиторозащищенных препаратов и отдельных представителей макролидных антибиотиков или респираторных фторхинолонов (категория доказательств А).
Практическому врачу следует иметь в виду, что факторами риска пенициллин-резистентности S.pneumoniae являются возраст больных старше 60 лет, наличие тяжелых соматических заболеваний, частое и длительное лечение антибиотиками, проживание в интернатах для престарелых. Другой проблемой резистентности является продукция H.influenzae фермента b-лактамазы, что обычно наблюдается у больных ХОБЛ, часто получающих антимикробную химиотерапию в связи с обострениями болезни. Учитывая эту информацию, в случаях пневмонии, возникшей на фоне ХОБЛ, назначение ингибиторозащищенных аминопенициллинов полностью оправданно.
Поскольку механизмы резистентности к пенициллину у S.pneumoniae и H.influenzae различны, то ингибиторозащищенные аминопенициллины активны против H.influenzae, продуцирующей b-лактамазу. Они могут сохранять активность по отношению к S.pneumoniae с невысоким уровнем резистентности, а также к пенициллин-резистентным стафилококкам. Поэтому в ситуациях с высокой вероятностью стафилококковой природы ВП (после перенесенного гриппа, на фоне хронического алкоголизма) выбор ингибиторозащищенных аминопенициллинов абсолютно обоснован.
Приверженность терапии
Введение/прием антибактериальных лекарственных препаратов на амбулаторном этапе зависит только от пациента. К сожалению, нередки случаи, когда первые признаки клинического улучшения служат сигналом пациенту для прекращения лечения или нарушения рекомендованного режима приема препарата. Следствие этого — потенциальный рост устойчивости микроорганизмов и меньшая, чем ожидается, эффективность антибиотикотерапии. Один из очевидных способов решения проблемы — сокращение продолжительности курса антибактериальной терапии.
При проведении антимикробной терапии в амбулаторных условиях следует обязательно считаться и с режимом приема лекарственного препарата: при приеме антибиотика 1–2 раза в сутки вероятность выполнения пациентом рекомендаций врача значительно выше. Два раза в сутки (каждые 12 ч) применяется препарат амоксиклав квиктаб (диспергируемые таблетки, содержащие 875 мг амоксициллина и 125 мг клавулановой кислоты). Особенностью этой лекарственной формы является возможность употреблять препарат, растворяя таблетку в половине стакана воды.
Оценка эффективности
Отсутствие эффекта от антибактериальной терапии в течение 24–48 ч требует тщательного анализа клинической ситуации, ревизии точности диагноза, оценки возможных осложнений пневмонии или лекарственной терапии. В эти сроки врач еще не располагает микробиологическими данными и фактически вновь рассматривает клиническую ситуацию, дополнительным условием которой является учет спектра действия и режима дозирования применявшегося антибиотика.
Продолжительность терапии
Ошибки в длительности антибактериальной терапии наиболее часты при лечении атипичных пневмоний. Правильно устанавливается диагноз, правильно назначаются препараты группы макролидов, однако продолжительность их применения часто ограничивается 5–7 днями. Клинически все проявления пневмонии стихают, и констатируется выздоровление. Однако через несколько дней клиническая симптоматика проявляется вновь. Подобные ситуации можно избежать, если соблюдать необходимые сроки антибактериальной терапии.
До сих пор оптимальная продолжительность лечения ВП является предметом дискуссий. Современные руководства определяют минимальный срок антибактериальной терапии неосложненной пневмонии в пределах 5 сут. и более (уровень рекомендации I). При микоплазменной и хламидийной этиологии пневмонии продолжительность антибактериальной терапии может значительно увеличиваться (при обязательном условии клинической и микробиологической эффективности).
Таким образом, своевременная диагностика ВП и грамотная рациональная тактика выбора препарата и ведения антибактериальной терапии обеспечивают успешное лечение этого иногда драматически протекающего, но широко распространенного заболевания.
disserCat — электронная библиотека диссертаций работаем для вас с 2009 года
- Корзина пуста
Вход
|
Регистрация
Вы робот?
Мы заметили, что с вашего адреса поступает очень много запросов.
Подтвердите, что вы не робот