Как изменится жизнь после резекции желудка: важная информация для пациентов и их близких
Содержимое
- 1 Как изменится жизнь после резекции желудка: важная информация для пациентов и их близких
- 1.1 Подготовка к резекции желудка
- 1.1.1 Медицинские осмотры и анализы
- 1.1.2 Диета и физические упражнения
- 1.1.3 Подготовка психологически
- 1.2 Видео по теме:
- 1.3 Процесс резекции желудка
- 1.4 Осложнения после резекции желудка
- 1.5 Реабилитация после удаления части желудка
- 1.6 Жизнь после резекции желудка: Как изменится пищеварение
- 1.6.1 Сокращение объема желудка
- 1.6.2 Изменение процесса переваривания пищи
- 1.6.3 Необходимость контроля за рационом питания
- 1.7 Питание после операции по удалению желудка
- 1.7.1 Выбор правильных продуктов
- 1.7.2 Режим питания
- 1.7.3 Избегайте жидкости во время еды
- 1.8 Как получить достаточное количество питательных элементов после резекции желудка?
- 1.8.1 Рацион питания
- 1.8.2 Белок
- 1.8.3 Жир
- 1.8.4 Углеводы
- 1.8.5 Витамины и минералы
- 1.9 Проблемы с потреблением алкоголя и курением после резекции желудка
- 1.9.1 Алкоголь
- 1.9.2 Курение
- 1.10 Повышенный риск развития рака после резекции желудка
- 1.11 Психологические проблемы после резекции желудка
- 1.12 Возвращение к обычной жизни после резекции желудка
- 1.12.1 Общие советы
- 1.12.2 Физическая активность
- 1.12.3 Трудовые занятия
- 1.12.4 Социальная жизнь
- 1.13 Вопрос-ответ:
-
- 1.13.0.1 Что такое резекция желудка?
- 1.13.0.2 Каковы последствия резекции желудка?
- 1.13.0.3 Как правильно питаться после резекции желудка?
- 1.13.0.4 Можно ли сексуальную жизнь вести после резекции желудка?
- 1.13.0.5 Существуют ли какие-либо формы занятий спортом после резекции желудка?
- 1.13.0.6 Можно ли пить алкоголь после резекции желудка?
-
- 1.1 Подготовка к резекции желудка
Что ждет человека после удаления части или всего желудка? Как изменится его жизнь? Узнайте о возможных ограничениях в питании, последствиях и приспособлениях, которые помогут вернуться к привычной жизни. Резекция желудка — это серьезный вид операции, который часто применяется в лечении различных заболеваний желудочно-кишечного тракта. Однако после такой операции многие пациенты сталкиваются с рядом сложностей в адаптации к новым условиям жизни. После удаления части желудка человек должен изменить свое питание, режим приема пищи, а также выполнять комплекс упражнений для снижения риска развития осложнений. Более того, патология может повлиять на эмоциональный фон пациента, вызывая стресс и нервозность. Тем не менее, благодаря правильной подготовке к операции, физической реабилитации и психологической поддержке, многие пациенты успешно преодолевают сложности и возвращаются к нормальной жизни. Следует отметить, что реабилитация после резекции желудка — это длительный процесс, который требует терпения и упорства.
Подготовка к резекции желудка
Медицинские осмотры и анализы
Перед операцией пациенту необходимо пройти ряд медицинских осмотров и анализов, чтобы оценить состояние здоровья и подготовиться к операции. Врачи будут измерять давление, вес, рост, проводить анализы крови и мочи, электрокардиограмму и рентген грудной клетки. Обязательно также будет проведена гастрофиброскопия, чтобы уточнить детали резекции желудка.
Читаю только по мере необходимости
52.27%
Диета и физические упражнения
Пациенту необходимо соблюдать специальную диету в течение нескольких дней или недель перед операцией. Это поможет уменьшить размер желудка и снизить риск осложнений. Также важно назначить соответствующие физические упражнения и убрать из рациона продукты, которые могут вызвать раздутость или запоры.
Подготовка психологически
Операция по резекции желудка может привести к чувству страха и неопределенности у пациента. Поэтому важно обсудить все вопросы с врачом и получить достаточно информации относительно операции и того, как жизнь изменится после нее. Некоторым пациентам может потребоваться консультация психолога, чтобы подготовиться к смене образа жизни и управлять эмоциями в этот период.
Видео по теме:
Процесс резекции желудка

Обычно во время операции удаляется часть желудка, которая содержит опухоль, язву или другой дефект. Затем к концу оставшегося желудка пришивается кишечник, чтобы продолжить пищеварение. Иногда может быть необходимо удаление соседних лимфоузлов.
Резекция желудка может быть необходима при раке желудка, язвенной болезни, беновых опухолях, заболеваниях, связанных с кислотностью желудочного сока и других состояниях. Важно понимать, что это серьезная операция и ее необходимо выполнять только в случае, когда ее польза превышает риски.
- Пациенты, которым была проведена резекция желудка, должны тщательно следить за своим питанием.
- Важно употреблять пищу медленно и в небольших порциях, чтобы избежать расширения желудка и дискомфорта.
- Многие пациенты, которым была проведена резекция желудка, потребуются витамины и минеральные добавки для поддержания здоровья.
Осложнения после резекции желудка
Резекция желудка – операция, после которой организм должен адаптироваться к новым условиям и особенностям функционирования органов пищеварения. В процессе реабилитации могут возникать различные осложнения.
- Кровотечение – это одно из наиболее опасных осложнений операции. Чаще всего кровотечение происходит на 2-3 день после операции. Оно может возникнуть как из магистральных сосудов, так и из мелких капилляров.
- Инфекция – еще одно опасное осложнение. Бактерии могут попасть в организм во время операции или в процессе реабилитации. Инфекция может привести к таким последствиям, как осложнение легочной функции, внутрибрюшные воспалительные процессы и даже сепсис.
- Нарушения кишечной функции – это одно из самых распространенных осложнений. При резекции желудка изменяется функционирование кишечника, что может привести к запорам, диарее и др. нарушениям.
- Нарушения водно-электролитного баланса – могут возникнуть в результате большой потери крови или жидкости во время операции. Недостаток электролитов может привести к нарушениям сердечного ритма, судорогам и др. проблемам.
- Пороки шва – могут возникнуть из-за неправильного осуществления операции или неправильной реабилитации.
При возникновении каких-либо осложнений необходимо обращаться за медицинской помощью и следовать рекомендациям врачей, чтобы предотвратить развитие серьезных осложнений и повысить шансы на восстановление организма.
Реабилитация после удаления части желудка
После резекции желудка пациенту необходима длительная и эффективная реабилитация. Она направлена на восстановление работоспособности организма и адаптацию к новым условиям пищеварения. Особенно важно следить за питанием, восстановить физическую активность и избегать стрессовых ситуаций.
В первые дни после операции пациент находится в палате под наблюдением медицинского персонала. Ему показывают, как правильно дышать и выполнять упражнения, направленные на восстановление подвижности кишечника и брюшной полости. Также проводится капельное введение жидкости и лекарств, а через несколько дней начинают вводить пищу через зонд.
После выписки из больницы пациенту необходимо следовать диете, которую назначит врач. Это позволит организму привыкнуть к новым условиям пищеварения и избежать осложнений. Также рекомендуется постепенно увеличивать физическую активность, начиная с ежедневных прогулок и простых упражнений по дыханию и растяжке.
- Полнокровное питание должно включать множество белков, жиров и углеводов, поэтому рекомендуется включать в рацион мясо, рыбу, яйца, каши, макароны.
- Первые 3 месяца после операции необходимо употреблять пищу в жидком или пюреобразном виде. После этого можно перейти на обычную пищу, но порции должны быть меньше, чем до операции.
- Частые приемы пищи (5-6 раз в день) помогают пищеварению.
- Нужно избегать жареной, жирной, острой и слишком сладкой пищи.
- Важно употреблять достаточно воды, чтобы избежать запоров.
Реабилитация после резекции желудка требует внимательности и терпения. Следование рекомендациям врачей и питание в соответствии с назначениями помогут пациенту быстрее приспособиться к новым условиям жизни и избежать осложнений.
Жизнь после резекции желудка: Как изменится пищеварение
Сокращение объема желудка
Одним из основных изменений после резекции желудка является сокращение его объема. Это значит, что человеку необходимо будет придерживаться определенной диеты и контролировать объем пищи, которую он потребляет за раз. В связи с уменьшением объема желудка, процесс пищеварения будет происходить быстрее, что может приводить к быстрой насыщаемости и чувству голода через короткий промежуток времени.
Изменение процесса переваривания пищи
После операции происходят изменения в процессе переваривания пищи. Это связано с тем, что кислота, выделяемая желудком, может попадать в кишечник быстрее, что может вызывать дискомфорт и неудобства. Также, уменьшение объема желудка может привести к тому, что пища быстрее покидает желудок, и не успевает перевариваться полностью.
Необходимость контроля за рационом питания

Питание после операции по удалению желудка
Выбор правильных продуктов
После резекции желудка, важно следить за качеством питания и избегать жирных, острых и сладких продуктов, чтобы избежать дискомфорта и проблем с пищеварением. Важно употреблять пищу высокого качества, содержащую все необходимые питательные вещества. Жидкие продукты, такие как бульоны, каши на воде, молочные продукты с низким содержанием жира и мясные продукты со специями помогут справиться с проблемами с пищеварением после операции.
Режим питания
После операции нужно следить за режимом питания. Старайтесь есть каждые 2-3 часа небольшими порциями. Такой подход поможет избежать чувства голода и заполнить желудок пищей, которую можно быстро и легко усвоить. Если вы не можете употреблять пищу каждые 2-3 часа, попробуйте увеличить число приемов пищи. Обратитесь к диетологу, чтобы он смог разработать оптимальный режим питания для вас.
Избегайте жидкости во время еды

- Каши на воде или на растительном бульоне;
- Компот из ягод;
- Молочные продукты с низким содержанием жира;
- Мясо, инжир, печенье, зеленый чай и рис,
Как получить достаточное количество питательных элементов после резекции желудка?
Рацион питания

Белок
Белки являются основой строительства новых тканей и клеток тела. Важно включать в рацион животные и растительные источники белка, такие как мясо, рыба, яйца, бобовые, орехи и семена.
Жир
Жиры необходимы для поддержания здоровой кожи и волос, а также усиления иммунитета. Необходимо включать в рацион натуральные жиры, такие как оливковое и кокосовое масло, авокадо, орехи и семечки. Однако, не стоит злоупотреблять жирной пищей, особенно животного происхождения.
Углеводы
Углеводы являются источником энергии для организма. Энергетические загрузки необходимы после сна и перед физическими нагрузками. Не следует употреблять пищу с высоким содержанием сахара, так как она может вызвать резкое увеличение уровня глюкозы в крови.
Витамины и минералы

Проблемы с потреблением алкоголя и курением после резекции желудка
Алкоголь
После резекции желудка потребление алкоголя может вызвать серьезные проблемы со здоровьем. Организм становится более чувствительным к алкогольным напиткам, поскольку их усвоение замедляется. Это может привести к большей вероятности повреждения печени и других внутренних органов. Кроме того, алкоголь может вызвать реакцию раздражения в области шва после операции. Следовательно, потребление алкоголя должно быть минимально или полностью исключено.
Курение
После резекции желудка курение может увеличить риск развития инфекций в легких, поскольку уменьшается количество кислорода, поступающего в организм через альвеолы легких. Курение также может привести к заживлению шва после операции в течение более длительного времени. Это может привести к увеличению длительности госпитализации и возможной необходимости второй операции. Кроме того, никотин может ослабить иммунитет, что делает организм более уязвимым для различных заболеваний.
- После резекции желудка желательно полностью исключить потребление алкоголя и курение.
- Алкоголизм и курение могут увеличить риск развития осложнений после операции и привести к увеличению длительности реабилитации.
- Важно обратиться к специалисту-терапевту для получения рекомендаций по отказу от вредных привычек и поддержки в процессе борьбы с ними.
Повышенный риск развития рака после резекции желудка
Резекция желудка – это операция, при которой удаляется часть или весь желудок. Она может проводиться при различных заболеваниях, таких как рак желудка или язвенная болезнь. Хотя эта операция может спасти жизнь пациента, она также может повысить риск развития рака в будущем.
После резекции желудка пациенты должны тщательно следить за своим здоровьем. Они должны регулярно посещать врача и контролировать свой рацион питания. Некоторые исследования показали, что регулярное употребление некоторых продуктов, таких как фрукты и овощи, может снизить риск развития рака у пациентов после резекции желудка.
Также важно, чтобы пациенты следили за своим весом и избегали курения и употребления алкоголя. Им следует обратить внимание на любые изменения в своем теле и немедленно сообщить об этом врачу. Регулярные обследования помогут выявить рак в его ранней стадии и повысить шансы на успешное лечение. Важно понимать, что повышенный риск развития рака после резекции желудка не означает, что он обязательно разовьется. При правильном уходе и контроле здоровья пациенты могут жить долгую и здоровую жизнь. Главное – не пренебрегать своим здоровьем и следить за ним с максимальной ответственностью.
Психологические проблемы после резекции желудка
Психологические проблемы после резекции желудка могут возникнуть у пациентов, которые прошли данную операцию. Обычно первые месяцы после резекции желудка сопряжены с различными нарушениями в пищеварительной системе, изменениями в рационе и питании, что может повлиять на настроение и эмоциональное состояние пациента. Некоторые из самых распространенных психологических проблем, с которыми сталкиваются пациенты:
- Депрессия и тревога, связанная с изменением жизни после операции;
- Страх перед едой, так как пациент может опасаться, что съев слишком много, вызовет проблемы в процессе пищеварения;
- Чувство вины или страх неудачи, связанный с невозможностью следовать диете или совершить ошибки в еде;
- Проблемы с телесным образом и самооценкой, особенно при потере веса после операции.
Важно помнить, что наличие у пациента психологических проблем после резекции желудка может привести к нарушениям в общем здоровье и вызвать дополнительные проблемы. Необходимо обратиться к специалисту, который сможет помочь в их решении.
Возвращение к обычной жизни после резекции желудка
Общие советы
После резекции желудка жизнь любого человека изменяется. Но не следует отчаиваться. Подходящие изменения в рационе и образе жизни позволят вернуться к обычной жизни. Важно придерживаться принципа малышево — «мало, но часто». Лучше есть десять раз в день, чем два раза в больших порциях. Кроме того, рекомендуется избегать жирной и острой пищи, мучных изделий, алкоголя и курения.
Физическая активность
Физические нагрузки после резекции желудка требуют особого внимания. В первый месяц после операции необходимо избегать физических упражнений. Далее, можно постепенно начинать заниматься более активной спортивной деятельностью. Рекомендуется выбирать спортивные упражнения с низкой интенсивностью и малым давлением на желудок. Например, ходьба, велосипед, плавание. Кроме того, не стоит забывать об упражнениях для укрепления мышц корпуса.
Трудовые занятия
Возвращение на работу после резекции желудка может занять несколько недель. В первый месяц после операции не стоит принимать на себя тяжелую физическую работу. Необходимо выбирать наиболее легкие и несложные задачи. Рекомендуется регулярный перерыв на отдых, чтобы не перенапрягать свой организм. Важно избегать стрессовых ситуаций и держать свой режим работы.
Социальная жизнь
После резекции желудка не следует сразу менять свой образ жизни. Необходимо продолжать общаться со своими друзьями и близкими. Если присутствуют проблемы с пищеварением, следует предупредить знакомых о своих новых требованиях к пище.
Рекомендуется избегать излишнего употребления алкоголя и других веществ, которые могут повредить вашему здоровью и вызвать вам потенциально опасную ситуацию.
В целом, возвращение к обычной жизни после резекции желудка зависит от нескольких факторов, включая состояние здоровья, возраст и индивидуальные потребности. Однако, следуя приведенным выше советам, можно пережить этот период легко и успешно.
Вопрос-ответ:
Что такое резекция желудка?
Резекция желудка — это хирургическая операция, при которой удаляется часть желудка. Обычно ее выполняют в случае онкологических заболеваний или язвенной болезни желудка, когда другие методы лечения не помогают.
Каковы последствия резекции желудка?
После резекции желудка, пациент может испытывать определенные проблемы со здоровьем. Одним из самых распространенных является диарея. Это связано с тем, что после операции желудок уже не может нормально пищеварить пищу, и она сразу проходит в кишечник. Также у пациентов может возникать анемия, из-за того что усваивание железа ослаблено. Кроме того, возможны проблемы с пищеварением и снижением веса.
Как правильно питаться после резекции желудка?
После резекции желудка очень важно следить за своим питанием. Организм больного уже не может полностью переваривать пищу и усваивать все нужные ему вещества. Поэтому очень важно питаться небольшими, но плотными порциями пищи 4-6 раз в день. Также нужно избегать жирной, сладкой и острой пищи, а также употреблять много жидкости. Рекомендуется обратиться к диетологу, который составит индивидуальный рацион питания, учитывая все особенности здоровья.
Можно ли сексуальную жизнь вести после резекции желудка?
Да, можно. Резекция желудка не влияет на половую жизнь пациента, но иногда может возникать усталость, снижение силы и интереса к сексу. В любом случае, если пациент испытывает какие-либо проблемы, он может обратиться к врачу-сексологу для консультации и поддержки.
Существуют ли какие-либо формы занятий спортом после резекции желудка?
Да, есть. После резекции желудка можно заниматься легкими видами спорта, например, ходьбой, бегом, занятиями йогой или плаванием. Также можно заниматься физическими упражнениями, направленными на укрепление мышечного корсета. Однако перед началом занятий спортом необходимо проконсультироваться с врачом и выбрать подходящую программу тренировок на основе индивидуальных особенностей здоровья.
Можно ли пить алкоголь после резекции желудка?
После резекции желудка не рекомендуется употреблять алкоголь, так как это может сильно навредить уже ослабленному организму. Алкоголь может вызвать раздражение слизистой оболочки желудка, а также нарушить всасывание важных питательных веществ. Если пациент все же решит пить алкоголь, он должен сделать это очень осторожно и только после разрешения врача.
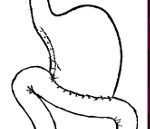
Продольная резекция желудка (ПРЖ, sleeve gastrectomy) стремительно набирает популярность в мире и занимает сегодня лидирующие позиции по частоте выполнения в России [1]. По данным национального бариатрического регистра, в структуре бариатрических вмешательств в России в 2015—2016 гг. ПРЖ составила 52—55% [2].
ПРЖ — рестриктивная операция, при которой формируется желудочная трубка объемом 100—150 мл, с сохранением антрального отдела. Механизм снижения веса обусловлен рестриктивным компонентом, а также гормональным механизмом, связанным с резким снижением содержания грелина [3].
Показания к выполнению ПРЖ
1) морбидное ожирение, ИМТ ≥40 кг/м2;
2) алиментарное ожирение, ИМТ ≥30—35 кг/м2, в сочетании с сопутствующей патологией (сахарный диабет 2-го типа, артериальная гипертензия, апноэ сна, артралгии и т. д.);
3) возраст старше 55—65 лет в сочетании с морбидным ожирением;
4) морбидное ожирение у детей, в том числе с генетическими синдромами (синдром Прадера—Вилли).
Качество выполнения операции зависит в первую очередь от навыков и знаний хирурга, но не менее важны качество инструментов и понимание последовательности этапов операции.
Техника ПРЖ связана с соблюдением основных факторов:
— положение пациента и хирурга;
— положение троакаров и инструментов;
— знание особенностей лапароскопической анатомии брюшной полости;
— владение навыками выполнения интракорпоральных узлов.
Первое правило лапароскопии: голова хирурга, операционное поле и монитор должны быть расположены раздельно по одной оси. Второе правило: соблюдение дистанции между троакарами. Рабочие троакары должны быть расположены под прямым углом к оптике по направлению к операционному полю.
ПРЖ выполняется традиционным и медиально-латеральным способом. Отличия касаются мобилизационного этапа операции, и прежде всего порядка выполнения этапов. При традиционном способе первым этапом выполняется мобилизация желудка по большой кривизне, а затем — резекция. Другой подход — медиально-латеральный — подразумевает выполнение резекции сразу же после вскрытия сальниковой сумки, а уже затем — мобилизацию по большой кривизне резецированного участка желудка.
Медиально-латеральный подход технически более сложный, с затрудненным выполнением натяжения стенки желудка на калибровочном зонде, особенно в области пищеводно-желудочного перехода. Кроме того, зачастую осложняется визуализация зоны операции, что значительно повышает риск повреждения селезенки и коротких артерий желудка.
Описываемая техника ПРЖ предназначена для лапароскопических операций, однако последовательность этапов и их особенности постоянны как при конверсионной лапаротомии, так и при использовании систем мануально-ассистированного лапароскопического доступа.
Операция проводится под общей анестезией. Пациент располагается в положении лежа на спине с разведенными ногами. Хирург находится между ног пациента, ассистент стоит слева от пациента, второй ассистент — справа.
Если используется лишь один монитор, он располагается за правым плечом пациента так, чтобы обеспечить удобный обзор для всех членов бригады (рис. 1).
При использовании нескольких мониторов их размещают за левым плечом и справа от пациента так, чтобы хирург и ассистент могли использовать отдельные мониторы (рис. 2).
Возможные варианты доступа при ПРЖ:
1) лапароскопический 5-портовый;
2) лапароскопический однопортовый;
3) лапароскопический через естественные отверстия (трансвагинальный у женщин);
4) лапаротомный.
Как правило, используется 5-портовый доступ. Доступ в брюшную полость получаем путем установки под визуальным контролем операционного лапароскопа с углом оптической оси 0° оптического 12—13 мм троакара по левой среднеключичной линии посередине между пупком и реберной дугой. После наложения карбоксиперитонеума 12—14 мм рт.ст. под визуальным контролем операционного лапароскопа с углом оптической оси 30˚ устанавливаются другие троакары — 12 мм (13 мм при использовании многоразового троакара) троакар по правой среднеключичной линии на одном уровне с левым троакаром и 10 мм троакар, в котором на время всей операции будет установлен лапароскоп и который вводится супраумбиликально; расстояние от пупка при этом зависит от роста и конституции пациента и определяется после визуальной оценки брюшной полости. Субксифоидально устанавливается троакар для печеночного ретрактора; 5 мм троакар для зажима ассистента устанавливается в левом подреберье несколько выше 12 мм троакара (рис. 3).
Если предполагаются технические трудности, связанные с недостаточной длиной инструментов при большом объеме и глубине брюшной полости или чрезмерной толщине передней брюшной стенки, линия установки троакаров может быть смещена кверху на 5—10 см.
Важным является выбор расстояния, при котором длина лапароскопа будет достаточной для подведения его к углу Гиса, в то же время троакар не должен находиться выше пилорической части желудка, иначе визуализация при мобилизации и прошивании сшивающими аппаратами в этой зоне будет крайне затруднена (рис. 4).
На представленном фото видно, что весь желудок расположен кпереди и кверху от лапароскопа так, что при любых манипуляциях стенка желудка и большая кривизна находятся в поле зрения, а при манипуляциях в нижней трети желудка и вблизи пилорической зоны угол между лапароскопом и передней брюшной стенкой не достигает 90˚.
После получения доступа в брюшную полость и установки троакаров пациент приводится в обратное положение Тренделенбурга. Если операционный стол обладает такой функциональностью, пациент может быть приведен в полусидячее положение. Выбор положения пациента является одним из ключевых моментов операции, так как при этом обеспечивается нужный объем карбоксиперитонеума, что позволит технически комфортно выполнять операцию (рис. 5).
Через установленные порты вводятся инструменты и лапароскоп. Через субксифоидальный троакар в брюшную полость вводится печеночный ретрактор, отводится печень, и начинается первый этап операции.
Этапы операции:
1) мобилизация желудочно-диафрагмальной связки, мембраны Лаймера—Бертелли;
2) доступ в сальниковую сумку;
3) мобилизация желудка по большой кривизне;
4) укладка калибровочного зонда;
5) резекция желудка;
6) укрепление степлерной линии;
7) удаление калибровочного зонда;

9) удаление резецированного желудка;
10) дренирование брюшной полости (по показаниям).
Во время операции используются следующие инструменты: одноразовый сшивающий аппарат 60 мм и кассеты для него; наконечник ультразвукового диссектора; наконечник инструмента для заваривания и 2 одноразовых 12 мм троакара.
1. Мобилизация начинается с рассечения ультразвуковым скальпелем Harmonic желудочно-диафрагмальной связки слева от пищевода (рис. 6).
Выполнение этой манипуляции в самом начале операции очень важно, так как нерассеченная желудочно-диафрагмальная связка затрудняет в дальнейшем мобилизацию в зоне желудочно-селезеночной связки и коротких желудочных артерий, не позволяя обеспечить необходимую тракцию. При выполнении этой манипуляции ассистент отводит ретрактором печень и натягивает дно желудка атравматическим зажимом. В качестве ретрактора можно использовать 10-мм палочку с тупым концом, который атравматично упирается в диафрагму. После использования множества различных ретракторов (Natanson, веерный ретрактор и т. д.) именно этот вариант был выбран из-за минимального риска травмы печени, вероятность которой достаточно высока, если печень изменена по типу жирового гепатоза, что практически всегда встречается при бариатрических операциях. После рассечения желудочно-диафрагмальной связки в зону угла Гиса закладывается небольшая салфетка с рентгеноконтрастной полоской, которая служит маркером в дальнейшем.
2. (2:40) Обеспечение доступа в сальниковую сумку выполняется ультразвуковым скальпелем Harmonic возле стенки нижней трети желудка. При этом хирург и ассистент обеспечивают натяжение сальника за счет тракции за него и за переднюю стенку желудка вниз и вверх соответственно.
3. (3:16) Мобилизация желудка по большой кривизне с использованием инструмента для заваривания сосудов Ligasure. Мобилизация выполняется непосредственно вдоль стенки желудка, при этом важно не оставлять участки сальника на стенке желудка, так как они легко кровоточат при тракции за них.
Мобилизация выполняется по большой кривизне от места вхождения в сальниковую сумку в сторону привратника до уровня угловой вырезки (incisura angularis) так, что до пилорического жома остается несколько сантиметров (3—6 см). При мобилизации в этой зоне необходима осторожность, чтобы не повредить правые желудочно-сальниковые сосуды.
Наибольшую сложность представляет мобилизация дна желудка в области селезенки, которая должна выполняться только под визуальным контролем, для чего иногда приходится применять удлиненную оптику, а также удлиненные инструменты. После пересечения желудочно-селезеночной связки при правильной мобилизации визуализируется предварительно заложенная салфетка, которая является маркером окончания мобилизации в этой зоне. Пересекаются короткие желудочные сосуды, полностью освобождается дно желудка по задней стенке. Затем выделяется угол Гиса, при этом производится активная ревизия на наличие грыжи пищеводного отверстия диафрагмы, которая устраняется в случае обнаружения путем задней крурорафии. Мобилизация считается завершенной при полностью освобожденном дне желудка (рис. 7).
После полной мобилизации по большой кривизне необходимо проконтролировать заднюю стенку желудка — иногда она соединяется спайками с поджелудочной железой. Спайки и сращения недопустимы, так как при прошивании они могут привести к формированию либо слишком широкого «рукава», либо «рукава» неправильной спиралевидной формы, что увеличивает риск возникновения стеноза.
4. (11:35) После мобилизации желудка анестезиолог вводит калибровочный зонд диаметром 36—38 Fr, на котором формируется «рукав». Использование калибровочного зонда обязательно, так как он помогает избежать сужения и стенозирования «рукава». Выбор диаметра калибровочного зонда обусловлен тем, что с увеличением диаметра уменьшается риск несостоятельности, а статистически значимой разницы снижения веса не происходит. Конец зонда вводится в привратник, а сам зонд укладывается по малой кривизне.
5. (12:20) Резекция желудка выполняется линейным сшивающим аппаратом с изменяемой кривизной дистальной части, что позволяет обеспечить наилучшее натяжение желудка на калибровочном зонде и равномерный диаметр остающейся желудочной трубки.
Натяжение желудка проводят хирург и ассистент, при этом необходимо строго следить за тем, чтобы натяжение было равномерным и ни одна из стенок не заходила в сшивающий аппарат бо́льшей порцией, чем другая, так как это может привести к перекруту (kin-king) желудочной трубки и повышает риск несостоятельности степлерной линии.
Перед каждым прошиванием обязательно обеспечивается рекомендованная производителем кассет экспозиция в 15—30 с, а также производится визуальный контроль всей длины кассеты как по передней, так и по задней стенке желудка, для того чтобы исключить попадание в кассету складки желудка или других тканей (рис. 8).
Для формирования степлерной линии можно использовать сочетание кассет с различной высотой скрепок, при этом более высокие скрепки применяются в начале прошивания, т. е. в дистальном отделе желудка, а более низкие — в конце, в проксимальных отделах. Операция также может быть выполнена с применением одной высоты скрепок — 3,8 мм («золотая» кассета).
При прошивании в зоне угла Гиса особое внимание уделяется тому, чтобы исключить формирование резидуального кармана, который может образоваться при недостаточном натяжении дна желудка (рис. 9).
6. (17:14) Как правило, степлерную линию можно не укреплять после резекции, но многие хирурги предпочитают усиливать ее дополнительными серозно-мышечными швами, что, возможно, снижает риск возникновения несостоятельности степлерной линии и помогает остановить кровотечение. В большинстве же случаев кровотечение из степлерной линии останавливается либо кратковременным тампонированием салфеткой, либо клипированием. Возможно проведение проверки кровотечения путем кратковременного подъема артериального давления пациента, что снижает частоту возникновения внутрибрюшного кровотечения в послеоперационном периоде. Применение электрической энергии в зоне степлерной линии строго запрещено, так как ток при этом распространяется по всей длине степлерной линии, а температура в зоне контакта скрепки и коагулятора достигает 1000 °C, что может привести к несостоятельности шва.
7. (23:10) Операция завершается удалением калибровочного зонда из просвета культи желудка под визуальным контролем, при этом выполняется активный осмотр «рукава».
8. Можно убедиться в герметичности введением в культю желудка метиленового синего.
9. (23:25) Препарат извлекается через 25-мм ранорасширитель, устанавливаемый на месте 12-мм троакара слева.
10. Операция завершается установкой дренажа вдоль степлерной линии по показаниям.
Правила хирургической техники при выполнении ПРЖ
1. Используется калибровочный зонд, оптимальный размер бужа 36—40 Fr.
2. Резекцию можно начинать только при полной мобилизации дна желудка и пересечении коротких желудочных сосудов.
3. Резекция должна начинаться (первое прошивание) в 2—6 см от пилоруса.
4. Используются кассеты с высотой скобы не менее 1,5 мм.
5. При прошивании последней кассеты нужно избегать наложения сшивающего аппарата на пищеводно-желудочный переход.
6. Растяжение стенок желудка должно быть равномерным относительно оси желудка с целью профилактики перекрута.
7. Ушивание степлерной линии производится только при наличии зонда в просвете желудка с целью профилактики уменьшения объема желудочной трубки.
Техника ПРЖ. Видео доступно по ссылке:
https://drive.google.com/file/d/0Bwvk90dFDd3oQ2kxcWpKTzBiZFE/view? usp=sharing
Авторы заявляют об отсутствии конфликта интересов.
Сведения об авторах
Хациев Бекхан Баялович — к.м.н., доцент, заведующий отделением; e-mail: bkhatsiev@yandex.ru
Узденов Науруз Ахматович — врач-хирург; e-mail: dr.nauka@mail.ru
Джанибекова Марина Алиевна — врач-хирург; e-mail: dj.djmarina@yandex.ru
Кузьминов Александр Николаевич — врач-хирург; e-mail: dr.kuzminov@gmail.com
Болезни оперированного желудка
Болезни оперированного желудка — это патологические состояния, возникшие после гастрорезекционных вмешательств и патогенетически связанные с ними. Проявляются диспепсическими расстройствами, болью в эпигастрии, вазомоторными и нейровегетативными реакциями, метаболическими и нутриционными нарушениями. Диагностируются с помощью рентгенографии желудка, эзофагогастродуоденоскопии, общего и биохимического анализа крови. Для лечения используют серотониновые, симпато- и холиноблокаторы, заместительную ферментную терапию, седативные средства, спазмолитики, прокинетики, антибактериальные препараты, эубиотики. При необходимости выполняют повторные операции.
Общие сведения
Симптомы постгастрорезекционной болезни развиваются у 20-45% пациентов после удаления 2/3-3/4 органа, проведения ваготомии и антрумэктомии. У 2,5-3% больных тяжесть клинической картины оперированного желудка превышает тяжесть первичного заболевания. В связи с успехами консервативной терапии язвенной болезни, после хирургического лечения которой в прошлом обычно развивались постгастрорезекционные расстройства, в настоящее время превалируют синдромы, связанные с удалением органа по поводу рака.
У 3,4-35% пациентов, прооперированных по методу Бильрот II, развивается демпинг-синдром, у 3-29% — болезнь приводящей петли, у 5-10% — гипогликемическое расстройство. Постгастрорезекционная анемия выявляется у 10-15% оперированных, послеоперационная дистрофия — у 3-10%, пептические язвы — у 1-3%. Постваготомической дисфагией страдает 3-17% пациентов. Рецидив язвы после пересечения блуждающего нерва наблюдается в 10-30% случаев. У 8-15% больных после операции по технике Бильрот 2 в течение 20-25 лет возникает рак желудочной культи.
Болезни оперированного желудка
Причины
Развитие болезней оперированного желудка может быть обусловлено как изменением физиологических условий функционирования органов ЖКТ, так и врачебными ошибками, допущенными в ходе операции и послеоперационном периоде. Зачастую факторы, провоцирующие возникновение БОЖ, сочетаются и усиливают эффект друг друга. По мнению специалистов в сфере гастроэнтерологии, основными причинами постгастрорезекционной болезни являются:
- Перестройка системы пищеварения. У пациентов, перенесших объемную дистальную резекцию, отсутствует антральный отдел, продуцирующий основную часть гастрина и соляной кислоты, что сказывается на эффективности переваривания белков. Потеря резервуарной функции органа способствует попаданию в просвет тонкой кишки недостаточно подготовленной пищи, которая плохо переваривается и всасывается. При выполнении резекции методом Бильрот-2 из процесса пищеварения практически исключается двенадцатиперстная кишка. Осложнением ваготомии зачастую становится нарушение эвакуации химуса из полости желудка.
- Технические ошибки при выполнении вмешательства. Риск развития различных расстройств оперированного желудка возрастает при выборе неподходящей техники операции, избыточной или недостаточной по объему резекции органа, которая существенно влияет на секреторно-эвакуаторную функцию либо способствует дальнейшему прогрессированию заболевания. Нормальному прохождению химуса может препятствовать неправильное наложение швов при формировании анастомозов и ушивании культи. Отсутствие шпоры при создании гастроеюноанастомоза часто провоцирует синдром приводящей петли.
- Патологический преморбидный фон. При наличии сопутствующей патологии снижаются постоперационные компенсаторные возможности пищеварительной системы. У 42% пациентов с синдромом оперированного желудка диагностируются болезни ЖКТ, у 49% — хронические заболевания других органов и систем. Постгастрорезекционные расстройства с большей вероятностью развиваются при недостаточном уровне вазоактивного интестинального полипептида, мотилина, холецистокинина, энкефалинов и других гастроинтестинальных гормонов, секретируемых диффузной нейроэндокринной системой для регуляции процессов пищеварения.
По наблюдениям некоторых исследователей, постгастрорезекционная болезнь чаще встречается у пациентов, имеющих психические травмы и стрессы в анамнезе. У 42% больных с БОЖ установлена связь предшествовавшей язвенной болезни с физическими травмами, заболеваниями ЦНС. В таких случаях послерезекционные нарушения протекали тяжелее, с резко выраженной невротической симптоматикой. В группу повышенного риска входят пациенты холерического и меланхолического склада с неуравновешенным и слабым типами высшей нервной деятельности, больные, которые из экономических соображений отказались от поддерживающего медикаментозного лечения.
Патогенез
Механизм развития постгастрорезекционных расстройств основан на различных сочетаниях нарушений гастроинтестинальной секреции, моторики и всасывания, а также их влиянии на работу других органов. Патогенез конкретного патологического состояния зависит от вызвавших его причин. В большинстве случаев пусковыми моментами являются снижение выработки компонентов желудочного сока и ускоренный пассаж химуса в кишечник, повышающие функциональную нагрузку на тонкую кишку, гепатобилиарную систему, панкреатическую железу оперированного пациента. В ответ на поступление гипертонического химуса усиливается секреция жидкого компонента кишечного сока, увеличивается приток крови к внутренним органам, часто возникает диарея.
Уменьшение объема циркулирующей крови сопровождается развитием гемодинамических расстройств и неврологической симптоматики. При растяжении тонкой кишки большим объемом пищевых масс, которые транзитом поступили из желудка, происходит массивный выброс серотонина, приводящий к нарушению регуляции активности головного мозга. Рефлекторное усиление секреции инсулина поджелудочной железой вызывает падение уровня глюкозы. Конечным итогом недостаточного переваривания и всасывания белков, жиров, углеводов, витаминов, ключевых макро- и микроэлементов, в первую очередь – железа, становятся нарушения обмена веществ и кроветворения, значительное снижение массы тела, полиорганные расстройства.
У части оперированных пациентов ведущую роль играет застой пищевых масс в разных отделах ЖКТ — в двенадцатиперстной кишке (при болезни приводящей петли) либо в желудке (после ваготомии). Кишечный стаз или гастростаз, нарушающий процессы пищеварения, приводит к растяжению стенки соответствующего органа с возникновением болевого синдрома, способствует развитию дисбактериоза, гнилостного брожения. При некоторых состояниях происходит обратный заброс кишечного и желудочного содержимого в расположенные выше отделы ЖКТ с раздражением их слизистой оболочки, возникновением реактивного воспаления, атрофических и неопластических процессов.
Классификация
При систематизации различных форм болезни оперированного желудка учитывают патогенез постгастрорезекционного синдрома, отсутствие или наличие органических изменений, особенности клинических проявлений. С учетом техники вмешательства в абдоминальной хирургии различают пострезекционную и постваготомическую патологию. В группе болезней, возникших после удаления части желудка, в свою очередь, выделяют:
- Функциональные расстройства. Связаны с нарушением нейрогуморальной регуляции пищеварительных процессов и пассажа химуса. Наблюдаются у 70% оперированных пациентов с БОЖ, в части случаев предшествуют органической патологии или сочетаются с ней. К этой категории заболеваний относят ранний и поздний (гипогликемический) синдромы, синдромы малого желудка и приводящей петли функционального происхождения, пищевую аллергию, дуодено- или еюногастральный, гастроэзофагальный рефлюксы, постгастрорезекционную астению, постваготомическую диарею.
- Органические нарушения. Сопровождаются морфологическими изменениями оперированных органов. Группа органических болезней представлена синдромом приводящей петли механического происхождения, рецидивирующей, в том числе пептической язвой, язвенным дефектом в рамках синдрома Золлингера-Эллисона, желудочно-кишечным свищом, рубцовой деформацией и сужением анастомоза, анастомозитом, раком культи, дистальным пептическим эзофагитом, пищеводом Баррета, сопутствующим послеоперационным гепатитом, панкреатитом.
Постваготомическими болезнями считаются рецидивировавшая язва, послеоперационная диарея, дисфункция желудочной кардии с развитием пептического воспаления пищевода и гастроэзофагорефлюксной болезни, ускоренная (демпинг-синдром) или замедленная (гастростаз) эвакуация химуса, рефлюкс-гастрит щелочного генеза. С пересечением блуждающего нерва также могут быть ассоциированы другие заболевания ЖКТ — панкреатит, холелитиаз. В некоторых случаях (при демпинг-болезни, функциональном и механическом синдромах приводящей петли) оправдано выделение нескольких степеней тяжести.
Симптомы
Симптоматика зависит от вида болезни оперированного желудка. В клинической картине могут наблюдаться как гастроинтестинальные симптомы, так и системные вазомоторные, нейровегетативные нарушения. При наиболее распространенном раннем демпинг-синдроме спустя 20-25 минут после приема пищи возникает слабость, сосудистые реакции (краснота или побледнение кожи лица), мелькание мушек перед глазами, головокружение, учащается сердцебиение. Приступ может длиться от 15 минут до нескольких часов. Характерно появление диспепсических симптомов: ухудшения аппетита, отрыжки, тошноты, урчания, дискомфорта в эпигастрии.
У оперированного больного, страдающего гипогликемическим синдромом, через 2-3 часа после употребления легкоуглеводистых продуктов внезапно развивается выраженная слабость, потливость, озноб. Пациент предъявляет жалобы на головокружение, сильное чувство голода. Урежается пульс, падает АД. Приступ обычно длится 5-20 минут. При синдроме приводящей петли отмечается тошнота, тяжесть в правой подреберной области, отрыжка. Типичный признак болезни — обильная рвота желчью и пищей, съеденной накануне, с последующим улучшением состояния. При прогрессировании заболевания присоединяются общие нарушения: потеря веса, слабость, снижение трудоспособности, отеки.
Клинические проявления пептических язв оперированного желудка выявляются через 6-12 месяцев после хирургического вмешательства. У пациентов возникает выраженный болевой синдром, который не связан с приемом пищи. Возможны диспепсические расстройства. Основными симптомами пострезекционной анемии являются слабость, бледность кожных покровов, одышка, головокружение, глоссит (воспаление языка), тахикардия. В тяжелой стадии болезни могут появляться боли в ногах, парестезии, снижение мышечной силы. У четверти оперированных наблюдается снижение веса ниже рекомендованного или невозможность восстановить дооперационный вес.
Осложнения
Из-за ускоренного продвижения пищи по кишечнику у пациентов после гастрорезекции возникают нарушения всех видов обмена, что клинически проявляется авитаминозами, тяжелыми электролитными сдвигами, остеопорозом, частыми переломами, сухостью кожи, выпадением волос, ломкостью ногтей, снижением остроты зрения, в терминальных стадиях — кахексией. При прогрессировании болезни возможны коллаптоидные состояния, требующие неотложной помощи.
Частыми осложнениями пептических язв являются прободение, сопровождающееся профузным кровотечением, пенетрация в соседний орган. При длительном течении анемии формируется гипоксия, которая может приводить к энцефалопатии, дистрофическим изменениям во внутренних органах. Развитие щелочного рефлюкс-гастрита с атрофией эпителиального слоя, ахлоргидрией повышает риск малигнизации желудочной культи. После резекции зачастую наблюдаются вторичные гнойные осложнения вследствие угнетения иммунитета.
Диагностика
Диагностический поиск при болезни оперированного желудка направлен на уточнение степени функциональных и органических нарушений, оценку состоятельности анастомоза, выявление критических состояний, требующих неотложной терапии. Обследование пациента осуществляется комплексно с применением таких лабораторных и инструментальных методов, как:
- Клинический анализ крови. Для пострезекционной В12-дефицитной анемии характерны изменения в виде уменьшения содержания эритроцитов и гемоглобина, увеличения цветного показателя более 1,05, появления макроцитов. Метод дополняют проведением биохимического исследования крови – при заболеваниях оперированного желудка наблюдается гипопротеинемия, повышение уровня печеночных ферментов, снижение концентрации глюкозы.
- Рентгенологическое исследование. При демпинг-синдроме на рентгенограммах желудка выявляют стремительное продвижение контраста в тонкую кишку и расширение отводящей петли. Типичные рентгенологические признаки рецидивировавшей язвы – симптом «ниши» (депо бария), конвергенция складок слизистой оболочки. В случае расстройства приводящей петли при рентгеноскопии натощак определяется жидкость в желудочной культе, что связано с ее рефлюксом из кишечника.
- Эзофагогастродуоденоскопия. Введение эндоскопа через пищевод в желудок и 12-перстную кишку позволяет оценить состояние слизистой оболочки пищеварительного тракта, обнаружить воспалительные изменения и нарушения моторики, установить локализацию язвенного дефекта, его размеры. Язвы чаще всего располагаются в зоне анастомоза или в отводящей петле. Во время ЭГДС может выполняться биопсия для последующего гистологического анализа.
При возможном рецидиве язвы рекомендовано выполнение анализа кала на скрытую кровь. Для верификации диагноза демпинг-синдрома производится провокационная проба – при положительном результате наблюдается ухудшение состояния пациента через 15-20 минут после перорального приема 150 мл гипертонического раствора глюкозы. Больным с постгастрорезекционной болезнью может потребоваться обследование других органов ЖКТ: УЗИ желчного пузыря, поджелудочной железы, МСКТ брюшной полости, МРТ-панкреатохолангиография и др.
Дифференциальная диагностика патологии оперированного желудка проводится со злокачественными новообразованиями ЖКТ, синдромом Золлингера-Эллисона, частичной кишечной непроходимостью, желудочно-кишечным свищем, хроническим энтеритом, болезнью Крона, инсулиномой, нейроэндокринными опухолями, гипопластической анемией. Кроме наблюдения у врача-гастроэнтеролога и абдоминального хирурга пациенту рекомендованы консультации гематолога, онколога, эндокринолога, инфекциониста, невролога.
Лечение болезней оперированного желудка
Выбор врачебной тактики определяется особенностями патологического постгастрорезекционного состояния. С учетом этапа развития болезни и выраженности симптоматики могут применяться как терапевтические, так и хирургические подходы к лечению БОЖ. Независимо от патологии всем пациентам показана диета с исключением ингредиентов, к которым выявлена непереносимость, жареной, копченой, консервированной, острой, горячей пищи, легкоусвояемых углеводов. В рационе рекомендуется увеличить долю богатых клетчаткой овощей, фруктов, зелени, отрубей, ягод, каш, диетического мяса (говядины, курятины, крольчатины). Питание должно быть частым, дробным (до 6-8 приемов пищи в день). Для коррекции отдельных симптомов оперированного желудка применяют следующие группы медикаментозных средств:
- Неселективные β-блокаторы. Замедляют эвакуацию химуса из желудка и перистальтику тонкого кишечника у больных с демпинг-синдромом. При постоянном приеме медикаментов в малых дозах симптоматика болезни уменьшается либо полностью исчезает. С аналогичной целью назначают ганглиоблокаторы, блокаторы М-холинорецепторов, новокаиновые блокады.
- Ферментные препараты. Заместительная терапия способствует процессу переваривания пищи. При функциональной недостаточности оперированного желудка показан прием желудочного сока, соляной кислоты с пепсином. Для улучшения кишечного пищеварения используют полиферментные средства, ферменты с двухэтапным эффектом, холинолитики.
- Седативные средства и транквилизаторы. Рекомендованы пациентам, у которых в структуре болезни ярко выражен нейровегетативный компонент. Обычно лечение начинают с растительных препаратов (настоев пустырника, валерианы, пиона), в более тяжелых случаях применяют малые дозы барбитуратов, производных бензодиазепина.
- Антагонисты серотонина. Назначение лекарственных средств патогенетически обосновано ролью серотонина в развитии демпинг-синдрома. При ускоренном пассаже пищи из оперированного желудка серотониновые блокаторы замедляют перистальтику кишечника и уменьшают выраженность вазомоторных расстройств за счет ингибирующего эффекта на уровне ЦНС.
- Спазмолитики и прокинетики. Выбор медикамента определяется типом нарушений, возникших после операции. Препараты применяются для нормализации процессов желчевыделения, моторно-эвакуаторной функции ЖКТ. Производные пиперидина способны замедлить кишечную пропульсию и повысить тонус сфинктеров, уменьшив выраженность демпинг-болезни.
- Антибактериальная терапия. Может потребоваться пациентам с симптомокомплексом приводящей петли. Курсовое назначение полусинтетических пенициллинов, тетрациклинов, сульфаниламидов позволяет устранить воспаление и санировать слепой участок петли от развившейся микрофлоры. Для уменьшения дисбиотических расстройств терапию дополняют эубиотиками.
Лечение послеоперационной или рецидивировавшей язвы производится по стандартам противоязвенных протоколов. Некоторым больным с заболеваниями оперированного желудка могут быть показаны антациды, противодиарейные и обволакивающие средства, энтеросорбенты. Для коррекции метаболических и нутриционных расстройств рекомендованы курсы витаминно-минеральных препаратов, восполняющих возможный дефицит витаминов группы В, железа. При терапевтической резистентности и прогрессировании постгастрорезекционной болезни требуется повторное оперативное вмешательство. С учетом клинической формы патологии проводится редуоденизация (гастроеюнодуоденопластика), хирургическая коррекция типа гастроэнтероанастомоза (сужение, реконструкция в анастомоз по Ру), дуоденоеюностомия, наложение Брауновского соустья.
Прогноз и профилактика
В 75% случаев своевременное назначение адекватной терапии позволяет существенно улучшить или нормализовать состояние больного. У 25% пациентов наблюдается прогрессирование органических и функциональных осложнений резекции желудка, приводящее к стойкой утрате трудоспособности. Профилактика патологий оперированного желудка заключается в развернутом предоперационном обследовании, подборе вида хирургической методики в зависимости от симптоматики, соблюдении техники операции, правильном наложении анастомозов, выборе объема гастрорезекции с учетом кислотопродуцирующей желудочной функции, тщательном наблюдении за больным в послеоперационном периоде с последующим ежегодным проведением ЭГДС.
|
Литература 1. Болезни оперированного желудка / Барановский А.Ю. — 2010 2. Болезни оперированного желудка. Методическое пособие / Яновой В.В. — 2012 3. Абдоминальная хирургия. Практическое пособие / Григорян Р.А. 2006 4. Абдоминальная хирургия. Национальное руководство / под ред. Затевахина И.И., Кириенко А.И., Кубышкина В.А. – 2017 |
Код МКБ-10 K91.1 |
Болезни оперированного желудка — лечение в Москве

ГБУЗ Пензенская, Башмаковская, Нижнеломовская, Бековская, Белинская, Неверкинская, Тамалинская, Шемышейская, Каменская, Мокшанская и Сердобская ЦРБ.
Демидов Г.И.
Ретроспективно проведен анализ 190 историй болезни больных лечившихся в ЦРБ в 2010-2011 годах. Умерло больных — 146, переведены в ГБУЗ ПОКБ им. Н.Н. Бурденко – 44. Судьба последних — неизвестна. В группе переведенных в ГБУЗ ПОКБ им. Н.Н. Бурденко в основном больные из малокоечных ЦРБ.
При изучении историй болезни интересовал вопрос: «Смерть носила фатальный характер или часть этих больных можно было спасти при своевременной диагностике и правильно выбранной хирургической тактике?»
Итак, все умершие распределены по возрастному составу: до 70 лет (54,8%) и старше 70 лет – (45,2%).
Консультанты из ТЦМК (хирурги и врачи-эндоскописты) были привлечены лишь 21 раз (14,4%), хотя показания для вызова врачей консультантов были практически во всех случаях.
По нозологии все умершие распределились следующим образом:
|
Нозология |
Число случаев |
| Острые гастродуоденальные язвы, осложнённые кровотечением |
7 |
| Хронические гастродуоденальные язвы, осложнённые кровотечением |
3 |
| Хронические гастродуоденальные язвы, осложнённые перфорацией |
5 |
| Синдром Маллори-Вэйсса |
2 |
| Кровотечение из варикознорасширенных вен пищевода |
18 |
| Инфаркт кишечника |
57 |
| Перфорация опухоли, перитонит |
3 |
| Формирующаяся киста поджелудочной железы |
2 |
| Панкреонекроз |
20 |
| Ущемленная грыжа передней брюшной стенки |
5 |
| Механическая желтуха |
3 |
| Кишечная непроходимость |
6 |
| Деструктивный холецистит |
6 |
| Декомпенсированный язвенный стеноз, неоперированный |
2 |
| Разрыв тощей кишки |
3 |
| Псевдоперитонит |
1 |
| Кровотечение из прямой кишки |
1 |
| Гангренозный аппендицит |
1 |
| Причина не установлена |
1 |
| Итого |
146 |
Как видно из таблицы, наиболее часто умирают больные с острой непроходимостью мезентериальных сосудов — 57 (39,0%), с панкреонекрозами — 20 (13,7%) и с кровотечением из варикозно-расширенных вен пищевода — 18 ( 12,3%).
Умерли без операции 29 человек (21,2%). Это – больные, поступившие в крайне запущенном и предагональном состоянии.
31 пациент (19,9%) поступил в стационар с диагнозом: желудочно-кишечное кровотечение с разной степенью кровопотери. Последнее обстоятельство является ведущим в определении хирургической тактики. Чем выше степень кровопотери, тем активнее должны быть действия хирурга в плане установления источника кровотечения и в решении вопроса об оперативном лечении.
Примером совершено ошибочной тактики служит история болезни больного К., 63 лет. Дежурный врач госпитализирует больного с диагнозом: «ИБС. Атеросклероз», хотя у больного были явные признаки желудочно-кишечного кровотечения. Через 10 часов больной осматривается хирургом и переводится из терапевтического отделения в палату интенсивной терапии для проведения гемостатической терапии без установления источника кровотечения, степени кровопотери и решения вопроса об экстренности операции. Через 10 часов сделана запись: «Состояние больного внезапно ухудшилось, АД 60 и 40 мм.рт.ст., Hb – 48 г/л., Эр – 1,6х1012/л». Срочная лапаротомия, дуоденотомия, прошивание сосуда в язве. Смерть через 5 часов.
В «оправдание» своего бездействия хирург оставляет запись, что «ФГДС не выполнялась из-за отсутствия врача-эндоскописта».
Возникает естественный вопрос: «А что мешало вызвать врача-эндоскописта и хирурга из ТЦМК, а вместе с ними сделать запас компонентов крови и своевременно прооперировать больного?»
Типичными ошибками хирургической тактики при эзофаго-гастро-дуоденальных кровотечениях являются:
1 – не учёт степени кровопотери по клиническим и лабораторным данным – АД, пульс, Hb и количество эритроцитов;
2 – принятие решения о консервативной терапии без эндоскопического уточнения источника кровотечения и его характера;
3 – установка на оперативное вмешательство только при рецидиве кровотечения, которое может возникнуть в любое время суток при кажущемся благоприятном течении болезненного процесса и зачастую носит фатальный характер;
4 – надежда на русский «авось» при отсутствии должных условий для диагностики и выполнения оперативного вмешательства, при отсутствии специалистов необходимой квалификации.
Кровотечение любой степени тяжести следует расценивать как прямую угрозу жизни, поэтому при наличии анамнестических и клинических признаков желудочно-кишечного кровотечения все действия хирурга должны носить экстренный, безотлагательный характер в любое время суток.
Тактика хирурга при желудочно-кишечных кровотечениях.
1. При хронических гастродуоденальных язвах:
1.1. При продолжающемся кровотечении F-1а, F-1b – срочное оперативное вмешательство.
1.2. При угрозе рецидива кровотечения F-2a, F-2b – показано оперативное вмешательство по относительно экстренным показаниям, то есть в этот же день или с утра следующего дня, при достаточном обеспечении компонентами крови и достаточной квалификации хирургов, с проведением гемостатической и гемозаместительной терапии.
1.3. При угрозе рецидива кровотечения F-2c и F-3 показано оперативное вмешательство в плановом порядке или перевод в другое лечебное учреждение.
2. При острых язвах, эрозивных гастритах – тактика более консервативна. В этих ситуациях показана эндоскопическая остановка кровотечения и перевод больных реанимационной бригадой в ГБУЗ ПОКБ им. Н.Н. Бурденко. При продолжающемся кровотечении показано срочное оперативное вмешательство.
3. При синдроме Маллори-Вэйсса показана эндоскопическая остановка кровотечения. Если это не удается, показано срочное оперативное вмешательство, так как риск рецидива кровотечения при этом заболевании достаточно высок.
4. При кровотечении из расширенных вен пищевода и желудка тактика хирурга определяется:локализацией процесса, степенью кровопотери, общим соматическим состоянием больного.
4.1. Если процесс локализован в средней трети пищевода:
4.1.1. При продолжающемся кровотечении – срочно установить зонд Блэкмора
4.1.2. При состоявшемся кровотечении – гемостатическая, гемозаместительная терапия, профилактика рецидива кровотечения неселективными бета-блокаторами (анаприлин, обзидан) и ингибиторами протонной помпы или Н2-блокаторами.
4.1.3. При состоявшемся кровотечении и стабильной гемодинамике, при отсутствии декомпенсации основного процесса (асцит, желтуха) больных молодого и трудоспособного возраста следует реанимационной бригадой переводить в сосудистое отделение ГБУЗ ПОКБ им. Н.Н. Бурденко с целью наложения сосудистых анастомозов.
Примечание: Установление назогастрального зонда с целью контроля за рецидивом кровотечения или зонда Блекмора с целью профилактики рецидива кровотечения следует считать грубейшей ошибкой.
4.2. При локализации процесса в нижней трети пищевода и кардии.
4.2.1. При продолжающемся кровотечении независимо от стадии цирротического процесса показаны — экстренная лапаротомия, широкая продольная гастротомия в области тела и дна желудка, прошивание 8-образными кетгутовыми швами кровоточащих сосудов или нитями с атравматическими иглами с низведением слизистой нижней трети пищевода по Баулину Н.А.
4.2.2. Если остановить кровотечение из пищевода не удается, рекомендуется томпонада пищевода по доктору Сафрошкину В.Н. (экс-хирург Шемышейской ЦРБ)
Примечание: При неустановленном эндоскопически источнике кровотечения (средняя и тяжелая степень кровопотери) следует срочно вызвать эндоскописта из ТЦМК и хирурга для решения вопроса о хирургической тактике.
Более редкими причинами желудочно-кишечного кровотечения следует считать онкопроцессы и доброкачественные полипы различной локализации (от пищевода до прямой кишки), дивертикулезная болезнь и билигемия. Геморроидальные кровотечения следует считать кровотечением наружной локализации, а потому они не могут быть отнесены к желудочно-кишечным.
Примеры ошибочной тактики при желудочно-кишечных кровотечениях.
- Больной П., 62 года. Поступил в хирургическое отделение с кровотечением из язвы гастродуоденоанастомоза. ФГДС – язва гастродуоденоанастомоза с угрозой рецидива кровотечения F-2b. Лечение консервативное. Через сутки появились клинические признаки рецидива кровотечения: Hb – 77 г/л. Повторно ФГДС – F-2b. Вопрос об оперативном вмешательстве не ставится. На следующие сутки снова рецидив кровотечения – экстренная лапаротомия, гастротомия, прошивание кровоточащего сосуда. Смерть через 4 часа после операции.
В данном случае следовало больного оперировать экстренно в первый же день или с утра следующего дня, не дожидаясь рецидива кровотечения.
- Больной Е., 55 лет. Поступил в хирургическое отделение с диагнозом: цирроз печени, кровотечение из варикозно-расширенных вен пищевода, установлен зонд Блекмора, кровотечение продолжается. Hb – 81 г/л., Er – 2,73х1012/л. Фиброгастроскопия – в нижней трети пищевода сгустки крови, из под которых подтекает кровь. Не оперирован. Смерть на следующие сутки.
- Больной Д., 62 года. Поступил в хирургическое отделение с кровотечением из хронической язвы 12-ти перстной кишки. ФГДС – глубокая язва 12-ти перстной кишки 2х1,5 см. с тромбом темно-багрового цвета. Консилиум не проводился, продолжалась консервативная терапия на 4-й день Hb – 88 г/л., Er – 2,9х1012/л. В виду нестабильности гемодинамики на 5-й день переведен в реанимацию. Оперирован на 6-й день. Смерть через час после операции.
Ошибки и опасности при оказании хирургической помощи при остром аппендиците.
Хирургическая тактика при острых деструктивных аппендицитах достаточно подробно изложена в методических рекомендациях по оказанию ургентной помощи при острых заболеваниях живота в ЛПУ 1-го и 2-го уровня (Пенза 2010 г.)
В пункте 8 записано: «При благоприятном течении послеоперационного периода больного не должны беспокоить: вздутие живота, тошнота и боли в ране. Температура к 3-му дню нормализуется, что позволяет прекратить антибактериальную терапию».
Примером ошибочной интраоперационной хирургической тактики и неадекватного ведения раннего послеоперационного периода служит история болезни больной Ф., 72 лет, которая была оперирована в экстренном порядке по поводу гангренозного аппендицита через 3 часа с момента госпитализации под эндотрахеальным наркозом.
Обнаружено, что отросток «гангренозно» изменен, расположен ретроцекально и ретроперитониально. Участок париетальной брюшины некротизирован, при иссечении которого в забрюшинной клетчатке обнаружен гной. Хирург ограничился ретроградным удалением отростка и дренированием брюшной полости трубчатым дренажом. Послеоперационный период протекал с наличием признаков интоксикации и тупых болей в правой боковой и поясничной областях. УЗИ выполнено лишь на 4-й день. Врач УЗИ диагностики пишет о наличии признаков паранефрита. Консилиум не проводился, консультант из ТЦМК не приглашался и больная берется на операцию лишь на 5-й день при развернутой картине перитонита с параличом кишечника. Вопрос о переводе больной в ГБУЗ ПОКБ им. Н.Н. Бурденко не ставился. На 13-й день больная умирает.
Как следовало поступить при первой операции? Здесь уместны два варианта:
- Дополнительное вскрытие забрюшинного пространства по Пирогову с проточным дренированием через поясничную область;
- Рану в правой подвздошной области продлить в правую поясничную область, выполнить ревизию забрюшинного пространства и установить дренажи в забрюшинное пространство и правый боковой канал.
И в том и в другом случае, следовало свободную брюшную полость изолировать от забрюшинного пространства прядью большого сальника на питающей ножке.
Ошибки и опасности при хирургическом лечении прободных гастродуоденальных язв.
Ошибки и опасности при прободных гастродуоденальных язвах возникают в процессе диагностики, в процессе хирургического лечения и в раннем послеоперационном периоде.
Диагностические ошибки обусловлены неправильной интерпретацией жалоб больного, отсутствием четкой методики обследования больного и неиспользованием параклинических методов исследования. Как известно, свободный газ в брюшной полости при обзорной R-графии живота выявляется лишь в 60-65% случаев. Недостаточно опытный хирург, как правило, ставит диагноз: «Острый панкреатит» и назначает консервативную терапию, хотя, в наше время, практически во всех лечебных учреждениях есть возможность выполнить ФГДС и УЗИ диагностику, чтобы избежать смертельно опасных ошибок.
Примером служит история болезни больной Ч., 74 лет, которая через сутки с момента госпитализации прооперирована, с прободной язвой 12-ти перстной кишки и распространенным перитонитом. Причинами запоздалого оперативного вмешательства явились: гипердиагностика острого панкреатита, ошибочная хирургическая тактика при остром панкреатите – не обозначена форма клинического течения, неиспользованые параклинические методы обследования. Обзорную R-графию сделали лишь через сутки — обнаружен свободный газ под куполом диафрагмы.
Примером ошибочной тактики ведения послеоперационного периода может служить история болезни больной Г., 53 лет, которую оперировали по поводу перфоративной язвы желудка. На 12-тый день выписали больную на амбулаторное лечение, не проведя фиброгастроскопии. Через три дня после выписки больная поступила в хирургическое отделение в состоянии геморрагического шока. С хирургом-консультантом из ТЦМК выполнена экстренная резекция желудка по Бильрот-2 по поводу хронической язвы 12-ти перстной кишки, осложненной кровотечением тяжелой степени. Понятно, что операция была технически сложной и обойтись простым ушиванием язвы было невозможно. К сожалению, в дальнейшем послеоперационный период осложнился абдоминальным гнойно-септическим процессом, что и привело к смерти.
Вывод: учитывая возможность наличия множественной локализации осложненных язв следует взять за правило перед выпиской из стационара проводить фиброгастроскопическое исследование.
У лиц пожилого и старческого возраста нередко приходится экстренно выполнять различные оперативные вмешательства, у которых в раннем послеоперационом периоде хронические гастродуоденальные язвы могут перфорировать или осложниться кровотечением, что и является основной причиной смерти.
Примером этому служит история болезни больной К., 61 года, поступившей в отделение хирургии с клиникой острой обструкционной толстокишечной непроходимости. Выполнена правосторонняя гемиколэктомия, с наложением илеотрансверзоанастомоза с интубацией тонкой кишки через концевую подвесную транзверзостому.
Ранний послеоперационный период протекает крайне тяжело, с нестабильной гемодинамикой. Утром второго дня после операции по дренажам, поставленным в забрюшинное пространство, выделилось до 400 мл. черного цвета жидкости. О возможной перфорации язвы желудка даже не возникало мыслей. На 3-тий послеоперационный день выполнена релапаротомия. Была обнаружена перфорация хронической язвы на малой кривизне желудка.
Следует помнить, что при перфорациях хронических дуоденальных язв с элементами пенетрации в гепатодуоденальную связку интраоперационно возникают сложности в выборе способа и объема операции. Как показывает опыт, ушивание таких язв чревато несостоятельностью швов в раннем послеоперационном периоде. Чтобы избежать этих осложнений, приходится решаться на резекцию желудка по Бильрот – 1 даже при наличии серозно-фибринозного перитонита.
Если перитонит носит гнойный характер или осложнен параличом тонкой кишки (2-я стадия перитонита по Напалкову, 1927 г.), следует: хорошо отсанировать брюшную полость, выполнить трансназальную интубацию тонкой кишки, зашить герметично перфорационное отверстие с оментопластикой на питающей ножке с последующим дренированием брюшной полости по классической методике.
В ряде случаев объем оперативного вмешательства бывает необоснованно завышен. Примером может служить история болезни больной Ф., 67 лет, которая была прооперирована в экстренном порядке по поводу прободной язвы пилорического отдела желудка. Перфорационное отверстие было зашито наложением двух рядов узловых швов. Опасаясь, что будет стеноз выходного отдела желудка, дополнительно наложили позадиободочный, и почему то не задний, а передний ГЭА, когда можно было ограничится установлением назогастрального зонда или ушить язву по Оппелю-Поликарпову, что гарантировало бы от стеноза.
Ошибки и опасности при хирургическом лечении деструктивных холециститов.
Хирургическая тактика и техника оперативных вмешательств достаточно хорошо отработаны. Послеоперационная летальность в крупных учреждениях колеблется от 1 до 2%.
Тем не менее, продолжают иметь место ошибки диагностического, тактического и технического характера, в выборе объема оперативного вмешательства и в диагностике ранних послеоперационных осложнений: кровотечение и желчеистечение в свободную брюшную полость.
Примером этому могут служить:
- История болезни больного В., 57 лет, поступившего в хирургическое отделение с диагнозом острый панкреатит без указания формы клинического течения. Госпитализирован в общую палату, записей динамического наблюдения нет. На второй день в связи с резким ухудшением состояния переводится в палату интенсивной терапии. Во время транспортировки наступила смерть. При аутопсии выявлена эмпиема желчного пузыря, распространенный гнойный перитонит.
- История болезни больного С., 70 лет, который был госпитализирован в хирургическое отделение, где был выставлен диагноз: «Острый холецистопанкреатит». Лейкоцитов крови – 25х109/л. Клиническая форма не обозначена, хирургическая тактика не определена. На следующий день в связи с наличием болевого синдрома и перитониальных симптомов выполнена операция – лапаротомия, холицистэктомия от дна. Желчный пузырь флегмонозно изменен. Подпеченочное пространство дренировано круглым полиперфорированным силиконовым дренажом. В течении 8 дней дневниковые записи гласят, что по дренажу выделяется по 50-80 мл. желчи. Вопрос о повторной операции и о переводе в ГБУЗ ПОКБ им. Н.Н. Бурденко не ставится, консультант из ТЦМК не приглашается.
На 4-й день у больного во время рвоты наступила эвентрация кишечника. Больной срочно оперирован тем же хирургом. Причина желчеистечения не установлена, характеристика перитонита не дана. Выполнена назоинтестинальная интубация (видимо имел место паралич тонкой кишки). Свободная брюшная полость от источника желчеистечения не отграничена.
Желчеистечение по дренажам продолжается, однако хирург из ТЦМК не приглашается и вопрос о переводе больного в ГБУЗ ПОКБ им. Н.Н. Бурденко не ставится еще в течении 4-х дней. На 8-й день госпитализации консультант из ТЦМК ввиду отсутствия затеков при контрастной R-графии показаний для релапаротомии не находит и, в свою очередь, допускает тактическую ошибку – не переводит больного в ГБУЗ ПОКБ им. Н.Н. Бурденко, где есть возможность квалифицированно провести УЗИ и КТ.
На 10-й день очередная эвентрация кишечника. Очередная лапаротомия, установить источник желчеистечения оказалось невозможным ввиду отсутствия желчи в момент ревизии и выраженных пластических фибринозных наложений. Очередная тактическая ошибка – больной не переведен в ГБУЗ ПОКБ им. Н.Н. Бурденко. На 14-й день больной переведен на ИВЛ, смерть на 15-й день.
- История болезни больного Ф., 72 года, оперированного в экстренном порядке по поводу острого обтурационного холецистита. Выполнена операция – холецистэктомия, дренирование холедоха по Пиковскому. На 3-й день после операции больной случайно удалил дренаж из холедоха. Несмотря на то, что желчь продолжала поступать через прокол в брюшной стенке и появились признаки ограниченного перитонита, релапаротомия выполнена лишь через 9 дней. Вопрос о вызове консультанта из ТЦМК и переводе в ГБУЗ ПОКБ им. Н.Н. Бурденко не ставился. Больной умер на 42 день после операции. Подобное отношение к судьбе больного трудно определить даже как врачебная ошибка.
- История болезни больной А., 56 лет, поступившей в хирургическое отделение с клиникой деструктивного холецистита. Операция выполнена лишь через 9 дней – якобы больная отказывалась до этого от операции. Во время операции был вскрыт паравезикальный абсцесс, выполнена холецистэктомия. Смерть больной наступила на 15 день вследствие полиорганной недостаточности. Естественно консультантов из ТЦМК не приглашали, вопрос о переводе в ГБУЗ ПОКБ им. Н.Н. Бурденко не ставился.
Ошибки и опасности при хирургическом лечении ущемленных грыж передней брюшной стенки.
Казалось бы, что проще, чем диагностировать ущемленную грыжу передней брюшной стенки при наличии плотного болезненного образования в области грыжевых ворот. В этих ситуациях вопрос решается просто – показана срочная операция — грыжесечение, рассечение ущемляющего кольца, оценка жизнеспособности ущемленной части кишки и завершающая пластика грыжевых ворот.
Подобную операцию легко выполнить под местным обезболиванием.
Совершенно другим должен быть подход к ущемленным грыжам, осложненным флегмоной грыжевого мешка, острой кишечной непроходимостью или перитонитом.
В подобных ситуациях показана срочная срединная лапаротомия с кратковременной предоперационной подготовкой в условиях реанимации или палаты интенсивной терапии.
При срединной лапаротомии оценивается:
- Характер экссудата в свободной брюшной полости (серозный, серозно-фибринозный, геморрагический, гнойный и тому подобное);
- Уровень ущемленной петли кишки (тощая или подвздошная)
- Состояние приводящей петли (насколько она растянута и на каком расстоянии от места ущемления и степень отечности её стенки, наличие или отсутствие перистальтических движений в связи с механическим раздражением. Иначе говоря, хирург уточняет наличие или отсутствие паралича приводящей петли и на каком расстоянии.
Эти критерии определяют интраоперационную формулировку диагноза, а, следовательно, характер и объем оперативного вмешательства.
При выборе объема операции следует рассмотреть несколько вариантов:
- Экссудат светлый, прозрачный в небольшом количестве. Приводящая петля растянута на 3-4 см, стенка её не отечна в грыжевое кольцо можно ввести указательный палец, растянуть его, а ущемленную петлю можно извлечь. Ущемлённая часть кишки синюшно-багровая, но розовеет и начинает перистальтировать в ответ на механическое раздражение.
Интраоперационный диагноз можно сформулировать так: «Ущемлённая …грыжа, осложнённая серозным перитонитом без паралича приводящей петли». Понятно, что ни о какой резекции кишки речь не идет. Достаточно провести новокаиновую блокаду брыжейки тонкой кишки и ушить внутреннее кольцо через лапаротомную рану, а стандартное грыжесечение выполнить при необходимости в плановом порядке.
- Экссудат серозно-геморрагический, малопрозрачный (мутноватый). Приводящая петля расширена до 4-5 см, содержит жидкость и газ. Стенки кишки отечны, не перестальтируют, протяженность парализованной кишки не менее 1 метра. Отводящая петля спавшаяся. Внутреннее кольцо исследовать не возможно.
Интраоперационный диагноз: «Ущемлённая… грыжа с некрозом и синдромом паралитической кишечной непроходимости. Серозно-геморрагический или серозно-фибринозный перитонит».
При этом варианте алгоритм действий хирурга следующий:
2.1 удаление экссудата электроотсосом и санация брюшной полости раствором фурацилина;
2.2 резекция ущемленной петли тонкой кишки с использованием ушивателей органов (УО-40, УО-60), без извлечения ущемленной части из грыжевого мешка;
2.3 эвакуация кишечного содержимого из приводящей части кишки путем сцеживания его в стерильный непромокаемый пакет или непосредственно в таз для сбора салфеток;
2.4 формирование Т-образного анастомоза (конец приводящей петли в бок отводящей) с последующей интубацией приводящей петли стерильным полиперфорированным силиконовым дренажом по методу Сапожкова А. (хирург БСМП г. Пенза 1994 год). Этот способ длительной декомпрессии тонкой кишки мы назвали «интубация тонкой кишки через илеостому по Майдлю». В отличие от других способов она легко выполнима, проходит асептично и не дает осложнений, присущих другим способам. Существенными моментами этого способа длительной декомпрессии приводящего отдела тонкой кишки являются:
1) анастомоз формируется в 8-10 см от конца отводящей петли;
2) первый обвивной непрерывный шов вокруг интубационной трубки затягивается туго, до полной герметичности;
3) второй кисетный шов накладывается в 2-3 см от первого и затягивается после погружения в него интубационной трубки, «нежно», до соприкосновения стенок, без тугого затягивания;
4) через прокол брюшной стенки в правой подвздошной или боковой областях интубационную трубку извлекают из брюшной полости и кишка подшивается к брюшине с захватом в шов предлежащих мышечно-апоневротических фасций и мышц (не менее 4 лигатур). Лигатуры, взятые на зажимы, затягиваются последовательно и отсекаются;
5) заключительным этапом является фиксация интубационной трубки к коже;
6) дренирование брюшной полости и послойное ушивание лапаротомной раны;
2.5) заключительный этап – операция грыжесечение. Вскрытие грыжевого мешка. Удаление содержимого грыжевого мешка и резицированной части кишки, пластика грыжевых ворот, если нет флегмоны грыжевого мешка.
3. Экссудат носит гнойный характер, тонкая кишка растянута газами и жидким содержимым на всем протяжении, стенка её багрово-синюшного цвета, отечна, не перистальтирует в ответ на механическое раздражение.
Интраоперационный диагноз можно сформулировать так: «Ущемленная … грыжа, распространенный гнойный перитонит, вторая стадия (по Напалкову 1927 г.) — с параличом тонкой кишки».
Алгоритм действия хирурга при этом варианте:
3.1 санация брюшной полости;
3.2 резекция ущемленной петли тонкой кишки;
3.3 интубация тонкой кишки через концевую илеостому, если резецирована петля подвздошной кишки. Если резецирована петля тощей кишки, интубация приводящей части кишки производится «вынужденно» через илеостому по Майдлю.
Примечание: формирование двухконцевой илеостомы возможно при условии выполнения программированной релапаротомии через 48-72 часа с целью закрытия свищей при стихающем гнойно-воспалительном процессе. Несоблюдение предлагаемого алгоритма действий, как правило, заканчивается неблагоприятно.
Примерами этим рекомендациям могут служить:
- История болезни больной А., 79 лет, которая поступила в хирургическое отделение с ущемленной рецидивной паховой грыжей. Операция через 20 минут – лапаротомия, резекция тонкой кишки, трансназальная интубация тонкой кишки.
Послеоперационный период протекает крайне тяжело, но, несмотря на это, в первые послеоперационные сутки больная экстубирована. Хирург из ТЦМК вызванный на консультацию через 3 дня, констатировал у больной наличие полиорганной недостаточности (сердечно-сосудистой, дыхательной недостаточности и динамической кишечной непроходимости). Больная переведена на ИВЛ. Состояние больной расценено как неоперабельное.
У данной больной были допущены ошибки:
а) не была проведена предоперационная подготовка;
б) грубой ошибкой следует считать трансназальную интубацию тонкой кишки, которая довольно травматична, тем более у 79 летней женщины с наличием сердечно-сосудистой патологии. В данном случае более рационально была бы интубация через концевую илеостому по Майдлю.
- История болезни больной Ж., 83 лет, поступившей в хирургическое отделение с правосторонней ущемленной бедренной грыжей, осложненной кишечной непроходимостью и перитонитом. Выполнена резекция петли подвздошной кишки, наложена концевая илеостома и выполнена для чего-то трансназальная интубация тощей кишки, хотя вполне можно было обойтись интубацией тонкой кишки через концевую илеостому. На 3-день больная умерла.
- История болезни больной М., 62 лет, которая поступила в хирургическое отделение и оперирована через 18 часов по поводу острой кишечной непроходимости. При лапаротомии установили, что причиной непроходимости явилось ущемление петли подвздошной кишки в бедренной грыже справа. Выполнена резекция тонкой кишки с анастомозом «конец в конец», хотя приводящие петли были растянуты, отечны, гиперемированы. Результатом этой операции явилась несостоятельность швов анастомоза. На 4-й день выполнена релапаротомия, резекция анастомозированной части тонкой кишки с интубацией через илеостому по Майдлю, а в 20 часов того же дня по дренажам из брюшной полости стало вытекать желудочное содержимое с примесью желчи. Экстренная релапаротомия. Обнаружена перфоративная язва желудка — ушита.
Вопрос о вызове консультанта из ТЦМК и переводе в ГБУЗ ПОКБ им. Н.Н. Бурденко не ставился в течении 9-ти дней. Выполнена релапаротомия по поводу перфорации тонкой кишки. На 11-й день очередная релапаротомия по поводу несостоятельности швов ушитой язвы желудка. Видимо у этой больной настолько был нарушен репаративный процесс, что возникали острые язвы с последующей перфорацией. Смерть наступила на 14 сутки пребывания в стационаре.
- История болезни больного П., 71 года. Оперирован экстренно по поводу ущемленной левосторонней паховой грыжи – грыжесечение, резекция некротизированной части большого сальника, пластика грыжевых ворот. Со 2-го дня у больного клиника кишечной непроходимости. Больного переводят в отделение реанимации. На 3-й день на УЗИ признаки кишечной непроходимости, на 5-й день на рентгенограмме — чаши Клойбера в толстой кишке – операция лапаротомия. Обнаружено, что подвздошная кишка на протяжении 30 см темно-багрового цвета, стенки кишки отечны. Вместо того, чтобы сделать резекцию тонкой кишки с удалением патологически измененной части, проводят трансназальную интубацию. Консультанта из ТЦМК вызывают лишь на 9-й день. Больная от предложенной операции отказалась. Умерла спустя 3-суток.
В данном случае танатогенез можно представить следующим образом: ущемленная петля самостоятельно вправилась в брюшную полость, видимо, во время анестезии, при явном деструктивном процессе (некроз части большого сальника) и в раннем послеоперационном периоде в связи с появлением клиники кишечной непроходимости, вопрос о лапаротомии не ставится в течение 5 дней. Грубой ошибкой следует считать отказ от резекции патологически измененного участка подвздошной кишки. Неблагоприятный исход закономерен. Патологоанатом в угоду хирурга завуалировал ущемленную грыжу под мезентериальный тромбоз, практически ничем не обосновав его, так как брыжеечные сосуды не исследовались.
- История болезни больной П., 77 лет. Поступила в хирургическое отделение с ущемленной правосторонней паховой грыжей, осложненной перитонитом. Экстренно выполнена операция грыжесечения под местной анестезией. Перитонит установлен интраоперационно. Под общим обезболиванием выполняется срединная лапаротомия. В 2,5 метрах от связки Трейца обнаруживают перфорационное отверстие без учета, что у больной помимо серозно-фибринозного перитонита еще имеется и паралич тонкой кишки. Участок кишки резецируют и накладывают анастомоз по типу «бок в бок». И как результат — послеоперационный распространенный гнойный перитонит с параличом тонкой кишки. Релапаротомия на 5-е сутки. Ограничиваются трансназальной интубацией тонкой кишки, санацией и дренированием брюшной полости. Летальный исход предопределен.
Следовало бы при первой операции просанировать брюшную полость, сформировать тонкокишечный свищ и через него заинтубировать приводящую часть кишки, и, справившись с перитонитом, идти на закрытие свища.
Ошибки и опасности при хирургическом лечении острой кишечной непроходимости.
Острая кишечная непроходимость у взрослых может быть вызвана множеством причин: спаечная болезнь, внутрибрюшные и наружные грыжи, онкопроцессы, инородные тела, закрывающие просвет кишечника (желчные камни, гельминты и т.п.), анатомофизиологические особенности органов брюшной полости.
Клинические признаки кишечной непроходимости хорошо известны. Степень их выраженности определяется уровнем препятствия. При тонкокишечной непроходимости превалируют схваткообразные боли и рвота застойным содержимым. При толстокишечной — вздутие живота, неотхождение газов и отсутствие стула.
Хирургическая тактика определяется видом непроходимости: функциональная, обструкционная или деструкционная (по классификации Литманна).
— Для деструкционной кишечной непроходимости характерно наличие перитониальных симптомов. При этом виде непроходимости показано срочное оперативное вмешательство с предоперационной подготовкой не более 2 часов.
— Для обструкционной кишечной непроходимости характерно отсутствие перитониальных симптомов и наличие чаш Клойбера при обзорной R-графии брюшной полости. При ней предоперационная подготовка может быть продлена до 4-6 часов, включая постановку очистительных клизм.
— Для функциональной кишечной непроходимости характерно отсутствие перитониальных симптомов и чаш Клойбера при обзорной R-графии брюшной полости. При этом виде непроходимости проводятся общепринятая комплексная консервативная терапия, R-контроль пассажа бария по желудочно-кишечному тракту, очистительная клизма.
При появлении рентген-признаков кишечной непроходимости показано оперативное вмешательство.
К этому виду кишечной непроходимости следует отнести и раннюю послеоперационную кишечную непроходимость, признаки которой начинают проявляться со 2-х суток после операции.
Несоблюдение этого алгоритма действий приводит к запоздалому оперативному вмешательству и к расширению объема операции, что зачастую становится причиной неблагоприятных исходов.
Самой серьезной ошибкой, которую допускают хирурги, является неточная формулировка диагноза без учета вида непроходимости. Как правило, в историях болезни выставлен диагноз: «Острая кишечная непроходимость», а при наличии на коже передней брюшной стенки послеоперационного рубца ставят диагноз — «Спаечная кишечная непроходимость». Хорошо еще, если выполняют рентген-контроль пассажа бария по желудочно-кишечному тракту. При деструкционной и обструкционной кишечной непроходимости делать этого совершенно не нужно, достаточно обзорной рентгенографии живота, так как это приводит к запоздалому оперативному вмешательству со смертельным исходом.
Примером этому положению может служить история болезни больной Х., 81 год, которая была прооперирована только через сутки после поступления в стационар. У больной оказалась опухоль селезеночного угла ободочной кишки. Была выполнена левосторонняя гемиколэктомия с наложением концевой трансверзостомы. Смерть на вторые сутки после операции. Объем операции явно завышен. Видимо, следовало ограничиться на первом этапе наложением трансверзостомы.
Неисполнение алгоритма диагностических действий, неиспользование рентгенологических контрастных исследований при функциональном виде кишечной непроходимости приводит к необоснованным лапаротомиям.
Больной К., 40 лет, поступил в хирургическое отделение с диагнозом: «Острая кишечная непроходимость», который был поставлен на основании резкого вздутия живота. Через 3 дня врач УЗИ диагностики ставит диагноз: «Кишечная непроходимость». При лапаротомии выявлен цирроз печени, асцит и парез правой половины ободочной кишки. На 11 послеоперационные сутки – релапаротомия по поводу вялотекущего перитонита. На следующий день больной умер. Патологоанатомический диагноз: «Цирроз печени, спленомегалия, асцит. Отек головного мозга».
Примером ошибочной хирургической тактики при обструкционной кишечной непроходимости служит история болезни больной Б., 74 лет, которая была госпитализирована в хирургическое отделение с диагнозом: «Острая кишечная непроходимость». Обзорная рентгенография органов брюшной полости не делается, диагноз не уточняется. На следующие сутки появились признаки перитонита. Экстренная лапаротомия. Диагноз: C-r сигмы, толстокишечная непроходимость, разрыв (перфорация) слепой кишки. Перитонит.
При хирургическом лечении острой кишечной непроходимости очень важно установить её причину и правильно выбрать объем и характер операции с учетом возраста больного, наличие сопутствующей сердечно-легочной патологии.
Не менее важным является определение степени декомпенсации, от чего зависит выбор способа декомпрессии приводящего отдела кишечника.
При деструкционной кишечной непроходимости: узлообразование, заворот, внутреннее ущемление, инвагинация, показана резекция петель кишечника en block. Превентивная длительная декомпрессия приводящего отдела тонкой кишки, если есть признаки его паралича (кишка растянута более 3-4 см химусом и газами, стенка кишки отечная, синюшно-багровая, не перистальтирует на механическое раздражение), проводится через назогастральный зонд.
У лиц пожилых и старческого возраста с сопутствующей сердечно-легочной патологией данный способ декомпрессии крайне нежелателен. В этих ситуациях предпочтительное отсечение патологического участка на уровне неизмененной части отводящей петли, мобилизация пораженной части с последующей эвакуацией содержимого из приводящего отдела кишечного содержимого в стерильную емкость или непосредственно в таз для отходов.
После выполнения данного этапа операции целесообразно наложение анастомоза «конец приводящей петли в бок отводящей» на расстоянии 8-10 см от места пересечения с последующей интубацией приводящего отдела тонкой кишки по А. Сапожкову.
Если паралича приводящего отдела кишки нет, можно ограничиться одномоментной декомпрессией методом «сцеживания» с последующим восстановлением целостности кишки.
При обструкционной кишечной непроходимости, если она обусловлена злокачественным процессом, показаний для резекции кишки нет.
В данном случае на первый план выступают устранение причин обструкции и выбор способа декомпрессии.
Если непроходимость обусловлена тотальным спаечным процессом и при этом приходится выполнять энтеролиз почти на всем протяжении тонкой кишки, показана трансназальная или проксимальная интубация тонкой кишки через подвесную петлевую илеостому с заглушкой по Шалимову после предварительной одномоментной декомпрессии путем «сцеживания» химуса в дистальные отделы.
Примером ошибочной интраоперационной тактики служит история болезни больной П., 82 лет, оперированной через 4 суток с момента госпитализации по поводу острой кишечной непроходимости. Причиной непроходимости явилось закрытие просвета подвздошной кишки желчным камнем. Выполнена илеолитотомия. Состояние приводящего отдела тонкой кишки в протоколе операции не отображено. Декомпрессия кишки не проводилась. Ранний послеоперационный период протекает с явной картиной ранней послеоперационной кишечной непроходимости — по назогастральному зонду постоянно оттекало застойное кишечное содержимое. Вопрос о релапаротомии не ставился. На 8 день после операции наступила смерть.
Другим примером ошибочного выбора способа длительной декомпрессии тонкой кишки служит история болезни больной А., 82 лет. Больная была прооперирована косым переменным доступом в правой подвздошной области — обнаружен инфильтрат. В связи с появлением признаков непроходимости, на 6-е сутки пребывания в стационаре выполнена лапаротомия, правосторонняя гемиколэктомия и трансназальная интубация тонкой кишки. Смерть больной наступила в этот же день. В данном случае трансназальная интубация ввиду её травматичности и с учетом возраста больной вообще была не показана. Декомпрессию тонкой кишки, если в этом была необходимость, можно было легко и просто выполнить через концевую подвесную трансверзостому.
Ошибки и опасности при хирургическом лечении острых деструктивных панкреатитов.
Целый ряд острых хирургических заболеваний органов брюшной полости: острый холецистит, прободные гастродуоденальные язвы, внутренние ущемления, острая непроходимость мезентериальных сосудов, могут протекать под маской острого панкреатита, что служит причиной запоздалого оперативного вмешательства и неблагоприятных исходов.
С другой стороны, панкреонекрозы — одна из наиболее трагических страниц абдоминальной хирургии. Летальность при них колеблется от 20 до 50 %. До сих пор вопросы хирургической тактики у разных авторов являются диаметрально противоположными. Одни считают, что надо их оперировать до развития таких грозных осложнений как забрюшинная флегмона и полиорганная недостаточность. Другие, наоборот считают, что оперативное вмешательство возможно только в фазе гнойно-септических осложнений.
Истина все же лежит посередине. Слишком активная хирургическая тактика ведет к снижению уровня послеоперационной летальности за счет больных, которых с успехом можно было и не оперировать, но это не приносит удовлетворения хирургу. Ещё большее разочарование испытывает хирург, когда он ничем не может помочь больному и понимает, что оперативное вмешательство нужно было предпринять как можно раньше.
В методических рекомендациях «По оказанию ургентной помощи при острых заболеваниях живота в ЛПУ 1 и 2 уровня» (Пенза 2010 г.) нами предложен, как нам кажется, наиболее оптимальный вариант определения хирургической тактики в зависимости от степени выраженности клинических проявлений.
В зависимости от степени тяжести клинических проявлений всех больных с острым панкреатитом следует делить на 3 клинических формы: легкая, средней тяжести, тяжелая, что и должно быть отраженно в формулировке диагноза.
Больные первой клинической группы: «Острый панкреатит, легкая форма» не требуют никакого хирургического вмешательства.
Больные второй клинической группы: «Острый панкреатит, среднетяжелая форма» требует проведения комплексной консервативной терапии, включающий в себя:
- Новокаиновые блокады по Роману, Филину или Виноградову;
- Инфузионную терапию со спазмолитиками, анальгетиками, антиферментативными препаратами, H2 блокаторами и антибиотиками широкого спектра действия, а при некупируемом болевом синдроме — наркотические анальгетики, не вызывающие спазма сфинктера Одди (промедол), если вы исключили перфоративную язву, ущемленную диафрагмальную грыжу, острый деструктивный холецистит и инфаркт миокарда, используя параклинические методы исследования: ФГДС, УЗИ, ЭКГ.
- Декомпрессию желудка с постоянной абдоминальной гипотермией.
Больные этой группы должны лечиться в палате интенсивной терапии или в отделении реанимации в течение 12 часов. При отсутствии эффекта от проведенной консервативной терапии показана лапаротомия.
Больным третьей клинической группы: «Острый панкреатит, тяжелая форма» такая же комплексная терапия проводится в течение не более 6 часов, если болевой синдром не купируется, состояние больного не улучшается, отсутствует положительная динамика от проводимого лечения — показана срочная лапаротомия.
Чтобы легче определять формы клинического течения, приводим таблицу:
|
Наименование клинического признака |
Легкая форма |
Среднетяжелая форма |
Тяжелая форма |
| Степень выраженности болевого синдрома |
Умеренный (купируется блокадой, спазмолитиками, анальгетиками) |
Выраженный (купируется наркотическими препаратами) |
Нетерпимый (не купируется наркотическими анальгетиками) |
| Рвота |
Однократная |
Многократная |
Многократная неукротимая |
| Язык |
Влажный |
Увлажняется |
Сухой |
| Вздутие живота |
Отсутствует |
Умеренное |
Выраженное |
| Болезненность |
Умеренная |
Выраженная, но глубокая пальпация доступна |
Глубокая пальпация недоступна |
| Дефанс передней брюшной стенки в эпигастрии |
Отсутствует |
Сомнительный |
Четкий |
| Симптом Щёткина |
Отсутствует |
Сомнительный |
Четкий |
| Притупление в отлогих местах |
— |
— |
+ |
| Симптом Мейо-Робсона |
— |
— |
+ |
| Перистальтические шумы |
Обычные |
Ослаблены |
Отсутствуют |
| Пульс |
До 90 |
90-100 |
Больше 100 |
| АД |
N |
N |
Меньше 100 |
| Одышка |
— |
— |
— + |
| Энцефалопатия |
— |
+ — |
+ |
| Лейкоцитоз |
До 12 тыс. |
12-16 тыс. |
Более 16 |
| Амилаза мочи и крови |
32 |
32-64 |
Более 64 ли менее 16 |
| Билирубин крови |
Менее 20 |
20-30 |
Более 30 |
| Глюкоза крови при отсутствии диабета |
Менее 8 |
8-10 |
Более 10 |
| Мочевина крови |
Менее 7 |
7-10 |
Более 10 |
| УЗИ брюшной полости |
N |
Свободная жидкость +- |
Свободная жидкость + |
Несоблюдение этого алгоритма действий, приводит к запоздалому оперативному вмешательству и, как правило, к летальному исходу, причиной которого является полиорганная недостаточность как следствие неуправляемой интоксикации.
Примером несоблюдения данного алгоритма действий служат:
- История болезни больной В., 72 лет, которая сутки находилась в терапевтическом отделении с подозрением на инфаркт миокарда. Больную не оперировали, умерла на следующие сутки. Патологоанатомический диагноз: «Геморрагический панкреонекроз».
- История болезни больной А., 54 лет, умершей через сутки в отделении реанимации. Не оперирована. На вскрытии — тотальный геморрагический панкреонекроз.
- История болезни больного К., 61 года, поступившего в отделение реанимации с АД 80 и 60 мм. рт. ст., пульс 112 ударов в минуту. Консилиум не проводится, хирургическая тактика не определена, форма клинического течения не установлена. Консультант из ТЦМК не приглашается. Через сутки с момента госпитализации операция — лапаротомия. Поражена вся забрюшинная клетчатка, дренирование не проводится. Смерть через 10 часов после операции.
- История болезни больного П., 53 лет, госпитализированного в хирургическое отделение с диагнозом: «Острый панкреатит». Форма клинического течения не выставлена. Госпитализирован не в реанимацию, а в общую палату, новокаиновые блокады не делаются, консервативная терапия неадекватна тяжести клинического течения, динамическое наблюдение за больным не проводится. Больной через 7 часов после госпитализации, падает в туалете. АД 60 и 40 мм рт. ст. Больной переводится в отделение реанимации, а операция лапаротомия выполняется через 2 суток с момента госпитализации. Консультанта из ТЦМК не приглашают. При тотальном геморрагическом панкреонекрозе не проводится абдоминизация поджелудочной железы, состояние забрюшинной клетчатки не отражено в протоколе операции и она не дренируется. Смерть через сутки после операции.
- История болезни больного У., 29 лет, госпитализированного в хирургическое отделение с диагнозом: «Острый панкреатит». Форма клинического течения не обозначена, новокаиновые блокады не проводятся, консервативная терапия неадекватна, динамическое наблюдение не проводится, хирургическая тактика не определена. Через 2 суток — развернутая картина полиорганной недостаточности. Под внутривенным обезболиванием без перевода на ИВЛ выполняется диагностическая лапароскопия и дренирование брюшной полости при частоте дыхания 34 в минуту и нестабильной гемодинамике. На ИВЛ переводят за 3 часа до смерти. На вскрытии — тотальный геморрагический панкреонекроз.
- История болезни больной Ш., 82 лет, лечившейся в хирургическом отделении с диагнозом: «Тромбоз мезентериальных сосудов» в течение 4-х суток. На вскрытии — геморрагический панкреонекроз, серозно-фибринозный перитонит.
- История болезни больного Г., 74 лет, поступившего в хирургическое отделение с диагнозом: «Острый панкреатит». Обзорная рентгенография брюшной полости сделана на следующие сутки — под куполом диафрагмы обнаружен свободный газ. Экстренная лапаротомия. Смерть на 12 сутки пребывания в стационаре от прогрессирующего перитонита.
- История болезни больного Л., 46 лет, поступившего в хирургическое отделение с диагнозом: «Острый панкреатит, формирующаяся псевдокиста». Взят на операцию через 3 недели после госпитализации с угрозой разрыва кисты. Операция — панкреатоцистоеюностомия с петлей по Ру. Через 19 суток взят на релапаротомию, вскрыты межпетельные абсцессы — 5 мл и удалено через мезоколон 100 мл инфицированной жидкости, удален секвестр через мезаколон, выполнена декомпрессия тонкой кишки по Зауэру. Через 7 суток очередная релапаротомия по поводу множественных перфораций острых язв тонкой кишки — процесс стал неуправляемым. Через 4 суток наступила смерть. У данного больного, на мой взгляд, первая операция выполнена явно с запозданием, когда наступила перфорация кисты в свободную брюшную полость.
- История болезни больного С., 57 лет, поступившего в хирургическое отделение с диагнозом: «Острый панкреатит». На вскрытии после 2-х суток пребывания в стационаре обнаружена эмпиема желчного пузыря и распространенный гнойный перитонит.
Не менее сложным оказывается выбор объема оперативного вмешательства при деструктивных панкреатитах. Как показывает опыт, формирование панкреатооментобурсостомы при распространении деструктивного процесса на забрюшинную и параколарную клетчатку явно недостаточно. Необходимо не просто дренировать пораженную область, но и своевременно ставить вопрос о необходимости релапаротомии, что возможно лишь в условиях ГБУЗ ПОКБ им. Н.Н. Бурденко, где есть высококвалифицированные хирурги и возможность выполнить КТ брюшной полости. Своевременно выполненное радикальное оперативное вмешательство, есть залог успешного лечения этой патологии.
Характер и объём оперативного вмешательства при деструктивных панкреатитах.
Среднетяжелые и тяжелые формы панкреатита обусловлены геморрагическими или преимущественно геморрагическими панкреонекрозами с наличием стеатонекрозов и зависят от распространенности процесса.
При первичном оперативном вмешательстве очень важно установить не только степень и характер деструкции в самой поджелудочной железе, но и степень пропитывания окружающей забрюшинной клетчатки, её распространенность.
Достаточно квалифицированный хирург при первичном операционном вмешательстве может руководствоваться вариантами, изложенными в методических рекомендациях.
Возможные варианты:
1 вариант.
Деструкция локализуется в поджелудочной железе с инфильтрацией экссудатом только парапанкреатической клетчатки, а экссудат в свободной брюшной полости носит серозный характер, тонкая кишка без признаков воспаления и паралича. Поджелудочная железа при пальпации плотная с повышенной кровоточивостью при попытке вскрытия парапанкреатической клетчатки и абдоминизации ее. Отсутствует гипертензия желчевыводящих путей. Интраоперационный диагноз формулируется так: Панкреонекроз, ферментативный перитонит. Объем оперативного вмешательства ограничивается удалением экссудата с промыванием брюшной полости, ненасильственной абдоминизацией поджелудочной железы и закрытым дренированием полости малого сальника круглыми двухпросветными силиконовыми дренажами через прокол передней брюшной стенки вне лапаротомной раны. Рекомендуется инфильтрация 0,25-0,5% раствором новокаина с антибиотиками широкого спектра действия и ингибиторами протеаз в количестве 500 мл в корень брыжейки тонкой и поперечно-ободочной кишки, в парапанкреатическую клетчатку на всём протяжении, если не выполнялась абдоминизация поджелудочной железы. Желательно установление в корень брыжейки микроирригатора для повторных введений вышеуказанных растворов.
2 вариант.
Отмечается пропитывание не только парапанкреатической, но и забрюшинной клетчатки справа, слева, или с обеих сторон, а также корня брыжейки тонкой и поперечно-ободочной кишки. Диагноз: некроз поджелудочной железы и забрюшинной клетчатки. При этом варианте обязательна абдоминизация поджелудочной железы, вскрытие и дренирование клетчаточных пространств, проточное дренирование полость малого сальника с выведением дренажа позади нисходящего отдела ободочной кишки в левую поясничную область, если процесс преимущественно локализуется в области хвоста и параколонарной и забрюшинной клетчатки слева.
Завершается операция оментобурсопанкреатопексией левой половиной большого сальника, что позволяет значительно уменьшить полости малого сальника и предупредить развитие перитонита нижнего этажа брюшной полости через мезоколон.
3 вариант,
Поджелудочная железа имеет тестоватую консистенцию, разрушается (фрагментируется) при пальцевом давлении, легко выполняется абдоминизация поджелудочной железы, что говорит о глубине деструкции в ней с преимущественной локализацией в области тела и хвоста, — рекомендуется выполнение дистальной панкреатнекрэктомии со спленэктомией или без неё. Операция заканчивается так же как при 2 варианте. Если хирург не владеет техникой дистальной панкреатнекрэктомии, допустима оментолапаростомия.
4 вариант.
Деструктивный процесс в поджелудочной железе и клетчатке сопровождается серозно-фибринозным перитонитом и синдромом кишечной непроходимости. В этом случае оперативное вмешательство следует дополнить длительной декомпрессией тонкой кишки одним из известных способов (назоинтестинальная интубация по Дедереру, через энтеростому по Майдлю или Джексону).
5 вариант.
Независимо от распространённости деструктивного процесса при наличии признаков вне- и внутрипечёночной гипертензии показано наложение декомпрессивной холецистостомы (холангиостомы).
При недостаточном опыте можно ограничиться санацией и дренированием сальниковой сумки силиконовыми дренажами и брюшной полости с тем, чтобы перевести больного в ГБУЗ ПОКБ им. Н.Н. Бурденко, для дальнейшего лечения или вызвать на себя консультанта из ТЦМК, для решения вопроса о релапаротомии.
Примерами ошибочной интраоперационной тактики служат:
- История болезни больного К., 33 лет, оперированного по поводу подозрения на разрыв мочевого пузыря. При нижнесрединной лапаротомии разрыва не обнаружено, в брюшной полости геморрагическая жидкость. Верхний этаж не обследован из-за спаечного процесса. Выставлен диагноз: «Туберкулез кишечника». Лечили в реанимации. Консультантов не вызывали. Больной на 14 сутки умер. На вскрытии — геморрагический панкреонекроз, перитонит.
- История болезни больной Д., 40 лет, которая была оперирована с диагнозом: «Перитонит». В брюшной полости обнаружена серозная жидкость, поджелудочная железа увеличена в объеме, плотная с участками распада. Почему-то решили, что это рак поджелудочной железы. Ограничились бурсооментостомой. Консультанта не вызывали. Через 4 дня смерть. На вскрытии — тотальный некроз поджелудочной железы.
- История болезни больной П., 38 лет, поступившей в хирургическое отделение через неделю с момента заболевания. Операция через 9 часов с момента госпитализации — лапаротомия, санация брюшной полости, холецистостома, трансназальная интубация тонкой кишки при нестабильной гемодинамике и оментостома. Смерть через 17 часов. На вскрытии — жировой панкреонекроз, серозно-фибринозный перитонит.
В данном случае объём операции необоснованно расширен трансназальной интубацией тонкой кишки.
Имели место случаи, когда больные поступали в стационар в предагональном состоянии и умирали в первые 4-6 часов. В этих ситуациях, ни о каком оперативном вмешательстве не может быть и речи.
Примечание: Если в лечебном учреждении хирурги владеют видеолапароскопическими технологиями, то они должны быть включены в диагностический и лечебный процесс, как первый этап оперативного вмешательства.
Ошибки и опасности в хирургическом лечении перитонитов.
Они могут быть диагностического характера, когда диагноз перитонита не выставляется, что служит причиной запоздалого оперативного вмешательства. С другой стороны, может иметь место гипердиагностика его при так называемых псевдоперитонеальных симптомокомплексах и псевдоперитонитах, обусловленных нехирургическими заболеваниями.
В рассматриваемой группе умерших из 146 больных перитониты, как осложнения, имели место у 92 (63 %) больных. У одного больного с циррозом печени при лапаротомии перитонит, как таковой, не был обнаружен и, следовательно, операция оказалась ошибочной.
У 57 больных (39 %) причиной перитонита послужил инфаркт кишечника. Среди причин перитонита второе место прочно занимают больные с панкреонекрозами. Единичными причинами явились перфорации и разрывы полых органов брюшной полости.
Если имеет место картина перфораторного перитонита, показано срочное оперативное вмешательство с предоперационной подготовкой не более 2-х часов, независимо от тяжести состояния больного.
При других перитонитах, обусловленных воспалительными процессами органов брюшной полости, следует провести полный комплекс клинико-лабораторных и параклинических методов исследования всех систем и органов для суждения о степени выраженности интоксикации с одновременным проведением дезинтоксикационной и антибактериальной терапии в течение не более 6 часов в условиях реанимационного отделения (палаты).
Если состояние больного не удается стабилизировать, то оперативное вмешательство теряет всякий смысл, т. е. состояние больного можно считать неоперабельным.
Примерами ошибочной диагностики и хирургической тактики служат истории умерших больных.
- Больной К., 53 лет. Поступил через 3 суток с момента заболевания с нестабильной гемодинамикой, с тяжелой степенью интоксикации. Экстренная лапаротомия. Диагноз: Мезентериальный тромбоз, инфаркт кишечника. Состояние нерезектабельное. Умер через 10 часов.
В данном случае при установленном диагнозе оперативное вмешательство не было показано.
- Больная Т., 39 лет. Госпитализирована с диагнозом «Панкреатит». Лечение консервативное. Без проведения полного комплекса диагностических мероприятий, через сутки ввиду неэффективности консервативной терапии больную взяли на операцию. Выявлен субтотальный инфаркт тонкой кишки, резекцию кишки делать не стали. Больная умерла через сутки после операции.
В данной ситуации имела место ошибочная диагностика и, возможно, необоснованный отказ от резекции кишки.
- Больной В., 74 года. Поступил с жалобами на боль в правой половине живота с наличием признаков местного перитонита. Экстренная лапаротомия доступом по Волковичу-Дьяконову под общим обезболиванием. Обнаружен некроз тонкой кишки, хотя перитонит, по характеру экссудата, был серозным. От срочной лапаротомии и резекции кишки необоснованно отказались. Больной прожил еще 5 дней.
В данном случае отказ от радикальной операции явно был не обоснован, видимо, ввиду низкой квалификации хирурга. Следовало бы сразу же вызвать консультанта из ТЦМК. К сожалению, подобные случаи не единичны. Больной Ф., 53 лет, которому была выполнена эксплоративная лапаротомия, прожил 6 суток без повторного оперативного вмешательства.
- Примером ошибочной тактики на догоспитальном этапе служит история болезни больного Т., 82 лет, которого бригада скорой помощи доставила из дома в приемное отделение больницы с АД 30 и 0 мм рт. ст. Больной умер в этот же день, не оперирован. Диагноз: мезентериальный тромбоз, перитонит.
- Больной М., 71 год, госпитализирован с диагнозом панкреатит, лечили консервативно, через 2 суток оперирован по поводу распространенного перитонита вследствие перфорации опухоли селезеночного угла ободочной кишки. Операция — резекция левого фланка с выведением трансверзостомы, с санацией и дренированием брюшной полости. При отсутствии паралича почему-то еще и выполнили трансназальную интубацию тонкой кишки. Смерть наступила на следующие сутки.
- Больной Г., 74 лет. Госпитализирован с диагнозом: «Панкреатит». Через сутки выполнена обзорная рентгенография брюшной полости, обнаружен свободный газ под куполом диафрагмы. Срочная лапаротомия. Обнаружена перфоративная язва 12-ти перстной кишки, перитонит.
С 3-их послеоперационных суток — нестабильная гемодинамика. Консультантов не приглашают, вопрос о переводе в ГБУЗ ПОКБ им. Н.Н. Бурденко не ставится. На 8-й послеоперационный день — смерть. Причина смерти — гнойный перитонит.
Ошибки интраоперационной диагностики.
Ошибки интраоперационной диагностики перитонита, а, следовательно, и выбор объема оперативного вмешательства обусловлены незнанием его характеристик: распространенности перитонита, характера экссудата, стадийности его клинического течения по Напалкову, степени выраженности интоксикации.
Хирург, прежде чем начать оперативное вмешательство при установленном источнике перитонита, должен взвесить свои возможности, уровень квалификации и достаточность практических навыков для выполнения операции в полном объеме. При наличии сомнений лучше вызвать консультанта на себя или решить вопрос о переводе больного в ГБУЗ ПОКБ им. Н.Н. Бурденко.
При неустановленном источнике перитонита, если состояние больного транспортабельное, лучше срочно решить вопрос о вызове консультанта или перевести больного в ГБУЗ ПОКБ им. Н.Н. Бурденко.
Характер и объем оперативных вмешательств при распространенных перитонитах.
Характер и объем оперативных вмешательств при распространенных перитонитах определяется:
1. Источником перитонита.
Источник перитонита должен быть удален! При невозможности удаления источника перитонита должны быть предприняты меры по его отграничению от свободной брюшной полости.
2. Характером экссудата.
2.1. При серозном характере (при отсутствии выпавшего фибрина) достаточно тщательно осушить брюшную полость. Дренажи устанавливаются, как правило, непосредственно к источнику перитонита.
2.2. При серозно-фибринозном перитоните (большое количество мутного экссудата и выпавшего фибрина, порой трудноудаляемого) — обязательно не только тщательное удаление экссудата, но и промывание брюшной полости с последующим установлением силиконовых дренажей.
2.3. При гнойном перитоните (множественные гнойные очаги), как правило, сопровождающимся параличом тонкой кишки, одномоментная санация брюшной полости практически невыполнима. Поэтому проводятся программированные релапаротомии с целью дополнительной санации гнойных очагов и брюшной полости.
Деление перитонитов по характеру экссудата: мочевой, каловый, желчный и т.п. не влияет на интраоперационную хирургическую тактику, а поэтому не имеет практического значения.
3. Синдромом кишечной непроходимости.
Перитонит по Напалкову (1927 г.) делится на 2 стадии: без паралича и с параличом тонкой кишки.
3.1. При 1 стадии перитонита длительная декомпрессия кишечника не требуется, т.е. нет необходимости в интубации тонкой кишки.
3.2. При 2 стадии перитонита показана длительная декомпрессия кишечника, которая предусматривает крайне важный второй момент — раннее энтеральное питание.
Декабрь 2012 г.
Демидов Г.И.
♦ Рубрика: Без рубрики.
Осложнения резекции желудка в раннем послеоперационном периоде.
Кровотечения
в просвет ЖКТ.
Внутрибрюшные
кровотечения.
Несостоятельность
желудочно-кишечных анастомозов:
несостоятельность культи 12п.к.,
несостоятельность желудочно-
двенадцатиперстных анастомозов,
несостоятельность желудочно-тонкокишечного
анастомоза
Непроходимость
анастомозов:
непроходимость желудочно- двенадцатиперстного
анастомоза,
непроходимость желудочно-тонкокишечного
анастомоза,
непроходимость межкишечного анастомоза.
Острый синдром
приводящей кишки.
Осложнения
со стороны желчных путей и поджелудочной
железы
послеоперационный панкреатит.
послеоперационная желтуха.
Некроз культи
желудка.
Абсцессы
брюшной полости.
Инфаркт
сальника.
Ранние
послеоперационные кровотечения.
Внутрижелудочное
кровотечение.
Наличие
желудочного отделяемого типа кофейной
гущи по назогастральному зонду в первые
24-48 часов не являются признаком
желудочно-кишечного кровотечения.
Однако появление свежей крови по
назогастральному зонду чаще всего
свидетельствует о сомнительном гемостазе
в зоне анастомоза. Иногда профузные
кровотечения в послеоперационном
периоде после резекции желудка возникают
при нераспознанной язве в проксимальных
отделах желудка или из острых эрозий
культи желудка. При продолжающемся
активном кровотечении рекомендуется
раннее эндоскопическое исследование
с попыткой гемостаза через эндоскоп.
Наиболее эффективным методом
эндоскопического гемостаза является
нанесение фибринового клея на кровоточащие
сосуды в области анастомоза или острые
эрозии культи желудка. Отсутствие
эффекта от вышеприведенных мероприятий
является показанием к релапаротомии.
Для остановки кровотечения при
релапаротомии производят поперечную
гастротомию желудка выше наложенных
гастродуодено- или гастроеюноанастомоза.
Кровоточащие сосуды прошиваются, что
обеспечивает надежный гемостаз.
Внутрибрюшное
кровотечение.
Причиной
внутрибрюшного кровотечения в раннем
послеоперационном периоде может быть
интраоперационная травма различных
органов брюшной полости. Наиболее часто
источником кровотечения является
соскальзывание лигатур с сосудов
сальника и ятрогенные повреждения
селезенки или печени, незамеченные при
выполнении оперативного вмешательства.
Реже возможны кровотечения из неадекватно
лигированных левой желудочной,
желудочно-сальниковых артерий, или
коротких артерий желудка. Очень редко
причиной внутрибрюшного кровотечения
может быть передняя брюшная стенка при
формировании контрапертур для дренажей.
Клиническая картина характеризуется
развитием геморрагического шока и
поступлением крови по дренажу. Ревизия
органов брюшной полости должна проводиться
очень тщательно и целенаправленно,
включая осмотр селезенки, коротких
желудочных сосудов, печени, диафрагмы,
малого сальника, желудочных и
желудочно-сальниковых артерий. В случае
необширных повреждений селезенки
возможно её ушивание с предварительной
перевязкой селезеночной артерии
рассасывающимся материалом на расстоянии
4 см от чревного ствола. Если же повреждение
обширное, а также на фоне геморрагического
шока самым надежным и быстрым является
спленэктомия.
Несостоятельность
швов анастомоза.
Несостоятельность
культи 12-иперстной кишки.
Несостоятельность
культи 12-иперстной кишки возникает
после гастрэктомии или резекции желудка
по Бильрот -2 и является одним из наиболее
частых и угрожающих жизни осложнений..
Частота этого осложнения составляет в
среднем 1-4% (колебания от 1 до 9 %). Вначале
50-ых годов летальность при этом осложнении
долстигала 50%, в 1960-70-х она составляла
10%, в настоящее время она не превышает
5%. Важно отметить, что у некоторых больных
с пептическими язвами пилородуоденального
отдела риск развития несостоятельности
культи 12-ип.к. выше, чем у других больных.
Кроме того развитие несостоятельности
швов культи 12-перстной кишки играют
некоторые факторы, такие как анемия и
гипопротеинэмия, алиментарные истощения
и техника закрытия культи 12-перстной
кишки.
Профилактикой
этого грозного осложнения является
точное сопоставление стенки кишки без
выворачивания слизистой оболочки,
сохранение кровоснабжения кишки ,
недопустимость тугого завязывания
швов. Часто несостоятельность культи
12-иперстной кишки развивается на фоне
пенетрации гигантских язв пилорического
канала или задней стенки луковицы
12-иперстной кишки и постбульбарных язв
в поджелудочную железу … В этих ситуациях
изменяются анатомические взаимоотношения
между 12-иперстной кишкой и окружающими
органами ( поджелудочной железой, общим
желчным протоком, желчным пузырем и
крупными сосудами, окружающими 12-ип.к.).
В этих случаях возникают значительные
технические трудности в мобилизации
12-и п.к. и формировании культи. Иногда
в таких ситуациях следует прибегать к
атипичному погружению культи в некоторых
модификациях ( Ниссон, Юдин и т. Д.) При
угрозе развития риска несостоятельности
рекомендуется наложение боковой
дуоденостомы для декомпрессии
дуоденальной культи. При выполнении
резекции желудка по Бильрот-2 возможна
выполнение декомпресии культи введением
зонда в приводящую петлю.
Несостоятельности культи 12-и п.к
способствуют: выраженная
ишемия в зоне дуоденальной культи или
анастомоза, чрезмерное сдавление стенок
культи наложенными швами, кровотечение
из панкреатодуоденальной зоны, развитие
послеоперационного панкреатита и
развитие абсцессов в области культи.
Наиболее часто несостоятельность
развивается обычно на 2-5 день после
операции. Клиническая картина проявляется
появлением болей в эпигастральной
области и правом подреберье, которые
нередко иррадиируют в правую половину
груди, лопатку или правую половину шеи.
В последующем развиваются симптомы
интоксикации с высокой лихорадкой.
Клиническая картина может протекать
в 3-х вариантах: 1) перфорация кишки в
свободную брюшную полость и развитие
перитонита., что требует как правило
выполнения экстренной лапаротомии , 2)
формирование абсцессов в подпеченочном
пространстве с прорывом его на переднюю
брюшную стенку по ходу дренажа и
образование в последующем дуоденального
свища, 3) формирование воспалительного
инфильтрата в правом подреберье с
последующим его рассасыванием. Диагноз
несостоятельности культи 12-ип.к. может
быть подтверждена путем введения
водорастворимого контраста в приводящую
петлю. Появления его вне пределов кишки,
которое можно диагностировать при
обзорной рентгенографии брюшной полости,
УЗИ, или компьютерной томографии.
Динамику несостоятельности при
воспалительном инфильтрате можно
оценить с использованием радиоизотопных
методов исследования ( с применением
технеция 99м).
При развитиии несостоятельности культи
12-п.к. и перитонита больным показана
экстренная лапаротомия, целью которой
является тщательная санация брюшной
полости и дренирование и тампонирование
области несостоятельности. Иногда для
более надёжного и быстрого создания
наружного свища культю 12-ип.к. дренируют
через дефект стенки культи или
дополнительным наложением боковой
дуоденостомы. В послеоперационном
периоде необходима декомпрессия желудка
и наложение еюностомы в отводящей петле,
что является предотвращением стимуляции
желчи и панкреатической секреции
желудочным содержимым. Осуществляют
полное парентеральное питание с
применением антибиотиков широкого
спектра действия. КТ или УЗИ помогают
оценить динамику воспалительного
процесса в области культи.
В настоящее время для более быстрого
закрытия дуоденального свища используют
соматостатин или его аналоги с
пролонгированным действием ( октреотид).
В случае длительного существования
дуоденального свища необходимо исключить
нарушения эвакуации дуоденального
содержимого из приводящей культи в
культю желудка возможным наличием
инородных тел или возникновением
препятствия в области приводящей петли.
При установлении указанных причин
больному нередко требуется выполнение
повторной операции с целью устранения
выявленных осложнений.
Иногда несостоятельность культи 12-ип.к.
протекает по пути формирования абсцесса.
В этих случаях возможно использовать
для лечения несостоятельность чрезкожную
пункцию этого абсцесса под контролем
УЗИ или КТ. Принципы парентарального
ведения больных, антибиотикотерапии,
декомпрессии культи сохраняют своё
значение.
При образовании инфильтрата рекомендуется
выжидательная тактика с динамическим
УЗИ или КТ.
Несостоятельность желудочно-
двенадцатиперстного анастомоза (после
Бильрот-1 или его модификаций.
Несостоятельность желудочно-
двенадцатиперстного анастомоза возникает
более часто, если анастомоз
наложен в области инфильтрата или на
фоне выраженной рубцовой деформаций в
области луковицы двенадцатиперстной
кишки.
Развитию несостоятельности способствует
избыточная мобилизация 12-ип.к., которая
сопровождается нарушением кровоснабжения,
недостаточная мобилизация культи
желудка или 12-ип.к., что способствует
натяжению анастомоза и технические
погрешности при наложении анастомоза.
Наиболее часто несостоятельность
протекает по типу точечной перфорации
и протекает менее выраженно, чем
несотоятельность 12-ип.к.. Клиника
характеризуетсЯ наличием умеренных
болей в эпигастральной области или в
правом подреберье, появлением лихорадеии
повышение лейкоцитов в крови.
Диагноз несостоятельности
подтверждается появлением окрашенной
желчью жидкости по дренажу из брюшной
полости или в области операционного
шва. Несостоятельность желудочно-
двенадцатиперстного анастомоза
часто является ограниченной, и не всегда
требует повторной операции. Тактика
ведения больных включает: I) обследование
для исключения возможных возможных
нарушений эвакуации и дистальнее
расположенного стеноза 12-ип.к. или
проксимальных отделов тощей кишки., 2)
обследование органов брюшной полости
с использованием компьютерной томографии
с целью идентификации абсцессов и УЗИ,
3) назначение антибиотиков широкого
спектра действия 4) парентеральное
питание, 5) кормлением по назоинтестинальному
зонду, установленному за зоной анастомоза,
и 6) использование в лечении октреатида,
7) возможная чрезкожная пункция скопившейся
жидкости в правом подпеченочном
пространстве.
При отсутствии эффекта от консервативного
лечения и нарастании симптомов перитонита
необходимо выполнение повторной операции
микроперфорация может быть устранена
путем фиксации сальника на ножке, и
созданием адекватного дренирования.
При выраженной несостоятельности
необходимо выполнить реконструктивную
операцию с формированием анастомоза
по Бильрот -2, Ру-анастомоза. Культю
12-ип.к. следует дополнительно укрепить
сальником на ножке, или наложением
концевой дуоденостомы.
Несостоятельность
желудочно-тонкокишечного
анастомоза ( после резекции по Бильрот-2,
или реконструкции по Ру).
Несостоятельность
желудочно-тонкокишечного анастомоза
встречается относительно редко.
Клиническая картина несостоятельности
протекает по типу микроперфорации при
желудочно-дуоденальных анастомозов и
развивается по тем же принципам. Диагноз
несостоятельности подтверждается
рентгенологическим исследованием с
использованием водорастворимых
контрастных веществ или появлением
желудочного или дуоденального содержимого
по дренажу. Принципы лечения такие же
как и при микроперфорации
желудочно-дуоденального анастомоза.
Несостоятельность, которая протекает
по типу инфильтрата требует проведения
консервативного лечения. Однако
выраженная Несостоятельность требунт
повторного оперативного вмешательства.
Если диаметр перфорации незначителен,
то возможно использование сальника на
ножке для укрывания перфоративного
отверстия. При значительном дефекте
несостоятельности необходима
реконструктивная операция с формированием
нового гастроеюноанастомоза или
реконструкция по Ру. При возникновении
несостоятельности при резекции по Ру
требуется ререзекция анастомоза с
повторным формированием анастомоза.
Несостоятельность пищеводно-желудочного
или пищеводно-тонкокишечного анастомоза
(после проксимальной резекции
желудка).
Развитие несостоятельности
пищеводно-желудочного или
пищеводно-тонкокишечного анастомозов
нередко приводит к развитию тяжелого
перитонита и смерти больных в
послеоперационом периоде. Наиболее
частой причиной развития несостоятельности
этих анастомозов являются технические
погрешности при наложении анастомозов.
Профилактикой этого осложнения является
симметричное наложение швов анастомоза,
точное сопоставление стенки пищевода
и желудка, особенно слизистой оболочки
и подслизистой основы, формирование
швов без излишнего натяжения при
завязывании швов и сохранение достаточного
кровоснабжения линии анастомоза.
Энтеральное питание следует начинать
только после контрольного рентгенологического
исследования с использованием растворимых
контрастных веществ на 5-7 сутки после
операции. Если при контрольном исследование
отмечается появление контрастна вне
анастомоза, больному продолжается
парентеральное питание в сочетании с
ентеральным питанием через зонд,
заведенным за анастомоз, которое
сочетается с антибактериальной терапией
и динамическим наблюдением за больным
с повторными рентгенологическими
исследовании, УЗИ или КТ. Иногда подобная
тактика сопровождается выздоровлением
больного через 1-2 недели.
Если несостоятельность пищеводно-желудочного
анастомоза с выраженной картиной
развивающегося перитонита больного
необходимо экстренно оперировать.
Наиболее часто в этой ситуации выполняется
санация брюшной полости и адекватное
дренирование зоны анастомоза , целью
которого является создание наружного
свища. Однако нередко подобная тактика
ведет к прогрессированию перитонита,
развитию медиастинита, сепсиса, что
является причиной летального исхода.
В очень редких случаях возможна попытка
резекции абдоминального отдела пищевода
и оставшейся дистальной части желудка
с формированием пищеводно-тонкокишечного
анастомоза, используя для выполнения
этой операции торакоабдоминальный
доступ.
Кроме технических погрешностей при
наложении различных анастомозов причиной
несостоятельности может быть
послеоперационный панкреатит или
формирование абсцесса (как следствие
нагноения гематом из-за неадекватного
гемостаза.).
Несостоятельность энтеро-энтероанастомоза
(* после резекции желудка типа Бальфура)
Нарушение проходимости анастомоза
( после резекции желудка по Бильрот-1,
Бильрот-2 и резекции по Ру).
Наиболее
частой причиной нарушения проходимость
анастомоза яляется развитие анастомозита
и частичной парасимпатической денервацией
культи желудка. Развитие анастомозита
после всехх типов операций сопровождается
нарушением эвакуауцции желудочного
содержимого в 12-ип.к. и тонкую кишку.
Назогастральная декомпрессия поддержание
гомеостаза на фоне парентерального
питания у большинства больных
сопровождается восстановлением
проходимости анастомозов. Однако
длительные нарушения эвакуации из
культи, подтвержденные с помощью с
использованием контрастной рентгенографии
с барием или эндоскопического исследования,
наиболее часто вызваны погрешностями
хирурга при формировании анастомоза.
Иногда нарушения проходимости анастомоза
возникают при необоснованных показаниях
к выполнению резекции желудка по
Бильрот-1 и его сдавлению за счет
формирования воспалительного инфильтрата
в гепатодуоденальной зоне.
Редкой причиной
нарушения эвакуации из культи желудка
после резекции желудка по бильрот -2
является формирование спаек в области
приводящей кишки в области отводящей
кишки ниже анастомоза. В редких случаях
и приводящие и отводящие петли могут
быть вовлечены в спаечный процесс.
Другой причиной нарушения эвакуации
может быть послеоперационный панкреатит
с развитием жирового некроза в области
брыжейки поперечно-ободочной кишки или
развитием оментита , который сдавливает
отводящую петлю тонкой кишки. Формирование
гематом в зоне анастомоза, а также
формирование воспалительного инфильтрата,
вызванного несостоятельности в области
анастомоза также может сопровождаться
нарушением эвакуации их культи.
После резекции
желудка энтеральное питание обычно
начинают с 3-4 дней, однако появление,
тошноты, чувства переполнения и рвоты
требует отмены энтерального питания,
декомпрессии культи желудка, возобновление
парентерального питания и выяснение
причины нарушения эвакуации из культи
( рентгенологическое исследование,
ЭГДС, УЗИ, КТ).
Выявление
механической природы нарушения
проходимости анастомоза иногда может
потребовать эндоскопической дилятации.
При неэффективности консервативных
методов лечения, больному показана
повторная операция , целью которой
является восстановление адекватной
проходимости анастомоза. При непроходимости
анастомоза После резекции по Бильрот-1
возможна реконструкция в Бильрот-2,
однако следует учитывать возможность
развития несостоятельности культи
12.-ип.к Альтернативным вариантом в этой
ситуации является дополнительное
наложение гастроеюноанастомоза на
короткой петле, которое формируется в
области большой кривизны желудка. После
резекции желудка по Бильрот-2, также
выполняют релапаротомию, целью которой
является устранение препятствия в
области отводящей или приводящей петель
анастомоза. Иногда в этих ситуациях
требуется реконструктивная операция,
которая устраняет нарушение проходимости
в области анастомоза или отводящей
петли.
Острый синдром приводящей петли.
Острый синдром приводящей возникает
при формировании чрезмерно длинного
отрезка приводящей петли после резекции
желудка по Бильрот-2. Причиной его может
быть развитие спаек, перекрута,
узлообразование тонкой кишки с участием
культи желудка. Синдром приводящей
петли является предраспологающим
фактором в развитии несостоятельности
дуоденальной культи.
При остром синдроме приводящей петли
желчь, панкреатический секрет накапливается
в кишке и значительно повышает давление
в панкреатическом протоке, что нередко
ведет к развитию п/о панкреатита.
Распознавание последнего осложнения
должно быть осуществлено как можно
раньше.
Клиника его проявляется болью в животе
вне зависимости от физической нагрузки,
появлением признаков интоксикации:
тахикардия, лейкоцитоз, лихорадка, и
нередко появлением симптомов раздражения
брюшины в правом подлдреберье.. Клиническая
картина дополняется возможными
проявлениями острого послеоперационного
панкреатита ( развитие токсического
шока и повышение серологических уровней
амилазы и уровня липаз) . Подозрение на
острый синдром приводящей петли требует
тщательного осбследования больного,
включающего УЗИ и КТ, что позволяет
исключить природу острогот панкреатита.
Подтверждение диагноза острого синдрома
приводящей петли требует экстренного
оперативного вмешательства.
Интраопреационные находки диктуют
тактику лечения.
Если причиной острого синдрома приводящей
петли явилось узлообразование , и кишка
жизнеспособна, наиболее адекватной
операцией в этой ситуации является
декомпрессия приводящей петли за счет
формирования дополнительного межкишечного
анастомоза по Брауну ниже ЖКА. При
сомнении в жизнеспособности петли
кишки, вовлеченной в узлообразование
возможна реконструктивная операция с
формированием Ру- анастомоза,( после
резекции нежизнеспособных участков
кишки и анастомоза) . При сомнении в
нежизнеспособности всех отделов 12-ип.к.
является выполнение панкреатодуоденальной
резекции.
Последствия повреждений поджелудочной
железы и послеоперационная желтуха.
Острый послеоперационный панкреатит.
Острый послеоперационный панкреатит
развивается после резекции желудка у
0,6-6% больных и является очень грозным
осложнением послеоперационного периода.
Наиболее частой причиной панкреатита
является повреждение головки или тела
поджелудочной железы во время операции.
Травматическое повреждение поджелудочной
железы возникает в результате обширного
скелетирования луковицы 12-ип.к. с целью
адекватного формирования культи, или
после мобилизации луковицы на фоне
гигантской язвы задней стенки,
пенетрирующей в поджелудочную железу.
Повреждения поджелудочной железы могут
возникнуть также при мобилизации 12 при
низких постбульбарных язвах. В этой
ситуации возможно повреждение протоков
поджелудочной железы. Клиническая
картина послеоперационного панкреатита
проявляется нередко уже в первые сутки
после оперативного вмешательства. У
больного возникают резкие боли в животе,
которые купируются введением только
наркотических анальгетиков, развиваются
лихорадка, и лейкоцитоз, появляются
симптомы раздражения брюшины и
определяются высокие показатели амилазы
и липазы в сыворотке крови. Дифференциальный
диагноз следует проводить с острым
синдромом приводящей петли. При
проведении дифдиагностики следует
учесть предшествующий острый панкреатит
перед операцией. Целенаправленное
обследование больного необходимо
провести в кратчайшие сроки, используя
УЗИ,КТ, и исследование сыворотки крови
на специфические ферменты. Очевидно,
что после резекции желудка по Бильрот-1
соответствующая клиническая картина
чаще возникает при остром панкреатите.
При уточнении диагноза острого п/о
панкреатита требуется проведение
лечения в реанимации, целью которого
является стабилизация состояния больного
( адекватная легочная вентиляция, лечение
почечной недоставаточности и предупрежение
полиорганной недостаточности,
восстановление сердечной-сосудистой
деятельности, коррекции метаболических
нарушений и предупреждение развития
сепсиса) и возможное предупреждение
развития осложнений панкреатита.
Основные принципы лечения панкреатита
включают полное парентеральное питание
больного, использование препаратов
соматостатина и применение антибиотиков
широкого спектра действия.
Тактика лечения определяется
развитием осложнений острого панкреатита.
Динамику процесса следует оценивать
на основании клиники с использование
факторов Apache
II или
Ranson, маркеров
панкреонекроза (
CPR , PMN-эластазы,
ЛДГ, PLA),
выявление очагов некроза при УЗИ,
спиральной или контрастной компьютерной
томографии. Дальнейшая тактика лечения
определяется развитием осложнений
панкреонекроза.
Послеоперационная Желтуха.
Развитие послеоперационной желтухи
после резекций желудка может быть
вызвано несколькими причинами: 1)
недостаточная санация брюшной полости
от желчи во время операции, 2)
несостоятельность анастомоза и всасывание
желчи брюшиной; 3) острый панкреатит ;
4) последствия повреждения внепеченочных
желчных протоков.
Послеоперационная Желтуха, вызванная
развитием частичной непроходимости
общего желчного протока в результате
острого панкреатита или сдавление
протока инфильтратом на фоне
несостоятельности, разрешается на фоне
лечения этих осложнений. Травматическое
повреждение внепеченочных желчных
протоков, незамеченное во время операции
требует выполнения экстренных оперативных
вмешательств, которые рассмотрены в
разделе интраоперационных осложнений.
Ишемический некроз культи желудка.
Ишемический некроз культи желудка
является довольно редким осложнением
после резекции желудка, но опасным для
жизни пациента. Наиболее вероятно
развитие этого осложнения при перевязке
левой желудочной артерии сразу после
отхождения от чревного ствола и,
дополнительно была выполнена спленэктомия
на фоне ятрогенного повреждения ( при
спленэктомии был перевязан основной
ствол селезеночной артерии перед
отхождением коротких желудочных
артерий). В этой ситуации кровоснабжение
культи желудка зависит от непостоянных
ветвей диафрагмальной артерии.
Клиническая картина
ишемического некроза культи желудка
появление сильная боль в животе
подобная кинжальной боли, которая
возникает в пределах от 24 до 72 часов
после операции. Нередко рентгенологическое
исследование с введением по назогастральному
зонду водорастворимого контраста
диагностирует несостоятельность, что
требует выполнения экстренного
оперативного вмешательства.
При определении жизнеспособной части
культи желудка возможно наложение
анастомоза по Ру. При отсутствии
жизнеспособности необходимо выполнить
гастрэктомию с реконструкцией по Ру.
При распространении некроза на дистальный
отдел пищевода, следует произвести
гастрэктомию с резекцией дистального
отдела пищевода с формированием
эзофагостомы на шее и еюностомы.
Если больной выздоравливает после
операции, в последующем можно произвести
реконструктивную операцию.
Абсцессы брюшной полости.
Причиной абсцессов после резекции
желудка наиболее часто является нагноение
гематом, или скопление инфицированной
жидкости после вскрытия просвета полых
органов. Наиболее частой причиной
является несостоятельность швов
анастомоза. Характерно развитие
подпеченочных и поддиафрагмальных
абсцессов, однако возможно развитие и
межкишечных абсцессов. Поддиафрагмальные
абсцессы по локализации распределяют
по правосторонние, левосторонние и
центральные. Клиническая картина
поддиафрагмальных и подпеченочных
абсцессов развивается на 7-10е сутки
после операции и проявляется возникновением
болей в эпигастрии, левом или правом
подреберье, интоксикацией, лихорадкой
и повышением лейкоцитов в крови со
сдвигом лейкоцитарной формулы влево.
Характерным для поддиафрагмального
абсцесса является некупирующаяся боль
в подреберье и левой половине грудной
клетки, усилением болей при глубоком
дыхании и кашле, а также иррадиацией
болей в надключичную область слева.
Иногда появляются специфические
рентгенологические признаки формирования
абсцесса в поддиафрагмальном пространстве:
высокое стояние купола диафрагмы,
ограничение её подвижности («диафрагманит»),
наличие плеврального выпота, или наличие
горизонтального уровня жидкости с газом
под диафрагмой, не связанного с желудком
или кишкой. Наибольшей диагностической
ценностью обладает УЗИ и КТ. При
подтверждении диагноза поддиафрагмального
абсцесса, не связанного с несостоятельностью
анастомозов необходимо его дренирование
под контролем УЗИ или КТ. Под контролем
УЗИ и КТ возможно также установление
дренажа для постоянной аспирации и
введения антибиотиков и ферментов, что
позволяет в большинстве случаев добиться
излечения. При отсутствии эффекта от
подобного ведения больного показано
операционное вскрытие и дренирование
абсцесса из забрюшинного доступа по
Клермону или Мельникову. Наилучший
эффект достигается при постоянном
промывании гнойника и аспирации
содержимого, желательно назначение
антибиотиков, в соответствии с данными
антибиотикограммы.
Инфаркт сальника.
Инфаркт сальника является достаточно
редким осложнением, которое встречается
на фоне ущемления или сдавления сальника
штрангом во внутренних карманах брюшной
полости или позади анастомоза. Клиника
характеризуется появлением болей в
животе, лихорадкой, лейкоцитозом и
появлением напряжения мышц передней
брюшной стенки. Диагноз может быть
подтвержден УЗИ или КТ. При нарастании
клиники перитонита больному показано
оперативное вмешательство с резекцией
измененного участка сальника.
Гастроилеостомия.
Подобное осложнение встречается в
результате технической ошибки хирурга
или его неопытности, когда желудочно-кишечный
анастомоз формируют с подвздошной
кишкой. Клиника характеризуется
появлением частой диареи с развитием
водно-электролитных расстройств,
сопровождается потерей массы тела и
быстрым истощением больного. Диагноз
подтверждается рентгенологическим
исследованием с водной взвесью
сернокислого бария. При подтверждении
диагноза необходимо повторное оперативное
вмешательство, которое сопровождается
разъединением анастомоза и выполнением
гастроеюностомии по Бильрот-2 или
выполнение реконструкции по Ру.
ОТДАЛЕННЫЕ РЕЗУЛЬТАТЫ
ОПЕРАТИВНЫХ ВМЕШАТЕЛЬСТВ НА ЖЕЛУДКЕ У
БОЛЬНЫХ С ОСЛОЖНЕННЫМИ ПЕПТИЧЕСКИМИ
ЯЗВАМИ ЖЕЛУДКА.
Результаты после резекций желудка и
вариантов ПЖВ
Оперативные вмешательства на желудке
у больных с пептическими язвами
сопровождаются изменением функции
желудка, изменением анатомических
взаимоотношений желудка с тонкой кишкой,
что нередко сопровождается расстройствами
функций пищеварительной системы.
В настоящее время
рассматривается возможность влияния
на частоту рецидивов язв после различных
вариантов ваготомии Helicoгеликобактер
пилори в желудке и на 12-и п.к. Патогенетическое
значение Н.р в возникновении пептических
язв желудка и 12-и п.к. не вызывает
сомнения. Возможно, что эрадикация Н.Р.
будет сопровождаться более эффективным
лечением рецидивных пептических язв в
желудке и 12-ип.к.
При продолжающихся рецидивах и появлении
осложнений возникают показания к
хирургическому вмешательству. Выбор
метода операции определяется типом
ваготомии , характером дренирующей
операции, и возможной причиной рецидива
( неполная и неадекватная ваготомия,
нарушения эвакуации из желудка).
У больных с неадекватной ваготомией
наиболее часто выполняется реваготомия
в сочетании с антрумэктомией.
У больных с развитием нарушения эвакуации
из желудка реваготомию необходимо
сочетать с более расширенной резекцией
желудка.
У больных с рецидивной язвой, осложненной
кровотечением или перфорацией, учитывая
состояние, распространенность и характер
перитонита следует выполнять паллиативные
вмешательства, направленные на спасение
жизни пациента или, при возможности
выполнения радикальной операции,
показана реваготомия с антрумэктомией.
При наличии рецидивной язвы желудка
после различных вариантов ваготомии
операцией выбора является гемигастрэктомия
с иссечением язвы.
Рецидив язвы после резекций желудка.
Рецидив язвы после резекции желудка
возможен после Бильрот-1 , Бильрот-2, или
резекции по Ру.
Частота рецидивных пептических язв
после резекций желудка составляет
0,5-10% . Наиболее часто пептические язвы
образуются после резекции желудка,
выполненной по поводу язвенной болезни
12-и п.к. Язва может локализоваться в
культе желудка, в области анастомоза,
или в отводящей петле. Наиболее частыми
причинами рецидивной пептической язвы
после резекции желудка являются: 1)
экономная резекция желудка у больных
с язвенной болезнью 12-ип.к., 2). оставление
части слизистой оболочки антрального
отдела в культе 12-ип.к. после резекции
по Бильрот-2, 3) не выявленные при первичной
операции синдром Золлингера-Эллисона,
синдром эндокринной гиперплазии-1, или
первичный гиперпаратиреоидизм.
Диагноз рецидивной пептической язвы
ставится на основании клинической
картины, данных рентгенологического
исследования и ЭГДС. Уточнение возможности
оставления слизистой антрального отдела
в культе 12-ип.к. возможно при проведении
сканирования после в/в введения Технеция
99М.
Диагностика синдрома Золлингера-Эллисона,
синдрома эндокринной неоплазии-1 подробно
рассматривалась выше. Консервативное
лечение пептических рецидивных язв
после резекции желудка нередко является
неэффективным, несмотря на использование
блокаторов протонной помпы длительной
поддерживающей терапии. Нередко
рецидивные язвы после резекции желудка
осложняются кровотечением, перфорацией
и формированием желудочно-толстокишечного
свища. При возникновении показаний к
хирургическому вмешательству операцией
выбора является трансторакальная
ваготомия, или ваготомия с ререзекцией
желудка .
Желудочно-тоще-толстокишечный свищ.
Наиболее часто причиной формирования
желудочно-тоще-толстокишечного свища
яавляется пептическая язва анастомоза
или отводящей пеьли с пенетрацией в
толстую кишку, после чего формируется
свищ. Клиническая картина характеризуется
появлением неприятного запаха изо рта,
фекальной рвотой, диарреей и потерей
массы тела. Нередко свищи сочетаются с
другими осложнениями пептической язвы
( кровотечение, перфорация, стеноз)
Диагноз можно подтвердить рентгеноконтрастным
исследованием с барием, ЭГДС, с помощью
компьютерной томографии и колоноскопией.
Дифдиагноз необходимо проводить между
раком культи желудка или болезнью Крона.
При уточнении диагноза больному показано
полное парентеральное питание,
антибиотикотерапия, декомпресия
толстой кишки, и применение блокаторов
протонной помпы. По-существу, консервативное
лечение является подготовкой к
оперативному вмешательству. Перед
операцией стоит обратить внимание на
подготовку толстой кишки. Операция
включает реваготомию, ререзекцию культи
в сочетании с резекцией толстой кишки.
Операция может быть завершена
реконструкцией по Ру.