Ошибается ли МРТ
Наверное, такой вопрос задает себе каждый, кто проходит это современное диагностическое исследование. Ведь это МРТ-аппарат показывает во всех подробностях то, что происходит в нашем организме! Так может ли диагноз МРТ быть неправильным?
Чтобы ответить на этот вопрос, нужно сначала понять, что такое МРТ – магнитно-резонансная томография. Это исследование, с помощью которого врач получает послойные изображения человеческого тела – нужный орган представляется в виде множества срезов, направленных в разных плоскостях. После того, как исследование выполнено, эти изображения поступают на компьютер к врачу. Изображения здорового органа отличаются от изображений патологически измененного органа.
Но делает ли сам аппарат МРТ выводы из полученных изображений? Различает ли сама аппаратура нормальные и больные органы? Конечно же, нет! Магнитно-резонансный томограф, даже самый дорогой и современный – это всего лишь инструмент для получения снимков. А эти снимки должны быть уже проанализированы, расшифрованы врачом! И только врач, его глаза и его мозг, способны сделать правильное заключение о том, в порядке ли ваши органы, и какие именно изменения в них произошли.
Диагностические ошибки при МРТ
И здесь появляется самый главный вопрос: обладает ли врач достаточной квалификацией для того, чтобы правильно расшифровать МРТ? Ведь это далеко не просто, и диплом мединститута еще не означает, что врач хорошо подготовлен. Ведь нужно знать множество специальных вещей – анатомию человека (как органы выглядят в разрезе?), принципы патологической анатомии (как изменяются органы при той или иной болезни?), принципы получения лучевых симптомов болезни (как тот или иной процесс в больном органе влияет на изменения МРТ-картины?), лучевую семиотику заболевания (какими признаками на МРТ обладает именно эта болезнь?), а также основы клинической диагностики!
Поэтому ответ на вопрос может быть один: МРТ ошибаться не может, может ошибаться только врач, анализирующий снимки МРТ. А отсюда вывод: правильная расшифровка МРТ, КТ, рентгена или маммографии – это залог верно поставленного диагноза!
Иногда происходит так, что человек прошел качественное МРТ-исследование, но его снимки расшифровал не очень квалифицированный рентгенолог. Какие бывают типичные ошибки рентгенолога при расшифровке МРТ?
1) Перепутать разные состояния, поставить неправильный диагноз
2) Не увидеть патологические изменения на снимках, пропустить заболевание
3) Наоборот, спутать нормальную МРТ-картину с патологической и сделать заключение о болезни, которой на самом деле нет
4) Неправильно трактовать стадию болезни (например, поставить не ту стадию рака)
Может ли обычный человек быть застрахован от всех этих ошибок? Конечно же, нет. Даже хорошие специалисты иногда делают ошибки!
Как часто бывают ошибки в описании МРТ?
Статистика показывает, что даже в странах с хорошо развитой медициной более 34% первичных диагнозов ставится ошибочно.
Типичные ошибки в расшифровке МРТ головного мозга
Типичные ошибки в расшифровке МРТ коленного сустава
Что делать в такой ситуации? В развитых странах давно существуют службы Второго мнения, когда результаты исследований можно отправить на пересмотр опытному специалисту. Повторная расшифровка МРТ, КТ, маммографии или ПЭТ-КТ осуществляется узкоспециализированным рентгенологом (радиологом), что помогает поставить более точный диагноз и разобраться в сложных медицинских случаях.
В России также существуют сервисы Второго мнения по КТ, МРТ и ПЭТ. С помощью них вы можете проконсультировать свои снимки КТ, МРТ, маммографии или ПЭТ. Исследование отправится в крупный профильный центр Москвы или Санкт-Петербурга к высокопрофессиональному диагносту — кандидату или доктору наук, который специализируется именно на вашем виде обследования. Такая консультация поможет избежать врачебных ошибок, сделает диагноз более точным, и даст лечащим врачам более полную информацию о вашем состоянии.
Читать подробнее о Втором мнении по КТ и МРТ
Читать подробнее о телемедицине
Может ли КТ ошибаться в диагнозе?
Кандидат медицинских наук, член Европейского общества радиологов
Может ли МРТ дать ошибочные результаты?
МРТ (магнитно-резонансная томография) — метод диагностики с высокой точностью. В результате обследования врач получает снимки, на которых видны многочисленные срезы исследуемого органа, направленные в плоскостях. После завершения процедуры на специальном оборудовании, все полученные изображения появляются на компьютере. Может ли МРТ ошибаться в диагнозе? Это зависти от ряда факторов. Все, начиная с подготовки к процедуре и заканчивая заключением врача, имеет прямое отношение к точной постановке диагноза.
Как часто возникают ошибки
Точность результатов МРТ-исследований зависит от томографов: от силы напряжения магнитного поля и мощности градиентов. Чем они будут выше, тем качественнее будет обследование. Старые томографы выдают меньшее количество снимков, они отличаются низким качеством.
Точность МРТ составляет 98%. Ошибки на стадии диагностики составляют 34% от всех первичных диагнозов (то есть каждый третий диагноз – неверный).
Статистика утверждает, что МРТ является точным методом. После сканирования необходимого органа доктор получает полную информацию о состоянии мышечной ткани, сосудов, костей, лимфатических узлов. Аппарат для проведения МРТ диагностики не делает никаких выводов о состоянии пациента, не анализирует изображения, не определяет болезнь органа. Томограф – инструмент для трансляции снимков на компьютер врача. После обследования специалист ставит пациенту диагноз.
Причины постановки неверного диагноза
Если пациент неправильно лег в аппарат, могут быть ошибочные снимки. Перед процедурой врач обязан проверить положение человека и правильно выбрать область томографирования. К примеру, смещение подголовника вследствие неверной укладки пациента, дает ошибки в интерпретации томограммы головного мозга. Правильная укладка пациента возможна под контролем трех оптических центраторов, а не только по одному боковому.
Появление артефактов на изображениях – дополнительная проблема. Артефакты – это погрешности, которые допускает доктор в процессе исследования, они способны ухудшить качество снимков. Большая часть артефактов не приводят к ошибкам в чтении результатов. Однако иногда они могут копировать патологические состояния. К подобным артефактам можно отнести:
- артефакты от движения;
- магнитной восприимчивости;
- усечения;
- химического сдвига;
- наложения.
Неправильный выбор методики проведения обследования
Для диагностики серьезных заболеваний, нельзя проводить МРТ без контрастирования. Процедура для диагностирования онкологических заболеваний без контрастирования не сможет указать очаги расположения метастазов, размер и структуру маленькой опухоли. МРТ с контрастированием позволит увидеть мельчайшие метастазы, которые при обычной диагностике не заметны, и поставить более точный диагноз.
Нарушения при подготовке и проведении исследования со стороны пациента
Если планируется МРТ кишечника и органов брюшины, за несколько часов до этого пациент должен отказаться от твердой пищи. Важное условие в момент процедуры – полнейшая неподвижность человека. Ведь самое незначительное движение смазывает изображение, оно уже не будет достоверным. Так как исследование может занимать достаточно долгое время (от 20 до 60 минут), то лучше всего предварительно опустошить кишечник и мочевой пузырь. Маленьким детям нужно выпить седативные лекарства.
Из одежды желательны натуральные ткани. С себя нужно снять посторонние предметы – часы, цепочки. Рентгенолог обязательно узнает о наличии зубных металлических протезов, имплантатов, содержащих металл, кардиостимуляторов, внутриматочных спиралей. Нельзя проходить процедуру при беременности (первый триместр – прямое противопоказание). При наличии татуировок возможен ожог тела. Для пациентов с массой тела более 110 кг диагностика не проводится.
Низкая квалификация специалиста рентгенолога
Значительная часть допущения ошибок возникает на этапе чтения результатов МРТ. Это вопрос компетентности и квалификации врачей радиологов. Чтобы проводить обследование и правильно интерпретировать результаты, важно знать информацию о заболеваниях и диагнозах.
От врача требуются знания:
- Анатомии и патологии. Ведь на срезе можно за патологию принять просто особенность строения органа.
- Правила получения лучевых признаков заболевания. Как процессы в органе влияют на МРТ.
- Симптоматика лучевых заболеваний. По каким признакам на МРТ определяют заболевание.
- Клиническая диагностика.
Бывает так, что пациент прошел исследование на новейшем оборудовании, но врач не сумел правильно и качественно интерпретировать снимки. К частым ошибкам специалиста по чтению МРТ относят:
- Неправильно диагностировать заболевание, перепутав состояния;
- Неверно определить конкретно стадию заболевания;
- Пропустить болезнь, не заметив патологических изменений на срезах;
- Перепутать норму с патологией, диагностировав заболевание, которого нет.
Что делать, если вы сомневаетесь в результате
Пациенты после МРТ-исследования обращаются за консультацией врачей радиологов или других узких специалистов, по чьей направленности проводилась процедура. На данном этапе врач сможет детально вникнуть в проблему, учитывая сведения о пациенте: результаты МРТ-исследования, необходимые анализы, выводы из изучения анамнеза. Только это позволит определить причину патологических изменений.
Сомневающимся пациентам результаты исследований можно отправить на расшифровку другому специалисту. Второе мнение для пациентов необходимо в том случае, если есть сомнения в правильности имеющегося описания или оно вовсе было утеряно. Второе мнение – это своего рода независимая экспертиза от другого врача лучевой терапии.
Подведение итогов
МРТ не может ошибаться в постановке диагноза. Определяет заболевание лечащий врач по снимкам с аппарата. Нужно выбирать специалиста с большим опытом в чтении снимков МРТ. Также неверный процесс процедуры может повлиять на точность диагноза для пациента.
Источник: diagme.ru
- Введение
- Причина 1: недостаточно мощный аппарат
- Причина 2: низкая квалификация врача
- Причина 3: беспокойное поведение пациента
- Причина 4: неправильная доза контрастирующего вещества
- Комментарии
МРТ-диагностика — это информативная методика обследования мягких тканей и внутренних органов. Достаточной эффективностью она обладает только в том случае, если выполняются требования к технологии проведения, выбору аппарата для процедуры. В противном случае снимки будут недостаточно качественными. В крайних случаях от томографии вообще не будет толку. Что же может помешать обследованию?
Причина 1: недостаточно мощный аппарат
Томографы делятся на три категории по интенсивности магнитного поля:
- Низкопольные. До 1 Тл. Используются для визуализации структур от 0.5-0.7 см в диаметре.
- Высокопольные. От 1 до 1.5 Тл. Основной класс аппаратов. Применяется для обследования в большинстве случаев.
- Сверхмощное оборудование. До 3 Тл. Применяется в крайних случаях, при обследовании тканей головного мозга и реже внутренних органов.
Если аппарат недостаточно мощный, снимки будут некачественными, смазанными. Сделать выводы не удастся.
Причина 2: низкая квалификация врача
Недостаточный уровень специалиста-рентгенолога сказывается двойственным образом:
- С одной стороны врач может ошибиться в выборе режима сканирования, не прибегнуть ко всем возможностям аппарата.
- С другой — вероятны ошибки в расшифровке результатов диагностики.
Интерпретации информации со снимков. В обоих случаях возникает путаница: данных мало, а то и вовсе они ложные.
Причина 3: беспокойное поведение пациента
Во время МРТ пациент должен лежать неподвижно, по возможности не шевелиться вообще. Все движения провоцируют т.н. артефакты на снимках. Помехи, визуальный шум. Они смазывают картинку, снижают информативность обследования. В наиболее неблагоприятных случаях диагностику придется проводить повторно.
Причина 4: неправильная доза контрастирующего вещества
Если назначена МРТ с контрастным усилением, доза агента подбирается исходя из веса пациента. Недостаточное количество контраста сделает снимки неинформативными. Четкость и яркость постконтрастного изображения будет недостаточной.
Если исключить все возможные факторы-помехи, информативность МРТ будет достаточной для постановки или подтверждения диагноза. В силах пациента выбрать клинику, оценить профессионализм специалиста, соблюдать инструкции врача во время процедуры. При ответственном подходе вероятность погрешностей минимальна.
Лицензии
Pitfalls in Interpreting mp-MRI of the Prostate: A Pictorial Review with Pathologic Correlation
V Panebianco et al.
Insights Imaging.
2015 Dec.
Free PMC article
Abstract
Objectives:
The purpose of this pictorial review is to present a wide spectrum of prostate multiparametric MRI (mp-MRI) pitfalls that may occur in clinical practice, with radiological and pathological correlation.
Methods:
All examinations were performed according to ESUR Guidelines protocols.
Results and conclusion:
mp-MRI imaging of the prostate often leads to interpreting doubts and misdiagnosis due to the many interpretative pitfalls that a tissue, whether healthy or treated, may cause. These «false-positive» findings may occur in each stage of the disease history, from the primary diagnosis and staging, to the post-treatment stage, and whether they are caused by the tissue itself or are iatrogenic, their recognition is critical for proper treatment and management. Knowledge of these known pitfalls and their interpretation in the anatomical-radiological context can help radiologists avoid misdiagnosis and consequently mistreatment.
Main messages:
• Some physiological changes in the peripheral and central zone may simulate prostate cancer. • Technical errors, such as mispositioned endorectal coils, can affect the mp-MRI interpretation. • Physiological changes post-treatment can simulate recurrence.
Keywords:
Differential diagnosis; Pitfalls; Prostate; Prostate MRI; mp-MRI.
Figures
A 74-year-old man with PCa at the apex and bilateral basal hypointense nodular zones (moustache sign) (white arrows). a Axial T2-weighted fast spin-echo image (4564/110). b axial T2-weighted fat saturated fast spin-echo image (4941/116) and c coronal T2-weighted fast spin-echo image (5059/120) showing symmetric, bilateral, well-defined homogeneous hypointense zones at the base of the prostate gland. d Axial perfusion gradient-echo T1-weighted, e gradient-echo T1-weighted subtracted image and f colour DCE (dynamic contrast enhance) MR map displaying mild enhancement of the hypointense zones. g Axial DWI image with b value = 1000, h 3000 mm2/sec, and i ADC map showing restricted diffusion phenomena of water molecules in the hypointense basal sites detected on T2-weighted images. According to the PIRADSv2 scoring system, the score for T2, DCE and DWI is, respectively: 3, + and 4; the overall score is 4, which means highly clinically significant cancer is likely to be present. i Photomicrograph from a prostatectomy specimen shows the compression exerted by BPH on the central zone, bilaterally (black arrows) a Axial T2-weighted fast spin-echo image (5525/110) and b axial T2-weighted fat saturated fast spin-echo image (4941/116) showing a hypointense zone at the mid-peripheral gland in the median posterior location. c Axial perfusion, gradient-echo T1-weighted, d gradient-echo T1-weighted subtracted image and e colour DCE MR map displaying mild enhancement of the hypointense zone. f Axial DWI image with b value = 1000 and g 3000 mm2/sec and h ADC map showing restricted diffusion phenomena of water molecules in the hypointense focus detected on T2-weighted images (white arrows). According to the PIRADSv2 scoring system, the score for T2, DCE and DWI is, respectively: 3, + and 4; the overall score is 4, which means highly clinically significant cancer is likely to be present. i Photomicrograph shows the area in the posterior middle third of the gland (black arrows) Median posterior hypointense area at the middle third of the gland with no ERC. a Axial T2-weighted fast spin-echo image and b axial Fat Saturated T2-weighted showing an ill-defined hypointense median area at the middle third of the gland. c ADC map showing mild restriction of water molecules diffusivity in the hypointense focus detected on T2-weighted images. d Axial perfusion gradient-echo T1-weighted, and e colour DCE MR map showing mild enhancement of the hypointense zone a Axial T2-weighted fast spin-echo image (5525/110). b Axial DWI image with b value = 1000. c ADC map showing mild restricted diffusion phenomena of water molecules in the hypointense focus detected on T2-weighted images (white arrows).d gradient-echo T1-weighted subtracted image and e colour DCE MR map displaying mild enhancement of the stromal nodule. According to the PIRADSv2 scoring system, the score for T2, DCE and DWI is, respectively: 2, − and 3; the overall score is 3, which means the presence of clinically significant cancer is equivocal. f Photomicrograph (50×) showing the BPH stromal nodule Ectopic stromal BPH nodule in the right peripheral zone (white arrows). a Axial T2-weighted fast spin-echo image (5045/110), b axial T2-weighted fat saturated fast spin-echo image (45461/116) and c coronal T2-weighted fast spin-echo image (5565/120) showing a round sharply defined nodule of low signal intensity surrounded by a pseudocapsule in the peripheral zone of the prostate at the right peri-apical location. d Axial DWI image with b value = 1000 mm2/sec and e = 3000 mm2/sec, and f ADC map showing remarkable diffusion restricted phenomena. g Axial perfusion gradient-echo T1-weighted and h gradient-echo T1-weighted subtracted image showing avid enhancement of the nodule. According to the PIRADSv2 scoring system, the score for T2, DCE and DWI is, respectively: 4, + and 3; the overall score is 3, which means the presence of clinically significant cancer is equivocal. i Pathologic correlation after prostatectomy yielded BPH (black arrows) Ectopic nodule in the right peripheral zone with no ERC. a Axial T2-weighted fast spin-echo image showing an hypointense well circumscribed nodule in right peripheral zone with an evident peripheral capsule. b ADC map and c axial DWI image with b value = 3000 mm2/sec, showing no significant restriction of water diffusivity. d Axial perfusion gradient-echo T1-weighted image shows marked and early enhancement simultaneous to other nodule constituents of the adenoma a Coronal T2-weighted fast spin-echo image (5525/110) and b Axial T2-weighted fast spin-echo image (5525/110) showing diffuse peripheral hypointensity in a patient who underwent intravesical instillation of BCG (white arrows). c ADC map showing high restricted diffusion phenomena of water molecules in the hypointense posterior area detected on T2-weighted images. d Axial DWI image with b value = 1000 and e gradient-echo T1-weighted subtracted image show slight enhancement of the area. f Histological picture shows diffuse granulomatous inflammation with multinucleated giant cells adjacent to a prostatic gland, (100×, H&E) (black arrow) Hypertrophic anterior fibromuscular stroma (white arrows). a Axial T2-weighted fast spin-echo image (5045/110), b coronal T2-weighted fast spin-echo image (5565/120) showing hypertrophic area of low signal intensity between the small transition zone lobes. c Axial DWI image with b value = 1000 mm2/sec and d ADC map showing no diffusion restricted phenomena. e Axial perfusion gradient-echo T1-weighted subtracted image showing late mild enhancement of the zone. According to the PIRADSv2 scoring system the score for T2, DCE and DWI is, respectively: 4/5, − and 2; the overall score is 4 (based on dominant sequence), which means the presence of clinically significant cancer is likely to be present Prominent peri-prostatic bundle with no ERC. a Axial T2-weighted fast spin-echo image showing an ill-defined hypointense area in posterior left peripheral zone, suspected for cancer. b Axial DWI image with b value = 3000 mm2/sec, and c ADC map image showing no areas of significant restriction of water diffusivity. d Axial perfusion gradient-echo T1-weighted image, and e colour DCE MR map showing no enhancing areas in left peripheral zone with and enhancing neuro-vascular bundles adherent to the glandular profile. According to he PIRADSv2 scoring system, the score for T2, DCE and DWI is, respectively: 2, + and 4; the overall score is 4 (based on dominant sequence), which means that the presence of clinically significant cancer is equivocal a Axial post-contrast T1-weighted fat saturated 3D FLASH (VIBE) axial image showing a small enhancing area in the right ischiopubic ramus. b Axial T2-weighted fast spin-echo (6330/115) and d coronal T2-weighted (5230/114) images display a small round hypointense area, which appears slightly hyperintense (white arrows) on c axial T2-weighted fat saturated image (8450/115). e Bone scan showing uptake of radiotracer in the right ischiopubic ramus. All these findings are consistent with bone metastasis. In addition, the reference standard was the drop of PSA value after hormonotherapy (from 18 ng/mL to 4.5 ng/mL) a Post-contrast T1-weighted fat saturated 3D FLASH (VIBE) axial image and b coronal T1-VIBE reconstructed image showing a small enhancing focus in the left iliac bone. c No bone alterations detected in the corresponding site on coronal T2-weighted fast spin-echo image (7940/112) (white arrows). d No areas with uptake of radiotracer are displayed at bone scan. These findings exclude the hypothesis of bone metastasis a Axial post-contrast T1-weighted fat saturated 3D FLASH (VIBE) axial image showing a round, well-defined hypervascular lesion in the right femoral head (white arrows). b Axial T2-weighted fast spin-echo (6200/112), c coronal T2-weighted (4110/112) and d axial T2-weighted, fat saturated spin-echo (8300/112) images display a round, lobulated, markedly hyperintense lesion surrounded by a sclerotic rim. These findings are consistent with enchondroma MR images of a 64-year-old man with prostate-specific antigen progression (PSA serum level 0.75 ng/mL) after radical retropubic prostatectomy, with suspected local recurrence. a Axial T2-weighted fast spin-echo (6200/112), b axial T2-weighted fat saturated fast spin-echo (8300/112) and c sagittal T2-weighted fast spin-echo (4640/112) show a solid tissue on posterior perianastomotic location in front of the rectal wall at about 40 mm from the ureteral meatus, which is slightly hyperintense compared to pelvic muscles (white arrows). d Axial Gradient-echo T1-weighted image and e Gradient-echo T1-weighted subtracted image showing a remarkable enhancement of the pathological tissue f Axial ADC map reconstructed from images obtained at b values of 0, 500 and 1000 s/mm show a dark area corresponding to the abnormal hyperintense tissue seen on T2-weighted images (black arrow). All these findings are consistent with local recurrence MR images of a 69-year-old man with prostate-specific antigen progression (PSA serum level 1.06 ng/mL) after radical retropubic prostatectomy, with suspected local recurrence. a Axial T2-weighted fast spin-echo (5525/109) and b axial T2-weighted fat saturated fast spin-echo image (5981/116) show a solid tissue on posterior perianastomotic location in front of the rectal wall at about 33 mm from the ureteral meatus which is hyperintense compared to pelvic muscles (white arrows). c Axial gradient-echo T1-weighted, d gradient-echo T1-weighted subtracted image and e DCE MR colour map showing a positive contrast enhancement of the abnormal tissue. f Diffusion weighted images with a b value of 1.000,g 3.000 s/mm2 and h ADC map show no diffusion restricted phenomena, consistent with residual glandular tissue MR images of a 64-year-old man with prostate-specific antigen progression (PSA serum level 0.9 ng/mL) after radical retropubic prostatectomy, with suspected local recurrence. a Axial T2-weighted fast spin-echo image shows, on the zone of right seminal vesicle, a nodular tissue (white arrows) with signal intensity similar to that of muscle. b Axial gradient-echo T1-weighted subtracted image shows no signs of enhancement on the same location as the solid nodular tissue seen on trasverse T2-weighted images. c Diffusion weighted images with a b value of 1.000 and d 3.000 s/mm2 and e ADC map show no diffusion restricted phenomena on corresponding site. These findings are consistent with seminal vesicle remnants with fibrotic evolution MR images of a 63-year-old man with prostate-specific antigen progression (PSA serum level 1.9 ng/mL) after radical retropubic prostatectomy. a Axial T2-weighted fast spin-echo (6006/109) and b axial T2-weighted fat saturated fast spin-echo image showing residual glandular tissue. c Axial T2-weighted fast spin echo (6006/109) and d sagittal T2-weighted fast spin echo (5059/120) showing retained seminal vesicles, which appear as high signal intensity tubular structures (white arrows) MR images of a 61-year-old man with prostate-specific antigen progression (PSA serum level 0.62 ng/mL) after radical retropubic prostatectomy, with suspected local recurrence. a Axial T2-weighted fast spin-echo (5170/112), b axial T2-weighted fat saturated fast spin-echo (6920/112) and c sagittal T2-weighted fast spin-echo (4730/114) image showing a hyperintense lobulated tissue on anterior perianastomotic location posterior to the pubic symphysis d Axial perfusion Gradient-echo T1-weighted subtracted image showing no signs of enhancement of the suspicious pathological tissue. e Diffusion-weighted images with a b value of 1.000, f 3.000 s/mm2 and g ADC map show no diffusion restricted phenomena. The hyperintese lobulated tissue detected in T2-weighted images represents a prominent sealed off venous plexus (white arrows) a Axial T2-weighted fast spin-echo (6330/115) and b axial T2-weighted fat saturated fast spin-echo image (8450/115) show, on the zone previously occupied by the right seminal vesicle, a slightly hyperintense lobulated tissue. c Gradient-echo T1-weighted subtracted image shows a well-defined area of marked enhancement (arrows) on the same location as the lobulated tissue seen on T2-weighted images. d Diffusion weighted image with a b value of 1.000 and e 3.000 s/mm2 and f the ADC map show no restricted diffusion signs. These findings are consistent with prominent periprostatic venous plexus (white arrows) MR images of a 68-year-old man with prostate-specific antigen progression (PSA serum level 0.67 ng/mL) after radical retropubic prostatectomy, with suspected local recurrence. a Axial T2-weighted fast spin-echo (6567/111) and b axial T2-weighted fast spin-echo fat saturated (7216/118) show on the zone previously occupied by the proximal portion of right seminal vesicle, a hyperintense nodular tissue (arrow). c Gradient-echo T1-weighted subtracted image and d colour DCE map shows a well-defined area of marked enhancement (arrow) on the same location as the solid nodular tissue seen on T2-weighted images. e Diffusion weighted images with a b value of 3.000 s/mm2 and f ADC map show a focal area of restricted diffusion (arrow) corresponding to the solid nodular tissue detected on T2-weighted images and the enhancing zone seen on dynamic contrast-enhancing images. These findings are consistent with local recurrence (white arrows) Hypertrophic verumontanum of a 66-year-old man with prostate-specific antigen progression (PSA serum level 0.75 ng/mL) after radical retropubic prostatectomy. a Axial T2-weighted fast spin-echo (6330/115), b axial T2-weighted fat saturated fast spin-echo image (8450/115) and c sagittal T2-weighted fast spin-echo (5000/114) show a small tissue at the bladder neck location, which is slightly hyperintense compared to pelvic muscles (arrow). d Axial Gradient-echo T1-weighted subtracted image showing no signs of enhancement of the suspicious pathological tissue detected on T2-weighted images. e Axial ADC map reconstructed from images obtained at b values of 0, 500 and 1000 s/mm2 show a bright area corresponding to the abnormal hyperintense tissue seen on T2-weighted images, which is a finding suggestive for the absence of restricted diffusion phenomena. f Photomicrograph from biopsy specimen showing verumontanum Post-RT treatment. a Axial T2-weighted fast spin-echo image showing an area of intermediate signal intensity in the peripheral posterior left portion of the gland after 3 months post-RT treatment suspected for recurrence. b Axial perfusion gradient-echo T1-weighted image shows mild enhancement in the suspected area. c ADC map and d axial DWI image with b value 1000 mm2/sec showing no areas of suspected restriction of water diffusivity. e colour DCE MR map showing marked enhancement in posterior left peripheral zone, corresponding to post-RT outcomes Post-HIFU treatment. a Axial T2-weighted fast spin-echo image showing an area of intermediate signal intensity in the anterior left portion of the gland after 3 months post-HIFU treatment, suspected for recurrence. b Axial perfusion gradient-echo T1-weighted image shows no significant enhancement in the suspected area. c Axial DWI image with b value 1000 mm2/sec, showing a higher hyperintense area in the anterior left portion of the prostate, d ADC map image showing no areas of significant restriction of water diffusivity, corresponding with post-HIFU treatment outcomes Post-MRgFUS treatment. a Pre-treatment axial T2-weighted fast spin-echo image and b post-contrast subtracted image showing a focal lesion on the postero-lateral aspect of the left third mid-gland with enhancement consistent with prostate cancer. c Post-treatment axial T1-weighted post-contrast subtracted image showing ablation of the area. d ADC map 6 months after MRgFUS treatment showing a focal zone of restricted diffusion suspected for local recurrence. e Post-contrast subtracted image showing no focus of contast enhancement. These findings are consistent with post-MrgFUS treatment fibrotic tissue Mispositioned endorectal coil. a ADC map (DWI acquired with b value = 1000 mm2/sec and b 3000 mm2/sec) showing focal low signal intensity on the left side of the apex. b Gradient-echo T1-weighted subtracted image showing at the same site strong focal enhancement. According to the PIRADS v2 scoring system, the score for DWI and DCE is, respectively, 4 and +, which means highly clinically significant cancer is likely to be present. c Axial T2-weighted fast spin-echo image (6006/110) display no differences in signal intensity between left and right postero-lateral aspect, and it represents the decisive sequence confirming the mispositioned endorectal coil Post-biopsy haemorrhage in the midgland of a 69-year-old man with a PSA serum level of 4.7 ng/mL. a Axial T2-weighted fast spin-echo image (5525/109) and b axial fat saturated T2-weighted fast spin-echo image (5981/116) showing a large hypointense zone involving the left posterior site of the midgland and a smaller zone of low signal intensity in the contralateral side (white arrows). c The first axial perfusion gradient-echo T1-weighted image acquired before the injection of contrast medium displays diffuse high signal intensity in the midgland representing recent post-biopsy haemorrhage. d Gradient-echo T1-weighted subtracted image and e colour DCE MR map showing a real hypervascular zone in the left midgland, which appear smaller in size than in a, b and c. f Axial DWI image with b value = 1000 mm2/sec and g 3000 mm2/sec, and h ADC map showing mild diffusion restricted phenomena in the left posterior aspect of the midperipheral zone. Pathologic correlation after prostatectomy yielded prostate adenocarcinoma, with a Gleason score of 6 in left midland MR images of a 64-year-old man with prostate-specific antigen progression (PSA serum level 0.62 ng/mL) after radical retropubic prostatectomy, with suspected local recurrence. a Axial T2-weighted fast spin-echo (6200/112), b axial T2-weighted fat saturated fast spin-echo (8300/112) and c coronal T2-weighted fast spin-echo (4110/114) image showing a unilocular, thin walled hyperintense cystic-like mass at the obturator lymph nodes location. d Axial post-contrast T1-weighted fat saturated 3D FLASH (VIBE) image showing no signs of enhancement of the cystic mass. e Axial ADC map reconstructed from images obtained at b values of 0, 500 and 1000 s/mm2 show a bright area corresponding to the cystic mass seen on T2-weighted images. These findings are consistent with lymphocele (white arrows)
Fig. 1
Fig. 2
Fig. 3
Fig. 4
Fig. 5
Fig. 6
Fig. 7
Fig. 8
Fig. 9
Fig. 10
Fig. 11
Fig. 12
Fig. 13
Fig. 14
Fig. 15
Fig. 16
Fig. 17
Fig. 18
Fig. 19
Fig. 20
Fig. 21
Fig. 22
Fig. 23
Fig. 24
Fig. 25
Fig. 26
Similar articles
-
Multiparametric MRI in detection and staging of prostate cancer.
Boesen L.
Boesen L.
Dan Med J. 2017 Feb;64(2):B5327.
Dan Med J. 2017.PMID: 28157066
Review.
-
Prostate magnetic resonance imaging for brachytherapists: Diagnosis, imaging pitfalls, and post-therapy assessment.
Venkatesan AM, Stafford RJ, Duran C, Soni PD, Berlin A, McLaughlin PW.
Venkatesan AM, et al.
Brachytherapy. 2017 Jul-Aug;16(4):688-697. doi: 10.1016/j.brachy.2016.12.012. Epub 2017 Jan 27.
Brachytherapy. 2017.PMID: 28139419
Review.
-
Multiparametric-MRI in diagnosis of prostate cancer.
Ghai S, Haider MA.
Ghai S, et al.
Indian J Urol. 2015 Jul-Sep;31(3):194-201. doi: 10.4103/0970-1591.159606.
Indian J Urol. 2015.PMID: 26166962
Free PMC article.Review.
-
Multiparametric magnetic resonance imaging localizes established extracapsular extension of prostate cancer.
Feng TS, Sharif-Afshar AR, Smith SC, Miller J, Nguyen C, Li Q, Luthringer D, Li D, Saouaf R, Kim HL.
Feng TS, et al.
Urol Oncol. 2015 Mar;33(3):109.e15-22. doi: 10.1016/j.urolonc.2014.11.007. Epub 2014 Dec 12.
Urol Oncol. 2015.PMID: 25512160
-
Current role of multiparametric magnetic resonance imaging for prostate cancer.
Loffroy R, Chevallier O, Moulin M, Favelier S, Genson PY, Pottecher P, Crehange G, Cochet A, Cormier L.
Loffroy R, et al.
Quant Imaging Med Surg. 2015 Oct;5(5):754-64. doi: 10.3978/j.issn.2223-4292.2015.10.08.
Quant Imaging Med Surg. 2015.PMID: 26682144
Free PMC article.Review.
Cited by
-
Prostate Cancer and Its Mimics-A Pictorial Review.
Żurowska A, Pęksa R, Bieńkowski M, Skrobisz K, Sowa M, Matuszewski M, Biernat W, Szurowska E.
Żurowska A, et al.
Cancers (Basel). 2023 Jul 19;15(14):3682. doi: 10.3390/cancers15143682.
Cancers (Basel). 2023.PMID: 37509343
Free PMC article.Review.
-
Radiologic-pathologic correlation of prostatic cancer extracapsular extension (ECE).
Guerra A, Flor-de-Lima B, Freire G, Lopes A, Cassis J.
Guerra A, et al.
Insights Imaging. 2023 May 16;14(1):88. doi: 10.1186/s13244-023-01428-3.
Insights Imaging. 2023.PMID: 37191739
Free PMC article.Review.
-
Diagnostic scope of 18F-PSMA-1007 PET/CT: comparison with multiparametric MRI and bone scintigraphy for the assessment of early prostate cancer recurrence.
Saule L, Radzina M, Liepa M, Roznere L, Kalnina M, Lioznovs A, Mamis E, Mikelsone M, Biederer J, Vjaters E.
Saule L, et al.
Am J Nucl Med Mol Imaging. 2021 Oct 15;11(5):395-405. eCollection 2021.
Am J Nucl Med Mol Imaging. 2021.PMID: 34754610
Free PMC article. -
Incidental findings in and around the prostate on prostate MRI: a pictorial review.
Trivedi J, Sutherland T, Page M.
Trivedi J, et al.
Insights Imaging. 2021 Mar 18;12(1):37. doi: 10.1186/s13244-021-00979-7.
Insights Imaging. 2021.PMID: 33738590
Free PMC article.Review.
-
Comparison of time curves from dynamic 18F-fluciclovine positron emission tomography and dynamic contrast-enhanced magnetic resonance imaging for primary prostate carcinomas.
Tulipan AJ, Vlatkovic L, Malinen E, Brennhovd B, Hole KH, Lie AK, Ragnum HB, Revheim ME, Seierstad T.
Tulipan AJ, et al.
Phys Imaging Radiat Oncol. 2018 Oct 2;7:51-57. doi: 10.1016/j.phro.2018.09.003. eCollection 2018 Jul.
Phys Imaging Radiat Oncol. 2018.PMID: 33458405
Free PMC article.
References
-
-
Walz J, Burnett AL, Costello AJ, Ja E, Graefen M, Guillonneau B, et al. Acritical analysis of the current knowledge of surgical anatomy related to optimization of cancer control and preservation of continence and erection incandidates for radical prostatectomy. Eur Urol. 2010;57:179–192. doi: 10.1016/j.eururo.2009.11.009.
—
DOI
—
PubMed
-
-
-
Panebianco V, Barchetti F, Sciarra A, Ciardi A, Indino EL, et al. Multiparametric magnetic resonance imaging vs. standard care in men being evaluated for prostate cancer: a randomized study. Urol Oncol. 2015;33:17.e1–7. doi: 10.1016/j.urolonc.2014.09.013.
—
DOI
—
PubMed
-
-
-
Fütterer JJ. MR imaging in local staging of prostate cancer. Eur J Radiol. 2007;63:328–334. doi: 10.1016/j.ejrad.2007.06.029.
—
DOI
—
PubMed
-
-
-
Hoeks CM, Barentsz JO, Hambrock T, et al. Prostate cancer: multiparametric MR imaging for detection, localization, and staging. Radiology. 2011;261:46–66. doi: 10.1148/radiol.11091822.
—
DOI
—
PubMed
-
-
-
Colleselli D, Hennenlotter J, Schilling D, et al. Impact of clinical parameters on the diagnostic accuracy of endorectal coil MRI for the detection of prostate cancer. Urol Int. 2011;86:393–398. doi: 10.1159/000324098.
—
DOI
—
PubMed
-
LinkOut — more resources
-
Full Text Sources
- Europe PubMed Central
- PubMed Central
- Springer
-
Other Literature Sources
- scite Smart Citations
Содержание
-
- 1. Насколько точна МРТ?
- 2. Может ли МРТ совершить ошибку?
- 3. Что может помешать правильному диагнозу МРТ?
Магнитно-резонансная томография признана одной из самых востребованных диагностических процедур. Метод применяют при неудовлетворительной информативности рутинных исследований для установления, стадирования заболевания, разработки плана лечения.
МР-сканер
МРТ дает послойные снимки анатомической области шагом от 1 мм, сделанные в разных плоскостях. Метод позволяет подробно изучить внутренние ткани и обнаружить мельчайшие очаги патологических изменений. Процедура дорогостоящая, чаще применяется в неоднозначных ситуациях, при длительном анамнезе, подозрении на опасное для жизни заболевание. Иногда пациенты сомневаются в результатах сканирования. При выявлении серьезной патологии возникает вопрос, может ли МРТ ошибаться в диагнозе.
Магнитно-резонансная томография признана точнейшим методом диагностики. Но возможность ошибки нельзя исключить на 100%. Наиболее распространенными причинами получения ложных результатов являются низкая информативность и неправильная расшифровка снимков.
Насколько точна МРТ?
Для сканирования применяют сложное оборудование, регулярно проходящее сервисное обслуживание. Вероятность получения ошибочного результата исследования из-за неисправности аппарата нулевая.
При рациональном использовании МР-томографии, соблюдении условий подготовки и диагностики, точность метода составляет около 98%.
Порядка 2% приходится на ошибки, спровоцированные:
- использованием недостаточно мощного оборудования;
- неправильным назначением процедуры (для исследования костей или легких и пр.);
- появлением на снимках артефактов;
- нарушением правил подготовки к исследованию;
- изменением методики проведения сканирования.
Диагностическая процедура позволяет визуализировать виртуальные срезы органов и тканей. Выявление патологических изменений — задача изучающего снимки специалиста. Нужны знания анатомии, физиологии, опыт в чтении томограмм. От квалификации врача лучевой диагностики зависит, будут ли замечены признаки заболевания на фото.
Медицинские специалисты в процессе работы
Рентгенолог протоколирует обнаруженные отклонения от нормы, после чего заключение выдают обследуемому. Информацию использует лечащий врач для постановки диагноза. Ответ на вопрос, может ли МРТ ошибаться, неоднозначный. Чаще погрешности возникают на этапе расшифровки изображений. По статистике медицинских центров, рентгенологи делают неверные заключения в 5-6% случаев.
Может ли МРТ совершить ошибку?
Во время магнитно-резонансной томографии получают монохромные снимки (изображения зон интереса в оттенках серого). Чередование светлых и темных участков соответствует контурам анатомических структур, расположенных в зоне исследования. Картинки могут отличаться в зависимости от режима сканирования. Патологические изменения проявляются как очаги аномального МР-сигнала (гипо- или гиперинтенсивного). Перечисленные явления можно увидеть при достаточной четкости и высоком разрешении снимков. Даже опытный специалист не сможет трактовать смазанные сканы.
Для получения точных снимков необходимы следующие условия:
- Достаточная мощность оборудования. Низкопольные открытые аппараты дают менее детальные срезы, чем томографы тоннельного типа.
- Контрастирование. Очаги воспалительных изменений, опухоли и сосуды лучше видны после введения в вену усилителя.
- Правильный режим сканирования. Перед началом исследования рентгенолог настраивает оборудование для выполнения срезов в определенных проекциях, если установки внесены неверно, органы и ткани могут плохо визуализироваться.
- Учет естественной контрастности структур. Плотные, содержащие мало воды ткани, плохо видны при МРТ.
- Риск появления артефактов в результате физиологических движений тела или органа. Магнитно-резонансную томографию нежелательно задействовать для исследования полых и сокращающихся структур, поскольку изменение положения провоцируют возникновение размытых участков на сканах.
При учете перечисленных факторов исследование дает четкие и точные снимки, а риск затруднений при трактовке — снижается.
Что может помешать правильному диагнозу МРТ?
Информативность томографии косвенно зависит от самого пациента. Сканирование некоторых зон требует подготовки. Это в большей мере касается полых органов и анатомических структур брюшной полости. Скопление газов в кишечнике, избыточная перистальтика способны сделать снимки нечеткими и снизить информативность сканирования. При оформлении записи на процедуру стоит уточнить правила подготовки.
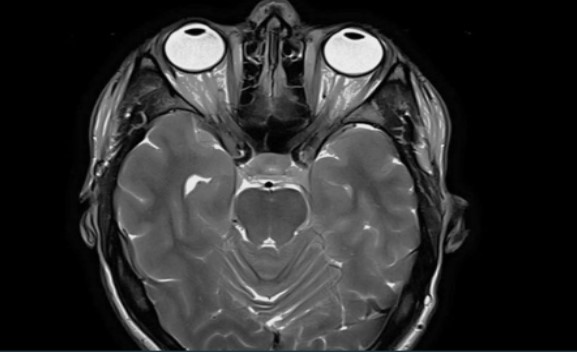
МР-скан глазниц
Искажение результатов возможно при наличии в теле пациента металлических имплантатов. Ферромагнетики взаимодействуют с полем, индуцируемом аппаратом. Это способствует появлению артефактов на снимках (засвеченных или размытых зон). В результате отсутствует возможность оценить изображение и предоставить достоверную характеристику анатомических структур. Чтобы избежать искажения фото, о металлических имплантатах следует заранее сообщить рентгенологу.
Стоит внимательно отнестись к подготовительным мероприятиям непосредственно перед процедурой. Нужно снять украшения и аксессуары, предметы одежды с металлической фурнитурой, избавиться от электронных устройств. Подобные изделия могут быть причиной появления артефактов.
В процессе сканирования важно соблюдать неподвижность. Любое, даже незначительное, изменение положения тела провоцирует размытие снимков.
Достоверность результатов МРТ в немалой степени зависит от квалификации рентгенолога. Лучше обращаться в специализированные диагностические центры. При подозрении на серьезное заболевание, есть смысл предоставить результаты МРТ еще одному врачу и сравнить заключения.
В ДЦ «Магнит» исследование проводят на закрытом высокопольном аппарате мощностью 1,5 Тл (Siemens Symphony с технологией Tim). Расшифровкой результатов занимаются специалисты с большим практическим опытом. В центре есть платная услуга «Второе мнение». Записаться на магнитно-резонансную томографию любой анатомической зоны можно по телефону +7 (812) 407-32-31.