- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Соколова А.В.
1
Малишевская Н.П.
2
1 Клиника «Уральская»
2 Государственное бюджетное учреждение Свердловской области «Уральский научно-исследовательский институт дерматовенерологии и иммунопатологии»
В России в течение последних 15 лет отмечается рост заболеваемости меланомой кожи (МК) на 70%. Наиболее неблагоприятны по своим последствиям ошибки в диагностике МК. Проведено клиническое и дерматоскопическое исследование 1030 новообразований кожи у 800 пациентов, последовательно обратившихся на прием к дерматологу. В выборку включены все пациенты с новообразованиями кожи, после удаления которых было произведено гистологическое исследование материала и получено патоморфологическое заключение (n=441). Из 441 гистологического исследования новообразований кожи совпадение с клинически установленным диагнозом было в 355 случаях (80,5%), расхождение — в 86 случаях (19,5%). Из 86 случаев расхождения диагнозов установлено 24 (27,9%) случая гиподиагностики диспластических невусов и меланомы кожи, 34 (39,5%) случая гипердиагностики диспластических невусов и меланомы кожи. Проанализированы причины расхождения клинического и дерматоскопического с патоморфологическим диагнозом в случаях сложной дифференциальной диагностики новообразований кожи, к которым относятся больные с диспластическими невусами и меланомой кожи, особенно на ранних стадиях. Основными причинами гиподиагностики меланоцитарных новообразований кожи являются малый размер новообразования, визуальная однородность цвета, беспигментные или мало пигментированные новообразования, визуально и дерматоскопически определяемые ровные и четкие контуры.
меланома кожи
диспластический невус
ошибки в диагностике меланомы
гиподиагностика меланомы кожи.
1. Демидов Л.В., Харкевич Г.Ю., Маркина И.Т. Меланома и другие злокачественные новообразования кожи // Энциклопедия клинической онкологии: руководство для практических врачей. — М.: РЛС, 2005. — С. 341–364.
2. Малишевская Н.П., Игликов В.А. и др. Эпидемиология злокачественных новообразований кожи на Среднем Урале / Кунгуров Н.В. (ред.) // Злокачественные новообразования кожи: заболеваемость, ошибки диагностики, организация раннего выявления, профилактика. — Курган: Зауралье, 2010. – С. 8-33.
3. Чиссов В.И., Старинский В.В., Петрова Г.В. Качественные новообразования в России в 2011 году (заболеваемость и смертность). — М.: ФП «МНИОИ им. П.А. Герцена» Минздрава России, 2013. — 289 с.
4. Chen S.T., Geller A.C., Tsao H. Update on the epidemiology of melanoma // Curr. Dermatol. Rep. — 2013. — № 2 (1). — Р. 24–34.
5. Малишевская Н.П., Кохан М.М., Соколова А.В и др. Дерматоонкология (злокачественные новообразования кожи, первичные лимфомы кожи): атлас / под общ. ред. проф. Н.В. Кунгурова. – Екатеринбург: Изд-во Урал. ун-та, 2016. – 68 с.
6. Состояние онкологической помощи населению России в 2016 году / под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. — М.: МНИОИ им. П.А. Герцена филиал ФГБУ «НМИРЦ» Минздрава России, 2017. — 236 с.
В России в течение последних 15 лет отмечается рост заболеваемости меланомой кожи (МК) на 70% [1-4]. Наиболее неблагоприятны по своим последствиям ошибки в диагностике МК. О значительном количестве диагностических ошибок на разных уровнях оказания медицинской помощи пациентам свидетельствует сохраняющийся высокий удельный вес больных с МК, выявленной на поздних стадиях опухолевого процесса [5]. За период с 2006 по 2016 год в РФ показатели запущенности по меланоме кожи значительно снизились (-40,6%), однако они по-прежнему остаются на недопустимо высоком уровне (18,9%) для опухолей визуальных локализаций [6]. Следует отметить, что гипердиагностика МК не влечет столь трагических последствий, как гиподиагностика, которая всегда связана с ухудшением прогноза течения заболевания и риском для жизни больного.
Цель исследования — установить причины расхождения результатов клинического и стандартного дерматоскопического обследования с патоморфологическим диагнозом в случаях сложной дифференциальной диагностики НОК. Проведено клиническое и дерматоскопическое исследование 1030 новообразований кожи (НОК) у 800 пациентов, последовательно обратившихся на прием к дерматологу. Из них в 441 (42,8%) случае выполнено удаление НОК радиоволновым или хирургическим методом с последующим гистологическим исследованием. Показаниями для удаления новообразований кожи явились подозрение на МК и диспластические невусы, все случаи сложной дифференциальной диагностики, а также все меланоцитарные новообразования, находящиеся в местах постоянного травмирования или имеющие большие размеры (>6 мм). В случаях подозрения на МК пациенты направлялись в Государственное бюджетное учреждение Свердловской области «Свердловский областной онкологический диспансер» для хирургического иссечения НОК и последующего лечения. В выборку включены все пациенты с верифицированными диагнозами НОК, в том числе пациенты с меланомой кожи на ранних (I-II) стадиях и диспластическими невусами, когда правильная и своевременная диагностика наиболее важна для дальнейшего прогноза течения заболевания (табл. 1).
Таблица 1
Структура новообразований кожи (n=441)
|
Меланоцитарные новообразования кожи |
Число больных с правильно установленным диагнозом, абс. (%) |
|
|
визуальный осмотр с использованием дерматоскопии |
гистологическое заключение |
|
|
Доброкачественные НОК |
349 (79,1%) |
361 (81,9%) |
|
Диспластические невусы кожи |
82 (18,6%) |
67 (15,2%) |
|
Меланома кожи на ранних стадиях |
10 (2,3%) |
13 (2,9%) |
Группу доброкачественных новообразований кожи составили меланоцитарные невусы без признаков дисплазии (n=263), себорейный кератоз (n=74) и гемангиомы кожи (n=12) в случаях их травмирования, с наличием геморрагических корочек на поверхности новообразований, затрудняющих визуальную и дерматоскопическую диагностику.
Таким образом, в данной выборке достоверных различий в правильности постановки диагноза при клиническом осмотре дерматолога с применением рутинной дерматоскопии и результатом гистологии не выявлено (табл. 1).
Из 441 гистологического исследования НОК совпадение с клинически установленным диагнозом было в 355 случаях (80,5%), расхождение — в 86 случаях (19,5%). Совпадение клинического дерматоскопического и гистологического диагнозов (n=355) выявлено в случаях доброкачественных новообразований кожи (n=305), диспластических невусов (n=45) и меланомы кожи (n=6). Из 86 случаев расхождения диагнозов установлено 24 (27,9%) случая гиподиагностики диспластических невусов и меланомы кожи, 34 (39,5%) случая их гипердиагностики.
Проанализированы причины расхождения клинического и стандартного дерматоскопического обследования с патоморфологическим диагнозом в случаях сложной дифференциальной диагностики НОК, к которым относятся больные с диспластическими невусами и меланомой кожи, особенно на ранних (I-II) стадиях (табл. 2).
Таблица 2
Визуальные признаки НОК, влияющие на гиподиагностику диспластических невусов и МК с использованием дерматоскопии (n=24)
|
Признак |
Частота встречаемости |
|
|
абс. |
% |
|
|
1. Малый размер новообразования (<6 мм) |
17 |
70,8 |
|
2. Визуально и дерматоскопически определяемые ровные четкие контуры |
3 |
12,5 |
|
3. Клинически и дерматоскопически определяемая однородность цвета |
6 |
25,0 |
|
4. Беспигментные или мало пигментированные новообразования |
5 |
20,8 |
Примечание: у одного больного могло быть несколько причин гиподиагностики, в связи с чем общая частота встречаемости признака превышает 100%.
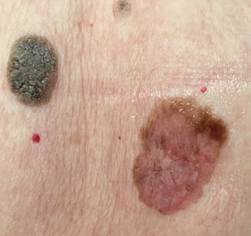
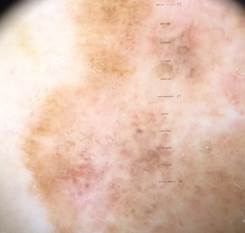
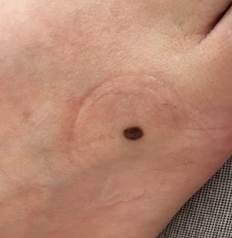
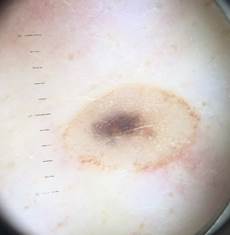
B соответствии с приведенными данными основными причинами гиподиагностики пигментированных новообразований кожи являются малый размер новообразования (70,8%, рис. 1), визуальная однородность цвета (25,0%, рис. 2), беспигментные или мало пигментированные новообразования (20,8%, рис. 3), визуально и дерматоскопически определяемые ровные и четкие контуры (12,5%, рис. 4).
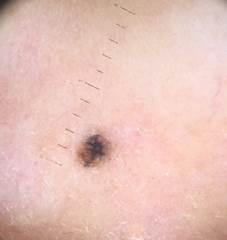
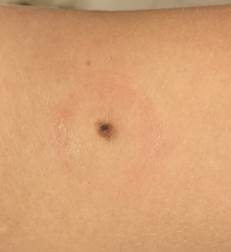
Рис. 1. Линейный размер меланомы кожи меньше 6 мм (дерматоскопическое изображение)
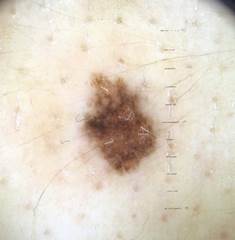
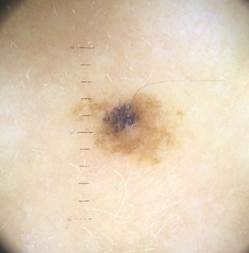
Рис. 2. Клиническое и дерматоскопическое изображение диспластического невуса кожи лба: клинически определяется визуальная однородность цвета
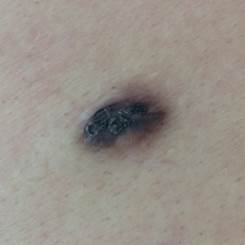
Рис. 3. Клиническое и дерматоскопическое изображение мало пигментированной меланомы кожи живота с участками регресса, выше – себорейный кератоз
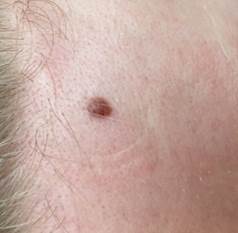
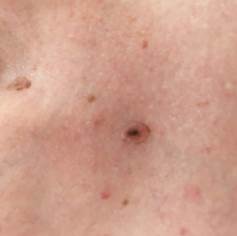
Рис. 4. Клиническое и дерматоскопическое изображение меланомы кожи тыльной поверхности стопы
Проанализированы причины гипердиагностики меланоцитарных новообразований кожи в случаях, когда возникают трудности в дифференциальной диагностике диспластических невусов и меланомы кожи (табл. 3).
Таблица 3
Визуальные признаки НОК, влияющие на гипердиагностику диспластических невусов и МК с дерматоскопией (n=34)
|
Признак |
Частота встречаемости |
|
|
абс. |
% |
|
|
1. Большой (свыше 10 мм) размер новообразования |
13 |
54,2 |
|
2. Клинически и дерматоскопически определяемые неровные контуры и асимметричность новообразования |
9 |
37,5 |
|
3. клинически и дерматоскопически определяемая неоднородность цвета |
15 |
62,5 |
|
4. Наличие в новообразовании фрагментов темно-коричневого и черного цвета при дерматоскопии новообразований |
8 |
33,3 |
Примечание: у одного больного могли быть несколько причин гипердиагностики, в связи с чем общая частота встречаемости признака превышает 100%.
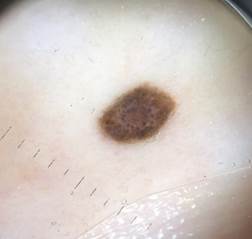
B соответствии с данными таблицы 3 основными причинами, которые приводят к гипердиагностике диспластических невусов и меланомы кожи, являются неоднородность цвета (62,5%, рис. 5, 7), размер новообразований более 10 мм (54,2%, рис. 6), неровные контуры и асимметричность новообразования (37,5%, рис. 5), а также наличие в новообразовании фрагментов темно-коричневого и черного цвета (33,3%, рис. 5-7).
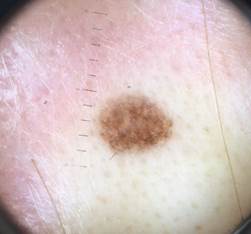
Рис. 5. Клиническое и дерматоскопическое изображение диспластического невуса кожи плеча: неоднородность цвета, неровные контуры и асимметричность новообразования, наличие в новообразовании эксцентрично расположенных фрагментов темно-коричневого и черного цвета
Рис. 6. Пигментированная дерматофиброма кожи бедра
Рис. 7. Клиническое и дерматоскопическое изображение диспластического невуса кожи живота
Результаты расчета показателей диагностической точности, чувствительности и специфичности клинического осмотра с применением дерматоскопии для диагностики НОК продемонстрировали, что чувствительность клинического осмотра с применением дерматоскопии для доброкачественных новообразований кожи (91,2%) на 45,0% выше, чем чувствительность диагностики меланомы кожи (46,2%). Но при этом определяется высокая (99,1%) специфичность клинической и дерматоскопической диагностики меланомы кожи, что свидетельствует о большой вероятности совпадения диагноза с данными патоморфологического исследования. Точность диагностики меланомы кожи составляет 97,5%, что на 9,1% выше, чем точность диагностики доброкачественных новообразований кожи (88,4%) с применением метода дерматоскопии.
На следующем этапе исследования был разработан «показатель гиподиагностики», т.е. число больных, которым необходимо провести клиническое и дерматоскопическое исследование новообразований кожи для того, чтобы у одного из них установленный клинический диагноз не подтвердился результатом гистологического исследования. Показатель гиподиагностики рассчитывали как отношение неверно диагностированных случаев ко всем случаям НОК в данной группе. Этот показатель составил 18,4 в случае диспластических невусов и меланомы кожи, и 63,0 в случае только меланомы кожи. Таким образом, при осмотре 63 больных с НОК в ситуациях сложной дифференциальной диагностики дерматолог допускает один случай гиподиагностики меланомы кожи.
Диагностические ошибки за счет гиподиагностики процесса имеют наиболее неблагоприятные для течения заболевания и прогноза жизни последствия, что диктует необходимость внедрения в клиническую практику новых современных неинвазивных методов обследования меланоцитарных новообразований кожи (спектрофотометрического интрадермального анализа, конфокальной лазерной сканирующей микроскопии).
Библиографическая ссылка
Соколова А.В., Малишевская Н.П. ОШИБКИ В ДИАГНОСТИКЕ МЕЛАНОЦИТАРНЫХ НОВООБРАЗОВАНИЙ КОЖИ // Современные проблемы науки и образования. – 2018. – № 2.
;
URL: https://science-education.ru/ru/article/view?id=27502 (дата обращения: 22.09.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Совершенно стандартная история, прочитав которую, вам станет ясно — зачем пересматривать гистологию, тем более в наших российских реалиях.
Зачем пересматривать гистологию
Вадим, добрый вечер!
Кратко: муж, 28 лет. Двое маленьких детей, один из которых на инвалидности. Мужу ставят диагноз — меланома. Кроме мужа никого нет. С диагнозом знакомы два дня, прошу помочь разобраться.
Месяц назад мужу удалили родинку в Военном госпитале в Москве, гистология выполнялась в Инвитро. Вот что было написано в заключении Инвитро.
Сложный диспластичный пигментный невус преимущественно из баллонообразных клеток с педжетоидной мелоноцитарной дисплазией 2 ст. Резекция в пределах неизменных тканей.
Рекомендуется консультация онкоморфолога.
(Вообще, если опустить сам факт проблемы, то остается вопрос: неужели в Военном госпитале нет своей лаборатории? прим. Дядя Вадик)
Муж поехал в Герцена, результат пришел другой:
Эпителиоклеточная неизъявленная пигментная меланома, 3-й уровень инвазии по Кларку, толщина по Бреслоу — 0,75 мм, с умеренной лимфоидно-плазмоклеточной инфильтрацией, низкой митотической активностью. Удалено в пределах здоровых тканей.

Два совершенно разных диагноза. Отвез стекла и блоки на Каширку, чтобы получить третье мнение. Результата еще нет. Не хочется терять время. Назначили узи живота, мрт мозга, кт легких, сканирование костей.
Вы уже человек опытный, хоть и не врач, но как вы думаете, с чего нам стоит начинать? Прочитала про ПЭТ К/Т на вашем сайта. Стоит заменить им все обследования? А что дальше? Израиль не потянем, в семье сложный ребенок. Где лучше всего лечат меланому в России? Каков прогноз с данными цифрами? Будем благодарны за ответы. Мужа нужно спасать, кроме него у нас никого нет.
И последний вопрос: онколог не осматривал мужа на предмет других родинок (а зачем? Пациент ведь не просит… прим Дядя Вадик), но лично мне не понравились еще штук 6 — все большие и черные. Особенно на месте недавнего солнечного ожога после поездки в Тайланд, они появились сразу же. Их все 6 удалять? Если ли у вас контакт хорошего дерматолога-онколога в Москве.
Будем благодарны за ответ.
Светлана, доброе утро!
С разу «в лоб» — прогноз с такой стадией в большинстве случаев БЛАГОПРИЯТНЫЙ, если диагноз будет подтвержден в таких же рамках.
Бывает всяко конечно, но если брать пример с меня, то это мой диагноз, а я вчера был на очередном осмотре (и по этому сразу вам не смог ответить, т.к. мы закончили уже ночью) и у меня все хорошо, чего и вам желаю!
Я бы все таки в первый раз сделал ПЭТ КТ, а потом через пол года уже УЗИ. Вы не написали где была родинка, т.к. надо делать УЗИ регионарных лимфоузлов еще (кроме живота).
А вот сканирование… странный выбор, т.к. кости – это последнее куда меланома дает метастазы (я вообще этого не понимаю – есть ПЭТ КТ, для чего делать КТ + УЗИ + Сцинтиграфию?).
Далее, вот если на Каширке будет ТРЕТИЙ результат, то рекомендую вам все же пересмотреть гистологию «у нас», в Израилях. Несете ее сюда https://melanomaunit.moscow/ и ездить никуда не нужно.
И в принципе все. Если БСЛ не делаем, то в дальнейшем просто наблюдаемся.
Родинки , если они выглядят подозрительно, смотрим в дерматоскоп, а вообще лучше сразу удалить! Хоть 10!
Вадим.
Спасибо вам огромное за ответ! Вы даже не представляете как я ждала Вашего письма!
Благоприятный — мы очень рады! На Каширке сегодня подтвердили меланому, но самой бумаги с гистологией у нас ещё нет на руках.
Про сканирование поняла. Почему не направляют на ПЭТ КТ мне тоже не понятно… Ещё раз позвольте мне уточнить, так как мы «в диагнозе» всего лишь третий день, но уже прочитали многое в интернете. Вы бы на нашем месте сделали ПЭТ КТ вместо всех этих обследований? Больше ВООБЩЕ ничего не нужно, если там все будет нормально? Родинка была на бедре, сантиметров 10-15 вниз и правее от паха. На правой ноге. Про УЗИ лимфоузлов тоже ничего не сказали, про биопсию тоже. Стоит сделать УЗИ лимфооузлов? Это обследование тоже, наверное, в крупных онкобольницах делается?
И ещё, позвольте уточнить — Вы сейчас как обследуетесь? Делаете раз в год ПЭТ КТ?
Мы сейчас заберём гистологию с Каширки и, конечно, пойдём на приём к онкологу (куда — пока ещё не решили в Герцена или Блохина), все эти вопросы я задаю чтоб самой понимать немного больше. Значит, ПЭТ КТ и наверное узи лимфоузлов? А потом?
Доброе утро!
Давайте так, я очень послушный пациент и полностью исполнял (и исполняю) назначения врачей, правда в моем случае – это израильские врачи.
Что было у меня:
декабрь 2011 – ПЭТ КТ
Февраль 2012 – биопсия сторожевых лимфоузлов (эту процедуру вы исключаете)
Февраль 2013 – ПЭТ КТ
Февраль 2014 – ПЭТ КТ
Февраль 2015 – УЗИ регионарных лимфоузлов и брюшной полости
Март 2016 — УЗИ регионарных лимфоузлов и брюшной полости
Ну и естественно исключение солнца и ежегодные осмотры (полностью, вся тушка осматривается!).
Если вы делаете ПЭТ КТ, то УЗИ делать не нужно. Так же, ваш онколог может назначить УЗИ через каждые три месяца/пол года (вот как назначит, так и нужно делать).
Если ПЭТ КТ не сделаете, то обязательно УЗИ брюшка и паховых лимфоузлов. Т.к. скорее всего, сторожевые лимфоузлы будут в паху располагаться (хотя может быть и правая подмышка, так что тут УЗИ тоже не помешает).
Для консультации рекомендую господина Синельникова
Вот как-то так.
Ещё раз вам большое человеческое спасибо! Даже спасибище!!!
С каждым днём у меня все больше уверенности, что у нас будет счастливая и долгая жизнь. Возможно, многодетная! Спасибо!!! Не болейте! Радуемся результатам вместе с вами!
К Синельникову идём на встречу лично, уже договорились на Каширке.
Тик… тик… тик…
Вадим, добрый день, позвольте я напишу Вам ещё раз. Забрали гистологию мужа из РОНЦ Блохина и она совсем иная, чем в центре Герцена. Другие цифры и появился 1 митоз (что это значит?) и злокачественный рост. Можно попросить вас посмотреть? К Синельникову идём завтра, но до этого дня нужно ещё дожить, учитывая, что все стало хуже… Пожалуйста, сравните. Сделали только КТ грудной клетки пока, нормально.

И снова здравствуйте!
Хуже не стало!
Дело в том, что мегапринципиальной разницы между 0,75 и 1,0 нет + в первом заключении написано «низкая митотическая активность», а во втором конкретизировано «1 митоз мм /кв», что так же является низкой митотической активностью. (для сравнения, я несколько дней назад, когда был на проверке, встречался с девушкой приехавшей на биопсию сторожевых лимфоузлов, дык вот у нее , если не ошибаюсь, 14 митозов на кв/мм)
Что такое митотический индекс https://www.vladlive.com/melanoma-2/melanoma-vse-o-bolezni/melanoma-zabolevanie-diagnostika-lechenie/#mitoz
Про злокачественный рост – см картинку. Т.е. от края разреза, до первой клетки меланомы 6 мм. Вообще маловато и думается мне, что нужно расширить границы! Но это вы уже с онкологом обсудите!

Вадим, спасибо за столь быстрый ответ!
Понятно, значит существенной разницы нет и второй анализ более расширенный как бы… Но тем не менее, мы, конечно, дождёмся вердикта.
6 мм, конечно, настораживают. Может быть ведь тоже погрешность в измерениях… Хоть мы и надеемся на обратное.
Получается это какая стадия? Уже не 1-я???
А мне как раз, второе больше нравится, т.к. оно более полное и точное.
Про 6 мм ВЫ НЕ ПОНЯЛИ! Это к «стадии» никакого отношения не имеет! У вас первая стадия. Я на рисунке изобразил «удаленный материал» и 6 мм это расстояние от края удаления до первых попадающихся клеток меланомы в коже (ну я непрофессиональным языком описываю конечно).
Т.е. тут просто надо еще раз иссечь более широко. Повторюсь – это вам доктор должен рассказать!
********************************
Ну вот, как-то так. Хочу отметить, что если бы диагноз оказался более «крутой» и девушка не озаботилась бы за пересмотром гистологии, то все могло закончится очень печально.
1. Думаете буду на Инвитро бочку катить? Нет, не буду. Сам сдавал у них много раз анализы, просто надо понимать одну вещь — анализ анализу рознь! И в случае с меланомой, да и наверное с другими видами онкологии, лучше обращаться в профильные учреждения.
2. Зачем пересматривать гистологию? Вот чтобы вам не говорили, чтобы не советовали — ошибки случаются ре-гу-ляр-но. И если в данном конкретном случае результаты больниц совпали, то это не значит, что так происходит всегда. Поверьте на слово.
3. Пару слов про консультации и тем более про онлайн (это к истории не относится, просто «навеяло»): прежде чем идти на консультацию к онкологу в частную клинику в Москве (а тем более на периферии!), или задавать вопросы онлайн , ознакомьтесь с его «послужным списком». Смотрел я тут сайты нескольких таких учреждений… в каждом имеется аж по нескольку супер-онко-мега-спецов. Да, молодые, красивые, в белых халатиках — вот только стаж, обычно, измеряется парой лет. Что вам может такой молодой красавЕц посоветовать, я даже не знаю. Откуда опыту взяться?
Пример (сегодняшний, кстати):
Мы с трудом выбили для мамы препарат зелбораф, она начала его принимать, но через неделю проявилась сильнейшая аллергическая реакция, значительно отекло всё лицо, по всему телу появилась сыпь, к этому всему присоединили см ь ещё зуд, лихорадка и проблемы со зрением. Местные врачи сказали отменить препарат из-за индивидуальной непереносимости и вернуть таблетки. Маме назначили антигистаминные препараты, ставят капельницы, более никакого лечения по их утверждению ей не назначить. Допускают назначение в дальнейшем декарбазина. На наши просьбы попробовать принимать зелбораф либо вместе с антигистаминными либо по иной схеме отвечают отказом.
Может быть Вы можете в связи с этим что-то посоветовать? Есть ли другие ингибиторы, доступны ли они для простых граждан? К кому можно обратиться за консультацией по зелбораф и преодолению его побочек?
ну и чего вам в этом случае посоветует «молодой человек в халатике», который Зелбораф то видел только на картинке?
Не болейте и имейте ввиду: «Спасение утопающих…..»
З.Ы Вот прошло уже 4 года как я сайтик свой веду, но каждый раз читая такие письма я просто поражаюсь нашим врачам. Ведь вы сами своим невниманием к пациентам, заставляете их лезть в интернет и искать ответы на вопросы! Неужели это непонятно? Почему я должен рисовать людям картинки и объяснять азы лечения меланомы? Не, я не против, но согласитесь — ЭТО НЕ НОРМАЛЬНО!
З.Ы. Вся переписка опубликована с полного согласия «правообладателя».
НО ЭТО ЕЩЕ НЕ ВСЕ
Вот очередной лабораторный перл из страны «ближнего зарубежья». Обратите пожалуйста внимание на выделенную цветом инвазию и сопоставьте это с вынесенным вердиктом. Из данного документа следует, что никакой разницы между 0,5 и 3,5 мм нет и все это относится к стадии Т1а. Хочу отметить, что все остальные лабораторные исследования были расписаны ОЧЕНЬ подробно — параметры крови, еще чего-то… куча цифр, а вот гражданин Бреслоу, как выясняется, вообще особой роли в постановке диагноза не играет (так, рядом пробегал).
И вот смотрит человек на ЭТО, а потом «лезет в интернет» и охреневает (я извиняюсь) от точности заключения! И главное то, что под этим документом пару месяцев назад подписалась целая врачебная комиссия 🙁

Теперь всё.
Я ответил на вопрос: зачем пересматривать гистологию?
01.04.2016
«Пока верстался номер»
Вчера, пока я ваял пост, прилетело окончание истории:
Вадим, считаю необходимым вам рассказать о нашей поездке на Каширку к Синельникову.
Я, конечно, до сих пор под впечатлением от этого гнетущего места. Синельников сказал, что разреза достаточно. Что-то там объяснил про то, что кожа потом сморщивается со временем и т.д. (Сидя там в кабинете, умом я это понимаю, но пересказать не смогу). Сказал, что БСЛУ может обсуждаться при данном размере, но в России её не делают. Интересно, почему?.. В общем, порекомендовал нам наблюдаться каждые три месяца. Сказал прогноз благоприятный. Поэтому оставаясь в России, мы и не сможем больше ничего сделать. Ну разве что сходить на консультацию к другому ведущему специалисту, послушать второе мнение, но не знаю, что нам это даст. В общем, сказал жить дальше и каждые три месяца обследоваться. Как-то так.
А вам спасибо большое за поддержку, разъяснения и просто большое человеческое спасибо!
Review
. 2021 Oct 15;8(4):494-501.
doi: 10.3390/dermatopathology8040051.
Lucia Lospalluti
2
, Anna Colagrande
1
, Antonietta Cimmino
1
, Paolo Romita
2
, Caterina Foti
2
, Aurora Demarco
2
, Francesca Arezzo
3
, Vera Loizzi
3
, Gennaro Cormio
3
, Sara Sablone
4
, Leonardo Resta
1
, Roberta Rossi
1
, Giuseppe Ingravallo
1
Affiliations
-
PMID:
34698090
-
PMCID:
PMC8544555
-
DOI:
10.3390/dermatopathology8040051
Free PMC article
Review
Dedifferentiated Melanoma: A Diagnostic Histological Pitfall-Review of the Literature with Case Presentation
Gerardo Cazzato et al.
Dermatopathology (Basel).
.
Free PMC article
Abstract
Dedifferentiated melanoma is a particular form of malignant melanoma with a progressive worsening of the patient’s clinical outcome. It is well known that melanoma can assume different histo-morphological patterns, to which specific genetic signatures correspond, sometimes but not always. In this review we address the diagnostic difficulties in correctly recognizing this entity, discuss the major differential diagnoses of interest to the dermatopathologist, and conduct a review of the literature with particular attention and emphasis on the latest molecular discoveries regarding the dedifferentiation/undifferentiation mechanism and more advanced therapeutic approaches.
Keywords:
dedifferentiated melanoma; diagnosis; immunohistochemistry; malignant melanoma (MM); pitfall.
Conflict of interest statement
The authors declare no conflict of interest.
Figures
(A) Lesion consisted of a nodular part of about 3 cm in diameter and a flat, blackish, elongated part of about 1.5 cm. (B) Dermoscopically, the lesion was characterized by marked chromatic asymmetry, with radial striae and peripheral pigment escape, with irregular globules. (A) The “shoulder” of the lesion was made up of atypical melanocytes, which ascended to the level of the dermoepidermal junction, morphologically suggestive of malignant melanoma. Note that the neoplastic cells had a tendency to invade the superficial/middle dermis (Hematoxylin-Eosin, Original Magnification: 10×). (B) Histological micrograph that highlights the two morphologically different components of dedifferentiated melanoma (Hematoxylin–Eosin, original magnification: 20×). (C,D) Nodule consisting of pleomorphic, atypical elements, with very numerous typical and atypical mitotic figures, eosinophilic intracytoplasmic paranuclear inclusions, nuclei with thinned chromatin and numerous central and peripheral nucleoli (Hematoxylin–Eosin, original magnification: 20× and 40×). (E) Immunostaining for HMB-45, which is strongly represented in the melanocyte proliferation constituting the “shoulder” of the lesion morphologically represented in (A). Note the total negativity of HMB-45 of atypical nodular proliferation (Immunohistochemistry, original magnification: 10×) (F) Immunostaining for CD10 strongly positive in the exophytic polypoid nodular component and negative in the shoulder of the lesion (Immunohistochemistry, original magnification: 10×). (A) The “shoulder” of the lesion was made up of atypical melanocytes, which ascended to the level of the dermoepidermal junction, morphologically suggestive of malignant melanoma. Note that the neoplastic cells had a tendency to invade the superficial/middle dermis (Hematoxylin-Eosin, Original Magnification: 10×). (B) Histological micrograph that highlights the two morphologically different components of dedifferentiated melanoma (Hematoxylin–Eosin, original magnification: 20×). (C,D) Nodule consisting of pleomorphic, atypical elements, with very numerous typical and atypical mitotic figures, eosinophilic intracytoplasmic paranuclear inclusions, nuclei with thinned chromatin and numerous central and peripheral nucleoli (Hematoxylin–Eosin, original magnification: 20× and 40×). (E) Immunostaining for HMB-45, which is strongly represented in the melanocyte proliferation constituting the “shoulder” of the lesion morphologically represented in (A). Note the total negativity of HMB-45 of atypical nodular proliferation (Immunohistochemistry, original magnification: 10×) (F) Immunostaining for CD10 strongly positive in the exophytic polypoid nodular component and negative in the shoulder of the lesion (Immunohistochemistry, original magnification: 10×). Literature search and article selection according to PRISMA guidelines.
Figure 1
Figure 2
Figure 2
Figure 3
Similar articles
-
Partially Dedifferentiated Primitive Malignant Melanoma with Pseudo-Angiomatous Features: A Case Report with Review of the Literature.
Ambrogio F, Colagrande A, Cascardi E, Grandolfo M, Filotico R, Foti C, Lupo C, Casatta N, Ingravallo G, Cazzato G.
Ambrogio F, et al.
Diagnostics (Basel). 2023 Jan 29;13(3):495. doi: 10.3390/diagnostics13030495.
Diagnostics (Basel). 2023.PMID: 36766604
Free PMC article. -
Dedifferentiated melanomas: Morpho-phenotypic profile, genetic reprogramming and clinical implications.
Massi D, Mihic-Probst D, Schadendorf D, Dummer R, Mandalà M.
Massi D, et al.
Cancer Treat Rev. 2020 Aug;88:102060. doi: 10.1016/j.ctrv.2020.102060. Epub 2020 Jun 23.
Cancer Treat Rev. 2020.PMID: 32619863
Review.
-
Dedifferentiated and undifferentiated neoplasms: A conceptual approach.
Baraban E, Cooper K.
Baraban E, et al.
Semin Diagn Pathol. 2021 Nov;38(6):119-126. doi: 10.1053/j.semdp.2020.09.002. Epub 2020 Sep 5.
Semin Diagn Pathol. 2021.PMID: 32948384
Review.
-
Balloon Cell Melanoma: Presentation of Four Cases with a Comprehensive Review of the Literature.
Cazzato G, Cascardi E, Colagrande A, Cimmino A, Ingravallo G, Lospalluti L, Romita P, Demarco A, Arezzo F, Loizzi V, Dellino M, Trilli I, Bellitti E, Parente P, Lettini T, Foti C, Cormio G, Maiorano E, Resta L.
Cazzato G, et al.
Dermatopathology (Basel). 2022 Mar 28;9(2):100-110. doi: 10.3390/dermatopathology9020013.
Dermatopathology (Basel). 2022.PMID: 35466242
Free PMC article.Review.
-
Amelanotic Malignant Melanoma of the Male Urethra: A Potential Diagnostic Pitfall.
Caputo A, Califano A, Fabiano M, Altieri V, Zeppa P, D’Antonio A.
Caputo A, et al.
Int J Surg Pathol. 2020 Aug;28(5):510-513. doi: 10.1177/1066896920919497. Epub 2020 May 10.
Int J Surg Pathol. 2020.PMID: 32390487
Cited by
-
Metastatic Melanoma to the Orbit With Dedifferentiation: A Case Report.
Rana HS, Dertinger JE, Clabeaux C, Makepeace N, Lewis J.
Rana HS, et al.
Cureus. 2023 Jul 9;15(7):e41591. doi: 10.7759/cureus.41591. eCollection 2023 Jul.
Cureus. 2023.PMID: 37559849
Free PMC article. -
Imaging Mass Spectrometry for the Classification of Melanoma Based on BRAF/NRAS Mutational Status.
Casadonte R, Kriegsmann M, Kriegsmann K, Streit H, Meliß RR, Müller CSL, Kriegsmann J.
Casadonte R, et al.
Int J Mol Sci. 2023 Mar 7;24(6):5110. doi: 10.3390/ijms24065110.
Int J Mol Sci. 2023.PMID: 36982192
Free PMC article. -
Partially Dedifferentiated Primitive Malignant Melanoma with Pseudo-Angiomatous Features: A Case Report with Review of the Literature.
Ambrogio F, Colagrande A, Cascardi E, Grandolfo M, Filotico R, Foti C, Lupo C, Casatta N, Ingravallo G, Cazzato G.
Ambrogio F, et al.
Diagnostics (Basel). 2023 Jan 29;13(3):495. doi: 10.3390/diagnostics13030495.
Diagnostics (Basel). 2023.PMID: 36766604
Free PMC article. -
Not Your Mother’s Melanoma: Causes and Effects of Early Melanoma Diagnosis.
Sadrolashrafi K, Cotter DG.
Sadrolashrafi K, et al.
Dermatopathology (Basel). 2022 Nov 27;9(4):368-378. doi: 10.3390/dermatopathology9040043.
Dermatopathology (Basel). 2022.PMID: 36547217
Free PMC article.Review.
References
-
-
Abbas O., Miller D.D., Bhawan J. Cutaneous malignant melanoma: Update on diagnostic and prognostic biomarkers. Am. J. Dermatopathol. 2014;36:363–379. doi: 10.1097/DAD.0b013e31828a2ec5.
—
DOI
—
PubMed
-
-
-
Cabrera R., Recule F. Unusual Clinical Presentations of Malignant Melanoma: A Review of Clinical and Histologic Features with Special Emphasis on Dermatoscopic Findings. Am. J. Clin. Dermatol. 2018;19((Suppl. S1)):15–23. doi: 10.1007/s40257-018-0373-6.
—
DOI
—
PMC
—
PubMed
-
-
-
Agaimy A., Specht K., Stoehr R., Lorey T., Märkl B., Niedobitek G., Straub M., Hager T., Reis A.C., Schilling B., et al. Metastatic Malignant Melanoma With Complete Loss of Differentiation Markers (Undifferentiated/Dedifferentiated Melanoma): Analysis of 14 Patients Emphasizing Phenotypic Plasticity and the Value of Molecular Testing as Surrogate Diagnostic Marker. Am. J. Surg. Pathol. 2016;40:181–191. doi: 10.1097/PAS.0000000000000527.
—
DOI
—
PubMed
-
-
-
Linee Guida per il Reporting di Revisioni Sistematiche e Meta-Analisi: Il PRISMA Statement. [(accessed on 2 September 2021)]. Available online: http://www.prisma-statement.org/documents/PRISMA%20Italian%20Statement.pdf.
-
-
-
Oxford Centre for Evidence-Based Medicine 2011 Levels of Evidence. [(accessed on 4 September 2021)]. Available online: http://www.cebm.net/wp-content/uploads/2014/06/CEBM-Levels-of-Evidence-2….
-
Publication types
LinkOut — more resources
-
Full Text Sources
- Europe PubMed Central
- MDPI
- PubMed Central
Grażyna Kamińska-Winciorek1, Waldemar Placek2
1The Center for Diagnostics and Treatment of Skin Diseases, Katowice, Poland
Head of Center: Grażyna Kamińska-Winciorek MD, PhD
2Dermatology, Sexually Transmitted Diseases and Clinical Immunology Clinic,
Head of Department: Prof. Waldemar Placek MD, PhD
Postep Derm Alergol 2015; XXXII, 1: 33–39
DOI: 10.5114/pdia.2014.44029
Краткое содержание
Дерматоскопия — это метод оценки структуры эпидермиса и дермы in vivo. В настоящее время он, вероятно, является наиболее точным нехирургическим методом диагностики меланоцитарных ново- образований. Ошибки диагностики могут приводить к неоправданному удалению доброкачественных новообразований и, что хуже, могут пропустить раннюю меланому. Ошибки дерматоскопического анализа можно разделить на связанные с невозможностью провести надлежащие тесты (процедурные и технические ошибки), и те, которые вытекают из недостатка знаний и опыта в дерматоскопии. В настоящей статье обсуждаются наиболее распространенные ошибки начинающих или неопытных врачей.
КЛЮЧЕВЫЕ СЛОВА: дерматоскопия, дермоскопия, распространенные ошибки, базовые ошибки, неверный диагноз, принципы, правила.
Cancer Foundation. Mr March поддерживается наградой от the Office of Medical Research, University of Nevada School of Medicine. Ms Truong and Ms Strazzulla внесли равный вклад с Drs Kim and Grossman.
Адрес для корреспонденции
Prof. Waldemar Placek MD, PhD, Dermatology, Sexually Transmitted Diseases and Clinical Immunology Clinic, University of Varmia and Masuria, 30 Wojska Polskiego St, 10-229 Olsztyn, Poland, phone/fax: + 48 601 915 419, e-mail: w.placek@wp.pl
Знание основано не только на правде, но и на ошибке.
Карл Густав Юнг
Введение
Дерматоскопия (дерматоскопия, эпилюминесцентная микроскопия, микроскопия поверхности кожи) — это метод in vivo исследования структур эпидермиса и дермы. Это простой проверенный способ диагностики, подразумевающий обследование новообразований кожи, главным образом меланоцитарных, с 10-кратным увеличением в традиционных дерматоскопах и с 70–100-кратным — в видеодерматоскопах (1,2).
Дерматоскопы/дермоскопы используют неполяризованный свет, требующий иммерсии (ультразвуковой гель, масло или вода) или поляризованный свет, который не требует применения каких-либо иммерсионных жидкостей. Использование дерматоскопии на приеме дерматолога увеличивает время консультации, но лишь на 72 секунды (3), поэтому стоит использовать ее для оценки любых новообразований на теле обследуемого пациента во время стандартного осмотра.
Так это описывается в литературе, на практике же дерматоскопия меланоцитарных новообразований кожного покрова всего тела с подготовкой документации и описание занимает от 30 до 40 минут. Дерматоскопия должна быть основным диагностическим инструментом, используемым не только опытными дерматологами, но также для скрининга меланоцитарных новообразований различными специалистами, в том числе онкологами, хирургами и врачами общей практики (2, 4).
Дерматоскопия характеризуется 83 % чувствительностью и 69 % специфичностью при выявлении меланомы (5). В клинической практике чрезвычайно важно правильно оценивать новообразования на теле пациента, основываясь на технических аспектах и базовых знаниях дерматоскопии.
Цель
Настоящая статья представляет авторскую классификацию наиболее распространенных и вероятных ошибок дерматоскопии на основе литературы, доступной на ресурсе PubMed, и личного опыта.
Ошибки
Ошибки дерматоскопического анализа можно разделить на связанные с невозможностью провести надлежащие тесты (процедурные и технические ошибки), и те, которые вытекают из-за недостатка знаний и опыта в дерматоскопии. В Таблице 1 представлена авторская классификация возможных ошибок дерматоскопии.
Процедурные (технические) ошибки
Выбор новообразований для дерматоскопии
Наиболее распространенной ошибкой, которую допускают врачи, является дерматоскопическая оценка только отдельных новообразований — тех, на которые указал пациент, или которые врач выбрал на основе клинической оценки по принципу ABCDE, или морфологической — черные новообразования, наиболее крупные в диаметре, возвышающиеся, или те, которые расположены в местах, где они могут подвергаться травматизации (в зоне нижнего белья, в акральных областях).
Решение об иссечении подозрительных новообразований должно приниматься на основе сравнения их с другими новообразованиями. В исследовании Argenziano и соавторов (6) решение об удалении подозрительного новообразования после морфологической оценки единственного новообразования в дерматоскопии принималось в 55 % случаев, но сокращалось до 14 % после сравнительного анализа с другими новообразования.
Чтобы выбрать несколько новообразований для иссечения, рекомендуется подготовить карту тела пациента, чтобы дать хирургу подсказки. Отметить такие участки можно при помощи фотографий, снятых камерой телефона самого пациента (7). Следует также помнить об обследовании всех новообразований на теле, не только меланоцитарных, но также розовых папул, чтобы не пропустить меланому, соответствующую правилу EFG («возвышающаяся», «плотная при пальпации», «постоянно растущая») (8).
Другой ошибкой является игнорирование небольших меланоцитарных новообразований при дерматоскопической оценке. Многие врачи, основываясь на классификации по правилу ABCD, считают, что меланомой могут быть только новообразования более 5 мм в диаметре.
Согласно литературе, 11,4–38,2 % всех меланом имеют диаметр менее 6 мм (9–12). В исследовании Giorgi и соавторов (13) 34 меланомы были выявлены среди 103 меланоцитарных новообразований диаметром менее 6 мм (33 %). В исследовании Bono и соавторов (14) из 924 меланом 22 (2,4 %) были микромеланомами с диаметром менее 3 мм. Клиническое правило АBCD в диагностике меланомы диаметром менее 6 мм не срабатывает (13).
Дерматоскопия меланомы с диаметром менее 5 мм, как правило, выявляет атипичные сосуды, нерегулярную окраску, присутствие атипичных глобул или точек, нерегулярных радиальных линий и зоны регресса (15) (Рис. 1). Другой ошибкой является использование дерматоскопии с такой периодичностью, при которой не удается установить профиль меланоцитарного невуса. Кроме того, следует проводить тотальное обследование кожных покровов всего тела (TBSE) (16).
Бессмысленно обследование пациента, который не желает раздеваться из чувства стыда, избегая обследование области гениталий, ягодиц; когда пациент не соглашается обследовать конечности, например, не хочет снимать обувь или не дает осмотреть кожу под волосами, а такое поведение встречается часто.
Таблица 1. Наиболее распространенные ошибки при дерматоскопии
| Некорректная оценка отдельных новообразований в дерматоскопии: |
| Недостаток знаний, связанных с определением базовых или главных дерматоскопических паттернов или дерматоскопических структур, в том числе неспособность отличить псевдоподии от периферических глобул; поиск таких структур, как кристаллические, с использованием неполяризованного света. |
Процедурные (технические) ошибки: |
| 1. Выбор новообразований для дерматоскопии. Необходимо обследовать все новообразования на теле в зависимости от количества и расположения: |
| Обследование только отдельных меланоцитарных новообразований, указанных пациентом. Обследование отдельных меланоцитарных новообразований, отобранных врачом на основе клинической оценки по правилу ABCDE или при наличии черных очагов, крупных новообразований, выступающих или расположенных в местах, подвергающих их риску злокачественности за счет травмирования (в зоне нижнего белья, в акральных зонах). Неприменение дерматоскопии к розовым немеланоцитарным невусам. Использование дерматоскопии с периодичностью, не позволяющей установить профиль меланоцитарного невуса. Бессмысленное обследование пациентов без осмотра генитальных зон, ягодиц, межъягодичной зоны, ступней или скальпа (из чувства стыда или из-за несогласия пациентов на обследование данных зон). Недостаток знаний относительно факторов, которые могут влиять на дерматоскопический паттерн или доброкачественное меланоцитарное образование, и нецелесообразное хирургическое удаление (дерматоскопическое исследование загорелых пациентов или использующих автозагар, что может менять цвет дерматоскопического паттерна). Невозможность обследования без планирования контрольных осмотров (каждые три месяца, каждые 6 месяцев, каждые 12 месяцев, менее часто, никогда). |
| 2. Выбор метода дерматоскопии: |
| Неправильное нанесение иммерсионной жидкости во время дерматоскопического обследования с использованием неполяризованного света. Вероятность ошибочного диагноза меланомы, узловой или бессимптомной меланомы вследствие использования не поляризованного дерматоскопа; кристаллические структуры, блестящие белые полосы определяются в поляризованном свете. Невозможность дерматоскопического обследования при длинносрочном контроле отдельных новообразований — невозможность выявления новых очагов, неспособность оценить развитие наблюдаемых меланоцитарных новообразований, особенно медленно растущих меланом in situ с небольшим диаметром. |
Все это может привести к неверной диагностике меланомы. Полнота дерматоскопического обследования должна стать частью медицинской практики. Риск пропустить злокачественное новообразование из-за невозможности проведения тотального обследования кожных покровов всего тела составляет 2,7 % (16).
В настоящее время дерматоскопия является точным методом выявления меланомы и минимизации неоправданных иссечений (так называемое количество, требующее иссечения — NNE, определяемое как отношение общего количества удаленных новообразований к количеству удаленных меланом (17, 18).
Недостаток знаний, относящихся к факторам, которые могут повлиять на дерматоскопический паттерн новообразования, согласно правилу «4 х 4 х 6» (19), может привести к неоправданному хирургическому удалению новообразования. Кроме того, дерматоскопическое обследование загорелых пациентов или тех, кто пользуется автозагаром, что может изменить цвет дерматоскопического рисунка, часто приводит к постановке ошибочного диагноза меланомы (20–22).
Чрезвычайно важно разработать стратегию дерматоскопического контроля для пациентов в зависимости от индивидуальных особенностей. Argenziano и соавторы (23) предлагают производить дерматоскопический контроль для предварительной оценки и последующее наблюдение отдельных новообразований при необходимости каждые 3 месяца вплоть до 54 месяцев (23).
Дерматоскопию следует проводить при краткосрочном мониторинге через 3 месяца (изменение характеристик меланомы наблюдается через 2–4 месяца), среднесрочном контроле с осмотром через 6 месяцев или долгосрочным — с ежегодным осмотром (особенно для медленно растущих меланом) (23).
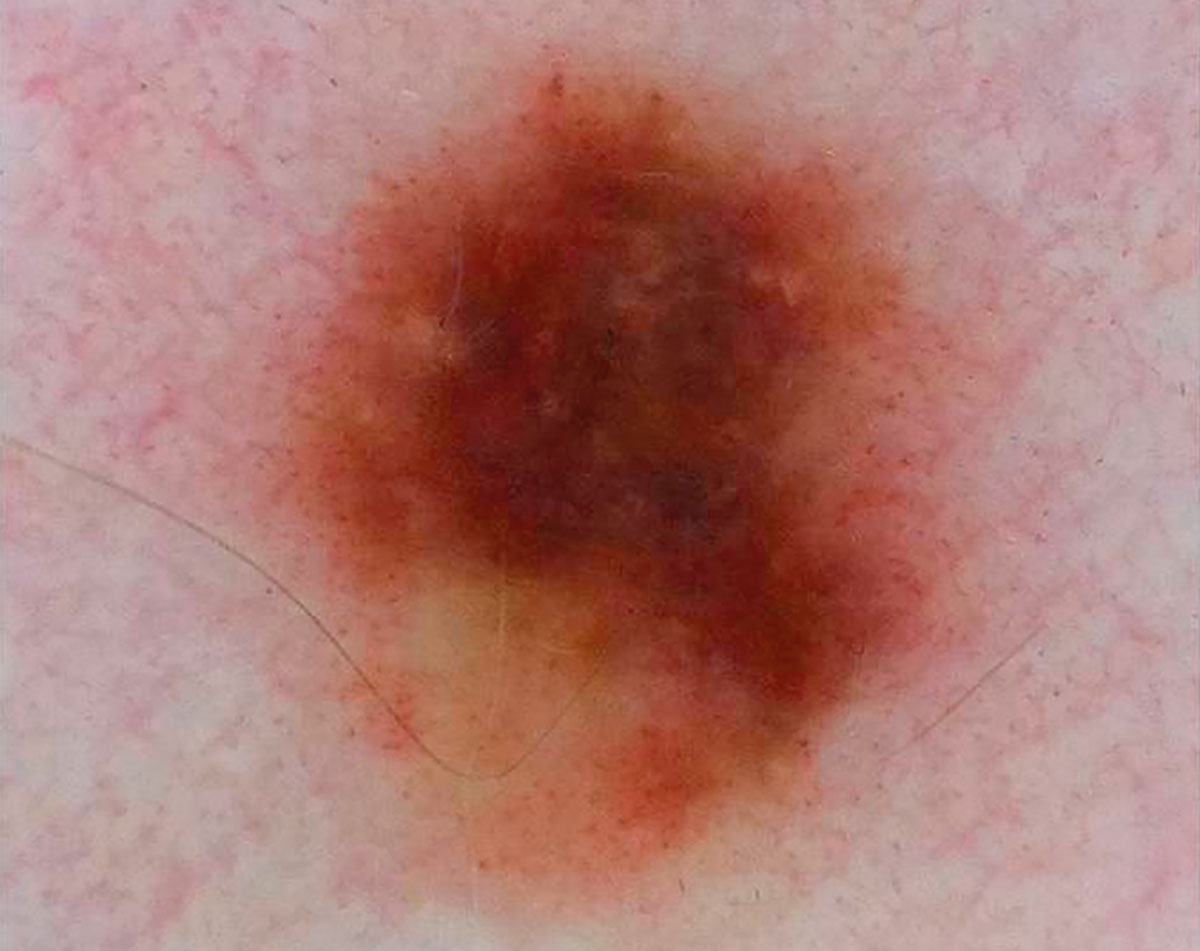
Рисунок 1. Дерматоскопический снимок меланомы in situ диаметром менее 5 мм.
Дерматоскопия показывает присутствие атипичных сосудов, атипичных глобул нерегулярного цвета, нерегулярных радиальных линий и нерегулярных многоцветных, коричневых и сине-серых участков
Степень соответствия составляет 84 % для протокола краткосрочного контроля, 64 % — для среднесрочного и 30 % — для долгосрочного (23). Периодичность контрольных осмотров зависит также от возраста пациента. Средний интервал в дерматоскопическом контроле составляет 20 месяцев (24) из-за вероятности развития медленно растущей меланомы (SGM).
Критерия для наблюдения отдельного новообразования являются асимметрия цвета, сетчатый рисунок и зоны регрессии (24). Ранние меланомы, выявленные цифровым методом, могут быть меньше в диаметре. Дерматоскопическим признаком при диагностике меланомы только лишь в контексте сравнительного исследования было небольшое увеличение диаметра очагов диаметром менее 2 мм (24).
В большом дерматоскопическом исследовании медленно растущей меланомы (25) дерматоскопическими признаками, предполагающими ее развитие, были недостаточные изменения диаметра и рост (75 % случаев) при наиболее медленном росте диаметра до 2 мм, разрушение более крупных структур, замена меланоцитарной сетки бесструктурными участками, появление новых цветовых оттенков (светло-коричневый исчезает, темно-коричневый появляется; такие цвета как красный, серый, черный и синий становятся более заметными) и новые дерматоскопические признаки меланомы, в том числе негативная сеть и сине-белая структура (25).
Выбор оптимального метода дерматоскопии
Иногда ошибка диагноза может произойти из-за небрежного использования дерматоскопии. Кроме упомянутых выше стандартных методов, для проведения дерматоскопического обследования с использованием ручного дерматоскопа важно правильно наносить иммерсионную жидкость во время дерматоскопического исследования в неполяризованном свете (2).
Вероятность ошибочного диагноза при выявлении узловой или бессимптомной меланомы может произойти из-за использования дерматоскопа с неполяризованным светом, тогда как блестящие белые полосы (кристаллы или кристаллические структуры) определяются дерматоскопами, использующими поляризованный свет (27).

Дерматоскоп Handyscope – устройство для мобильной цифровой дерматоскопии (FotoFinder)
Первое в мире устройство для цифровой теледерматоскопии, работающее на iOS и Android. В отличие от множества обычных дерматоскопов, handyscope соединяется с камерой мобильного устройства и использует специализированное программное обеспечение, включающее в себя оценку новообразований искусственным интеллектом, сервисы второго мнения и анализа клинических данных, а также сервисы защищенного облачного хранения дерматоскопических снимков.
Блестящие белые полосы указывают на злокачественность (отношение шансов: 10,534), особенно в случаях меланомы с инвазией, меланомы с высокой оценкой тотальной дерматоскопии (TDS) и тонких бессимптомных меланом (27). Кроме того, недостаточность архивных записей о предыдущих дерматоскопических обследованиях при контроле отдельных новообразований, а также невозможность определить новые очаги, неспособность оценить развитие наблюдаемых меланоцитарных новообразований, особенно медленно растущих меланом (24,25) или меланом in situ маленького диаметра, могут привести к тому, что меланома останется незамеченной.
Согласно Puig и Malvehi (28) дерматоскопическое обследование, тотальное фотографирование всего тела (TBD), цифровая дерматоскопия (DD) имеют важное значение для выявления меланомы. Цифровой контроль (DFU) у пациентов с диспластическими невусами позволяет выявить новые новообразования и изменения в существующих очагах (28).
Сочетание тотального фотографирования всего тела и цифровой дерматоскопии называется двухступенчатым методом цифрового контроля и способствует раннему выявлению меланомы на основе наблюдения макроскопических и дермоскопических изменений (29).
Ошибки, связанные с дефицитом знаний
В широком смысле ошибки, связанные с дефицитом знаний, включают диагностику и терапевтические решения, принятые в результате недостаточных знаний в области дерматоскопии. Неверный выбор новообразований для дерматоскопического обследования может быть связан с недостаточным пониманием дерматоскопического паттерна или структур, неспособностью отличить псевдоподии от периферических глобул, а также недостаток знаний различных алгоритмов дерматоскопического анализа (1, 2, 19, 30-32).
Каждый врач, выполняющий дерматоскопию, должен знать основные правила (контрольные списки): 3-точечное правило Argenziano (4, 33), 7-точечное итальянское правило (34), алгоритм, основанный на анализе паттерна («хаос и признаки») (35), австралийский метод Мензиса, 7 признаков меланомы или метод дерматоскопии Штольца и ABC-правило Блума (36), широко описанные в медицинской литературе в связи с их чувствительностью и специфичностью.
При применении правила ABCD для диагностики меланомы кожи чувствительность составляет 90,5 %, специфичность 72,4 % и диагностическая достоверность 78,1 % (36).
Результаты применения правила ABC показывают соответственно 90,5 %, 87 % и 88,1 %; метода Мензиса — 95,2 %, 77,8 %, 83,3 %; 7-признаков — 94 %, 74,6 % и 80,7 %, 7-точечного метода — 90,5 %, 87 % и 88,1 % (36). Чувствительность при использовании 3-точечного метода дерматоскопии достигает 89,6 % при 94,2 % специфичности (33).
В соответствии с 3-точечным методом следует уделить внимание асимметрии дерматоскопических правил и оценкой только лишь на основании одного из них, например, используя только правило ABCD Штольца. Поиск, например, кристаллических структур в неполяризованном свете — это не только техническая ошибка, но и ошибка, обусловленная дефицитом знаний.
Дерматоскопическая оценка отдельных немеланоцитарных новообразований должна основываться на общей структуре всего рисунка (зависит от выбранных паттернов) и локальных структурах (на основе выбранных дерматоскопических структур и признаков) и базироваться на расположении дерматоскопических структур, а не симметрии новообразования (4, 33). Также следует использовать другой нестандартный критерий — симптом «гадкого утенка» («ugly duckling» [37, 38] или симптом «fancy looking, так называемый признак «black sheep» [39]), а не только алгоритмы дерматоcкопического анализа.
Правило 4 х 4 х 6, предложенное Zalaudek и соавторами (19), позволяет клиницистам фиксировать общий паттерн и фак- торы, которые влияют на терапевтическое решение при установлении дерматоскопического диагноза отдельного меланоцитарного новообразования. Четыре дерматоскопических критерия связаны с цветом, паттерном, распределением пигмента и локализацией новообразования (19).
Шесть факторов, которые влияют на дерматоскопические действия, включают возраст, фототип кожи по Фицпатрику, историю болезни, воздействие ультрафиолета, беременность и динамику роста (19).
4 дерматоскопических критерия
| Черный | Глобульный | Многоочаговый | Акральные участки |
| Серый | Звездчатый | Необычный | Ногти |
| Коричневый | Сетчатый | Центральный | Лицо |
| Синий | Однородный синий |
Равномерный | Слизистая |
6 факторов
| Возраст | Воздействие ультрафиолета |
| Фототип кожи по Фицпатрику | Беременность |
| История болезни | Динамика роста |
Рисунок 2. Правило 4 х 4 х 6, предложенное Zalaudek и соавторами (19).
4 дерматоскопических критерия, распределенных по 4 подгруппам с 6 факторами, влияющими на терапевтическое решение, на основе дерматоскопии.
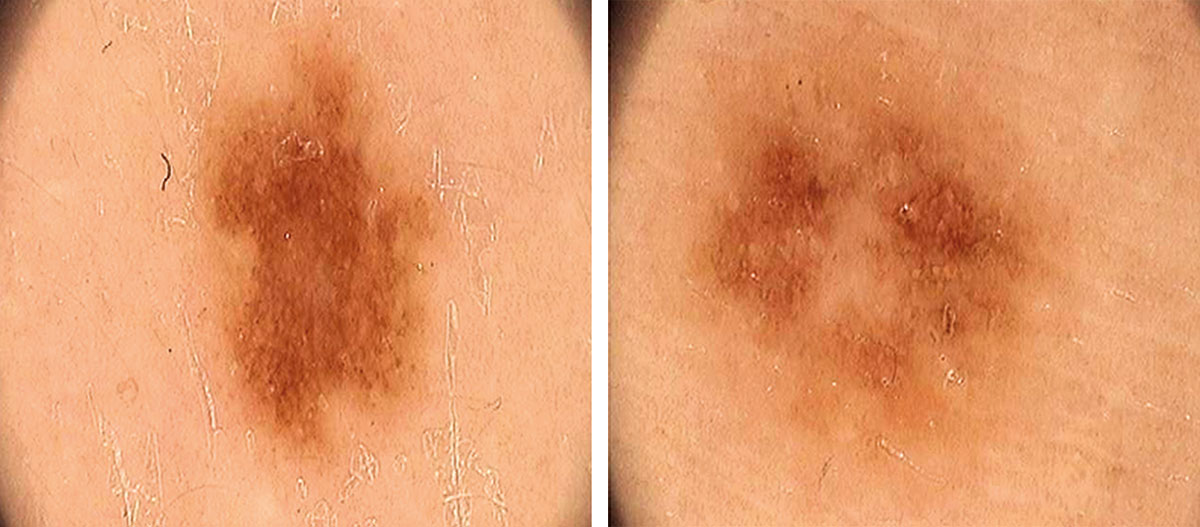
Рисунок 3. Два разных меланоцитарных новообразования у одного и того же пациента
в профиле, типичном для данного пациента
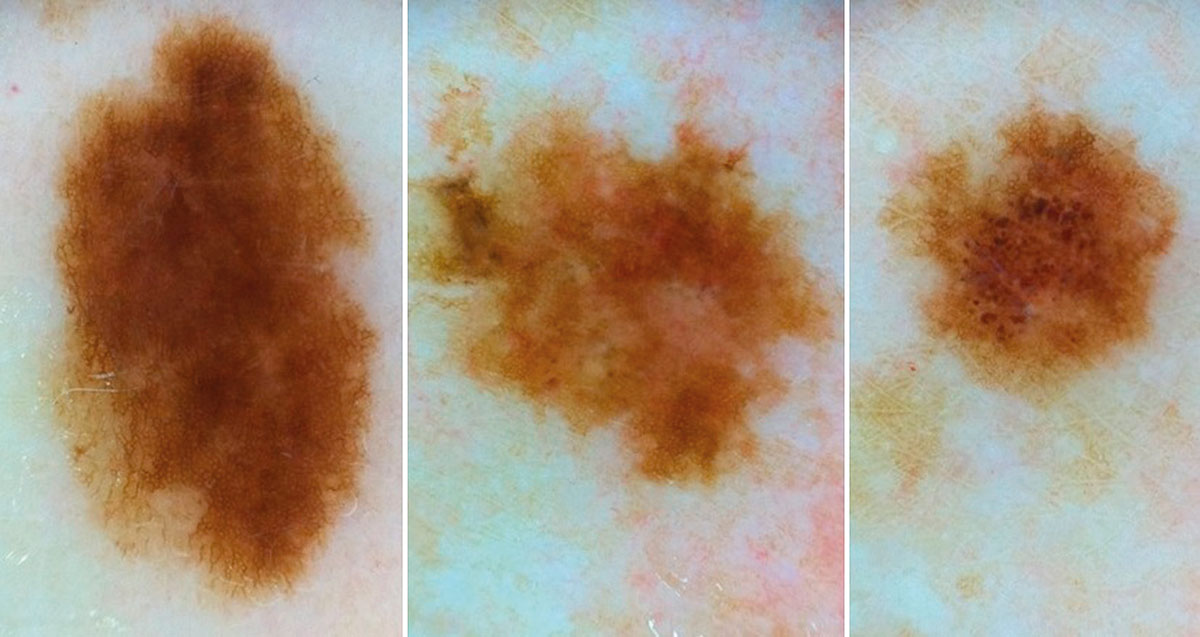
Рисунок 4. Три разных меланоцитарных новообразования у одного пациента
с дерматоскопическим профилем «подозрительное новообразование –
подлежит удалению». На деле «signature nevus», не подлежащие удалению
Правило 4 х 4 х 6, описанное ранее Zalaudek и соавторами (19), показано на Рисунке 2. В дифференциальном диагнозе меланоцитарных новообразований полезно определить так называемый профиль невуса, распространенный и характерный для большинства новообразований (6) (Рисунок 3).
Недостаточное знание критериев определения меланоцитарных новообразований и так называемых «signature nevus», характерных и индивидуальных для конкретного пациента (4) (Рисунок 4), может привести к ненужному хирургическому иссечению новообразований, которые кажутся подозрительными (например, выбор сразу 5–10 меланоцитарных новообразования для удаления во время одного обследования).
В настоящее время дерматоскопия позволяет выявлять меланому in situ диаметром менее 5 мм. В таких случаях стандартные дерматоскопические правила не работают и, следовательно, чрезвычайно важно понимать дерматоскопические признаки меланомы in situ (MIS).
Дерматоскопические признаки in situ меланом — это сетчатый рисунок, сине-серая сеть, многокомпонентная, очаговая, спитцоидная негативная сеть, сеть из глобул синего цвета и глобулярная сетчатая структура (41). Новым признаком меланомы in situ является также «mistletoe sign» (знак омелы) (42).
Меланома in situ, как правило, больше в диаметре, чем диспластический невус; атипичная сеть покрывает более половины площади, обычно присутствуют несколько типов пигментной сети, в центральной и периферийных зонах имеются бело-голубые участки регрессии (43).
В недавнем исследовании Seidenari и соавторов (44) из 22 микромеланом (диаметром менее 4 мм) 12 были определены как меланомы in situ с наиболее частым проявлением атипичной пигментной сети и нерегулярного цвета (44). В диагностике черных узелков должно применяться правило сине-черных точек.
Стандартный дерматоскопический критерий в комбинации с поиском синих и черных цветов в новообразовании дает 90,6 % точность и 92 % специфичность при выявлении узелковой меланомы (45). Предельно важным в дифференциальном дерматоскопическом анализе меланомы является понимание дерматоскопического изображения симулянтов меланомы (черного себорейного кератоза, синего невуса и многих других) (46-48).
Важно подчеркнуть, что терапевтические решения должны приниматься на основе правила 4 х 4 х 6 (19) и никогда на основе единственного дерматоскопического критерия. Что касается исследования Argenziano и соавторов (19), дерматоскопия повышает выявление ранней меланомы за счет трех главных аспектов: дерматоскопические признаки меланомы гораздо раньше выявляются при дерматоскопии, чем при клиническом обследовании; клиницисты чаще проверяют не просто подозрительные, а даже банально выглядящие новообразования и более тщательно наблюдают пациентов (49).
Полное обследование кожных покровов, наблюдение пациентов со множественными родинками, адекватная диагностика новообразований, требующих лечения; использование сравнительного подхода к пациентам с множественными невусами — это ключ к надлежащему выявлению меланомы и предотвращению базовых ошибок (49).
Таким образом, во избежание ошибочной диагностики меланомы Lallas и соавторы (5) рекомендовали обследовать все новообразования на коже, осматривать все участки тела, принимать 10-секундное решение (когда время обследования новообразования дольше, оно требует удаления), наблюдать пациентов со множественными меланоцитарными новообразованиями, всегда иссекать подозрительные узелковые новообразования и сочетать клинический критерий с дерматоскопическими, а также коррелировать клинические критерии с гистопатологическими (50).
В настоящее время дерматоскоп является незаменимым диагностическим инструментом для каждого врача, сравнимым со стетоскопом, который необходим для обследования физического состояния каждого пациента (51).
Конфликт интересов
Авторы не сообщают о конфликте интересов.
Список литературы
1. Kaminska-Winciorek G. Digital dermatology. Cornetis, Wrocław 2008.
2. Kaminska-Winciorek G, Spiewak R. Basic dermoscopy of melanocytic lesions for beginners. Postepy Hig Med Dosw (Online) 2011; 65: 501-8.
3. Zalaudek I, Kittler H, Marghoob AA, et al. Time required for a complete skin examination with and without dermoscopy: a prospective, randomized multicenter study. Arch Dermatol 2008; 144: 509-13.
4. Zalaudek I, Argenziano G, Soyer HP, et al. Dermoscopy Working Group. Three-point checklist of dermoscopy: an open internet study. Br J Dermatol 2006; 154: 431-7.
5. Blum A, Hofmann-Wellenhof R, Luedtke H, et al. Value of the clinical history for different users of dermoscopy compared with results of digital image analysis. J Eur Acad Dermatol Venereol 2004; 18: 665-9.
6. Argenziano G, Cacitrala C, Argido M. Dermoscopy of patients with multiple nevi: improvement management recommendations using a comparative diagnostic approach. Arch Dermatol 2011; 147: 46-9.
7. Kaminska-Winciorek G, Spiewak R. Tips and tricks in the dermoscopy of pigmented lesions. BMC Dermatol 2012; 12: 14.
8. Giacomel J, Zalaudek I, Mordente I, et al. Never perform laser treatment of skin tumors with clinical “EFG” criteria. J Dtsch Dermatol Ges 2008; 6: 386-8.
9. Fernandez EM, Helm KF. The diameter of melanomas. Dermatol Surg 2004; 30: 1219-22.
10. Abbasi NR, Yankowitz M, Gutkowicz-Krusin D, et al. Utility of lesion diameter in the clinical diagnosis of cutaneous melanoma. Arch Dermatol 2008; 144: 469-74.
11. Goldsmith SM. A series of melanomas smaller than 4 mm and implications for the ABCDE rule. J Eur Acad Dermatol Venereol 2007; 21: 929-34.
12. Helsing P, Loeb M. Small diameter melanoma: a follow-up of the Norwegian Melanoma Project. Br J Dermatol 2004; 151: 1081-3.
13. De Giorgi V, Savarese I, Rossari S, et al. Features of small melanocytic lesions: does small mean benign? A clinical-dermoscopic study. Melanoma Res 2012; 22: 252-6.
14. Bono A, Bartoli C, Baldi M, et al. Micro-melanoma detection. A clinical study on 22 cases of melanoma with a diameter equal to or less than 3 mm. Tumori 2004; 90: 128-31.
15. Pupelli G, Longo C, Veneziano L, et al. Small-diameter melanocytic lesions: morphological analysis by means of in vivo confocal microscopy. Br J Dermatol 2013; 168: 1027-33.
16. Argenziano G, Zalaudek I, Hofmann-Wellenhof R, et al. Total body skin examination for skin cancer screening in patients with focused symptoms. J Am Acad Dermatol 2012; 66: 212-9.
17. Argenziano G, Cerroni L, Zalaudek I, et al. Accuracy in melanoma detection: a 10-year multicenter survey. J Am Acad Dermatol 2012; 67: 54-9.
18. Chen L, Dusza S, Grazzini M, et al. Redefining the number needed to excise. Australas J Dermatol 2013; 54: 310-2.
19. Zalaudek I, Docimo G, Argenziano G. Using dermoscopic criteria and patient-related factors for the management of pigmented melanocytic nevi. Arch Dermatol 2009; 145: 816-26.
20. Orpin SD, Preston PW, Salim A. The ‘St Tropez’ sign: a new dermoscopic feature of seborrheic keratoses? Clin Exp Dermatol 2006; 31: 707-9.
21. Hofmann-Wellenhof R, Wolf P, Smolle J, et al. Influence of UVB therapy on dermoscopic features of acquired melanocytic nevi. J Am Acad Dermatol 1997; 37: 559-63.
22. Kaminska-Winciorek G. Dermatoscopy of melanocytic lesions: an influence of ultraviolet radiation. Przegl Dermatol 2008; 95: 463-7.
23. Argenziano G, Mordente, I Ferrara G. Dermoscopic monitoring of melanocytic lesions: clinical outcome and patients compliance vary according to follow-up protocols. Br J Dermatol 2008; 159: 331-6.
24. Argenziano G, Kittler H, Ferrara G, et al. Slow-growing melanoma: a dermoscopy follow-up study. Br J Dermatol 2010; 162: 267-73.
25. Terushkin V, Dusza SW, Scope A, et al. Changes observed in slow-growing melanomas during long- term dermoscopic monitoring. Br J Dermatol 2012; 166: 1213-20.
26. Jaimes N, Marghoob AA. The morphologic universe of melanoma. Dermatol Clin 2013; 31: 599-613.
27. Shitara D, Ishioka P, Alonso-Pinedo Y. Shiny white streaks: a sign of malignancy at dermoscopy of pigmented skin lesions. Acta Derm Venereol 2014; 94: 132-7.
28. Puig S, Malvehy J. Monitoring patients with multiple nevi. Dermatol Clin 2013; 31: 565-77.
29. Salerni G, Carrera C, Lovatto L, et al. Characterization of 1152 lesions excised over 10 years using total body photography and digital dermatoscopy in the surveillance of patients at high risk for melanoma. J Am Acad Dermatol 2012; 67: 836-45.
30. Soyer HP, Argenziano G, Ruocco V, et al. Dermoscopy of pigmented skin lesions. Eur J Dermatol 2001; 11: 270-6.
31. Zalaudek I, Kreusch J, Giacomel J, et al. How to diagnose nonpigmented skin tumors: a review of vascular structures seen with dermoscopy: part II. Nonmelanocytic skin tumors. J Am Acad Dermatol 2010; 63: 377-86.
32. Zalaudek I, Manzo M, Savarese I, et al. The morphologic universe of melanocytic nevi. Semin Cutan Med Surg 2009; 28:149-56.
33. Soyer HP, Argenziano G, Zalaudek I, et al. Three-point checklist of dermoscopy. A new screening method for early detection of melanoma. Dermatology 2004; 208: 27-31.
34. Argenziano G, Catricalà C, Ardigo M, et al. Seven-point checklist of dermoscopy revisited. Br J Dermatol 2011; 164: 785-90.
35. Kittler H. Dermatoscopy: introduction of a new algorithmic method based on pattern analysis for diagnosis of pigmented skin lesions. Dermatooncology: Dermatol Pract Concept 2007; 13: 1.
36. Blum A, Rassner G, Garbe C. Modified ABC-point list of dermoscopy: a simplified and highly accurate dermoscopic algorithm for the diagnosis of cutaneous melanocytic lesions. J Am Acad Dermatol 2003; 48: 672-8.
37. Carli P, Chiarugi A, de Giorgi V. Examination of lesions (including dermoscopy) without contact with the patient is associated with improper management in about 30% of equivocal melanomas. Dermatol Surg 2005; 31: 169-72.
38. Scope A, Dusza SW, Halpern AC, et al. The “ugly duckling” sign: agreement between observers. Arch Dermatol 2008; 144: 58-64.
39. Thomas L. Braun R. Atlas of dermatoscopy. Urban & Partner, Wrocław 2008.
40. Argenziano G, Albertini G, Castagnetti F, et al. Early diagnosis of melanoma: what is the impact of dermoscopy? Dermatol Ther 2012; 25: 403-9.
41. Seidenari S, Bassoli S, Borsari S, et al. Variegated dermoscopy of in situ melanoma. Dermatology 2012; 224: 262-70.
42. Kaminska-Winciorek G, Właszczuk P, Wydmański J. “Mistletoe sign” probably a new dermoscopic descriptor fro melanoma in situ and melanocytic junctional nevus in the inflammatory stage. Postep Derm Alergol 2013; 30: 316-9.
43. Seidenari S, Ferrari C, Borsari S, et al. The dermoscopic variability of pigment network in melanoma in situ. Melanoma Res 2012; 22: 151-7.
44. Seidenari S, Ferrari C, Borsari S, et al. Dermoscopy of small melanomas: just miniaturized dermoscopy? Br J Dermatol 2014; 171: 1006-13.
45. Argenziano G, Longo C, Cameron A, et al. Blue-black rule: a simple dermoscopic clue to recognize pigmented nodular melanoma. Br J Dermatol 2011; 165: 1251-5.
46. Kaminska-Winciorek G, Wydmanski J. Benign simulator of melanoma on dermoscopy-black colour does not indicate always melanoma. J Preclin Clin Res 2013; 1: 6-12.
47. Kaminska-Winciorek G. Letter: “Blue pseudo-veil sign” – a new dermoscopic term? Dermatol Surg 2012; 38: 1574-5.
48. Kamińska-Winciorek G, Spiewak R. Dermoscopy on nevus comedonicus: a case report and review of the literature. Postepy Dermatol Alergol 2013; 30: 252-4.
49. Argenziano G, Albertini G, Castagnetti F, et al. Early diagnosis of melanoma: what is the impact of dermoscopy? Dermatol Ther 2012; 25: 403-9.
50. Lallas A, Zalaudek I, Apalla Z, et al. Management rules to detect melanoma. Dermatology 2013; 226: 52-60.
51. Zalaudek I, Lallas A, Moscarella E, et al. The dermatologist’s stethoscope-traditional and new applications of dermoscopy. Dermatol Pract Concept 2013; 3: 67-71.
Современная эпидемиологическая ситуация по злокачественным новообразованиям кожи в Российской Федерации характеризуется прогредиентным ростом заболеваемости населения раком кожи и меланомой; увеличением доли злокачественных новообразований (ЗНО) кожи в структуре общей онкологической заболеваемости и сохранением в ней лидирующих позиций, особенно среди женского населения и лиц старше 60 лет; высокими показателями среднегодовых темпов прироста и общего прироста за период 2003–2013 гг., в 2 раза превышающими аналогичные показатели по всей онкологической заболеваемости.
В 2013 г. в РФ было выявлено 75 112 новых случаев ЗНО кожи (С43, С44, С46.0), из них 8974 меланомы (С43) и 66 138 других новообразований кожи. Среди всех ЗНО кожи удельный вес меланомы составил 11,95%, рака кожи — 88,05% [1, 2].
Результаты анализа состояния диагностики ЗНО кожи в РФ свидетельствуют о сохраняющейся проблеме несвоевременной диагностики меланомы. На I стадии опухолевого процесса в 2013 г. было выявлено лишь 29,9% больных. Только каждый пятый больной (19,1%) выявляется активно, каждый четвертый (23,8%) — в запущенных (III, IV) стадиях опухолевого процесса, что сохраняет показатель первогодичной летальности на высоком для опухолей визуальной локализации уровне (12,3% больных меланомой погибают в течение одного года с момента установления диагноза).
Среди задач, предусмотренных национальной онкологической программой [3], — увеличение показателей выявляемости больных на ранних стадиях злокачественного процесса и, как следствие, снижение смертности и инвалидности населения от злокачественных новообразований. Одной из приоритетных задач является обеспечение диагностики опухолевых заболеваний визуальных локализаций, в том числе меланомы кожи (МК), на ранних стадиях.
Данные официальной статистики, некоторых публикаций и собственные клинические наблюдения свидетельствуют о том, что нередко больной со злокачественным новообразованием кожи несвоевременно обращается к врачу, когда опухоль имеет уже распространенный характер (глубокий уровень инвазии, иногда метастазы), либо длительное время наблюдается у врачей общей лечебной сети, дерматологов, косметологов, хирургов с ошибочным диагнозом и, как следствие, получает неадекватную терапию, в ряде случаев стимулирующую дальнейший злокачественный рост [4–9]. Качество диагностики злокачественных новообразований кожи, особенно ранних форм, нельзя признать удовлетворительным [10–12].
Наибольшее значение в диагностике МК имеют квалификация и опыт врача первичного контакта [13]. Однако частота клинической диагностики опухолей кожи врачами общей лечебной сети невысока и находится на уровне 29,9% [6, 14]. Было установлено, что каждый десятый больной с меланомой на своем диагностическом маршруте проходил через 3–5 инстанций, 17,4% пациентов на догоспитальном этапе получали неадекватное лечение, а 7,9% больных были признаны здоровыми.
Проведенный нами анализ запущенных случаев меланомы показал, что они в равной степени обусловлены как поздним обращением пациентов к врачу (49,5%), так и врачебными ошибками в клинической диагностике на «доонкологическом» амбулаторно-поликлиническом этапе диагностического маршрута больных (50,5%) [6].
Ошибки в диагностике МК по своим последствиям наиболее трагичны. О значительном количестве диагностических ошибок на различных уровнях оказания медицинской помощи пациентам (от первичного обращения пациента к врачу до дальнейшего его наблюдения в поликлиниках и районных больницах как общего, так и дерматовенерологического профиля) свидетельствует высокий удельный вес больных с меланомой, выявляемых на поздних (III–IV) стадиях опухолевого процесса.
Частота ошибок клиницистов в распознавании меланомы варьирует от 18% до 81%, при этом даже первичное гистологическое исследование дает до 20–30% ошибочных результатов [8, 15]. Это влечет за собой неадекватную тактику лечения, приводит к появлению запущенных случаев и неблагоприятному исходу, что недопустимо для опухолей визуальной локализации. Так, по наблюдениям О. М. Конопацковой [4] неправильная тактика врачей при амбулаторном обследовании и лечении больных с пигментными новообразованиями на коже (хирургическое вмешательство при отсутствии пред- и послеоперационной цитологической и гистологической верификации) привела в тому, что у 63,6% пациентов была констатирована диссеминация опухолевого процесса в течение первого года после радикального удаления меланомы.
При раннем выявлении МК, когда толщина новообразования не превышает 0,76 мм (по Breslow), пятилетняя выживаемость наблюдается практически у 95% больных [6, 14, 16–18]. В связи с этим основные задачи современной клинической медицины в отношении МК заключаются в ее ранней диагностике и первичной профилактике, что требует информационного обеспечения разрабатываемых профилактических программ. Последнее обусловлено, во-первых, недостаточным уровнем дерматоонкологических знаний и онкологической настороженности врачей «неонкологических» специальностей, в том числе врачей общей практики, во-вторых, рядом объективных причин, связанных с трудностью клинической диагностики беспигментных и акральных меланом.
В повседневной практике не только дерматологу, но и врачам других специальностей часто приходится встречаться с разнообразными пигментированными новообразованиями кожи, требующими особого внимания и адекватной диагностической тактики. Некоторые авторы [19] считают, что на этапе дифференциальной диагностики каждое пигментное новообразование на коже следует рассматривать как потенциальную меланому.
Экспертный анализ клинических диагнозов, установленных больным с МК на догоспитальных этапах их диагностического маршрута, позволил определить наиболее типичные варианты диагностических ошибок. Нередко при МК ставится ошибочный диагноз «фиброма», «себорейный кератоз», «ангиокератома» и другие, что влечет за собой последующую неадекватную лечебную тактику. Проводится либо хирургическое иссечение новообразования в неадекватных границах под местной инфильтрационной анестезией, часто без последующего гистологического исследования, либо удаление новообразования деструктивными методами (диатермокоагуляция, криодеструкция, лазерная аблация) у хирургов, дерматологов или косметологов. Причиной подобных ошибочных действий врача является, по-видимому, абсолютная уверенность в доброкачественности новообразования, основанная на отсутствии или слабо выраженной пигментации опухоли, а также ошибочный, но часто встречающийся среди врачей клинический стереотип, ассоциирующий степень выраженности пигментации новообразования кожи с его злокачественностью, при этом не учитывается возможность развития беспигментных форм меланомы (рис. 1).
Действительно, в большинстве случаев (в 75–80%) визуальная окраска первичной меланомы интенсивно коричневая или черная [6, 14], но в 15,8–16,4% случаев наблюдается розовый цвет (рис. 2), в 7,3% — светло-коричневый (рис. 1), что дезориентирует врача и приводит к диагностическим ошибкам. Последнее убедительно иллюстрируют два клинических наблюдения.
Больной Р., 23 лет. An. morbi: на коже правой надлопаточной области с детства было опухолевидное образование кожи телесного цвета. В течение последних 3–4 месяцев заметил быстрое его увеличение. Наблюдался у дерматолога по месту жительства с диагнозом: «Папиллома кожи спины? Ангиофиброма».
В связи с увеличением размеров другого пигментного новообразования на коже в поясничной области был направлен на консультацию в онкологическое учреждение. Status localis: при клиническом осмотре онкологом: на коже правой надлопаточной области имеется экзофитный папилломатозный очаг розового (!) цвета, неправильной формы с четкими контурами, размером 1,5 × 2 см, безболезненный, эластичный с эрозированной поверхностью, без признаков воспаления. На коже в области поясницы — гиперпигментированная куполообразная папула неправильных очертаний, размером 5 × 8 мм в диаметре, коричневого цвета. Регионарные лимфоузлы не увеличены.
С диагностической целью проведено широкое хирургическое иссечение указанных новообразований под общей анестезией.
Результаты послеоперационного гистологического исследования: в надлопаточной области — эпителиоидный вариант меланомы с изъязвлением, развившейся на фоне меланоцитарного невуса, III стадия инвазии по Breslow. В поясничной области — внутридермальный меланоцитарный невус.
Больной Г., 70 лет. An. morbi: cчитает себя больным с момента, когда заметил появление и быстрое увеличение «пятна» красновато-коричневого цвета на коже нижней трети левого плеча, которое было с детства. Скоро, со слов больного, вокруг пятна появилось воспаление и новые темные мелкие «родинки». Обратился к дерматологу, который с диагнозом «фурункул плеча» направил пациента на лечение к хирургу по месту жительства. С диагнозом «фурункул плеча» в течение месяца лечился у хирурга амбулаторно (перевязки с мазью Вишневского). Процесс прогрессировал, в области очага появилась кровоточивость, постоянно образовывались геморрагические корочки. Направлен на консультацию в онкологический диспансер.
Status localis: при осмотре в поликлинике: на коже нижней трети левого плеча имеется новообразование диаметром до 1,5 см ярко-розового (!) цвета, в центре — наслоение геморрагических корочек, перифокально — воспаление (гиперемия, отечность) и мелкие пигментированные узелковые высыпания. Подмышечные лимфоузлы слева увеличены до 1,5 см, эластичные, подвижные.
С подозрением на меланому госпитализирован в хирургическое отделение, где проведено широкое хирургическое иссечение опухоли. Результат послеоперационного патоморфологического исследования: беспигментная меланома веретеноклеточного типа; инвазия всех слоев дермы до подкожной клетчатки. Окончательный диагноз: меланома нижней трети левого плеча — pT4N0M0 (III ст.).

Проведенный нами анализ визуальной окраски первичных МК у 105 пациентов также показал, что в 82,9% случаев наблюдалась типичная окраска опухоли (коричневая, черная). Но у 17,1% больных МК была нетипичного цвета (телесного, всех оттенков розового, вишневого) (рис. 2). Среди жителей г. Екатеринбурга беспигментные меланомы составили 15,9% случаев [20]. При этом у больных с МК, возникшей на клинически неизмененной коже (de novo), беспигментная форма опухоли регистрировалась в 2,2 раза чаще, чем в случаях развития меланом на фоне меланоцитарных невусов.
Данные других отечественных авторов также свидетельствуют о том, что клинически беспигментные меланомы регистрируются нередко, в 7–10% случаев [6, 14]. Это имеет большое клиническое значение, так как наибольшие объективные трудности в клинической диагностике возникают именно при беспигментной меланоме. Кроме того, существует мнение, что отсутствие пигмента в опухоли имеет и определенное прогностическое значение. Установлено, что клетки меланомы, в которых образование пигмента резко снижено, являются менее дифференцированными, а значит, более злокачественными. Возможно, именно этим обусловлено наличие прямой линейной корреляции между степенью пигментации первичной меланомы и сроками выживаемости больных [14].
Проведенный нами детальный анализ диагностического маршрута 18 больных с беспигментной МК показал, что лишь в 1 случае диагноз был поставлен своевременно — при локализации опухолевого очага на лице, который был клинически расценен как базалиома, и в связи с этим пациент был своевременно направлен к онкологу. В остальных случаях на предыдущих этапах клинической диагностики у хирургов и дерматологов, к которым первично обратились пациенты, беспигментная МК расценивалась как фиброма, гемангиома, пиогенная гранулема, ангиокератома, фурункул, гигрома, трофическая язва, организованный тромбофлебит. В соответствии с этими диагнозами больные получали разнообразную терапию, в том числе с использованием деструктивных методов лечения (криодеструкция, электрокоагуляция) или хирургического иссечения в неадекватных границах с применением местной инфильтрационной анестезии. В результате на момент установления правильного диагноза лишь у 2 (11,1%) больных глубина инвазии меланомы соответствовала II уровню по Breslow. В остальных случаях (88,9%) при послеоперационном патоморфологическом исследовании выявлен III–V уровень инвазии (III — 11,1%, IV — 55,6%, V — 22,2%). Ранние клинические стадии заболевания (I–II) были лишь у 3 (16,7%) больных, у остальных (15 человек, 83,3%) выявлены III–IV стадия с регионарными метастазами в лимфоузлы и мягкие ткани (13 пациентов) и генерализацией опухолевого процесса (2 больных). Среди больных беспигментной меланомой преобладали женщины (72,2%) и акральная локализация опухоли регистрировалась в 2 раза чаще (22,2%), чем в целом среди всех больных с МК (10,5%).
Подногтевые варианты меланомы кожи в начальной стадии опухолевого процесса клинически выглядят как меланонихия. Во всех наблюдаемых некоторыми авторами случаях подногтевых меланом имел место частичный или полный лизис ногтевого матрикса, в 76% — имелись экзофитные, бугристые разрастания, в каждом втором случае поражения носили амеланотический характер [8, 13].
По нашим данным при акральных лентигинозных меланомах в два раза чаще, чем при других локализациях, встречаются беспигментные формы, что объективно затрудняет процесс клинической диагностики. Поэтому визуально беспигментные меланомы подошв нередко проходили под клиническими «масками» очагового гиперкератоза, «сухой» мозоли, подошвенной бородавки. Приводим клиническое наблюдение.
Больной Б., 52 года. An. morbi: cчитает себя больным в течение двух лет, когда появилась «сухая мозоль» на подошвенной поверхности правой стопы в проекции II–III плюсневых костей. Периодически лечился у дерматолога, применял кератолитические пластыри, мази, горячие ванны для ног с последующим срезанием распаренной «мозоли». В дальнейшем в этой области, со слов больного, появилось «темное пятно, которое стало кровоточить». Через 7–8 месяцев развился отек стопы и нижней трети голени, сопровождающийся общим повышением температуры. Обратился к хирургу. Диагностировано «рожистое воспаление», назначено лечение антибиотиками, локально — УФ-облучение. Через 3 месяца заметил увеличение паховых лимфоузлов справа. Только после этого с подозрением на онкопатологию был направлен в онкологический диспансер.
Status localis: на подошвенной поверхности правой стопы в проекции II и III плюсневых костей экзофитное новообразование с багрово-сероватой кровоточащей язвой размером до 2 см. Стопа отечна, кожа гиперемирована. В правой паховой области пальпируется несколько увеличенных лимфоузлов размером от 0,5 до 2,5 см, болезненных, смещаемых.
Проведено хирургическое иссечение опухоли и операция Дюкена.
Результат послеоперационного патоморфологического исследования: в коже — изъязвившаяся эпителиоидноклеточная меланома, III стадия инвазии по Breslow. Метастазы в трех паховых лимфоузлах, в кожном лоскуте бедра и брюшной стенки с их полным замещением опухолевой тканью. Больному назначена полихимиотерапия.
Довольно часто (до 25,0% случаев) на амбулаторных этапах диагностики акральная меланома ошибочно принимается за пиогенную гранулему. Это доброкачественное сосудистое новообразование кожи, возникая чаще именно на акральных участках, как правило, после механической травматизации на клинически неизмененной коже в процессе эволюции может изменить свой типичный красновато-вишневый цвет на фиолетово-синий и даже интенсивный темно-коричневый оттенок. При этом кровоточивость новообразования, появление вследствие этого на его поверхности геморрагических корок, присоединение вторичной инфекции и обусловленное этим наличие признаков воспаления действительно создает значительные объективные трудности для визуальной дифференциальной диагностики. Поэтому в случаях отсутствия надежных дифференциально-диагностических критериев единственно правильным тактическим решением врача, не владеющего методом дерматоскопии, является направление больного к более опытному дерматологу для проведения дополнительного обследования с использованием неинвазивных методов (дерматоскопии, спектрофотометрического интрадермального анализа, конфокальной микроскопии), либо в онкологическое учреждение, где в зависимости от конкретной клинической картины будут проведены дополнительные, адекватные клинической ситуации диагностические исследования с целью уточнения диагноза.
Приводим клиническое наблюдение:
Больная Ш., 30 лет. An. morbi: считает себя больной с момента, когда на тыльной поверхности V пальца левой стопы после механической травмы появился узелок розоватого цвета, который в течение последующих 6 месяцев стал увеличиваться в размерах. Обратилась к дерматологу. С диагнозом: «Пиогенная гранулема?» направлена к хирургу по месту жительства, где под местной анестезией проведено хирургическое иссечение новообразования без последующего гистологического исследования. Через 2 месяца вновь заметила рост «узелка». Хирургом проведена лазерная деструкция, после чего начался быстрый рост новообразования, в связи с чем больная направлена в онкологический центр.
Status localis: на коже тыльной поверхности основной фаланги V пальца левой стопы опухолевидное образование ярко-розового (!) цвета размером 1,0 × 0,5 × 1,5 см, плотно-эластической консистенции, кожа вокруг не изменена. Регионарные лимфоузлы не пальпируются. Предварительный диагноз: «Пиогенная гранулема? Беспигментная меланома?». С диагностической целью проведена ампутация V пальца левой стопы.
Результат патоморфологического исследования послеоперационного материала: беспигментная меланома, IV уровень инвазии по Breslow (pT3N0M0).
Рассматривая проблему ошибок в диагностике МК, следует отметить, что гипердиагностика также встречается довольно часто, но она не влечет столь трагических последствий, как гиподиагностика, которая всегда связана с ухудшением прогноза течения заболевания и риском для жизни больного.
В заключение следует подчеркнуть, что систематический анализ причин позднего выявления злокачественных новообразований кожи, особенно меланомы, клинических и тактических ошибок врачей неонкологического профиля, их обсуждение на совместных с онкологами врачебных конференциях или заседаниях научно-практических обществ будут способствовать формированию онкологической настороженности и более ранней диагностике злокачественных опухолей кожи.
Литература
- Состояние онкологической помощи населению России в 2013 году / Под ред. Каприна А. Д., Старинского В. В., Петровой Г. В. ФГБУ «МНИОИ» им. П. А. Герцена МЗ России, Росс. центр информац. технол. и эпидемиол. исслед. в области онкологии. М., 2014, 235 с.
- World Healthcare Organization. Ultraviolet radiation and the INTERSUN Programme. http://www.who.int/uv/faq/skincancer/en/index1.html (visited on 09-Aug-2013).
- Чиссов В. И., Старинский В. В., Петрова Г. В. Злокачественные новообразования в России в 2009 г. (заболеваемость и смертность). М.: ФГУ «МНИОИ им. П. А. Герцена Минздравсоцразвития России», 2011.
- Конопацкова О. М. Лечение меланом кожи в амбулаторных условиях // Росс. онколог. журн. 2006. № 3. С. 38–41.
- Конопацкова О. М., Оркин В. Ф., Завьялов А. И. Акральная лентигинозная меланома кожи, сочетающаяся с микотической инфекцией стоп и ногтей // Журн. дермато-венерол. и косметол. 1996. № 1. С. 35–36.
- Малишевская Н. П. Ошибки в клинической диагностике злокачественных новообразований кожи. В кн.: Кунгуров Н. В., Малишевская Н. П., Кохан М. М., Игликов В. А. Злокачественные новообразования кожи: заболеваемость, ошибки диагностики, организация раннего выявления, профилактика. Курган: Изд-во «Зауралье», 2010. С. 125–149.
- Молочков В. А. Меланоцитарные невусы и их связь с меланомой // Росс. журн. кож. вен. болезней. 1998. № 2. С. 68–76.
- Селюжицкий И. В., Анфилов С. В., Мурзо А. В. Ошибки в диагностике и лечении подногтевой меланомы // Росс. онкол. журн. 2004. С. 33–34.
- Хлебникова А. Н., Кладова А. Ю., Кириченко Н. А., Сарханн В. С. К проблеме гигантских базалиом // Клин. дерматол. и венерол. 2007. № 1. С. 9–12.
- Гельфонд М. Л. Дифференциальная диагностика опухолей кожи в практике дерматологов и косметологов // Практическая онкология. 2012, т. 13, 2.
- Кубанова А. А., Мартынов А. А. Место злокачественных новообразований кожи в структуре онкологической заболеваемости населения Российской Федерации // Вестник дерматологии и венерологии. 2007, № 6.
- Rigel D. S. Epidemiology of melanoma // Seminars in cutaneous medicine and surgery. 2010, № 12.
- Фрадкин С. З., Залуцкий И. В. Меланома кожи. Минск: Беларусь, 2000. 221 с.
- Анисимов В. В., Вагнер Р. И., Барчук А. С. Меланома кожи. Ч. 1. Эпидемиология, этиология, патогенез, профилактика. СПб: Наука, 1995. 151 с.
- Ильин И. И. Необычный случай гигантской меланомы // Вестн. дерматол. и венерол. 1992. № 5. С. 31–36.
- Паршикова С. М. Опухолеподобные процессы (невусы) и опухоли из пигментообразующей ткани (меланомы). В кн.: Патологоанатомическая диагностика опухолей человека. Рук-во для врачей в двух томах / Под ред. Н. А. Краевского, А. В. Смольянинова, Д. С. Саркисова. М.: Медицина, 1993. Т. 2. С. 558–587.
- Piteiro A. B., Perez-Espana L., Hervella M. et al. Giant basal cell carcinoma // J. Dermatol. 2003; 30: 7: 573–575.
- Takemoto S., Fukamizu H., Yamanaka K. et al. Giant basal cell carcinoma: improvement in the quality of life after extensive resection // Scand J Plast Reconstr Surg Hand Surg. 2003; 37: 3: 181–185.
- Имянитов Е. Н. Эпидемиология и биология опухолей кожи // Практическая онкология. 2012; 13 (2): 61–68.
- Соколова А. В. Клиническая дифференциальная диагностика меланоцитарных невусов кожи с применением метода поверхностной дерматоскопии: Автореф. дисс. … к.м.н. Екатеринбург, 2003. 25 с.
Н. П. Малишевская*, 1, доктор медицинских наук, профессор
А. В. Соколова**, кандидат медицинских наук
* ГБУ СО УрНИИДВиИ, Екатеринбург
** Kлиника «Уральская», Екатеринбург
1 Контактная информация: orgotdel_2008@mail.ru