Туберкулез органов дыхания – одна из самых актуальных проблем здравоохранения в мире и в Российской Федерации. Заболеваемость населения РФ туберкулезом с 1991 г. увеличилась на 150% и в 2002 г. составила 88,1 на 100 тыс. населения. Смертность от туберкулеза увеличилась за этот период почти в 3 раза [1]. Высок процент поздней диагностики туберкулеза легких в лечебных учреждениях общей лечебной сети. В этих случаях только у около 20% больных туберкулезом легких заболевание диагностируют в первые 2–3 недели заболевания, а у остальных 80% – в сроки от 1 до 3 мес. Расхождение диагнозов по туберкулезу у умерших в нетуберкулезных больницах достигает 80% и более. По данным А.Г. Хоменко, особенно часты диагностические ошибки при абациллярных формах туберкулеза. Известно также, что у больных активным туберкулезом органов дыхания микобактерии туберкулеза в мазках мокроты в первые 2–3 недели болезни нередко не обнаруживаются, особенно у больных казеозной пневмонией, и при отсутствии деструктивных изменений в легких [2].
Поскольку основой диагностики туберкулеза служит обнаружение микобактерии туберкулеза (МОТ), приведем сравнительную характеристику методов их обнаружения. При бактериоскопии мазка, окрашенного по Цилю–Нильсену, МБТ могут быть обнаружены при наличии не менее 100.000 –1.000.000 бактериальных клеток в 1 мл патологического материала. Такое значительное количество МБТ встречается при распространенных, преимущественно легочных формах заболевания (диссеминированная, фиброзно–кавернозная, цирротическая). Методы накопления (флотация) повышают выявляемость МБТ по сравнению с обычной микроскопией на 10%. Люминесцентная микроскопия при туберкулезе в настоящее время является эффективным бактериоскопическим методом лабораторной диагностики, широко применяющимся в микробиологических лабораториях Российской Федерации. Чувствительность метода люминесцентной микроскопии 10.000 – 100.000 МБТ в 1 мл материала [8].
Культуральный метод выявления МБТ дает положительные результаты при наличии в исследуемом материале от 20 до 100 жизнеспособных микробных клеток в 1 мл. Однако он трудоемок и длителен в связи с тем, что МБТ являются в основном медленно растущими организмами и рост их колоний наблюдают в течение 2–3 месяцев. Для увеличения результативности культурального метода рекомендуется применять посев материала одновременно на две–три различных питательных среды. Продолжительность роста МБТ ограничивает диагностические возможности клиницистов. МБТ выявляются лишь при 52–65% случаев активного туберкулеза легких, а в клинике внелегочного туберкулеза удельный вес их выявления еще ниже. Значительные трудности представляет обнаружение микобактерий у лиц со скудным их выделением. Среди впервые выявленных больных у одной трети бактериовыделение является однократным. Культуральный метод позволяет проводить определение чувствительности и устойчивости МБТ к противотуберкулезным антибиотикам [8].
За рубежом широкое распространение получила радиометрическая система ВАСТЕС для быстрого обнаружения живых МБТ в жидкой питательной среде. Микобактерии культивируют в жидкой ВАСТЕС–среде, где в качестве источника углерода используется меченая 14С пальмитиновая кислота. При положительных данных бактериоскопического исследования рост МБТ обнаруживали радиометрически на 7–10–й день и на 14–21–й дни при отрицательных данных. К недостаткам этого метода, ограничивающим возможность его широкого применения, относятся: высокая себестоимость исследования; необходимость применения радиоактивных изотопов и специального радиометрического оборудования, сложность работы с изотопной технологией; необходимость дополнительного посева на плотную питательную среду при возникновении проблем с идентификацией или интерпретацией результатов.
Метод ПЦР основан на ферментативной амплификации выбранных специфических участков генома бактерий рода Mycobacterium tuberculosis, их дальнейшей детекции и идентификации. Аналитическая чувствительность метода очень высока и соответствует выявлению 1–10 бактериальных клеток. Чувствительность метода достигает 74–92%, специфичность 92–100%. На эффективность ПЦР–анализа существенным образом влияет метод обработки клинического материала [3]. В ПЦР–диагностике туберкулеза для исследований обычно используют мокроту, промывные воды бронхов, бронхиальные аспираты, плевральную жидкость, мочу, спинномозговую жидкость, кровь, биоптаты лимфоузлов и других тканей.
Если у пациента не удается обнаружить МБТ при стандартном обследовании, проводится дальнейший диагностический поиск, включающий патоморфологическое исследование материала, полученного при биопсии пораженного органа, при котором подтверждением диагноза служит выявление туберкулезной гранулемы с казеозным некрозом, эпителиодными клетками, лимфоцитами, гигантскими многоядерными клетками Пирогова–Лангханса.
Как уже было сказано выше, в настоящее время растет число больных с острыми формами туберкулеза органов дыхания. По данным Челноковой О. (2003г.) , среди впервые выявленных больных туберкулезом органов дыхания число остро прогрессирующих форм составило 35%, у 7% была казеозная пневмония.[7].
Приводим наше наблюдение.
Больная К., 52 лет, поступила в клинику госпитальной терапии ММА имени И.М. Сеченова 01.03.05 с жалобами на выраженную слабость, одышку при минимальной физической нагрузке, разговоре, надсадный приступообразный кашель с выделением желто–зеленой мокроты до 50 мл за сутки, усиливающийся ночью, повышение температуры тела до 38°С, кожный зуд, отсутствие аппетита, похудание на 12 кг за год.
Из анамнеза жизни: Родилась 13 августа 1953 г. в Тамбовской области. В детстве от сверстников в физическом развитии не отставала. Образование высшее – закончила Волгоградский Медицинский институт. Работала врачом–терапевтом. С 1989 года живет в Москве. До 2004 года работала терапевтом–реабилитологом в отделении реабилитации инвалидов центра социального обслуживания. Замужем, имеет 2 сыновей (23 и 16 лет). Вредные привычки отрицает. Менструации с 14 лет, регулярные, необильные, безболезненные. Было 7 беременностей, из них 3 родов, 4 медицинских аборта. Менопауза в 46 лет. Из перенесенных заболеваний: в детстве – частые ангины, ОРВИ, корь, паротит. В 7 лет перенесла туберкулезный бронхоаденит, по поводу чего в течение года принимала противотуберкулезные препараты. В последующем к фтизиатру не обращалась. Аппендэктомия в 20 лет, тонзиллэктомия в 25 лет. Миопия средней степени. Отец умер в 92 года от острого нарушения мозгового кровообращения, мать умерла в 47 лет от рака желудка. Сестра 45 лет – практически здорова. Дети: первый сын трагически погиб, второй сын 23 лет здоров, у третьего сына 16 лет несахарный диабет. Аллергологический анамнез не отягощен.
Из истории заболевания: с 37 летнего возраста пациентка страдала первичным билиарным циррозом. С 1997 г. наблюдается в клинике госпитальной терапии ММА имени И.М. Сеченова, где диагноз первичного билиарного цирроза был подтвержден морфологически. По данным обследования в это время в анализах крови уровень щелочной фосфатазы (ЩФ) и гамма–глутамилтранспептидазы (Г–ГТ) превышал норму в 10 раз, АЛТ и АСТ в 3 раза, также отмечалась анемия (Нв 80–90 г/л), ускорение СОЭ до 50–60 мм/ч. Проводилась терапия урсофальком, сеансы плазмафереза, однако активность заболевания оставалась постоянно высокой: сохранялись синдром цитолиза, холестаза. С 2001 г. выявляется варикозное расширение вен пищевода 2–3 ст., синдром печеночно–клеточной недостаточности. Пациентка продолжала принимать урсофальк, соблюдала диету, чувствовала себя относительно удовлетворительно, кожный зуд был незначительным. Отмечала постепенное снижение массы тела, к концу 2003 года масса тела составляла 58–60 кг.
Резкое ухудшение состояния с декабря 2003 г., когда после переохлаждения появился кашель с гнойной мокротой, эпизод кровохарканья, лихорадка до 38°С. Пациентка была госпитализирована в отделение реанимации и интенсивной терапии (ОРИТ) городской больгницы по месту жительства, где диагностирована двухсторонняя плевропневмония с локализацией инфильтрации в нижней доле слева и верхней и нижней долях справа. Консультирована фтизиатром – туберкулез был отвергнут. Проводилась терапия антибактериальными препаратами, трихополом. Температура тела нормализовалась в течение недели, однако кашель и одышка сохранялись, пациентка похудела на 7 кг. В марте 2004 г. в связи с появлением бронхообструктивного синдрома была госпитализирована в городскую больницу. При исследовании функции внешнего дыхания выявлено снижение показателей жизненной емкости легких, вентиляционные нарушения по обструктивному типу, проба с бронхолитиками отрицательная. Проводилась терапия фликсотидом, вентолином – без существенного эффекта. В апреле вновь отмечаются подъемы температуры тела до 38–39°С, самостоятельно лечилась линкомицином и пефлоксацином в течение 5 дней, температура снизилась до субфебрильных цифр, но одышка и кашель сохранялись на прежнем уровне. Была вновь госпитализирована в городской стационар, где диагносцирован хронический бронхит, проводимая терапия не известна. После выписки сохранялась и нарастала выраженная слабость, кашель с гнойной мокротой, одышка при небольшой нагрузке, субфебрильная температура тела с периодическим повышением до фебрильных цифр, иногда озноб, потливость. В конце июня была госпитализирована в клинику госпитальной терапии им. А.А. Остроумова.
При обследовании было выявлено: в анализах крови: анемия, ускорение СОЭ, снижение альбумина, выраженный синдром холестаза, цитолиза, печеночно–клеточной недостаточности. В мокроте: лейкоциты покрывают все поля зрения. Candida. При компьютерной томографии (КТ) легких: справа во 2 сегменте плотные очаги, в 4 сегменте на фоне ограниченного фиброза – плотные очаги, уплотнение междолевой плевры справа; слева в 3 сегменте участок ограниченного фиброза; в корне правого легкого визувализируется мягкотканный конгломерат, отмечается уменьшение объема и уплотнение легочной ткани 2 и 6 сегментов, просвет 2 бронха не визуализируется, просвет 6 бронха резко сужен и деформирован; конгломерат интимно прилежит к костальной и медиастинальной плевре; субплеврально справа в 6 сегменте – неправильной формы округлое образование 17мм, связанное с конгломератом; жидкости в плевральных полостях не определяется; структуры средостения и корней легких дифференцированы; признаков лимфаденопатии не выявлено. В клинике проводился дифференциальный диагноз между воспалительным процессом в правом легком (возможно, грибковой этиологии), туберкулезом, опухолью правого бронха. Проводилась дезинтоксикационная терапия, урсофальк, цефтриаксон. Однако пациентка отказалась от продолжения обследования и противомикробной терапии и была выписана по собственному желанию. Диагноз оставался неясным.
За последующие 4 месяца отмечалось усиление ночного кашля с выделением слизисто–гнойной мокроты, нарастание одышки (вплоть до одышки при разговоре, в покое), периодически лихорадка до 38–39°С, выраженная общая слабость, отсутствие аппетита, дальнейшее похудание. В начале ноября отметила появление плотного округлого болезненного образования в подчелюстной области слева. Самостоятельно принимала антибиотики без особого эффекта. 25 ноября 2004 г. была госпитализирована в клинику госпитальной терапии им. А.А. Остроумова. Больная поступила в крайне тяжелом состоянии: кахексия, масса тела 38 кг. Кожные покровы бледные, сухие. В подчелюстной области справа пальпируется болезненное округлое образование плотноэластической консистенции, над легкими дыхание ослаблено, в нижних отделах с обеих сторон крепитация, тоны сердца приглушены, ритм правильный, ЧСС 90 в мин, АД 95/60 мм рт.ст., живот мягкий, безболезненный, печень на 1 см выступает из–под края реберной дуги, отеков нет. В связи с нарастанием дыхательной недостаточности 28 ноября пациентка была переведена в ОРИТ ГТК. При обследовании: в анализе крови отмечалась анемия Нв 107 г/л, лейкоцитоз до 24 тыс., относительная лимфопения, ускорение СОЭ до 35 мм/ч, снижение альбумина до 2,7 г/л, холинэстеразы до 1012 МЕ/л (норма 5600–12900), повышение уровня ЩФ 1590 ед/л (норма 98–274), Г–ГТ 323 ед/л (5–61), АСТ 52 ед (0–40), АЛТ 48 ед (0–400, общего билирубина 2,0 мг/дл (0,2–1,0). При компьютерной томографии легких выявлено: в легких в ранее обнаруженном конгломерате в области 2 и 6 сегментов справа определяются полости распада размером 25–28 мм; слева определяется участок консолидации легочной ткани, занимающий практически полностью 8 сегмент и частично 9 и 10; просветы бронхов в данном участке прослеживаются; в области этих изменений в 9 и 10 сегментах определяется снижение воздушности легочной ткани по типу «матового стекла» и усиление легочного рисунка; обширные участки консолидации, снижения воздушности легочной ткани и усиления легочного рисунка определяются преимущественно в язычковых сегментах слева, а также в средней доле, в 3 и 6 сегментах справа; лимфоузлы средостения умеренно увеличены в количестве. Заключение: По сравнению с предыдушими данными наблюдается отрицательная динамика в виде появления обширных участков консолидации и снижения воздушности легочной ткани; формирования полостей в ранее обнаруженных учасках уплотнения легочной ткани. К дифференциально–диагностическому ряду рекомендовано добавить бронхиолит с пневмонией, аспирационную пневмонию, саркоидоз (альвеолярный саркоид), менее вероятно наличие бронхиоло–альвеолярного рака. На ЭКГ: синусовая тахикардия с ЧСС 110 в мин; блокада передней ветви левой ножки пучка Гиса; перегрузка правого предсердия. При УЗИ органов брюшной полости: печень не увеличена, умеренно неоднородная, внутрипеченочные желчные протоки не расширены, воротная вена до 8 мм; желчный пузырь не увеличен, обычной формы, стенки плотные, камней нет; поджелудочная железа не увеличена, умеренно неоднородная, уплотнена; селезенка 116х46 мм; почки расположены низко, нормальных размеров (до 110х48 мм), толщина паренхимы до 12 мм; патологических образований не выявлено; в целом эхогенность паренхимы почек повышена; убедительных данных за наличие лимфатических узлов в брюшной полости не получено.
30 ноября проведена пункция образования подчелюстной области слева, получено 30 мл сливкообразного гноя. В цитограмме картина воспаления, в посеве выявлен рост Staphylococcus aureus 107 (MSSA), Candida 103. Больной проводились повторные санационные фибробронхоскопии (ФБС). При ФБС: просвет трахеи свободный, слизистая бледная, атрофичная, взята биопсия из верхне–долевого бронха слева и справа, браш–биопсия из нижних отделов. В цитограмме бронхиального смыва – клетки пролиферирующего бронхиального эпителия с элементами атипии на фоне воспаления; в посеве выявлен рост Acinetobacter anitratus – 103, чувствительный к левофлоксацину и ципрофлоксацину, Candida – 103. В повторных посевах – рост Candida. Браш–биопсия – клетки бронхиального кубического эпителия, макрофаги, лейкоциты до 20 в п/зр (нейтрофилы, лимфоциты). Биопсия бронха – стенка бронха с явлениями склероза и воспалительной инфильтрации; в прилежащей легочной паренхиме явления неспецифического интерстициального фиброза и слабо выраженная лимфо–гистиоцитарная инфильтрация. В бронхиальном смыве и в жидкости бронхо–альвеолярного лаважа методом ПЦР ДНК микобактерий туберкулеза (МБТ) не обнаружена. В повторных анализах мокроты при микроскопии микобактерии не обнаружены. Однократно в посеве крови выявлен рост E.coli, в связи с чем обсуждался вопрос развития септицемии. Тем не менее в связи с сохраняющимся подозрением на туберкулезную этиологию процесса пациентка неоднократно консультирована фтизиатром. Консультация фтизиатра: «Учитывая длительность заболевания, сохранение инфильтративных изменений в легких с обеих сторон, сохранение полостей деструкции, нельзя исключить специфическую природу заболевания. Рекомендовано: повторное исследование мокроты на микобактерии туберкулеза, повторная рентгенография, компьютерная томография легких в динамике».
Несмотря на ингаляции увлажненного О2, продолжалось нарастание явлений дыхательной недостаточности: состояние больной было тяжелым: отмечалось частое поверхностное дыхание с частотой до 40 и более в мин, угнетение сознания. В связи с этим 29 ноября больная была интубирована и переведена на искусственную вентиляцию легких, требовавшую медикаментозной седации. По мере компенсации состояния к 5 декабря введение седативных препаратов было прекращено. Учитывая компенсацию клинических признаков дыхательной недостаточности, а также положительную рентгенологическую динамику, с 7 декабря проводились попытки перевода больной на самостоятельное дыхание. Однако они оставались безуспешными: при уменьшении количества аппаратных дыханий у больной развивалось тахипноэ до 25–30 в мин и происходило быстрое истощение больной. 10 декабря проведена трахеостомия, и продолжена ИВЛ через трахеостомическую трубку. Течение заболевания осложнилось развитием ДВС–синдрома, проводилась трансфузионная терапия, переливание свежезамороженной плазмы, альбумина. Проводилась массивная антибактериальная терапия со сменой антибактериальных препаратов с учетом результатов посева и определения чувствительности (левофлоксацин + ванкомицин, имипинем, амоксициллин/клавуланат + амикацин), противогрибковая терапия (флуконазол), бронхолитическая, муколитическая, иммунокорригирующая терапия. На фоне проводимой терапии состояние улучшилось, и с 12 декабря ее удалось перевести на самостоятельное дыхание с ингаляцией увлажненного кислорода через трахеостомическую трубку, а с 18 декабря показатели газов крови сохранялись в пределах нормы без ингаляции кислорода. При контрольной компьютерной томографии легких отмечалась некоторая положительная динамика в виде уменьшения консолидации легочной ткани нижней доли левого легкого и формирования полостей в передне–базальных участках с обеих сторон. В результате проведенного обследования с учетом характера течения заболевания диагноз был сформулирован следующим образом: хронический абсцесс средней доли правого легкого с абсцедированием и развитием деструктивной пневмонии обоих легких бактериально–грибковой этиологии. Септицемия. Абсцесс подчелюстной области слева. ДВС–синдром. Дыхательная недостаточность 2–3 ст., продленная ИВЛ. Состояние после трахеостомии от 10.12.2004 г. – хронический слизисто–гнойный бронхит в фазе обострения. Первичный билиарный цирроз, умеренно активный, субкомпенсированный. Портальная гипертензия. Варикозное расширение вен пищевода 2 ст. Печеночно–клеточная недостаточность. Вторичный иммунодефицит. Кахексия. В дальнейшем пациентка была переведена в отделение пульмонологии, где продолжалась антибактериальная (амоксициллин/клавуланат, затем цефепим) и противогрибковая терапия, вводился пентаглобин, гепатопротекторы, свежезамороженная плазма. На фоне проводимой терапии сосотояние несколько улучшилось: нормализовалась температура, уменьшился кашель, пациентка стала передвигаться в пределах палаты. Больная была выписана домой под наблюдение участкового терапевта с рекомендациями продолжить антибактериальную терапию. Но несмотря на это в феврале вновь отмечаются подъемы температуры до 38°С с ознобом, усиление кашля, нарастание одышки и слабости.
В марте 2005 г. пациентка госпитализирована. В повторных анализах мокроты МБТ не обнаруживаются. В отделении проводилась терапия амикацином в течение 2 недель. При микологическом исследовании мокроты выявлен рост Candida albicans и Candida fland в высоком титре, резистентных к флуконазолу и чувствительных только к амфотерицину В. Учитывая деструктивный характер изменений при компьютерной томографии легких, результаты микологического исследования, 14 марта была начата терапия амфотерицином В. Однако в связи с плохой переносимостью, нарастанием гипокалиемии препарат был отменен, продолжена терапия фунгизоном. Продолжалось введение свежезамороженной плазмы, иммуноглобулина, альбумина, гепатопротекторов. В связи с отсутствием динамики в состоянии пациентка заочно была консультирована фтизиатрами: «Туберкулезная природа изменений в легких маловероятна так как: отсутствуют данные за перенесенный туберкулез, остаточные изменения туберкулеза органов дыхания на КТ; повторная микроскопия мокроты и бронхиальных смывов на выявление МБТ при наличии множественных полостей деструкции в обоих легких, исследование мокроты на ДНК МБТ методом ПЦР дали отрицательный результат; лечение антибиотиками широкого спектра в 2004 г. привело к интенсивному улучшению распространенных полисегментарных изменений (инфильтратов) в обоих легких. Целесообразно дополнительно провести исследование мокроты на МБТ методом микроскопии и посева». Течение заболевания осложнилось развитием левостороннего пневмоторакса, проводились пункция и дренирование плевральной полости. В связи с отрицательной динамикой по КТ легких начата антибактериальная терапия ципрофлоксацином и ванкомицином, но в связи с неэффективностью в течение последующих дней получала линезолид. 7 апреля рецидив пневмоторакса. При контрольной КТ: в области 9 сегмента левого легкого наблюдается появление участка инфильтрации легочной ткани размером 40х30х56 мм; также участок инфильтрации 8х16х29 мм определяется слева в 3 сегменте. Воздуха в полости плевры не обнаружено. Пациентка была выписана домой с диагнозом: «Двухсторонняя деструктивная пневмония смешанной этиологии (стафилококковая, кандидозная), тяжелого течения с образование множественных полостей. Рецидивирующий пневмоторакс слева от 27.03.05 и 07.04.04. Диффузный и очаговый пневмофиброз. Вторичная легочная гипертензия. Дыхательная недостаточность 3 стадии. Состояние после трахеостомии от 10.12.04 г. Хронический слизисто–гнойный бронхит в фазе обострения. Первичный билиарный цирроз 3–4 стадии. Печеночно–клеточная недостаточность 2 степени по Чайлд–Пью. Кахексия. Вторичное иммунодефицитное состояние. Энцефалопатия смешанного генеза 2 ст, астено–вегетативный синдром, вестибулопатия».
Однако на следующий день в связи с повторным пневмотораксом была госпитализирована в городскую больницу. Со слов родственников известно, что в стационаре была отменена антибактериальная терапия, назначены системные глюкокортикостероиды, который получала в течение месяца – практически без эффекта. Была выписана домой. 12 июля пациентка скончалась дома. Труп был доставлен в патолого–анатомическое отделение больницы.
Из протокола вскрытия: «В просвете гортани и трахеи гноевидное содержимое. Слизистая оболочка дыхательных путей серо–розовая, без кровоизлияний. Левое легкое воздушной консистенции. На разрезах ткань левого легкого темно–красная, с поверхности разрезов выдавливается пенистая розовая жидкость, из сосудов вытекает жидкая кровь. На поверхности разреза в ткани левого легкого определяются множественные серовато–желтоватые участки без четких границ, творожистой консистенции, размерами до 3х2, 5х2 см, с полостями, заполненными гноем, без четкой капсулы. В верхней доле правого легкого – участок светло–серо–желтого цвета, размерами 6,5х5х3 см, не связанный с крупными бронхами, с нечеткими границами, мягко–эластической консистенции. В остальной ткани правого легкого множественные участки творожистой консистенции, размерами 2,5х5х2 см, светло–серовато–желтоватого цвета, без четких границ, а также полости диаметром до 2 см, заполненные гноем. В обоих легких множественные сливающиеся мелкие зернистые очаги с гноевидным отделяемым. Лимфатические узлы корня легкого уплотнены, размерами до 3,5х2,5х2 см, ткань на разрезах черная, с серовато–желтыми включениями. Пристеночная плевра не утолщена, тонкая, гладкая, блестящая».
Результаты патогистологического исследования: «Легкие – множественные очаги казеозного некроза, часть их без демаркационной зоны. Прилежащие к зоне казеозного некроза альвеолы заполнены фибринозным экссудатом. Часть очагов казеозного некроза со слабо выраженной капсулой, представленной рыхлыми пучками соединительной ткани, диффузно–инфильтрированной лимфоидными элементами. В отдельных участках – эпителиоидные клетки, гигантские клетки инородных тел и Пирогова–Лангханса. Лимфатические узлы корня правого легкого – лимфоидные фолликулы единичные мелкие, без светлых центров. В– и Т–зоны опустошены. Диффузно в препарате лимфоциты. Единичные эпителиоидно–гигантоклеточные гранулемы без явлений казеоза и фиброзирующиеся гранулемы»
Патологоанатомический диагноз: «Основное заболевание: Инфильтративный туберкулез верхней доли правого легкого с кавернизацией. Полисегментарная казеозная пневмония в верхней доле правого легкого. Диссеминация – множественные очаги казеозного некроза в обоих легких. Казеозный некроз лимфатических узлов корня правого легкого. Осложнения: Отек головного мозга. Малокровие органов. Смешанные свертки крови в полостях сердца и крупных сосудах. Дистрофические изменения миокарда, почек. Кахексия. Сопутствующие заболевания: Атерокальциноз аорты. Мелкоузловой цирроз печени. Склероз поджелудочной железы. Остеопороз».
Анализируя данный клинический случай, хочется отметить изначально имевшуюся у врачей настороженность в отношении туберкулеза. Несмотря на повторные отрицательные результаты обнаружения МБТ в мокроте, неспецифическую картину воспаления, полученную при биопсии бронха, и отрицательные результаты ПЦР, сомнения в отношении туберкулезной этиологии процесса оставались до последних дней пребывания больной в стационаре. Особенностью данного случая является отсутствие выделения МБТ даже в той стадии заболевания, когда по данным КТ имелись признаки деструкции легочной ткани. Возможно, это было обусловлено проведением массивной антибактериальной терапии, включавшей препараты, обладающие туберкулостатическим действием (фторхинолоны II поколения и аминогликозиды). Существенным фактором, повлиявшим на ошибку в диагностике было повторное выявление роста бактериальной (золотистый стафилоккк, ацинетобактер) и грибковой флоры в посевах бронхиальных смывов и мокроты. Остается неясным вопрос о сроках развития у больной такой формы туберкулеза, как казеозная пневмония. Кажется маловероятным, что пациентка страдала этой формой туберкулеза в течение всего периода заболевания. Возможно, она развилась уже в терминальной стадии, когда иммунодефицитное состояние усугубило назначение системных глюкокортикостероидов.
По данным Мишина В.Ю., основными причинами диагностических ошибок туберкулеза легких в лечебных учреждениях общей медицинской сети являются: неполно собранный фтизиатрический анамнез, связанный с недостаточной настороженностью в отношении туберкулеза; неправильная оценка и интерпретация клинических проявлений туберкулеза легких в современных эпидемических условиях; неправильная трактовка рентгенологических изменений в легких и отсутствие рентгенологического контроля через 7–10 дней лечения пневмонии; отсутствие или однократное исследование мазков мокроты на микобактерии туберкулеза по Цилю–Нильсену; обзорная бронхоскопия без взятия биопсийного материала; тяжелая сопутствующая патология. Наибольшее число диагностических ошибок отмечается при инфильтративном туберкулезе легких и казеозной пневмонии [4,7].
Казеозная пневмония – это форма вторичного туберкулеза легких, характеризующаяся быстрым развитием и распространением казеозно–некротических изменений в легких в условиях выраженного иммунодефицита и бурного размножения микобактерий. Клинически она проявляется остро прогрессирующим течением с неуклонным усилением интоксикационного, бронхопульмонального синдромов, рентгенологически в легких выявляется поражение 3 и более сегментов, лабораторными признаками иммунодефицита, выраженными метаболическими нарушениями. Госпитализация подавляющего большинства больных казеозной пневмонией (до 86%) в общесоматические стационары определяется наличием «масок» заболевания и тяжелым состоянием больных при обращении за медицинской помощью. Дифференциальный диагноз наиболее часто приходится проводить с сепсисом, гангреной, абсцессом легкого, деструктивной пневмонией [5]. Высокая смертность (60–80%) определяется не только тяжелым, прогрессирующим течением, но и поздним началом противотуберкулезной терапии. При позднем начале она бывает неэффективна вследствие значительного объема поражения легочной ткани и развития выраженных полиорганных нарушений. Неуклонное увеличение объема поражения легочной ткани, которое носит необратимый характер, прогрессивное ухудшение состояния определяют сроки диагностики казеозной пневмонии в течение 1–2 недель как критические. По истечении данного периода в случае отсутствия эффекта от проводимой терапии, отрицательных результатов исследований мокроты на МБТ при сохранении подозрения на казеозную пневмонию целесообразно начинать комплексную противотуберкулезную терапию [6].
В последнее время все чаще врачам терапевтических стационаров приходится сталкиваться с различными формами туберкулеза органов дыхания, протекающими атипично, без бактериовыделения. Настороженность в отношении туберкулеза, тщательный клинико–анамнестический анализ, повторные лабораторные и инструментальные исследования для подтверждения специфической этиологии процесса позволяют своевременно диагностировать туберкулез и направить больного в противотуберкулезный стационар для проведения специфической терапии. С другой стороны, всегда нужно помнить о возможности и необходимости проведения в определенных случаях пробной противотуберкулезной терапии.
Литература:
1. Трифонова А.Ю., Стаханов В.А. Медико–социальные и психологические аспекты заболеваемости населения туберкулезом в современных условиях. // Российский медицинский журнал, №5, 2005 г. с.9–11.
2. Хоменко А.Г. Туберкулез: Руководство для врачей. М., 1998 г.
3. Вишневская Е.Б. Особенности выделения ДНК для ПЦР при туберкулезе внелегочных локализаций. // Проблемы туберкулеза. № 5, 1998 г., с.23–26.
4. Мишин В.Ю., Дейкина О.Н., Назарова Н.В. Дифференциальная диагностика туберкулеза легких и внебольничной пневмонии. // Консилиум медикум, т.6, № 4, 2004 г., с.232.
5. Степанян И.Э. Вопросы диагностики и дифференциальной диагностики туберкулеза органов дыхания в современных условиях. //РМЖ, т.7, №17, 1999г. с.836.
6. Кибрик Б.С., Челнокова О.Г. Проблемы диагностики и лечения казеозной пневмонии. // Пульмонология, т. 13 № 4, 2004 г. с.41–44.
7. Даниляк И.Г. Трудный диагноз болезней органов дыхания. «Русский врач», М., 2005 г. С. 48–70.
8. Козулицына Т.И. Микробиологические исследования./ В руководстве для врачей: Туберкулез органов дыхания. М.,1981 г.– с.136–149.
Библиографическое описание:
Ошибки и сложности диагностики при туберкулезе тазобедренного сустава / П. Х. Назиров, Н. Н. Туйчиев, Ф. Х. Рустамов [и др.]. — Текст : непосредственный // Молодой ученый. — 2018. — № 10.1 (196.1). — С. 29-31. — URL: https://moluch.ru/archive/196/49449/ (дата обращения: 22.09.2023).
Актуальность. Туберкулез относится к наиболее значимым инфекционным заболеваниям по всему миру [1, с.445].
По данным Васильева А.В., (2000 г.) по частоте поражения тазобедренный сустав занимает одно из ведущих мест и составляет 20% [2, с. 568].
Туберкулез костей и суставов является вторичным туберкулезом и нередко имеет первичный очаг в легких или в медиастинальных лимфатических узлах. Распространение инфекционного процесса происходит гематогенным путем. Поражение костей и суставов зависит от количества и вирулентности МБТ, а так же состояния клеточного иммунитета больного [3, с.55].
Наиболее достоверным диагностическим признаком является обнаружение микобактерий туберкулеза в патологическом материале. Однако, выделение возбудителя при костно-суставном туберкулезе, в связи с олигобациллярностью диагностического материала, сопряжено с определенными трудностями и наблюдается значительно реже, чем при туберкулезе легких, что приводит к «недовыявлению» или несвоевременной постановке диагноза [4, с.30]. Результатом становится прогрессирование деструктивных процессов в пораженном суставе, увеличение процента инвалидности и резкое снижение качества жизни этой категории больных [5, с.54]. По мнению ряда авторов, медикаментозная химиотерапия служит дополнением к хирургическому лечению [6, с.259].
Туберкулезный коксит является сложной комбинацией туберкулезного артрита и остеомиелита [3, с.55]. Трудности диагностики и лечения инвалидизируют до 67% больных, что приобретает особую актуальность, поскольку данная локализация туберкулезного процесса наиболее часто поражает пациентов трудоспособного возраста от 20 до 50 лет.
Цель исследования: анализ ошибок и сложностей в диагностике туберкулеза тазобедренного сустава.
Материалы и методы: Обследовано 50 больных активным туберкулёзом тазобедренного сустава, находившихся на стационарном лечении в клинике РСНПМЦ ФиП в 2013-2017гг. Женщин 18(36%), мужчин – 32(64%). Возраст больных варьировал от 20 до 65 лет. Средний возраст составил 45±2 лет. Обследование больных включало: рентгенография, МРТ и МСКТ, клинико-биохимические, микробиологические, ортопедический статус и по показаниям проведена фистулография (триомбраст 76%). При наличии функционирующих свищей у 5 (10%) больных, и при подозрении абсцесса вокруг сустава – у 20 (40%) больных проводили пункции сустава и патологический материал (синовиальная жидкость – у 9(45%), гной – у 11(55%) подвергался генетическим методам исследований, (Gene Expert/ Hain Test) с последующим определением чувствительности к 1-му и 2-му ряду противотуберкулезных препаратов в жидкой среде – MGIT-960.
Наряду с общими симптомами туберкулеза оценивался ортопедический статус больных.
Открытая биопсия проводилась 25(50%) больным. Биоптат исследовали гистологическим и генно-молекулярным методами.
Всем больным назначали режим противотуберкулезной терапии, включающий изониазид 5-10 мг/кг, рифампицин 15-25 мг/кг массы тела, этамбутол 15-25 мг/кг и пиразинамид 15-20 мг/кг массы тела.
Результаты. У 35(70%) больных давность заболевания отмечена от 1 года до 2 лет, с медленным прогрессированием болей в суставе, редкими подъемами температуры до субфебрильных цифр и постепенным присоединением ограничения движений в суставе. При чем 30(60%) из этих больных лечились с диагнозом коксартроз в общей лечебной сети.
Полное развитие клинической картины в течение 1-2 месяцев, с повышением температуры до фебрильных цифр, быстрым нарастанием контрактуры сустава и потерей массы тела имело место у 15 (30%) больных. Длительность жалоб больных до установления диагноза составила от 1 месяца до 2 лет, в среднем до 6-7 месяцев.
Результаты общеклинических исследований больных туберкулезным кокситом показали отклонения от нормы в функции печени (АСТ, АЛТ, общего билирубина) у 8(16%) больных. Снижение гемоглобина отмечено у 15 (30%) больных, ускорение СОЭ у 9 (18%) больных, повышение серомукоидов, С-реактивного белка, фибриногена – у всех 32 (64%) больных.
По количеству очагов туберкулезного поражения выявлены 2 (4%) больных с поражением обоих тазобедренных суставов. Костная деструкция характеризовалась очагами округлой формы с наличием различных по количеству, плотности и размерам секвестров, а так же сообщением с полостью сустава; синовитом, что проявлялось утолщением капсулы сустава на КТ, либо патологическим несимметричным сигналом на МРТ и различной степенью экссудата в суставе, который также проявлялся ярким сигналом в Т2 и низким сигналом в Т1 режимах МРТ, а на КТ выглядел как четкое неправильной формы вещество с плотностью меньшей, чем мягкие ткани.
Рентгенологическое и КТ-исследование при туберкулёзном коксите показало, что у взрослых не встречаются первичные очаги в самой головке бедренной кости. Первичные очаги в шейке бедренной кости являются редкостью (4%). У взрослых процесс в суставе, в подавляющем большинстве случаев, распространяется из очагов, локализующихся в костях вертлужной впадины (42%). Они являются зоной первичной деструкции, в то время как изменения в головке бедренной кости деструктивного или реактивного характера развиваются вторично. Прогрессирование воспаления у 27 (54%) больных привело к глубокому разрушению костей вертлужной впадины и формированию различных по размерам губчатых секвестров, структура которых отчетливо склерозируется к 10-12 месяцам заболевания. Подобные секвестры можно считать патогномичными для туберкулезного коксита. У 21 (42%) больного туберкулезный коксит развивался как следствие трохантерита.
Разрушение более трети головки бедренной кости установлено у 5(10%) больных, при этом отмечалось укорочение конечности от 2 до 5 см.
В 23 (46%) случаях имел место остеопороз костей, составляющих сустав, который проявлялся на рентгенограммах повышением прозрачности костной ткани без реакции надкостницы.
Сочетание туберкулезного коксита с активным туберкулезом в легких в виде очагов инфильтрации выявлено у 5 (10%) больных, у 2 из них обнаружены МБТ в мокроте.
Из 50 больных туберкулезным кокситом, бактериоскопически диагноз подтвержден у 16 (32%), у 4 (8%) выделена культура МБТ на исследование GenXpert.
Таким образом, туберкулезный коксит сопровождается выраженными клинико-лабораторными и рентгено-томографическими изменениями. Верификация диагноза носит комплексный характер. Специфическое поражение тазобедренного сустава протекает с тотальным разрушением сустава.
Выводы:
1. Туберкулезное поражение тазобедренного сустава вторично.
2. Диагностика туберкулезного коксита основывается на сопоставлении клинико-лабораторных, бактериологических и рентгенологических данных.
3. Для верификации диагноза требуется проведение открытой биопсии.
Литература:
- Klein H1, Seeger J, Schleicher I. «Tuberculous coxitis: diagnostic problems and varieties of treatment: a case report». // Open Orthop J. 2012; 6: 445-8.
- Васильев А.В. «Внелегочной туберкулез: руководство для врачей» Издательство: // Фолиант. 2000. С.568.
- Göb A. «Surgical treatment of coxitis tuberculosa (author’s transl)» // Z Orthop Ihre Grenzgeb. 1980;118(1):55-60.
- Назиров П.Х. и соавт. «Клинико-рентгенологическая характеристика туберкулеза костей и суставов у больных резистентными формами микобактерий». // Медицинский журнал Узбекистана. 2013 г. №3, с.30-33.
- Сердобинцев М.С., Бердес А.И., с соавт. «Социально-медицинская эффективность репаративных операций при прогрессирующем туберкулезе тазобедренного сустава» // Журнал Проблемы туберкулеза и болезней легких. 2008 г. №12. С. 54.
- Kessler P. «Treatment of tuberculous coxitis with special reference to modern surgical therapy» // Z. Erkr. Atmungsorgane.1985;165(3):259-66.
Основные термины (генерируются автоматически): туберкулезный коксит, больной, тазобедренный сустав, бедренная кость, сустав, активный туберкулез, верификация диагноза, кг массы тела, патологический материал, туберкулезное поражение.
-
Архив журнала
/ -
2017
/ - №5
Маски урогенитального туберкулеза как причина диагностических ошибок
DOI: https://dx.doi.org/10.18565/urology.2017.5.100-105
Д.П. Холтобин, Е.В. Кульчавеня
ФГБУ «Новосибирский НИИ туберкулеза» Минздрава России, Новосибирск, Россия; ГБОУ ВПО «Новосибирский государственный медицинский университет» Минздрава России, Новосибирск, Россия
Урогенитальный туберкулез не имеет патогномоничных симптомов, поэтому часты ошибки в диагностике. С целью оценки причин и частоты ошибочных диагнозов был проведен систематический обзор литературы. Мы критически оценивали некоторые статьи, авторы которых описывали наблюдение урогенитального туберкулеза как редкое и необычное, потому что сами редко встречались с этим заболеванием, хотя на самом деле это было типичное проявление мочеполового туберкулеза.
Проанализированы и проиллюстрированы особенности мочеполового туберкулеза у больных туберкулезом легких, особенности дифференциальной диагностики урогенитального туберкулеза и рака почек и мужских половых органов, приведены ошибки в диагностике туберкулеза уретры, туберкулеза яичка и его придатка, туберкулеза полового члена и туберкулеза предстательной железы. Описана мочекаменная болезнь как маска и сопутствующее заболевание мочеполового туберкулеза. Указаны действительно редкие формы проявления как причина ошибок диагностики туберкулеза мочевого пузыря. Приведены примеры фатальных исходов мочеполового туберкулеза. Проанализированы грануломатозный интерстициальный нефрит вследствие туберкулезной инфекции и туберкулез почечной артерии как причина реноваскулярной артериальной гипертензии.
Наиболее частой причиной поздней диагностики урогенитального туберкулеза являются отсутствие типичной картины, тенденция протекать под маской других заболеваний.
Туберкулез остается одной из самых смертельных болезней. Согласно данным ВОЗ, в 2016 г. туберкулезом заболели 10,4 млн человек и умерли от него 1,8 млн [1]. Основное внимание ВОЗ уделяет туберкулезу легких; допускаем, что им не известен тот факт, что по аутопсийным исследованиям 77% мужчин, умерших от туберкулеза всех локализаций, имели таковой предстательной железы, как правило при жизни не установленный. Вместе с тем генитальный туберкулез – заболевание, передающееся половым путем, и одна из основных причин бесплодия, как мужского, так и женского [2, 3]. До сих пор во многих регионах Российской Федерации сохраняется напряженной эпидемическая ситуация по туберкулезу [4, 5]. Структура внелегочного туберкулеза нестабильна, зависит от многих причин, но доля мочеполового туберкулеза в течение десятилетий не опускалась ниже второго места [6, 7]. Настороженность в отношении уротуберкулеза невысока, социально-демографические характеристики пациентов существенно отличаются от таковых при туберкулезе легких [8]. Своевременному выявлению туберкулеза мочевого пузыря могла бы способствовать оптимальная терапия по поводу инфекций нижних мочевыводящих путей, под маской которых нередко скрывается туберкулез, но, как показывают опросы специалистов и анализы амбулаторных карт, не менее половины врачей выбирают для эмпирической терапии неоптимальные препараты [9–12].
Проблема урогенитального туберкулеза отражает много противоречий – от терминологии, классификации до подходов к лечению. Тем не менее нам следует преодолеть их для лучшего понимания этого загадочного и потенциально смертельного заболевания.
С целью оценки причин и частоты ошибочных диагнозов мы провели систематический обзор литературы.
В поисковых системах Medline/PubMed и Google Shcolar был осуществлен поиск статей по ключевым словам «urogenital tuberculosis, rare» и «urogenital tuberculosis, unusual»; в системе elibrary поиск проведен по ключевым словам «редкие случаи мочеполового туберкулеза», «мочеполовой туберкулез». В русскоязычной литературе нам не удалось обнаружить статей, посвященных необычному течению мочеполового туберкулеза. По запросу «urogenital tuberculosis rare» было найдено 230 статей, по запросу «urogenital tuberculosis unusual» – 81; всего – 311 источников. Тридцать четыре статьи повторялись, поэтому были исключены из анализа, 33 касались эпидемических данных, были обзором литературы, 48 описывали случаи нетуберкулезных заболеваний, 3 были посвящены врожденному туберкулезу, 16 – урогенитальному туберкулезу как сопутствующему заболеванию и 8 статей – урогенитальному туберкулезу как осложнению БЦЖ-терапии, поэтому также были исключены. Кроме того, мы исключили 22 статьи, в которых описывались подходы к лечению, но не было данных о клинической картине. Среди оставшихся 147 мы выбрали 43, которые описывали действительно редкие случаи заболевания; в обзор также вошло 6 источников, касающихся эпидемиологических исследований.
Мы критически оценивали некоторые статьи, авторы которых описывали случай урогенитального туберкулеза как редкий и необычный потому, что сами редко встречались с этим заболеванием, хотя на самом деле это было типичное проявление мочеполового туберкулеза.
Мочеполовой туберкулез у больных туберкулезом легких
Последнее время все реже диагностируют изолированный урогенитальный туберкулез и все чаще – сочетанный с другими локализациями, преимущественно с туберкулезом органов дыхания [3]. Генерализованный туберкулез в 16% случаев манифестирует урогенитальными проявлениями [3]. Подобную ситуацию описали G. Colbert и соавт. [13]. Пациент жаловался на тошноту и почечную колику; при обследовании выявлялся генерализованный туберкулез легких, брюшины и мочевой системы. Туберкулез вульвы у пациентки с туберкулезом легких в течение длительного времени интерпретировали как заболевание, передаваемое половым путем [14]. Гистологическое иследование биоптата вульвы у женщины с туберкулезом легких и периферических лимфатических узлов подтвердило специфическое воспаление половых органов [15].
Мочеполовой туберкулез и рак почек
A. Androulaki и соавт. [16] сообщили о клиническом наблюдении, когда первоначально по данным рентгенологического обследования был установлен диагноз «рак почки», однако в моче была обнаружена Mycobacterium tuberculosis (Mtb) и диагноз был пересмотрен. Больной был излечен консервативно противотуберкулезными препаратами. A. Bouchikhi и соавт. [17] описали пациента с жалобами на боль в области левой почки, учащенное мочеиспускание и повторные эпизоды макрогематурии в течение 6 мес. Мультиспиральная компьютерная томография выявила левосторонний гидронефроз, гидроуретер со значительным утолщением стенки левого мочеточника в нижней трети. На этом основании пациенту был выставлен диагноз «опухоль нижней трети левого мочеточника». Однако нарастающая дизурия, присоединившийся эпидидимит и пиоспермия заставили задуматься о урогенитальном туберкулезе. Моча была исследована на Mtb молекулярно-генетическим методом, результат оказался положительным [17]. Диагноз был изменен на «туберкулез мочеточника». Это яркий пример неверной интерпретации клинической картины: авторы констатировали генерализованное инфекционно-воспалительное заболевание мочеполовой системы, в которое оказались вовлеченными почки, мочеточник, мочевой пузырь, придаток яичка и предстательная железа, однако расценили его как изолированный туберкулез мочеточника. Согласно классификации [3], туберкулез мочевыводящих путей всегда вторичен по отношению к нефротуберкулезу, что исключает диагноз «изолированный туберкулез мочеточника» в принципе.
Урогенитальный туберкулез и рак мужских половых органов
В дифференциально-диагностическом ряду мочеполового туберкулеза злокачественные опухоли стоят на одном из первых мест. Именно под маской рака очень часто протекает урогенитальный туберкулез. Изолированный туберкулезный эпидидимит в структуре туберкулеза мужских половых органов [6] занимает 21,5% и безусловно необычайно сложен для диагностики. Сообщалось о 20-летнем мужчине, который в течение 2 мес отмечал постепенное увеличение мошонки в размерах, боли не было. У пациента диагностирована паратестикулярная опухоль справа и запланировано хирургическое вмешательство. Однако в день операции появилась сильная боль, покраснение правой половины мошонки. Картина повторного УЗИ свидетельствовала скорее в пользу изменений воспалительного характера. Больному была выполнена секционная биопсия придатка, и туберкулез подтвержден патоморфологически [18].
Изолированный эпидидимит/орхоэпидидимит легко можно принять за опухоль, особенно у пациента, не имеющего в анамнезе контакта с туберкулезом и ранее не болевшего туберкулезом. В течение 4 мес у 44-летнего мужчины нарастала «опухоль» левой половины мошонки, по поводу чего ему была выполнена левосторонняя орхэктомия. Гистологически диагностирован туберкулез [19]. Похожие случаи описаны и другими авторами [20]. У пациента возникла безболевая форма орхоэпидидимита через 5 мес после биопсии простаты, которая была выполнена в связи с высоким уровнем простатспецифического антигена; гистологически, однако, в биоптатах опухолевые клетки обнаружены не были. Тем не менее больному поставлен диагноз рака яичка и выполнена орхэктомия; патоморфологическое исследование операционного материала указывало на туберкулезное воспаление [21].
Мочекаменная болезнь как маска и сопутствующее заболевание мочеполового туберкулеза
Схожая клиническая и рентгенологическая картины уролитиаза и нефротуберкулеза способствуют ошибочной диагностике. Описано наблюдение мочеполового туберкулеза, протекавшее с клинической картиной камня мочеточника [22]. У других авторов [23] был пациент с камнями в обеих почках, почечной недостаточностью. Больному проведена левосторонняя нефрэктомия, гистологически установлен туберкулез, начата противотуберкулезная химиотерапия и на ее фоне выполнена правосторонняя уретеролитотрипсия. Разумеется, благоприятный прогноз у этого больного весьма сомнительный.
В. Я. Фарбировичем с коллегами четырежды был диагностирован туберкулез мочеточника у пациентов, поступавших в стационар с «почечной коликой вследствие рентгеннегативного камня». Во время уретероскопии обнаруживали язву слизистой мочеточника, выполняли биопсию, патоморфологически верифицировали туберкулез [3].
Казеозные массы в каверне почки могут имбибироваться солями кальция, что формирует рентгенологическую картину, схожую с таковой при уролитиазе [24].
Редкие формы проявления как причина ошибок диагностики туберкулеза мочевого пузыря
Туберкулез мочевого пузыря диагностируют более чем у половины больных туберкулезом почек [3]. Именно вовлечение в процесс мочевого пузыря часто побуждает пациента обращаться к врачу. Сообщалось [25] о двух наблюдених кавернозного туберкулеза легких, диагностированных после того, как развился туберкулез мочевого пузыря и простаты. Типичную ситуацию описывают T. Kanekoи соавт. [26]. В 19 лет у пациента впервые появился приступ дизурии и макрогематурии, который повторялся в течение 5 лет по нескольку раз в год, купировался самостоятельно или домашними средствами. В 21 год пациент все же решил обратиться в клинику, где была диагностирована инфекция мочевыводящих путей и проведена антибактериальная терапия. Поскольку никакого улучшения пациент не отметил, он продолжил самолечение еще в течение 3 лет. В 24 года он поступил в клинику с жалобами на учащенное болезненное мочеиспускание. Трансректальное УЗИ показало значительное уменьшение емкости мочевого пузыря, утолщение его стенки и полости в предстательной железе. В моче обнаружена Mtb [25]. В течение длительного времени урогенитальный туберкулез протекал под маской цистита, и в результате туберкулез мочевого пузыря был диагностирован в 4-й, терминальной, стадии.
Туберкулез мочевого пузыря 4-й стадии не может быть излечен консервативно противотуберкулезными препаратами, таким больным показана цистэктомия с энтеропластикой [3, 27, 28]. Вместе с тем для своевременной диагностики туберкулеза мочевого пузыря достаточно направлять пациентов к фтизиоурологу в случае низкой эффективности стандартных курсов терапии по поводу цистита, если изменение поведения, адекватная контрацепция и ммунопрофилактика не дают результатов [28, 29].
F. Lopes и соавт. [27] представили наблюдение 67-летнего пациента, которому 31 год назад была выполнена аугментационная илиоцистопластика по поводу урогенитального туберкулеза. Больной обратился к врачу в связи с бессимптомной микрогематурией. Рентгенологически было обнаружено три полипа в артифициальном мочевом пузыре. Была выполнена энтероцистпростатэктомия; гистологическое исследование операционного материала выявило аденокарциному мочевого пузыря и предстательной железы, Gleason 7 (3+4) [27].
Редко, но бывает спонтанный разрыв пораженного туберкулезом мочевого пузыря. У молодой женщины, экстренно оперированной по поводу «острого живота», во время лапаротомии были обнаружены перфорации аппендикса и мочевого пузыря. Туберкулез был верифицирован патоморфологически. Впоследствии у этой пациентки выявлена стриктура нижней трети правого мочеточника [30]. Ряд авторов [31, 32] также описывают спонтанные разрывы мочевого пузыря вследствие туберкулеза.
Ошибки в диагностике туберкулеза уретры
A. Bouchikhi и соавт. [33] сообщили о невероятном случае мочеполового туберкулеза у мужчины, проявившегося протяженной стриктурой уретры и множественными уретроскротальными свищами. Пациент предъявлял жалобы на нарушение мочеиспускания и гнойные выделения из уретры. Ретроградная уретроцистограмма выявила сужение просвета уретры на всем протяжении и множественные свищи. Однако туберкулез не был заподозрен и пациенту была выполнена уретропластика. В послеоперационном периоде отмечен рецидив и даже большее распространение свищей, рана нагноилась. Только после этого был предположен туберкулез и проведена биопсия периуретральных тканей и стенок свища; туберкулез был подтвержден гистологически [33]. Полагаем, у этого пациента был также и нефротуберкулез, поскольку туберкулез мочевыводящих путей вторичен по отношению к туберкулезу почек, фактически является его осложнением.
Ошибки в диагностике туберкулеза яичка и его придатка
A. Rakototiana и соавт. [34] столкнулись с трудностями в диагностике изолированного туберкулезного орхоэпидидимита у двоих мальчиков, что, впрочем, неудивительно. Клиническая картина была нетипичной: в одном случае заболевание протекало как гидроцеле, в другом – по типу острого орхоэпидидимита. Оба мальчика были оперированы, в обоих случаях были обнаружены узловатые образования яичек, на поверку оказавшиеся туберкулезными.
Травма может провоцировать активацию латентного туберкулеза. Увеличение в размере и уплотнение правого придатка у молодого человека были расценены как осложнение после травмы мошонки. Тем не менее было принято решение о проведении биопсии, по результатам которого выявлен туберкулезный эпидидимит. В ходе дальнейшего обследования был диагностирован кавернозный туберкулез левой почки, в моче обнаружена Mtb [35].
Ошибки в диагностике туберкулеза полового члена
Неожиданно много работ было посвящено туберкулезу головки полового члена – и не только как осложнению после БЦЖ-терапии по поводу рака мочевого пузыря [36].
Язвы на коже полового члена у инфицированного вирусом иммунодефицита (ВИЧ) мужчины были расценены как заболевание, передаваемое половым путем, однако результаты соскоба края язвы на предмет наличия Mtb оказались положительными [37].
Сообщалось [38] о наблюдении язвенного туберкулеза головки полового члена, развившегося после полового акта с больной туберкулезом женщиной. J. Kar и соавт. [39] обнаружили первичный язвенный туберкулез головки полового члена у 31-летнего мужчины. У пациента была гиперэргическая проба Манту; диагноз верифицирован патоморфологически. Тщательное обследование не выявило других очагов туберкулеза в организме этого пациента. Аналогичное наблюдение было в практике и других авторов [40]. Возможна и безъязвенная форма туберкулеза полового члена, когда пальпируются плотные подкожные безболезненные узлы [41, 42]. Поскольку биопсия таких образований не представляет затруднений, диагноз подтверждают патоморфологическим исследованием ткани. Все авторы отмечают выраженную реакцию на внутрикожное введение туберкулина (реакция Манту) больным туберкулезом полового члена. K. Karthikeyan и соавт. [43] образно назвали длительно текущий туберкулез полового члена «надутый пузырь». S. Nakamura и соавт. [44] описали 37 наблюдений туберкулеза полового члена, диагностированных в Японии в течение 10 лет (с 1978 по 1987 г.).
Приведен случай ошибочной трактовки симптомов туберкулеза полового члена как гангрены Фурнье; неэффективность проводимой терапии заставила пересмотреть диагноз [45].
Ошибки в диагностике туберкулеза предстательной железы
Туберкулез предстательной железы – нередкая форма урогенитального туберкулеза. Описана история 65-летнего мужчины, который обратился к врачу по поводу учащенного болезненного мочеиспускания, ослабления струи мочи. За последние полгода он потерял 10 кг массы тела. Легких патологических изменений не выявлено, тест на ВИЧ отрицательный. При пальцевом ректальном исследовании пальпировалась увеличенная плотная предстательная железа с крупными плотными узлами. Трансректальное УЗИ признаков малигнизации не обнаружило, объем железы составил 39 см3. Гистологически найдены призанки туберкулезного воспаления, при окраске биоптатов по Цилю–Нильсену обнаружены Mtb [46]. В другом наблюдении у 64-летнего мужчины с симптомами обструкции нижних мочевыводящих путей предполагали рак простаты, однако патоморфологическое исследование биоптатов предстательной железы выявило туберкулез [47].
Фатальные случаи мочеполового туберкулеза
Ввиду отсутствия патогномоничных симптомов диагностика урогенитального туберкулеза может запаздывать, иногда фатально. Примером тому служит следуеющее наблюдение [48]. Молодая женщина поступила в клинику в состоянии адинамии, анорексии, лихорадки, с потерей массы тела и обширными отеками. Считает себя больной 10 мес. Живот был увеличен в размере, болезненный при пальпации. Лабораторные анализы показали азотемию, лейкоцитоз, умеренную лейкоцитурию и протеинурию. Объем суточной мочи был снижен. Трансабдоминальное УЗИ брюшной полости обнаружило сморщенный мочевой пузырь с толстыми стенками и образование, содержащее негомогенную жидкость, в тазовой области слева. Дважды была выполнена диагностическая лапаротомия, пока, наконец, не обнаружен осумкованный абсцесс в области малого таза. Была начата стандартная противотуберкулезная полихимиотерапия. Позже был получен рост Mtb из мочи. На фоне лечения отмечено прогрессивное снижение почечных функций, что послужило основанием для проведения гемодиализа. Методом компьютерной томографии был диагностирован двусторонний поликавернозный туберкулез, осложненный туберкулезом мочеточников. Вскоре появились менингеальные симптомы, развился менингоэнцефалит и больная погибла [48].
Tуберкулез почечной артерии как причина реноваскулярной артериальной гипертензии
Z. Bouziane и соавт. [49] наблюдали туберкулез почечной артерии. Семнадцатилетний пациент был обследован по поводу артериальной гипертензии. Обнаружены окклюзия правой почечной артерии, увеличенные параренальные и мезентериальные лимфатические узлы. Авторы предположили туберкулез и начали соответствующую терапию. Через 1 мес выполнена реваскуляризация. Артериальное давление нормализовалось. Случай интересный, но сомнительный, поскольку туберкулез ничем, кроме увеличенных лимфоузлов, не подтвержден, а купирование гипертензии наступило не на фоне приема противотуберкулезных препаратов, а вследствие операции.
Грануломатозный интерстициальный нефрит вследствие туберкулезной инфекции
Грануломатозный интерстициальный нефрит (ГИН) – нечастая форма острого интерстициального нефрита. Описана история молодого человека с прогрессирующим ухудшением почечных функций и нарастанием протеинурии [50]. Биопсия почки выявила ГИН; также в биоптате была обнаружена Mtb методом полимеразной цепной реакции. Пациенту была начата противотуберкулезная полихимиотерапия в сочетании с глюкокортикоидами; также он получил 11 сеансов гемодиализа.
Мочеполовой туберкулез не имеет характерных симптомов; наиболее часто пациенты отмечают боль (в области почки, над лоном, в промежности, в мошонке), дизурию, почечную колику, гематурию, но частота этих симптомов может многократно колебаться в разных регионах при разной эпидемической ситуации и в разное время. Проведенный анализ подтвердил нашу гипотезу: большинство так называемых редких и необычных случаев мочеполового туберкулеза на самом деле таковыми являются только для врачей, кто очень редко диагностирует или хотя бы подозревает урогенитальный туберкулез и, соответственно, не выполняет необходимый комплекс исследований. Всегда следует иметь в виду туберкулез у больных с инфекциями мочевыводящих путей, при урогенитальном раке, мочекаменной болезни, так как возможно как маскирование, так и сочетание этих заболеваний. Туберкулез может способствовать развитию злокачественной опухоли, поэтому всегда должна быть соответствующая настороженность в отношении больных с хроническим течением и даже излеченных от туберкулеза. Фактически урогенитальный туберкулез не редкая, а редко диагностируемая болезнь. Урогенитальный туберкулез – контагиозное заболевание со многими осложнениями, в том числе летальными. Именно поэтому должен использоваться весь арсенал диагностических средств, чтобы не пропустить его.
Литература
1. WHO Global tuberculosis report 2015: who.int›tb/publications/global_report/en/
2. Kamyshan I.S. Handbook on tuberculosis of urogenital organs. Kiev, 2003. 212 p. Russian (Камышан И.С. Руководство по туберкулезу урогенитальных органов. Киев, 2003. 212 с.).
3. Kulchavenya E.V., Krasnov V.A., Mordyk A.V. Almanac of extrapulmonary tuberculosis. Novosibirsk: Sibprint, 2015. 247 p.: ill. ISBN 978-5-94301-579-3. Russian (Кульчавеня Е.В., Краснов В.А., Мордык А.В. Альманах внелёгочного туберкулеза. Новосибирск: Сибпринт, 2015. 247 с.: илл. ISBN 978-5-94301-579-3).
4. Kulchavenya E., Zhukova I., Kholtobin D. Spectrum of Urogenital Tuberculosis. J Infect Chemother October. 2013;19(Issue 5):880–883.
5. Kulchavenya E.V., Khomyakov V.T. Tuberculosis of extrapulmonary localization in Western Siberia. Tuberkulez i bolezni legkikh. 2003;80(4):13–15. Russian (Кульчавеня Е.В., Хомяков В.Т. Туберкулез внелегочной локализации в Западной Сибири. Туберкулез и болезни легких. 2003;80(4):13–15).
6. Kulchavenya E., Khomyakov V. Male Genital Tuberculosis in Siberians. World J Urol. 2006;24(1):74–78.
7. Kulchavenya E.V., Koveshnikova E.Yu., Zhukova I.I. Clinical and epidemiological features of modern tuberculous spondylitis. Tuberkulez i bolezni legkikh. 2013;1:41–45. Russian (Кульчавеня Е.В., Ковешникова Е.Ю., Жукова И.И. Клинико-эпидемиологические особенности современного туберкулезного спондилита. Туберкулез и болезни легких. 2013;1:41–45).
8. Osadchii A.V., Kulchavenya E.V., Reikhrud T.A., Naryshkina S.L., Kozhevnikova E.V., Khomyakov V.T. Socio-demographic characteristics of patients with pulmonary tuberculosis and extrapulmonary localization. Tuberkulez i bolezni legkikh. 2015;2:46–48. Russian (Осадчий А.В., Кульчавеня Е.В., Рейхруд Т.А., Нарышкина С.Л., Кожевникова Е.В., Хомяков В.Т. Социально-демографическая характеристика больных туберкулезом легких и внелегочных локализаций. Туберкулез и болезни легких. 2015;2:46–48).
9. Gadzhieva Z.K., Kazilov Yu.B., Alyaev Yu.G., Aboyan I.A., Kazilov B.R. Urination disorders. Do we know all about them? Urologiia. 2014;1:20–26. Russian (Гаджиева З.К., Казилов Ю.Б., Аляев Ю.Г., Абоян И.А., Казилов Б.Р. Нарушения мочеиспускания. Все ли мы о них знаем? Урология. 2014;1:20–26).
10. Gadzhieva Z.K., Kazilov Yu.B., Mugutdinov T.M., Kazilov B.R., Alyaev Yu.G., Aboyan I.A. Features of diagnosis and treatment of various disorders of urination by physicians of the Republic of Dagestan and other regions of the North Caucasus and Southern Federal districts. Urologiia. 2016;4:48–56. Russian (Гаджиева З.К., Казилов Ю.Б., Мугутдинов Т.М., Казилов Б.Р., Аляев Ю.Г., Абоян И.А. Особенности диагностики и лечения различных нарушений мочеиспускания врачами Республики Дагестан и других регионов Северо-Кавказского и Южного Федеральных округов. Урология. 2016;4:48–56).
11. Kulchavenya E.V., Brizhatyuk E.V. Tuberculosis of the urinary bladder: diagnosis and treatment. Urologiia. 2006;3:61–65. Russian (Кульчавеня Е.В., Брижатюк Е.В. Туберкулез мочевого пузыря: диагностика и лечение. Урология. 2006;3:61–65).
12. Kulchavenya E.V., Breusov A.A. Effectiveness of Uro-Vaxom in recurrent infectious and inflammatory diseases of the genitourinary system. Urologiia. 2011;4:7–11. Russian (Кульчавеня Е.В., Бреусов А.А. Эффективность уро-ваксома при рецидивирующих инфекционно-воспалительных заболеваниях мочеполовой системы. Урология. 2011;4:7–11).
13. Colbert G., Richey D., Schwartz J.C. Widespread tuberculosis including renal involvement. Proc (Bayl Univ Med Cent). 2012;25(3):236–239.
14. Nanjappa V., Suchismitha R., Devaraj H.S., Shah M.B., Anan A., Rahim S.N. Vulval tuberculosis – an unusual presentation of disseminated tuberculosis. J Assoc Physicians India. 2012;60:49–52.
15. Wong S., Rizvi H., Cerio R., O’Toole E.A. An unusual case of vulval papulonecrotic tuberculid. Clin Exp Dermatol. 2011;36(3):277–280. Doi: 10.1111/j.1365-2230.2010.03925.x. Epub 2010 Sep 30.
16. Androulaki A., Papathomas T.G., Liapis G. et al. Inflammatory pseudotumor associated with Mycobacterium tuberculosis infection. Int J Infect Dis. 2008;12(6):607–10. Doi: 10.1016/j.ijid.2007.12.011.
17. Bouchikhi A.A., Amiroune D., Tazi M.F. et al. Isolated urethral tuberculosis in a middle-aged man: a case report. J Med Case Rep. 2013;7(1):97. DOI: 10.1186/1752-1947-7-97.
18. Kho V.K., Chan P.H. Isolated tuberculous epididymitis presenting as a painless scrotal tumor. J Chin Med Assoc. 2012;75(6):292–95. Doi: 10.1016/j.jcma.2012.04.014.
19. Badmos K.B. Tuberculous epididymo-orchitis mimicking a testicular tumour: a case report. Afr Health Sci. 2012;12(3):395–397.
20. Lakmichi M.A., Kamaoui I., Eddafali B. et al. An unusual presentation of primary male genital tuberculosis. Rev Urol. 2011;13(3):176–178.
21. Yu-Hung L.A., Lu S.H., Yu H.J., Kuo Y.C., Huang C.Y. Tuberculous epididymitis presenting as huge scrotal tumor. Urology. 2009;73(5):1163.e5-7. Doi: 10.1016/j.urology.2008.04.015.
22. Wong N., Hoag N.A., Jones E.C., Rowley A., McLoughlin M.G., Paterson R.F. Genitourinary tuberculosis masquerading as a ureteral calculus. Can Urol Assoc J. 2013;7(5–6):E363–E366.
23. Gupta S., Santhosh R., Meitei K.S., Singh S.R. Primary Genito-Urinary Tuberculosis with Bilateral Urolithiasis and Renal Failure-An Unusual Case. J Clin Diagn Res. 2013;7(5):927–929.
24. Prakash J., Goel A., Sankhwar S., Singh B.P. Extensive renal and ureteral calcification due to tuberculosis: rare images for an uncommon condition. BMJ Case Rep. 2013;2013.
25. Kumar A., Srivastava A., Mishra V.K., Banerjee G. Tubercular cavity behind the prostate and bladder: an unusual presentation of genitourinary tuberculosis. J Urol. 1994;151(5):1351–1352.
26. Kaneko T., Kudoh S., Matsushita N. et al. Case of bladder tuberculosis with onset at the age of nineteen – treatment of urinary tract tuberculosis in accordance with the new Japanese Tuberculosis Treatment Guidelines. Nihon Hinyokika Gakkai Zasshi. 2008;99(1):29–34.
27. Lopes F.A., Rolim N., Rodrigues T., Canhoto A. Intestinal adenocarcinoma in an augmented ileocystoplasty. BMJ Case Rep. 2013;2013.
28. Kholtobin D.P., Kulchavenya E.V., Khomyakov V.T. Bladder tuberculosis stage 4: how to restore urination? Urologiia. 2014;5:26–29. Russian (Холтобин Д.П., Кульчавеня Е.В., Хомяков В.Т. Туберкулез мочевого пузыря 4-й стадии: как восстановить мочеиспускание. Урология. 2014;5:26–29).
29. Kulchavenya E.V., Brizhatyuk E.V., Khomyakov V.T., Breusov A.A. Incidence of cystitis depending on the type of contraception. Urologiia. 2013;1:41–42. Russian (Кульчавеня Е.В., Брижатюк Е.В., Хомяков В.Т., Бреусов А.А. Частота возникновения цистита в зависимости от вида контрацепции. Урология. 2013;1:41–42).
30. Kong C.H., Ali S.A., Singam P., Hong G.E., Cheok L.B., Zainuddin Z.M. Spontaneous bladder perforation: a rare complication of tuberculosis. Int J Infect Dis. 2010;14(Suppl. 3):e250-2. Doi: 10.1016/j.ijid. 2009.10.006.
31. Kumar R.V., Banerjee G.K., Bhadauria R.P., Ahlawat R. Spontaneous bladder perforation: an unusual management problem of tuberculous cystitis. Aust N Z J Surg. 1997;67(1):69–70.
32. Vallejo G.C., Palacio E.V., Reig R.C., Raventos B.C., Morote R.J., Soler R.A. Spontaneous bladder rupture secondary to urinary tuberculosis. Actas Urol Esp. 1994;18(8):829–832.
33. Bouchikhi A.A., Amiroune D., Tazi M.F. et al. Pseudotumoral tuberculous ureteritis: a case report. J Med Case Rep. 2013;7(1):45.
34. Rakototiana A.F., Hunald F.A., Razafimanjato N., Ralahy M.F., Rakoto-Ratsimba H.N., Rantomalala H.Y. Isolated testicular tuberculosis in children. Report of 2 Malagasy cases. Arch Pediatr. 2009;16(2):112–114. Epub 2008 Dec 13.
35. Michel P. Urogenital tuberculosis revealed by scrotal trauma. Presse Med. 1990;19(31):1454–1455.
36. Chowdhury A.R., Dey R.K.Penile tuberculosis following intravesical Bacille Calmette-Guérin immunotherapy. Indian J Urol. 2013;29(1):64–66. DOI: 10.4103/0970-1591.109989.
37. Stockamp N.W., Paul S., Sharma S., Libke R.D., Boswell J.S., Nassar N.N. Cutaneous tuberculosis of the penis in an HIV-infected adult. Int J STD AIDS. 2013.
38. Toledo-Pastrana T., Ferrándiz L., Pichardo A.R., Muniaín Ezcurra M.A., Camacho Martínez F.M. Tuberculosis: an unusual cause of genital ulcer. Sex Transm Dis. 2012;39(8):643–644. Doi: 10.1097/OLQ.0b013e318251577b.
39. Kar J.K., Kar M. Primary tuberculosis of the glans penis. J Assoc Physicians India. 2012;60:52–53.
40. Sah S.P., AshokRaj G., Joshi A. Primary tuberculosis of the glans penis. Australas J Dermatol. 1999;40(2):106–107.
41. Baskin L.S., Mee S. Tuberculosis of the penis presenting as a subcutaneous nodule. J Urol. 1989;141(6):1430–1431.
42. Yonemura S., Fujikawa S., Su J.S., Ohnishi T., Arima K., Sugimura Y. Tuberculid of the penis with a scab on the nodule. Int J Uro. 2004;11(10):931–933.
43. Karthikeyan K., Thappa D.M., Shivaswamy K.N. «Water can» penis caused by tuberculosis. Sex Transm Infect. 2004;80(1):75.
44. Nakamura S., Aoki M., Nakayama K., Kanamori S., Onda S. Penis tuberculid (papulonecrotic tuberculid of the glans penis): treatment with a combination of rifampicin and an extract from tubercle bacilli (T.B. vaccine). J Dermatol. 1989;16(2):150–153.
45. López Barón E., Gómez-Arbeláez D., Díaz-Pérez J.A. Primary prostatic tuberculosis. Case report and bibliographic review. Arch Esp Urol. 2009;62(4):309–313.
46. Savu C., Surcel C., Mirvald C., Gîngu C., Hortopan M., Sinescu I. Atypical primary tuberculosis mimicking an advanced penile cancer. Can we rely on preoperative assessment? Rom J Morphol Embryol. 2012;53(4):1103–1106.
47. Rabesalama S.S., Rakoto-Ratsimba H.N., Rakototiana A.F. et al. Isolated prostate tuberculosis. Report of a case in Madagascar. Prog Urol. 2010;20(4):314–316. Doi: 10.1016/j.purol.2009.06.004.
48. Daher E.F., Silva J.G.B., Damasceno R.T. et al. End-stage renal disease due to delayed diagnosis of renal tuberculosis: a fatal case report. Braz J Infect Dis. 2007;11(1):169–171.
49. Bouziane Z., Boukhabrine K., Lahlou Z. et al. Tuberculosis of the renal artery: a rare cause of renovascular arterial hypertension. Ann Vasc Surg. 2009;23(6):786.e7–9. Doi: 10.1016/j.avsg.2008. 02.022.
50. Sampathkumar K., Sooraj Y.S., Mahaldar A.R. et al. Granulomatous interstitial nephritis due to tuberculosis-a rare presentation. Saudi J Kidney Dis Transpl. 2009;20(5):842–845.
Об авторах / Для корреспонденции
А в т о р д л я с в я з и: Е. В. Кульчавеня – д.м.н., проф., гл. науч. сотр. ННИИТ, проф. кафедры туберкулеза НГМУ, Новосибирск, Россия; e-mail: urotub@yandex.ru
Похожие статьи
- Диагностика рака предстательной железы с помощью оценки жесткости различных типов ткани с использованием ультразвуковой эластометрии сдвиговой волной
- Антропоморфологические особенности больных туберкулезом предстательной железы
- Современные маркеры и гистологические особенности рака предстательной железы
- Этапы диагностики и оперативное лечение при сочетанных повреждениях мочевого пузыря
- Роль патогенетической терапии в сохранении фертильности эякулята у больных туберкулезом предстательной железы
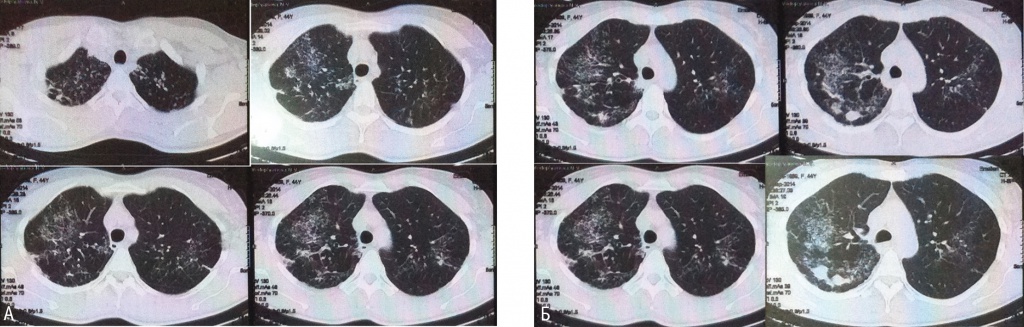
У пациентки В., 44 лет, стоматолога по профессии, при прохождении медицинского обследования в сентябре 2014 г. были впервые выявлены изменения в легких диссеминированного характера (рис. 1А, Б). До этого в течение 5–6 лет рентгенологическое исследование легких не проводилось. Жалоб не предъявляла. Обратилась за консультацией в ФГБНУ «Центральный научно-исследовательский институт туберкулеза», где на амбулаторном этапе обследования ей были выполнены туберкулиновые тесты: проба Манту с 2 ТЕ — 5 мм, диаскинтест — 10 мм, а также бронхологическое исследование (08.10.2014) со взятием бронхоальвеолярного лаважа (БАЛ), комплексом биопсий и последующим цитоморфологическим и микробиологическим исследованием полученного материала.
Рис. 1. Компьютерная томограмма органов грудной клетки при первичном обращении в 2014 г. Фото аторов
Эндоскопическая картина без особенностей. В цитограмме БАЛ: альвеолярных макрофагов — 88%, лимфоцитов — 7%, нейтрофилов — 0%, эозинофилов — 5%.
При проведении цитологического исследования материалов чрезбронхиальной биопсии легких были выявлены группы клеток цилиндрического эпителия, единичные макрофаги, лимфоциты, тучные клетки, небольшие участки фиброза. Кислотоусточивых микобактерий (КУМ) нет.
Гистологическое исследование материалов чрезбронхиальной биопсии легкого показало следующее: фрагмент стенки бронха с выраженным перибронхиальным и периваскулярным фиброзом, в легочной ткани небольшая лимфоидно-макрофагальная инфильтрация и признаки незавершенного фагоцитоза. Имеется одна отдельно лежащая марофагально-гистиоцитарная гранулема с пояском склероза. Заключение: картина соответствует хроническому гранулематозному воспалению. Результаты микробиологического исследования: КУМ нет, ДНК микобактерий туберкулеза (МБТ) методом ПЦР не найдены, посев БАЛ на КУМ отрицательный.
Учитывая профессиональный анамнез пациентки, наличие у нее контакта с различными стоматологическими материалами, отсутствие жалоб, макрофагально-эозинофильный характер БАЛ, морфологическую картину материалов чрезбронхиальной биопсии легкого и положительные результаты туберкулиновых тестов, мы включили в дифференциальный ряд экзогенный аллергический альвеолит, саркоидоз легких, диссеминированный туберкулез легких. Рекомендована госпитализация в отдел дифференциальной диагностики ФГБНУ «ЦНИИТ» для верификации диагноза.
Больная была госпитализирована 28.10.2014. Состояние при поступлении удовлетворительное, жалоб нет. Пациентка нормостенического телосложения, дыхание везикулярное, хрипов нет. Периферические лимфоузлы не увеличены. Показатели клинического и биохимического анализов крови в норме.
При исследовании ФВД было выявлено умеренное снижение вентиляционной способности легких по смешанному типу. ЖЕЛ — 68% д. в., ОФВ1 — 64% д. в., МСВ75 — 48% д. в., МСВ50 — 55% д. в., МСВ25 — 79% д. в., РаО2
— 73 мм рт. ст., РаСО2
— 38 мм рт. ст.
На КТ органов грудной клетки (КТ ОГК), выполненной в сентябре 2014 г., легочный рисунок деформирован за счет уплотнения соединительной ткани интерстиция на уровне дольковых и внутридольковых структур. Мелкие полиморфные очаговые тени перибронховаскулярной и перилимфатической локализации образуют небольшие конгломераты и участки инфильтрации по типу «матового стекла». Отмечается «цепочечное» расположение очагов в субплевральных отделах по linia circumscripta. Выражены симптомы центрилобулярной эмфиземы, в области верхушек легких — парасептальная эмфизема. Субплеврально в проекции верхних долей — буллезная эмфизема.
Внутригрудные лимфатические узлы не увеличены, в них визуализируются мелкие кальцинаты. Просветы бронхов свободные. Стенки их уплотнены. Заключение: рентгеносемиотика свидетельствует в пользу диссеминированного туберкулеза легких лимфогенного генеза (см. рис. 1А, Б).
Пациентке была произведена видеоассистированная торакоскопия с резекцией сегмента С4 справа с частичной плеврэктомией 05.11.2014. При осмотре плевра на всем протяжении гиперемирована, утолщена. По всему легкому пальпируется очагово-сливная просовидная плотная диссеминация. Микробиологическое исследование операционного материала: КУМ и ДНК МБТ методом ПЦР не обнаружены.
Результаты цитологического исследования операционного материала: выраженная лимфоидная и макрофагальная реакция, скопления эпителиоидных клеток, клетки Пирогова — Лангханса, участки кругового фиброза, напоминающие гранулемы в стадии фиброзирования. Заключение:
гранулематоз. Картина может соответствовать саркоидозу или продуктивной стадии туберкулезного воспаления.
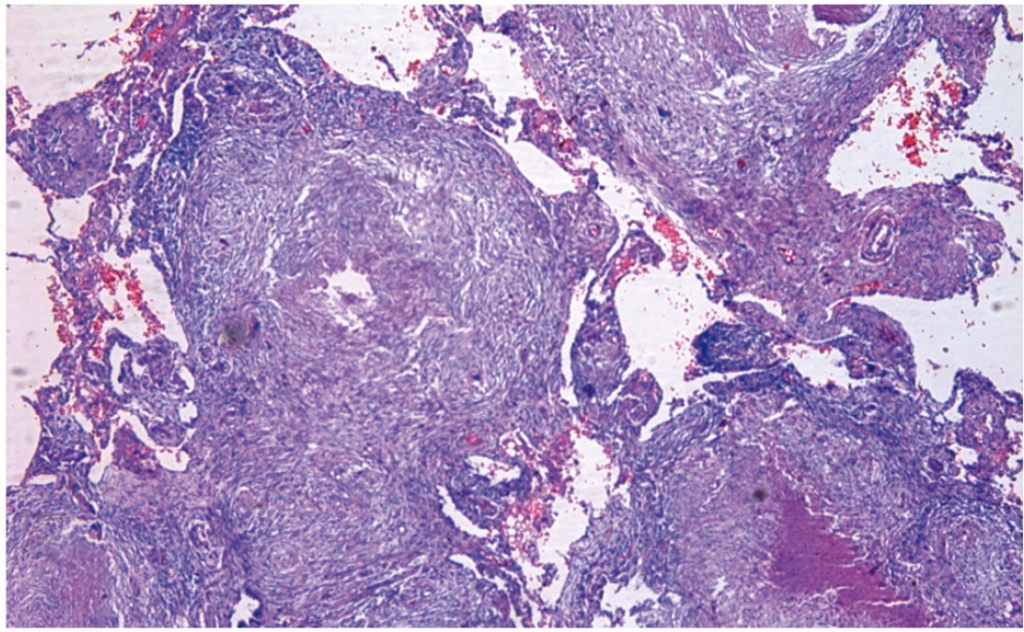
При гистологическом исследовании операционного материала обнаружено, что в ткани легкого имеются множественные гранулемы в интерстиции. Часть из них склерозируется, некоторые казеифицируются. Перибронхиолярно имеются свежие бугорки. Отмечаются фокусы деструкции стенок бронхиол. Заключение: диссеминированный туберкулез (рис. 2).
Рис. 2. Гистологическое исследование операционного материала 05.11.2014. Окраска гематоксилин-эозином. Фото аторов
Таким образом, на основании данных проведенного обследования пациентке установлен клинический диагноз: диссеминированный туберкулез легких. МБТ нет. Назначено лечение по первому режиму противотуберкулезной терапии: рифампицин 0,45 мг, изониазид 0,6 мг, пиразинамид 1,5 мг, этамбутол 1,2 мг, витамины группы В, гепатопротекторы.
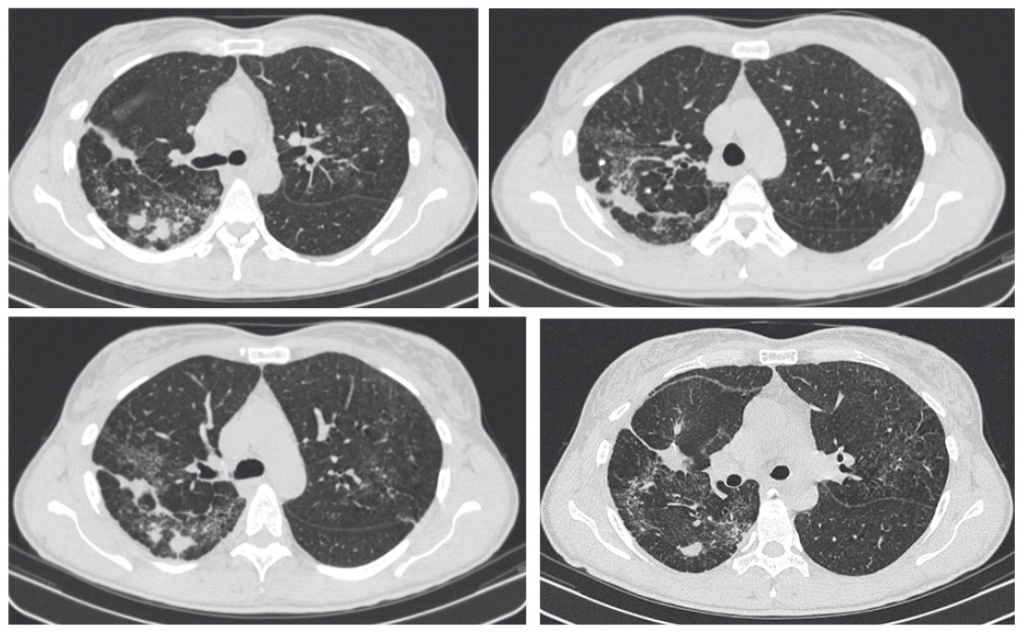
Однако через 50 дней после назначения терапии у больной появились жалобы на одышку и признаки нарастания бронхиальной обструкции по показателям МСВ75 (32% д. в.), МСВ50 (36% д. в.), МСВ75 (56% д. в.). Была выполнена КТ ОГК (январь 2015), на ней зарегистрирована отрицательная динамика: появление легочной инфильтрации по типу «матового стекла» и нарастание диссеминированных изменений (рис. 3).
Рис. 3. Компьютерная томограмма органов грудной клетки от 15.01.2015 ― отрицательная динамика в процессе лечения. Фото аторов
Специалисты института усомнились в правильности установленного диагноза. С одной стороны, в пользу наличия у пациентки туберкулеза свидетельствовали ее профессиональный анамнез (возможный контакт с больными туберкулезом), положительные туберкулиновые тесты, характерная картина КТ и результаты морфологического исследования операционного материала. С другой стороны, отсутствие клинической симптоматики (в том числе признаков туберкулезной интоксикации) при большой распространенности процесса, макрофагально-эозинофильный характер БАЛ, отсутствие МБТ во всех полученных диагностических материалах вызывали сомнение в данном диагнозе.
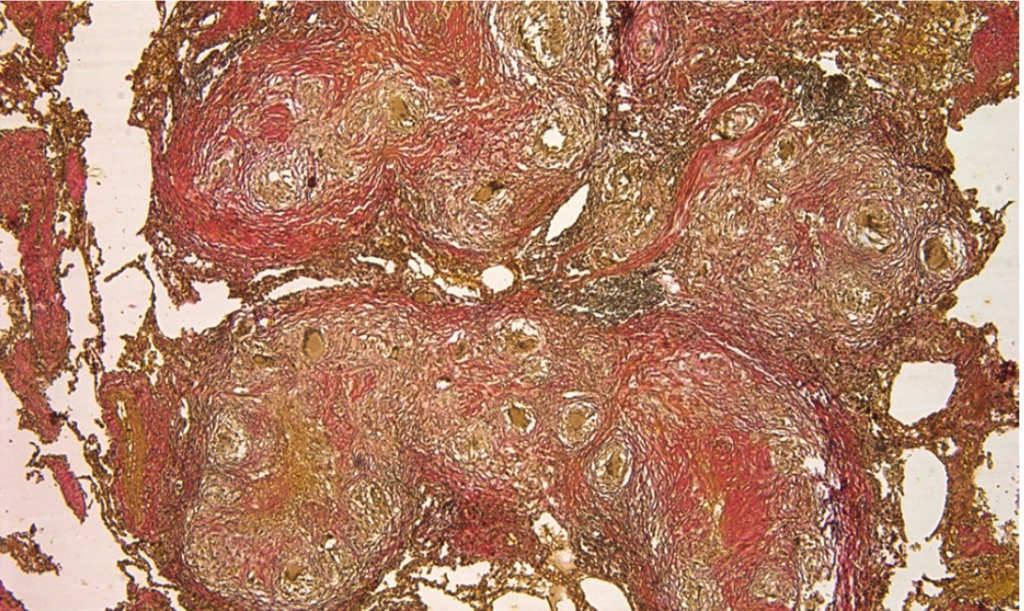
Было принято решение о проведении расширенного патоморфологического консилиума для пересмотра препаратов операционного материала. Применена дополнительная окраска по Ван Гизону (специфическое окрашивание на наличие соединительной ткани), при которой выявлены многочисленные туберкулезные гранулемы в плотной фиброзной капсуле с участками казеоза в центре (рис. 4). Участники консилиума дали однозначное заключение:
диссеминированный туберкулез легких, продуктивная стадия воспаления. В это же время стал известен результат посева операционного материала: посев на МБТ положительный, чувствительность сохранена ко всем классам противотуберкулезных препаратов, в том числе к тем, которые пациентка принимала.
Рис. 4. Гистологическое исследование операционного материала. Окраска по Ван Гизону. Фото аторов
В связи с вышеизложенным, полученную отрицательную динамику при КТ ОГК мы расценили как развитие лекарственного альвеолита в ответ на применение противотуберкулезной химиотерапии. Клинический диагноз с учетом полученных данных сформулировали следующим образом: Диссеминированный туберкулез легких. Лекарственный альвеолит.
Была произведена коррекция терапии: к противотуберкулезным препаратам (рифампицин 0,45 мг; изиниазид 0,6 мг; пиразинамид 1,5 мг; этамбутол 1,2 мг) добавлены системные глюкокортикостероиды (преднизолон) в дозе 15 мг в сутки. Через месяц скорректированного лечения (всего за время терапии в стационаре пациентка приняла 80 доз химиопрепаратов) показатели ФВД нормализовались: ЖЕЛ — 85% д. в., ОФВ1
— 80% д. в., МСВ75 — 63% д. в., МСВ50 — 87% д. в., МСВ25 — 79% д. в. При контрольной КТ ОГК зарегистрирована положительная динамика в виде частичного рассасывания и уплотнения интерстициальных изменений в легочной ткани (рис. 5).
Рис. 5. Компьютерная томограмма органов грудной клетки от 14.02.2015 ― положительная динамика. Фото аторов
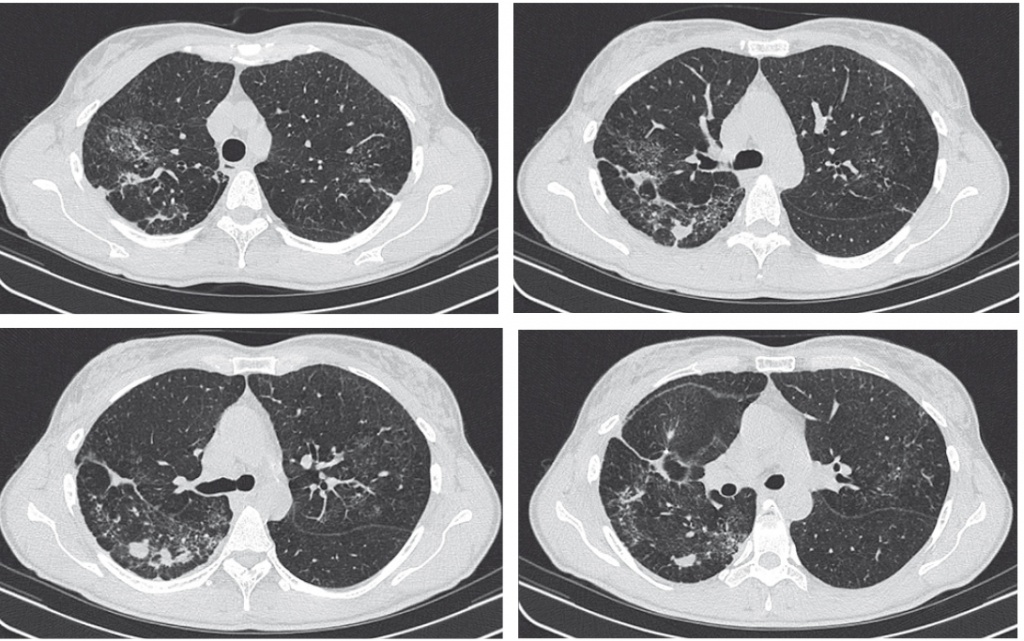
ЗАКЛЮЧЕНИЕ
Данный клинический случай демонстрирует сложность диагностики диссеминированных процессов в легких даже при получении информационно значимого диагностического материала. В описанном примере у пациентки отсутствовали жалобы, в связи с чем рентгенологическое обследование не выполнялось в течение нескольких лет, поэтому неизвестна была и давность заболевания. Отсутствие микобактерий туберкулеза в полученном диагностическом материале (бронхоальвеолярном лаваже, чрезбронхиальной биопсии легкого, операционном материале) заставляло изначально сомневаться в правомерности диагноза туберкулеза, а отрицательная клиническая и рентгенологическая динамика в процессе лечения также усиливали сомнения. Однако комплексное морфологическое и микробиологическое исследование материала, полученного при расширенной биопсии с помощью хирургической видеоассистированной торакоскопии, позволило правильно установить диагноз и назначить адекватную терапию.
Трудность заключалась и в том, что продуктивный туберкулез сам по себе достаточно плохо поддается лечению в связи с наличием плотных фиброзных капсул вокруг туберкулезных гранулем, и развившийся вследствие приема противотуберкулезных препаратов лекарственный альвеолит усложнял и диагностический, и терапевтический процессы.
3903 просмотра
Здравствуйте, помогите пожалуйста разобраться в вопросе. Для медкомиссии срочно потребовалась пройти флюрографию. За 5 дней до исследования у меня была температура 38,сначала был сухой кашель через 3 дня перешёл во влажный, мокрота была зелёного цвета и очень тяжело отходила, болело горло, и насморк был такой что ни какие капли вообще не помогали. Пошла делать флюрографию в 2х проекциях по результатом обнаружили на верхушке левого легкого кальцинаты, заключение лёгкие и сердце в норме, кальцинаты, состояние после перенесеного восполения лёгких. Ни кто ни куда меня не отправлял я сама на следующий день отправилась в туб диспансер за справкой о том что я у них не состаю на учёте. Но врачи увидевшие заключение кальцинаты предложили пройти кт, результат мелкие очаги в обоих лёгких, предложили сделать манту, результат 22мм, провели микроскопию мокроты результат отрицательный, было решение отправить на лечение и диагноз очаговый туберкулёз, на мою простуженность ни кто не обратил внимания и сказали что моя простуда не влияет на результат манту.После принятие 2х недельного курса припоратов, мне становилось все хуже и хуже (тошнота, рвота, головокружение) так как я сомневалась в правильности постановки диагноза, я прошла исследование t-spot, результат отрицательный, ещё после 2 недель я пошла флюрографию в 2х проекциях результат лёгкие и сердце в норме. Показав результаты исследования врачу он сказал что я всеровно болею туберкулёзом и мои исследования не информативны, я сделала кт на нем без изменений остались мелкие кальцинаты. Подскажите пожалуйста верно ли поставлен диагноз очаговый туберкулёз? Ведь t-spot и флюрография показала отрицательные результаты. Можно ли ещё что нибудь пройти что бы опровергнуть или подтвердить данный диагноз? Время пройти 3х месячное лечение просто так нет, если действительно не больна
На сервисе СпросиВрача доступна консультация фтизиатра по любой волнующей Вас проблеме. Врачи-эксперты оказывают консультации круглосуточно и бесплатно. Задайте свой вопрос и получите ответ сразу же!
Гинеколог, Инфекционист, Педиатр
Здравствуйте. Сделайте диаскин тест и предъявите все результаты врачам
Стоматолог, Детский стоматолог
Здравствуйте. Нужно сделать диаскин тест
Педиатр
Здравствуйте т спот отрицательно
Это говорит что туберкулеза нет
Возможно поражение лёгких атипичными микроорганизмами
Сдайте кровь на вэб цмв впг токсоплазму хламидии и микоплазмы методом ифа igg m
Ветеринар
Здравствуйте. Туберкулеза у вас нет
Педиатр, Массажист
А почему Вам диаскин тест при постановке диагноза не сделали? Раз идёт такая штука, пишите жалобу в Минздрав и страховую компанию. А начните с заведующего тубдиспансером, ему написать жалобу с требованием коллегиального( консилиум) заключения по Вашему случаю. Вот если откажут- жалоба дальше. Только предупредительный их о своих дальнейших планах.
Клиент
Здравствуйте, дело в том что в больнице сказали что диаскинтеста нет, провели манту и говорят что этого хватит для того что бы начать лечить меня. Была у глав врача, собирали комиссию все говорят в один голос что туберкулёз у меня есть, и нужно его лечить а данные теста это все ерунда. Я написала жалобу в здравохранение неделю назад, и сегодня заведующий отделением сообщил что будут проводить бронхоскопию.почему раньше не провели я не пойму. И я буду дальше проходить лечение, не зависимо от результатов
Уролог, Андролог
Здравствуйте. Необходимо дообследоваться — пройдите Диаскин-тест. Сдайте методом ИФА кровь на персистирующие инфекции — на вирус Эпштейна-Барра, цитомегаловирус, микоплазму, токсоплазму, хламидии, вирус простого герпеса.
Педиатр, Массажист
Странная ситуация. Настаивайте на диасктнтесте, напишите таки жалобу , пусть » разбирают полёты» минздрав и страховая компания. В нашей стране психиатры и фтизиатры делают тебя практически бесправным….
Клиент
Спасибо) буду искать тогда другие пути решения этой проблемы
Фтизиатр
Здравствуйте, заключение обследования немного странное. Необходим рентген органов грудной клетки через 2-3 месяца, не ФГ, а именно рентген. Или КТ, но здесь доза облучения достаточно высокая. А у вас за короткое время уже было несколько рентген — обследований. Обычно взрослым делают Диаскин-тест ( реакция Манту чаще для детского возраста ). Вам можно подойти к руководителю данного туб.диспансера для решения этого вопроса. Если вопрос не будет решен — подать заявление на решение вопроса врачебной комиссией. Или обратиться в другой диспансер. Туберкулёз у вас под очень большим сомнением, но это придется доказать. На счёт лечения — вы сейчас можете официально письменно отказаться от лечения, написав, что это временно и вы отвечаете за возможные последствия сами, что согласны продолжить лечение, если туберкулёз будет доказан. Удачи вам и зжоровья.
Клиент
Здравствуйте, спасибо за ответ. КТ делали 2 раза. И на обоих видны мелкие очаги, от чего они могут быть если это не туберкулёз? мне ставили манту месяц назад могу ли делать сейчас диаксин тест?
Фтизиатр
Простите, описка : Удачи вам и здоровья.
Фтизиатр
Во-первых, Манту и Диаскин-тест можно делать одновременно на обеих руках. Во-вторых, мелкие петрификаты могут быть и в результате давно перенесенного туберкулеза под видом бронхита или затянувшейся простуды ( такие случаи не редки ), и в результате бронхита, пневмонии. Но чаще после перенесенного ( даже в детстве ) лёгкой формы туберкулезного процесса. Но это не причина ставить вам диагноз туберкулёз на сегодняшний момент.
Клиент
Подскажите пожалуйста, я пропила 2 недели Противотуберкулезные припораты, затем после результатов t-spot бросила их принимать, каковы последствия? Или все же нужно было их пропить (просто от них было очень плохо, болели почки, рвота, головокружение)
Фтизиатр
Дело в том, что противотуберкулезные препараты нередко плохо переносятся. Но просто прекращать лечение тоже нельзя, т.к. может развиться устойчивая форма туберкулёза, которую в дальнейшем сложно лечить. Но две недели роли не сыграют. Об этом не беспокойтесь
Клиент
Можно ещё вопрос) А если я ранее перенесла туберкулёз t-spot показал бы результат или нет? И если я его перенесла организм само излечился? А ещё мне спустя месяц после того как я написала жалобу в здравохранение назначали бронхоскопию, что она покажет? И стоит ли её делать? я боюсь что они могут сфальсифицировать результаты, так как уже подделали результаты осмотра в лечебной карте которого не было, ко мне и пальцем не притронулись а в карте было прописано что произведен осмотр, так же я не здавала анализ на яйцеглист а в карте прописан результат
Фтизиатр
Если туберкулёз был, значит организм инфицирован, человек здоров, но антитела микобактерий присутствуют. Можно инфицироваться и без туберкулёза ( положительная реакция Манту у детей ). Поэтому, Манту, Диаскин-тест, Тспот могут быть положительными. Бронхоскопия покажет состояние слизистой трахеи и бронхов, возможна биопсия кусочка слизистой, с последующей гистологией. Но, к сожалению, сфальсифицировать можно, вы правы. А лёгкая форма туберкулёза при невосприимчивости к микобактериями, при хорошем противотуберкулезном иммунитете может быть как затянувшийся бронхит и вылечиться самостоятельно. К сожалению, такое встречается не часто.
Клиент
Спасибо Вам огромное, за подробную информацию
Оцените, насколько были полезны ответы врачей
Проголосовало 8 человек,
средняя оценка 4.5
Что делать, если я не нашел ответ на свой вопрос?
Если у Вас похожий или аналогичный вопрос, но Вы не нашли на него ответ — получите свою 03 онлайн консультацию от врача эксперта.
Если Вы хотите получить более подробную консультацию врача и решить проблему быстро и индивидуально — задайте платный вопрос в приватном личном сообщении. Будьте здоровы!




