Неонатальный скрининг — это комплекс мероприятий, который дает возможность выявить какие-либо заболевания на доклинической стадии, что позволяет своевременно начать лечение. К сожалению, учитывая большое количество материала, возможны различные ошибки и получение как ложноположительных, так и ложноотрицательных результатов.
Впервые в 1962 году Роберт Маккриди совместно с Робертом Гатри организовали сбор бланков из фильтровальной бумаги с сухими пятнами крови от каждого новорожденного в штате Массачусетт и тестировали их на фенилкетонурию. В настоящее время массовый скрининг новорожденных проводится в 52 странах мира: США — на 45 нозологий, в Германии — 14, Великобритании -5, России -5 (фенилкетонурия, врожденный гипотиреоз, врожденная дисфункция коры надпочечников, галактоземия, муковисцидоз).
Впервые скрининг на врожденный гипотиреоз был проведен в Канаде в 1973 г. путем определения концентрации тироксина (Т4) в капле крови на фильтровальной бумаге радиоиммунологическим методом.
Почему же возникают ошибки при проведению скрининга с целью выявления врожденного гипотиреоза и врожденной дисфункции коры надпочечников (дефицита 21-гидроксилазы)?
Возникновение ошибок при проведении скрининга на врожденный гипотиреоз возможно на всех этапах обследования. Важно учитывать сроки и правила забора крови. Кровь забирается путём чрезкожной пункции (чаще из пятки) на 4-5 день после рождения у доношенных и на 7-14 день у недоношенных детей. Кровью объёмом 6-8 капель полностью пропитывают специальную фильтровальную бумагу.
Возможны ошибки при измерении результатов.
Так же есть ошибки, связанные с нарушением информирования, игнорировании полученных данных.
Существуют варианты гипотиреоза, прикоторых возможно более позднее повышение ТТГ (после взятия скрининговой программы).
Есть варианты гипотиреоза, при которых отсутствует повышение ТТГ (вторичный, резистентность тканей к тиреоидным гормонам).
Ложноположительные результаты могут возникать при ошибке метода. Ложноотрицательные методы — при вторичном гипотиреозе, гипотиреозе, связанном с резистентностью тканей к гормонам щитовидной железы.
В первые недели жизни ребенка заподозрить дефицит 21-гидроксилазы позволяет наличие вирилизации наружных гениталий у девочек и развитие синдрома потери соли у детей обоего пола. Вирильная форма заболевания у мальчиков диагностируется только к 4-5 годам жизни, при появлении симптомов преждевременного полового развития. Костный возраст при этом уже значительно опережает хронологический. Подобный клинический подход к диагностике 21-гидроксилазного дефицита приводит к большому количеству ошибок. До 30% девочек с тяжелыми проявлениями вирилизации наружных гениталий ошибочно регистрируются в мужском поле. До 35% мальчиков с сольтеряющей формой заболевания погибают в первые недели жизни, т.к. заболевание остается нераспознанным.
Своевременно поставить диагноз позволяет неонатальный скрининг на выявление 21-гидроксилазного дефицита, при котором определяется уровень 17 — гидроксипрогестерона. Этот метод был предложен Pung с соавт. в 1977 г. К 1991 г. Программу неонатального скрининга внедрили 29 стран мира.
При заборе крови в роддоме в сопроводительных документах, отсылаемых в лабораторию, помимо стандартной информации необходимо указать вес новорожденного, срок гестации при недоношенности, прием матерью и (или) ребенком дексаметазона, выраженная билирубинемия , применение в/в трансфузии до взятия крови на скрининг.
Выполняется исследование уровня 17ОНП, проводится выборка положительных результатов и повторно тестируются сомнительные результаты. Для детей, рожденных на различных сроках гестации, используются отдельные нормативные стандарты уровня 17ОНП. Это обусловлено тем, что уровень 17ОНП у недоношенных и маловесных детей значительно выше, чем у детей, рожденных в срок и имеющих нормальный вес. Отсутствие нормативной шкалы значений 17ОНР может приводить к большому числу ложноположительных результатов. В лабораториях, осуществляющих скрининг, необходим постоянный контроль качества проведения гормонального исследования. К 9-10 дню жизни доношенного ребенка лабораторная обработка результатов должна быть закончена. Информация о всех положительных результатах должна быть немедленно направлена в поликлинику по месту жительства ребенка или в стационар, где он еще может находиться.
Помимо недоношенности, ложноположительные результаты могут определяться у новорожденных детей с тяжелым общим соматическим состоянием, у детей на фоне в/в трансфузии, у детей с высокой билирубинемией. Ложноотрицательные результаты могут определяться у детей, матери которых (и/или сам ребенок) получали терапию дексаметазоном с целью профилактики и лечения легочной патологии новорожденных (недостаток сульфактана).
Учитывая значительный процент ложноположительных результатов, особенно у недоношенных детей, при отсутствии клинических симптомов следует дважды с интервалом 1-2 недели проводить определение 17ОНП в сыворотке крови, прежде чем начать лечение. Детям с диагностированным адреногенитальным синдромом необходимо проведение молекулярно-генетического исследования для выявления мутаций в гене CYP21. Молекулярно-генетическая диагностика у пациентов с положительным результатом гормонального исследования внедрена в качестве второго этапа скрининга в некоторых странах для уменьшения количества ложноположительных результатов. Проблемой, сдерживающей широкое внедрение данного метода, является его высокая стоимость. Выявление конкретных мутантных аллелей помогает подтвердить диагноз и дифференцировать форму заболевания, что позволяет адекватно подобрать дозы препаратов в периоде новорожденности и раннем детском возрасте. Исследование мутаций в гене СУР21 дает возможность провести дифференциальный диагноз между дефицитом 21-гидроксилазы и 11в-гидроксилазы — гипертонической формой ВДКН, имеющей сходную клиническую картину и сопровождающейся умеренным повышением 17-ОНП. Эффективным методом уточняющей диагностики является анализ стероидного спектра методом жидкостной хроматографии с тандемной масс-спектрометрией, позволяющей оценить уровни 17-ОНП, кортизола и андростендиона. Это дает возможность четко дифференцировать ферментативный дефект при заболевании.
В своей практике не редко приходится сталкиваться с ложноположительными результатами. За время появления скрининговой программы в Крыму по определению дефицита 21-гидроксилазы ложноотрицательных результатов не было.
Несколько отходя от основной темы, но о скрининге. За последние 6 мес. у нас выявлено 3 ребенка с синдромом Дауна. Двоим диагноз поставлен в роддоме. Третьего ребенка с фенотипом синдрома Дауна ко мне на консультацию прислал педиатр с жалобами на большой язык, плохую прибавку в массе, задержку психо-моторного развития. Направила на кариотипирование, результат — 47, ХХ+21. Двое детей от молодых здоровых родителей. Все матери даунят стали на учет на ранних сроках беременности, которые были желанные и запланированные. Соответственно, все скрининговые программы в период беременности проводились.
Поэтому, уважаемые коллеги, если у Вас есть какие-то подозрения, помните, что любой скрининг может выдавать ошибочный результат. Для уточнения диагноза нужно использовать более точные методы исследования.
Литература
1. Петеркова В.А. Врожденная дисфункция коры надпочечников у детей , М., 2003.
2. Дедов И.И., Петеркова В.А. Детская эндокринология., М., 2006
Первичные иммунодефициты (ПИД, врожденные ошибки иммунитета) — это генетические заболевания, которые влияют на развитие и функцию иммунной системы, тем самым повышая восприимчивость к инфекционным патогенам, аутоиммунитету и злокачественным новообразованиям.

Согласно мировым данным, ранняя диагностика посредством скрининга новорожденных позволяет начать своевременное лечение с достижением высоких показателей выживаемости. В отличие от индивидуального персонифицированного клинического обследования скрининговый тест дает возможность заподозрить редкое, но серьезное состояние еще до развития клинических проявлений.
Причины ПИД
ПИД является наследственным заболеванием, то есть передается в семьях так же, как фенотипические характеристики, такие как цвет глаз, передаются от родителей к ребенку. Это вызвано ошибкой (мутацией) в генетической последовательности ДНК.
Определение генетической причины важно не только для установления диагноза, но и для генетического консультирования членов семьи. Генетические дефекты могут быть унаследованы от родителей или могут быть связаны со спонтанными мутациями (de novо).
При ТКИН генетическое нарушение в последовательности ДНК может быть унаследовано либо как Х-сцепленный (сцепленный с полом) дефект, когда ген наследуется от матери, в таком случае вероятность рождения больного ребенка составляет 50 % и болеют только мальчики, либо как дефект с аутосомно-рецессивным типом наследования, при котором дефектный ген наследуется от обоих родителей и в 25 % случаев вызывает заболевание у детей обоего пола.
Дефицит клеточного и гуморального иммунитета
Младенцы с ТКИН, как правило, выглядят здоровыми при рождении, но очень восприимчивы к тяжелым, угрожающим жизни вирусным, бактериальным и грибковым инфекциям.
Согласно мировым данным, за последние годы из крайне редких заболеваний с дебютом в раннем возрасте ПИД концептуально превратились в относительно распространенные заболевания нарушенного контроля за иммунным гомеостазом, которые могут проявиться самой различной симптоматикой.
Еще 5 лет назад считалось, что частота ТКИН составляет 1:100 000, однако внедрение неонатального скрининга на выявление ПИД, которое проводится с 2018 года во всех штатах США и более чем в 20 европейских странах, позволило получить более точную оценку встречаемости, которая составляет 1:10 000–28 000.
Единственным методом лечения для таких пациентов является трансплантация гемопоэтических стволовых клеток (ТГСК), позволяющая не только сохранить жизнь, но и обеспечить ее качество, если она проведена своевременно.
Ранняя диагностика и лечение играют решающую роль в выживании пациентов. Возможность выявления у новорожденных детей ПИД, обусловленных наличием генетического дефекта, — актуальный запрос современной медицины во всем мире, в том числе и в Республике Беларусь.
В этом может помочь только неонатальный скрининг, показавший высокую эффективность в тех странах, где он проводится.
Диагностика врожденных ошибок иммунитета
Одним из перспективных и высокоэффективных методов выявления ПИД и других форм лимфопении является метод количественного определения кольцевых фрагментов ДНК Т- и В-клеточных рецепторов TREC и KREC (с англ. T-cell receptor excision circles (TREC) — эксцизионное кольцо Т-клеточного рецептора и Kappa-deleting recombination excision circles (KREC) — эксцизионное кольцо делеционного элемента иммуноглобулина каппа), которые являются маркерами новообразовавшихся T- и В-лимфоцитов. Благодаря наличию в составе TREC и KREC консервативных последовательностей ДНК их удается определить с помощью ПЦР.
В мире существует несколько тест-систем, некоторые из них используются для определения только TREC, некоторые для одновременного определения и TREС, и KREC, что является наиболее оптимальным, так как позволяет выявить не только Т-, но и В-клеточную лимфопению.
Скрининговые исследования с использованием TREC и KREC успешно применяются в США, Италии, Швеции, Германии, Нидерландах, Франции, Испании, Норвегии. В России недавно утверждена государственная программа скрининга ПИД, планируется внедрение данного метода.
В Беларуси существует собственный метод количественного определения кольцевых фрагментов ДНК Т- и В-клеточного рецептора (TREC/KREC) посредством ПЦР в режиме реального времени, разработанный на базе РНПЦ ДОГИ.
Метод обладает высокой эффективностью, чувствительностью и специфичностью в отношении определения дефицита Т- и В-лимфоцитов. Немаловажно, что для проведения исследований используются отечественные реагенты.
Метод доказал свою клиническую эффективность в диагностике ПИД и представлен в четырех инструкциях по применению, утвержденных Минздравом. В настоящее время применяется в РНПЦ ДОГИ для выявления врожденных нарушений иммунитета.
Неонатальный скрининг на выявление ПИД
Обоснование скрининга новорожденных вытекает из знаний о том, что ТКИН потенциально излечима, но не распознается эффективно до начала опасных для жизни ребенка инфекций.
Впервые в Беларуси в Минске с апреля этого года начинается совместный пилотный проект РНПЦ ДОГИ и комитета по здравоохранению Мингорисполкома по скринингу новорожденных на ПИД. Это позволит вовремя распознать врожденное нарушение иммунной системы и провести своевременное лечение. Пилотное скрининговое исследование будет проводиться в течение года, за этот период будет обследовано около 12 тысяч новорожденных.
Что нужно для проведения исследования? всего одно пятно сухой капли крови, которая берется у новорожденного из пятки и наносится на фильтровальную бумагу.
Особенности определения TREС и KREC
Для скринингового исследования на ПИД будет использована мультиплексная ПЦР в режиме реального времени с одновременным исследованием сразу двух маркеров. Оптимальный срок выполнения данного исследования определяется маркером TREC, что обусловлено процессом онтогенеза иммунной системы с более поздним появлением Т-лимфоцитов в системе кровообращения плода. Поэтому важно учитывать гестационный возраст новорожденного и проводить исследование не ранее возраста, соответствующего 36–37 неделям гестации, так как именно с этого возраста показатели TREC и KREC не отличаются от таковых у доношенных новорожденных.
Когда есть подозрение на ТКИН или комбинированный иммунодефицит, который, как правило, является наиболее частым «сценарием» у недоношенных детей, первыми диагностическими шагами все же должен быть скрининг новорожденных с определением эксцизионных колец Т- и В-клеточных рецепторов (TREC/KREC).
Получение низких показателей относительно нижнего порога нормальных значений TREС и/или KREC — повод для иммунологического и молекулярно-генетического обследования.
Согласно мировым данным, средний возраст постановки диагноза ПИД при отсутствии скрининга колеблется в разных странах от одного дня до полутора лет, составляя в среднем 4 месяца. В семьях с отягощенным анамнезом по ПИД такие дети, как правило, выявляются раньше и начинают получать адекватное лечение в более раннем возрасте, до развития тяжелой инфекции, однако частота случаев семейной патологии составляет не более 20 % общего количества пациентов с ПИД. Именно поэтому проведение скрининга на выявление врожденных ошибок иммунитета позволит улучшить раннюю диагностику, что является залогом эффективного лечения.
Затраты на один анализ по определению TREC/KREC составляют ориентировочно 20 белорусских рублей. Выявление одного новорожденного с ПИД и проведение ТГСК в первое полугодие его жизни позволит сэкономить до 300 тысяч белорусских рублей в сравнении с затратами на лечение и пребывание ребенка в стационаре.
Ранняя диагностика, до того, как у младенца появятся какие-либо инфекции, чрезвычайно важна, поскольку ТГСК, проведенная в первые три с половиной месяца жизни, дает 94 % успеха до начала инфекции.
Клинические случаи
Девочка Е., родилась от 3-й беременности, 3-х срочных родов. Масса тела при рождении 4 080 г, рост 53 см. В возрасте 2,2 месяца появилась мелкоточечная геморрагическая сыпь на коже нижних конечностей и лице. Анамнез отягощен: смерть сестры в возрасте 6 месяцев. При патологоанатомическом исследовании: в тимусе отсутствие лимфоцитов и телец Гассаля, тяжелая пневмония, гепатит, полиорганные функциональные расстройства. Диагноз ТКИН установлен посмертно.
В возрасте 3 месяцев пациентка поступает в РНПЦ ДОГИ. Количество копий TREC — 0 копий/106 [2,2×106–4,5×105], KREC — 8,2×103 копий/106 [2,0×103–2,9×105]. ОАК: нейтрофилез со сдвигом влево, лейко- и лимфопения (лейкоциты 3,7×10⁹/л [5,5–13,0×10⁹/л], лимфоциты 1,4×10⁹/л [3,5–9,0×10⁹/л]). В иммунограмме снижено количество Т-лимфоцитов (СD3+ — 0,05×10⁹/л [0,6–2,2×10⁹/л]), повышено количество В-лимфоцитов (CD19+ — 0,92×10⁹/л [0,11–0,53×10⁹/л]), нормальное количество натуральных киллеров (CD3-CD16+CD56+ — 1,26×10⁹/л [0,1–1,9×10⁹/л]).
Результат УЗИ: печень выступает из-под реберной дуги +0,5–1 (см).
Учитывая семейный анамнез, данные TREС/KREC иммунологического исследования, девочке установлен диагноз ТКИН с иммунофенотипом T-B+NK+. Выполнена ТГСК. Посредством секвенирования следующего поколения (англ. Next-generation sequencing, NGS) была установлена генетическая причина ТКИН — вариант в гене альфа цепи ИЛ-7 (IL7Rα).
В данной ситуации установление генетического диагноза имеет положительное значение для семьи, поскольку знание о семейном случае ТКИН позволит вести следующую беременность мамы девочки E. с обязательным медико-генетическим консультированием и перинатальной диагностикой.
Девочка У., родилась от 2-й беременности, 2-х преждевременных родов с гестационным возрастом 32 недели. В возрасте 2 месяцев поступила в РНПЦ ДОГИ. Температура тела 38,0 °С. C-реактивный белок 0,79 мг/дл [менее 0,5 мг/дл]. В ОАК анемия (Hb 109 г/л [125–175 г/л], эритроциты 3,75×1012/л [3,8–5,6×1012/л]), лейко- и лимфопения (лейкоциты 4,23×109/л [6,5–14,0×109/л], лимфоциты 2,96×109/л [3,5–9,0×109/л]. Клинический анамнез: генерализованная ЦМВ-инфекция.
При проведении определения количества копий TREC и KREC данные маркеры в периферической крови не детектировались (TREC=0 копий, KREC=0 копий), исследование проведено дважды. При иммунологическом исследовании Т-лимфоциты в норме лимфоцитов (СD3+ — 2,85×109/л [0,6–2,2×109/л]), В-лимфоциты снижены (CD19+ — 0,003×109/л [0,11–0,53×109/л]), снижены натуральные киллеры (CD3+CD16+CD56+ — 1,5 % [5–25 %]), низкое относительное содержание тимических мигрантов (CD4+CD31+CD45RA+ — 1,8 % [49–85 %]).
Пациентке поставлен диагноз ТКИН (Т-В-NK-). Проведено молекулярно-генетическое исследование и выявлен компаунд из двух патогенных гетерозиготных мутаций в гене RAG1, приводящих к ТКИН. Девочке выполнена ТГСК в возрасте 7 месяцев.
Мальчик М., гестационный возраст при рождении 25–26 недель. Масса тела при рождении 980 г, рост 30 см. Рожден от 1-й беременности, 1-х преждевременных родов. Оценка по шкале Апгар 6/8 на первой минуте. С рождения находился на ИВЛ, состояние тяжелое. Новорожденный ребенок был обследован и находился под наблюдением на базе РНПЦ «Мать и дитя».
В ОАК при рождении отмечается лейкоцитоз (лейкоциты 71,6×109/л [10,0–30,0×109/л]) и относительная лимфопения (лимфоциты 13,6 % [24,0–40,0 %]). При клинико-лабораторном исследовании установлен диагноз: сепсис новорожденного, обусловленный анаэробными организмами. На базе РНПЦ ДОГИ пациенту при фактическом гестационном возрасте 26–27 недель было выполнено определение количества TREC и KREC и субпопуляционного состава лимфоцитов периферической крови. Отмечалось снижение копий TREС с нормальным количественным содержанием KREC (TREC — 1×103 копий/106 [2,2×103–4,5×105], KREC — 1,6×104 копий/106 [2,0×103–2,9×105] лейкоцитов периферической крови).
При иммунологическом обследовании выявлено снижение относительного содержания Т-лимфоцитов (СD3+ — 27,4 % [41,0–88,0 %], наивных Т-лимфоцитов (CD3+CD45RA+ — 50,2 % [61,0–93,0 %], количество В-лимфоцитов в норме (CD19+ — 34 % [4–37 %]). У младенца отмечался дисбаланс клеточного и гуморального звеньев иммунитета, что характерно для недоношенных новорожденных.
При достижении гестационного возраста 27–28 недель исследования повторили. Отмечалось еще большее снижение TREC, показатели KREС оставались в диапазоне нормальных значений (TREC — 0,3×103 копий/106, KREC — 1,2×104 копий/106 лейкоцитов). Все так же отмечалась Т-клеточная лимфопения (СD3+ — 33,4 %), наивные Т-лимфоциты (CD3+CD45RA+ — 21,4 %). Состояние ребенка продолжало оцениваться как тяжелое.
Относительно клинической картины сепсиса, низких наивных лимфоцитов и показателей TREC возникла настороженность относительно диагноза ТКИН. Новорожденный был проконсультирован врачом-иммунологом РНПЦ ДОГИ Юлией Жаранковой, продолжено дальнейшее наблюдение для исключения/установления диагноза ТКИН.
На 27-й день жизни, когда гестационный возраст новорожденного составлял 29–30 недель, было проведено повторное исследование ОАК, уровней TREC и KREC и субпопуляционного состава лимфоцитов. В ОАК все также лейкоцитоз (лейкоциты 36,6ґ109/л), количество TREC все еще снижено, KREC в норме (TREC — 0,9×103 копий/106, KREC — 5,4×103 копий/106 лейкоцитов периферической крови). Относительное содержание Т-лимфоцитов и наивных в норме (СD3+ — 67,0 %, CD3+CD45RA+ — 78,8 %). Состояние новорожденного тяжелое.
Когда гестационный возраст мальчика достиг 35 недель, повторное исследование TREC и KREC показало, что и TREC и KREC были в диапазоне нормальных значений (TREC — 2,2×104 копий/106, KREC — 2,1×104 копий/106 лейкоцитов периферической крови). По данным иммунологического исследования CD3+ T-лимфоциты и наивные лимфоциты были также в диапазоне нормальных значений.
На 47-й неделе клиническая картина сепсиса разрешилась. По данным ОАК (лейкоциты 6,0×109/л, лимфоциты 58 %), количество наивных лимфоцитов было в норме, показатели TREC и KREC также оставались в диапазоне нормальных значений.
Таким образом, наблюдаемая лимфопения могла быть обусловлена незрелостью ребенка и клиническим статусом. По причине физиологически нормальных по возрасту иммунологических показателей генетическое исследование не проводилось.
Недоношенные дети имеют незрелую иммунную систему (с точки зрения как врожденного, так и адаптивного иммунного ответа), что является одной из причин их восприимчивости к различным тяжелым бактериальным, грибковым и вирусным инфекциям.
Учитывая наличие физиологического иммунодефицита недоношенных и возможного ПИД, специалисты в отделениях интенсивной терапии, неонатологи должны иметь высокую настороженность относительно ПИД при рецидивирующих или непрекращающихся инфекциях и воспалениях.
Именно по причине незрелости иммунной системы недоношенных новорожденных с целью исключения ложноположительных результатов рекомендуется проводить скрининговое исследование с определением TREC и KREC у таких детей не ранее 36 недель гестационного возраста.
Скрининг в период новорожденности — это массовое обследование детей, практикуемое не только в нашей стране, но и в странах Европы и Америки. Обычно его еще называют «пяточным» тестом и проводят для всех детей, рожденных в любых учреждениях родовспоможения. Необходимость данного скрининга продиктована ростом заболеваемости тяжелыми, но вполне поддающимися коррекции в раннем возрасте заболеваниями у младенцев. Сегодня в число болезней, которые выявляет скрининг, относят пять серьезных патологий.
Скрининг новорожденного — что это и зачем?
Такой анализ выполняется всем детям без исключений в период 4-5 суток (либо, по показаниям, и позднее). Результат этого скрининга будут получены позднее, через три-четыре недели, уже в поликлинике, если выявлены те или иные отклонения. Переживать по поводу проведения подобного исследования не стоит — это нужное и важное мероприятие. По мнению докторов, скрининг новорожденного относится к наиболее эффективным мерам ранней диагностики генетических и обменных патологий в раннем возрасте, когда еще можно начать коррекцию и сохранить малышу здоровье. Данный скрининг новорожденного рекомендован к массовому проведению ВОЗ и внедрен во многих странах как обязательное и бесплатное для родителей исследование. Наша страна практикует подобное исследование уже более 15 лет, и его результаты позволили вовремя выявить детей с проблемами и оказать им квалифицированную помощь, не допуская серьезных осложнений.
Проведение скрининга у детей
У нас в стране проводится скрининг пяти самых серьезных и тяжелых патологий, другие страны практикуют выявление до 40 различных патологий. Если ребёнок относится к группе риска и родители хотят провести дополнительное обследование (оно платное), скрининг можно расширить до 16 возможных патологий. Возникает вопрос, почему именно пять патологий? В списке исследуемых находятся те болезни, которые при раннем их выявлении, поддаются лечению, или степень их тяжести может быть значительно уменьшена. В основном, это болезни обмена, а вот хромосомные аномалии сюда не включены.
Забор крови для анализа проводится по строгим срокам — дети, рожденные доношенными, обследуются на 4-5 сутки, для недоношенных сроки сдвигают позже 7 дня. При выписке новорожденного ранее этого срока, забор крови для анализа проводится на дому или в условиях поликлиники, за которой закрепили малыша. Исследуют капиллярную кровь, взятую из пяточки, отсюда и название метода. Капельки крови наносят по особым методикам на пять круглых бланков с особой фильтровальной бумагой. Важно, чтобы анализ был взят натощак, примерно 3 часа до забора ребёнка не кормят.
Важно, чтобы сроки скрининга были соблюдены. Дети, которым анализ взят ранее (на 1-3 сутки жизни), могут давать ложные результаты (как положительные, так и отрицательные). Но и позже 10 суток кровь забирать нежелательно, это затянет получение результата, для многих из выявляемых патологий ценным будет буквально каждый день.
Что может выявить скрининг новорожденного
Первое, что может выявить скрининг новорожденного, это состояние врожденного гипотиреоза (резко подавленные функции щитовидной железы). Если вовремя не начать терапию, последствия этой патологии серьезны — задержка как физического роста и развития, так и сильная психическая отсталость, вплоть до кретинизма. Встречается с частотой 1:5000 новорожденных, при своевременном выявлении дети имеют шансы на полную коррекцию патологии. Конечно, потребуется практически пожизненный прием замещающих гормонов, но это позволит детям расти и развиваться полноценно как физически, так и умственно.
Помимо этого, скрининг новорожденного помогает в выявлении муковисцидоза. Это генетическая патология, приводящая к нарушению секреции желез дыхательной и пищеварительной систем. Встречается у 1 из 3000 детей, при раннем начале заболевания, дети имеют благоприятные прогнозы для жизни и здоровья при условии адекватной терапии.
Реже выявляют адреногенитальный синдром (1:15тыс), но он проявляет себя нарушением выработки у детей гормонов корой надпочечников. Это существенно влияет на развитие органов и тканей, работу сердца. Патология без адекватной терапии смертельно опасна, лечение будет заключаться в пожизненном приеме препаратов.
Еще две патологии, которыми могут страдать дети, и которые выявляет скрининг — это галактоземия и фенилкетонурия. Это генетические заболевания, при которых страдает выработка особых ферментов, участвующих в метаболизме. Они приводят к тяжелым и необратимым последствиям, если своевременно их не выявить. Лечением подобных проблем будет пожизненная диета с исключением галактозы или фенилаланина.
Вопросы по результатам скрининга
Вокруг данного анализа существует много споров, и те родители, у кого результаты скрининга оказались ложно-положительными, пережили множество тяжелых минут. Но те, кому данный скрининг дал своевременные данные о болезни ребёнка, ему благодарны. Дети получили лечение своевременно, что позволило им сохранить здоровье и полноценно развиваться. Поэтому, важно знать ответы на основные вопросы, кающиеся данного обследования. И прежде всего, как узнать результаты скрининга. Готовится анализ до трех недель, поэтому, если в месячном возрасте на приеме педиатр вам ничего не сообщил, значит, результаты отрицательны. Если же результаты положительны — это ее не диагноз, но вам сообщат из клиники, что необходимо прохождение повторных анализов и углубленного обследования. Иногда бывают ложно-положительные результаты (особенно в случае муковисцидоза).
Если повторно выявлены позитивные результаты скрининга, необходимо посещение генетика и направление на обследование к врачам-специалистам и более прицельные анализы. После подтверждения диагноза, производится немедленное принятие решения о лечении крохи.
Насколько результаты скрининга достоверны, но могут ли они не показать болезнь? Если анализ взят правильно, натощак, то его результаты достаточно достоверны. Но это еще не диагноз. Кроме того, в редких случаях бывает так, что при отрицательном результате заболевание есть, и оно выявится уже позднее, при наличии первых симптомов.
Педиатрия. Национальное руководство / под ред. А. А. Баранова – 2014
Неонатальный скрининг новорожденных ХМАО в 1999-2003 гг / Кунцевич Н.В., Белошицкая Т.А., Урванцева И.А. // Медицинская генетика – 2005 – Т. 4 №5
Аудиологический скрининг новорожденных / Шилова Н.А., Харламова Н.В., Чаша Т.В., Толкачева Е.В. // Вопросы практической педиатрии – 2009 – Т. 4 №S1
Основными задачами неонатального скрининга муковисцидоза (НС МВ) являются раннее выявление детей с этим наследственным заболеванием, до развития клинической картины и сокращение (в перспективе) распространенности МВ в популяции. Доказаны очевидные преимущества ранней диагностики МВ на доклиническом этапе, такие как улучшение показателей выживаемости[1], физического и когнитивного развития[2], функции дыхательной системы[3], снижение психологической нагрузки в семье пробанда в процессе диагностического поиска.
За последние 30 лет НС МВ прошел три фазы развития:
- определение уровня иммунореактивного трипсиногена (ИРТ) в 1970-х гг.;
- оценка его применимости в качестве биомаркера в ряде клинических исследований в начале 1980-х гг.;
- внедрение и распространение измерения его содержания в программах НС в системах здравоохранения развитых стран (1980–1990-е гг.)[4, 5].
В России НС МВ был начат в ряде регионов с июня 2006 г. в качестве пилотного проекта, а с января 2007 г. является обязательным во всех регионах в соответствии с Приказом Минздравсоцразвития РФ № 185 от 22.03.2006 г. «О массовом обследовании новорожденных детей на наследственные заболевания».
При этом сохраняется необходимость совершенствования подходов к оценке результатов НС МВ, поскольку концентрация ИРТ в крови новорожденных весьма динамична. Считается, что даже у здоровых детей в первые три дня после рождения она может повышаться до 58 нг/мл,затем снижаться, на 4-й день вновь повышаться, снижаясь на 5-й день, и еще раз увеличиваться к 8-му дню[6]. Возможные причины таких скачков — недоношенность и неонатальный стресс[7].
Кроме того, показано, что факторы внешней среды могут значительно влиять на уровень ИРТ в исследуемых образцах: так, он снижался на 40% в течение недели при хранении сухих пятен крови на бланках НС при температуре 27 °С и влажности 80%[8]. Загрязнение сухих пятен крови фекалиями новорожденного ведет к ложноположительному результату[9]. Считается, что повышенная температура (особенно в летние месяцы) способствует снижению активной концентрации исследуемого аналита в пятнах крови[9]. Данное обстоятельство для территории ХМАО-Югры играет весомую роль вследствие сложной логистики доставки в центральную генетическую лабораторию образцов крови из отдаленных территорий округа.
Подобная индивидуальная вариабельность сильно осложняет определение корректных референсных интервалов, необходимых для выявления МВ. Более того, тип питания (грудное/искусственное вскармливание) и этническая гетерогенность исследуемой популяции (популяционная вариабельность) также вносят свой вклад в размытость референсных интервалов при их оценке[10, 11]. О проблеме ложноположительных результатов измерения содержания ИРТ говорится и в Национальном консенсусе «Муковисцидоз: определение, диагностические критерии, терапия»[12].
В ранее представленном нами исследовании, анализировавшем результаты НС МВ в ХМАО-Югры за период 2006–2014 гг., выявлено наличие большого количества ложноположительных результатов тестирования ИРТ-1[13] и обоснована по этой причине необходимость уточнения региональных референсных показателей ИРТ. Пороговое значение биомаркера является верхней точкой так называемого референсного интервала, который представляет собой интервал значений, куда входят данные пациентов с характеристиками, аналогичными подобным у участников референс-группы[14].
В практической работе многие лаборатории используют референсные интервалы, опубликованные другими исследователями, установленные на другом оборудовании и для других популяций[15]. Это может привести к значительным искажениям реальных операционных характеристик лабораторного теста (чувствительности, специфичности и пр.). Более того, сам производитель наборов для НС МВ (Pribory Oy) в инструкции к ним указывает на необходимость разработки локальных референсных пороговых значений ИРТ (DELFIA Neonatal IRT kit. Instructions for use. Reagents for 960 (384) assays (Perkin Elmer). Last revision Feb 2011).
По умолчанию предлагается использовать порог, соответствующий 99-му процентилю в исследуемой выборке (n = 1896). Однако его абсолютные значения для пороговой концентрации ИРТ довольно значительно различаются для разных наборов: для AutoDELFIA (автоматизированное измерение ИРТ) — 73,3 нг/мл, тогда как для DELFIA (полуавтоматическое измерение) — 57,8 нг/мл (для наборов, использующихся с 2014 г.). Такая неопределенность и побудила нас провести собственное исследование для выяснения оптимального алгоритма расчетов пороговых уровней (ПУ) ИРТ.
В русскоязычной научной литературе подобные вопросы до сих пор не обсуждались, а научные статьи описывают лишь практические результаты проведения НС на территории регионов РФ за последние годы. При анализе англоязычных научных публикаций мы опирались на исследования проблематики расчета ПУ ИРТ специалистами Школы медицины Висконсина, США[16, 17].
Целью настоящего исследования стало совершенствование НС МВ путем применения плавающего ПУ (ППУ) ИРТ и сравнение его эффективности с таковой использования фиксированного ПУ (ФПУ) ИРТ в региональных условиях ХМАО-Югры.
МАТЕРИАЛЫ И МЕТОДЫ
Проведено сплошное ретроспективно-проспективное когортное исследование, в которое на этапе оценки эффективности НС МВ и определения ППУ ИРТ включались результаты всех новорожденных детей на территории ХМАО-Югры с 2006 по 2017 г. (ретроспективная часть) и результаты НС МВ за 2018 г. (проверочный этап исследования, проспективная часть).
Концентрацию ИРТ определяли с помощью коммерческих наборов DELFIA Neonatal IRT kit, AutoDELFIA Neonatal IRT kit (PerkinElmer, Wallac Oy, Финляндия) на флуориметрах Victor2, AutoDELFIA (PerkinElmer, Wallac Oy, Финляндия) методом флуоресцентного иммунного анализа с разрешением по времени.
Источником статистических данных стали лабораторные журналы НС МВ, оформленные в соответствии с упомянутым выше Приказом Минздравсоцразвития № 185 от 22.03.2006 г. Была проведена оцифровка рукописных данных (ИРТ-1, ИРТ-2, даты забора крови; для каждого образца создавался уникальный идентификационный ID-номер). Первичная статистическая обработка выполнялась в программе MS Office Excel.
ППУ ИРТ рассчитывали с помощью программного обеспечения floating Level of IRT (flIRT), разработанного нами совместно с IT-специалистами Сургутского государственного университета[18]. При этом выборка данных для расчета ППУ ИРТ производилась по принципу «скользящего» окна для всех подтвержденных случаев МВ (n = 32) за весь период ретроспективного наблюдения (2006–2017). Выбирались все показатели концентраций ИРТ-1, полученные за несколько дней лабораторных постановок, таким образом, чтобы общее число исследуемых образцов находилось в диапазоне 500–600. Для каждого случая МВ отбирали по 500 образцов, предшествующих случаю, и по 500 образцов, последующих за случаем МВ.
С помощью программного обеспечения flIRT строили гистограмму для каждой исследуемой совокупности случаев, после предварительного логарифмирования набора данных (по основанию натурального числа e) проводили первичное удаление «выбросов» методом «трех сигм» и расчет 99,5 процентиля с определением ID-номеров образцов, выходящих за границы ПУ ИРТ и предназначенных для повторного тестирования (ретеста, ИРТ-2). Образцы, выделенные в группу ретеста, экспортировались в таблицу в виде, максимально удобном для интерпретации врачами генетической лаборатории. Пороговым считали рекомендованный в указанном выше Национальном консенсусе 99,5 процентиль совокупности показателей ИРТ в пределах «скользящего окна».
В течение 2018 г. использовали стандартный (оценка ИРТ-1 по ФПУ = 57,8 нг/мл) и инновационный (оценка результатов НС МВ по ППУ > 99,5 процентиля) подходы и сравнивали их.
Идентичность происхождения сухих пятен крови для ложноотрицательного случая МВ (с ретестом ИРТ в пределах нормы) верифицировали методом ПЦР-диагностики 12 независимых полиморфизмов (тест-системы «КардиоГенетика Тромбофилия» и «Генетика Метаболизма Фолатов», «ДНК-Технология», Россия) для образцов сухих пятен крови, отобранных на первичный тест, ретест, и для образца цельной крови пациента с МВ.
При статистической обработке материала использовали непараметрические методы: определение моды, расчет процентилей, исследование операционных характеристик теста — чувствительности (Se), специфичности (Sp), прогностической ценности положительного (PPV) и отрицательного (NPV) результата[19].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Массовый скрининг новорожденных на МВ в рамках Национального проекта «Здоровье» проводится в ХМАО-Югры с 01.06.2006 г. За период с июня 2006 г. по декабрь 2017 г. обследован 283 741 новорожденный, среднемноголетний охват скринингом составил 96,3%; при этом охват в период 2009–2017 гг. — в среднем 98,9% (табл. 1). Сниженные цифры охвата в начале проведения НС МВ связаны с рабочими моментами по внедрению инфраструктуры и логистики исследований на обширной территории ХМАО-Югры. В 2006–2017 гг. выявлены 32 пациента с подтвержденным диагнозом МВ.
Таблица 1
Результаты неонатального скрининга (НС) на муковисцидоз в ХМАО-Югры за период 2006–2017 гг.
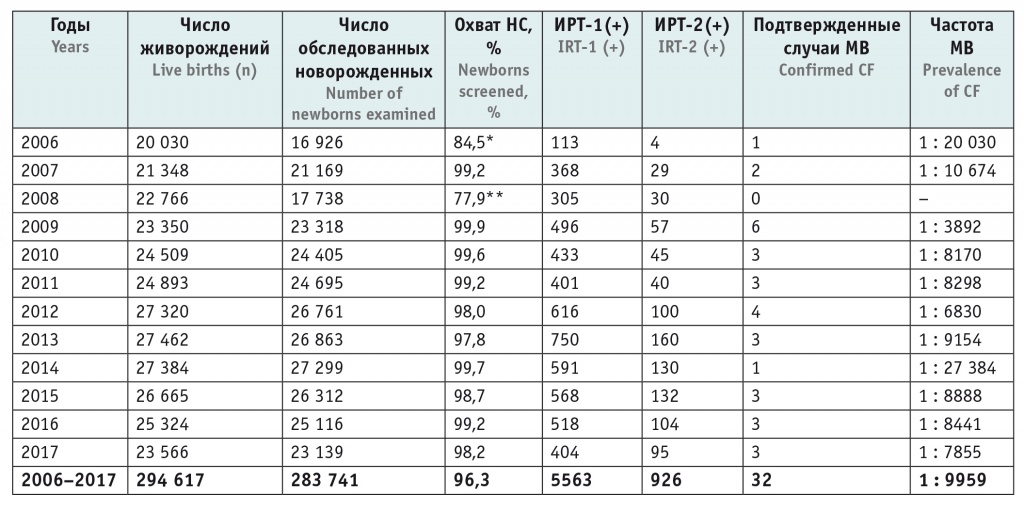
Примечание. Здесь и в таблице 2, рисунках: ИРТ — иммунореактивный трипсиноген, МВ — муковисцидоз.
* В 2006 г. неонатальный скрининг выполнялся с июня по декабрь.
** В 2008 г. неонатальный скрининг выполнялся в течение всего года, кроме марта.
Среднемноголетняя частота МВ в ХМАО-Югры составила 1 случай на 9207 новорожденных детей; среднемноголетние операционные характеристики теста: Se — 100,0%, Sp — 98,1%; PPV — 0,65%; NPV — 100,0%. Проведены 5563 ретеста (около 2,0% от всего количества первичных исследований), из них только 32 оказались истинно-положительными. Такое число ретестов при отсутствии МВ соответствует примерно 2,5-месячному объему выполняемых исследований НС МВ.
Накопленный 12-летний опыт по осуществлению НС МВ в ХМАО-Югры и большой объем данных позволили произвести полноценное объективное исследование полученных результатов с целью возможной оптимизации существующих алгоритмов. В сплошном ретроспективном исследовании, охватывающем период 2006–2017 гг., проанализирована информация по НС МВ обо всех 32 детях с подтвержденным диагнозом МВ.
На рисунке 1 приведены данные, отображающие показатели первичных тестов ИРТ и ретестов с соответствующим диапазоном концентраций для каждого случая МВ. У 16 человек концентрация ИРТ в ретесте была ниже концентрации первичного ИРТ (темные бары), у 14 человек — выше (светлые бары).
Рис. 1. Показатели первичного теста (иммунореактивный трипсиноген 1) и ретеста (иммунореактивный трипсиноген 2) для всех случаев муковисцидоза, выявленных во время неонатального скрининга за период 2006–2017 гг. Светлые бары: ИРТ-2 > ИРТ-1; темные бары: ИРТ-2 < ИРТ-1
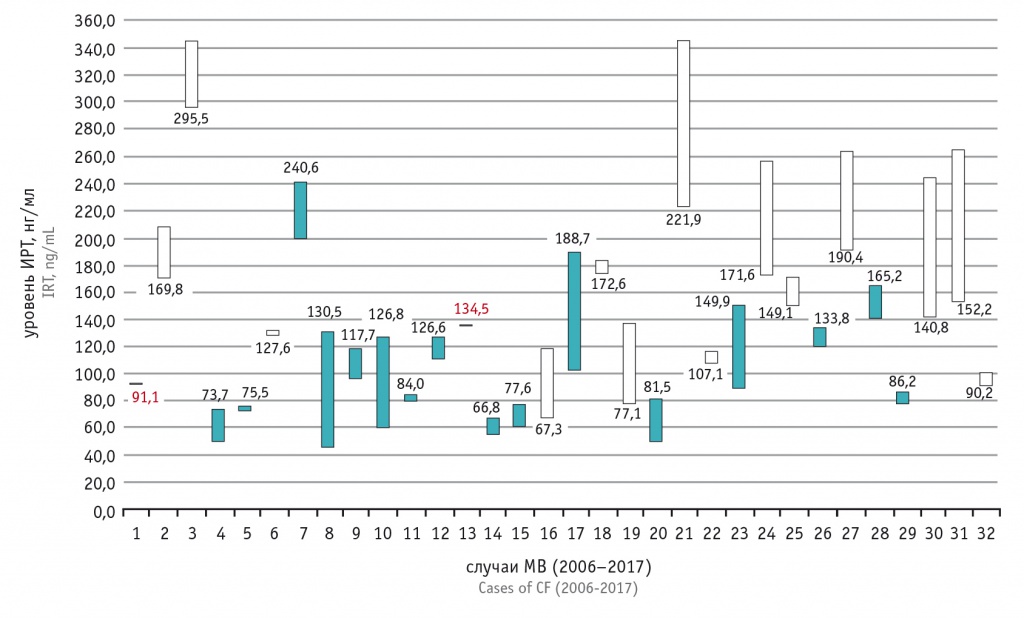
У ребенка № 1 ретест не проводился по причине отсутствия реактивов, у ребенка № 13 ретест оказался ложноотрицательным, однако при последующей проверке выяснилось, что на бланке НС была нанесена кровь другого человека (эти случаи выделены красным на диаграмме).
Красными линиями обозначены рекомендованные производителем реагента ФПУ ИРТ, при этом заметно последовательное снижение ПУ с 65,0 нг/мл до 57,8 нг/мл.
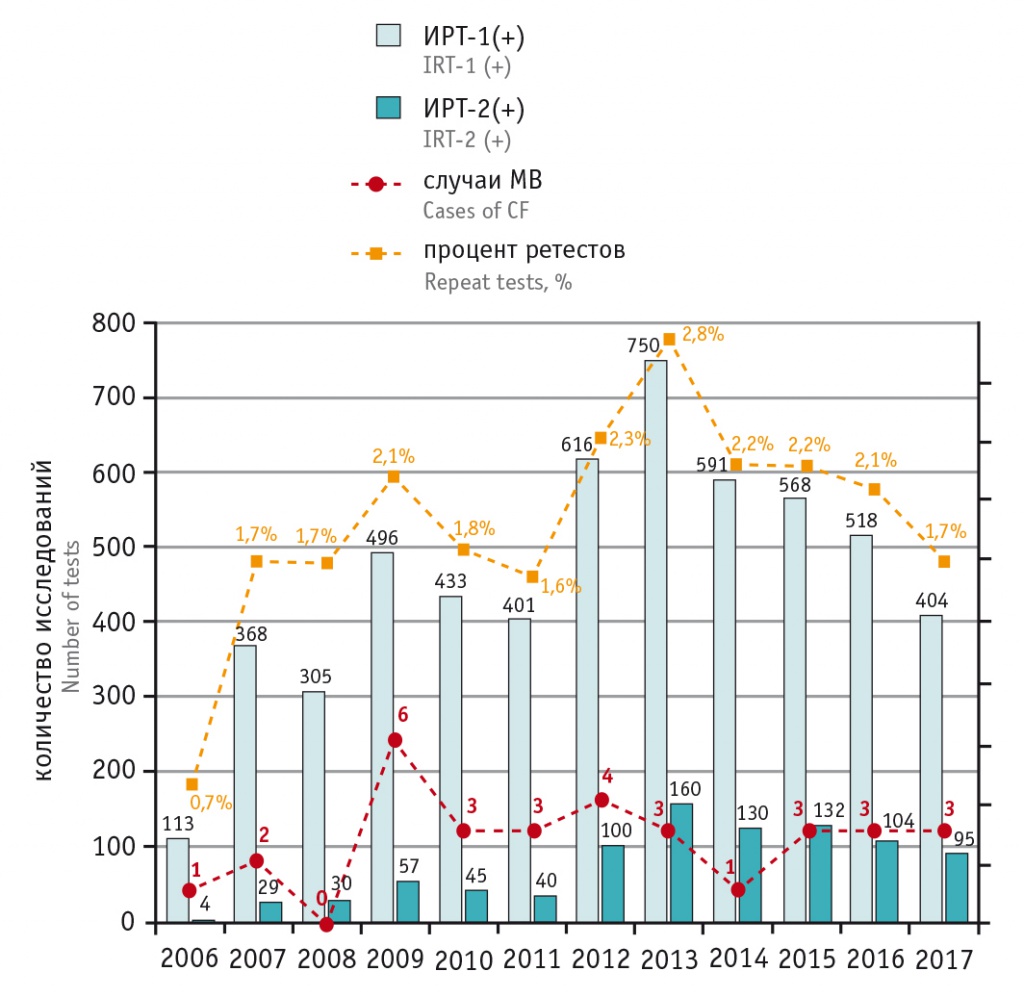
На рисунке 2 приведены диаграммы ежегодного сравнения количества образцов с концентрациями ИРТ-1, ИРТ-2 выше ФПУ и подтвержденных случаев МВ. Видно, что «просеивающая» способность НС для выявления МВ весьма высока, и в последовательных раундах скрининга возможно отобрать из десятков тысяч буквально несколько единиц образцов с истинно-положительным результатом, руководствуясь определенным пороговым значением концентрации ИРТ-1 для отбора образцов на повторное тестирование в рамках алгоритма ИРТ-1/ИРТ-2.
Рис. 2. «Просеивающая» способность неонатального скрининга на муковисцидоз в ХМАО-Югры: общее количество ретестов (абсолютное число и процент от числа первичных тестов); число положительных ретестов; число подтвержденных случаев муковисцидоза
Нами совместно с IT-специалистами СурГУ разработано программное обеспечение flIRT для быстрой статистической обработки наборов данных НС МВ. На первом этапе была визуализирована выборка из 5000 образцов ИРТ-1 за 2009 г. путем построения гистограммы (рис. 3), где наиболее частой оказалась концентрация ИРТ по величине моды в 12,5 нг/мл.
Рис. 3. Логнормальное распределение концентраций иммунореактивного трипсиногена 1 на гистограмме выборки из 5000 образцов сухих пятен крови неонатального скрининга муковисцидоза (2009)
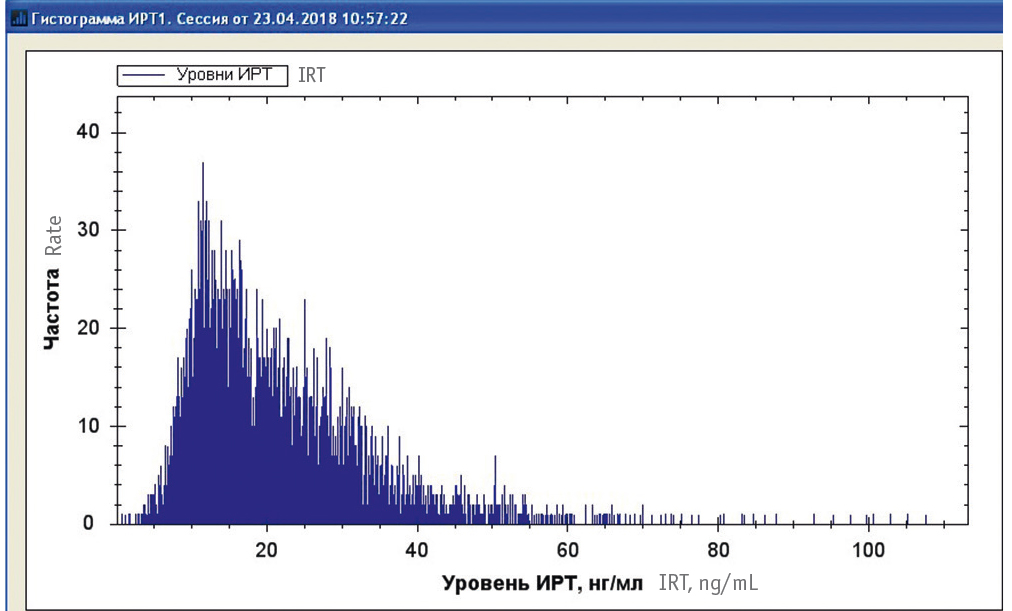
Предварительный анализ показал, что тип распределения такой выборки — логнормальный, т. к. при логарифмировании гистограмма принимает вид нормального распределения.
Большой набор неоцифрованных данных (более 283 тыс. показателей уровня ИРТ-1) значительно осложнил предстоящую задачу расчета региональных ППУ ИРТ. Поэтому мы использовали принцип «горячих точек», когда для подтверждения/опровержения применимости метода ППУ были оцифрованы и использованы для статистической обработки ограниченные, «локальные» сеты данных, группирующиеся вокруг каждого подтвержденного случая МВ с размером выборки n ≈ 1000 для каждого случая. Таким образом, при числе случаев подтвержденного МВ за всю историю проведения НС в ХМАО-Югре, равном 32, анализируемый объем выборки значительно уменьшился (≈ 32 000 уникальных данных).
Вся выборка была разбита на 32 локальных сета, причем в каждом сете позиция случая с МВ занимала такое место, чтобы была реализована возможность всестороннего анализа. Каждый сет данных разбивался на несколько частей, и каждая часть соответствовала объему ежедневной работы лаборатории и варьировала в пределах от 50 до 150 образцов.
Для каждого рабочего дня рассчитывался свой ППУ ИРТ, причем общее число образцов должно быть в пределах от 500 до 600[16]. Такая совокупность образуется при объединении результатов постановок за несколько (4–8) рабочих дней.
При вычислении (пересчете) ППУ для следующего рабочего дня некоторая часть прежних данных совокупности замещается новыми, полученными в текущий рабочий день, таким образом, чтобы соблюдался критерий 500 < n < 600. Подобное «окно» данных каждый следующий рабочий день сдвигается вправо при умозрительном расположении всех результатов на временно́й шкале (принцип «скользящего окна»). Необходимо обратить внимание на то, что для каждого сета данных ППУ вычисляется не для выборки, а для всей совокупности полученных результатов за несколько рабочих дней, что значительно повышает информационную емкость метода.
Путем последовательного отбора в качестве оптимального ПУ ИРТ был выбран 99,5 процентиль, что соответствует европейским[20] и российским[12]>/span> рекомендациям. Использование меньших значений процентилей при расчете ППУ (99-й, 95-й) показало сильное занижение порога ИРТ-1 и нецелесообразность дальнейшего моделирования с процентилями, меньшими, чем 99,5 (рис. 4). Использование алгоритма расчета ППУ ИРТ-1 для трех случаев МВ из 32 с самыми низкими цифрами ИРТ-1 (67,3; 66,8; 77,6 нг/мл) подтвердил его применимость даже для этих случаев (рис. 5).
Рис. 4. Использование программного обеспечения floating Level of IRT для расчета плавающего порогового уровня иммунореактивного трипсиногена 1 в соответствии с разными процентилями в локальной выборке из 500 образцов сухих пятен крови
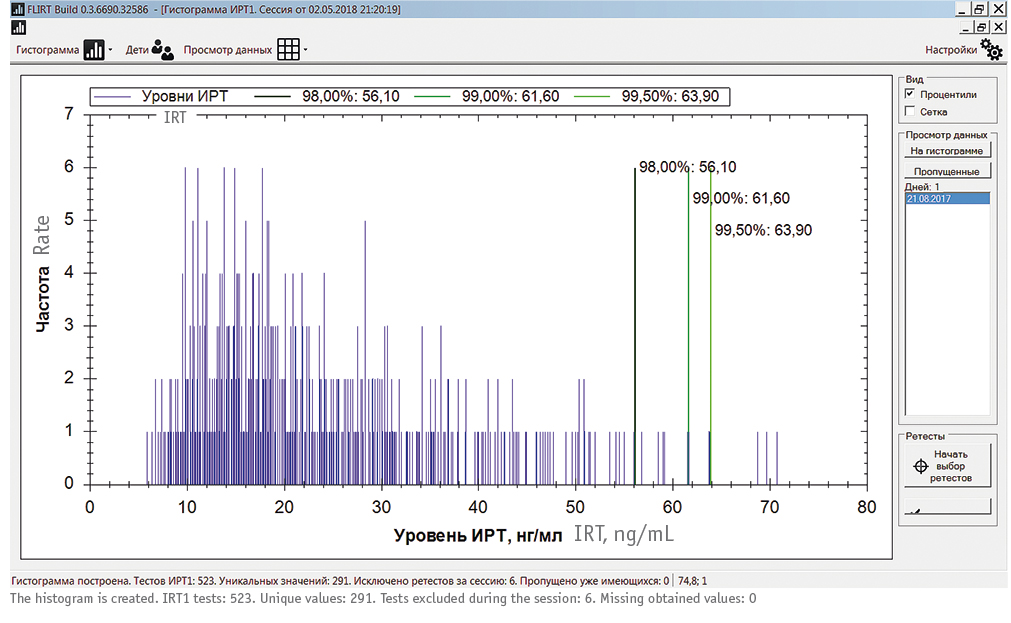
Рис. 5. Сравнение плавающего порогового уровня (ППУ) иммунореактивного трипсиногена 1 с фиксированным пороговым уровнем (ФПУ) для всех случаев муковисцидоза (МВ), выявленных в программе неонатального скрининга МВ за 2006–2017 гг. в ХМАО-Югры. Фиолетовые точки — уровни ИРТ-1 в диапазоне 60,0–90,0 нг/мл (выше 90,0 нг/мл на диаграмме не отражены); овалами выделены три случая МВ, для которых значения ППУ ИРТ-1 максимально приближены к значениям первичного теста ИРТ-1
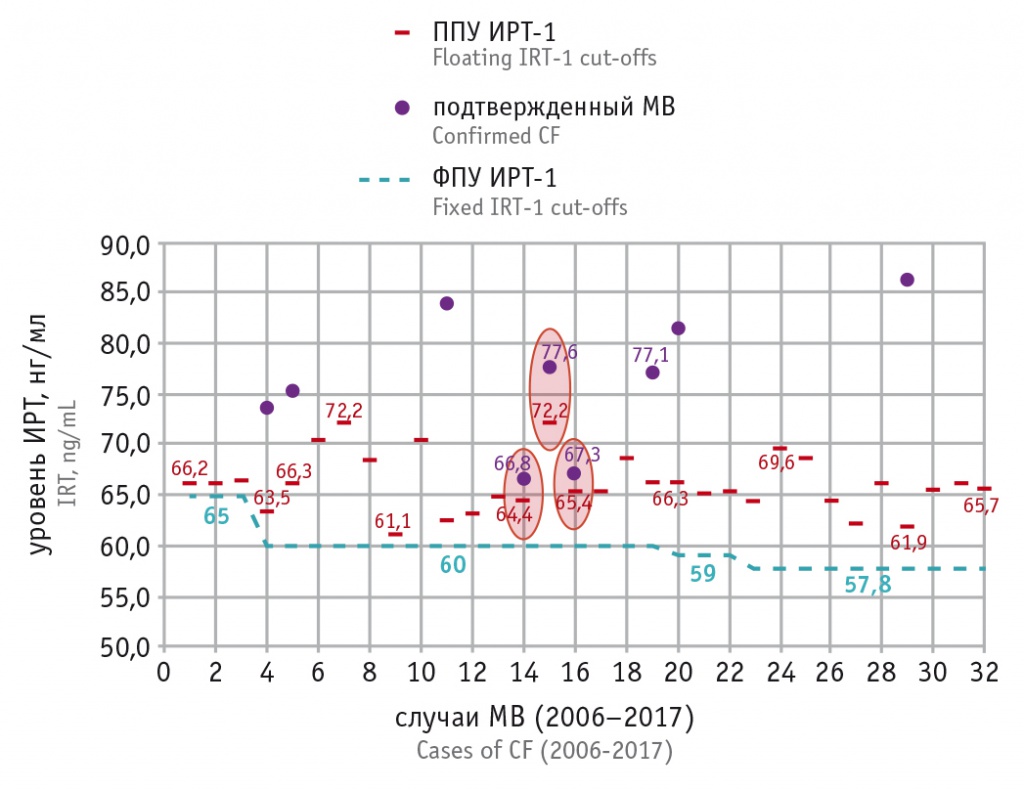
На рисунке 5 приведены ППУ ИРТ, рассчитанные для всех случаев МВ, в сравнении с фиксированными уровнями. Видно, что диапазон ППУ колеблется в пределах 61,1–72,2 нг/мл, и практически везде уровни ИРТ-1 при МВ слишком высоки, чтобы попасть в число ложноотрицательных результатов (на диаграмме обозначены только 9 таких случаев, все остальные уровни ИРТ-1 — за пределами области построения графика). Овалами выделены 3 случая МВ, при которых концентрация ИРТ-1 «вплотную» приближается к ППУ, однако во всех этих случаях ИРТ-1 > ППУ.
При анализе данных НС МВ за период 2014–2017 гг., когда применялся при расчетах ФПУ ИРТ 57,8 нг/мл, отмечено, что при использовании ППУ наблюдается значительное снижение количества результатов ИРТ-1 выше ППУ и, соответственно, количества направляемых на ретест образцов.
В течение 2018 г. проводился сравнительный анализ эффективности НС МВ с использованием двух подходов — стандартного (учет ФПУ = 57,8 нг/мл) и разработанного нами (оценка ИРТ-1 по ППУ > 99,5 процентиля), результаты представлены в таблице 2. Внедрение компьютерной программы по оценке ИРТ-1 на основе ППУ [18] позволило практически в 4 раза снизить необходимость проведения ретеста без уменьшения эффективности диагностики МВ. Всего в 2018 г. МВ впервые диагностирован у 3 детей, причем у всех этих новорожденных результат НС МВ расценен как положительный и при стандартном подходе, и при оценке показателя ИРТ-1 методом ППУ.
Таблица 2
Сравнительная оценка результатов неонатального скрининга муковисцидоза в 2018 г. при использовании фиксированного и плавающего пороговых уровней иммунореактивного трипсиногена
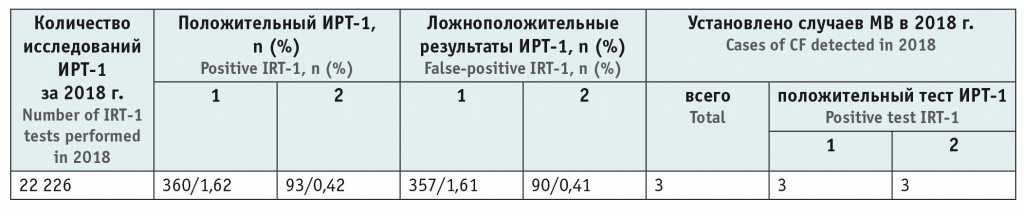
Примечание: 1 — стандартный подход (ИРТ > 57,8 нг/мл); 2 — метод плавающего порогового его уровня (ИРТ > 99,5 процентиля).
Se теста, по данным 2018 г., при использовании обоих методов оценки результатов НС МВ (ФПУ и ППУ) составила 100%, Sp при использовании ФПУ — 98,4%, ППУ — 99,6%.
Среднее значение (мода) ППУ ИРТ-1 в 2018 г. было 65,4 нг/мл против рекомендуемого изготовителем реагента ФПУ 57,8 нг/мл, минимальный ППУ — 61,9 нг/мл, максимальный — 66,2 нг/мл. Анализ НС всех случаев установленного МВ за период 2006–2018 гг. (35 детей) показал, что каждый из 35 показателей ИРТ-1 был больше соответствующего ему ППУ как при ретроспективном, так и при проспективном исследовании.
ЗАКЛЮЧЕНИЕ
Внедрение неонатального скрининга муковисцидоза (НС МВ) позволило обеспечить раннюю (уже в периоде новорожденности) диагностику заболевания и своевременно начать его базисную терапию. Ретроспективный анализ результатов НС МВ за период 2006–2017 гг. позволил установить среднемноголетнюю частоту МВ на территории ХМАО-Югры, которая составила 1 случай на 9207 живорожденных детей. Знание этого эпидемиологического показателя важно с точки зрения планирования ресурсов здравоохранения: затрат на диагностику (включая генную), дорогостоящее лечение и реабилитацию пациентов с МВ на региональном уровне.
Применение при НС МВ фиксированного порогового уровня (ФПУ) иммунореактивного трипсиногена (ИРТ) 1, рекомендованного изготовителем реагента, дает большое количество ложноположительных результатов (до 2,0% от общего числа ИРТ-1), следствием чего становятся нерациональные затраты на проведение ретеста (ИРТ-2). Негативным является и психологическое состояние родителей в ожидании повторного исследования уровня ИРТ в течение первого месяца жизни ребенка.
Разработанный метод расчета плавающего порогового уровня (ППУ) ИРТ (> 99,5 процентиля) продемонстрировал не меньшую результативность (критерий non-inferiority trial), чем традиционно используемый ФПУ ИРТ, по отсутствию ложноотрицательных результатов. Внедрение компьютерной авторской программы Floating Level of IRTV[18] по определению ППУ позволяет значительно (примерно в 4 раза) уменьшить число ложноположительных результатов, необходимость проведения ретеста и повысить специфичность теста с 98,4% до 99,6% с сохранением 100%-ной чувствительности.
Использование данной компьютерной программы максимально упрощает задачу гибкой статистической обработки данных (возможность для оператора менять по своему усмотрению размер «окна», изменять уровни процентилей и пр.). Визуализация совокупности данных на гистограмме позволяет провести наглядный контроль результатов, параллельная оцифровка результатов — аккумулировать доступную базу данных для обращений и более подробных расчетов, необходимых по каким-либо причинам в перспективе.
Благодарности: авторы выражают искреннюю благодарность ряду лиц, без которых данная работа была бы невозможна: заведующему Окружной медико-генетической консультацией (г. Сургут) Л.Н. Колбасину за информационную поддержку; врачу клинической лабораторной диагностики Н.В. Кунцевич за неоценимую помощь при оцифровке данных; IT-специалисту СурГУ И.Н. Девицыну за участие в разработке и постоянное совершенствование компьютерной программы flIRT, использованной в исследовании.
Врожденные и наследственные заболевания могут стать причиной серьезных проблем со здоровьем и даже летального исхода. Однако большинство таких патологий поддаются лечению и не успевают причинить вред, если диагностировать их как можно раньше, еще до появления первых симптомов. Для этого существует процедура неонатального скрининга. Рассказываем, как изменился неонатальный скрининг новорожденных в 2023 году, сколько заболеваний можно обнаружить с его помощью и как узнать результаты.
Что такое неонатальный скрининг
Понятие скрининг впервые сформулировала комиссия США по хроническим заболеваниям. Это произошло в 1951 году. Скринингом назвали идентификацию нераспознанного заболевания или дефекта с помощью тестов и других легко выполнимых диагностических процедур.
Неонатальный скрининг новорожденных нужен для раннего выявления врожденных и наследственных патологий. Это исследование проводят всем без исключения детям в первые дни жизни (1). В России такой тест нередко называют «пяточным», поскольку кровь для исследования берут из именно этой области тела.
Полезная информация о неонатальном скрининге
Мы собрали в одной таблице основную информацию о скрининге новорожденных.
| Сколько болезней может выявить скрининг | 36 наследственных заболеваний |
| Откуда берут кровь на анализ | Из пятки новорожденного |
| Когда берут кровь на анализ | У доношенных детей — в течение 24-48 часов после рождения, у недоношенных — на 144-168 часу жизни |
| Обязательна ли эта процедура | Да, скрининг проводят всем новорожденных детям в России |
| Где можно сделать неонатальный скрининг | Скрининг проводят либо в роддоме, либо в поликлинике по месту жительства |
| Когда будут готовы результаты скрининга | В течение 72 часов после забора крови |
Какие наследственные заболевания выявляет неонатальный скрининг
Наследственных и врожденных заболеваний много, несколько сотен. Во время скрининга ищут не все, а только те, которые встречаются достаточно часто, могут привести к тяжелым последствиям и поддаются современным методам лечения. До 2023 года в большинстве регионов РФ неонатальный скрининг новорожденных позволял выявить 5 заболеваний:
- фенилкетонурию;
- врожденный гипотериоз;
- галактоземию;
- муковисцидоз;
- врожденную дисфункцию коры надпочечников (2).
В некоторых регионах, например, в Москве, действовали программы, которые помогали обнаружить 11 заболеваний. Такое исследование финансировалось из местного бюджета.
С 31.12.2022 года начал действовать Приказ №274н «Об утверждении порядка оказания медицинской помощи пациентам с врожденными и (или) наследственными заболеваниями». Согласно этому документу, неонатальный скрининг новорожденных расширился до 36 заболеваний. В массовое стандартное обследование включили первичные иммунодефициты, спинальную мышечную атрофию и целый ряд нарушений обмена веществ (1) (2).
Список 36 заболеваний, выявляемых неонатальным скринингом
Основная цель скрининга — не просто обнаружить патологию, а как можно быстрее начать лечение, чтобы ребенок мог нормально расти и развиваться. Кратко расскажем, почему возникают и чем опасны 36 заболеваний, которые можно выявить в процессе исследования.
- Фенилкетонурия — нарушение обмена аминокислот, из-за чего в организме накапливается фенилаланин и токсические продукты его распада. Это влечет за собой поражение ЦНС и развитие умственной отсталости. Заболевание лечат с помощью специальной диеты.
- Врожденный гипотиреоз — состояние, когда щитовидная железа не вырабатывает гормоны тироксин и трийодтиронин или вырабатывает их в недостаточном количестве. Проявления гипотиреоза: отставание в умственном и физическом развитии, низкий рост, деформация костей черепа. Для лечения используется заместительная гормональная терапия.
- Муковисцидоз — генетически обусловленное нарушение в работе желез внутренней секреции, больше всего страдают органы дыхания и поджелудочная железа. Заболевание часто осложняется инфекциями. Тяжесть муковисцидоза и его формы могут быть разными, но без лечения большинство больных умирает в детском возрасте, тогда как своевременная диагностика и терапия позволяют значительно увеличить продолжительность жизни.
- Галактоземия — нарушение преобразования галактозы в глюкозу. Галактоза накапливается в организме и вызывает интоксикацию с поражением ЖКТ, органов зрения и нервной системы. Для профилактики осложнений нужна строгая диета.
- Адреногенитальный синдром, или врожденная дисфункция коры надпочечников (ВДКН) — нарушение выработки стероидных гормонов. Больные должны пожизненно принимать гормональные препараты. Без лечения у пациентов может развиться острая надпочечниковая недостаточность, бесплодие, энурез, частые инфекции мочевыводящих путей, расстройства личности.
- Дефицит биотинидазы — наследственное заболевание, связанное с недостаточностью эффектов витамина B7, или биотина. Болезнь проявляется младенческой эпилепсией, которая не поддается медикаментозной терапии, ухудшением зрения и слуха, мышечной гипотонией и задержкой физического развития. Лечение — пожизненный прием биотина и препаратов для предупреждения судорожных приступов.
- Недостаточность биотина — заболевание, связанное с нарушением метаболизма биотина. Проявляется судорогами, гипотонией мышц, поражениями кожи. Лечение — прием препаратов биотина.
- Дефицит синтеза биоптерина и дефицит реактивации биоптерина — редкие заболевания, при которых нарушается синтез дофамина и серотонина. У детей с этой патологией наблюдается низкая масса тела при рождении, тремор, гипотония, гипокинезия и плохое сосание. Задержка развития становится заметна в возрасте 4-6 месяцев. Ее признаки: неспособность удерживать головку, сонливость, раздражительность, затруднение глотания, избыточное слюнотечение, необъяснимое повышение температуры, судорожные припадки. Лечение — заместительная терапия и диета с ограничением фенилаланина.
- Тирозинемия I типа или гепаторенальная тирозинемия — редкое заболевание, которое связано с дефицитом фумарилацетоацетат гидролазы. При этой патологии поражается печень, почки, нервная и скелетно-мышечная система. Основа лечения — диета без тирозина и фенилаланина.
- Лейциноз, или болезнь «кленового сиропа». Патология связана с нарушением метаболизма аминокислот лейцина, изолейцина, валина. Чаще встречается тяжелая форма заболевания, которая проявляется острой младенческой энцефалопатией. Лечение включает медикаментозную и диетотерапию.
- Пропионовая ацидемия и метилмалоновая ацидемия — нарушения обмена аминокислот: изолейцина, валина, треонина и метионина. Проявляются отказом от пищи, рвотой, потерей веса, обезвоживанием. Дети до 6 месяцев должны получать специальное питание вместо грудного молока и обычных смесей. А детям старше 6 месяцев противопоказаны продукты с большим содержанием белка.
- Изовалериановая ацидемия — нарушение обмена аминокислот. Сопровождается метаболическими кризами с тошнотой, рвотой и судорогами, которые нужно купировать в стационаре. Пациентам назначают препараты карнитина и глицина, лечебные смеси. В дальнейшем показано постоянное наблюдение у врача-педиатра и врача-невролога.
- Нарушения окисления жирных кислот — заболевания, вызванные отсутствием или дефицитом ферментов для расщепления жиров, что вызывает задержку развития. Всем пациентам нужен индивидуальный рацион, куда включают специализированные смеси с жировыми компонентами.
- 3-гидрокси-3-метилглутаровая недостаточность — редкое наследственное заболевание, которое вызывает выраженный ацидоз и гипогликемию. Для лечения применяется диета и лекарственные препараты.
- Бета-кетотиолазная недостаточность — сбой обмена веществ, которое проявляется неврологическими нарушениями, рвотой, вялостью, нарушением сердечного ритма, кардиомиопатией, отставанием в психомоторном развитии. Основа лечения — диета.
- Первичная карнитиновая недостаточность — наследственный дефект транспорта карнитина. При этом состоянии ухудшается мышечный метаболизм. Для лечения рацион пациента обогащают L-карнитином.
- Недостаточность карнитин-пальмитоилтрансферазы, тип I — нарушение транспорта жирных кислот. Заболевание протекает в виде острых метаболических приступов с судорогами, рвотой, отказом от еды. Терапия — диета с высоким содержанием углеводов и жирных кислот определенного вида.
- Недостаточность карнитин-пальмитоилтрансферазы, тип II — редкое заболевание, связанное с нарушением транспорта жирных кислот. Существует три формы заболевания: неонатальная, инфантильная и взрослая. Наиболее опасной считается неонатальная форма. Лечение заболевания предполагает диету с высоким содержанием углеводов и добавлением среднецепочечных жирных кислот.
- Недостаточность карнитин-ацилкарнитин транслоказы — нарушение окисления жирных кислот, которое обычно сопровождается тяжелой гипогликемией, кардиомиопатией и/или аритмией, дисфункцией печени, слабостью скелетных мышц и энцефалопатией. Необходимо полное исключение голодания и диета.
- Гомоцистинурия — заболевание вызвано нарушением обмена незаменимой аминокислоты метионина. В результате в организме повышается уровень аминокислоты гомоцистеина, что может привести к поражению многих органов и систем. Симптомы: дефицит массы тела, раздражительность, плаксивость, деформация конечностей, позднее закрытие родничка. Рекомендуется диетотерапия со специализированными продуктами, которые не содержат метионин.
- Цитруллинемия — нарушение обмена мочевины с избыточным накоплением аммиака в организме. У младенцев патология проявляется неврологическими нарушениями (сонливость, судороги, угнетение сознания), задержкой психомоторного развития. Лечение — диетотерапия и прием препаратов аргинина и цитрина.
- Глутаровая ацидемия, тип I. При этой патологии в организме не полностью расщепляются аминокислоты лизин, гидроксилизин и триптофан, что приводит к развитию неврологических нарушений. Лечение — отказ от продуктов, богатых лизином.
- Детская спинальная мышечная атрофия I типа (болезнь Вердинга-Гоффмана) — заболевание, возникающее из-за дефекта в гене SMN1 и обычно проявляющееся в течение первого года жизни. Основные симптомы: нарастающая мышечная слабость вплоть до полной неподвижности. Заболевание считается очень тяжелым и часто приводит к летальному исходу.
- Первичные иммунодефициты — в эту группу входят более 400-х врожденных нарушений иммунитета. Пациенты с иммунодефицитом часто и тяжело болеют инфекционными заболеваниями, для лечения которых используются антибактериальные, противогрибковые и противовоспалительные препараты, иммуноглобулины. При тяжелых формах иммунодефицита показана трансплантация гемопоэтических стволовых клеток.
Когда и как проводится неонатальный скрининг
Кровь на скрининг берут в роддоме в первые дни жизни малыша. Сжатые сроки объясняются тем, что врожденные и наследственные заболевания надо диагностировать как можно раньше, чтобы начать терапию вовремя и не допустить развития осложнений. Рассказываем, какой документ регламентирует проведение скрининга и что такое тест-бланк.
Приказ Минздрава №274н от 21.04.22 г
Это приказ «Об утверждении порядка оказания медицинской помощи пациентам с врожденными и (или) наследственными заболеваниями». В документе говорится, какие виды медицинской помощи доступны этой категории пациентов и какие медицинские организации могут эту помощь оказывать. Приказ вступил в силу 31 декабря 2022 года.
В Приказе перечислены патологии, которые диагностируются в рамках неонатального скрининга, и указан порядок проведения этого исследования. В частности, в Приказе описано, как брать кровь на анализ, как оформлять направление на скрининг и тест-бланк, как действовать при положительном и отрицательном результате первого исследования. В документе также изложен алгоритм медицинской помощи детям, у которых выявили наследственное и/или врожденное заболевание. Им доступны все виды помощи, в том числе высокотехнологичная (1).
Тест-бланк
Это бумажная карточка для взятия, хранения и транспортировки образцов крови. Внутренняя впитывающая часть бланка изготовлена из целлюлозного материала, который абсорбирует кровь. На бланке напечатаны круги — они обозначают место для нанесения биоматериала (1) (3).
Для скрининга нужны 2 тест-бланка — на один наносят 3 пятна крови, на другой 5. На бланках указывают номер медицинского свидетельства о рождении, ФИО матери, дату рождения ребенка, дату и время забора крови. Затем к бланкам прикрепляют распечатанное направление на скрининг и отправляют в лабораторию. Медицинская организация, которая выполняет забор крови, должна отправлять тест-бланки в лабораторию ежедневно или 1 раз в два дня (1).
Где проводится неонатальный скрининг
Исследование выполняют в медико-генетической лаборатории, а кровь на анализ в большинстве случаев берут в родильном доме. Рассказываем, как проходит процедура, сколько времени занимает и где еще ее можно сделать.
В роддоме
Кровь берут натощак, когда после кормления малыша прошло 3 часа. Медработник протирает пятку новорожденного спиртовой, а затем сухой стерильной салфеткой, и делает небольшой прокол. Первую каплю крови вытирают стерильным тампоном, а последующие наносят на тест-бланк (3). У доношенных детей кровь берут в первые 24-48 часов жизни, у недоношенных — через 144-168 часов после рождения (1).
В поликлинике
Если малыш родился дома или скрининг не сделали в роддоме, следует как можно быстрее обратиться в поликлинику по месту жительства. Здесь у новорожденного возьмут кровь, отправят тест-бланк в лабораторию и получат результаты.
Методы проведения неонатального скрининга
На сегодняшний день используется единственный основной метод проведения неонатального скрининга.
Анализ крови
Это ведущий метод диагностики врожденных и наследственных патологий. Появление новых технологий позволило значительно расширить список болезней, выявляемых в рамках скрининга. Сегодня для исследования могут использовать:
- высокоэффективную жидкостную хроматографию (ВЭЖХ) в сочетании с масс-спектрометрией (ВЭЖХ-МС);
- иммунохимические методы;
- полимеразную цепную реакцию (ПЦР);
- секвенирование по Сэнгеру;
- массовое параллельное секвенирование (МПС) (3).
Во время теста исследуют сухие пятна крови. Чтобы их получить, медработник наносит на тест-бланк определенное количество биоматериала и сушит минимум 2 часа при комнатной температуре. После этого тест-бланк помещают в индивидуальную упаковку и отправляют в лабораторию (3).
Как узнать результаты неонатального скрининга
Результаты получает районная детская поликлиника по месту жительства ребенка. Если скрининг не выявил заболеваний, ребенок считается «условно здоровым» и не нуждается в дополнительном обследовании. Поэтому при отрицательном результате скрининга родителям ничего не сообщают. Участковый врач поликлиники или заведующий отделением педиатрии связывается с родителями, если у ребенка подозревают наличие какого-то заболевания. Врач сообщит, что нужно делать, и даст направление на дальнейшие исследования (1) (2).
ВИМИС АКиНЕО
ВИМИС АКиНЕО — это часть российской медицинской информационной системы. Здесь аккумулируются данные о пациентах, которым оказывали или оказывают медицинскую помощь по направлениям «Акушерство и гинекология» (АК) и «Неонатология» (НЕО). К таким пациентам относятся и новорожденные дети. После забора крови у ребенка медики создают электронное направление на неонатальный скрининг, которое затем вместе с результатами анализов остается в системе ВИМИС АКиНЕО (4).
В дальнейшем вся медицинская информация сохраняется в личном кабинете пациента «Мое здоровье» на портале Госуслуг. В личный кабинет приходят уведомления о необходимости посетить врача и пройти диагностику. Здесь же остаются результаты лабораторных и инструментальных исследований, поэтому их необязательно приносить врачу в «бумажном» виде. Врачу-педиатру из поликлиники или лечащему врачу из профильного отделения больницы будут доступны все сведения из личного кабинета, кроме того, он сможет получать от системы «подсказки» по диагностике и лечению в соответствии с действующими клиническими рекомендации.
Сроки получения результатов исследования
Срок исследования биоматериала в медико-генетической лаборатории — не более 72-х часов. В среднем результаты бывают готовы на 5-е сутки жизни доношенного ребенка и на 12-е сутки у недоношенного. Если выявлены отклонения, врач должен сообщить об этом законным представителям ребенка в течение 24-х часов (1).
Сколько стоит неонатальный скрининг в 2023 году
Скрининг для выявления 36 заболеваний проводится в государственных медико-генетических центрах. Каждый новорожденный гражданин нашей страны может пройти обследование бесплатно по полису ОМС. Родителям не придется самостоятельно искать лабораторию и оплачивать анализы: если не родильный дом, то районная поликлиника по месту жительства помогут получить эту диагностическую услугу любому новорожденному малышу.
Отзывы врачей о необходимости неонатального скрининга
Комментирует врач-педиатр, детский хирург, зав. педиатрическим отделением Анна Осипова:
— Неонатальный скрининг необходим для своевременного выявления тяжелых заболеваний, например, большую группу занимают болезни обмена веществ. За 30-летний опыт проведения данных исследований можно говорить о проделанной работе и ее результатах. Например, у пациентов с муковисцидозом более чем в два раза увеличилась продолжительность жизни, во много раз снизилась младенческая смертность при сольтеряющих формах врожденной гипоплазии коры надпочечников. Таким образом, снижается риск развития тяжелых клинических последствий этих заболеваний, снижается летальность и улучшается качество жизни детей и их социальная адаптация. И расширение списка диагностируемых заболеваний в неонатальном скрининге дает еще больше шансов на качественную жизнь большому количеству детей. Мы надеемся, что в дальнейшем список заболеваний будет расти несмотря на то, что 36 заболеваний — это уже прекрасный результат, к которому мы долго шли.
Популярные вопросы и ответы
Большинство родителей слышали о скрининге, но хотели бы узнать больше от практикующего специалиста. На популярные вопросы отвечает врач-педиатр, детский хирург, зав. педиатрическим отделением Анна Осипова.
В каких случаях нужен повторный неонатальный скрининг?
По результатам первичного скрининга образуется две группы детей: «условно здоровые» и «высокого риска». В первую группу входят новорожденные, у которых не выявили отклонений. Такие дети в дополнительном обследовании не нуждаются.
Новорожденные из второй группы должны пройти повторный скрининг. Пока идет исследование, ребенка могут госпитализировать и назначить ему лечебное питание. Если результат второго скрининга положительный, ребенка включают в группу детей с врожденными/наследственными заболеваниями, а сведения о нем передаются в медицинскую организацию по месту жительства.
Отличается ли неонатальный скрининг для доношенного и недоношенного ребенка?
Скрининг для доношенного и недоношенного ребенка не отличается своим комплексом или наполнением, разница лишь в сроках забора крови на тест-бланк. У доношенных детей кровь берут в первые 24-48 часов жизни, у недоношенных — на 144-168 часу жизни.
Как и когда появился неонатальный скрининг?
Неонатальный скрининг в его нынешнем виде появился далеко не сразу. Кратко расскажем о том, как совершенствовался этот метод обследования.
• 1934 г. — Норвежский врач Ивар Асбьерн Феллинг открыл фенилкетонурию, обнаружив в моче детей с развивающейся умственной отсталостью повышенное содержание фенилпировиноградной кислоты. Эту кислоту он определял при помощи химической реакции, которая получила название «проба Феллинга».
• Начало 50-х гг XX века — Немецкий педиатр Хорст Биккель разработал метод лечения фенилкетонурии с помощью диеты, которая ограничивала поступление в организм фенилаланина. Причем диета была более эффективной на ранней стадии заболевания, еще до появления симптомов. В связи с этим возникла необходимость диагностировать фенилкетонурию как можно раньше.
• Начало 1960-х гг — Американский микробиолог Роберт Гатри изобрел лабораторный экспресс-тест, способный выявить фенилкетонурию по капле крови. Это фактически стало началом неонатального скрининга.
• 1969 г. — Всех новорожденных в Германии стали обследовать на наличие фенилкетонурии по методу Гатри. Список заболеваний постоянно расширялся, например, вслед за фенилкетонурией в него была включена галактоземия.
• 1993 г. — В России впервые стали проводить неонатальный скрининг, который на тот момент включал всего два заболевания: фенилкетонурию и врожденный гипотериоз. Это стало первым этапом развития данного диагностического направления в нашей стране.
Источники
- Приказ Министерства здравоохранения Российской Федерации от 21.04.2022 № 274н «Об утверждении Порядка оказания медицинской помощи пациентам с врожденными и (или) наследственными заболеваниями».
URL: http://publication.pravo.gov.ru/Document/View/0001202207130023?ysclid=lbz0767oey298399166 - Неонатальный скрининг в 2023 г.: расширенный список нозологий и возможности диетотерапии. Журнал «Лечащий врач» от 26.12.2022 года.
URL: https://www.lvrach.ru/2036/partners/15438554 - Методические рекомендации. Метод получения сухого пятна крови на тест-бланк для проведения клинико-лабораторных исследований.
URL: https://amg-genetics.ru/pdf/2023/met_rekomendacii_pyatna_krovi_29_12_2022.pdf - Методические рекомендации по формированию направления на неонатальный скрининг в ВИМИС «АКиНЕО». Москва 2023 год.
URL: https://vimis.ncagp.ru/med_rek_ns.pdf?5521097