Аденокарцинома – это опасная для жизни опухоль, которая развивается в клетках, выделяющих слизь, пищеварительные соки и другие жидкости. Она представляет из себя разновидность карциномы – самого распространенного типа рака. Ее клетки способны прорастать в окружающие ткани, разрушать их, распространяться по телу и создавать различных его частях метастазы – дополнительные онкологические новообразования.
Что такое аденокарцинома и как она развивается?
В организме человека есть более 30 триллионов клеток, каждая из которых действует согласно строго определенной встроенной «программе»: рождается, работает и умирает. Иногда из-за влияния некоторых заболеваний, химических веществ, радиации, наследственных особенностей или случайных сбоев в процессе их деления возникают ошибки. В результате чего в теле появляются мутировавшие, или измененные клетки, обладающие особыми свойствами:
- Бесконтрольно размножаются.
- Не погибают по окончанию нормального жизненного цикла.
- Со временем из их множества формируется опухоль, которая не раздвигает окружающие ткани, а прорастает в них и разрушает.
- Они отрываются от основного, так называемого первичного очага, попадают в сосуды кровеносной и лимфатическойЛимфатическая система дублирует кровеносную. В ней циркулирует лимфа – межклеточная жидкость, которая омывает все клетки тела, доставляет в них необходимые вещества и забирает отходы. На всем протяжении ее сосудов расположены лимфоузлы – похожие на горошину маленькие органы, которые обезвреживают и выводят из организма опасные вещества. систем.
- С кровью и лимфой – жидкостью, омывающей все клетки организма, перемещаются в различные части тела.
- Закрепляются в других структурах и органах, таких как мозг, печень, легкие или кости, и создают в них метастазы – дополнительные раковые новообразования.
Со временем все большее количество жизненно важных тканей повреждается, а их работа нарушается.
Какие бывают метастазы и как они перемещаются по организму?
Измененными могут стать и клетки желез, выделяющие различные жидкости. Чаще всего аденокарциномы возникают в:
- Желудке, в котором происходит накопление и расщепление пищи.
- Легких, и составляют около 40% всех видов опасных опухолей дыхательных путей. Они развиваются в клетках, которые производят слизь, необходимую для выведения из тела пыли и микробов, содержащихся в воздухе. Обычно медленно растут и чаще встречаются у курильщиков, в том числе бывших.
- Молочной железе, и составляют большинство видов рака данного органа. Формируются в клетках, производящих грудное молоко.
- Пищеводе – трубке, по которой пища проходит из рта в желудок. Как правило, измененными становятся клетки, которые выстилают ее нижнюю часть и создают смазывающую слизь.
- Поджелудочной железе, расположенной за желудком. Около 85% всех случаев ее онкологических заболеваний – это аденокарциномы, возникающие в протоках, переносящих необходимые для пищеварения вещества.
- Предстательной железе у мужчин, находящейся чуть ниже мочевого пузыря. Развивается в клетках, производящих защищающую сперматозоиды жидкость.
- Прямой кишке, выводящей остатки переваренной пищи из организма.
- Толстой кишке, в которой происходит всасывание воды и питательных веществ. Аденокарцинома – это самый распространенный тип рака данного органа. Обычно они начинаются с небольшого полипа – нароста ткани на внутренней стенки.
Причины развития аденокарциномы
Сегодня научное сообщество не знает, почему именно возникают все случаи онкологии. Врачам известны только так называемые факторы риска, которые увеличивают вероятность появления в организме измененных клеток. Наличие одного или даже нескольких из них не гарантируют того, что заболевание обязательно разовьется. У каждого типа аденокарциномы есть свой список возможных причин.
Легкое:
- Курение, в том числе пассивное, то есть вдыхание табачного дыма.
- Загрязнение воздуха и химические вещества, такие как радиоактивный газ радон, диоксид кремния, прочие тяжелые металлы и использующийся в строительстве и другой промышленности асбест.
- Семейный анамнез – наличие кровных родственников, у которых уже есть подобный диагноз.
- Облучение: радиация, полученная в ходе диагностики и лечения различных видов онкологических заболеваний при воздействии на область грудной клетки.
Предстательная железа:
- Риск развития рака увеличивается после 50 лет, при этом большинство случаев выявляется у мужчин старше 65 лет.
- Мутации, или изменения генов BRCA1 и BRCA2, которые отвечают за устранение ошибок в клетках и предотвращение развитие опухолей.
- Синдром Линча, повышающий вероятность возникновения опасных новообразований у людей в возрасте до 50 лет.
- Курение.
- Ожирение и лишний вес.
- Семейный анамнез — наличие кровных родственников с подобным диагнозом.
- Неправильное питание: лишние калории, избыток животных жиров и сахара в рационе, а также нехватка фруктов и овощей.
- Недостаточная физическая активность.
- Воспалительные заболевания простаты.
Поджелудочная железа:
- Вероятность развития аденокарциномы повышается с возрастом. Большая часть случаев выявляется у пациентов старше 65 лет, причем у мужчин чаще, чем у женщин.
- Наследственные генетические синдромы, увеличивающие риск возникновения опухолей.
- Мутации, или изменения, вызывающие панкреатит – воспаление поджелудочной железы.
- Некоторые факторы образа жизни: курение, лишний вес, нехватка физической нагрузки, злоупотребление алкоголем и диета с высоким содержанием жира и красного мяса.
Пищевод:
- Пол и возраст: большинство случаев новообразований выявляется у мужчин старше 55 лет.
- Травмы и повреждения пищевода, в том числе от кислоты, забрасываемой из желудка, алкоголя и горячих жидкостей.
- Другие виды рака: легких, ротовой полости или горла.
- Наследственность – наличие кровных родственников, у которых уже есть подобный диагноз.
- Тилоз – чрезмерное разрастание верхнего слоя кожи на ладонях и подошвах стоп, а также образование папиллом, которые представляют из себя небольшие наросты ткани в пищеводе.
- Питание: нехватка в рационе фруктов и овощей.
- Воздействие химикатов и раздражителей, таких как сажа, табачный дым, выхлопные газы, металлическая пыль и других.
Кишечник:
- Чаще всего колоректальные аденокарциномы встречаются у мужчин старше 50 лет.
- Воспалительные заболевания, приводящие к постоянному повреждению стенок органа.
- Ожирение.
- Сидячий образ жизни и отсутствие физической нагрузки.
- Употребление алкоголя и табака.
- Полипы – разрастания тканей на стенке кишечника.
- Диета с низким содержанием клетчатки и высоким – жира и полуфабрикатов из мяса.
Молочная железа:
- Семейный анамнез – наличие родственников с подобным диагнозом.
- Возраст от 55 лет.
- Мутации, или изменения генов BRCA1 и BRCA2, которые отвечают за устранение ошибок в клетках и предотвращение развитие опухолей.
- Ранние менструации – до 12 лет, и менопауза после 55 лет.
- Лучевая терапия – облучение области грудной клетки.
- Плотная ткань молочной железы.
- Употребление алкоголя.
- Ожирение.
- Наличие рака груди или яичников, в том числе находящихся в ремиссииРемиссия – это полное отсутствие признаков заболевания.
- Нехватка физической активности.
- Отсутствие беременностей, грудного вскармливания и роды после 30 лет.
Желудок:
- Большинство пациентов – мужчины в возрасте от 60 лет.
- Избыточный вес.
- Алкоголь и табак.
- Полипы – разрастания ткани на стенке органа.
- Синдром Линча, повышающий вероятность возникновения опасных новообразований у людей в возрасте до 50 лет.
- Избыток красного мяса в рационе, употребление большого количества соленой, маринованной или копченой пищи.
- Инфекция Helicobacter pylori – бактерии, повреждающие слизистую оболочку желудка и приводящие к развитию язвы и гастритаГастрит – это воспаление слизистой оболочки желудка..
- Наличие родственников с подобным диагнозом.
- Группа крови А (II).
- Наследственные синдромы, провоцирующие разрастание тканей или возникновение опухолей.
Аденокарцинома развивается из-за ошибок в генах, которые контролируют рождение, работу и смерть клеток. Такие изменения происходят по нескольким причинам.
- Часть возникает при делении клеток.
- Некоторые из них вызваны воздействием вредных веществ и образом жизни.
- И в части случаев они наследуются от родителей.
Так называемые онкогены стимулируют развитие клеток, а супрессоры опухолей – замедляют их рост и вызывают гибель по окончанию жизненного цикла. Если в результате различных нарушений первые из них активируются, а вторые «выключаются», в организме человека появляется рак.

Диагностика аденокарциномы
Сегодня медицина предлагает множество различных методов, позволяющих выявлять раковые опухоли даже на самых ранних этапах.
- Биопсия – изъятие небольшого количества тканей для изучения свойств ее клеток. Данное исследование – единственный способ постановки точного диагноза. Материал забирается в ходе хирургической операции или прокола иглой, после чего передается в лабораторию, где специалисты выявляют в нем раковые клетки и определяют их тип. Эта информация необходима врачам для подбора правильного лечения и определения прогнозов пациента.
- Рентгенография грудной клетки, а также маммография, обнаруживающая новообразования в молочной железе.
- УЗИ , или сонография – оценка состояния внутренних структур с использованием звуковых волн. Процедура не наносит вреда организму пациента и часто выполняется для выявления очагов заболевания, расположенных в том числе в лимфатических узлах – органах иммунной системы, задерживающих и уничтожающих опасные вещества.
- Магнитно-резонансная томография, МРТ – создание крайне подробного и детализированного изображения мягких тканей, включая мозг, нервы и сосуды при помощи мощных магнитов и радиоволн. МРТ обнаруживает опухоли и определяет их точные размеры и границы. Она не назначается людям с несовместимыми трансплантатами и протезами и не дает возможности исследовать части скелета, в которые часто проникают измененные клетки.
- Компьютерная томография, или КТ. Специальный аппарат делает множество рентгеновских снимков и объединяет их в одну четкую черно-белую картинку. КТ позволяет изучать не только мягкие структуры, но и кости, а также содержащие большое количество воздуха органы, такие как легкие.
- Позитронно-эмиссионная томография. До начала процедуры человек получает небольшое количество радиоактивного сахара, который накапливается в быстро делящихся клетках, в том числе раковых. Затем проводится сканирование, выявляющее любые, даже самые маленькие их скопления. ПЭТ применяется для поиска в организме метастазов – дополнительных очагов онкологии, если врачи точно не знают, в какой именно области они могут находиться. Некоторое оборудование позволяет одновременно выполнять ПЭТ и КТ, благодаря чему доктор получает гораздо больше информации, чем дает каждое из данных исследований.
- Анализы крови. Назначаются для поиска онкомаркеров – белков, выделяемых некоторыми типами измененных клеток, а также для оценки качества работы внутренних органов, таких как почки и печень.
Пройти полную диагностику аденокарциномы можно в онкологическом центре «Лапино-2».
У нас есть высококвалифицированные специалисты и современное оборудование, которое позволяет выявлять опасные опухоли на самых ранних стадиях.
У пациентов нашей клиники нет необходимости тратить времени на поездки по разным медицинским учреждениям – все процедуры выполняются на территории Центра. Исследования проводятся без очереди, в максимально сжатые сроки, а результаты анализов мы получаем из собственной лаборатории.
Стадии аденокарциномы
После выявления рака врачи выясняют его стадию – количество пострадавших от измененных клеток тканей. Для определения этапа аденокарциномы используется международная система TNM, основанная на 3 ключевых моментах:
- Т: размере основной опухоли.
- N: количестве поврежденных лимфатических узлов.
- М: наличии или отсутствии метастазов – дополнительных очагов заболевания в различных областях организма.
Стадии:
В тканях присутствуют измененные клетки, но они есть только там, где впервые возникли.
I. Опухоль имеет минимальные размеры и находится в пределах органа, в котором она образовалась.
II. На этом этапе очаг разрастается до более крупных габаритов, но другие структуры здоровы.
III. Новообразование увеличивается еще сильнее и выходит за границы органа, в котором появилось. Либо неправильные клетки обнаруживаются в лимфатических узлах – «фильтрах» иммунной системы, задерживающих и обезвреживающих опасные вещества.
IV. Единственная стадия, в медицинском шифре которой рядом с буквой «М» стоит цифра «1», а не ноль. Это значит, что в теле пациента присутствуют метастазы – дополнительные раковые опухоли в других областях организма, расположенных далеко от первичного очага.

Лечение аденокарциномы
Тактика борьбы с раком зависит от большого количества факторов: количества пострадавших тканей, размера и расположения опухоли, возраста человека, наличия у него других тяжелых заболеваний и его общего состояния здоровья.
Часто основным методом лечения аденокарциномы является хирургия – удаление новообразования и небольшого количества окружающей ее здоровой ткани. Нормальные структуры изымаются для того, чтобы в организме не осталось ни одной измененной клетки, которая могла бы размножиться и сформировать новый очаг заболевания.
Операции проводятся как классическим способом – с выполнением крупных разрезов, так и лапароскопически – с использованием специального инструмента через небольшие проколы. Такие вмешательства позволяют повреждать минимум тканей и сокращают кровопотерю, болевые ощущения и сроки восстановления, но требуют большого опыта и мастерства хирурга.
Химиотерапия – применение препаратов для уничтожения неправильных клеток. Они вводятся в вену или принимаются внутрь, попадают в кровоток, распространяются по всему телу и действуют во всех его областях. Благодаря такому свойству их можно использовать в том числе на запущенных стадиях, при распространении рака и появлении метастазовМетастаз – это новая, дополнительная онкологическая опухоль, возникшая в тканях или органах, расположенных далеко от основного ракового очага.. «Химия» проводится циклами, каждый из которых чередуется с периодом отдыха, необходимого для восстановления организма.
Лучевая терапия – разрушение измененных клеток радиацией. Лечение предполагает 2 вида воздействия:
- внешнее – облучение из специального аппарата, расположенного вне тела;
- и внутреннее, или брахитерапию – размещение радиоактивных веществ в опухоли или близких к ней тканях.
Может назначаться совместно с химиотерапией. Проводится до операции для уменьшения размеров опухоли и облегчения ее удаления, а также после хирургического вмешательства для уничтожения всех оставшихся неправильных клеток.
Таргетная терапия – прием препаратов, которые воздействуют только на определенные изменения в клетках. С их помощью можно остановить рост новообразования или уменьшить его размеры. В отличие от обычной «химии», влияющей на любые быстро делящиеся клетки, такие вещества практически не повреждают здоровые ткани.
Гормональная терапия. Гормоны – это вещества, которые создаются железами, с кровью перемещаются в различные ткани и сообщают им, как действовать – работать или отдыхать, поглощать что-то или выделять. Данные соединения влияют на развитие некоторых видов аденокарцином. Контроль их количества или прекращение выработки с помощью специальных лекарств может замедлить или прекратить увеличение опухолей.
Иммунотерапия – средства, которые помогают собственной иммунной системе человека выявлять и разрушать измененные клетки. Такие препараты обычно назначаются пациентам с распространенным раком для сокращения размеров новообразований и остановки их роста.
В онкологическом центре «Лапино-2» проводится лечение различных типов аденокарцином на любой стадии.
У нас работают отличные специалисты – врачи с мировым именем и огромным опытом в области выявления и борьбы с онкологическими заболеваниями.
Мы применяем все современные методики и используем исключительно оригинальные препараты, дающие предсказуемый результат.
Нашим пациентам не приходится терять драгоценное время – у нас нет очередей, а все процедуры проводятся точно в срок, с максимальным комфортом для каждого посетителя.
Прогнозы и выживаемость при аденокарциноме
Прогноз индивидуален для каждого человека и зависит от множества факторов: возраста, наличия других тяжелых заболеваний, типа рака, его распространенности, свойств его клеток и реакции на проводимую терапию.
Врачи определяют примерные перспективы пациента, ориентируясь на данные «пятилетней выживаемости». Этот показатель представляет из себя статистическую выборку – количество больных, оставшихся в живых через 5 или более лет с момента постановки диагноза.
Для различных типов аденокарциномы общая для всех стадий цифра выглядит следующим образом:
- опухоли желудка: 32%;
- кишечника: 90%;
- легких: 56%;
- молочной железы: 90%;
- пищевода: 47%;
- поджелудочной железы: 10%;
- тонкой кишки: 68%.
Борисова О.В.
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
Ермолаева А.Г.
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Москва, Россия
Мельникова В.Ю.
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Москва, Россия
Петров А.Н.
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава РФ
Славнова Е.Н.
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
Срочная интраоперационная морфологическая диагностика в онкологии
Авторы:
Волченко Н.Н., Борисова О.В., Ермолаева А.Г., Мельникова В.Ю., Петров А.Н., Славнова Е.Н.
Как цитировать:
Волченко Н.Н., Борисова О.В., Ермолаева А.Г., Мельникова В.Ю., Петров А.Н., Славнова Е.Н. Срочная интраоперационная морфологическая диагностика в онкологии. Онкология. Журнал им. П.А. Герцена.
2015;4(4):5‑11.
Volchenko NN, Borisova OV, Ermolaeva AG, Melnikova VYu, Petrov AN, Slavnova EN. Rapid intraoperative morphological diagnosis in oncology. P.A. Herzen Journal of Oncology. 2015;4(4):5‑11. (In Russ.)
https://doi.org/10.17116/onkolog2015445-11

Срочная интраоперационная морфологическая диа-гностика (СИМД) — цитологическая и гистологическая — применяется более 100 лет. В последнее время наблюдается общемировая тенденция к снижению количества срочных морфологических исследований во время операции. Это связано с широким применением минимально инвазивных методов получения материала в дооперационной диагностике с целью морфологической верификации процесса, определения факторов прогноза течения заболевания и показаний к назначению адекватной терапии. Благодаря развитию методов уточняющей морфологической диагностики, таких как иммуногистохимия (ИГХ) и цитохимия, и молекулярно-генетических методов расширяются знания об опухолях. Правильный диагноз возможен только при исследовании всего объема опухоли, включая соответствующие ИГХ и молекулярно-генетические исследования. В связи с применением методов уточняющей диагностики показания для СИМД значительно сокращаются. Однако важность срочного морфологического исследования остается несомненной. СИМД по-прежнему играет важную роль, так как определяет тактику хирурга во время операции, позволяет избежать повторных операций или излишне обширных оперативных вмешательств.
Целью интраоперационной морфологической диагностики является адекватное выполнение хирургического вмешательства. Основными задачами срочного интраоперационного морфологического исследования являются:
1) морфологическая верификация диагноза после нескольких неудачных попыток или невозможности дооперационной диагностики, а также при несоответствии морфологического диагноза операционным находкам;
2) уточнение степени распространенности опухолевого процесса путем изучения зон регионарного метастазирования, близкорасположенных органов, состояния органов высокого риска метастазирования, экссудатов и смывов из серозных оболочек;
3) установление абластичности операционных краев резекции;
4) контроль информативности взятого материала при некоторых диагностических операциях.
СИМД имеет ограниченные возможности для уточнения гистогенеза и степени дифференцировки опухоли, для определения характера опухоли (первичная или метастаз), диагностики опухолей кожи, сарком мягких тканей и костей, злокачественных лимфом, опухолевых узлов полиморфного строения, оценки степени лечебного патоморфоза. Не следует применять СИМД при подозрении на cr in situ или микроинвазию.
Показания для срочного цитологического или гистологического исследования определяет оперирующий хирург. Оба метода имеют свои преимущества и недостатки.
По данным литературы [1—6], точность СИМД в зависимости от объекта исследования составляет от 89% при исследовании лимфатических узлов до 98—99% при других локализациях. Ошибочный диагноз при СИМД возможен как ложноположительный, так и ложноотрицательный. Причинами ложноотрицательного морфологического заключения могут быть регрессия опухоли, вызванная неоадъювантной химиотерапией, некроз, замещение опухолевой ткани новообразованными сосудами, гистиоцитами, лимфоцитами и фиброзом, что может быть неправильно истолковано как хроническое воспаление. Причинами ложноположительных заключений являются резко выраженная пролиферация и реактивные изменения клеточных элементов. Эти ошибки могут быть вызваны неправильным толкованием морфологической картины, низким качеством замороженных срезов, неправильным забором материала для исследования, незнанием макроскопических признаков, сложными случаями для интерпретации, наличием только карциномы in situ в образце, гетерогенностью опухоли.
Следовательно, необходимо понимание различных проблем, с которыми может столкнуться как патологоанатом при исследовании замороженных срезов, так и цитолог при СИМД.
Для качественной интраоперационной морфологической верификации диагноза необходимо получение информативного операционного материала, правильное оформление сопроводительных документов с указанием анамнестических данных, стадии процесса, характера предоперационного лечения, сроков его проведения, макро- и микроскопического исследования операционного материала.
Цель исследования — оценить точность СИМД и проанализировать причины диагностических ошибок.
Материал и методы
В 2013 г. ФГБУ «ФМИЦ им. П.А. Герцена» выполнено 418 срочных гистологических исследований у 361 больного (7% общего количества операций) и 1198 срочных цитологических исследований у 646 (12,5%) больных. В 2014 г. выполнено 507 срочных гистологических исследований у 356 (8%) пациентов и 1356 срочных цитологических исследований у 676 (15,5%) пациентов. Для срочного гистологического исследования применяются криостатные срезы, препараты окрашиваются гематоксилином и эозином. Недостатком криостатных срезов является более низкое качество гистологических препаратов, чем при плановом гистологическом исследовании после приготовления парафиновых блоков. Срочное гистологическое исследование проводится в течение 20—30 мин. Для срочной окраски цитологических препаратов применяют набор для окраски Лейкодиф (Чехия). Срочное цитологическое исследование занимает 10—15 мин. Для исследования экссудатов из серозных полостей и диагностики метастатического поражения лимфатических узлов применяется иммунофлюоресцентное исследование (ИФИ) с антителом к эпителиальному антигену Ber-EP4 FITC («Dako»). ИФИ осуществляется на флюоресцентном микроскопе Carl Zeiss Imager M1.
Результаты
Морфологическая верификация диагноза
Интраоперационная морфологическая верификация диагноза применяется в основном при периферических образованиях легких, недоступных для дооперационного морфологического исследования, при опухолях яичников, а также при неуверенном дооперационном морфологическом диагнозе при опухолях молочной железы. Мы придерживаемся правила — не использовать срочное исследование при cr in situ, так как можно не получить категоричного заключения ни при срочном, ни при плановом исследовании.
Гистологическая СИМД для верификации процесса в легком позволила установить туберкулез в 32,8%, гамартому в 8,2%, хроническое продуктивное воспаление в 6,6% наблюдений, что дало возможность избежать излишне радикальных операций. Нейроэндокринные опухоли (типичный и атипичный карциноид) выявлены в 8,2% наблюдений (рис. 1, 2 и далее). Злокачественный процесс установлен в 44,3% наблюдений, при этом 85% составила аденокарцинома легкого, преимущественно высокодифференцированная (прежний БАР) (рис. 3), а 14,8% — метастазы аденокарциномы кишечного типа, желудка и меланомы в ткани легкого. Расхождений срочного и планового гистологического исследований не отмечалось.
При срочном цитологическом исследовании образований в легком гиподиагностика составила 6,7% (4 наблюдения из 60), что связано с получением материала из очага некроза, воспаления, а также наличием микроочагов опухоли на фоне пневмонии. В 6,6% наблюдений цитологически было дано неуверенное заключение.
Опухоли яичников всегда подвергаются СИМД с целью верификации диагноза, что обусловлено отсутствием дооперационной морфологической диагностики — опухоли практически не пунктируют из-за опасности диссеминации. Изучение криостатных срезов является важным диагностическим инструментом определения характера поражений яичников. В 30% наблюдений проведено двустороннее исследование яичников. При СИМД сравнительно просто диагностируют неопухолевые поражения яичников, такие как фолликулярная, лютеиновая, эндометриоидная кисты, эндометриоз и т. д. (54,4%). Доброкачественные опухоли яичников диагностированы в 15,8% случаев, пограничные опухоли яичников (ПОЯ) — в 8,5%, злокачественные — в 21,5%. В одном наблюдении при СИМД диагностирована аденокарцинома яичника, а при плановом гистологическом исследовании установлена тератома. Ошибка связана с выраженной пролиферацией и образованием сосочковых структур эпителиального компонента тератомы. СИМД опухолей яичников имеет ряд ограничений, особенно при ПОЯ, которые характеризуются некоторыми гистологическими особенностями — нарушением стратификации эпителиального пласта, увеличением митотической активности, в некоторых случаях ядерной атипией, но отсутствует стромальная инвазия. СИМД опухолей яичников определяет объем оперативного вмешательства. При доброкачественных и ПОЯ можно выполнить органосохраняющее лечение у молодых женщин, в то время как злокачественные эпителиальные опухоли, как правило, требуют обширного хирургического вмешательства с гистерэктомией, двусторонним удалением придатков матки и сальника, а также тазовой и ретроперитонеальной лимфаденэктомией. При исследовании опухолей яичников необходимо тщательное макроскопическое исследование материала в совокупности с клиническими данными и методами инструментального исследования. Желательно исследовать несколько криостатных срезов из разных участков. По нашим данным, ошибка при исследовании ПОЯ яичников имела характер гиподиагностики и составила 7%, что связано в основном с наличием лишь микроочагов опухоли (рис. 4). Большой размер опухоли, двустороннее поражение, а также муцинозный характер являются неблагоприятными факторами в определении злокачественного потенциала при СИМД. В 20% наблюдений при исследовании брюшины при СИМД выявлены импланты ПОЯ. Если имеются инфаркт и некротические изменения, а также киста, лишенная эпителиальной выстилки, окончательные выводы следует делать при плановом гистологическом исследовании на парафиновых блоках. В 14,3% случаев при СИМД выявлены метастазы в яичниках эндометриоидной аденокарциномы, аденокарциномы шейки матки, желудка, молочной железы и почки, подтвержденные плановым гистологическим исследованием.
Таким образом, чувствительность СИМД при опухолях яичников составляет 98,7%, специфичность — 99%.
Срочное цитологическое исследование яичников применяется при пункции кист или при невозможности гистологического исследования. В одном наблюдении при исследовании кисты цитологически имелась гиподиагностика ПОЯ, что связано с объективными трудностями — клеточная атипия отсутствовала. Однако при пересмотре цитологических препаратов имелись плотные опухолевые комплексы из мелких клеток, что характерно для ПОЯ.
СИМД при образованиях молочной железы в настоящее время применяют крайне редко, так как морфологический диагноз является результатом исследования дооперационных трепанобиопсий. При расхождении цитологического и гистологического диагнозов и при неуверенном дооперационном диагнозе проводится срочное морфологическое исследование. Доброкачественные поражения составили 57%, при плановом гистологическом исследовании подтверждены такие процессы, как аденоз, фиброаденома с дисплазией эпителия. Рак молочной железы установлен в 40% (18 наблюдений), из них 33% составил дольковый рак, в 2 наблюдениях выявлена cr in situ, в одном наблюдении имелся тубулярный рак на фоне склерозирующего аденоза (рис. 5). В другом наблюдении при СИМД диагностирована липогранулема, а при плановом гистологическом исследовании выявлен небольшой очаг инвазивного рака без признаков специфичности. Чувствительность интраоперационного гистологического диагноза при раке молочной железы составляет 97%, специфичность — 100%. Неуверенное заключение дается в 1—2% наблюдений. Противопоказаниями к срочному исследованию являются внутрипротоковый и внутридольковый рак (cr in situ), внутрипротоковая папиллома. Высокодифференцированная папиллярная и тубулярная карцинома, отсутствие клеточной атипии при инвазивном дольковом раке часто при СИМД неправильно диагностируются как доброкачественные поражения как при цитологическом, так и гистологическом исследовании. Инвазивный микрососочковый рак и лимфому молочной железы трудно диагностировать при СИМД.
Случаи гипердиагностики в нашем материале не выявлены, но такие ошибки возможны при пролиферирующем папилломатозе и аденоме соска с гиперплазией эпителия протоков соска с формированием железистых и папиллярных структур, особенно с центральным некрозом, что можно ошибочно принять за внутрипротоковый рак; при склерозирующем аденозе с радиальным рубцом, когда создается впечатление инвазивного роста рака; при гранулематозном мастите, эктазии протоков и некрозе жировых клеток. Для избежания морфологической ошибки необходимо тщательное исследование препарата: отсутствие атипии эпителия, наличие миоэпителиального слоя, плотная коллагеновая строма помогают в постановке правильного морфологического диагноза.
Интраоперационно цитологически опухоли молочной железы исследуют крайне редко: при наличии кист и отсутствии дооперационного морфологического диагноза. В нашем исследовании имелось одно наблюдение, когда цитологически диагностирована папиллярная киста молочной железы, а при плановом гистологическом исследовании диагностирован папиллярный рак.
Цитологическая гиподиагностика при исследовании первичной опухоли составила 3,8%, что связано с утратой морфологических особенностей опухолевых клеток, особенно при недифференцированных и мелкоклеточных новообразованиях (например, мелкоклеточный лимфоцитоподобный рак), а также выраженными дистрофическими изменениями опухолевых клеток. Цитологическая гипердиагностика не превысила 1% и связана с выраженными реактивными изменениями эпителия.
Уточнение степени распространенности опухолевого процесса
С развитием интраоперационного ультразвукового исследования, микрохирургических пособий во время операции, позволяющих обнаружить очаги опухоли, невыявленные на дооперационном обследовании, и интраоперационных находок при непосредственной ревизии операционной раны СИМД имеет неоценимые преимущества. Проведение СИМД в 10% случаев изменяет объем оперативного вмешательства [7]. Невозможность выполнения оперативного вмешательства должна быть подтверждена морфологически.
СИМД позволяет объективно оценить состояние лимфатического коллектора. В 30—40% макроскопически неизмененных лимфатических узлов обнаруживают метастазы, а в 25—30% макроскопически похожих на метастатические узлы при микроскопическом исследовании метастазы не выявляют. Срочное интраоперационное гистологическое исследование лимфатических узлов может быть неудачным в 25% наблюдений [7]. Большое количество ложноотрицательных заключений как цитологических, так и гистологических является серьезной проблемой для клинического применения СИМД в основном из-за ограниченной способности обнаруживать микрометастазы, особенно подкапсульные, которые просто не попадают в срез или соскоб с поверхности разрезанного лимфатического узла. Кроме того, возможна потеря отдельных опухолевых клеток при приготовлении гистологического препарата. Чувствительность и специфичность срочного цитологического исследования лимфатических узлов аналогичны исследованию криостатных срезов, поэтому цитологический метод является альтернативой срочному гистологическому исследованию лимфатических узлов.
В нашем центре проведена работа по исследованию лимфатических узлов при радикальной трахелэктомии у пациенток с начальным раком шейки матки [8]. Удаленные лимфатические узлы подвергали срочному цитологическому исследованию. При обнаружении увеличенных и подозрительных по метастатическому поражению тазовых и парааортальных лимфатических узлов срочное цитологическое исследование дополняли или заменяли срочным гистологическим исследованием. По результатам срочного цитологического и гистологического исследования у 5 (6%) пациенток из 81 выявлены метастазы в лимфатических узлах, в связи с чем произведена конверсия трахелэктомии в расширенную экстирпацию матки с удалением или транспозицией придатков. Метастатическое поражение лимфатических узлов во всех случаях было подтверждено при плановом гистологическом исследовании. В 3 случаях установлены микрометастазы (<2 мм), в 2 — макрометастазы. Число положительных лимфатических узлов варьировало от 1 до 5. Во всех наблюдениях отмечались метастазы плоскоклеточного рака [8].
В настоящее время широко применяется СИМД сторожевого (сигнального) лимфатического узла (СЛУ). Метастатическое поражение СЛУ является одним из основных прогностических и предиктивных факторов при раннем раке желудка, шейки матки, молочной железы и меланоме. СЛУ является первым лимфатическим узлом на пути оттока лимфы от первичной опухоли. Отрицательный СЛУ может исключать возможность метастазов в других лимфатических узлах, что не всегда подтверждается на практике. Например, у женщин с ранним раком шейки матки и молочной железы, которые хотят сохранить репродуктивный потенциал, можно избежать радикального хирургического вмешательства, если в сторожевом узле отсутствует метастаз. Исследование СЛУ проведено гистологически у 4 пациенток при раке шейки матки, метастазов не выявлено; цитологически исследовано 3 СЛУ при раке желудка (у 2) и молочной железы (у 1), метастазов не выявлено.
Причинами гиподиагностики является исследование не всех удаленных лимфатических узлов. Оптимально исследуют не более 5 лимфатических узлов из-за ограничения временны́х рамок. Пролиферация гистиоцитарных элементов при синус-гистиоцитозе с наличием крупных полиморфных гистиоцитов может служить причиной гипердиагностики. Для уточнения диагноза используется ИФИ лимфатических узлов, повышающее достоверность цитологической диагностики до 94%.
Часто для уточнения степени распространенности опухолевого процесса исследуются близкорасположенные органы, брюшина.
Важное значение в оценке степени распространенности опухолевого процесса имеет исследование экссудатов из серозных полостей. Остается сложной и нерешенной задачей цитологического исследования диссеминатов с брюшины при перстневидно-клеточном раке желудка из мелких клеток, ПОЯ, так как эти опухоли при микроскопическом исследовании крайне сложно дифференцировать с реактивным мезотелием. Срочное гистологическое исследование в большинстве наблюдений позволяет установить диссеминацию опухоли. Применение ИФИ повышает выявляемость клеток аденогенного рака до 98% (рис. 6, 7). Из исследованных 150 экссудатов при СИМД ИФИ проведено в 17 (11%) наблюдениях, из них наиболее часто при перстневидно-клеточном раке желудка (12 наблюдений) и ПОЯ (4 наблюдения), что позволило установить диссеминацию опухоли в брюшной полости.
Достоверность СИМД метастазов в печени составляет 98%, гиподиагностика отмечена в одном наблюдении из-за резко выраженной деформации материала. Наиболее часто метастазы в печени выявляют при аденокарциноме желудка и толстой кишки.
Установление абластичности операционного края резекции
Для морфологического контроля абластичности хирургического края интраоперационное исследование имеет важное значение, так как связано с расширением показаний для экономных резекций, особенно при раке молочной железы при трахелэктомии и микрохирургических операциях на органах головы и шеи, а также при раке желудка, толстой кишки, легкого и др.
В настоящее время имеется четкая тенденция к уменьшению расстояния между опухолью и краем резекции. В последние годы появились исследования, показывающие, что сокращения края резекции не приводит к увеличению частоты местных рецидивов и ухудшению выживаемости. По мнению многих исследователей, применение лучевой терапии расширяет возможности оперативного вмешательства.
При раке молочной железы патоморфолог, как правило, дает заключение о негативном крае при расположении опухоли от 1 до 5 мм от края резекции; о позитивном крае, если опухолевые клетки присутствуют в исследуемом материале, и о сомнительном или закрытом крае, когда опухолевые клетки располагаются на расстоянии менее 1 мм от края резекции. При раке молочной железы для срочного гистологического исследования доставляется удаленная опухоль и исследуется один или два края ближайших к опухолевому узлу. Из 87 исследованных краев резекции опухоль обнаружена в 12 (13,8%). В 3 (4%) наблюдениях положительный край резекции установлен только при плановом гистологическом исследовании, что потребовало повторной операции. Факторами, определяющими гистологическую гиподиагностику при СИМД, являются обширный внутрипротоковый компонент и инвазивная дольковая карцинома.
При раке молочной железы проводят срочное цитологическое исследование нижнего и верхнего краев резекции, подсосковой зоны, иногда исследуют медиальный и латеральный края. У 2,5% больных в крае резекции обнаружены опухолевые клетки. Ложноотрицательные цитологические заключения составили 1,2%.
Для исследования краев резекции при раке молочной железы часто доставляется жир, а паренхима молочной железы отсутствует, поэтому адекватно оценить абластичность не представляется возможным.
Оценка края резекции при раке желудка рекомендуется для пациентов при T3 или T4 стадии заболевания, интраоперационно исследуют, как правило, проксимальный край резекции. Срочное гистологическое исследование позволило выявить опухолевый рост в крае резекции при раке желудка в 8% наблюдений. Положительный край был обусловлен инвазией опухоли подслизистого слоя, неопределяемой при макроскопическом исследовании (рис. 8).
При резекции легкого гистологическое исследование краев резекции применяется редко, за 2 года всего 11 наблюдений. Опухолевые клетки обнаружены только в одном наблюдении при неходжкинской лимфоме. Цитологически край резекции бронха исследовали в 17 наблюдениях, опухолевые клетки не обнаружены.
При раке пищевода опухолевые клетки по краю резекции обнаружены в 11,5%, в одном наблюдении опухоль по краю резекции выявлена только при плановом гистологическом исследовании.
Для оценки адекватности удаления шейки матки при трахелэктомии, выполняли поперечный срез толщиной 1—2 мм с ее резидуальной части для срочного гистологического исследования. С помощью CytoBrush из сохраняемого отрезка цервикального канала получали материал с последующим проведением интраоперационного цитологического анализа. Положительная граница резекции интраоперационно установлена у 5 (6%) из 81 больной. В одном случае, по данным срочного гистологического исследования, выявили рак in situ по краю резекции, в связи с чем произвели дополнительное дисковидное иссечение шейки матки, что позволило обеспечить отрицательную границу резекции и выполнить органосохраняющую операцию. В остальных 4 случаях произведена конверсия трахелэктомии в расширенную экстирпацию матки с транспозицией яичников. Положительная граница резекции в 2 случаях из 5 обнаружена при аденокарциноме, в 2 случаях при аденоплоскоклеточном раке и лишь в одном случае при плоскоклеточном гистотипе [8].
Исследование краев резекции при раке поджелудочной железы проведено в 6 наблюдениях, из них в 3 гистологически выявлена аденокарцинома.
В нашем центре широко применяется цитологическое исследование краев резекции при операциях на органах головы и шеи — опухолевые клетки выявлены в 6,8% наблюдений.
С целью определения абластичности краев резекции при онкоортопедических операциях исследование костного мозга на криостатных срезах практически не применяется, поэтому используется срочное цитологическое исследование. Достоверность исследования составляет 98,8%.
В целом 12% результатов интраоперационного морфологического исследования образцов тканей краев резекции показывают необходимость расширения оперативного вмешательства, чтобы сделать его адекватным.
Контроль информативности взятого материала при некоторых диагностических операциях
При опухолях мягких тканей и костей, средостения диагноз возможен только при комплексном клинико-морфологическом исследовании с обязательным применением методов иммуногистохимии, а также во многих случаях молекулярно-генетических методов исследования. Интраоперационная морфологическая, в основном цитологическая диагностика применяется с целью контроля информативности взятого материала для планового гистологического исследования и по информативности не уступает исследованию замороженных срезов. По данным некоторых авторов, диагноз был бы невозможен без цитологического исследования. Это, как правило, лимфома, плазмоцитома, саркома Юинга, метастатическая карцинома, метастатическая меланома, рак из клеток Меркеля, липосаркома. Для малоклеточных, фиброзных, миксоидных и опухолей из жировой ткани роль цитологического исследования отпечатков ограничена.
Заключение
СИМД остается незаменимой в онкологии, так как способна уточнить информацию о характере патологического процесса, степени его распространения, состояния окружающих тканей и краев резекции, что необходимо при выборе адекватного хирургического вмешательства. Однако, при неясном диагнозе и при небольшом количестве полученного материала не следует любой ценой добиваться интраоперационного морфологического исследования, особенно если речь идет о редких опухолях и неинвазивном раке.
Чувствительность гистологического метода при СИМД составляет 98%, специфичность — 99%, чувствительность цитологического метода при СИМД составляет 95%, специфичность — 96%. Гистологическая гипердиагностика при срочном исследовании составляет 0,5%, гиподиагностика 1%, цитологическая гипердиагностика — 3%, гиподиагностика — 9%. Заключения в предположительной форме при срочном гистологическом исследовании составляют 2%, при цитологическом — 11%. В 12% результатов интраоперационного морфологического исследования образцов тканей краев резекции показывают необходимость расширения оперативного вмешательства. Неинформативный материал при срочном исследовании достигает 2—5%, в основном при срочном цитологическом исследовании.
Золотым стандартом морфологического исследования является комплексное цитологическое и гистологическое исследования, которые являются взаимодополняющими. Необходимо подчеркнуть значение междисциплинарного подхода к диагностике, в том числе и интраоперационной, включая клинические данные и результаты инструментальных методов исследования с целью достижения точного диагноза.
Участие авторов:
Концепция и дизайн исследования: Н.Н.В.
Сбор и обработка материала: В.Ю.М., А.Г.Е., О.В.Б., Е.Н.С.
Статистическая обработка: О.В.Б., А.Н.П.
Написание текста: В.Н.Н., О.В.Б.
Редактирование: В.Н.Н.
Конфликт интересов отсутствует.
Случай №28:

Случай №27:

Случай №26:

Случай №25:

Случай №24:


При подозрении на лимфопролиферативное заболевание гистологическое исследование должно дополняться иммуногистохимическим. Довольно часто диагноз, предполагаемый по результатам гистологического исследования, корректируется по итогам иммуногистохимии! Этот случай не стал исключением. К нам поступил материал с входящим диагнозом ангиоиммунобластная лимфома. Проведенные иммуногистохимические исследования привели к корректировке диагноза на доброкачественный — у пациента диагностирована болезнь Кастлемана.

Материал следующего пациента пришел к нам на исследование из Казахстана. Входящий диагноз — неходжкинская лимфома (нодальная B-клеточная лимфома маргинальной зоны). Для качественной постановки диагноза при подозрении на лимфопролиферативное заболевание требуется иммуногистохимическое исследование! Данный случай показателен, так как по результатам иммуногистохимии онкологический диагноз не подтвердился. Пациенту был поставлен диагноз — реактивная фолликулярная гиперплазия лимфоидной ткани.

Входящий гистологический диагноз — эпителиоидно-клеточная малопигментная меланома без изъязвления. После проведения пересмотра гистологии диагноз был изменен на эпителиоидноклеточный невус Шпитц. Этот тип доброкачественных образований часто вызывает сложности при дифференцировании его с меланомой ранней стадии, поэтому очень важно в этом случае проводить пересмотр гистологических стекол у патоморфолога, специализирующегося в данной области. Так как это доброкачественное образование, удаленное радикально, то пациенту не потребуется дополнительное лечение.
Случай №20:
Этот случай иллюстрирует необходимость проведения пересмотров гистологических стекол при первоначальной постановке злокачественного диагноза. К нам на исследование поступили материалы девушки 1987 г.р. с диагнозом рак яичника. По результатам пересмотра материалов нашими специалистами было вынесено другое заключение — серозная пограничная опухоль. Пациентке потребуется иное лечение, чем в случае злокачественной опухоли.
Случай №19:
Еще один случай из практики, наглядно показывающий необходимость проведения иммуногистохимических исследований для постановки точного диагноза. Материал поступил к нам со входящим диагнозом — фибромиксоидная саркома (злокачественное новообразование). Для постановки диагноза были проведены иммуногистохимические исследования. По результатам этих исследований был поставлен другой диагноз — плеоморфная фиброма (это доброкачественное образование).
Случай №18:
Этот случай иллюстрирует важность своевременного получения «второго мнения» высококвалифицированных специалистов. 
Случай №17:
Этот случай — еще одно подтверждение необходимости проведения иммуногистохимических 
Случай №16:
Опухоли центральной нервной системы часто представляют диагностическую сложность.
Случай №15:

Случай №14:
Клинический диагноз, с которым поступил материал 52-летней женщины, — B-клеточная лимфосаркома
Случай №13:
Поступил материал с входящим клиническим диагнозом — нейробластома. Проведены
Случай №12:
Входящий гистологический диагноз — анапластическая ганглиоглиома (GIII). По результатам
Случай №11:
Поступили материалы пациента 9 лет из Новокузнецка с подозрением на миксоидную
Случай №10:
Входящий клинический диагноз — рак предстательной железы. Пациент обратился за 

Мужчина 65 лет, Улан Удэ, входящий диагноз рак простаты, после простого пересмотра стекол нашими специалистами поставлен диагноз гиперплазия (не рак). Интересно в этом случае то, что это самый часто встречающийся вид рака у мужчин после 50.
Случай №8:
Входящий диагноз пациентки 25 лет из Иркутска — рак печени. Проведены иммуногистохимические исследования, материал оказался очень сложным в диагностике и был проконсультирован через систему Digital Pathology с профессором из Германии Дитером Хармсом, причем консультация заняла менее суток. Онкологический диагноз был изменен на доброкачественный — у пациентки аденома печени.

Поступил материал с подозрением на периферический рак нижней доли правого легкого. Исследованная ткань внутрилегочного лимфатического узла содержала признаки фолликулярной гиперплазии и антракоза. По итогам консультирования опухолевое поражение не было выявлено.
Случай №6:
Материалы поступили с подозрением на мелкоклеточную лимфому. По результатам проведенных гистологических и иммуногистохимических исследований установлено отсутствие опухолевого материала. Онкологический входящий диагноз был изменен на доброкачественную гиперплазию лимфоузла, вероятно вирусного генеза. Доброкачественная гиперплазия лимфоузлов часто требует для дифференцировки с лимфомами мнения патоморфолога, специализирующегося на данном типе онкологических заболеваний.
Случай №5:
Входящий клинический диагноз — системное заболевание лимфатических узлов шеи, 
Эффективность лечения рака зависит не только от развития методов терапии — без постановки точного морфологического диагноза врач-онколог не может выбрать подходящий для конкретной опухоли вид лечения. Важным компонентом современной онкологической помощи, который, к сожалению, часто остается в тени достижений технологий разрушения опухолей, является правильная постановка диагноза. А точнее — определение типа опухолевых клеток и, соответственно, их устойчивости к различным видам внешнего воздействия. Решает эту задачу морфологическая диагностика, базовый принцип которой — исследование образцов опухолевых клеток.
С каким образцами опухолевых клеток работает патоморфология?
Базой для морфологической диагностики являются образцы тканей (фрагменты опухолей). Наиболее частым способом забора материала является трепан-биопсия, которая осуществляется при помощи специальной толстой иглы, также используется инцизионная биопсия, которая выполняется при помощи скальпеля и эксцизионная биопсия с тотальным забором пораженного участка (например, биопсия лимфоузла при диагностике лимфом).
После образцы тканей проходят этапы специальной подготовки (фиксации и проводки), после чего пропитываются парафином с формированием блока. Из блоков на специальных устройствах (микротомах) приготавливаются тонкие срезы толщиной 4-5 микрон. Полученные срезы помещаются на стекла, подвергающиеся различным методам окраски с целью выделения различий в клеточных структурах. Эти, так называемые, “стекла”, подлежат тщательному рассмотрению врачом-патоморфологом.
Каждый из этапов подготовки образцов критичен для возможности и точности последующих молекулярных методов исследования, поэтому нарушение технологии подготовки может привезти к неправильному назначению лечения.
Зачем изучать опухоли под микроскопом?
Количество известных разновидностей опухолей — велико. Наиболее полной считается классификация Всемирной организации здравоохранения (ВОЗ), которая в печатном виде представляет собой 11 томов, около 400 страниц в каждом. Итог — ошибки в постановке диагноза неизбежны.
Патоморфологическая классификация опухолей Всемирной организации здравоохранения (ВОЗ) едва уместилась в 11 томов
Показатель ошибок при постановке диагноза поражает: от 5 до 50% всех онкологических диагнозов в мире — неверны. Половина этих ошибок не становятся фатальными — различные виды рака могут одинаково реагировать на определенный подход к лечению. Но значительная часть неточностей приводит к неадекватному лечению рака у пациентов, которое может способствовать прогрессированию заболевания.
Среди объективных причин ошибочных диагнозов, связанных с морфологической диагностикой, лидирует невозможность получения образца опухолевой ткани для ее морфологического исследования ввиду трудности доступа либо тяжелого состояния пациента.
Среди субъективных причин ошибок морфологической диагностики наиболее распространены:
- ошибка при заборе материала (например, при раке простаты следует проводить множественный забор образцов, т.к. опухоль в этом органе может иметь крайне сложную пространственную форму);
- отсутствие возможности конкретного лечебного учреждения провести морфологическую диагностику в необходимом объеме (собственная морфологическая лаборатория — это сложный и дорогой институт);
- нарушения протоколов как в части отказа от забора и морфологического исследования образцов, так и в части стандартов проведения морфологической диагностики опухоли (в том числе и устаревшие методики, отсутствие необходимого оборудования, низкая квалификация специалистов, на повышение которой не выделяется средств).
И только морфологическая диагностика, проведенная с соблюдением всех стандартов взятия материала, подготовки и рассмотрения образцов, способна дать окончательный ответ о типе опухоли и ее особенностях.
Гистология и иммуногистохимия — в чем отличие?
Первоначально, морфологическая диагностика решала задачу определения наличия злокачественного процесса в ткани. Для этого применялся метод, который в современной медицине называется “гистологическое морфологическое исследование”, или, как часто можно услышать от пациентов “гистология”.
С помощью гистологического морфологического исследования может быть проведена дифференциальная диагностика доброкачественных процессов и злокачественной опухоли — т.е. определение наличия измененных (атипичных) клеток в образце тканей. Простое гистологическое исследование в любом случае носит субъективный характер и зависит от профессионализма проводящего его врача. Поэтому, при подозрении на наличие опухоли, второе мнение от ведущих экспертов МИБС в этой области значительно снижает риск ошибочного диагноза.
При подтверждении опухолевого процесса в тканях, пациенту требуется более точная диагностика, которая точно определит тип опухоли и укажет на наиболее эффективный подход к ее лечению — иммуногистохимия.
Зачем нужно иммуногистохимическое исследование?
Основой иммуногистохимии является окрашивание клеток специфическими веществами, которые реагируют на определенные типы опухолевых клеток и “мишени”, специфические свойства и мутации генов конкретного типа рака.
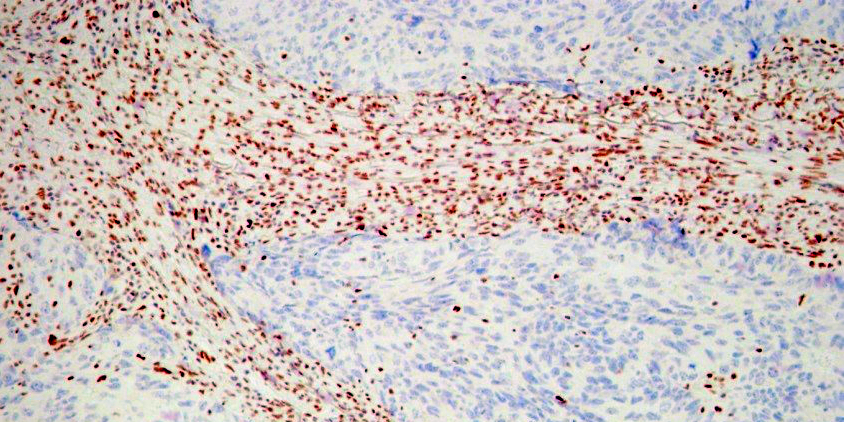
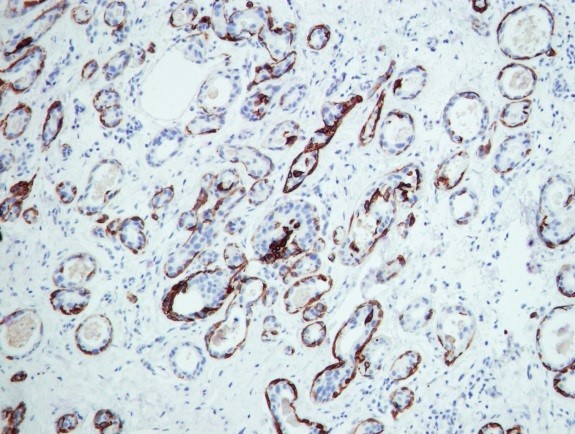
Пример иммуногистохимии в МИБС: Позитивная реакция на СК14 (коричневое окрашивание) вокруг всех подозрительных структур исключает рак молочной железы – дополнительное лечение пациентке не требуется
Таким образом, иммуногистохимия позволяет точно указать нозологию (разновидность) опухоли, что чрезвычайно важно для проведения адекватного лечения, а также – для прогнозирования развития заболевания. Например, некоторые разновидности рака молочной железы (тубулярный, фиброматоз-подобный) не требуют иного лечения, кроме хирургического.
Иммуногистохимия в МИБС: Позитивная реакция на bcl10 в лимфоидных клетках конъюнктивы глаза (коричневое окрашивание вокруг фолликула) подтверждает диагноз MALT-лимфомы, при которой наибольшего эффекта покажет химиотерапия, а не хирургическое лечение
Лечим метастазы. Когда не обойтись без патоморфолога?
Метастазы представляют собой “копию” злокачественных клеток первичной опухоли, точнее, того типа тканей, из которых развилось новообразование. Поэтому тип клеток метастаза может указать на локализацию первичного рака. Это крайне важно, если первичная опухоль не проявляет себя симптомами и не диагностирована. С другой стороны, если первичная опухоль, имеет уязвимость к препаратам таргетной терапии, то ее метастазы могут утратить это свойство. В таком случае иммуногистохимия образца метастазов покажет, что для первичной опухоли лечение будет прежним, а вот для метастазов следует избрать другой подход.
Молекулярные исследования + Таргетная терапия + Иммунотерапия = Эффективное лечение рака
Благодаря развитию методов молекулярной диагностики (иммуногистохимия, ПЦР, секвенирование), лекарственная терапия рака идет большими шагами вперед. Помимо химиотерапии, сейчас активно используются таргетные препараты, целенаправленно воздействующие на мишени в опухолевых клетках (HER2, CD20, c-kit, мутантный b-Raf и др.).
Кроме того, в настоящее время онкология переживает «бум» иммунотерапии, при применении которой лекарственные препараты разрывают порочный механизм, препятствующий уничтожению опухолей собственными иммунными клетками.
Однако для правильного назначения таких препаратов необходимым условием является определение специфических маркеров при помощи иммуногистохимического или молекулярно-генетического исследования опухолевой ткани. Более того, часто маркеры, указывающие на чувствительность к иммунотерапии (MMR, MSI), также говорят о том, что пациенту не следует назначать химиотерапию, в особенности это касается рака толстой кишки и желудка.
Иммуногистохимия показала, что негативная реакция на MSH2 (синее окрашивание ядер опухоли, коричневое окрашивание неопухолевой ткани) свидетельствует о том, что рак тела матки, представленный на данном слайде, чувствителен к иммунотерапии
Какой рак можно вылечить без операции?
Некоторые разновидности опухоли не только не требуют хирургического лечения, но оно им противопоказано, так как может привести к прогрессированию заболевания. Это прежде всего лимфома, опухоль, возникающая из лимфоцитов, которые располагаются как в лимфоузлах, так и в паренхиматозных органах.
Развитие иммуногистохимии и основанных на ее результатах таргетной терапии и иммунотерапии постоянно расширяют спектр видов рака, которые можно вылечить “точечным” воздействием исключительно на опухолевые клетки. Помимо лечения лимфомы, по состоянию на начало 2019 года наибольшее применение методы иммунотерапии и таргетного лечения получили при лечении таких заболеваний, как:
- рак молочной железы;
- рак простаты;
- рак кишечника;
- рак легкого;
- лимфомы;
- рак желудка;
- меланома
при которых современные протоколы лечения требуют выполнение иммуногистохимии. Большинство ошибок в диагностике и лечении данных заболеваний связано либо с не проведением иммуногистохимии, либо с ее неправильной интерпретацией. Цена ошибки, к сожалению, может быть фатальной, так как назначение неправильного лечения может привести к резистентности (устойчивости) опухолевых клеток к лекарственным препаратам, которые при правильном назначении часто приводят к выздоровлению пациента.
Как повысить качество морфологической диагностики в клиниках России?
Выбирайте МИБС как для первого проведения базовой морфологической диагностики либо иммуногистохимического исследования, так и для получения второго мнения от ведущих специалистов нашей медицинской компании относительно имеющихся образцов ткани опухоли (часто называемого пациентами “пересмотр стёкол”), полученных при обследовании в другом онкоцентре.
Почему следует выбрать патоморфологическую лабораторию МИБС?
- исследование и оценка рассматриваемого материала проводится одновременно несколькими ведущими специалистами в центральной патоморфологической лаборатории МИБС в Санкт-Петербурге, сотрудничающей с федеральными онкологическими центрами.
- все вопросы логистики центр МИБС в вашем регионе берет на себя.
- МИБС владеет всеми технологиями, необходимыми для постановки правильного патоморфологического диагноза. От вас не потребуется проводить дополнительные исследования в других лабораториях.
- Иммуногистохимическое исследование может быть проведено в полном объеме за счет средств ОМС (бесплатно для пациента) при наличии направления по форме 14у.
Как заказать морфологическое / иммуногистохимическое исследование в МИБС?
- позвоните в любой центр МИБС в вашем регионе;
- привезите материал (гистологические препараты, парафиновые блоки, копию выписки из истории болезни и прочие документы, описывающие характер заболевания) в центр МИБС вашего города;
- получите заключение через 3-10 дней (в зависимости от вида и объема исследования).
заместитель главного врача по лабораторной медицине МИБС
врач-патологоанатом
доктор медицинских наук
- Формы, виды, типы, стадии аденокарциномы
- Причины и симптомы рака
- Прогноз выживаемости при заболевании
- Диагностика аденокарциномы
- Методы лечения железистого рака
- Последствия и реабилитация после лечения аденокарциномы
- Профилактика аденокарциномы
В статье вы узнаете, что такое аденокарцинома, какие виды, формы и стадии ее существуют. Мы рассмотрим, как проявляется этот рак, каковы методы диагностики и лечения, а также прогноз выживаемости пациентов при данном заболевании.
Что такое аденокарцинома (железистый рак)?
Аденокарцинома — это злокачественная опухоль в железистом эпителии, который выстилает поверхность большинства внутренних и наружных органов. Ее развитие провоцирует неконтролируемый рост и деление клеток. Опухоль может располагаться на различных частях тела, слизистых и внутренних органах.
Чаще она развивается в предстательной железе, легких, печени, толстом кишечнике, поджелудочной железе и пищеводе.
Формы, виды, типы, стадии аденокарциномы
Врачи классифицируют аденокарциному по скорости роста, строению, локализации и степени распространенности опухоли.
Виды аденокарцином
В зависимости от скорости распространения и реакции на лечение, специалисты выделяют такие виды заболевания:
| Вид | Характеристика |
|---|---|
|
Высокодифференцированная аденокарцинома |
Медленно распространяется и хорошо поддается лечению. В 60% случаев высокодифференцированная аденокарцинома протекает в скрытой форме, поэтому врачи выявляют ее на поздних стадиях. |
|
Умеренно дифференцированная аденокарцинома |
Она характеризуется средней агрессивностью и скоростью роста. |
|
Низкодифференцированная аденокарцинома |
Самый опасный вид рака. При низкодифференцированной аденокарциноме новообразование быстро распространяется по организму, рано дает вторичные опухоли (метастазы) и плохо поддается лечению. |
Формы аденокарциномы
Формы аденокарциномы выделяют в зависимости от жидкости, которую вырабатывает опухоль:
- серозная;
- гнойная;
- слизисто-секреторная (муцинозная).
Формы аденокарциномы в зависимости от структуры новообразования:
- папиллярная (сосочковая);
- фолликулярная;
- трубчатая;
- тубулярная;
- солидная;
- кистозная;
- ацинарная.
Типы аденокарциномы
В большинстве случаев врачи выявляют аденокарциному в таких органах:
- желудок;
- поджелудочная железа;
- молочная железа;
- толстая кишка;
- матка;
- печень;
- легкие;
- предстательная железа.
Стадии аденокарциномы
По степени распространенности злокачественного процесса врачи различают 5 стадий аденокарциномы:
- 0 стадия (in situ) — раковые клетки не распространяются за пределы эпителия, в котором образовались.
- 1 стадия — опухоль до 2 см в диаметре, локализованная в органе.
- 2 стадия — новообразование до 4 см, которое может дать метастазы в регионарные (ближайшие к опухоли) лимфатические узлы.
- 3 стадия — опухоль прорастает на всю толщину стенки органа, распространяется на соседние органы, дает метастазы в несколько лимфоузлов.
- 4 стадия — аденокарцинома дает множественные метастазы в отдаленные органы и лимфатические узлы.
Получить консультацию
Причины развития и симптомы аденокарциномы
Причины развития аденокарциномы индивидуальны для каждого органа. К основным факторам, которые способствуют формированию опухоли, относятся:
- нарушения в структуре слизистых оболочек;
- наличие язв, полипов, свищей;
- хронические заболевания какого-либо органа;
- генетическая предрасположенность;
- вредные привычки — курение, злоупотребление алкоголем;
- неправильное питание;
- гормональные изменения;
- вирусные инфекции — папилломавирус, гепатит;
- генетическая мутация в клетках органа;
- ожирение;
- стрессы.
Симптомы аденокарциномы зависят от вида и локализации новообразования. В большинстве случаев они появляются на 2-3 стадии, когда заболевание начинает распространяться по организму. К основным признакам аденокарциномы относятся:
- нарушение работы какого-либо органа;
- увеличение лимфоузлов;
- плохое самочувствие;
- болевые ощущения в каком-то из органов;
- резкое снижение веса;
- потеря аппетита;
- наличие крови в выделениях.
Прогноз выживаемости при аденокарциноме
Продолжительность жизни при аденокарциноме зависит от стадии, на которой начали лечение, дифференциации и локализации опухоли. Прогноз при раке врачи измеряют 5-летней выживаемостью. Она означает количество человек с заболеванием, которые пережили рубеж в 5 лет.
| Стадия аденокарциномы | 5-летняя выживаемость |
|---|---|
|
0 стадия |
92-100% |
|
1 стадия |
80-100% |
|
2 стадия |
50-100% |
|
3 стадия |
37-93% |
|
4 стадия |
15-50% |
Получить консультацию по лечению
Методы диагностики аденокарциномы
Для диагностики железистого рака пациент должен пройти комплексное обследование, которое включает в себя инструментальные и лабораторные исследования:
Лабораторное исследование крови. C его помощью доктора выявляют нарушения в работе внутренних органов.
Анализ крови на онкомаркеры. Помогает определить наличие веществ, которые характерны для конкретного типа аденокарциномы.
Анализ мочи. Помогает выявить воспалительные процессы в организме.
Гистология и гистохимия опухоли. Лабораторные исследования, с помощью которых врачи определяют злокачественность и строение опухоли, прогнозируют эффективность гормональной и таргетной терапии.
Инструментальная диагностика при аденокарциноме
Для диагностики аденокарциномы доктора прибегают к таким инструментальным исследованиям:
УЗИ. С помощью УЗИ врачи обследуют ткани органа и регионарные лимфатические узлы. Ультразвуковое исследование позволяет выявить новообразования и установить их размер.
Эндоскопическое исследование. Неинвазивное визуальное обследование внутренней поверхности органов. Доктора проводят процедуру с помощью гибкой трубки с камерой, которую вводят через естественное отверстие.
Виды эндоскопических исследований в зависимости от органа:
- кишечник — колоноскопия;
- мочевой пузырь — цистоскопия;
- шейка матки — кольпоскопия;
- матка — гистероскопия;
- пищевод — эзофагоскопия;
- желудок — гастроскопия.
Биопсия. Биопсия — это забор тканей новообразования для лабораторного исследования. Врачи проводят процедуру чрескожным методом с помощью шприца, или эндоскопическим — через естественные отверстия.
Рентген или компьютерная томография (КТ). С помощью рентгена или компьютерной томографии врачи выявляют метастазы в органах грудной, тазовой и брюшной полостей.
МРТ. МРТ позволяет определить строение и размер первичной опухоли, выявить вторичные новообразования в головном и спинном мозге.
Сцинтиграфия. Врачи прибегают к процедуре при комплексной диагностике аденокарциномы почек, легких, печени, простаты, щитовидной железы. С помощью сцинтиграфии они отличают метастазы от воспалительных процессов и оценивают эффективность лечения.
Позитронно-эмиссионная компьютерная томография (ПЭТ-КТ). ПЭТ-КТ определяет точную локализацию основного очага и метастазов. С помощью процедуры специалисты выявляют даже самые маленькие опухоли — до 1 мм.
Получить консультацию по диагностике
Методы лечения аденокарциномы
По результатам комплексного обследования доктора подбирают самые эффективные методы хирургии и терапии. На выбор методики влияют локализация, вид и стадия аденокарциномы.
Операция по удалению аденокарциномы
Цель операции при аденокарциноме — удалить опухоль. Виды хирургических вмешательств:
Открытая операция
Во время открытой операции доктор делает разрез до 20 см и удаляет опухоль.
Преимущества: цена на открытую операцию ниже, чем на другие виды.
Недостатки: у пациента остается большой шрам.
Лапароскопическое удаление опухоли
Врач выполняет процедуру через несколько маленьких разрезов — до 2 см. Пораженные ткани он удаляет специальными щипцами. Ход процедуры доктор контролирует с помощью специального прибора с камерой.
Преимущества: шрамы после лапароскопии малозаметны. Восстановление пройдет в 1,5 раза быстрее, чем после открытой операции.
Недостатки: стоимость лапароскопического вмешательства выше, чем открытого.
Удаление аденокарциномы на роботе Да Винчи
Операцию на Да Винчи хирург выполняет через разрезы до 2 см. Он управляет установкой дистанционно за пультом. Компьютер обрабатывает движения доктора и переводит их в плавные манипуляции робота, устраняя дрожание рук. Это позволяет не повредить нервы и крупные сосуды.
Преимущества: вы восстановитесь в 2 раза быстрее, чем после открытой операции.
Операция на Да Винчи имеет особые преимущества при аденокарциноме предстательной и щитовидной желез. После роботизированного удаления простаты у 90% мужчин сохраняются функции эрекции и мочеиспускания, после открытого — у 70%. Удаление щитовидной железы с помощью Да Винчи врачи проводят через подмышку, поэтому процедура не оставляет видимых следов вмешательства.
Недостатки: роботизированная операция стоит дороже, чем открытая и лапароскопическая. С помощью Да Винчи нельзя удалить большие новообразования.
Эндоскопическое удаление аденокарциномы
С помощью эндоскопа врачи удаляют опухоли начальных стадий, расположенные в органах ЖКТ, мужской и женской мочеполовых системах. Во время процедуры доктора используют трубку с камерой и специальные щипцы, которые вводят через естественные отверстия в теле.
Преимущества: после вмешательства у вас не останется шрамов.
Недостатки: с помощью эндоскопа нельзя удалить большие опухоли.
Лучевая терапия при аденокарциноме
При лучевой терапии уничтожение раковых клеток происходит с помощью радиации. Врачи назначают радиотерапию до, после или вместо хирургического вмешательства. Цель предоперационного облучения — уменьшить опухоль, послеоперационного — уничтожить оставшиеся раковые клетки и предотвратить возвращение болезни. Радиотерапия вместо операции показана при маленьких, неоперабельных новообразованиях и на поздних стадиях, чтобы облегчить симптомы.
Дистанционная лучевая терапия при аденокарциноме
Во время процедуры врачи используют высокоточный линейный ускоритель, который воздействует на опухоль и не вредит всему организму. Виды дистанционной радиотерапии:
- 3D-конформная лучевая терапия (3D-CRT) — аппарат создает трехмерную модель новообразования и облучает его под разными углами;
- лучевая терапия с модулированной интенсивностью (IMRT) — позволяет точно рассчитать дозу радиации и подстроить луч под размер и форму опухоли;
- лучевая терапия с визуальным контролем (IGRT) — во время процедуры аппарат выполняет КТ-снимки новообразования. Это позволяет доктору корректировать положение пациента, чтобы радиационный луч точно воздействовал на опухоль и не вредил здоровым тканям;
- гипофракционная стереотаксическая лучевая терапия SBRT — облучение новообразования высокой дозой радиации. Доктора назначают процедуру при некоторых формах аденокарциномы легких и печени;
- интраоперационная лучевая терапия — врачи прибегают к методике, когда не могут удалить все новообразование. После иссечения видимой части опухоли они облучают близлежащие ткани.
Удаление аденокарциномы с помощью системы Кибер-нож
С помощью Кибер-ножа врачи проводят радиохирургическую операцию — удаление опухоли без разрезов на теле. Аппарат точечно воздействует на злокачественные ткани и не повреждает здоровые. Точность воздействия Кибер-ножа составляет 99,6%.
Врачи прибегают к процедуре при аденокарциноме легких, печени, предстательной, поджелудочной и молочной желез.
Контактная радиотерапия (брахитерапия)
Во время брахитерапии врачи с помощью иголок помещают радиоактивные семена в опухоль. Радиация воздействует на новообразование локально и не повреждает здоровые ткани.
Врачи прибегают к брахитерапии при аденокарциноме простаты, шейки матки, прямой кишки.
Радиойодтерапия при аденокарциноме
Онкологи проводят радиойодтерапию после хирургического лечения некоторых видов аденокарциномы щитовидки. Цель процедуры — уничтожить оставшиеся в железе злокачественные клетки и предотвратить рецидив.
Во время процедуры пациент перорально принимает капсулу с радиойодом. Опухолевые клетки железы притягивают вещество и разрушаются под его воздействием. В других тканях радиоактивный йод скапливается в незначительных объемах, поэтому процедура безопасна для организма.
Удаление аденокарциномы фокусированной ультразвуковой абляцией HIFU
При HIFU разрушение новообразования происходит за счет локального воздействия ультразвуком.
Процедура показана при начальных стадиях аденокарциномы почки, печени, простаты, груди, матки, мочевого пузыря.
Химиотерапия при аденокарциноме
Химиотерапия — это уничтожение злокачественных клеток с помощью химических веществ.
Системная химиотерапия
При системной химиотерапии пациент получает противораковый препарат методом капельного вливания. Виды системной химиотерапии:
- неоадъювантная — уменьшает опухоль перед операцией;
- адъювантная — уничтожает оставшиеся злокачественные клетки;
- лечебная — врачи ее применяют как единственную методику для уничтожения маленьких опухолей;
- паллиативная — уменьшает симптомы и улучшает качество жизни на поздних стадиях.
Гипертермическая внутрибрюшинная химиотерапия (HIPEC)
Врачи проводят HIPEC, если аденокарцинома дала множественные метастазы в органы брюшной полости. После удаления видимых частей опухоли доктора вводят в брюшную полость разогретый противораковый препарат. За счет высокой температуры он глубже проникает в ткани органов и уничтожает больше раковых клеток, чем традиционная химия.
Через 90 минут врачи выводят препарат и накладывают шов.
Гормональная терапия при аденокарциноме
К лечению гормональными препаратами врачи прибегают при аденокарциноме молочной и щитовидной желез, мужской и женской половых систем.
Врачи назначают прием гормонопрепаратов до или после хирургического вмешательства. Предоперационная терапия уменьшает новообразование, послеоперационная — предотвращает возвращение болезни.
Таргетная терапия при аденокарциноме
Врачи прибегают к целевой терапии, если лабораторное исследование новообразования обнаружило генетическую мутацию клеток. Таргетные препараты останавливают их рост и деление.
Онкологи назначают такое лечение при неэффективности предшествующих методик. Пациент получает лекарства в виде таблеток, инъекций или методом капельного вливания.
Иммунотерапия при аденокарциноме
Прием иммунопрепаратов показан при неэффективности предыдущего лечения. Она помогает организму выявить злокачественные клетки и самостоятельно уничтожить их.
Получить консультацию по лечению
Последствия и реабилитация после аденокарциномы
Последствия аденокарциномы индивидуальны. Они зависят от ее типа, стадии и метода лечения. В большинстве случаев после лечения наблюдаются:
- анемия;
- потеря веса;
- слабость;
- нарушение пищеварения;
- нарушение работы органа, на котором проводили операцию.
На длительность реабилитации влияет метод лечения и общее состояние. Чтобы ускорить восстановление, избегайте стрессов, переутомления, переохлаждения и длительного пребывания на солнце, полноценно отдыхайте и соблюдайте диету, которую назначил доктор.
Профилактика аденокарциномы
Не существует метода, который на 100% помогает избежать аденокарциномы, но снизить вероятность ее развития можно. Для этого необходимо:
- проходить ежегодные комплексные обследования начиная с 25 лет;
- обследоваться дважды в год, если врачи диагностировали аденокарциному у близких родственников;
- проводить регулярные самостоятельные осмотры тела;
- заниматься спортом;
- употреблять здоровую пищу;
- отказаться от вредных привычек;
- поддерживать здоровый вес;
- проводить профилактику заболеваний, передающихся половым путем.
➤ Врачи-координаторы Bookimed подберут для вас лучшие клиники и докторов, которые специализируются на диагностике и лечении аденокарциномы. Мы учтем особенности медицинского случая, ваши потребности и пожелания. Вы получите индивидуальную программу процедур со стоимостью и сможете заранее спланировать бюджет поездки.
➤ Bookimed — международный сервис по подбору медицинских решений и организации лечения по всему миру. Каждый месяц наши врачи-координаторы помогают 5 000 пациентов. Наша миссия — предоставить каждому необходимое медицинское решение и оказать помощь на всех этапах: от выбора клиники и организации поездки до возвращения домой. Мы остаемся на связи с вами 24/7, чтобы ваш путь к здоровью был простым и комфортным.
➤ Услуги Bookimed для пациентов бесплатны. Подбор решения и организация поездки на ваш счет за лечение не влияют.
Оставьте заявку, чтобы получить консультацию врача-координатора Bookimed по лечению аденокарциномы.
Получить консультацию
Борисова О.В.
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
Ермолаева А.Г.
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Москва, Россия
Мельникова В.Ю.
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Москва, Россия
Петров А.Н.
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава РФ
Славнова Е.Н.
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
Срочная интраоперационная морфологическая диагностика в онкологии
Авторы:
Волченко Н.Н., Борисова О.В., Ермолаева А.Г., Мельникова В.Ю., Петров А.Н., Славнова Е.Н.
Как цитировать:
Волченко Н.Н., Борисова О.В., Ермолаева А.Г., Мельникова В.Ю., Петров А.Н., Славнова Е.Н. Срочная интраоперационная морфологическая диагностика в онкологии. Онкология. Журнал им. П.А. Герцена.
2015;4(4):5‑11.
Volchenko NN, Borisova OV, Ermolaeva AG, Melnikova VYu, Petrov AN, Slavnova EN. Rapid intraoperative morphological diagnosis in oncology. P.A. Herzen Journal of Oncology. 2015;4(4):5‑11. (In Russ.)
https://doi.org/10.17116/onkolog2015445-11

Срочная интраоперационная морфологическая диа-гностика (СИМД) — цитологическая и гистологическая — применяется более 100 лет. В последнее время наблюдается общемировая тенденция к снижению количества срочных морфологических исследований во время операции. Это связано с широким применением минимально инвазивных методов получения материала в дооперационной диагностике с целью морфологической верификации процесса, определения факторов прогноза течения заболевания и показаний к назначению адекватной терапии. Благодаря развитию методов уточняющей морфологической диагностики, таких как иммуногистохимия (ИГХ) и цитохимия, и молекулярно-генетических методов расширяются знания об опухолях. Правильный диагноз возможен только при исследовании всего объема опухоли, включая соответствующие ИГХ и молекулярно-генетические исследования. В связи с применением методов уточняющей диагностики показания для СИМД значительно сокращаются. Однако важность срочного морфологического исследования остается несомненной. СИМД по-прежнему играет важную роль, так как определяет тактику хирурга во время операции, позволяет избежать повторных операций или излишне обширных оперативных вмешательств.
Целью интраоперационной морфологической диагностики является адекватное выполнение хирургического вмешательства. Основными задачами срочного интраоперационного морфологического исследования являются:
1) морфологическая верификация диагноза после нескольких неудачных попыток или невозможности дооперационной диагностики, а также при несоответствии морфологического диагноза операционным находкам;
2) уточнение степени распространенности опухолевого процесса путем изучения зон регионарного метастазирования, близкорасположенных органов, состояния органов высокого риска метастазирования, экссудатов и смывов из серозных оболочек;
3) установление абластичности операционных краев резекции;
4) контроль информативности взятого материала при некоторых диагностических операциях.
СИМД имеет ограниченные возможности для уточнения гистогенеза и степени дифференцировки опухоли, для определения характера опухоли (первичная или метастаз), диагностики опухолей кожи, сарком мягких тканей и костей, злокачественных лимфом, опухолевых узлов полиморфного строения, оценки степени лечебного патоморфоза. Не следует применять СИМД при подозрении на cr in situ или микроинвазию.
Показания для срочного цитологического или гистологического исследования определяет оперирующий хирург. Оба метода имеют свои преимущества и недостатки.
По данным литературы [1—6], точность СИМД в зависимости от объекта исследования составляет от 89% при исследовании лимфатических узлов до 98—99% при других локализациях. Ошибочный диагноз при СИМД возможен как ложноположительный, так и ложноотрицательный. Причинами ложноотрицательного морфологического заключения могут быть регрессия опухоли, вызванная неоадъювантной химиотерапией, некроз, замещение опухолевой ткани новообразованными сосудами, гистиоцитами, лимфоцитами и фиброзом, что может быть неправильно истолковано как хроническое воспаление. Причинами ложноположительных заключений являются резко выраженная пролиферация и реактивные изменения клеточных элементов. Эти ошибки могут быть вызваны неправильным толкованием морфологической картины, низким качеством замороженных срезов, неправильным забором материала для исследования, незнанием макроскопических признаков, сложными случаями для интерпретации, наличием только карциномы in situ в образце, гетерогенностью опухоли.
Следовательно, необходимо понимание различных проблем, с которыми может столкнуться как патологоанатом при исследовании замороженных срезов, так и цитолог при СИМД.
Для качественной интраоперационной морфологической верификации диагноза необходимо получение информативного операционного материала, правильное оформление сопроводительных документов с указанием анамнестических данных, стадии процесса, характера предоперационного лечения, сроков его проведения, макро- и микроскопического исследования операционного материала.
Цель исследования — оценить точность СИМД и проанализировать причины диагностических ошибок.
Материал и методы
В 2013 г. ФГБУ «ФМИЦ им. П.А. Герцена» выполнено 418 срочных гистологических исследований у 361 больного (7% общего количества операций) и 1198 срочных цитологических исследований у 646 (12,5%) больных. В 2014 г. выполнено 507 срочных гистологических исследований у 356 (8%) пациентов и 1356 срочных цитологических исследований у 676 (15,5%) пациентов. Для срочного гистологического исследования применяются криостатные срезы, препараты окрашиваются гематоксилином и эозином. Недостатком криостатных срезов является более низкое качество гистологических препаратов, чем при плановом гистологическом исследовании после приготовления парафиновых блоков. Срочное гистологическое исследование проводится в течение 20—30 мин. Для срочной окраски цитологических препаратов применяют набор для окраски Лейкодиф (Чехия). Срочное цитологическое исследование занимает 10—15 мин. Для исследования экссудатов из серозных полостей и диагностики метастатического поражения лимфатических узлов применяется иммунофлюоресцентное исследование (ИФИ) с антителом к эпителиальному антигену Ber-EP4 FITC («Dako»). ИФИ осуществляется на флюоресцентном микроскопе Carl Zeiss Imager M1.
Результаты
Морфологическая верификация диагноза
Интраоперационная морфологическая верификация диагноза применяется в основном при периферических образованиях легких, недоступных для дооперационного морфологического исследования, при опухолях яичников, а также при неуверенном дооперационном морфологическом диагнозе при опухолях молочной железы. Мы придерживаемся правила — не использовать срочное исследование при cr in situ, так как можно не получить категоричного заключения ни при срочном, ни при плановом исследовании.
Гистологическая СИМД для верификации процесса в легком позволила установить туберкулез в 32,8%, гамартому в 8,2%, хроническое продуктивное воспаление в 6,6% наблюдений, что дало возможность избежать излишне радикальных операций. Нейроэндокринные опухоли (типичный и атипичный карциноид) выявлены в 8,2% наблюдений (рис. 1, 2 и далее). Злокачественный процесс установлен в 44,3% наблюдений, при этом 85% составила аденокарцинома легкого, преимущественно высокодифференцированная (прежний БАР) (рис. 3), а 14,8% — метастазы аденокарциномы кишечного типа, желудка и меланомы в ткани легкого. Расхождений срочного и планового гистологического исследований не отмечалось.
При срочном цитологическом исследовании образований в легком гиподиагностика составила 6,7% (4 наблюдения из 60), что связано с получением материала из очага некроза, воспаления, а также наличием микроочагов опухоли на фоне пневмонии. В 6,6% наблюдений цитологически было дано неуверенное заключение.
Опухоли яичников всегда подвергаются СИМД с целью верификации диагноза, что обусловлено отсутствием дооперационной морфологической диагностики — опухоли практически не пунктируют из-за опасности диссеминации. Изучение криостатных срезов является важным диагностическим инструментом определения характера поражений яичников. В 30% наблюдений проведено двустороннее исследование яичников. При СИМД сравнительно просто диагностируют неопухолевые поражения яичников, такие как фолликулярная, лютеиновая, эндометриоидная кисты, эндометриоз и т. д. (54,4%). Доброкачественные опухоли яичников диагностированы в 15,8% случаев, пограничные опухоли яичников (ПОЯ) — в 8,5%, злокачественные — в 21,5%. В одном наблюдении при СИМД диагностирована аденокарцинома яичника, а при плановом гистологическом исследовании установлена тератома. Ошибка связана с выраженной пролиферацией и образованием сосочковых структур эпителиального компонента тератомы. СИМД опухолей яичников имеет ряд ограничений, особенно при ПОЯ, которые характеризуются некоторыми гистологическими особенностями — нарушением стратификации эпителиального пласта, увеличением митотической активности, в некоторых случаях ядерной атипией, но отсутствует стромальная инвазия. СИМД опухолей яичников определяет объем оперативного вмешательства. При доброкачественных и ПОЯ можно выполнить органосохраняющее лечение у молодых женщин, в то время как злокачественные эпителиальные опухоли, как правило, требуют обширного хирургического вмешательства с гистерэктомией, двусторонним удалением придатков матки и сальника, а также тазовой и ретроперитонеальной лимфаденэктомией. При исследовании опухолей яичников необходимо тщательное макроскопическое исследование материала в совокупности с клиническими данными и методами инструментального исследования. Желательно исследовать несколько криостатных срезов из разных участков. По нашим данным, ошибка при исследовании ПОЯ яичников имела характер гиподиагностики и составила 7%, что связано в основном с наличием лишь микроочагов опухоли (рис. 4). Большой размер опухоли, двустороннее поражение, а также муцинозный характер являются неблагоприятными факторами в определении злокачественного потенциала при СИМД. В 20% наблюдений при исследовании брюшины при СИМД выявлены импланты ПОЯ. Если имеются инфаркт и некротические изменения, а также киста, лишенная эпителиальной выстилки, окончательные выводы следует делать при плановом гистологическом исследовании на парафиновых блоках. В 14,3% случаев при СИМД выявлены метастазы в яичниках эндометриоидной аденокарциномы, аденокарциномы шейки матки, желудка, молочной железы и почки, подтвержденные плановым гистологическим исследованием.
Таким образом, чувствительность СИМД при опухолях яичников составляет 98,7%, специфичность — 99%.
Срочное цитологическое исследование яичников применяется при пункции кист или при невозможности гистологического исследования. В одном наблюдении при исследовании кисты цитологически имелась гиподиагностика ПОЯ, что связано с объективными трудностями — клеточная атипия отсутствовала. Однако при пересмотре цитологических препаратов имелись плотные опухолевые комплексы из мелких клеток, что характерно для ПОЯ.
СИМД при образованиях молочной железы в настоящее время применяют крайне редко, так как морфологический диагноз является результатом исследования дооперационных трепанобиопсий. При расхождении цитологического и гистологического диагнозов и при неуверенном дооперационном диагнозе проводится срочное морфологическое исследование. Доброкачественные поражения составили 57%, при плановом гистологическом исследовании подтверждены такие процессы, как аденоз, фиброаденома с дисплазией эпителия. Рак молочной железы установлен в 40% (18 наблюдений), из них 33% составил дольковый рак, в 2 наблюдениях выявлена cr in situ, в одном наблюдении имелся тубулярный рак на фоне склерозирующего аденоза (рис. 5). В другом наблюдении при СИМД диагностирована липогранулема, а при плановом гистологическом исследовании выявлен небольшой очаг инвазивного рака без признаков специфичности. Чувствительность интраоперационного гистологического диагноза при раке молочной железы составляет 97%, специфичность — 100%. Неуверенное заключение дается в 1—2% наблюдений. Противопоказаниями к срочному исследованию являются внутрипротоковый и внутридольковый рак (cr in situ), внутрипротоковая папиллома. Высокодифференцированная папиллярная и тубулярная карцинома, отсутствие клеточной атипии при инвазивном дольковом раке часто при СИМД неправильно диагностируются как доброкачественные поражения как при цитологическом, так и гистологическом исследовании. Инвазивный микрососочковый рак и лимфому молочной железы трудно диагностировать при СИМД.
Случаи гипердиагностики в нашем материале не выявлены, но такие ошибки возможны при пролиферирующем папилломатозе и аденоме соска с гиперплазией эпителия протоков соска с формированием железистых и папиллярных структур, особенно с центральным некрозом, что можно ошибочно принять за внутрипротоковый рак; при склерозирующем аденозе с радиальным рубцом, когда создается впечатление инвазивного роста рака; при гранулематозном мастите, эктазии протоков и некрозе жировых клеток. Для избежания морфологической ошибки необходимо тщательное исследование препарата: отсутствие атипии эпителия, наличие миоэпителиального слоя, плотная коллагеновая строма помогают в постановке правильного морфологического диагноза.
Интраоперационно цитологически опухоли молочной железы исследуют крайне редко: при наличии кист и отсутствии дооперационного морфологического диагноза. В нашем исследовании имелось одно наблюдение, когда цитологически диагностирована папиллярная киста молочной железы, а при плановом гистологическом исследовании диагностирован папиллярный рак.
Цитологическая гиподиагностика при исследовании первичной опухоли составила 3,8%, что связано с утратой морфологических особенностей опухолевых клеток, особенно при недифференцированных и мелкоклеточных новообразованиях (например, мелкоклеточный лимфоцитоподобный рак), а также выраженными дистрофическими изменениями опухолевых клеток. Цитологическая гипердиагностика не превысила 1% и связана с выраженными реактивными изменениями эпителия.
Уточнение степени распространенности опухолевого процесса
С развитием интраоперационного ультразвукового исследования, микрохирургических пособий во время операции, позволяющих обнаружить очаги опухоли, невыявленные на дооперационном обследовании, и интраоперационных находок при непосредственной ревизии операционной раны СИМД имеет неоценимые преимущества. Проведение СИМД в 10% случаев изменяет объем оперативного вмешательства [7]. Невозможность выполнения оперативного вмешательства должна быть подтверждена морфологически.
СИМД позволяет объективно оценить состояние лимфатического коллектора. В 30—40% макроскопически неизмененных лимфатических узлов обнаруживают метастазы, а в 25—30% макроскопически похожих на метастатические узлы при микроскопическом исследовании метастазы не выявляют. Срочное интраоперационное гистологическое исследование лимфатических узлов может быть неудачным в 25% наблюдений [7]. Большое количество ложноотрицательных заключений как цитологических, так и гистологических является серьезной проблемой для клинического применения СИМД в основном из-за ограниченной способности обнаруживать микрометастазы, особенно подкапсульные, которые просто не попадают в срез или соскоб с поверхности разрезанного лимфатического узла. Кроме того, возможна потеря отдельных опухолевых клеток при приготовлении гистологического препарата. Чувствительность и специфичность срочного цитологического исследования лимфатических узлов аналогичны исследованию криостатных срезов, поэтому цитологический метод является альтернативой срочному гистологическому исследованию лимфатических узлов.
В нашем центре проведена работа по исследованию лимфатических узлов при радикальной трахелэктомии у пациенток с начальным раком шейки матки [8]. Удаленные лимфатические узлы подвергали срочному цитологическому исследованию. При обнаружении увеличенных и подозрительных по метастатическому поражению тазовых и парааортальных лимфатических узлов срочное цитологическое исследование дополняли или заменяли срочным гистологическим исследованием. По результатам срочного цитологического и гистологического исследования у 5 (6%) пациенток из 81 выявлены метастазы в лимфатических узлах, в связи с чем произведена конверсия трахелэктомии в расширенную экстирпацию матки с удалением или транспозицией придатков. Метастатическое поражение лимфатических узлов во всех случаях было подтверждено при плановом гистологическом исследовании. В 3 случаях установлены микрометастазы (<2 мм), в 2 — макрометастазы. Число положительных лимфатических узлов варьировало от 1 до 5. Во всех наблюдениях отмечались метастазы плоскоклеточного рака [8].
В настоящее время широко применяется СИМД сторожевого (сигнального) лимфатического узла (СЛУ). Метастатическое поражение СЛУ является одним из основных прогностических и предиктивных факторов при раннем раке желудка, шейки матки, молочной железы и меланоме. СЛУ является первым лимфатическим узлом на пути оттока лимфы от первичной опухоли. Отрицательный СЛУ может исключать возможность метастазов в других лимфатических узлах, что не всегда подтверждается на практике. Например, у женщин с ранним раком шейки матки и молочной железы, которые хотят сохранить репродуктивный потенциал, можно избежать радикального хирургического вмешательства, если в сторожевом узле отсутствует метастаз. Исследование СЛУ проведено гистологически у 4 пациенток при раке шейки матки, метастазов не выявлено; цитологически исследовано 3 СЛУ при раке желудка (у 2) и молочной железы (у 1), метастазов не выявлено.
Причинами гиподиагностики является исследование не всех удаленных лимфатических узлов. Оптимально исследуют не более 5 лимфатических узлов из-за ограничения временны́х рамок. Пролиферация гистиоцитарных элементов при синус-гистиоцитозе с наличием крупных полиморфных гистиоцитов может служить причиной гипердиагностики. Для уточнения диагноза используется ИФИ лимфатических узлов, повышающее достоверность цитологической диагностики до 94%.
Часто для уточнения степени распространенности опухолевого процесса исследуются близкорасположенные органы, брюшина.
Важное значение в оценке степени распространенности опухолевого процесса имеет исследование экссудатов из серозных полостей. Остается сложной и нерешенной задачей цитологического исследования диссеминатов с брюшины при перстневидно-клеточном раке желудка из мелких клеток, ПОЯ, так как эти опухоли при микроскопическом исследовании крайне сложно дифференцировать с реактивным мезотелием. Срочное гистологическое исследование в большинстве наблюдений позволяет установить диссеминацию опухоли. Применение ИФИ повышает выявляемость клеток аденогенного рака до 98% (рис. 6, 7). Из исследованных 150 экссудатов при СИМД ИФИ проведено в 17 (11%) наблюдениях, из них наиболее часто при перстневидно-клеточном раке желудка (12 наблюдений) и ПОЯ (4 наблюдения), что позволило установить диссеминацию опухоли в брюшной полости.
Достоверность СИМД метастазов в печени составляет 98%, гиподиагностика отмечена в одном наблюдении из-за резко выраженной деформации материала. Наиболее часто метастазы в печени выявляют при аденокарциноме желудка и толстой кишки.
Установление абластичности операционного края резекции
Для морфологического контроля абластичности хирургического края интраоперационное исследование имеет важное значение, так как связано с расширением показаний для экономных резекций, особенно при раке молочной железы при трахелэктомии и микрохирургических операциях на органах головы и шеи, а также при раке желудка, толстой кишки, легкого и др.
В настоящее время имеется четкая тенденция к уменьшению расстояния между опухолью и краем резекции. В последние годы появились исследования, показывающие, что сокращения края резекции не приводит к увеличению частоты местных рецидивов и ухудшению выживаемости. По мнению многих исследователей, применение лучевой терапии расширяет возможности оперативного вмешательства.
При раке молочной железы патоморфолог, как правило, дает заключение о негативном крае при расположении опухоли от 1 до 5 мм от края резекции; о позитивном крае, если опухолевые клетки присутствуют в исследуемом материале, и о сомнительном или закрытом крае, когда опухолевые клетки располагаются на расстоянии менее 1 мм от края резекции. При раке молочной железы для срочного гистологического исследования доставляется удаленная опухоль и исследуется один или два края ближайших к опухолевому узлу. Из 87 исследованных краев резекции опухоль обнаружена в 12 (13,8%). В 3 (4%) наблюдениях положительный край резекции установлен только при плановом гистологическом исследовании, что потребовало повторной операции. Факторами, определяющими гистологическую гиподиагностику при СИМД, являются обширный внутрипротоковый компонент и инвазивная дольковая карцинома.
При раке молочной железы проводят срочное цитологическое исследование нижнего и верхнего краев резекции, подсосковой зоны, иногда исследуют медиальный и латеральный края. У 2,5% больных в крае резекции обнаружены опухолевые клетки. Ложноотрицательные цитологические заключения составили 1,2%.
Для исследования краев резекции при раке молочной железы часто доставляется жир, а паренхима молочной железы отсутствует, поэтому адекватно оценить абластичность не представляется возможным.
Оценка края резекции при раке желудка рекомендуется для пациентов при T3 или T4 стадии заболевания, интраоперационно исследуют, как правило, проксимальный край резекции. Срочное гистологическое исследование позволило выявить опухолевый рост в крае резекции при раке желудка в 8% наблюдений. Положительный край был обусловлен инвазией опухоли подслизистого слоя, неопределяемой при макроскопическом исследовании (рис. 8).
При резекции легкого гистологическое исследование краев резекции применяется редко, за 2 года всего 11 наблюдений. Опухолевые клетки обнаружены только в одном наблюдении при неходжкинской лимфоме. Цитологически край резекции бронха исследовали в 17 наблюдениях, опухолевые клетки не обнаружены.
При раке пищевода опухолевые клетки по краю резекции обнаружены в 11,5%, в одном наблюдении опухоль по краю резекции выявлена только при плановом гистологическом исследовании.
Для оценки адекватности удаления шейки матки при трахелэктомии, выполняли поперечный срез толщиной 1—2 мм с ее резидуальной части для срочного гистологического исследования. С помощью CytoBrush из сохраняемого отрезка цервикального канала получали материал с последующим проведением интраоперационного цитологического анализа. Положительная граница резекции интраоперационно установлена у 5 (6%) из 81 больной. В одном случае, по данным срочного гистологического исследования, выявили рак in situ по краю резекции, в связи с чем произвели дополнительное дисковидное иссечение шейки матки, что позволило обеспечить отрицательную границу резекции и выполнить органосохраняющую операцию. В остальных 4 случаях произведена конверсия трахелэктомии в расширенную экстирпацию матки с транспозицией яичников. Положительная граница резекции в 2 случаях из 5 обнаружена при аденокарциноме, в 2 случаях при аденоплоскоклеточном раке и лишь в одном случае при плоскоклеточном гистотипе [8].
Исследование краев резекции при раке поджелудочной железы проведено в 6 наблюдениях, из них в 3 гистологически выявлена аденокарцинома.
В нашем центре широко применяется цитологическое исследование краев резекции при операциях на органах головы и шеи — опухолевые клетки выявлены в 6,8% наблюдений.
С целью определения абластичности краев резекции при онкоортопедических операциях исследование костного мозга на криостатных срезах практически не применяется, поэтому используется срочное цитологическое исследование. Достоверность исследования составляет 98,8%.
В целом 12% результатов интраоперационного морфологического исследования образцов тканей краев резекции показывают необходимость расширения оперативного вмешательства, чтобы сделать его адекватным.
Контроль информативности взятого материала при некоторых диагностических операциях
При опухолях мягких тканей и костей, средостения диагноз возможен только при комплексном клинико-морфологическом исследовании с обязательным применением методов иммуногистохимии, а также во многих случаях молекулярно-генетических методов исследования. Интраоперационная морфологическая, в основном цитологическая диагностика применяется с целью контроля информативности взятого материала для планового гистологического исследования и по информативности не уступает исследованию замороженных срезов. По данным некоторых авторов, диагноз был бы невозможен без цитологического исследования. Это, как правило, лимфома, плазмоцитома, саркома Юинга, метастатическая карцинома, метастатическая меланома, рак из клеток Меркеля, липосаркома. Для малоклеточных, фиброзных, миксоидных и опухолей из жировой ткани роль цитологического исследования отпечатков ограничена.
Заключение
СИМД остается незаменимой в онкологии, так как способна уточнить информацию о характере патологического процесса, степени его распространения, состояния окружающих тканей и краев резекции, что необходимо при выборе адекватного хирургического вмешательства. Однако, при неясном диагнозе и при небольшом количестве полученного материала не следует любой ценой добиваться интраоперационного морфологического исследования, особенно если речь идет о редких опухолях и неинвазивном раке.
Чувствительность гистологического метода при СИМД составляет 98%, специфичность — 99%, чувствительность цитологического метода при СИМД составляет 95%, специфичность — 96%. Гистологическая гипердиагностика при срочном исследовании составляет 0,5%, гиподиагностика 1%, цитологическая гипердиагностика — 3%, гиподиагностика — 9%. Заключения в предположительной форме при срочном гистологическом исследовании составляют 2%, при цитологическом — 11%. В 12% результатов интраоперационного морфологического исследования образцов тканей краев резекции показывают необходимость расширения оперативного вмешательства. Неинформативный материал при срочном исследовании достигает 2—5%, в основном при срочном цитологическом исследовании.
Золотым стандартом морфологического исследования является комплексное цитологическое и гистологическое исследования, которые являются взаимодополняющими. Необходимо подчеркнуть значение междисциплинарного подхода к диагностике, в том числе и интраоперационной, включая клинические данные и результаты инструментальных методов исследования с целью достижения точного диагноза.
Участие авторов:
Концепция и дизайн исследования: Н.Н.В.
Сбор и обработка материала: В.Ю.М., А.Г.Е., О.В.Б., Е.Н.С.
Статистическая обработка: О.В.Б., А.Н.П.
Написание текста: В.Н.Н., О.В.Б.
Редактирование: В.Н.Н.
Конфликт интересов отсутствует.
Мы используем файлы cооkies для улучшения работы сайта. Оставаясь на нашем сайте, вы соглашаетесь с условиями
использования файлов cооkies. Чтобы ознакомиться с нашими Положениями о конфиденциальности и об использовании
файлов cookie, нажмите здесь.
Эффективность лечения рака зависит не только от развития методов терапии — без постановки точного морфологического диагноза врач-онколог не может выбрать подходящий для конкретной опухоли вид лечения. Важным компонентом современной онкологической помощи, который, к сожалению, часто остается в тени достижений технологий разрушения опухолей, является правильная постановка диагноза. А точнее — определение типа опухолевых клеток и, соответственно, их устойчивости к различным видам внешнего воздействия. Решает эту задачу морфологическая диагностика, базовый принцип которой — исследование образцов опухолевых клеток.
С каким образцами опухолевых клеток работает патоморфология?
Базой для морфологической диагностики являются образцы тканей (фрагменты опухолей). Наиболее частым способом забора материала является трепан-биопсия, которая осуществляется при помощи специальной толстой иглы, также используется инцизионная биопсия, которая выполняется при помощи скальпеля и эксцизионная биопсия с тотальным забором пораженного участка (например, биопсия лимфоузла при диагностике лимфом).
После образцы тканей проходят этапы специальной подготовки (фиксации и проводки), после чего пропитываются парафином с формированием блока. Из блоков на специальных устройствах (микротомах) приготавливаются тонкие срезы толщиной 4-5 микрон. Полученные срезы помещаются на стекла, подвергающиеся различным методам окраски с целью выделения различий в клеточных структурах. Эти, так называемые, “стекла”, подлежат тщательному рассмотрению врачом-патоморфологом.
Каждый из этапов подготовки образцов критичен для возможности и точности последующих молекулярных методов исследования, поэтому нарушение технологии подготовки может привезти к неправильному назначению лечения.
Зачем изучать опухоли под микроскопом?
Количество известных разновидностей опухолей — велико. Наиболее полной считается классификация Всемирной организации здравоохранения (ВОЗ), которая в печатном виде представляет собой 11 томов, около 400 страниц в каждом. Итог — ошибки в постановке диагноза неизбежны.
Патоморфологическая классификация опухолей Всемирной организации здравоохранения (ВОЗ) едва уместилась в 11 томов
Показатель ошибок при постановке диагноза поражает: от 5 до 50% всех онкологических диагнозов в мире — неверны. Половина этих ошибок не становятся фатальными — различные виды рака могут одинаково реагировать на определенный подход к лечению. Но значительная часть неточностей приводит к неадекватному лечению рака у пациентов, которое может способствовать прогрессированию заболевания.
Среди объективных причин ошибочных диагнозов, связанных с морфологической диагностикой, лидирует невозможность получения образца опухолевой ткани для ее морфологического исследования ввиду трудности доступа либо тяжелого состояния пациента.
Среди субъективных причин ошибок морфологической диагностики наиболее распространены:
- ошибка при заборе материала (например, при раке простаты следует проводить множественный забор образцов, т.к. опухоль в этом органе может иметь крайне сложную пространственную форму);
- отсутствие возможности конкретного лечебного учреждения провести морфологическую диагностику в необходимом объеме (собственная морфологическая лаборатория — это сложный и дорогой институт);
- нарушения протоколов как в части отказа от забора и морфологического исследования образцов, так и в части стандартов проведения морфологической диагностики опухоли (в том числе и устаревшие методики, отсутствие необходимого оборудования, низкая квалификация специалистов, на повышение которой не выделяется средств).
И только морфологическая диагностика, проведенная с соблюдением всех стандартов взятия материала, подготовки и рассмотрения образцов, способна дать окончательный ответ о типе опухоли и ее особенностях.
Гистология и иммуногистохимия — в чем отличие?
Первоначально, морфологическая диагностика решала задачу определения наличия злокачественного процесса в ткани. Для этого применялся метод, который в современной медицине называется “гистологическое морфологическое исследование”, или, как часто можно услышать от пациентов “гистология”.
С помощью гистологического морфологического исследования может быть проведена дифференциальная диагностика доброкачественных процессов и злокачественной опухоли — т.е. определение наличия измененных (атипичных) клеток в образце тканей. Простое гистологическое исследование в любом случае носит субъективный характер и зависит от профессионализма проводящего его врача. Поэтому, при подозрении на наличие опухоли, второе мнение от ведущих экспертов МИБС в этой области значительно снижает риск ошибочного диагноза.
При подтверждении опухолевого процесса в тканях, пациенту требуется более точная диагностика, которая точно определит тип опухоли и укажет на наиболее эффективный подход к ее лечению — иммуногистохимия.
Зачем нужно иммуногистохимическое исследование?
Основой иммуногистохимии является окрашивание клеток специфическими веществами, которые реагируют на определенные типы опухолевых клеток и “мишени”, специфические свойства и мутации генов конкретного типа рака.
Пример иммуногистохимии в МИБС: Позитивная реакция на СК14 (коричневое окрашивание) вокруг всех подозрительных структур исключает рак молочной железы – дополнительное лечение пациентке не требуется
Таким образом, иммуногистохимия позволяет точно указать нозологию (разновидность) опухоли, что чрезвычайно важно для проведения адекватного лечения, а также – для прогнозирования развития заболевания. Например, некоторые разновидности рака молочной железы (тубулярный, фиброматоз-подобный) не требуют иного лечения, кроме хирургического.
Иммуногистохимия в МИБС: Позитивная реакция на bcl10 в лимфоидных клетках конъюнктивы глаза (коричневое окрашивание вокруг фолликула) подтверждает диагноз MALT-лимфомы, при которой наибольшего эффекта покажет химиотерапия, а не хирургическое лечение
Лечим метастазы. Когда не обойтись без патоморфолога?
Метастазы представляют собой “копию” злокачественных клеток первичной опухоли, точнее, того типа тканей, из которых развилось новообразование. Поэтому тип клеток метастаза может указать на локализацию первичного рака. Это крайне важно, если первичная опухоль не проявляет себя симптомами и не диагностирована. С другой стороны, если первичная опухоль, имеет уязвимость к препаратам таргетной терапии, то ее метастазы могут утратить это свойство. В таком случае иммуногистохимия образца метастазов покажет, что для первичной опухоли лечение будет прежним, а вот для метастазов следует избрать другой подход.
Молекулярные исследования + Таргетная терапия + Иммунотерапия = Эффективное лечение рака
Благодаря развитию методов молекулярной диагностики (иммуногистохимия, ПЦР, секвенирование), лекарственная терапия рака идет большими шагами вперед. Помимо химиотерапии, сейчас активно используются таргетные препараты, целенаправленно воздействующие на мишени в опухолевых клетках (HER2, CD20, c-kit, мутантный b-Raf и др.).
Кроме того, в настоящее время онкология переживает «бум» иммунотерапии, при применении которой лекарственные препараты разрывают порочный механизм, препятствующий уничтожению опухолей собственными иммунными клетками.
Однако для правильного назначения таких препаратов необходимым условием является определение специфических маркеров при помощи иммуногистохимического или молекулярно-генетического исследования опухолевой ткани. Более того, часто маркеры, указывающие на чувствительность к иммунотерапии (MMR, MSI), также говорят о том, что пациенту не следует назначать химиотерапию, в особенности это касается рака толстой кишки и желудка.
Иммуногистохимия показала, что негативная реакция на MSH2 (синее окрашивание ядер опухоли, коричневое окрашивание неопухолевой ткани) свидетельствует о том, что рак тела матки, представленный на данном слайде, чувствителен к иммунотерапии
Какой рак можно вылечить без операции?
Некоторые разновидности опухоли не только не требуют хирургического лечения, но оно им противопоказано, так как может привести к прогрессированию заболевания. Это прежде всего лимфома, опухоль, возникающая из лимфоцитов, которые располагаются как в лимфоузлах, так и в паренхиматозных органах.
Развитие иммуногистохимии и основанных на ее результатах таргетной терапии и иммунотерапии постоянно расширяют спектр видов рака, которые можно вылечить “точечным” воздействием исключительно на опухолевые клетки. Помимо лечения лимфомы, по состоянию на начало 2019 года наибольшее применение методы иммунотерапии и таргетного лечения получили при лечении таких заболеваний, как:
- рак молочной железы;
- рак простаты;
- рак кишечника;
- рак легкого;
- лимфомы;
- рак желудка;
- меланома
при которых современные протоколы лечения требуют выполнение иммуногистохимии. Большинство ошибок в диагностике и лечении данных заболеваний связано либо с не проведением иммуногистохимии, либо с ее неправильной интерпретацией. Цена ошибки, к сожалению, может быть фатальной, так как назначение неправильного лечения может привести к резистентности (устойчивости) опухолевых клеток к лекарственным препаратам, которые при правильном назначении часто приводят к выздоровлению пациента.
Как повысить качество морфологической диагностики в клиниках России?
Выбирайте МИБС как для первого проведения базовой морфологической диагностики либо иммуногистохимического исследования, так и для получения второго мнения от ведущих специалистов нашей медицинской компании относительно имеющихся образцов ткани опухоли (часто называемого пациентами “пересмотр стёкол”), полученных при обследовании в другом онкоцентре.
Почему следует выбрать патоморфологическую лабораторию МИБС?
- исследование и оценка рассматриваемого материала проводится одновременно несколькими ведущими специалистами в центральной патоморфологической лаборатории МИБС в Санкт-Петербурге, сотрудничающей с федеральными онкологическими центрами.
- все вопросы логистики центр МИБС в вашем регионе берет на себя.
- МИБС владеет всеми технологиями, необходимыми для постановки правильного патоморфологического диагноза. От вас не потребуется проводить дополнительные исследования в других лабораториях.
- Иммуногистохимическое исследование может быть проведено в полном объеме за счет средств ОМС (бесплатно для пациента) при наличии направления по форме 14у.
Как заказать морфологическое / иммуногистохимическое исследование в МИБС?
- позвоните в любой центр МИБС в вашем регионе;
- привезите материал (гистологические препараты, парафиновые блоки, копию выписки из истории болезни и прочие документы, описывающие характер заболевания) в центр МИБС вашего города;
- получите заключение через 3-10 дней (в зависимости от вида и объема исследования).
заместитель главного врача по лабораторной медицине МИБС
врач-патологоанатом
доктор медицинских наук
Аденокарцинома – это опасная для жизни опухоль, которая развивается в клетках, выделяющих слизь, пищеварительные соки и другие жидкости. Она представляет из себя разновидность карциномы – самого распространенного типа рака. Ее клетки способны прорастать в окружающие ткани, разрушать их, распространяться по телу и создавать различных его частях метастазы – дополнительные онкологические новообразования.
Что такое аденокарцинома и как она развивается?
В организме человека есть более 30 триллионов клеток, каждая из которых действует согласно строго определенной встроенной «программе»: рождается, работает и умирает. Иногда из-за влияния некоторых заболеваний, химических веществ, радиации, наследственных особенностей или случайных сбоев в процессе их деления возникают ошибки. В результате чего в теле появляются мутировавшие, или измененные клетки, обладающие особыми свойствами:
- Бесконтрольно размножаются.
- Не погибают по окончанию нормального жизненного цикла.
- Со временем из их множества формируется опухоль, которая не раздвигает окружающие ткани, а прорастает в них и разрушает.
- Они отрываются от основного, так называемого первичного очага, попадают в сосуды кровеносной и лимфатическойЛимфатическая система дублирует кровеносную. В ней циркулирует лимфа – межклеточная жидкость, которая омывает все клетки тела, доставляет в них необходимые вещества и забирает отходы. На всем протяжении ее сосудов расположены лимфоузлы – похожие на горошину маленькие органы, которые обезвреживают и выводят из организма опасные вещества. систем.
- С кровью и лимфой – жидкостью, омывающей все клетки организма, перемещаются в различные части тела.
- Закрепляются в других структурах и органах, таких как мозг, печень, легкие или кости, и создают в них метастазы – дополнительные раковые новообразования.
Со временем все большее количество жизненно важных тканей повреждается, а их работа нарушается.
Какие бывают метастазы и как они перемещаются по организму?
Измененными могут стать и клетки желез, выделяющие различные жидкости. Чаще всего аденокарциномы возникают в:
- Желудке, в котором происходит накопление и расщепление пищи.
- Легких, и составляют около 40% всех видов опасных опухолей дыхательных путей. Они развиваются в клетках, которые производят слизь, необходимую для выведения из тела пыли и микробов, содержащихся в воздухе. Обычно медленно растут и чаще встречаются у курильщиков, в том числе бывших.
- Молочной железе, и составляют большинство видов рака данного органа. Формируются в клетках, производящих грудное молоко.
- Пищеводе – трубке, по которой пища проходит из рта в желудок. Как правило, измененными становятся клетки, которые выстилают ее нижнюю часть и создают смазывающую слизь.
- Поджелудочной железе, расположенной за желудком. Около 85% всех случаев ее онкологических заболеваний – это аденокарциномы, возникающие в протоках, переносящих необходимые для пищеварения вещества.
- Предстательной железе у мужчин, находящейся чуть ниже мочевого пузыря. Развивается в клетках, производящих защищающую сперматозоиды жидкость.
- Прямой кишке, выводящей остатки переваренной пищи из организма.
- Толстой кишке, в которой происходит всасывание воды и питательных веществ. Аденокарцинома – это самый распространенный тип рака данного органа. Обычно они начинаются с небольшого полипа – нароста ткани на внутренней стенки.
Причины развития аденокарциномы
Сегодня научное сообщество не знает, почему именно возникают все случаи онкологии. Врачам известны только так называемые факторы риска, которые увеличивают вероятность появления в организме измененных клеток. Наличие одного или даже нескольких из них не гарантируют того, что заболевание обязательно разовьется. У каждого типа аденокарциномы есть свой список возможных причин.
Легкое:
- Курение, в том числе пассивное, то есть вдыхание табачного дыма.
- Загрязнение воздуха и химические вещества, такие как радиоактивный газ радон, диоксид кремния, прочие тяжелые металлы и использующийся в строительстве и другой промышленности асбест.
- Семейный анамнез – наличие кровных родственников, у которых уже есть подобный диагноз.
- Облучение: радиация, полученная в ходе диагностики и лечения различных видов онкологических заболеваний при воздействии на область грудной клетки.
Предстательная железа:
- Риск развития рака увеличивается после 50 лет, при этом большинство случаев выявляется у мужчин старше 65 лет.
- Мутации, или изменения генов BRCA1 и BRCA2, которые отвечают за устранение ошибок в клетках и предотвращение развитие опухолей.
- Синдром Линча, повышающий вероятность возникновения опасных новообразований у людей в возрасте до 50 лет.
- Курение.
- Ожирение и лишний вес.
- Семейный анамнез — наличие кровных родственников с подобным диагнозом.
- Неправильное питание: лишние калории, избыток животных жиров и сахара в рационе, а также нехватка фруктов и овощей.
- Недостаточная физическая активность.
- Воспалительные заболевания простаты.
Поджелудочная железа:
- Вероятность развития аденокарциномы повышается с возрастом. Большая часть случаев выявляется у пациентов старше 65 лет, причем у мужчин чаще, чем у женщин.
- Наследственные генетические синдромы, увеличивающие риск возникновения опухолей.
- Мутации, или изменения, вызывающие панкреатит – воспаление поджелудочной железы.
- Некоторые факторы образа жизни: курение, лишний вес, нехватка физической нагрузки, злоупотребление алкоголем и диета с высоким содержанием жира и красного мяса.
Пищевод:
- Пол и возраст: большинство случаев новообразований выявляется у мужчин старше 55 лет.
- Травмы и повреждения пищевода, в том числе от кислоты, забрасываемой из желудка, алкоголя и горячих жидкостей.
- Другие виды рака: легких, ротовой полости или горла.
- Наследственность – наличие кровных родственников, у которых уже есть подобный диагноз.
- Тилоз – чрезмерное разрастание верхнего слоя кожи на ладонях и подошвах стоп, а также образование папиллом, которые представляют из себя небольшие наросты ткани в пищеводе.
- Питание: нехватка в рационе фруктов и овощей.
- Воздействие химикатов и раздражителей, таких как сажа, табачный дым, выхлопные газы, металлическая пыль и других.
Кишечник:
- Чаще всего колоректальные аденокарциномы встречаются у мужчин старше 50 лет.
- Воспалительные заболевания, приводящие к постоянному повреждению стенок органа.
- Ожирение.
- Сидячий образ жизни и отсутствие физической нагрузки.
- Употребление алкоголя и табака.
- Полипы – разрастания тканей на стенке кишечника.
- Диета с низким содержанием клетчатки и высоким – жира и полуфабрикатов из мяса.
Молочная железа:
- Семейный анамнез – наличие родственников с подобным диагнозом.
- Возраст от 55 лет.
- Мутации, или изменения генов BRCA1 и BRCA2, которые отвечают за устранение ошибок в клетках и предотвращение развитие опухолей.
- Ранние менструации – до 12 лет, и менопауза после 55 лет.
- Лучевая терапия – облучение области грудной клетки.
- Плотная ткань молочной железы.
- Употребление алкоголя.
- Ожирение.
- Наличие рака груди или яичников, в том числе находящихся в ремиссииРемиссия – это полное отсутствие признаков заболевания.
- Нехватка физической активности.
- Отсутствие беременностей, грудного вскармливания и роды после 30 лет.
Желудок:
- Большинство пациентов – мужчины в возрасте от 60 лет.
- Избыточный вес.
- Алкоголь и табак.
- Полипы – разрастания ткани на стенке органа.
- Синдром Линча, повышающий вероятность возникновения опасных новообразований у людей в возрасте до 50 лет.
- Избыток красного мяса в рационе, употребление большого количества соленой, маринованной или копченой пищи.
- Инфекция Helicobacter pylori – бактерии, повреждающие слизистую оболочку желудка и приводящие к развитию язвы и гастритаГастрит – это воспаление слизистой оболочки желудка..
- Наличие родственников с подобным диагнозом.
- Группа крови А (II).
- Наследственные синдромы, провоцирующие разрастание тканей или возникновение опухолей.
Аденокарцинома развивается из-за ошибок в генах, которые контролируют рождение, работу и смерть клеток. Такие изменения происходят по нескольким причинам.
- Часть возникает при делении клеток.
- Некоторые из них вызваны воздействием вредных веществ и образом жизни.
- И в части случаев они наследуются от родителей.
Так называемые онкогены стимулируют развитие клеток, а супрессоры опухолей – замедляют их рост и вызывают гибель по окончанию жизненного цикла. Если в результате различных нарушений первые из них активируются, а вторые «выключаются», в организме человека появляется рак.

Диагностика аденокарциномы
Сегодня медицина предлагает множество различных методов, позволяющих выявлять раковые опухоли даже на самых ранних этапах.
- Биопсия – изъятие небольшого количества тканей для изучения свойств ее клеток. Данное исследование – единственный способ постановки точного диагноза. Материал забирается в ходе хирургической операции или прокола иглой, после чего передается в лабораторию, где специалисты выявляют в нем раковые клетки и определяют их тип. Эта информация необходима врачам для подбора правильного лечения и определения прогнозов пациента.
- Рентгенография грудной клетки, а также маммография, обнаруживающая новообразования в молочной железе.
- УЗИ , или сонография – оценка состояния внутренних структур с использованием звуковых волн. Процедура не наносит вреда организму пациента и часто выполняется для выявления очагов заболевания, расположенных в том числе в лимфатических узлах – органах иммунной системы, задерживающих и уничтожающих опасные вещества.
- Магнитно-резонансная томография, МРТ – создание крайне подробного и детализированного изображения мягких тканей, включая мозг, нервы и сосуды при помощи мощных магнитов и радиоволн. МРТ обнаруживает опухоли и определяет их точные размеры и границы. Она не назначается людям с несовместимыми трансплантатами и протезами и не дает возможности исследовать части скелета, в которые часто проникают измененные клетки.
- Компьютерная томография, или КТ. Специальный аппарат делает множество рентгеновских снимков и объединяет их в одну четкую черно-белую картинку. КТ позволяет изучать не только мягкие структуры, но и кости, а также содержащие большое количество воздуха органы, такие как легкие.
- Позитронно-эмиссионная томография. До начала процедуры человек получает небольшое количество радиоактивного сахара, который накапливается в быстро делящихся клетках, в том числе раковых. Затем проводится сканирование, выявляющее любые, даже самые маленькие их скопления. ПЭТ применяется для поиска в организме метастазов – дополнительных очагов онкологии, если врачи точно не знают, в какой именно области они могут находиться. Некоторое оборудование позволяет одновременно выполнять ПЭТ и КТ, благодаря чему доктор получает гораздо больше информации, чем дает каждое из данных исследований.
- Анализы крови. Назначаются для поиска онкомаркеров – белков, выделяемых некоторыми типами измененных клеток, а также для оценки качества работы внутренних органов, таких как почки и печень.
Пройти полную диагностику аденокарциномы можно в онкологическом центре «Лапино-2».
У нас есть высококвалифицированные специалисты и современное оборудование, которое позволяет выявлять опасные опухоли на самых ранних стадиях.
У пациентов нашей клиники нет необходимости тратить времени на поездки по разным медицинским учреждениям – все процедуры выполняются на территории Центра. Исследования проводятся без очереди, в максимально сжатые сроки, а результаты анализов мы получаем из собственной лаборатории.
Стадии аденокарциномы
После выявления рака врачи выясняют его стадию – количество пострадавших от измененных клеток тканей. Для определения этапа аденокарциномы используется международная система TNM, основанная на 3 ключевых моментах:
- Т: размере основной опухоли.
- N: количестве поврежденных лимфатических узлов.
- М: наличии или отсутствии метастазов – дополнительных очагов заболевания в различных областях организма.
Стадии:
В тканях присутствуют измененные клетки, но они есть только там, где впервые возникли.
I. Опухоль имеет минимальные размеры и находится в пределах органа, в котором она образовалась.
II. На этом этапе очаг разрастается до более крупных габаритов, но другие структуры здоровы.
III. Новообразование увеличивается еще сильнее и выходит за границы органа, в котором появилось. Либо неправильные клетки обнаруживаются в лимфатических узлах – «фильтрах» иммунной системы, задерживающих и обезвреживающих опасные вещества.
IV. Единственная стадия, в медицинском шифре которой рядом с буквой «М» стоит цифра «1», а не ноль. Это значит, что в теле пациента присутствуют метастазы – дополнительные раковые опухоли в других областях организма, расположенных далеко от первичного очага.

Лечение аденокарциномы
Тактика борьбы с раком зависит от большого количества факторов: количества пострадавших тканей, размера и расположения опухоли, возраста человека, наличия у него других тяжелых заболеваний и его общего состояния здоровья.
Часто основным методом лечения аденокарциномы является хирургия – удаление новообразования и небольшого количества окружающей ее здоровой ткани. Нормальные структуры изымаются для того, чтобы в организме не осталось ни одной измененной клетки, которая могла бы размножиться и сформировать новый очаг заболевания.
Операции проводятся как классическим способом – с выполнением крупных разрезов, так и лапароскопически – с использованием специального инструмента через небольшие проколы. Такие вмешательства позволяют повреждать минимум тканей и сокращают кровопотерю, болевые ощущения и сроки восстановления, но требуют большого опыта и мастерства хирурга.
Химиотерапия – применение препаратов для уничтожения неправильных клеток. Они вводятся в вену или принимаются внутрь, попадают в кровоток, распространяются по всему телу и действуют во всех его областях. Благодаря такому свойству их можно использовать в том числе на запущенных стадиях, при распространении рака и появлении метастазовМетастаз – это новая, дополнительная онкологическая опухоль, возникшая в тканях или органах, расположенных далеко от основного ракового очага.. «Химия» проводится циклами, каждый из которых чередуется с периодом отдыха, необходимого для восстановления организма.
Лучевая терапия – разрушение измененных клеток радиацией. Лечение предполагает 2 вида воздействия:
- внешнее – облучение из специального аппарата, расположенного вне тела;
- и внутреннее, или брахитерапию – размещение радиоактивных веществ в опухоли или близких к ней тканях.
Может назначаться совместно с химиотерапией. Проводится до операции для уменьшения размеров опухоли и облегчения ее удаления, а также после хирургического вмешательства для уничтожения всех оставшихся неправильных клеток.
Таргетная терапия – прием препаратов, которые воздействуют только на определенные изменения в клетках. С их помощью можно остановить рост новообразования или уменьшить его размеры. В отличие от обычной «химии», влияющей на любые быстро делящиеся клетки, такие вещества практически не повреждают здоровые ткани.
Гормональная терапия. Гормоны – это вещества, которые создаются железами, с кровью перемещаются в различные ткани и сообщают им, как действовать – работать или отдыхать, поглощать что-то или выделять. Данные соединения влияют на развитие некоторых видов аденокарцином. Контроль их количества или прекращение выработки с помощью специальных лекарств может замедлить или прекратить увеличение опухолей.
Иммунотерапия – средства, которые помогают собственной иммунной системе человека выявлять и разрушать измененные клетки. Такие препараты обычно назначаются пациентам с распространенным раком для сокращения размеров новообразований и остановки их роста.
В онкологическом центре «Лапино-2» проводится лечение различных типов аденокарцином на любой стадии.
У нас работают отличные специалисты – врачи с мировым именем и огромным опытом в области выявления и борьбы с онкологическими заболеваниями.
Мы применяем все современные методики и используем исключительно оригинальные препараты, дающие предсказуемый результат.
Нашим пациентам не приходится терять драгоценное время – у нас нет очередей, а все процедуры проводятся точно в срок, с максимальным комфортом для каждого посетителя.
Прогнозы и выживаемость при аденокарциноме
Прогноз индивидуален для каждого человека и зависит от множества факторов: возраста, наличия других тяжелых заболеваний, типа рака, его распространенности, свойств его клеток и реакции на проводимую терапию.
Врачи определяют примерные перспективы пациента, ориентируясь на данные «пятилетней выживаемости». Этот показатель представляет из себя статистическую выборку – количество больных, оставшихся в живых через 5 или более лет с момента постановки диагноза.
Для различных типов аденокарциномы общая для всех стадий цифра выглядит следующим образом:
- опухоли желудка: 32%;
- кишечника: 90%;
- легких: 56%;
- молочной железы: 90%;
- пищевода: 47%;
- поджелудочной железы: 10%;
- тонкой кишки: 68%.
В онкологии любая врачебная ошибка грозит серьёзными последствиями: некорректно назначенная токсичная химиотерапия может убить пациента так же, как и отсутствие лечения, если у пациента есть рак, но диагноза нет.
Число онкологических диагнозов в России, как и во всём мире, растёт: в прошлом году отечественные врачи выявили 617,2 тысячи новых случаев злокачественных заболеваний – это на 20 тысяч больше, чем в 2017-м. Между тем, по мнению экспертов, как минимум 30% такихдиагнозов требуют корректировки: в уточнении могут нуждаться как вид ибиологические характеристикиопухоли или распространённость процесса, так и самый важный вопрос: злокачественная опухоль или доброкачественная.
Никто не застрахован от ошибок
Диагноз «рак» ставит врач-онколог, опираясь на результаты морфологических исследований. Основное из них – гистологическое, во время которого фрагмент опухоли исследуется под микроскопом: оно позволяет увидеть структурные изменения тканей, понять, идёт ли речь о раке или о доброкачественном новообразовании. Для его выполнения образец ткани, полученный при биопсии или, например, во время операции, направляется в патоморфологическую лабораторию, где его обрабатывают и делают из него парафиновые блоки, а блоки нарезают на гистологические стёкла, которые изучает врач-патоморфолог.
Для уточнения диагноза проводится углублённый иммуногистохимический анализ: его применяют, если первичный очаг заболевания неизвестен или обнаруженные клетки трудно отнести к определённому виду рака. Это исследование основано на использовании антител, которые вступают в реакции с антигенами опухоли. Набор характерных антител существует практически для каждого вида онкологических заболеваний, поэтому при помощи такого исследования можно подтвердить или опровергнуть диагноз, а также получить уточняющую информацию о заболевании. Но иногда и его недостаточно: часть случаев требует дополнительного молекулярно-генетического исследования для того, чтобы предсказать развитие болезни и подобрать эффективную схему лечения.
На всех этапах диагностики рака возможны ошибки: стёкла с образцами могут перепутать, при биопсии могут взять кусочек ткани не с того участка, сам врач, проводящий исследование, может ошибиться. Результаты исследований гистологических стёкол всегда зависят от квалификации врача, который смотрит в микроскоп, и случаев, с которыми ему уже доводилось сталкиваться на практике, ведь ни один патолог не может знать абсолютно все виды рака. Знания и опыт требуются как для выявления изменений, так и для верной трактовки результата. Цена ошибки в этом случае очень высока: если неопытный врач принял особенности строения тканей, характерные для некоторых доброкачественных состояний, за рак, пациента направят на операцию и сложное лечение, которого можно было бы избежать при выполнении исследования высококвалифицированным специалистом. При этом врач, который поставил диагноз, может и не подозревать, что ошибся.
Семь раз проверь
Чтобы избежать неправильного диагноза и, как следствие, некорректного лечения, необходимо показать гистологические блоки второму специалисту, желательно – специализирующемуся на конкретной локализации рака. В 2016 году на базе Лаборатории «Гемотест» – федеральной медицинской сети, которая охватывает 280 городов России, – был создан Независимый экспертный совет в рамках проекта «Онкологическая экспертиза». В совет вошли 30 ведущих специалистов национальных медицинских исследовательских центров, которые проводят пересмотр гистологических и цитологических препаратов, полученных в любых медицинских учреждениях, частных и государственных.
Для получения экспертного заключения достаточно отнести препараты – стёкла или блоки – в любое лабораторное отделение «Гемотест». В большинстве случаев при пересмотре диагноза выявляется клинически значимое расхождение – такое, которое способно существенно повлиять на тактику лечения. «Одно из самых сложных направлений в онкоморфологии – опухоли кроветворной и лимфоидной тканей, опухоли мягких тканей и костей, в которых частота расхождений высокая. В некоторых выборках расхождения могут достигать 50%, то есть из двух входящих случаев в одном диагноз меняется. Иногда процент расхождения выше», – говорит заведующий отделением клинической молекулярной морфологии Северо-Западного государственного медицинского университета имени И. И. Мечникова, консультант Экспертного совета «Гемостест», руководитель направления «Телепатология» Юрий Криволапов.
«Патологоанатом ориентируется на собственный опыт, квалификацию, существующие стандарты диагностики и критерии патологии. Естественно, если доктор не обладает должной практикой диагностики определённой патологии, то он может ошибиться, особенно в переходных моментах. Именно с этим и связано такое количество расхождений, – объясняет руководитель отдела гистологии лаборатории «Гемостест» Сергей Кижаев. – И часто, пересматривая биоматериал пациента, направленный из региональной лаборатории, мы даём заключение, отличное от первоначального. В своей практике мы используем несколько пар глаз, чтобы сойтись в одном мнении».
Опыт лаборатории «Гемотест»: результаты пересмотра диагнозов в рамках проекта «Второе мнение» (3 года, 2500 случаев)

.png)