- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Соколова А.В.
1
Малишевская Н.П.
2
1 Клиника «Уральская»
2 Государственное бюджетное учреждение Свердловской области «Уральский научно-исследовательский институт дерматовенерологии и иммунопатологии»
В России в течение последних 15 лет отмечается рост заболеваемости меланомой кожи (МК) на 70%. Наиболее неблагоприятны по своим последствиям ошибки в диагностике МК. Проведено клиническое и дерматоскопическое исследование 1030 новообразований кожи у 800 пациентов, последовательно обратившихся на прием к дерматологу. В выборку включены все пациенты с новообразованиями кожи, после удаления которых было произведено гистологическое исследование материала и получено патоморфологическое заключение (n=441). Из 441 гистологического исследования новообразований кожи совпадение с клинически установленным диагнозом было в 355 случаях (80,5%), расхождение — в 86 случаях (19,5%). Из 86 случаев расхождения диагнозов установлено 24 (27,9%) случая гиподиагностики диспластических невусов и меланомы кожи, 34 (39,5%) случая гипердиагностики диспластических невусов и меланомы кожи. Проанализированы причины расхождения клинического и дерматоскопического с патоморфологическим диагнозом в случаях сложной дифференциальной диагностики новообразований кожи, к которым относятся больные с диспластическими невусами и меланомой кожи, особенно на ранних стадиях. Основными причинами гиподиагностики меланоцитарных новообразований кожи являются малый размер новообразования, визуальная однородность цвета, беспигментные или мало пигментированные новообразования, визуально и дерматоскопически определяемые ровные и четкие контуры.
меланома кожи
диспластический невус
ошибки в диагностике меланомы
гиподиагностика меланомы кожи.
1. Демидов Л.В., Харкевич Г.Ю., Маркина И.Т. Меланома и другие злокачественные новообразования кожи // Энциклопедия клинической онкологии: руководство для практических врачей. — М.: РЛС, 2005. — С. 341–364.
2. Малишевская Н.П., Игликов В.А. и др. Эпидемиология злокачественных новообразований кожи на Среднем Урале / Кунгуров Н.В. (ред.) // Злокачественные новообразования кожи: заболеваемость, ошибки диагностики, организация раннего выявления, профилактика. — Курган: Зауралье, 2010. – С. 8-33.
3. Чиссов В.И., Старинский В.В., Петрова Г.В. Качественные новообразования в России в 2011 году (заболеваемость и смертность). — М.: ФП «МНИОИ им. П.А. Герцена» Минздрава России, 2013. — 289 с.
4. Chen S.T., Geller A.C., Tsao H. Update on the epidemiology of melanoma // Curr. Dermatol. Rep. — 2013. — № 2 (1). — Р. 24–34.
5. Малишевская Н.П., Кохан М.М., Соколова А.В и др. Дерматоонкология (злокачественные новообразования кожи, первичные лимфомы кожи): атлас / под общ. ред. проф. Н.В. Кунгурова. – Екатеринбург: Изд-во Урал. ун-та, 2016. – 68 с.
6. Состояние онкологической помощи населению России в 2016 году / под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. — М.: МНИОИ им. П.А. Герцена филиал ФГБУ «НМИРЦ» Минздрава России, 2017. — 236 с.
В России в течение последних 15 лет отмечается рост заболеваемости меланомой кожи (МК) на 70% [1-4]. Наиболее неблагоприятны по своим последствиям ошибки в диагностике МК. О значительном количестве диагностических ошибок на разных уровнях оказания медицинской помощи пациентам свидетельствует сохраняющийся высокий удельный вес больных с МК, выявленной на поздних стадиях опухолевого процесса [5]. За период с 2006 по 2016 год в РФ показатели запущенности по меланоме кожи значительно снизились (-40,6%), однако они по-прежнему остаются на недопустимо высоком уровне (18,9%) для опухолей визуальных локализаций [6]. Следует отметить, что гипердиагностика МК не влечет столь трагических последствий, как гиподиагностика, которая всегда связана с ухудшением прогноза течения заболевания и риском для жизни больного.
Цель исследования — установить причины расхождения результатов клинического и стандартного дерматоскопического обследования с патоморфологическим диагнозом в случаях сложной дифференциальной диагностики НОК. Проведено клиническое и дерматоскопическое исследование 1030 новообразований кожи (НОК) у 800 пациентов, последовательно обратившихся на прием к дерматологу. Из них в 441 (42,8%) случае выполнено удаление НОК радиоволновым или хирургическим методом с последующим гистологическим исследованием. Показаниями для удаления новообразований кожи явились подозрение на МК и диспластические невусы, все случаи сложной дифференциальной диагностики, а также все меланоцитарные новообразования, находящиеся в местах постоянного травмирования или имеющие большие размеры (>6 мм). В случаях подозрения на МК пациенты направлялись в Государственное бюджетное учреждение Свердловской области «Свердловский областной онкологический диспансер» для хирургического иссечения НОК и последующего лечения. В выборку включены все пациенты с верифицированными диагнозами НОК, в том числе пациенты с меланомой кожи на ранних (I-II) стадиях и диспластическими невусами, когда правильная и своевременная диагностика наиболее важна для дальнейшего прогноза течения заболевания (табл. 1).
Таблица 1
Структура новообразований кожи (n=441)
|
Меланоцитарные новообразования кожи |
Число больных с правильно установленным диагнозом, абс. (%) |
|
|
визуальный осмотр с использованием дерматоскопии |
гистологическое заключение |
|
|
Доброкачественные НОК |
349 (79,1%) |
361 (81,9%) |
|
Диспластические невусы кожи |
82 (18,6%) |
67 (15,2%) |
|
Меланома кожи на ранних стадиях |
10 (2,3%) |
13 (2,9%) |
Группу доброкачественных новообразований кожи составили меланоцитарные невусы без признаков дисплазии (n=263), себорейный кератоз (n=74) и гемангиомы кожи (n=12) в случаях их травмирования, с наличием геморрагических корочек на поверхности новообразований, затрудняющих визуальную и дерматоскопическую диагностику.
Таким образом, в данной выборке достоверных различий в правильности постановки диагноза при клиническом осмотре дерматолога с применением рутинной дерматоскопии и результатом гистологии не выявлено (табл. 1).
Из 441 гистологического исследования НОК совпадение с клинически установленным диагнозом было в 355 случаях (80,5%), расхождение — в 86 случаях (19,5%). Совпадение клинического дерматоскопического и гистологического диагнозов (n=355) выявлено в случаях доброкачественных новообразований кожи (n=305), диспластических невусов (n=45) и меланомы кожи (n=6). Из 86 случаев расхождения диагнозов установлено 24 (27,9%) случая гиподиагностики диспластических невусов и меланомы кожи, 34 (39,5%) случая их гипердиагностики.
Проанализированы причины расхождения клинического и стандартного дерматоскопического обследования с патоморфологическим диагнозом в случаях сложной дифференциальной диагностики НОК, к которым относятся больные с диспластическими невусами и меланомой кожи, особенно на ранних (I-II) стадиях (табл. 2).
Таблица 2
Визуальные признаки НОК, влияющие на гиподиагностику диспластических невусов и МК с использованием дерматоскопии (n=24)
|
Признак |
Частота встречаемости |
|
|
абс. |
% |
|
|
1. Малый размер новообразования (<6 мм) |
17 |
70,8 |
|
2. Визуально и дерматоскопически определяемые ровные четкие контуры |
3 |
12,5 |
|
3. Клинически и дерматоскопически определяемая однородность цвета |
6 |
25,0 |
|
4. Беспигментные или мало пигментированные новообразования |
5 |
20,8 |
Примечание: у одного больного могло быть несколько причин гиподиагностики, в связи с чем общая частота встречаемости признака превышает 100%.
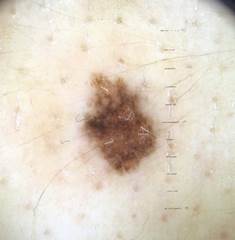
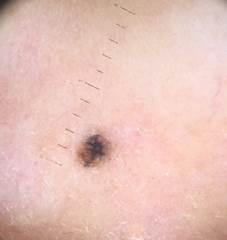
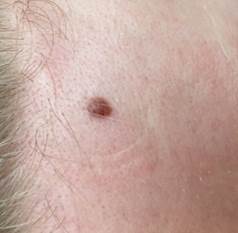
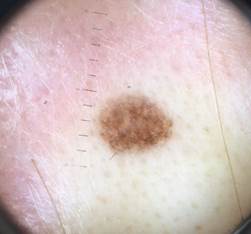
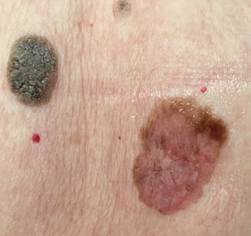
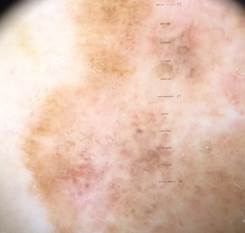
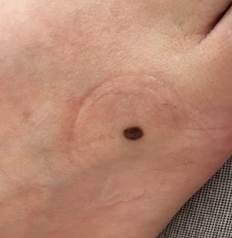
B соответствии с приведенными данными основными причинами гиподиагностики пигментированных новообразований кожи являются малый размер новообразования (70,8%, рис. 1), визуальная однородность цвета (25,0%, рис. 2), беспигментные или мало пигментированные новообразования (20,8%, рис. 3), визуально и дерматоскопически определяемые ровные и четкие контуры (12,5%, рис. 4).
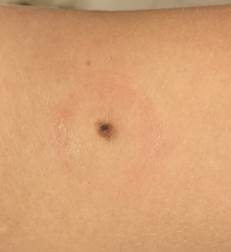
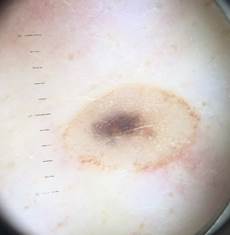
Рис. 1. Линейный размер меланомы кожи меньше 6 мм (дерматоскопическое изображение)
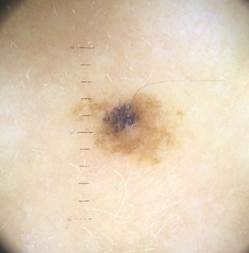
Рис. 2. Клиническое и дерматоскопическое изображение диспластического невуса кожи лба: клинически определяется визуальная однородность цвета
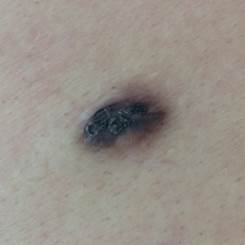
Рис. 3. Клиническое и дерматоскопическое изображение мало пигментированной меланомы кожи живота с участками регресса, выше – себорейный кератоз
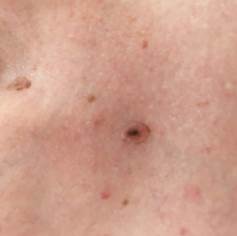
Рис. 4. Клиническое и дерматоскопическое изображение меланомы кожи тыльной поверхности стопы
Проанализированы причины гипердиагностики меланоцитарных новообразований кожи в случаях, когда возникают трудности в дифференциальной диагностике диспластических невусов и меланомы кожи (табл. 3).
Таблица 3
Визуальные признаки НОК, влияющие на гипердиагностику диспластических невусов и МК с дерматоскопией (n=34)
|
Признак |
Частота встречаемости |
|
|
абс. |
% |
|
|
1. Большой (свыше 10 мм) размер новообразования |
13 |
54,2 |
|
2. Клинически и дерматоскопически определяемые неровные контуры и асимметричность новообразования |
9 |
37,5 |
|
3. клинически и дерматоскопически определяемая неоднородность цвета |
15 |
62,5 |
|
4. Наличие в новообразовании фрагментов темно-коричневого и черного цвета при дерматоскопии новообразований |
8 |
33,3 |
Примечание: у одного больного могли быть несколько причин гипердиагностики, в связи с чем общая частота встречаемости признака превышает 100%.
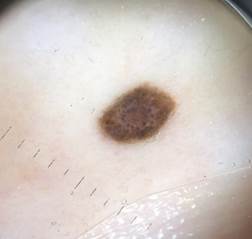
B соответствии с данными таблицы 3 основными причинами, которые приводят к гипердиагностике диспластических невусов и меланомы кожи, являются неоднородность цвета (62,5%, рис. 5, 7), размер новообразований более 10 мм (54,2%, рис. 6), неровные контуры и асимметричность новообразования (37,5%, рис. 5), а также наличие в новообразовании фрагментов темно-коричневого и черного цвета (33,3%, рис. 5-7).
Рис. 5. Клиническое и дерматоскопическое изображение диспластического невуса кожи плеча: неоднородность цвета, неровные контуры и асимметричность новообразования, наличие в новообразовании эксцентрично расположенных фрагментов темно-коричневого и черного цвета
Рис. 6. Пигментированная дерматофиброма кожи бедра
Рис. 7. Клиническое и дерматоскопическое изображение диспластического невуса кожи живота
Результаты расчета показателей диагностической точности, чувствительности и специфичности клинического осмотра с применением дерматоскопии для диагностики НОК продемонстрировали, что чувствительность клинического осмотра с применением дерматоскопии для доброкачественных новообразований кожи (91,2%) на 45,0% выше, чем чувствительность диагностики меланомы кожи (46,2%). Но при этом определяется высокая (99,1%) специфичность клинической и дерматоскопической диагностики меланомы кожи, что свидетельствует о большой вероятности совпадения диагноза с данными патоморфологического исследования. Точность диагностики меланомы кожи составляет 97,5%, что на 9,1% выше, чем точность диагностики доброкачественных новообразований кожи (88,4%) с применением метода дерматоскопии.
На следующем этапе исследования был разработан «показатель гиподиагностики», т.е. число больных, которым необходимо провести клиническое и дерматоскопическое исследование новообразований кожи для того, чтобы у одного из них установленный клинический диагноз не подтвердился результатом гистологического исследования. Показатель гиподиагностики рассчитывали как отношение неверно диагностированных случаев ко всем случаям НОК в данной группе. Этот показатель составил 18,4 в случае диспластических невусов и меланомы кожи, и 63,0 в случае только меланомы кожи. Таким образом, при осмотре 63 больных с НОК в ситуациях сложной дифференциальной диагностики дерматолог допускает один случай гиподиагностики меланомы кожи.
Диагностические ошибки за счет гиподиагностики процесса имеют наиболее неблагоприятные для течения заболевания и прогноза жизни последствия, что диктует необходимость внедрения в клиническую практику новых современных неинвазивных методов обследования меланоцитарных новообразований кожи (спектрофотометрического интрадермального анализа, конфокальной лазерной сканирующей микроскопии).
Библиографическая ссылка
Соколова А.В., Малишевская Н.П. ОШИБКИ В ДИАГНОСТИКЕ МЕЛАНОЦИТАРНЫХ НОВООБРАЗОВАНИЙ КОЖИ // Современные проблемы науки и образования. – 2018. – № 2.
;
URL: https://science-education.ru/ru/article/view?id=27502 (дата обращения: 22.09.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Очередной очень интересный случай. Чем заканчивается ошибка в гистологии и зачем нужна биопсия сторожевых лимфоузлов + один из вариантов борьбы с побочными эффектами от таргетной терапии. Экстра-короткий, но препознавательнейший пост.
Для увеличения объема текста, разбавлю основную канву своим видением вакцинации от ковидлы.
Обе части — это общение с одним и тем же человеком.
I Прививка от COVID
12.12.2021
— Вадим, добрый день! В своём блоге Вы писали, что вакцинировались спутником V. Но Вы как я понимаю уже какое то время не принимаете никакую терапию. А есть ли у Вас истории, кто привился, принимая таргетную терапию. Врач в поликлинике предлагает привиться, а химиотерапевт против вакцинации. Что же делать, как жить….буду благодарна за ответ.
— Добрый день!
1 Никаких противопоказаний у вас нет (если самочувствие нормальное)
2 В блоге таких историй нет, НО, есть в нашей группе
Допустим, 26.10.2021 посмотрите пост.
Гораздо лучше привиться, чем на фоне таргетов еще и вирь подхватить.
С прививками, все же, гораздо проще болезнь протекает.
— Да, самочувствие нормальное, как Вы считаете можно продолжать принимать лекарства после вакцинации и между прививками?
— Конечно можно.
Опять же, все будет зависеть от самочувствия.
У некоторых после прививки температура поднимается на пару дней. Вот на этот срок и прервать прием таргетов (страшного ничего нет в этом).
Шоб не усугублять, так сказать
II Ошибка в гистологии. Через какое время может «аукнуться».
январь 2022
— Вадим, добрый день! Год назад удалили меланому. Через 3 месяца увеличились лимфоузлы паховые с одной стороны. Биопсию лимфоузлов оперирующий хирург делать не посоветовал. Сказал, что может быть ещё более быстрое распространение.
Принимаем таргеты . 6 месяцев. Через 3 месяца на ПЭТ все чисто. Я читала у Вас, что принимать это лечение необходимо до того как снова будет прогрессирование. Неужели оно обязательно будет? БРАФ есть. А может можно уже перейти на иммунную терапию? Хотя врач не хочет пока переводить.
— Добрый вечер!
А лимфоузлы удаляли? Вы мне можете историю болезни показать? (личные данные можно удалить/замазать… мне важен сам текст).
— Лимфоузлы не удаляли. После увеличения лимфоузлов (через 3 месяца после операции), назначили на БРАФ мутацию, которая подтвердилась и ПЭТ КТ показало метастазы в правом паховом лимфоузле . Назначили таргетную терапию.
После 3 месяцев их приема лимфоузлы пришли в норму, ПЭТ КТ показало полный ответ. В ближайшее время снова будет ПЭТ КТ.
Ошибка гистологии в 2000г :
Результат через 20 лет:

— Хм. как интересно.
Если подходить «классически», то таргетная терапия , когда начинается при наличии неоперабельного метастаза (метастазов), принимается либо до непереносимости, либо до прогрессирования (которое может и через 5-6 лет произойти, а может вообще не произойти).
Если происходит прогресс, то переводят на иммунотерапию. Но , сейчас пошла новая мода — несколько месяцев таргеты, а потом сразу на иммунотерапию переводят. Это , по моему мнению, не правильно.
На эту тему скоро будет статья (в статье бум обсуждать КИ «SECOMBIT», очень интересное по сути и имеющее одну, не менее интересную, загвоздку прим Дядя Вадик).
Понимаете, иммунотерапия может и не сработать. И на фоне полного ответа от таргетов переходить на лечение, которое помогает с вероятностью в 50%…
Лучше таргеты пить , если переносимость нормальная.
— Вот и химиотерапевт не советует переходить на иммунотерапию, а оперирующий врач, сказал, что если есть ответ, то после того как произошёл полный ответ надо ещё пол срока пить таргеты, а потом переходить на иммунную. Но это ведь тоже на подарок?
А таргеты теперь пить постоянно? Даже если ПЭТ будет показывать, что все хорошо?
— Да, таргеты пить постоянно.
А лимфоузел визуально вот прям очень сильно был увеличен? Удивительно, что без подтверждения (без биопсии) сразу его в метастазы записали.
— Да, Вадим, сильно, прям шишка была, началось с небольшого увеличения, но пока добились таргеты, он ещё подрос, но как только начал пить, сразу пошло на уменьшение. Сейчас УЗИ показывает, что лимфоузел в норме, но изменён, но онколог говорит, что это не страшно.
Видимо изменён, потому что был сильно увеличен.
— Ок. Ну тогда тем более нет смысла бросать таргеты. Раз такой хороший ответ.
— Почему то оперирующий врач не советовал делать БСЛУ, сказал, что может быстро пойти прогрессирование.
— Потому, что дурной.
Ларчик просто открывается, на самом деле.
— Может он был уверен, что если пошло увеличение ЛУ, значит есть МТ?
— Биопсию сторожевых лимфоузлов надо было проводить сразу в момент удаления опухоли. Если бы сделали БСЛУ, нашли и удалили бы все нужные л/у, которые в тот момент еще были только-только поражены, то ситуация упростилась бы. 1 год таргетов в адъювантном режиме и все.
(На эту тему так же скоро будет статья, ибо я не понимаю, почему не выполняется БСЛУ , в случае выявления пальпируемого метастаза. Свое видение попытаюсь объяснить в одном из следующих постов прим. Дядя Вадик)
III Борьба с побочными эффектами от таргетной терапии
Один из вариантов.
— Ещё, может быть кому то поможет- могу описать как мы боролись с побрякали вначале приема таргетов. Была лихорадка жуткая, температура, до потери сознания.
— ДА!
Я сам вообще не разбираюсь в борьбе с побочками. А вопросы постоянно задают.
Чем подробнее, тем лучше.
— В первую неделю было все нормально, а дальше началась жуть. Через 4 часа после приема поднималась температура до 39, учащался пульс, поднималось давление. Сознание уходило. Я металась как зверь, не знала что делать. Звонила врачам.
Наш онколог из поликлиники посоветовал принимать преднизолон часа за 2 до приема препаратов, причём сразу большую дозу 4 таблетки, так как маленькая не помогала. Потом постепенно стали уменьшать количество, перешли на одну, затем стали пить через день, через пару недель -через 2, потом 2 раза в неделю, теперь уже месяца 3 обходимся без преднизалона. Но началось что то типа аллергии красные пятна иногда выступают, особенно заметны после душа. А так все ок.
*****************
Вот такая история.
Почему именно ошибка гистологии, а не «просто новая меланома»?
Смотрите, конспирологическую теорию о том, что после полного удаления нормальной родинки может появиться меланома, мы отметаем. Тут вообще без вариантов.
Второе, меланома появилась в том же месте, где было удалено предыдущее новообразование. «Совпадение? Не думаю.» Либо мы опять должны наделить опухоль неким «разумом»: Где бы мне появиться? Ща посмотрим… ВО, тута 20 лет назад родинку удалили, значит здеся и будем начинать митоз!Можно, конечно, фантазировать, но лучше сие оставить Стивену Кингу. У него лучше получается.
По этому, остается единственный вариант — 20 лет назад была удалена меланома в некой совсем начальной стадии (in situ, как вариант) и что-то осталось. В этом, как раз, нет ничего необычного.
И по поводу терапии… каждый раз у меня какие-то «непонятки» возникают:
- Если эти пораженные л/у удалить, то остается 1 год таргетной терапии в адъювантном режиме и всё.
- А если не удалять, даже не смотря на полный ответ, то пить бесконечно?
В общем, все равно я не до конца понимаю эти тонкости.
Не болейте!
01.02.2022
ЗАКЛЮЧЕНИЕ: ПЭТ/КТ данных за наличие очагов патологической метаболической активности, характерной для 18F-FDG позитивного неопластического процесса, не выявлено.
При сравнении с ПЭТ/КТ исследованием от 30.08.2021г — без выраженной динамики, достоверных данных за прогрессирование основного заболевания не получено.
Review
. 2021 Oct 15;8(4):494-501.
doi: 10.3390/dermatopathology8040051.
Lucia Lospalluti
2
, Anna Colagrande
1
, Antonietta Cimmino
1
, Paolo Romita
2
, Caterina Foti
2
, Aurora Demarco
2
, Francesca Arezzo
3
, Vera Loizzi
3
, Gennaro Cormio
3
, Sara Sablone
4
, Leonardo Resta
1
, Roberta Rossi
1
, Giuseppe Ingravallo
1
Affiliations
-
PMID:
34698090
-
PMCID:
PMC8544555
-
DOI:
10.3390/dermatopathology8040051
Free PMC article
Review
Dedifferentiated Melanoma: A Diagnostic Histological Pitfall-Review of the Literature with Case Presentation
Gerardo Cazzato et al.
Dermatopathology (Basel).
.
Free PMC article
Abstract
Dedifferentiated melanoma is a particular form of malignant melanoma with a progressive worsening of the patient’s clinical outcome. It is well known that melanoma can assume different histo-morphological patterns, to which specific genetic signatures correspond, sometimes but not always. In this review we address the diagnostic difficulties in correctly recognizing this entity, discuss the major differential diagnoses of interest to the dermatopathologist, and conduct a review of the literature with particular attention and emphasis on the latest molecular discoveries regarding the dedifferentiation/undifferentiation mechanism and more advanced therapeutic approaches.
Keywords:
dedifferentiated melanoma; diagnosis; immunohistochemistry; malignant melanoma (MM); pitfall.
Conflict of interest statement
The authors declare no conflict of interest.
Figures
(A) Lesion consisted of a nodular part of about 3 cm in diameter and a flat, blackish, elongated part of about 1.5 cm. (B) Dermoscopically, the lesion was characterized by marked chromatic asymmetry, with radial striae and peripheral pigment escape, with irregular globules. (A) The “shoulder” of the lesion was made up of atypical melanocytes, which ascended to the level of the dermoepidermal junction, morphologically suggestive of malignant melanoma. Note that the neoplastic cells had a tendency to invade the superficial/middle dermis (Hematoxylin-Eosin, Original Magnification: 10×). (B) Histological micrograph that highlights the two morphologically different components of dedifferentiated melanoma (Hematoxylin–Eosin, original magnification: 20×). (C,D) Nodule consisting of pleomorphic, atypical elements, with very numerous typical and atypical mitotic figures, eosinophilic intracytoplasmic paranuclear inclusions, nuclei with thinned chromatin and numerous central and peripheral nucleoli (Hematoxylin–Eosin, original magnification: 20× and 40×). (E) Immunostaining for HMB-45, which is strongly represented in the melanocyte proliferation constituting the “shoulder” of the lesion morphologically represented in (A). Note the total negativity of HMB-45 of atypical nodular proliferation (Immunohistochemistry, original magnification: 10×) (F) Immunostaining for CD10 strongly positive in the exophytic polypoid nodular component and negative in the shoulder of the lesion (Immunohistochemistry, original magnification: 10×). (A) The “shoulder” of the lesion was made up of atypical melanocytes, which ascended to the level of the dermoepidermal junction, morphologically suggestive of malignant melanoma. Note that the neoplastic cells had a tendency to invade the superficial/middle dermis (Hematoxylin-Eosin, Original Magnification: 10×). (B) Histological micrograph that highlights the two morphologically different components of dedifferentiated melanoma (Hematoxylin–Eosin, original magnification: 20×). (C,D) Nodule consisting of pleomorphic, atypical elements, with very numerous typical and atypical mitotic figures, eosinophilic intracytoplasmic paranuclear inclusions, nuclei with thinned chromatin and numerous central and peripheral nucleoli (Hematoxylin–Eosin, original magnification: 20× and 40×). (E) Immunostaining for HMB-45, which is strongly represented in the melanocyte proliferation constituting the “shoulder” of the lesion morphologically represented in (A). Note the total negativity of HMB-45 of atypical nodular proliferation (Immunohistochemistry, original magnification: 10×) (F) Immunostaining for CD10 strongly positive in the exophytic polypoid nodular component and negative in the shoulder of the lesion (Immunohistochemistry, original magnification: 10×). Literature search and article selection according to PRISMA guidelines.
Figure 1
Figure 2
Figure 2
Figure 3
Similar articles
-
Partially Dedifferentiated Primitive Malignant Melanoma with Pseudo-Angiomatous Features: A Case Report with Review of the Literature.
Ambrogio F, Colagrande A, Cascardi E, Grandolfo M, Filotico R, Foti C, Lupo C, Casatta N, Ingravallo G, Cazzato G.
Ambrogio F, et al.
Diagnostics (Basel). 2023 Jan 29;13(3):495. doi: 10.3390/diagnostics13030495.
Diagnostics (Basel). 2023.PMID: 36766604
Free PMC article. -
Dedifferentiated melanomas: Morpho-phenotypic profile, genetic reprogramming and clinical implications.
Massi D, Mihic-Probst D, Schadendorf D, Dummer R, Mandalà M.
Massi D, et al.
Cancer Treat Rev. 2020 Aug;88:102060. doi: 10.1016/j.ctrv.2020.102060. Epub 2020 Jun 23.
Cancer Treat Rev. 2020.PMID: 32619863
Review.
-
Dedifferentiated and undifferentiated neoplasms: A conceptual approach.
Baraban E, Cooper K.
Baraban E, et al.
Semin Diagn Pathol. 2021 Nov;38(6):119-126. doi: 10.1053/j.semdp.2020.09.002. Epub 2020 Sep 5.
Semin Diagn Pathol. 2021.PMID: 32948384
Review.
-
Balloon Cell Melanoma: Presentation of Four Cases with a Comprehensive Review of the Literature.
Cazzato G, Cascardi E, Colagrande A, Cimmino A, Ingravallo G, Lospalluti L, Romita P, Demarco A, Arezzo F, Loizzi V, Dellino M, Trilli I, Bellitti E, Parente P, Lettini T, Foti C, Cormio G, Maiorano E, Resta L.
Cazzato G, et al.
Dermatopathology (Basel). 2022 Mar 28;9(2):100-110. doi: 10.3390/dermatopathology9020013.
Dermatopathology (Basel). 2022.PMID: 35466242
Free PMC article.Review.
-
Amelanotic Malignant Melanoma of the Male Urethra: A Potential Diagnostic Pitfall.
Caputo A, Califano A, Fabiano M, Altieri V, Zeppa P, D’Antonio A.
Caputo A, et al.
Int J Surg Pathol. 2020 Aug;28(5):510-513. doi: 10.1177/1066896920919497. Epub 2020 May 10.
Int J Surg Pathol. 2020.PMID: 32390487
Cited by
-
Metastatic Melanoma to the Orbit With Dedifferentiation: A Case Report.
Rana HS, Dertinger JE, Clabeaux C, Makepeace N, Lewis J.
Rana HS, et al.
Cureus. 2023 Jul 9;15(7):e41591. doi: 10.7759/cureus.41591. eCollection 2023 Jul.
Cureus. 2023.PMID: 37559849
Free PMC article. -
Imaging Mass Spectrometry for the Classification of Melanoma Based on BRAF/NRAS Mutational Status.
Casadonte R, Kriegsmann M, Kriegsmann K, Streit H, Meliß RR, Müller CSL, Kriegsmann J.
Casadonte R, et al.
Int J Mol Sci. 2023 Mar 7;24(6):5110. doi: 10.3390/ijms24065110.
Int J Mol Sci. 2023.PMID: 36982192
Free PMC article. -
Partially Dedifferentiated Primitive Malignant Melanoma with Pseudo-Angiomatous Features: A Case Report with Review of the Literature.
Ambrogio F, Colagrande A, Cascardi E, Grandolfo M, Filotico R, Foti C, Lupo C, Casatta N, Ingravallo G, Cazzato G.
Ambrogio F, et al.
Diagnostics (Basel). 2023 Jan 29;13(3):495. doi: 10.3390/diagnostics13030495.
Diagnostics (Basel). 2023.PMID: 36766604
Free PMC article. -
Not Your Mother’s Melanoma: Causes and Effects of Early Melanoma Diagnosis.
Sadrolashrafi K, Cotter DG.
Sadrolashrafi K, et al.
Dermatopathology (Basel). 2022 Nov 27;9(4):368-378. doi: 10.3390/dermatopathology9040043.
Dermatopathology (Basel). 2022.PMID: 36547217
Free PMC article.Review.
References
-
-
Abbas O., Miller D.D., Bhawan J. Cutaneous malignant melanoma: Update on diagnostic and prognostic biomarkers. Am. J. Dermatopathol. 2014;36:363–379. doi: 10.1097/DAD.0b013e31828a2ec5.
—
DOI
—
PubMed
-
-
-
Cabrera R., Recule F. Unusual Clinical Presentations of Malignant Melanoma: A Review of Clinical and Histologic Features with Special Emphasis on Dermatoscopic Findings. Am. J. Clin. Dermatol. 2018;19((Suppl. S1)):15–23. doi: 10.1007/s40257-018-0373-6.
—
DOI
—
PMC
—
PubMed
-
-
-
Agaimy A., Specht K., Stoehr R., Lorey T., Märkl B., Niedobitek G., Straub M., Hager T., Reis A.C., Schilling B., et al. Metastatic Malignant Melanoma With Complete Loss of Differentiation Markers (Undifferentiated/Dedifferentiated Melanoma): Analysis of 14 Patients Emphasizing Phenotypic Plasticity and the Value of Molecular Testing as Surrogate Diagnostic Marker. Am. J. Surg. Pathol. 2016;40:181–191. doi: 10.1097/PAS.0000000000000527.
—
DOI
—
PubMed
-
-
-
Linee Guida per il Reporting di Revisioni Sistematiche e Meta-Analisi: Il PRISMA Statement. [(accessed on 2 September 2021)]. Available online: http://www.prisma-statement.org/documents/PRISMA%20Italian%20Statement.pdf.
-
-
-
Oxford Centre for Evidence-Based Medicine 2011 Levels of Evidence. [(accessed on 4 September 2021)]. Available online: http://www.cebm.net/wp-content/uploads/2014/06/CEBM-Levels-of-Evidence-2….
-
Publication types
LinkOut — more resources
-
Full Text Sources
- Europe PubMed Central
- MDPI
- PubMed Central
Денис Мврков, Мужчина, 26 лет
Здравствуйте, у меня была родинка на боку и вдруг она стала чуть чуть чесаться, чесалась очень редко и зуд был не сильным и появился вокруг нее небольшой орел красный, родинка размером длина 7мм и ширина 3мм, где то так, я долго не думаю пошел к дермотологу и направили меня через два дня 03.03.17г в моники на дерматоскопию. Диагноз по дерматоскопии Полный диагноз -Меланоцитарный невус правого бока поверхности туловища, травмированный. Краткий анамнез -Дерматоскопия, глобулы и пигмента есть регулятит. Лечение -крем фуцидин 2р в день 2 недели. Дерматолог в мониках сказал можешь ее не удалять, невус нормальный просто кремом фуцидин помажешь и все, я настоял на удаление и он написал удалить тогда по месту прописки в своем городе Подмосковья с хирургическим иссечением и взятия гистологии с профилактической целью. Удалили мне невус 16.03.2017г и отправили на гистологию , невус уже за это время до операции, перестал чесаться и пропал вокруг него ореол небольшой красноватый, невус не шелушился, не кровоточил, не болел при нажатие на него пальцем. Через две недели мне сказали результаты, у себя в городе, что у меня меланома 1 стадии и что мне нужно поехать в г Балашиха около Москвы, что бы мне там уточнили диагноз, какой то процедурой с моей гистологией, рак это или не рак. У меня такой вопрос, как такое вообще получилось, ведь мне даже сначала не хотели ее удалять в Москве в мониках, сказали , что там все нормально, помажь мазью и все, но я настоял на удаление и очень удивился гистологии которая пришла в моем городе где я проводил удаление , как вы считаете, какие мои прогнозы на жизнь ? И может ли это быть ошибкой. ? Фото родинки скинул и фото уже как сняли швы
Добрый день. Для того , чтобы понимать наверняка, нужно пересмотреть ваши гистологические препараты в онкологическом учреждении, поэтому вас направляют в Балашиху. Я бы рекомендовал вам обратиться для этого в ГКБ №62 или МНИОИ им. П.А. Герцена — скорее всего это будет платно, но это в ваших интересах. Также дополнительно попросите, чтобы они оценили расстояние до края резекции, что очень важно.
Судить по вашим фотографиям меланома это или нет я не могу. Дерматоскопия тут является объективным анализом, все остальное субъективно. Как и мнение отдельно взятого доктора. Говорить о том, ошибся он или нет, я не могу, так как для этого нужно пересмотреть гистологические препараты. Если этого просят в учреждении , где вам удаляли косвенно свидетельствует , что они не уверены, и , возможно, перебдели — что не плохо учитывая насколько грозное это заболевание. Напишите мне по результатам пересмотра и будем решать дальше.
Консультация врача онколога на тему «Меланома 1 стадии или ошибка врача делавший гистологию прогнозы» дается исключительно в справочных целях. По итогам полученной консультации, пожалуйста, обратитесь к врачу, в том числе для выявления возможных противопоказаний.
Ответ опубликован 4 апреля 2017
Grażyna Kamińska-Winciorek1, Waldemar Placek2
1The Center for Diagnostics and Treatment of Skin Diseases, Katowice, Poland
Head of Center: Grażyna Kamińska-Winciorek MD, PhD
2Dermatology, Sexually Transmitted Diseases and Clinical Immunology Clinic,
Head of Department: Prof. Waldemar Placek MD, PhD
Postep Derm Alergol 2015; XXXII, 1: 33–39
DOI: 10.5114/pdia.2014.44029
Краткое содержание
Дерматоскопия — это метод оценки структуры эпидермиса и дермы in vivo. В настоящее время он, вероятно, является наиболее точным нехирургическим методом диагностики меланоцитарных ново- образований. Ошибки диагностики могут приводить к неоправданному удалению доброкачественных новообразований и, что хуже, могут пропустить раннюю меланому. Ошибки дерматоскопического анализа можно разделить на связанные с невозможностью провести надлежащие тесты (процедурные и технические ошибки), и те, которые вытекают из недостатка знаний и опыта в дерматоскопии. В настоящей статье обсуждаются наиболее распространенные ошибки начинающих или неопытных врачей.
КЛЮЧЕВЫЕ СЛОВА: дерматоскопия, дермоскопия, распространенные ошибки, базовые ошибки, неверный диагноз, принципы, правила.
Cancer Foundation. Mr March поддерживается наградой от the Office of Medical Research, University of Nevada School of Medicine. Ms Truong and Ms Strazzulla внесли равный вклад с Drs Kim and Grossman.
Адрес для корреспонденции
Prof. Waldemar Placek MD, PhD, Dermatology, Sexually Transmitted Diseases and Clinical Immunology Clinic, University of Varmia and Masuria, 30 Wojska Polskiego St, 10-229 Olsztyn, Poland, phone/fax: + 48 601 915 419, e-mail: w.placek@wp.pl
Знание основано не только на правде, но и на ошибке.
Карл Густав Юнг
Введение
Дерматоскопия (дерматоскопия, эпилюминесцентная микроскопия, микроскопия поверхности кожи) — это метод in vivo исследования структур эпидермиса и дермы. Это простой проверенный способ диагностики, подразумевающий обследование новообразований кожи, главным образом меланоцитарных, с 10-кратным увеличением в традиционных дерматоскопах и с 70–100-кратным — в видеодерматоскопах (1,2).
Дерматоскопы/дермоскопы используют неполяризованный свет, требующий иммерсии (ультразвуковой гель, масло или вода) или поляризованный свет, который не требует применения каких-либо иммерсионных жидкостей. Использование дерматоскопии на приеме дерматолога увеличивает время консультации, но лишь на 72 секунды (3), поэтому стоит использовать ее для оценки любых новообразований на теле обследуемого пациента во время стандартного осмотра.
Так это описывается в литературе, на практике же дерматоскопия меланоцитарных новообразований кожного покрова всего тела с подготовкой документации и описание занимает от 30 до 40 минут. Дерматоскопия должна быть основным диагностическим инструментом, используемым не только опытными дерматологами, но также для скрининга меланоцитарных новообразований различными специалистами, в том числе онкологами, хирургами и врачами общей практики (2, 4).
Дерматоскопия характеризуется 83 % чувствительностью и 69 % специфичностью при выявлении меланомы (5). В клинической практике чрезвычайно важно правильно оценивать новообразования на теле пациента, основываясь на технических аспектах и базовых знаниях дерматоскопии.
Цель
Настоящая статья представляет авторскую классификацию наиболее распространенных и вероятных ошибок дерматоскопии на основе литературы, доступной на ресурсе PubMed, и личного опыта.
Ошибки
Ошибки дерматоскопического анализа можно разделить на связанные с невозможностью провести надлежащие тесты (процедурные и технические ошибки), и те, которые вытекают из-за недостатка знаний и опыта в дерматоскопии. В Таблице 1 представлена авторская классификация возможных ошибок дерматоскопии.
Процедурные (технические) ошибки
Выбор новообразований для дерматоскопии
Наиболее распространенной ошибкой, которую допускают врачи, является дерматоскопическая оценка только отдельных новообразований — тех, на которые указал пациент, или которые врач выбрал на основе клинической оценки по принципу ABCDE, или морфологической — черные новообразования, наиболее крупные в диаметре, возвышающиеся, или те, которые расположены в местах, где они могут подвергаться травматизации (в зоне нижнего белья, в акральных областях).
Решение об иссечении подозрительных новообразований должно приниматься на основе сравнения их с другими новообразованиями. В исследовании Argenziano и соавторов (6) решение об удалении подозрительного новообразования после морфологической оценки единственного новообразования в дерматоскопии принималось в 55 % случаев, но сокращалось до 14 % после сравнительного анализа с другими новообразования.
Чтобы выбрать несколько новообразований для иссечения, рекомендуется подготовить карту тела пациента, чтобы дать хирургу подсказки. Отметить такие участки можно при помощи фотографий, снятых камерой телефона самого пациента (7). Следует также помнить об обследовании всех новообразований на теле, не только меланоцитарных, но также розовых папул, чтобы не пропустить меланому, соответствующую правилу EFG («возвышающаяся», «плотная при пальпации», «постоянно растущая») (8).
Другой ошибкой является игнорирование небольших меланоцитарных новообразований при дерматоскопической оценке. Многие врачи, основываясь на классификации по правилу ABCD, считают, что меланомой могут быть только новообразования более 5 мм в диаметре.
Согласно литературе, 11,4–38,2 % всех меланом имеют диаметр менее 6 мм (9–12). В исследовании Giorgi и соавторов (13) 34 меланомы были выявлены среди 103 меланоцитарных новообразований диаметром менее 6 мм (33 %). В исследовании Bono и соавторов (14) из 924 меланом 22 (2,4 %) были микромеланомами с диаметром менее 3 мм. Клиническое правило АBCD в диагностике меланомы диаметром менее 6 мм не срабатывает (13).
Дерматоскопия меланомы с диаметром менее 5 мм, как правило, выявляет атипичные сосуды, нерегулярную окраску, присутствие атипичных глобул или точек, нерегулярных радиальных линий и зоны регресса (15) (Рис. 1). Другой ошибкой является использование дерматоскопии с такой периодичностью, при которой не удается установить профиль меланоцитарного невуса. Кроме того, следует проводить тотальное обследование кожных покровов всего тела (TBSE) (16).
Бессмысленно обследование пациента, который не желает раздеваться из чувства стыда, избегая обследование области гениталий, ягодиц; когда пациент не соглашается обследовать конечности, например, не хочет снимать обувь или не дает осмотреть кожу под волосами, а такое поведение встречается часто.
Таблица 1. Наиболее распространенные ошибки при дерматоскопии
| Некорректная оценка отдельных новообразований в дерматоскопии: |
| Недостаток знаний, связанных с определением базовых или главных дерматоскопических паттернов или дерматоскопических структур, в том числе неспособность отличить псевдоподии от периферических глобул; поиск таких структур, как кристаллические, с использованием неполяризованного света. |
Процедурные (технические) ошибки: |
| 1. Выбор новообразований для дерматоскопии. Необходимо обследовать все новообразования на теле в зависимости от количества и расположения: |
| Обследование только отдельных меланоцитарных новообразований, указанных пациентом. Обследование отдельных меланоцитарных новообразований, отобранных врачом на основе клинической оценки по правилу ABCDE или при наличии черных очагов, крупных новообразований, выступающих или расположенных в местах, подвергающих их риску злокачественности за счет травмирования (в зоне нижнего белья, в акральных зонах). Неприменение дерматоскопии к розовым немеланоцитарным невусам. Использование дерматоскопии с периодичностью, не позволяющей установить профиль меланоцитарного невуса. Бессмысленное обследование пациентов без осмотра генитальных зон, ягодиц, межъягодичной зоны, ступней или скальпа (из чувства стыда или из-за несогласия пациентов на обследование данных зон). Недостаток знаний относительно факторов, которые могут влиять на дерматоскопический паттерн или доброкачественное меланоцитарное образование, и нецелесообразное хирургическое удаление (дерматоскопическое исследование загорелых пациентов или использующих автозагар, что может менять цвет дерматоскопического паттерна). Невозможность обследования без планирования контрольных осмотров (каждые три месяца, каждые 6 месяцев, каждые 12 месяцев, менее часто, никогда). |
| 2. Выбор метода дерматоскопии: |
| Неправильное нанесение иммерсионной жидкости во время дерматоскопического обследования с использованием неполяризованного света. Вероятность ошибочного диагноза меланомы, узловой или бессимптомной меланомы вследствие использования не поляризованного дерматоскопа; кристаллические структуры, блестящие белые полосы определяются в поляризованном свете. Невозможность дерматоскопического обследования при длинносрочном контроле отдельных новообразований — невозможность выявления новых очагов, неспособность оценить развитие наблюдаемых меланоцитарных новообразований, особенно медленно растущих меланом in situ с небольшим диаметром. |
Все это может привести к неверной диагностике меланомы. Полнота дерматоскопического обследования должна стать частью медицинской практики. Риск пропустить злокачественное новообразование из-за невозможности проведения тотального обследования кожных покровов всего тела составляет 2,7 % (16).
В настоящее время дерматоскопия является точным методом выявления меланомы и минимизации неоправданных иссечений (так называемое количество, требующее иссечения — NNE, определяемое как отношение общего количества удаленных новообразований к количеству удаленных меланом (17, 18).
Недостаток знаний, относящихся к факторам, которые могут повлиять на дерматоскопический паттерн новообразования, согласно правилу «4 х 4 х 6» (19), может привести к неоправданному хирургическому удалению новообразования. Кроме того, дерматоскопическое обследование загорелых пациентов или тех, кто пользуется автозагаром, что может изменить цвет дерматоскопического рисунка, часто приводит к постановке ошибочного диагноза меланомы (20–22).
Чрезвычайно важно разработать стратегию дерматоскопического контроля для пациентов в зависимости от индивидуальных особенностей. Argenziano и соавторы (23) предлагают производить дерматоскопический контроль для предварительной оценки и последующее наблюдение отдельных новообразований при необходимости каждые 3 месяца вплоть до 54 месяцев (23).
Дерматоскопию следует проводить при краткосрочном мониторинге через 3 месяца (изменение характеристик меланомы наблюдается через 2–4 месяца), среднесрочном контроле с осмотром через 6 месяцев или долгосрочным — с ежегодным осмотром (особенно для медленно растущих меланом) (23).
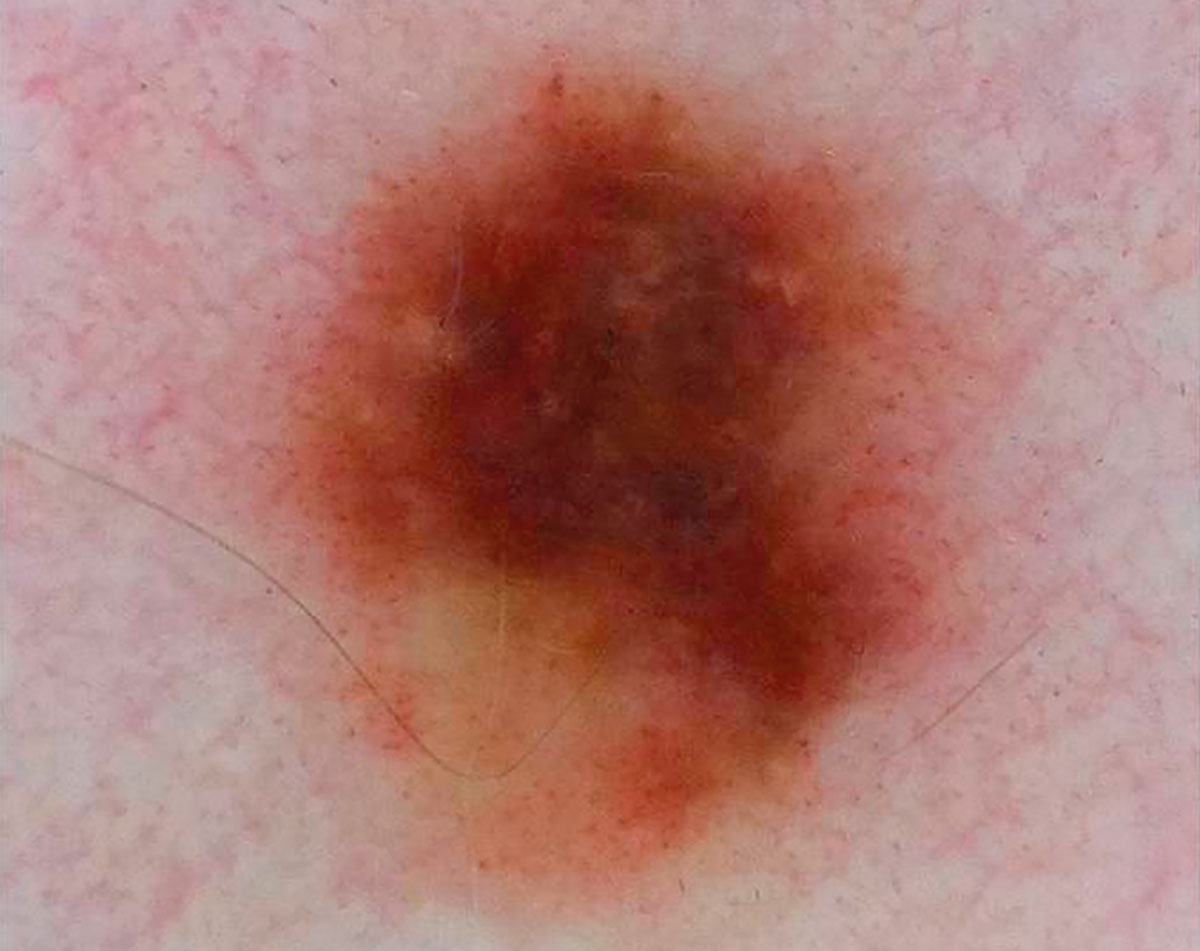
Рисунок 1. Дерматоскопический снимок меланомы in situ диаметром менее 5 мм.
Дерматоскопия показывает присутствие атипичных сосудов, атипичных глобул нерегулярного цвета, нерегулярных радиальных линий и нерегулярных многоцветных, коричневых и сине-серых участков
Степень соответствия составляет 84 % для протокола краткосрочного контроля, 64 % — для среднесрочного и 30 % — для долгосрочного (23). Периодичность контрольных осмотров зависит также от возраста пациента. Средний интервал в дерматоскопическом контроле составляет 20 месяцев (24) из-за вероятности развития медленно растущей меланомы (SGM).
Критерия для наблюдения отдельного новообразования являются асимметрия цвета, сетчатый рисунок и зоны регрессии (24). Ранние меланомы, выявленные цифровым методом, могут быть меньше в диаметре. Дерматоскопическим признаком при диагностике меланомы только лишь в контексте сравнительного исследования было небольшое увеличение диаметра очагов диаметром менее 2 мм (24).
В большом дерматоскопическом исследовании медленно растущей меланомы (25) дерматоскопическими признаками, предполагающими ее развитие, были недостаточные изменения диаметра и рост (75 % случаев) при наиболее медленном росте диаметра до 2 мм, разрушение более крупных структур, замена меланоцитарной сетки бесструктурными участками, появление новых цветовых оттенков (светло-коричневый исчезает, темно-коричневый появляется; такие цвета как красный, серый, черный и синий становятся более заметными) и новые дерматоскопические признаки меланомы, в том числе негативная сеть и сине-белая структура (25).
Выбор оптимального метода дерматоскопии
Иногда ошибка диагноза может произойти из-за небрежного использования дерматоскопии. Кроме упомянутых выше стандартных методов, для проведения дерматоскопического обследования с использованием ручного дерматоскопа важно правильно наносить иммерсионную жидкость во время дерматоскопического исследования в неполяризованном свете (2).
Вероятность ошибочного диагноза при выявлении узловой или бессимптомной меланомы может произойти из-за использования дерматоскопа с неполяризованным светом, тогда как блестящие белые полосы (кристаллы или кристаллические структуры) определяются дерматоскопами, использующими поляризованный свет (27).

Дерматоскоп Handyscope – устройство для мобильной цифровой дерматоскопии (FotoFinder)
Первое в мире устройство для цифровой теледерматоскопии, работающее на iOS и Android. В отличие от множества обычных дерматоскопов, handyscope соединяется с камерой мобильного устройства и использует специализированное программное обеспечение, включающее в себя оценку новообразований искусственным интеллектом, сервисы второго мнения и анализа клинических данных, а также сервисы защищенного облачного хранения дерматоскопических снимков.
Блестящие белые полосы указывают на злокачественность (отношение шансов: 10,534), особенно в случаях меланомы с инвазией, меланомы с высокой оценкой тотальной дерматоскопии (TDS) и тонких бессимптомных меланом (27). Кроме того, недостаточность архивных записей о предыдущих дерматоскопических обследованиях при контроле отдельных новообразований, а также невозможность определить новые очаги, неспособность оценить развитие наблюдаемых меланоцитарных новообразований, особенно медленно растущих меланом (24,25) или меланом in situ маленького диаметра, могут привести к тому, что меланома останется незамеченной.
Согласно Puig и Malvehi (28) дерматоскопическое обследование, тотальное фотографирование всего тела (TBD), цифровая дерматоскопия (DD) имеют важное значение для выявления меланомы. Цифровой контроль (DFU) у пациентов с диспластическими невусами позволяет выявить новые новообразования и изменения в существующих очагах (28).
Сочетание тотального фотографирования всего тела и цифровой дерматоскопии называется двухступенчатым методом цифрового контроля и способствует раннему выявлению меланомы на основе наблюдения макроскопических и дермоскопических изменений (29).
Ошибки, связанные с дефицитом знаний
В широком смысле ошибки, связанные с дефицитом знаний, включают диагностику и терапевтические решения, принятые в результате недостаточных знаний в области дерматоскопии. Неверный выбор новообразований для дерматоскопического обследования может быть связан с недостаточным пониманием дерматоскопического паттерна или структур, неспособностью отличить псевдоподии от периферических глобул, а также недостаток знаний различных алгоритмов дерматоскопического анализа (1, 2, 19, 30-32).
Каждый врач, выполняющий дерматоскопию, должен знать основные правила (контрольные списки): 3-точечное правило Argenziano (4, 33), 7-точечное итальянское правило (34), алгоритм, основанный на анализе паттерна («хаос и признаки») (35), австралийский метод Мензиса, 7 признаков меланомы или метод дерматоскопии Штольца и ABC-правило Блума (36), широко описанные в медицинской литературе в связи с их чувствительностью и специфичностью.
При применении правила ABCD для диагностики меланомы кожи чувствительность составляет 90,5 %, специфичность 72,4 % и диагностическая достоверность 78,1 % (36).
Результаты применения правила ABC показывают соответственно 90,5 %, 87 % и 88,1 %; метода Мензиса — 95,2 %, 77,8 %, 83,3 %; 7-признаков — 94 %, 74,6 % и 80,7 %, 7-точечного метода — 90,5 %, 87 % и 88,1 % (36). Чувствительность при использовании 3-точечного метода дерматоскопии достигает 89,6 % при 94,2 % специфичности (33).
В соответствии с 3-точечным методом следует уделить внимание асимметрии дерматоскопических правил и оценкой только лишь на основании одного из них, например, используя только правило ABCD Штольца. Поиск, например, кристаллических структур в неполяризованном свете — это не только техническая ошибка, но и ошибка, обусловленная дефицитом знаний.
Дерматоскопическая оценка отдельных немеланоцитарных новообразований должна основываться на общей структуре всего рисунка (зависит от выбранных паттернов) и локальных структурах (на основе выбранных дерматоскопических структур и признаков) и базироваться на расположении дерматоскопических структур, а не симметрии новообразования (4, 33). Также следует использовать другой нестандартный критерий — симптом «гадкого утенка» («ugly duckling» [37, 38] или симптом «fancy looking, так называемый признак «black sheep» [39]), а не только алгоритмы дерматоcкопического анализа.
Правило 4 х 4 х 6, предложенное Zalaudek и соавторами (19), позволяет клиницистам фиксировать общий паттерн и фак- торы, которые влияют на терапевтическое решение при установлении дерматоскопического диагноза отдельного меланоцитарного новообразования. Четыре дерматоскопических критерия связаны с цветом, паттерном, распределением пигмента и локализацией новообразования (19).
Шесть факторов, которые влияют на дерматоскопические действия, включают возраст, фототип кожи по Фицпатрику, историю болезни, воздействие ультрафиолета, беременность и динамику роста (19).
4 дерматоскопических критерия
| Черный | Глобульный | Многоочаговый | Акральные участки |
| Серый | Звездчатый | Необычный | Ногти |
| Коричневый | Сетчатый | Центральный | Лицо |
| Синий | Однородный синий |
Равномерный | Слизистая |
6 факторов
| Возраст | Воздействие ультрафиолета |
| Фототип кожи по Фицпатрику | Беременность |
| История болезни | Динамика роста |
Рисунок 2. Правило 4 х 4 х 6, предложенное Zalaudek и соавторами (19).
4 дерматоскопических критерия, распределенных по 4 подгруппам с 6 факторами, влияющими на терапевтическое решение, на основе дерматоскопии.
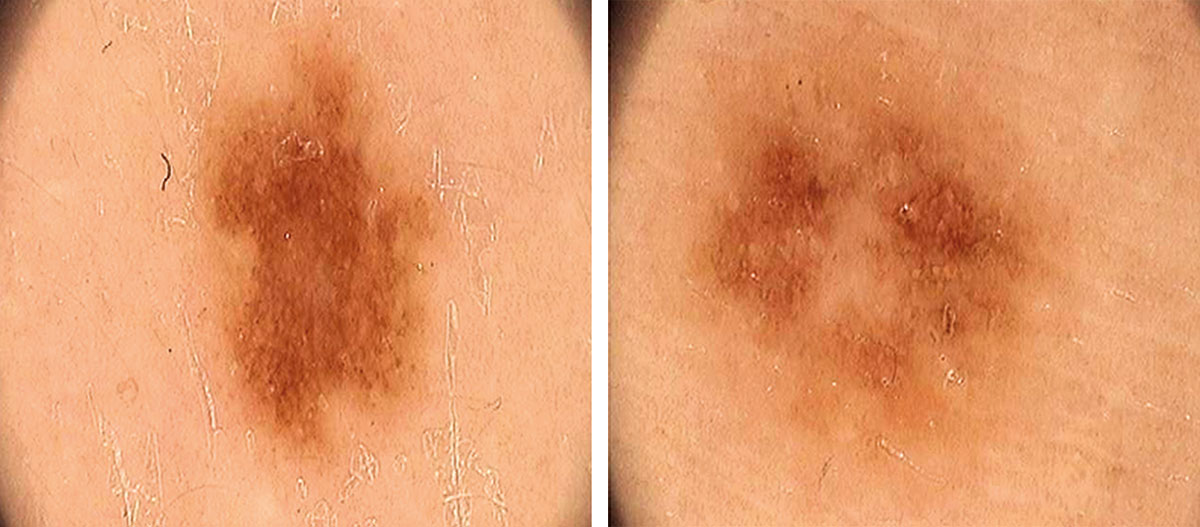
Рисунок 3. Два разных меланоцитарных новообразования у одного и того же пациента
в профиле, типичном для данного пациента
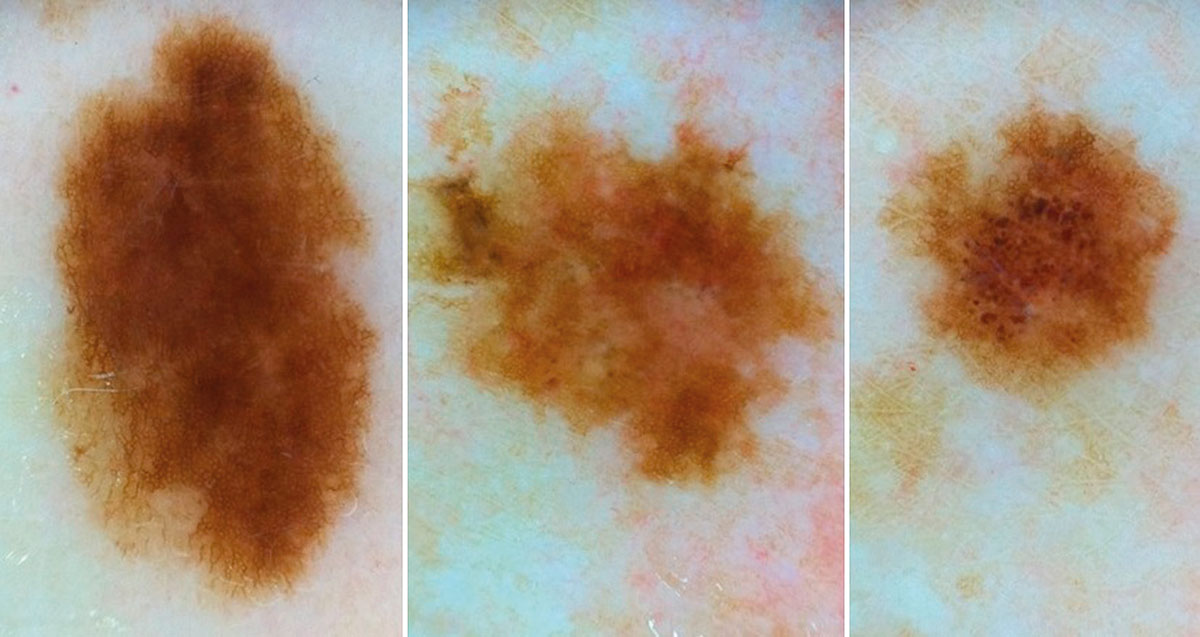
Рисунок 4. Три разных меланоцитарных новообразования у одного пациента
с дерматоскопическим профилем «подозрительное новообразование –
подлежит удалению». На деле «signature nevus», не подлежащие удалению
Правило 4 х 4 х 6, описанное ранее Zalaudek и соавторами (19), показано на Рисунке 2. В дифференциальном диагнозе меланоцитарных новообразований полезно определить так называемый профиль невуса, распространенный и характерный для большинства новообразований (6) (Рисунок 3).
Недостаточное знание критериев определения меланоцитарных новообразований и так называемых «signature nevus», характерных и индивидуальных для конкретного пациента (4) (Рисунок 4), может привести к ненужному хирургическому иссечению новообразований, которые кажутся подозрительными (например, выбор сразу 5–10 меланоцитарных новообразования для удаления во время одного обследования).
В настоящее время дерматоскопия позволяет выявлять меланому in situ диаметром менее 5 мм. В таких случаях стандартные дерматоскопические правила не работают и, следовательно, чрезвычайно важно понимать дерматоскопические признаки меланомы in situ (MIS).
Дерматоскопические признаки in situ меланом — это сетчатый рисунок, сине-серая сеть, многокомпонентная, очаговая, спитцоидная негативная сеть, сеть из глобул синего цвета и глобулярная сетчатая структура (41). Новым признаком меланомы in situ является также «mistletoe sign» (знак омелы) (42).
Меланома in situ, как правило, больше в диаметре, чем диспластический невус; атипичная сеть покрывает более половины площади, обычно присутствуют несколько типов пигментной сети, в центральной и периферийных зонах имеются бело-голубые участки регрессии (43).
В недавнем исследовании Seidenari и соавторов (44) из 22 микромеланом (диаметром менее 4 мм) 12 были определены как меланомы in situ с наиболее частым проявлением атипичной пигментной сети и нерегулярного цвета (44). В диагностике черных узелков должно применяться правило сине-черных точек.
Стандартный дерматоскопический критерий в комбинации с поиском синих и черных цветов в новообразовании дает 90,6 % точность и 92 % специфичность при выявлении узелковой меланомы (45). Предельно важным в дифференциальном дерматоскопическом анализе меланомы является понимание дерматоскопического изображения симулянтов меланомы (черного себорейного кератоза, синего невуса и многих других) (46-48).
Важно подчеркнуть, что терапевтические решения должны приниматься на основе правила 4 х 4 х 6 (19) и никогда на основе единственного дерматоскопического критерия. Что касается исследования Argenziano и соавторов (19), дерматоскопия повышает выявление ранней меланомы за счет трех главных аспектов: дерматоскопические признаки меланомы гораздо раньше выявляются при дерматоскопии, чем при клиническом обследовании; клиницисты чаще проверяют не просто подозрительные, а даже банально выглядящие новообразования и более тщательно наблюдают пациентов (49).
Полное обследование кожных покровов, наблюдение пациентов со множественными родинками, адекватная диагностика новообразований, требующих лечения; использование сравнительного подхода к пациентам с множественными невусами — это ключ к надлежащему выявлению меланомы и предотвращению базовых ошибок (49).
Таким образом, во избежание ошибочной диагностики меланомы Lallas и соавторы (5) рекомендовали обследовать все новообразования на коже, осматривать все участки тела, принимать 10-секундное решение (когда время обследования новообразования дольше, оно требует удаления), наблюдать пациентов со множественными меланоцитарными новообразованиями, всегда иссекать подозрительные узелковые новообразования и сочетать клинический критерий с дерматоскопическими, а также коррелировать клинические критерии с гистопатологическими (50).
В настоящее время дерматоскоп является незаменимым диагностическим инструментом для каждого врача, сравнимым со стетоскопом, который необходим для обследования физического состояния каждого пациента (51).
Конфликт интересов
Авторы не сообщают о конфликте интересов.
Список литературы
1. Kaminska-Winciorek G. Digital dermatology. Cornetis, Wrocław 2008.
2. Kaminska-Winciorek G, Spiewak R. Basic dermoscopy of melanocytic lesions for beginners. Postepy Hig Med Dosw (Online) 2011; 65: 501-8.
3. Zalaudek I, Kittler H, Marghoob AA, et al. Time required for a complete skin examination with and without dermoscopy: a prospective, randomized multicenter study. Arch Dermatol 2008; 144: 509-13.
4. Zalaudek I, Argenziano G, Soyer HP, et al. Dermoscopy Working Group. Three-point checklist of dermoscopy: an open internet study. Br J Dermatol 2006; 154: 431-7.
5. Blum A, Hofmann-Wellenhof R, Luedtke H, et al. Value of the clinical history for different users of dermoscopy compared with results of digital image analysis. J Eur Acad Dermatol Venereol 2004; 18: 665-9.
6. Argenziano G, Cacitrala C, Argido M. Dermoscopy of patients with multiple nevi: improvement management recommendations using a comparative diagnostic approach. Arch Dermatol 2011; 147: 46-9.
7. Kaminska-Winciorek G, Spiewak R. Tips and tricks in the dermoscopy of pigmented lesions. BMC Dermatol 2012; 12: 14.
8. Giacomel J, Zalaudek I, Mordente I, et al. Never perform laser treatment of skin tumors with clinical “EFG” criteria. J Dtsch Dermatol Ges 2008; 6: 386-8.
9. Fernandez EM, Helm KF. The diameter of melanomas. Dermatol Surg 2004; 30: 1219-22.
10. Abbasi NR, Yankowitz M, Gutkowicz-Krusin D, et al. Utility of lesion diameter in the clinical diagnosis of cutaneous melanoma. Arch Dermatol 2008; 144: 469-74.
11. Goldsmith SM. A series of melanomas smaller than 4 mm and implications for the ABCDE rule. J Eur Acad Dermatol Venereol 2007; 21: 929-34.
12. Helsing P, Loeb M. Small diameter melanoma: a follow-up of the Norwegian Melanoma Project. Br J Dermatol 2004; 151: 1081-3.
13. De Giorgi V, Savarese I, Rossari S, et al. Features of small melanocytic lesions: does small mean benign? A clinical-dermoscopic study. Melanoma Res 2012; 22: 252-6.
14. Bono A, Bartoli C, Baldi M, et al. Micro-melanoma detection. A clinical study on 22 cases of melanoma with a diameter equal to or less than 3 mm. Tumori 2004; 90: 128-31.
15. Pupelli G, Longo C, Veneziano L, et al. Small-diameter melanocytic lesions: morphological analysis by means of in vivo confocal microscopy. Br J Dermatol 2013; 168: 1027-33.
16. Argenziano G, Zalaudek I, Hofmann-Wellenhof R, et al. Total body skin examination for skin cancer screening in patients with focused symptoms. J Am Acad Dermatol 2012; 66: 212-9.
17. Argenziano G, Cerroni L, Zalaudek I, et al. Accuracy in melanoma detection: a 10-year multicenter survey. J Am Acad Dermatol 2012; 67: 54-9.
18. Chen L, Dusza S, Grazzini M, et al. Redefining the number needed to excise. Australas J Dermatol 2013; 54: 310-2.
19. Zalaudek I, Docimo G, Argenziano G. Using dermoscopic criteria and patient-related factors for the management of pigmented melanocytic nevi. Arch Dermatol 2009; 145: 816-26.
20. Orpin SD, Preston PW, Salim A. The ‘St Tropez’ sign: a new dermoscopic feature of seborrheic keratoses? Clin Exp Dermatol 2006; 31: 707-9.
21. Hofmann-Wellenhof R, Wolf P, Smolle J, et al. Influence of UVB therapy on dermoscopic features of acquired melanocytic nevi. J Am Acad Dermatol 1997; 37: 559-63.
22. Kaminska-Winciorek G. Dermatoscopy of melanocytic lesions: an influence of ultraviolet radiation. Przegl Dermatol 2008; 95: 463-7.
23. Argenziano G, Mordente, I Ferrara G. Dermoscopic monitoring of melanocytic lesions: clinical outcome and patients compliance vary according to follow-up protocols. Br J Dermatol 2008; 159: 331-6.
24. Argenziano G, Kittler H, Ferrara G, et al. Slow-growing melanoma: a dermoscopy follow-up study. Br J Dermatol 2010; 162: 267-73.
25. Terushkin V, Dusza SW, Scope A, et al. Changes observed in slow-growing melanomas during long- term dermoscopic monitoring. Br J Dermatol 2012; 166: 1213-20.
26. Jaimes N, Marghoob AA. The morphologic universe of melanoma. Dermatol Clin 2013; 31: 599-613.
27. Shitara D, Ishioka P, Alonso-Pinedo Y. Shiny white streaks: a sign of malignancy at dermoscopy of pigmented skin lesions. Acta Derm Venereol 2014; 94: 132-7.
28. Puig S, Malvehy J. Monitoring patients with multiple nevi. Dermatol Clin 2013; 31: 565-77.
29. Salerni G, Carrera C, Lovatto L, et al. Characterization of 1152 lesions excised over 10 years using total body photography and digital dermatoscopy in the surveillance of patients at high risk for melanoma. J Am Acad Dermatol 2012; 67: 836-45.
30. Soyer HP, Argenziano G, Ruocco V, et al. Dermoscopy of pigmented skin lesions. Eur J Dermatol 2001; 11: 270-6.
31. Zalaudek I, Kreusch J, Giacomel J, et al. How to diagnose nonpigmented skin tumors: a review of vascular structures seen with dermoscopy: part II. Nonmelanocytic skin tumors. J Am Acad Dermatol 2010; 63: 377-86.
32. Zalaudek I, Manzo M, Savarese I, et al. The morphologic universe of melanocytic nevi. Semin Cutan Med Surg 2009; 28:149-56.
33. Soyer HP, Argenziano G, Zalaudek I, et al. Three-point checklist of dermoscopy. A new screening method for early detection of melanoma. Dermatology 2004; 208: 27-31.
34. Argenziano G, Catricalà C, Ardigo M, et al. Seven-point checklist of dermoscopy revisited. Br J Dermatol 2011; 164: 785-90.
35. Kittler H. Dermatoscopy: introduction of a new algorithmic method based on pattern analysis for diagnosis of pigmented skin lesions. Dermatooncology: Dermatol Pract Concept 2007; 13: 1.
36. Blum A, Rassner G, Garbe C. Modified ABC-point list of dermoscopy: a simplified and highly accurate dermoscopic algorithm for the diagnosis of cutaneous melanocytic lesions. J Am Acad Dermatol 2003; 48: 672-8.
37. Carli P, Chiarugi A, de Giorgi V. Examination of lesions (including dermoscopy) without contact with the patient is associated with improper management in about 30% of equivocal melanomas. Dermatol Surg 2005; 31: 169-72.
38. Scope A, Dusza SW, Halpern AC, et al. The “ugly duckling” sign: agreement between observers. Arch Dermatol 2008; 144: 58-64.
39. Thomas L. Braun R. Atlas of dermatoscopy. Urban & Partner, Wrocław 2008.
40. Argenziano G, Albertini G, Castagnetti F, et al. Early diagnosis of melanoma: what is the impact of dermoscopy? Dermatol Ther 2012; 25: 403-9.
41. Seidenari S, Bassoli S, Borsari S, et al. Variegated dermoscopy of in situ melanoma. Dermatology 2012; 224: 262-70.
42. Kaminska-Winciorek G, Właszczuk P, Wydmański J. “Mistletoe sign” probably a new dermoscopic descriptor fro melanoma in situ and melanocytic junctional nevus in the inflammatory stage. Postep Derm Alergol 2013; 30: 316-9.
43. Seidenari S, Ferrari C, Borsari S, et al. The dermoscopic variability of pigment network in melanoma in situ. Melanoma Res 2012; 22: 151-7.
44. Seidenari S, Ferrari C, Borsari S, et al. Dermoscopy of small melanomas: just miniaturized dermoscopy? Br J Dermatol 2014; 171: 1006-13.
45. Argenziano G, Longo C, Cameron A, et al. Blue-black rule: a simple dermoscopic clue to recognize pigmented nodular melanoma. Br J Dermatol 2011; 165: 1251-5.
46. Kaminska-Winciorek G, Wydmanski J. Benign simulator of melanoma on dermoscopy-black colour does not indicate always melanoma. J Preclin Clin Res 2013; 1: 6-12.
47. Kaminska-Winciorek G. Letter: “Blue pseudo-veil sign” – a new dermoscopic term? Dermatol Surg 2012; 38: 1574-5.
48. Kamińska-Winciorek G, Spiewak R. Dermoscopy on nevus comedonicus: a case report and review of the literature. Postepy Dermatol Alergol 2013; 30: 252-4.
49. Argenziano G, Albertini G, Castagnetti F, et al. Early diagnosis of melanoma: what is the impact of dermoscopy? Dermatol Ther 2012; 25: 403-9.
50. Lallas A, Zalaudek I, Apalla Z, et al. Management rules to detect melanoma. Dermatology 2013; 226: 52-60.
51. Zalaudek I, Lallas A, Moscarella E, et al. The dermatologist’s stethoscope-traditional and new applications of dermoscopy. Dermatol Pract Concept 2013; 3: 67-71.