Лекция
1.
Аналитическая
химия – не
просто дисциплина, накапливающая и
систематизирующая знания; эта наука
имеет огромное практическое значение
в жизни общества, она создает средства
для химического анализа и обеспечивает
его осуществление – в этом ее главное
предназначение. Без эффективного
химического анализа невозможно
функционирование ведущих отраслей
народного хозяйства, систем охраны
природы и здоровья населения, оборонного
комплекса, невозможно развитие многих
смежных областей знания.
Ошибки при количественном анализе.
По своему характеру
ошибки анализа подразделяются на
систематические, случайные и промахи.
-
Систематические
– погрешности, одинаковые по знаку и
влияющие на результат в сторону его
увеличения, либо в сторону уменьшения.
а)
Методические – это ошибки, которые
зависят от особенности применяемого
метода (неполное протекание реакции,
частичное растворение осадка, свойство
индикатора).
б)
Оперативные – недостаточное промывание
осадка на фильтре, ошибки
приборные
или реактивов, неравноплечность весов.
в)
Индивидуальные – ошибки лаборантов
(способность точно определять
окраску
при титровании, психологические ошибки).
г)
Приборные
или реактивные (эти ошибки связаны с
недостаточной точностью используемых
приборов, ошибки лаборанта).
-
Случайные
— они неизбежны при любом определении.
Они могут быть значительно уменьшены
при увеличении числа параллельных
определений. -
Промахи
— грубые ошибки, которые обусловлены
от неправильного подсчета разновесок,
поливания части раствора, просыпания
осадка.
Чувствительность, правильность и точность анализа.
Чувствительность
– минимальная определяемая концентрация
вещества.
Правильность
– близость полученного результата к
истинному.
Точность
— характеристика
воспроизводимости определения от опыта
к опыту. Анализ считается выполненным
более точным, чем меньше различаются
результаты параллельных определений
между собой.
Абсолютная
ошибка –
разность между полученным результатом
и истинным или наиболее достоверным
значением.
Относительная
ошибка – отношение абсолютной ошибки
к истинному значению.
Группы методов анализа.
Принято
делить методы анализа на три большие
группы:
-
химические
методы анализа
— когда данные получаются в результате
выделения осадка, выделения газа,
изменения цвета окраски; -
физико-химические
методы анализа
— может быть зафиксировано какое-нибудь
физическое или химическое изменение
величин; -
физические
методы анализа
К
химическим методам относят:
-
гравиметрический
(весовой) анализ -
титриметрический
(объемный) анализ -
газоволюмометрический
анализ
К
физико–химическим методам относят все
способы инструментального анализа:
-
фотоколориметрический
-
спектрофотометрический
-
нефелометрический
-
потенциометрический
-
кондуктометрический
-
полярографический
К
физическим относятся:
-
спектральный
эмиссионный -
радиометрический
(метод меченых атомов) -
рентгеноспектральный
-
люминесцентный
-
нейтронно-активизационный
-
эмиссионный
(пламенная фотометрия) -
атомно-абсорбционный
-
ядерно-магнитный
резонанс
Лекция
2. Гравиметрический
метод анализа.
Гравиметрический
анализ основан на точном измерении
массы определяемого вещества в виде
соединения или простого вещества
определенного состава. Основным
инструментом являются весы.
Гравиметрические
методы подразделяются на две подгруппы:
I.
методы осаждения
II.
методы отгонки.
В
методах осаждения
навеску анализируемого вещества
переводят в раствор, после этого
определяемый элемент осаждают в виде
малорастворимого соединения. Выпавший
осадок отделяют фильтрованием, тщательно
промывают или высушивают, и точно
взвешивают. По массе осадка и его формуле
рассчитывают содержание определенного
элемента в % по массе.
В
методах отгонки
определяемый компонент удаляют в виде
летучих продуктов, и по убыли в весе
судят о содержании элемента.
Требования
к осадкам:
Осаждаемой
формой – называют то соединение, которое
образуется при взаимодействии с реагентом
– осадителем,
а весовой формой – соединение, которое
взвешивают для получения окончательного
результата анализа.
Например,
при определении кремния в чугунах формой
осаждения является кремниевая кислота
H2SiO3·nH2O,
а весовой формой является безводная
двуокись кремния, получающаяся в
результате прокаливания при температуре
около 1000оС.
иногда осаждаемая и весовая форма могут
представлять собой одно и тоже соединение.
Например, при определении серы весовым
методом ее осаждают из раствора, и
взвешивают в виде сульфата бария, который
при прокаливании химически не изменяется.
Требования
к осаждаемой форме:
1)
Малая растворимость осаждаемой формы
соединения, содержащего определенное
вещество и как более низкое содержание
в ней определяющего вещества.
осаждаемая
форма весовая форма
Требование
к осаждению – малая растворимость.
Произведение
растворимости
К
ним относятся: AgCl,
BaSO4,
Fe(OH)3,
Sb2S3
2)
Структура осадка должна отвечать
условиям фильтрования и позволять
отмывку осадков с достаточной скоростью.
Мелкокристаллические
осадки, могут пройти через поры фильтра.
Наиболее удобны крупнокристаллические
осадки, т.к. они не забивают поры фильтра,
имеют слабо развитую поверхность, мало
адсорбируют посторонние ионы и легко
отмываются от них. Фильтруются через
фильтр средней плотности, маркируемый
Белой лентой. Аморфные осадки, например,
многие гидроксиды имеют сильно развитую
поверхность, адсорбируют посторонние
вещества из раствора и трудно от них
отмываются. Фильтрование таких осадков
проводят через неплотный фильтр,
маркируемый Красной лентой. Самые
мелкокристаллические осадки (например,
BaSO4),
фильтруются через фильтр с Синей лентой.
Окклюзия
– внедрение посторонних ионов в структуру
кристаллической решетки.
BaSO4
-
°
xBa+2
°
x
x
°
K+
°
K+
— 1, 37 A
Na+
— 0, 95 A
Ba+2
-1,35 A
3)
Важно, чтобы осаждаемая форма легко
переходила в весовую.
Осаждаемая
и весовая формы должны быть химически
инертными, чтобы не приводить к
количественным ошибкам.
Пример:
1)
2)
CaO
— высокореакционное вещество, это
означает, что оно может «захватить»
пары воды или углекислый газ
б
лента
красная
лента фильтры
синяя
лента
Требования
к весовой форме:
-
Точное
соответствие ее состава химической
формуле. Если такого соответствия нет,
вычисление результатов невозможно.
-
Химическая
устойчивость весовой формы.
-
Содержание
определяемого в весовой форме должно
быть как можно меньшим, тогда погрешности
определения меньше скажутся на
окончательном результате анализа.
Искомое
процентное содержание ( Р ) рассчитывают
по формуле:
,
где
b
– количество весовой формы
a
– навеска исследуемого вещества
F
– фактор пересчета
Фактор
пересчета показывает, скольким граммам
определяемого элемента соответствует
1 г весовой формы.
Из
двух возможных гравиметрических методов
определения элемента при прочих равных
условиях будет более точным тот, для
которого фактор пересчета будет меньше.
;
;
Анализ
может быть:
а)
частным – определяется один или несколько
веществ, а другие не интересуют
б)
полным – на содержание всех входящих
составных частей (Σ = 100%).
Полный
анализ проводится для того, чтобы узнать
все составные части данного вещества.
Цемент
– CaO, MgO, Fe2O3,
Al2O3,
SiO2,
CaSO4,
SO3.
FeCl3
+ NH4OH
→ Fe2(OH)3.
Классификация погрешностей на систематические, случайные и грубые (промахи) с указанием некоторых причин их возникновения дана в разделе 1.5. Инструментальные ошибки в химическом анализе связаны с точностью взвешивания на аналитических весах и точностью измерения объемов мерной посудой. Методические ошибки обусловлены особенностями реакции, лежащей в основе метода, и неправильно составленной методикой анализа. В терминах теории информации случайные погрешности соответствуют шумам в канале передачи информации, систематические погрешности — помехам, а грубые — нарушениям канала связи. [c.129]
К систематическим ошибкам И типа относятся инструментальная, реактивная, методическая ошибки (включая индикаторную), эталонная ошибка и некоторые другие. Инструментальная ошибка. Каждый прибор, используемый для измерения, вносит в результаты измерения погрешности, часть из кото рых имеет характер случайных, а часть — систематических ошибок. Поскольку случайные ошибки рассматриваются и учитываются в совокупности, имеет смысл попытаться вычленить систематическую составляющую инструментальной ошибки химического анализа. Систематический характер носят ошибки калибровки приборов. Так, например, истинный объем мерной посуды (бюреток, пипеток, мерных колб) никогда в точности не соответствует номиналу, указанному на заводском клейме или в паспорте. Разница между истинным значением и номиналом тем меньше, чем выше класс точности измерительного прибора и обычно не превышает цены наименьшего деления на измерительной шкале. В частности, каждый конкретный экземпляр мерной посуды содержит свою персональную систематическую ошибку, завышающую или занижающую измеряемый объем в сравнении с номиналом. Для того чтобы оценить величину этой ошибки, следует провести калибровку посуды — найти достаточно точный вес точно отмеренного объема чистой жидкости (например, дистиллированной воды), а затем вычислить объем, используя точное справочное значение плотности жидкости при заданной температуре рн< [c.25]
Методическая ошибка — одна из наиболее трудно поддающихся учету систематических погрешностей химического анализа, которая складывается из погрешностей отдельных химических операций. Ни процессы разложения, ни процессы синтеза химических соединений, равно как и процессы разделения компонентов, которые всегда связаны с образованием новых фаз, никогда не проходят до конца. Стремление любой физико-химической системы к максимуму энтропии и минимуму энергии Гиббса всегда как бы- противодействует стремлению аналитика-экспериментатора выделить полностью определяемый компонент и нацело превратить его в аналитически активное соединение. По той же причине даже условие практической полноты образования и выделения соединений определяемого компонента никогда не гарантирует его чистоты от примесей других компонентов. [c.46]
Методические ошибки химического анализа [c.46]
По источникам происхождения погрешности (ошибки) химического анализа подразделяют на инструментальные, реактивные, методические, погрешности пробоотбора и т. п. Часто в названии содержатся еще более конкретные указания на природу (источник) ошибок —индикаторная ошибка, ошибка соосажде-ния, ошибка натекания, капельная ошибка. [c.23]
В повседневной практике работы аналитических лабораторий принято подсчитывать ошибки, характеризую-щ,ие расхождение результатов анализов, выполненных двумя разными методами или одним -методом, но в разных лабораториях. В этом случае надо иметь в виду, что, во-первых, d Ф О, так как каждый из методов может иметь некоторую постоянную ошибку а, а во-вторых, наряду с ошибками воспроизводимости могут иметь место случайные методические ошибки S n-хим, обусловленные особенностями химического и фазового состава проб. Результаты подобных подсчетов можно интерпретировать следующим выражением [c.58]
Рассмотрим в качестве примера возможность применения выражения (6.16) при оценке доверительного предела для методической ошибки химического анализа в пробах неизвестного состава, если правильность анализа контролируется по небольшому числу стандартных образцов. Допустим, что в лаборатории была проанализирована большая партия проб неизвестного состава и вместе с ними для оценки методических ошибок анализировалось т стандартных образцов, причем для каждого стандарт- [c.172]
Индикаторная ошибка. Своеобразным видом методической ошибки титриметрических методов анализа является индикаторная ошибка. Эта ошибка возникает в связи с тем, что индикатор вступает в реакцию взаимодействия с титрантом либо несколько раньше, либо несколько позже точки эквивалентности. Поскольку взаимодействие определяемого компонента и индикаторного вещества -с титрантом подчиняется законам химического равновесия, момент вступления индикатора в реакцию определяется как прочностью обоих образующихся соединений (константой образования), так и соотношением концентраций искомого компонента и индикатора. Из всех этих величин только концентрация индикатора не является закрепленной и может варьироваться в тех или иных пределах. [c.33]
Результаты первых анализов оказались. ..неверными Вкрались методические ошибки, сразу не обнаруженные, которые давали завышенное содержание золота. Слишком велика была вера в классическое химическое пробирное искусство. Вначале не было также навыков по разделению микроколичеств золота и серебра, в результате чего выделялось золото, содержащее серебро. Профессору Габеру потребовалось длительное время, чтобы найти самые существенные источники ошибок и исключить их. В конце концов с помощью усовершенствованного метода он мог определить с достоверностью даже миллионную часть миллиграмма (1г) золота. Совершенно не была учтена возможность занесения микроколичеств золота извне. Золото в виде следов присутствует повсюду в реактивах, сосудах, посуде. Это — небольшие количества, но их достаточно, чтобы исказить результат микроанализа и привести к нереально завышенным значениям. [c.93]
Систематические ошибки связаны с закономерным изменением внешних и внутренних параметров, определяющих интенсивность аналитической линии, при переходе от одних условий анализа к другим или от одного образца к другому. В процессе измерений они, как правило, остаются постоянными или изменяются по определенному закону. К систематическим относятся ошибки, в основном обусловленные недостатками иди несовершенством методических приемов по учету влияния химического состава образца на результаты определений, например неучтенные влияния матричных эффектов, а также ошибки такого характера, как несоответствие истинного состава эталонного образца его паспортным данным, неправильная градуировка аппаратуры, ее конструктивные недостатки и неисправности, различие геометрических параметров измерений эталонного и исследуемого образца, систематически неправильные действия исследователя и т. д. [c.28]
Физико-химические методы, как правило, используют на последнем этапе химико-аиалитичеекого процесса. Измерения с помощью приборов существенно влияют на качество полученных результатов. Однако возникнрвение ошибок возможно и на других этапах анализа. На этапах 2, 3, 4 преобладают ошибки, часто называемые методическими ошибками химического анализа. Ошибки, преобладающие на этапах анализа 1 и 5, относят к инструментальным ошибкам они возникают в результате всевозможных помех при формировании, передаче и регистрации сигналов измерительных приборов. [c.231]
| Рис. 29. Рассеяние точек, характеризующих абсолютные методические ошибки химического анализа шлаков при определении СаО, SiOa, FeO, MnO и MgO. | 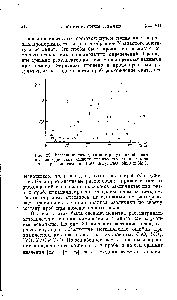 |
В связи с этим была сделана попытка рассматривать методические ошибки химического анализа как случайные величины. На рис. 29 показано рассеяние точек, характеризующих абсолютные методические ошибки при химическом анализе шлака на компсгненты СаО, SiOj, ГеО, МпО и MgO. По оси абсцисс здесь отложены содержания определяемого компонента в пробе, а по оси ординат вначения Дс = с — Сп , где с—средний результат анализа [c.210]
Перевод определяемого компонента в аналитически активную форму. Этот этап предшествует конечному определению и, как правило, состоит в добавлении специфических реагентов (осадителей, комплексан-тов, восстановителей, окислителей и т. д.), которые практически нацело переводят анализируемый компонент в форму, удобную для конечного определения. Как и предыдущий, он отягощен, с одной стороны, ошибками, возникающими вследствие неполного образования соединений, и, с другой — ошибками за счет образования схожих соединений других компонентов (соосаждение, соокисление и т. д.). Ошибки предыдущего и настоящего этапов часто объединяют под общим названием методической ошибки химического анализа.. [c.13]
К второму типу можно отнести погрешности известной природы, значения которых могут быть оценены в ходе химического анализа или при постановке специального эксперимента. К ним относятся инструментальные, реактивные ошибки, ошибки отдельных стадий химического анализа — методические погрешности. Если исследователь может оцешггь ошибки отдельных стадий и операций, то, по закону сложения погрепшостей, он может вычислить общую погрешность результата анализа. В табл. 2.1 приведены расчеты абсолютных и относительных погрешностей некоторых фующий. [c.40]
Ко второму типу можно отнести погрешности известной природы, значения которых могут быть оценены в ходе химического анализа или при постановке специального эксперимента. К ним относятся инструментальные, реактивные ошибки, ошибки отдельных стадий химического анализа — методические погрешности. Если исследова- [c.65]
К ошибкам этого же типа в значительной мере можно отнести также индикаторные ошибки в титриметрических методах, поскольку во многих случаях их можно предрассчитать. В какой-то мере возможна приближенная оценка отдельных видов методической ошибки и в других методах химического анализа. Однако обычно методические ошибки включают в себя отдельные слагаемые, обусловленные не только неполнотой протекания равновесных процессов или параллельным протеканием сопроцессов , но и неравновесностью отдельных стадий химико-аналитических процессов, т. е. связанные с кинетическими факторами. [c.25]
Методическая ошибка — одна из наиболее трудно-поддающихся учету систематических ошибок химического-анализа, которая складывается из ошибок отдельных химических операций. Ни процессы разложения, ни процессы синтеза химических соединений,, равно как и процессы разделения компонентов, которые всегда связаны с образованием новых фаз, никогда не проходят до конца. Стремление любой физико-химической системы к максимуму энтропии и минимуму свободной энергии всегда как бы противодействует стремлению аналитика-экспериментатора выделять нацело определяемый компонент и нацело превращать его в аналитически активное соединение. По той же причине даже условие практической полноты образования и выделения соединений определяемога компонента никогда не гарантирует его чистоты от примесей других комйонентов. Труд химика-аналитика — это, образно говоря, постоянная борьба с тенденцией хаоса, равновероят-нрго распределения и перемешивания компонентов труд аналитика — созидательный труд, направленный на уменьшение энтропии и получение информации от химико-аналитической системы. Вполне естественно, что работа подобного рода отягощена помехами принципиального характера. [c.30]
Предсказания возможности колебаний в химических системах, подобных только что описанной, делались, начиная с 1910 г. (работы Лотка), на основе анализа системы дифференциальных уравнений. Одиако первые математические модели соответствовали совершенно невозможным реакциям. К тому же все попытки экспериментального обнаружения колебательных реакций долгое время оставались слаборезультативными в каждой из предложенных систем можно было углядеть либо методические ошибки, либо нехимический источник колебаний. Действительно, если в произвольную химическую систему ввести таймер , который будет, иапример, периодически вбрасывать 0 реактор допмнительные порции реагентов, — очевидно, возникнут и колебания скорости. Такие колебания аналогичны вынужденным колебаниям в механике. Но собственные колебания, задаваемые внутренним таймером в химических системах, долгое время найти не удавалось. [c.128]
Если отбросить ошибку пробоотбора, как непосредственно не относящуюся к методу анализа, то общая ошибка складывается из ошибок измерений и ошибок, связанных с химическими реакциями. Как правилр, ошибки измерений должны быть меньше, чем ошибки метода. В то время как ошибками измерений можно пренебречь, как это постоянно делается в физических исследованиях, для методических ошибок это не удается или удается лишь в исключительных случаях. Их описание, равно как и описание общей ошибки, возможно только с помощью методов математической статистики. [c.25]
Клинико-химические, как и все количественные измерения, принципиально отягощены возможностью ошибок. Весь процесс клинического исследования можно разделить на 4 этапа: взятие пробы, хранение пробы, анализ, оценка и выдача результата. Ошибки, возникающие на разных этапах работы, бывают внелабораторного и внутрилабораторного характера.
Внелабораторные ошибки
Существенным источником внелабораторных ошибок является трудность учета времени последнего приема пищи больным. Поэтому следует унифицировать время взятия крови и применять для исследования кровь, взятую натощак. Эмоциональное состояние пациента, время суток, положение тела больного оказывают влияние на количественные и качественные показатели крови.
Все указанные выше факторы погрешностей связаны с состоянием больного. Но нельзя недооценивать и ряд других факторов, которые также отражаются на качестве результатов: техника взятия крови, используемые при этом инструменты, сосуды, в которых хранится кровь. Иглы, применяемые для взятия крови, должны иметь достаточно большой диаметр, чтобы не возникало повреждения эритроцитов. Посуда и инструменты для взятия крови не должны содержать следов моющих средств, должны быть сухими.
Весьма существенной причиной возникновения погрешностей анализа является нарушение условий хранения проб. Уже одно более длительное стояние сыворотки над эритроцитами может привести к изменению концентраций компонентов. Сыворотка должна быть отделена от кровяного сгустка не позднее двух часов после взятия крови.
Упомянутые источники погрешностей не поддаются качественному и количественному контролю, их в большинстве случаев не очень легко распознать, исключить погрешности можно только тщательной и кропотливой работой. Следует добиться стандартизованных условий, обязательных при взятии проб крови. Необходимо регулярное инструктирование персонала клиник и амбулаторий о правилах и условиях сбора и хранения материала для различных клинико-диагностических исследований.
Внутрилабораторные ошибки
Надежность результатов исследования при проведении анализов в лаборатории зависит от целого ряда факторов. Погрешность в аналитическом процессе — это внутрилабораторные ошибки, появление и предупреждение которых зависит только от работников лабораторий.
Результаты анализов в большой мере зависят от индивидуальных способностей лабораторного персонала, важным фактором является и качество применяемых измерительных инструментов. Существенным источником ошибок является приготовление стандартных растворов, который может иметь иную концентрацию, чем должна быть по расчету. Многочисленность применяемых методов, из которых большая часть уже устарела, также является частой причиной многих ненадежных результатов. Помочь этому может последовательное внедрение унифицированных методов.
Наиболее распространена следующая классификация ошибок. Различают три основных вида ошибок: грубые, случайные и систематические.
Грубая ошибка — это одиночное значение исследуемого компонента, выходящее за пределы установленного для данного компонента области (за допустимые пределы погрешности). Причиной грубых ошибок является недостаточная тщательность в работе.
Случайная ошибка — одиночное значение, не выходящее за пределы установленной для данного компонента области. Случайными называются неопределенные по величине и знаку ошибки, в появлении каждой из которых не наблюдается какой-либо закономерности. Эти ошибки происходят при любом аналитическом определении. Наличие их сказывается в том, что повторные определения того или иного компонента в данном образце, выполненные одним и тем же методом, дают как правило несколько различающиеся между собой результаты. Случайные ошибки практически невозможно исключить совсем, они могут возникать из-за негомогенности пробы материала, недостаточно высокого качества оборудования, чаще случайные ошибки вызываются субъективными факторами. Этот вид ошибок можно значительно ограничить после оценки их размера, величина ошибки (разброс данных) является мерилом воспроизводимости лабораторных результатов. Чем меньше величина случайных ошибок, тем лучше воспроизводимость исследований. Распространенным способом характеристики воспроизводимости результатов является величина среднеквадратического отклонения.
Для суждения о правильности анализа совпадение или расхождение результатов параллельных проб не имеет значения. В этом случае на первый план выступают систематические ошибки.
Систематическими ошибками называют погрешности, одинаковые по знаку, имеющие определенную причину, влияющие на результат либо в сторону увеличения, либо в сторону уменьшения его. Систематические ошибки можно обычно предусмотреть или же ввести соответствующие поправки (ошибки методического характера). Систематические ошибки повторяются при каждом измерении, так как они вызываются постоянными причинами, влияют они на всю серию определений. В качестве причин могут выступать ошибки приборов (автоматические анализаторы, фотоэлектроколориметры) и неправильное приготовление реактивов, индивидуальные особенности работника (ошибочное восприятие окраски пробы). С введением биохимических анализаторов и автоматических дозаторов число случайных ошибок (ошибок манипуляций) уменьшается, но возрастает необходимость контроля за появлением систематических ошибок и увеличивается необходимость в контрольных материалах для их обнаружения. Величина систематической ошибки характеризует правильность результатов анализа.
Общепринятым способом выявления случайных ошибок служит постановка анализа в двух и более параллельных пробах. Для исключения случайных ошибок большое значение может иметь последовательная регистрация анализов, проводимых повторно у одного и того же больного. Регистрация и сопоставление результатов с динамикой клинического течения заболеваний позволяет лаборатории своевременно обратить внимание на немотивированный «скачок» того или иного показателя, который мог быть обусловлен случайной ошибкой.
Обнаружение и предупреждение систематических ошибок составляет более сложную задачу. Необходимо тщательное подведение итогов ежедневной работы лаборатории. Если оказывается, что в один из дней все или большинство результатов по данной методике сдвинуты в какую либо сторону, это должно натолкнуть на мысль о систематической ошибке, необходима самая тесная связь с клиникой.
Возникновению ошибок необходимо противопоставить постоянное измерение точности выполнения анализов, надежность работы лаборатории, т.е. контроль качества исследований.
Для
выявления ошибок и их численной оценки
(особенно при разработке новых
аналитических методик) количественный
анализ повторяют несколько раз, т.е.
проводят параллельные
определения. Под
параллельными определениями понимают
получение нескольких результатов
единичных определений для одной и той
же пробы в одинаковых условиях.
Пусть
μ
— истинное
значение определяемой величины; Х1,
Х2,
…, Хi,
…, …, Хn
— измеренные
(единичные) значения определяемой
величины — результаты единичных
определений; п- общее
число единичных определений.
Под
единичным определением понимают
однократное проведение всей
последовательности операций,
предусмотренных методикой анализа.
Результат единичного определения- это
значение содержания определяемого
компонента, найденное при единичном
определении.
Иногда
(часто) вместо истинного значения
определяемой величины μ
используют действительное
значение содержания а
(или просто
действительное
значение а),
под которым
подразумевают экспериментально
полученное или расчетное значение
определяемого содержания, настолько
близкое к истинному, что для данной цели
может быть использовано вместо него.
Тогда величина

есть
среднее
арифметическое (среднее) из
результатов единичных определений.
Считается, что х–
— наиболее вероятное значение определяемой
величины, более вероятное, чем каждое
отдельное значение Хi.
Под
правильностью
результата
анализа понимают качество анализа,
отражающее близость к нулю разности
между средним арифметическим и истинным
μ
(или действительным а)
значением определяемой величины:

Другими
словами, правильность результата анализа
отражает близость полученного среднего
значения х–
к истинному (или действительному)
значению определяемой величины.
Воспроизводимость
результата
анализа характеризует степень близости
результатов единичных определений Хi,
друг к другу.
Правильность
и воспроизводимость результата анализа
зависят от различного типа ошибок.
1.4.2. Классификация ошибок количественного анализа.
Ошибки
количественного анализа условно
подразделяют
на систематические,
случайные и грубые.
Грубые
ошибки,
обусловленные
несоблюдением методики анализа, очевидны.
Они устраняются при повторном проведении
анализа с соблюдением всех требуемых
условий, предусмотренных методикой
анализа.
а)
Систематическая ошибка
Различают:
систематическую
ошибку и
процентную
систематическую ошибку.
Систематическая
ошибка результата
анализа Δ0
— это статистически значимая разность
между средним х–
и действительным а
(или истинным
μ)
значениями содержания компонента:

Систематическая
ошибка результата анализа может быть
больше нуля, меньше нуля или равна нулю.
Процентная
систематическая ошибка (относительная
величина систематической ошибки) —
это систематическая ошибка, выраженная
в процентах от действительного значения
а
(или истинного
значения μ)
определяемой величины:
δ
= (х–
– а)∙100%
/ а
или δ = (х–
– μ)•100% / μ (1.3)
Для
относительной величины систематической
ошибки вместо символа 5 используют
также обозначение Δ0
%.
Систематическая
ошибка характеризует правильность
результатов анализа; поэтому правильность
анализа можно определить так же, как
качество анализа, отражающее близость
к нулю систематической ошибки.
Систематические
ошибки обусловлены либо постоянно
действующими причинами (и поэтому они
повторяются при многократном проведении
анализа), либо изменяются по постоянно
действующему закону, который можно
учесть.
Так,
например, процентная систематическая
ошибка (Δс/с)•100% фотометрических
определений (с
— концентрация,
Δс — систематическая ошибка определения
концентрации фотометрическим методом)
минимальна в интервале изменений
оптической плотности А
от А
≈ 0,2 до А
≈ 0,8 и
составляет (Δс/с)•100% < 0,4%.
Источники
систематических ошибок. Невозможно
с исчерпывающей полнотой перечислить
все источники систематических ошибок.
Основными являются следующие.
Методические
— обусловлены
особенностями методики анализа. Например,
аналитическая реакция прошла не до
конца; имеются потери осадка вследствие
его частичной растворимости в растворе
или при его промывании; наблюдается
соосаждение примесей с осадком, вследствие
чего масса осадка возрастает, и т.д.
Инструментальные
— обусловлены
несовершенством используемых приборов
и оборудования. Так, например,
систематическая ошибка взвешивания на
лабораторных аналитических весах
составляет ±0,0002 г. Систематическая
ошибка в титриметрических методах
анализа вносится вследствие неточности
калибровки бюреток, пипеток, мерных
колб, цилиндров, мензурок и т.д.
Индивидуальные
— обусловлены
субъективными качествами аналитика.
Так, например, дальтонизм может влиять
на определение конечной точки титрования
при визуальной фиксации изменения
окраски индикатора.
В
конечном итоге правильность результатов
анализа определяется наличием или
отсутствием именно систематических
ошибок.
Существуют способы
выявления систематических ошибок.
а)
Использование стандартных, образцов.
Общий состав
стандартного образца должен быть близким
к составу анализируемой пробы, а
содержание определяемого компонента
в стандартном образце должно быть точно
известно.
Анализ
стандартного образца — наиболее надежный
способ выявления наличия или отсутствия
систематической ошибки и оценки
правильности результата анализа.
б) Анализ
исследуемого объекта другими методами.
Исследуемый
объект анализируют методом или методами,
которые не дают систематической ошибки
(метрологически аттестованы), и сравнивают
результаты анализа с данными, полученными
при анализе того же объекта с использованием
оцениваемой методики или не аттестованного
оборудования. Сравнение позволяет
охарактеризовать правильность оцениваемой
методики анализа.
в)
Метод добавок или метод удвоения —
используют при отсутствии стандартных
образцов и метрологически аттестованной
методики (метода) анализа.
Анализируют
образец, используя оцениваемую методику.
Затем удваивают массу анализируемой
пробы или увеличивают (уменьшают) массу
в иное число раз, снова находят содержание
определяемого компонента в уже новой
пробе и сравнивают результаты анализов.
Должна выполняться определенная
закономерность (например, пропорциональность).
б)
Случайные ошибки.
Случайные
ошибки показывают отличие результатов
параллельных определений друг от друга
и фактически характеризуют воспроизводимость
анализа. Причины
случайных ошибок однозначно указать
невозможно. При многократном повторении
анализа они или не воспроизводятся, или
имеют разные численные значения и даже
разные знаки.
Случайные
ошибки можно оценить методами
математической статистики, если
выявлены и устранены систематические
ошибки (или систематические ошибки
меньше случайных).
ЭТАПЫ
КОЛИЧЕСТВЕННОГО ХИМИЧЕСКОГО АНАЛИЗА
Наука
об измерениях, методах и средствах
обеспечения их единства
и способах достижения требуемой точности
называется метрологией.
Количественный
химический анализ, целью которого
является
определение содержания веществ в разных
объектах, может
рассматриваться как измерительная
процедура, характеризующаяся
рядом специфических особенностей.
Количественный
химический анализ, прежде всего, является
многостадийным процессом, включающим
ряд этапов и стадий. При выполнении
химического анализа с помощью любого
метода можно выделить следующие
основные этапы:
— постановка
аналитической задачи;
— выбор метода
анализа;
— выполнение
анализа;
— оценка качества
анализа;
— принятие решений
по результатам анализа.
При
постановке аналитической задачи
необходимо дать характеристику объекта
анализа, указать химическую формулу
определяемого
компонента, возможный интервал его
содержаний, требуемую
точность и продолжительность анализа.
Выбор
метода анализа определяется поставленной
аналитической
задачей и техническими возможностями
аналитической лаборатории.
Этап,
связанный непосредственно с проведением
химического
анализа, наиболее трудоемок и включает
ряд стадий, представленных на рис. 5.2.
Методика
анализа включает
подробное описание последовательности
и условий проведения всех стадий анализа.
Точное следование
методике анализа позволяет выполнить
анализ с минимальными
погрешностями на каждой стадии и получить
правильный
результат анализа.
Первая
стадия химического анализа — отбор
средней
(представительной)
пробы. Это
небольшая часть анализируемого объекта,
средний
состав и свойства которой должны быть
идентичны во всех
отношениях среднему составу и свойствам
объекта анализа. Содержание
определяемого компонента в анализируемой
пробе должно
отражать среднее содержание этого
компонента во всем исследуемом
объекте, т. е. анализируемая проба должна
быть представительной.
Погрешность в отборе пробы часто
определяет общую
погрешность химического анализа. Не
оценив погрешность на
этой стадии, нельзя говорить о правильности
определения компонента
в анализируемом объекте.
Подготовка
пробы к анализу включает ряд сложных
операций, например, такие как высушивание
пробы, разложение (вскрытие)
пробы,
устранение влияния мешающих компонентов.
В зависимости
от цели анализа, природы объекта и
выбранного метода могут быть использованы
разные модификации и комбинации этих
операций.
В правильном проведении химического
анализа роль подготовки
пробы настолько велика, что химик-аналитик
должен каждый
раз оценивать необходимость включения
операций пробоподготовки
в методику анализа, их влияние на общую
погрешность анализа.
После
отбора и подготовки пробы наступают
стадии химического
анализа, на которых определяют количество
компонента. С
этой целью измеряют аналитический
сигнал. В
большинстве методов им является среднее
из измерений физической величины на
заключительной стадии анализа,
функционально связанной с содержанием
определяемого компонента. Это
может быть сила тока, ЭДС системы,
оптическая плотность, интенсивность
излучения и т.д. В отдельных методах
анализа возможно непосредственное
определение содержания. Например, в
гравиметрическом методе иногда прямо
измеряют массу определяемого компонента.
При
определении количества компонента
измеряют величину аналитического
сигнала. Затем рассчитывают содержание
компонента с использованием функциональной
зависимости аналитического
сигнала от содержания: у =
f(с),
которая устанавливается расчетным или
опытным путем и может быть представлена
в виде формулы, таблицы или графика.
Содержание может быть выражено абсолютным
количеством определяемого компонента
в молях, в единицах массы или через
соответствующие концентрации.
При
измерении аналитического сигнала
учитывают наличие полезного аналитического
сигнала, являющегося функцией содержания
определяемого компонента, и аналитического
сигнала фона, обусловленного
примесями определяемого компонента и
мешающими компонентами в растворах,
растворителях и матрице образца, а также
«шумами» в
измерительных приборах, усилителях
и другой аппаратуре. Эти шумы не имеют
отношения к определяемому компоненту,
но накладываются на его собственный
аналитический сигнал. Задача аналитика
состоит в том, чтобы максимально снизить
величину аналитического сигнала фона
и, главное, сделать минимальными его
колебания.
Обычно
аналитический сигнал фона учитывают в
контрольном
(холостом) опыте, когда
через все стадии химического анализа
проводится проба, не содержащая
определяемого компонента. Полезным при
этом будет аналитический сигнал, равный
разности измеренного сигнала и
аналитического сигнала фона.
На
основании существующей зависимости
между аналитическим сигналом и содержанием
находят концентрацию определяемого
компонента. Обычно при этом используют
методы
градуированного графика, стандартов
или
добавок. Описанные
в литературе другие способы определения
содержания компонента, как правило,
являются модификацией этих трех методов.
Наиболее
распространен метод
градуировочного графика: в
координатах (аналитический сигнал –
содержание компонента) строят график
с использованием образцов сравнения с
разными и точно известными уровнями
содержания компонента (концентрация
С).
Затем, измерив
величину аналитического сигнала в
пробе, находят содержание определяемого
компонента по градуировочному графику
(рис. 5.3).
В
методе
стандартов измеряют
аналитический сигнал в образце
сравнения (стандартном образце) с
известным содержанием компонента и в
анализируемой пробе: Уст
= sСст
и ух
= sСХ,
где s-коэффициент
пропорциональности.
Если
определенное в идентичных условиях
значение s
заранее известно, то можно провести
расчет по формуле Сх
= Ух/S.
Обычно же используют соотношение Уст/УХ
= Сст/СХ,
откуда
Иногда
работают с двумя стандартными образцами,
в которых содержание компонента
отличается от предполагаемого содержания
в анализируемой пробе в одном случае в
меньшую, в другом — в большую сторону.
Этот вариант метода стандартов называют
методом
ограничивающих растворов.
Содержание определяемого компонента
рассчитывают по формуле

Если
при определении малых количеств
компонента нужно учесть
влияние матрицы образца на величину
аналитического сигнала,
то часто используют
методы добавок — расчетный
или графический.
При
определении содержания расчетным
методом берут
две аликвоты
раствора анализируемой пробы. В одну
из них вводят добавку
определяемого компонента известного
содержания. В обеих
пробах измеряют аналитический сигнал
— ух
и
ух+доб—
Неизвестную
концентрацию определяемого компонента
рассчитывают
по формуле
где
Vдоб
и Сдоб
— объем и концентрация добавленного
раствора определяемого компонента; V
— аликвота
анализируемой пробы.
При
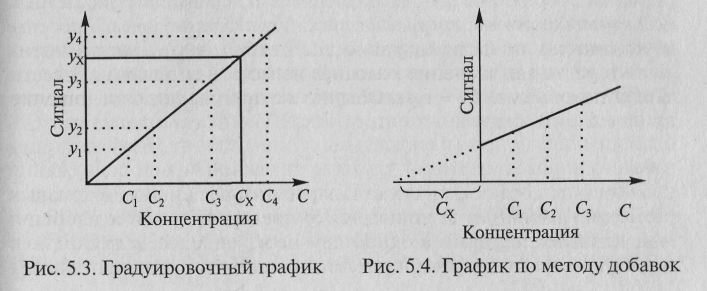
определении содержания компонента
графическим
методом
берут
п
аликвот
анализируемой пробы: 1, 2, 3, …, п.
Во
2-ю, …, п-ю
аликвоты
вводят известные, возрастающие, количества
определяемого
компонента. Во всех аликвотах измеряют
аналитический сигнал
и строят график в координатах аналитический
сигнал -содержание
определяемого компонента, приняв за
условный нуль содержание
определяемого компонента в аликвоте
без добавки (аликвота 1). Экстраполяция
полученной прямой до пересечения с
осью абсцисс дает отрезок слева от
условного нуля координат, величина
которого в выбранном масштабе и единицах
измерения соответствует
Сх
определяемого компонента (рис. 5.4).
Метод
стандартов и метод добавок применимы
для линейной градуировочной функции.
Метод градуировочного графика допускает
использование как линейной, так и
нелинейной функций аналитический
сигнал—содержание. В последнем случае
требуется большее число экспериментальных
данных, и результат определения содержания
компонента бывает, как правило, менее
точным.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Подборка по базе: Сенсорные способности являются базой для успешного овладения раз, 1 лекция.docx, Экспр тест лекция 1.docx, 13 лекция Маркетинг.pdf, Тема 15 ЛЕКЦИЯ Я-концепция личности.pdf, Тест с ответами по предмету электрические измерения.doc, Форма анализа воспитательной работы для руководителей предметных, Цель, задачи, предмет и объект антикоррупционной экспертизы. Суб, стандарт лекция.doc, 115з_Вводная лекция.doc
Ошибки в количественном анализе. Классификация ошибок количественного анализа (систематическая ошибка, случайные ошибки).
2. Гравиметрический (весовой) метод анализа
Сущность гравиметрического анализа. Аналитические весы: устройство и правила работы на них.
Метод осаждения. Основные этапы гравиметрического анализа. Осаждаемая и гравиметрическая форма осадка. Осадки кристаллические и аморфные. Растворимость осадков. Требования к осадкам в количественном анализе. Выбор осадителя и требования, предъявляемые к осадителю. Условия осаждения и получения гравиметрической формы. Расчеты в гравиметрическом анализе.
3. Химические титриметрические (объемные) методы анализа
Сущность титриметрического анализа. Основные понятия: аликвота, титрант, титрование, точка эквивалентности, конечная точка титрования, индикатор, кривая титрования.
Исходные вещества и требования к ним. Стандартные и стандартизированные растворы. Фиксаналы.
Вычисления в титриметрическом анализе. Способы выражения концентрации веществ в растворе: молярная концентрация, молярная концентрация эквивалента (нормальная концентрация), титр, титриметрический фактор пересчета (титр по определяемому веществу), поправочный коэффициент. Расчет массы стандартного вещества, необходимой для приготовления титранта. Расчет концентрации при его стандартизации. Расчет массы и массовой доли определяемого вещества по результатам титрования.
Классификация методов титриметрического анализа: кислотно-основное, окислительно-восстановительное, осадительное, комплексонометрическое титрование.
Виды (приемы) титрования: прямое, обратное, косвенное (заместительное).
Измерительная посуда и ее калибрование.
4. Методы кислотно-основного титрования
Сущность метода. Основные реакции и титранты метода. Ацидиметрия и алкалиметрия. Точка нейтральности и конечная точка титрования. Кривые титрования. Титрование сильной кислоты сильным основанием (или наоборот); слабой кислоты сильным основанием (или наоборот); слабого основания сильной кислотой (или наоборот). Расчет и построение кривых титрования.
Индикаторы в кислотно-основном титровании. Теория индикаторов; интервал перехода индикатора. Выбор индикатора.
Расчеты в методах кислотно-основного титрования. Примеры использования данного метода в химическом анализе.
5. Методы окислительно-восстановительного титрования
Основы методов окисления-восстановления. Использование окислительно-восстановительных реакций в количественном анализе. Классификация методов окисления-восстановления. Редокс-потенциалы и направления протекания реакций. Константы равновесия окислительно-восстановительных реакций.
Факторы, определяющие скорость реакций окисления-восстановления. Расчеты в методах редоксметрии.
Кривые титрования в методах редоксметрии. Фиксирование точки эквивалентности. Редокс-индикаторы.
Перманганатометрия. Сущность метода. Условия проведения титрования. Титрант, его приготовление, стандартизация. Установление конечной точки титрования. Применение перманганатометрии. Иодометрия. Иодометрическое титрование для определения окислителей (заместительное титрование). Иодометрическое титрование для определения восстановителей (прямое и обратное титрование). Рабочие растворы их приготовление, стандартизация, хранение. Примеры применения метода.
6. Методы осаждения
Характеристика и классификация методов осаждения. Реакции, лежащие в основе методов осаждения. Сходство и отличие методов осаждения от гравиметрического анализа.
Индикаторы метода осадительного титрования: осадительные, металлохромные, адсорбционные.
Аргентометрическое титрование. Сущность метода. Титрант, его приготовление, стандартизация. Разновидности методов аргентометрии: Фольгарда, Мора, Фаянса–Фишера–Ходакова.
1. ЛЕКЦИЯ 17 на тему «Метрологические основы аналитической химии»
2. План:
• 1.
Метрология
как
наука.
Правильность
и
воспроизводимость.
• 2. Классификация ошибок количественного анализа.
• 3. Методы проверки правильности результатов анализа.
• 4. Некоторые понятия математической статистики и их
использование в количественном анализе. Доверительный
интервал и доверительная вероятность
• 5. Пример статистической обработки и представления
результатов количественного анализа.
• Литература: Харитонов Ю.Я. Аналитика. Кн. 2, гл.1,
§1.4-1.7.
3. 1. Метрология как наука. Правильность и воспроизводимость.
• Под параллельными определениями понимают получение
нескольких результатов единичных определений для одной
пробы практически в одинаковых условиях.
• При проведении химического анализа обычно не
ограничиваются единичным определением, а проводят
несколько параллельных определений (как правило, 3-5) для
одной и той же пробы в одинаковых условиях. Средний
результат параллельных определений называют результатом
анализа и обозначают через с или х. Отклонение
результатов анализа от истинного содержания
определяемого компонента (µ) называют погрешностью
(или ошибкой) определения.
4. Пусть μ — истинное значение определяемой величины; х1,х2,хi..хn — измеренные (единичные) значения определяемой величины результаты единичных
Пусть μ — истинное значение определяемой величины;
х1,х2,хi..хn — измеренные (единичные) значения
определяемой величины результаты единичных
определений; п — общее число единичных определений.
• Под единичным определением понимают
однократное проведение всей последовательности
операций, предусмотренных методикой анализа.
• Результат единичного определения — это значение
содержания определяемого компонента, найденное
при единичном определении.
5. Часто вместо истинного значения определяемой величины μ используют действительное значение содержания а (или просто дейcтвительнoe значе
Часто вместо истинного значения определяемой
величины μ используют действительное значение
содержания а (или просто дейcтвительнoe значение
а), под которым подразумевают экспериментально
полученное или расчетное значение определяемого
содержания, настолько близкое к истинному, что для
данной цели может быть использовано вместо него.
Тогда величина
хср.= (х1+х2+…+хп) / п = (∑хі) / п
(1)
есть среднее арифметическое (среднее) из
результатов единичных определений. Считается, что
хср. — наиболее вероятное значение определяемой
величины, более вероятное, чем каждое
отдельное значение хi.
6.
Правильностью измерений называют
качество измерений, отражающее близость к
нулю систематических погрешностей.
Под правuльностью результата анализа
понимают качество анализа, отражающее
близость к нулю разности между средним
арифметическим
и
истинным
μ
(или
действительным а) значением определяемой
величины:
хср.- μ →0
или
хср.- а →0
при n → ∞
при n → ∞
7. 2. Классификация ошибок количественного анализа Ошибки количественного анализа условно подразделяют на систематические, случайные и гру
2. Классификация ошибок
количественного анализа
Ошибки количественного анализа
условно подразделяют на систематические, случайные и
грубые.
8.
А. Систематические ошибки
Систематические
погрешности
являются
следствием
устойчивых отклонений результатов анализа от истинных величин.
Погрешность измерений, которая при повторных измерениях
остается постоянной или закономерно изменяется, называется
систематической погрешностью.
Различают: систематическую ошибку и процентную систематическую ошибку.
Систематическая ошибка результата анализа Δo — это статистически значимая разность между средним хср. и действительным а (или
истинным μ) значениями содержания определяемого компонента:
Δo = хср.- а или Δo = хср. — μ.
(2)
Систематическая ошибка результата анализа может быть больше нуля, меньше нуля или равна нулю.
Процентная систематическая ошибка (относительная величина
систематической ошибки) — это систематическая ошибка,
выраженная в процентах от действительного значения а (или
истинного значения μ) определяемой величины:
9. По способу численного представления погрешности подразделяют на абсолютные и относительные. Абсолютная погрешность — отклонение результ
10. Источники систематических ошибок
• Методические — обусловлены особенностями методики
анализа.
• Инструментальные — обусловлены несовершенством
используемых приборов и оборудования.
• Индивидуальные — обусловлены субъективными
качествами аналитика.
Так, например, дальтонизм может влиять на
определение конечной точки титрования при визуальной
фиксации изменения окраски индикатора.
Правильность результатов анализа определяется
наличием или отсутствием систематических ошибок.
11. Б. Случайные ошибки
Погрешность,
которая
при
повторных
измерениях
изменяется
случайным
образом,
называется случайной погрешностью измерений.
Причины их возникновения многообразны, и исключить
их полностью невозможно.
Промах – это погрешность, резко искажающая
результат анализа и обычно легко обнаруживаемая,
вызванная,
как
правило,
небрежностью
или
некомпетентностью аналитика.
Случайные
ошибки
показывают
отличие
результатов параллельных определений друг от друга
и характеризуют воспроизводимость анализа.
12. 3. Методы проверки правильности результатов анализа Аналитический сигнал – среднее результатов измерений физической величины на заключи
3. Методы проверки правильности
результатов анализа
Аналитический сигнал – среднее результатов
измерений физической величины на заключительном
этапе анализа, функционально связанное с содержанием
определяемых компонентов.
В качественном химическом анализе – изменение
агрегатного состояния или внешнего вида вещества в
результате химической реакции.
При определении количества компонента измеряется
величина аналитического сигнала: масса осадка, сила
тока, интенсивность линии спектра и т.д.
Затем рассчитывают содержание компонента с
использованием функциональной зависимости
аналитический сигнал–содержание: у = f(c), которая
устанавливается расчетным или опытным путем и может
быть представлена в виде формулы, таблицы или
13. На основании существующей зависимости между измеренным аналитическим сигналом и содержанием находят концентрацию определяемого компоне
На основании существующей зависимости между измеренным
аналитическим сигналом и содержанием находят концентрацию
определяемого компонента. Обычно при этом используют методы
градуировочного графика, стандартов или добавок.
1). Метод градуировочного графика:
у
у3
ух
у2
у1
с1
с2
сх
с3
с
При
этом
в
координатах
аналитический сигнал – содержание
компонента
строят
график
с
использованием образцов сравнения с
различным и точно известным
содержанием
определяемого
соединения. Затем, измерив величину
аналитического
сигнала
в
анализируемой
пробе,
находят
содержание определяемого компонента
по градуировочному графику.
14. 2). Метод стандартов В методе стандартов измеряют аналитический сигнал в образце сравнения (эталонном образце) с известным содержанием ком
15. 2). Метод добавок
• При определении содержания компонента
методом
добавок
берут
п
аликвот
анализируемой пробы: 1, 2, 3, …, п. В аликвоты
2, 3, …, п вводят известные, возрастающие
количества определяемого компонента. Во всех
аликвотах измеряют аналитический сигнал –
содержание определяемого компонента, приняв
за условный нуль содержание определяемого
компонента в аликвоте без добавки (аликвота 1).
16. Рис. 2. Метод добавок.
у
сх
с1
с2
с3
с
Экстраполяция полученной прямой до пересечения с осью
абсцисс дает отрезок, расположенный влево от условного
нуля координат, величина которого в выбранном масштабе и
единицах измерения соответствует искомому содержанию (сх)
определяемого компонента (рис.2).
17.
• Во всех рассмотренных способах используют
образцы сравнения (эталоны), т.е. образцы, пробы,
растворы с точно установленным содержанием
компонента.
• Методы анализа, использующие образцы
сравнения – это так называемые относительные
методы химического анализа.
• Абсолютных (безэталонных) методов в
аналитической химии немного – например, методы
гравиметрии, прямой кулонометрии, некоторые
варианты радиохимических методов.
18. 4. Некоторые понятия математической статистики и их использование в количественном анализе Сумму вариант, деленную на число вариант п, наз
19.
20.
• Если число наблюдений велико, величина S
стремится к некоторому постоянному значению σ,
которое можно назвать статистическим пределом S:
σ = lim S
n→∞
• Этот
предел
называют
стандартным
отклонением, а квадрат этой величины – дисперсией
измерений. Таким образом, в условиях аналитического
определения обычно находят выборочное среднее x, а
не генеральное среднее µ и выборочное стандартное
отклонение S , а не σ.
21.
22.
23. Доверительная вероятность Р — вероятность нахождения действительного значения определяемой величины а в пределах доверительного интерв
Доверительная вероятность Р — вероятность
нахождения действительного значения определяемой
величины а в пределах доверительного интервала.
Изменяется от 0 до 1 или (что то же самое) от 0% до
100%.
В фармацевтическом анализе при контроле качества
лекарственных препаратов доверительную вероятность
чаще всего принимают равной Р = 0,95 = 95% и
обозначают как P0,95. При оценке правильности методик
или методов анализа доверительную вероятность
обычно считают равной Р = 0,99 = 99%.
24. _ Полуширину доверительного интервала Δx находят по формуле: _ Δx = tP, f s /√n где tP, f — коэффициент нормированных отклонений (коэффициент Стьюд
Полуширину доверительного интервала Δx находят
по формуле:
_
Δx = tP, f s /√n
где tP, f — коэффициент нормированных отклонений
(коэффициент Стьюдента, функция Стьюдента, критерий
Стьюдента), который зависит от доверительной
вероятности Р и числа степеней свободы f = n — 1, т. е. от
числа п проведенных определений.
Численные значения tP, f рассчитаны для различных
возможных величин Р и n и табулированы в справочниках.
Чем больше п, тем меньше tP, f Однако при n > 5
уменьшение tP, f уже сравнительно невелико, поэтому на
практике обычно считают достаточным проведение пяти
параллельных определений (n= 5).
25. 5. Пример статистической обработки и представления результатов количественного анализа.
5. Пример статистической обработки и
представления результатов количественного
анализа.
• Пусть содержание определяемого компонента в
анализируемом образце, найденное в пяти параллельных
единичных определениях (п = 5), оказалось равным, %:
3,01; 3,04; 3,08; 3,16 и 3,31. Известно, что систематическая
ошибка отсутствует.
• Требуется провести статистическую обработку
результатов количественного анализа (оценить их
воспроизводимость) при доверительной вероятности,
равной Р = 0,95.
26.
27.
28. Относительная (процентная) ошибка среднего результата ε: _ _ ε = (Δx /x) ·100%.
Относительная (процентная) ошибка среднего
результата ε:
_ _
ε = (Δx /x) ·100%.
Итоговая таблица
xi
п
_
х
s
_
Δx
х ± Δх
ε
3,01; 3,04; 3,08; 3,16
и 3,31
5
3,12
0,12
0,15 (Р = 0,95)
3,12 ± 0,15
4,8%
29. Оценка правильности результатов анализа — проблема значительно более трудная, чем оценка воспроизводимости. Для оценки правильности необ
Оценка правильности результатов анализа — проблема
значительно более трудная, чем оценка
воспроизводимости.
Для оценки правильности необходимо сравнение
результата измерения с истинным значением. Строго
говоря, такое значение никогда не может быть известно.
Однако для практических целей можно вместо
истинного использовать любое значение,
систематическая погрешность которого пренебрежимо
мала. Если при этом и случайная погрешность также
пренебрежимо мала, то такое значение можно считать
точной величиной (константой) и постулировать в
качестве истинного. Величина, принимаемая за
истинное значение, называется действительной
величиной и обозначается a
30. Важнейшие способы получения информации о действительном (или, по крайней мере, не содержащем систематической погрешности) значении содерж
Важнейшие способы получения
информации о действительном (или,
по крайней мере, не содержащем
систематической погрешности)
значении содержания
определяемого компонента в
анализируемом образце состоят в
следующем:
31. Данные независимого анализа. Образец анализируют повторно, используя другую методику анализа, о которой известно (из опыта практического
Данные независимого анализа.
Образец анализируют повторно,
используя другую методику анализа,
о которой известно (из опыта
практического применения), что она
не содержит систематической
погрешности.
1.
32. 2. Способ «введено — найдено». В этом случае аналитик сам готовит для анализа образец с известным содержанием определяемого компонента. Полу
2. Способ «введено — найдено». В
этом случае аналитик сам готовит
для анализа образец с известным
содержанием определяемого
компонента. Полученный результат
(«найдено») сравнивают с заданным
содержанием («введено»).
33. 3. Использование стандартных образцов. В качестве объекта анализа выбирают подходящий СО, а данные о содержании определяемого компонента б
3. Использование стандартных образцов. В
качестве объекта анализа выбирают
подходящий СО, а данные о содержании
определяемого компонента берут из паспорта
СО.
После получения тем или иным способом
независимых данных о содержании
определяемого компонента их необходимо
сравнить с результатами, полученными с
помощью проверяемой методики.
34. Чувствительность, селективность и их характеристики
• Точность результатов анализа в целом и ее
отдельные составляющие, правильность и
воспроизводимость, могут сильно изменяться в
зависимости от состава образца. При уменьшении
содержания определяемого компонента или при
увеличении содержания посторонних компонентов
точностные характеристики непрерывно ухудшаются,
и с какого-то момента определение, а затем и
обнаружение компонента оказывается вообще
невозможным. Работоспособность методики в таких
«экстремальных», неблагоприятных для анализа
условиях характеризуют еще два важнейших понятия
химической метрологии — чувствительность и
селективность.
35. Чувствительность.
• Традиционно под «чувствительностью»
понимают возможность обнаружения или
определения при помощи данной методики
малых содержаний вещества («методика
высокочувствительна» — значит, она
позволяет работать в области очень низких
концентраций). Простейшей численной
величиной, характеризующей эту
возможность, служит коэффициент
чувствительности (S).
36. Однако знание одной лишь величины S не позволяет ответить на вопрос, насколько низкие содержания можно определять с помощью той или иной ме
Однако знание одной лишь величины S не позволяет
ответить на вопрос, насколько низкие содержания
можно определять с помощью той или иной методики.
Во-первых, коэффициент чувствительности — величина
размерная, поэтому сопоставление коэффициентов
чувствительности для принципиально разных
(различающихся природой аналитического сигнала)
методов невозможно. Во-вторых, сопоставление
значений S даже одинаковой размерности имеет смысл
действительно только «при прочих равных условиях»,
т.е. в первую очередь при одинаковой точности
измерения аналитических сигналов. В то же время эта
точность может меняться от методики к методике.
Поэтому для характеристики чувствительности
используют еще две величины, называемые пределом
обнаружения и пределом определения.
37. Предел обнаружения (cmin) — это наименьшее содержание вещества, которое может быть обнаружено по данной методике с заданной степенью достове
Предел обнаружения (cmin) — это наименьшее
содержание вещества, которое может быть
обнаружено по данной методике с заданной
степенью достоверности. Таким образом,
предел обнаружения (как это и следует из
названия) характеризует методику с точки
зрения возможностей качественного анализа.
38. Для характеристики возможностей методики с точки зрения количественного анализа используют величину, называемую пределом определения clim
Для характеристики возможностей методики с
точки зрения количественного анализа
используют величину, называемую пределом
определения clim. Предел определения — это
минимальное содержание компонента, которое
можно определить с заданной степенью
точности, характеризуемой предельно
допустимой величиной относительного
стандартного отклонения
39. Селективность. Под селективностью (или избирательностью) понимают возможность определения данного вещества в присутствии посторонних ко
Селективность. Под селективностью
(или избирательностью) понимают
возможность определения данного
вещества в присутствии посторонних
компонентов. Численной характеристикой
селективности служит коэффициент
селективности ki,J
40. Заключение
Аналитическая химия – это наука о методах и средствах получения
информации о составе вещества. Но любая информация представляет
интерес только тогда, когда известно, насколько она достоверна.
Оценка достоверности результатов – это неотъемлемая часть
химического анализа, это задача не менее важная и ответственная,
чем само их получение. В данном пособии рассмотрены лишь
некоторые, наиболее простые, но вместе с тем и наиболее
распространенные приемы, используемые для оценки качества
результатов химического анализа. На практике контроль качества
результатов химического анализа часто оказывается достаточно
сложным. Это связано со спецификой химического анализа –
многостадийной косвенной измерительной процедуры, которая
включает не только операцию измерения как таковую, но и
предварительные этапы пробоотбора и пробоподготовки, а также
градуировку. Отдельную задачу представляет собой обеспечение
качества результатов химического анализа, достижение необходимой
точности. Ее решение требует множества мер не только научного, но и
организационного характера. Эти мероприятия, устанавливаемые
законодательно, разрабатывают и проводят в жизнь специальные
отраслевые, национальные и межгосударственные службы.
41. Изучением всех вопросов, связанных с измерением химических величин, методами и средствами обеспечения их единства, контроля и обеспечения
качества результатов химического анализа занимается
специальный раздел аналитической химии –
химическая метрология. Основные правила и законы
химической метрологии едины для всех методов
анализа. Знание химической метрологии, умение
правильно обрабатывать, оценивать и
интерпретировать результаты химического анализа и,
шире, любого химического эксперимента – одна из
важных составляющих подготовки химикаисследователя.
Химический анализ: как правильно оценить причину ошибки
Химический анализ является неотъемлемой частью химических исследований. Он позволяет выявить химические свойства и состав веществ и материалов. Ошибка в химическом анализе может влиять на точность и достоверность результатов. Правильное определение причины ошибки имеет важное значение для дальнейших исследований.
Определение ошибки в химическом анализе
Ошибка в химическом анализе может возникать из-за различных причин: ошибок в измерительной технике, неправильного выбора метода анализа, ошибок в подготовке образца или в расчетах. Определение причины ошибки позволяет устранить ее и увеличить точность анализа.
Правильное выявление причины ошибки
Чтобы правильно выявить причину ошибки в химическом анализе необходимо провести следующие шаги:
-
Проверить измерительную технику: проверить работу приборов, калибровку, корректировку и при необходимости заменить или отремонтировать неисправные детали.
-
Проверить метод анализа: проверить выбранный метод анализа на соответствие исследуемому материалу. Если метод анализа не подходит для данного материала, необходимо выбрать другой метод.
-
Проверить образец: провести дополнительные исследования образца для выявления других факторов, которые могут влиять на результаты анализа.
-
Проверить расчеты: проверить правильность расчетов и формул, используемых при анализе.
-
Провести эксперимент повторно: провести эксперимент повторно, используя те же методы и технику, и сравнить результаты с предыдущими.
Заключение
Методы химического анализа являются важным инструментом для выявления свойств и состава веществ. Ошибки возникают неизбежно, но правильное выявление ошибки позволит улучшить точность и достоверность результатов анализа. В своей работе химики должны следовать определенным процедурам контроля качества и регулярно проверять оборудование и методы анализа, чтобы получить наиболее точные результаты.







