Слезозаместительная терапия синдрома «сухого глаза»
Искусственные заменители слезы
Одним из основных направлений лечения синдрома «сухого глаза» (ССГ) на современном этапе является применение искусственных заменителей слезы, содержащих водную основу и повышающих вязкость смазочных веществ на основе природных или синтетических полимеров. Данные компоненты, воздействуя на водный и муциновый слои прероговичной слезной пленки (СП), смешиваются с остатками нативной слезы и образуют собственную прероговичную СП [1]. Благодаря этому достигается гомеостатическое равновесие между постоянным испарением слезной жидкости и ее выработкой.
Искусственные заменители слезы в зависимости от степени вязкости подразделяются на средства низкой, средней, высокой вязкости и гели. К препаратам данной фармакологической группы предъявляются следующие требования [2]: стерильность; соответствие физиологическому значению рН естественной слезы (уровень pH=7,2–7,4); изотоничность; соответствующая осмолярность (181–354 мОсмоль/л); оптимальная вязкость, превышающая вязкость слезной жидкости, — 15–30 сПз или 5–15 мПа-с; бесцветность и прозрачность (без отрицательного влияния на оптические свойства глаза); отсутствие механических включений и риска загрязнения микрофлорой; отсутствие эффекта привыкания; хорошая переносимость и отсутствие токсичности; возможность применения при ношении контактных линз.
Фармацевтический рынок на сегодняшний день предлагает широкий ассортимент полимерных слезозаменителей (лубрикантов), содержащих полусинтетические (кармеллоза и гидроксипропилметилцеллюлоза) и синтетические полимеры (полиэтиленгликоль, пропиленгликоль, поливинилпирролидон, поливиниловый спирт, повидон, карбомер). В ряде препаратов используются природные полисахариды (натриевая соль гиалуроновой кислоты, гидроксипропилгуар, декстран, трегалоза, TS-полисахарид), обладающие максимальными восполняющими свойствами при патологии водного и муцинового слоев СП и стимулирующие регенерацию эпителия глазной поверхности [2, 3]. Помимо полимерной основы препараты искусственной слезы могут содержать электролиты, буферные растворы, регуляторы вязкости, а также консерванты, препятствующие росту микроорганизмов при вскрытии флакона [2].
Одним из традиционных компонентов искусственных слезозаменителей является гиалуроновая кислота (ГК), получившая широкое распространение благодаря образованию эффективной связи с водой, устойчивости к высыханию и отличной биосовместимости. ГК впервые была выделена из стекловидного тела глазного яблока в 1934 г. немецким биохимиком K. Meyer и его американским ассистентом J. Palmer, а позже была обнаружена также в слезной железе, эпителии роговицы, конъюнктиве и слезной жидкости [4]. Необходимо отметить, что офтальмологические препараты, изготовленные на основе ГК, полностью биосовместимы и при инстилляции в конъюнктивальную полость не вызывают чувства инородного тела [4, 5]. ГК является природным полимером и относится к группе полисахаридов, которые также называют полисахаридами соединительной ткани, мукополисахаридами или гликозаминогликанами [4, 6]. Данная группа веществ влияет на распределение воды в соединительной ткани, в т. ч. и в строме роговицы [7]. Так, например, ГК обладает выраженной способностью удерживать воду за счет большого количества гидроксильных групп, образующих водородные связи [7, 8]. Согласно исследованиям данная кислота способна удержать количество воды, в 1000 раз превышающее ее собственную массу [7]. При повышении градиента давления и температуры окружающей среды ГК снижает вязкоэластические свойства раствора [7, 8]. Помимо этого, ГК обладает противовоспалительными свойствами [4] и способна стимулировать миграцию эпителиоцитов, способствуя заживлению эрозий роговицы, устранению неровностей глазной поверхности и стабилизируя состояние СП [8]. I.C. You et al. отмечают, что наибольший терапевтический эффект наблюдается на фоне применения 0,3% раствора ГК: более высокая концентрация препарата благотворно влияет на процесс заживления эрозий роговицы, увеличивает плотность бокаловидных клеток конъюнктивы, снижает апоптоз эпителиоцитов роговой оболочки [9].
Другими компонентами искусственных заменителей слезы, применяемыми при лечении ССГ, являются карбоксиметилцеллюлоза и гидроксипропилцеллюлоза. Эти полисахариды увеличивают вязкость слезной жидкости, способствуют восстановлению эпителиальных клеток роговицы и применяются, как правило, в сочетании с ГК. Растворимая гидроксипропилцеллюлоза используется в препарате Lacrisert (Bausch&Lomb, США), который помещается в нижний конъюнктивальный свод и, растворяясь в течение 12 ч, утолщает СП. Препарат рекомендуется к применению у пациентов с умеренной и тяжелой степенью ССГ, однако противопоказан при высокой чувствительности к гидроксипропилцеллюлозе [6].
Гидроксипропилгуар — водорастворимый природный полисахарид, являющийся производным гуаровой камеди, наиболее эффективный и часто используемый компонент слезозаменителей, восполняющий муциновый слой СП. В составе капель с гидроксипропилгуаром обязательными составляющими являются борная кислота, при взаимодействии с которой образуется структурированный гелеобразный раствор, и сорбитол, препятствующий преждевременной связи гидроксипропилгуара с борат-ионами. Попадая на глазную поверхность, борная кислота взаимодействует с двухвалентными ионами кальция, магния и цинка слезной жидкости, благодаря чему связь с гидроксипропилгуаром становится более прочной. Образующаяся на поверхности роговицы тонкая высокомолекулярная пленка эффективно увлажняет глазную поверхность, повышает время разрыва СП, минимизирует испарение слезы за счет снижения ее осмолярности и препятствует тем самым высыханию роговицы [6, 10].
Большое число научных исследований последних лет посвящено изучению влияния природного дисахарида трегалозы на организм человека, обладающей способностью вызывать аутофагию клеток [11, 12]. Согласно экспериментальным исследованиям in vitro и in vivo трегалоза защищает клетки роговицы от высыхания, препятствует апоптозу эпителиоцитов роговицы и конъюнктивы и их ультрафиолет (УФ) -индуцированному окислительному повреждению [6, 13]. Установлено, что под воздействием этого дисахарида существенно снижается содержание конъюнктивальных провоспалительных цитокинов и восстанавливается осмотический баланс слезы у лабораторных мышей [6, 14]. При лечении поврежденной роговицы трегалозой отмечается быстрое купирование воспаления, подавляются формирование рубца и неоваскуляризация роговой оболочки. Отсутствие токсичных свойств у данного дисахарида позволяет применять его у человека в течение длительного времени [13]. Наибольший терапевтический эффект трегалозы наблюдается при совместном применении с ГК. Добавление трегалозы способствует улучшению переносимости и эффективности проводимого лечения с точки зрения облегчения симптомов (по данным опросника OSDI (Ocular Surface Disease Index — индекс поражения поверхности глаза)), по сравнению с инстилляциями фармакологического препарата, содержащего в своем составе только гиалуронат, что, по мнению исследователей, демонстрирует биопротекторное действие трегалозы [15].
Согласно клиническим исследованиям благотворное влияние на течение ССГ оказывает применение осмопротекторов. Установлено, что L-карнитин и эритрит подавляют активацию с-Jun-N-концевых киназ и митоген-активированных протеинкиназ, тем самым снижая гиперосмолярность слезной жидкости [16, 17]. L-карнитин, эритрит и бетаин оказывают значительное супрессивное действие на синтез и секрецию провоспалительных цитокинов и хемокинов, уменьшают апоптоз эпителиальных клеток. Кверцетин, эпигаллокахетин, N-пропилгаллат и галловая кислота препятствуют повреждению клеток активными формами кислорода, воздействуя на такой механизм развития ССГ, как окислительный стресс [6, 17].
Для профилактики роста микроорганизмов после вскрытия флакона с каплями многие производители включают в состав мультидозных форм слезозаменителей консерванты, известные своей токсичностью и неблагоприятным влиянием на глазную поверхность. В связи с этим отдельные фармацевтические фирмы разработали формы флаконов, препятствующие проникновению микроорганизмов внутрь флакона, исключив контаминацию раствора без применения консерванта. В настоящее время такими флаконами являются известный в России флакон системы COMOD (URSAFARM, Германия), а также Container-OSD (TRB Chemedica, Швейцария) и ABAK Bottle (Thea Pharmaceuticals, Франция). Помимо риска инфицирования и развития осложнений, связанных с применением консервантов, многоразовые флаконы с глазными каплями имеют и ряд других недостатков: их материал способен поглощать консерванты и действующие вещества (полиэтилен абсорбирует бензалкония хлорид), а красители, входящие в состав стенок флакона, могут проникать в лекарственный раствор. Для устранения этих побочных явлений отдельные производители наладили выпуск одноразовых тюбик-капельниц, содержащих дозу слезозаменителя для однократной инстилляции в оба глаза («single-dose» или «unit-dose») [18].
Бензалкония хлорид является наиболее часто используемым консервантом, входящим в состав большинства глазных капель, при этом данное вещество индуцирует апоптоз эпителиоцитов роговицы и конъюнктивы, оказывает токсическое действие на нервные окончания роговой оболочки и замедляет регенерацию повреждений роговицы. В эксперименте in vitro показано, что раствор бензалкония хлорида, превышающий концентрацию 0,005%, значительно нарушает липидный слой СП [19, 20]. Новые варианты консервантов оказывают менее губительное воздействие на глазную поверхность. Так, например, поликватерниум не оказывает детергентного действия и не разрушает липидный слой СП, благодаря чему нежелательные эффекты в отношении глазной поверхности сведены к минимуму [21]. Существует также группа окислительных консервантов, распадающихся при контакте со слезой. К ним относят перборат натрия — после инстилляции в конъюнктивальную полость консервант преобразуется в воду и кислород; а также стабилизированный оксихлорокомплекс — консервант, состоящий из хлорита, хлората натрия и диоксида хлора и распадающийся под действием света [21]. Однако необходимо отметить, что даже так называемые «исчезающие консерванты» могут оказывать некоторое негативное воздействие на глазную поверхность, поэтому предпочтительной формой слезозаменителей остаются бесконсервантные монодозные препараты [22].
Отдельную роль в составе слезозаменителей играет наличие электролитов. При ССГ их концентрация в слезной жидкости увеличивается вследствие испарения и/или недостаточной выработки слезы. Установлено, что относительно высокий уровень калия в слезной жидкости способствует защите эпителия роговицы от УФ-воздействия и поддержанию нормальной толщины роговицы. Кроме того, целостность и светорассеивающие свойства роговичного эпителия в значительной степени зависят от колебаний концентраций в слезе калия, кальция, магния, бикарбоната и хлорида натрия [6].
Биологические заменители слезы
Производство и применение биологических замени-телей слезы для лечения ССГ в настоящее время ограничено требованиями законодательства разных стран к препаратам крови, обязательным серологическим исследованием на наличие вируса иммунодефицита человека, гепатитов и других инфекций, а также коротким сроком хранения препаратов данной группы с соблюдением особого температурного режима. Однако, несмотря на указанные сложности, биологические заменители слезы имеют и ряд существенных преимуществ при лечении ССГ. Так, например, аутологичная сыворотка имеет pH, сходный с таковым слезной жидкости, а также содержит витамины и биологически активные вещества (эпителиальный фактор роста, фактор роста нервов и т. д.). Кроме того, сыворотка ингибирует высвобождение провоспалительных цитокинов, повышает количество бокаловидных клеток в конъюнктиве и стимулирует выработку муцина [23, 24]. Для применения в клинической практике на сегодняшний день разработано также много препаратов на основе тромбоцитов: обогащенная тромбоцитами плазма; плазма, обогащенная факторами роста; лизат тромбоцитов. Согласно результатам исследования J.L. Alio et al. инстилляции плазмы, обогащенной тромбоцитами, 4–6 р/сут больным ССГ способствуют уменьшению симптомов заболевания на 89% уже через 1 мес. после начала лечения [25].
Применение криоконсервированной амниотической мембраны при лечении ССГ купирует воспалительную реакцию за счет индукции апоптоза нейтрофилов и моноцитов, уменьшения инфильтрации нейтрофилами и макрофагами. Кроме того, доказана способность амниотической мембраны стимулировать регенерацию роговичных нервов благодаря присутствию фактора роста нервов [26].
Препараты, стимулирующие секрецию слезы
Еще одной группой препаратов для слезозаместительной терапии являются секретагоги — стимуляторы слезо-течения, которые доступны или находятся в стадии разработки в других странах. Существуют стимуляторы водного, муцинового и/или липидного слоев СП. Препарат Diquafosol tetrasodium (Diquas, Santen, Япония) одобрен к применению в качестве 3% офтальмологического раствора в Японии и Южной Корее. Данный препарат стимулирует водный компонент СП и секрецию муцина из эпителиальных и бокаловидных клеток конъюнктивы [27]. По данным Y.S. Byun, инстилляции Diquafosol tetrasodium способствуют эффективному заживлению эпителиальных дефектов роговицы [28]. Препарат Rebamipide (Mucosta; Otsuka pharmaceutical, Япония) в настоящее время одобрен в Японии для лечения ССГ как стимулятор муциноподобных гликопротеинов в роговичном эпителии, повышающий уровень экспрессии мукопротеинов MUC1, MUC4 и MUC16 [29, 30].
Альтернативным методом стимуляции слезопродукции при лечении ССГ является назальная нейростимуляция, основанная на усилении выработки слезной жидкости после химического или механического раздражения слизистой оболочки носовой полости с помощью специального устройства [31]. Интраназальный стимулятор TrueTear (Allergan, США) состоит из ручного блока-стимулятора с одноразовым гидрогелевым наконечником и наружного зарядного устройства. Согласно результатам клинических исследований применение интраназального стимулятора способствует значительному уменьшению симптомов сухости и раздражения глазной поверхности у больных ССГ (по данным опросника OSDI), а также улучшению показателей теста Ширмера и увеличению объема выработки слезы [32].
Противовоспалительная терапия синдрома «сухого глаза»
Консервативное лечение ССГ, особенно средней и тяжелой степени, на сегодняшний день невозможно без местной противовоспалительной терапии с назначением нестероидных противовоспалительных средств (НПВС), кортикостероидов, антиметаболитов. Однако применение препаратов данных фармакологических групп требует тщательного контроля за состоянием глазной поверхности больных ССГ в связи с риском развития осложнений (присоединение вторичной инфекции, изъязвление поверхности роговицы, транзиторное повышение офтальмотонуса, прогрессирование катаракты) [32].
В настоящее время для достижения противовоспалительного эффекта при лечении ССГ достаточно широко применяются инстилляции 0,05% раствора циклоспорина (Рестасис, Allergan, США) из группы антиметаболитов [33]. Механизм действия препарата связан с ингибированием серин/треонин фосфатазы (кальциневрин) и последующим снижением экспрессии генов, участвующих в активации Т-клеток. Следствием этого является подавление антиген-зависимой секреции активированными Т-лимфоцитами провоспалительных лимфокинов [34]. Согласно клиническим исследованиям инстилляции 0,05% раствора циклоспорина при лечении ССГ способствуют увеличению объема секретируемой слезы, повышению плотности бокаловидных клеток конъюнктивы, а также улучшают субъективные ощущения у больных, уменьшая при этом риск повреждения эпителия роговицы [35, 36].
Одно из базовых средств противовоспалительной терапии ССГ — 0,1% раствор дексаметазона фосфата, который блокирует факторы транскрипции: ядерный фактор κB и активатор белка, ингибируя тем самым транскрипцию интерлейкина-2. Помимо этого, под действием дексаметазона фосфата уменьшается число Т- и В-лимфоцитов, снижается выработка иммуноглобулинов и компонентов системы комплемента. Однако длительное применение данного препарата сопряжено с риском развития большого числа побочных эффектов. Под руководством профессора В.В. Бржеского для лечения ССГ разработан лекарственный препарат, содержащий 0,01% раствор дексаметазона фосфата, 6% раствор поливинилпирролидона и 1,5–5,5% раствор декстрозы, показавший высокую клиническую эффективность в комплексной терапии ССГ [34, 37].
Механизм действия НПВС связан с ингибированием циклооксигеназы в каскаде окисления арахидоновой кислоты, благодаря чему снижается синтез простагландинов, ответственных за развитие воспалительной реакции. Однако простагландины необходимы для синтеза белка и ДНК в эпидермальных клетках. Кроме того, НПВС, особенно при длительном местном применении, вызывают дистрофические изменения со стороны эпителия конъюнктивы и роговицы с развитием поверхностного точечного кератита. В связи с этим вопрос о целесообразности и эффективности применения препаратов данной фармакологической группы при лечении ССГ остается открытым [34, 38].
Для лечения дисфункции мейбомиевых желез как одной из основных причин ССГ многие исследователи рекомендуют системное и местное применение антибактериальных препаратов. Так, например, антибиотики тетрациклинового ряда (доксициклин) ингибируют продукцию бактериальных липаз, улучшая тем самым липидный профиль мейбомиевых масел. Местное применение азитромицина оказывает и антибактериальное, и противовоспалительное действие [39, 40].
Одним из новых препаратов с противовоспалительным действием для лечения ССГ является 5% раствор Lifitegrast (Xiidra, Novartis, Швейцария), представляющий собой функционально-ассоциированный антагонист антигена лимфоцитов-1 (Lymphocyte function-associated antigen-1, LFA-1). Препарат блокирует взаимодействие белков клеточной поверхности LFA-1 с молекулами межклеточной адгезии-1, а также ингибирует миграцию Т-клеток и высвобождение провоспалительных цитокинов при ССГ [41, 42].
В настоящее время при разработке препаратов для лечения ССГ с целью улучшения доступности лекарств используются нанотехнологии. Препаратами, изготовленными на основе данных технологий, являются KPI-121 (Kala Pharmaceuticals, США) — наночастичный препарат кортикостероида, а также лотепреднол этабонат и OTX-101 (Seciera, Sun Pharma, Индия) — наномицеллярные препараты циклоспорина и RGN-259 (ReGenTree, США) — синтетическая копия природного белка тимозина β4, который, как предполагается, способствует миграции эпителиоцитов роговицы и уменьшает выраженность воспаления [42].
Хирургические методы лечения синдрома «сухого глаза»
Хирургическое лечение ССГ проводится при тяжелых формах течения заболевания, когда фармакотерапия не позволяет достичь ожидаемого эффекта, что отрицательно сказывается на качестве жизни больного. Необходимо отметить, что оперативные вмешательства при ССГ сопряжены с риском повреждения роговицы и конъюнктивы и присоединения вторичной инфекции в послеоперационном периоде.
Одним из щадящих методов хирургического лечения заболевания является закрытие просвета слезных точек с помощью обтураторов для уменьшения оттока слезной жидкости и удержания ее на глазной поверхности. Обтураторы, состоящие из ателоколлагена — коллагена, предварительно обработанного протеазами, после установки в слезные точки превращаются в гель, который постепенно, в течение 1–16 нед. растворяется. Нерастворимые обтураторы слезных точек изготавливаются из силикона и имеют различный дизайн. Для временной окклюзии слезных точек используется также цианакрилатный клей. Кроме того, возможно проведение диатермокоагуляции нижней слезной точки. Основными осложнениями данных операций являются спонтанное выталкивание обтуратора из слезной точки и присоединение вторичной инфекции [43, 44].
Ранее, в особо тяжелых случаях ССГ с изменениями роговицы ксеротического характера, выполняли такие операции, как пересадка протока околоушной слюнной железы, трансплантация подчелюстной слюнной железы. В настоящее время указанные хирургические вмешательства выполняются довольно редко [45, 46]. К операциям, ограничивающим испаряемость слезной жидкости, относятся канторафия (ушивание век с медиального или латерального угла глазной щели) и тарзорафия (полное или частичное сшивание краев век). Также в настоящее время весьма успешно при хирургии ССГ используется биологическое покрытие роговицы с целью снижения патологического воздействия внешних факторов на глазную поверхность.
Немедикаментозные способы лечения синдрома «сухого глаза»
Соблюдение рекомендаций для исключения или минимизации воздействия внешних факторов риска, способствующих развитию и прогрессированию ССГ, позволяет существенно облегчить и/или улучшить состояние больного. Общеизвестно, что глазная поверхность наиболее подвержена воздействию ветра, низкой относительной влажности, пониженной или повышенной температуры, УФ-излучения, загрязняющих веществ, табачного дыма и др. [47–49]. На начальном этапе лечения больным ССГ рекомендуется использование увлажнителей воздуха или специальных очков для увлажнения воздуха рядом с глазом. Пользователям компьютеров и других гаджетов рекомендуется делать перерывы при зрительной работе и размещать монитор устройства ниже уровня глаз, благодаря чему уменьшается площадь открытой глазной поверхности [8].
В последние годы разработано большое количество пищевых добавок, содержащих омега-3 и омега-6 полиненасыщенные жирные кислоты (ПНЖК). Согласно научным исследованиям биодобавки с омега-3 ПНЖК способствуют повышению стабильности СП за счет модифицирования внутриклеточных липидов в слезных железах. Комбинация омега-3 и омега-6 ПНЖК также оказывает положительное влияние на качество и количество внутриклеточных липидов в мейбомиевых железах. При этом эффективность приема пероральных добавок существенно повышается, если основным компонентом добавки является омега-3 ПНЖК в отдельности или с меньшей долей омега-6 ПНЖК [50].
Заключение
На сегодняшний день существует большое число консервативных и хирургических методов лечения ССГ, применение которых позволяет облегчить течение заболевания и улучшить качество жизни больных. Выбор того или иного варианта лечения должен носить исключительно персонализированный характер, с обязательным учетом возраста больного и его рода деятельности, факторов риска и степени тяжести ССГ, наличия сопутствующих офтальмологических и системных заболеваний. При этом проводимое лечение не всегда обеспечивает достижение желаемого терапевтического эффекта с облегчением состояния больного. Поэтому поиск и разработка новых лечебно-профилактических мероприятий при лечении ССГ являются на сегодняшний день одной из актуальных проблем современной офтальмологии.
Сведения об авторах:
Татарникова Елена Борисовна — заочный аспирант кафедры офтальмологии, ORCID iD 0000-0003-3038-8117;
Кривошеина Ольга Ивановна — д.м.н., профессор, заведующая кафедрой офтальмологии, ORCID iD 0000-0001-7509-5858.
ФГБОУ ВО СибГМУ Минздрава России. 634050, Россия, г. Томск, Московский тракт, д. 2.
Контактная информация: Татарникова Елена Борисовна, e-mail: elenka.morozova.92@inbox.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 01.06.2020.
About the authors:
Elena B. Tatarnikova — distant postgraduate student of the Department of Ophthalmology, ORCID iD 0000-0003-3038-8117;
Olga I. Krivosheina — Doct. of Sci. (Med.), Professor, Head of the Department of Ophthalmology, ORCID iD 0000-0001-7509-5858.
Siberian State Medical University. 2, Moskovskiy tract, Tomsk, 634050, Russian Federation.
Contact information: Elena B. Tatarnikova, e-mail: elenka.morozova.92@inbox.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 01.06.2020.
ВВЕДЕНИЕ
В последние годы все большую актуальность для клинической практики приобретает синдром «сухого глаза», клинически проявляющийся роговично-конъюнктивальным ксерозом различной выраженности. По этой причине оба термина достаточно правомочны при обозначении рассматриваемого заболевания и широко используются в литературе.
В целом, к cиндрому «сухого глаза» относят комплекс клинико-функциональных признаков высыхания (ксероза) поверхности роговицы и конъюнктивы вследствие длительного нарушения стабильности слезной пленки, покрывающей роговицу.
Синдром «сухого глаза» в настоящее время служит одной из нередких причин хронического раздражения глаза, воспалительной инъекции сосудов конъюнктивы и, соответственно, «красного глаза».
Рассматриваемое заболевание характеризуется главным образом обилием субъективных симптомов при относительно менее выраженных объективных признаках. Вместе с тем ксеротические процессы в роговице и конъюнктиве, свойственные синдрому «сухого глаза», зачастую достигают и такой выраженности, когда приходится предпринимать экстренные хирургические вмешательства для сохранения зрительных функций и глазного яблока пациента.
ЭПИДЕМИОЛОГИЯ СИНДРОМА «СУХОГО ГЛАЗА»
По данным разных авторов, рассматриваемое заболевание распространено в среднем у 15-17% всего взрослого населения развитых стран мира. Причем этот показатель имеет тенденцию к повышению из года в год. Так, за последние 30 лет частота обнаружения синдрома «сухого глаза» возросла в 4,5 раза!
Увеличение распространенности синдрома «сухого глаза» в последние годы связано также с дальнейшим развитием кераторефракционных хирургических вмешательств (ЛАЗИК, ЛАСИК, ФРК, уходящая в прошлое передняя радиальная кератотомия и др.).
На рост заболеваемости синдромом «сухого глаза» влияние также оказывают широкое распространение компьютерных мониторных систем, кондиционеров и другого офисного оборудования, совершенствование средств контактной коррекции зрения и других «составляющих» жизни современного цивилизованного общества. Важным «вкладом» в распространенность синдрома «сухого глаза» также является систематическое применение современных медикаментозных препаратов самой различной направленности, использование косметических средств (и косметических операций на коже лица), ухудшение экологической обстановки.
ПАТОГЕНЕЗ СИНДРОМА «СУХОГО ГЛАЗА»
В основе возникновения рассматриваемого заболевания лежит нарушение стабильности слезной пленки, в норме покрывающей переднюю поверхность глазного яблока.
Известно, что толщина слезной пленки у здоровых людей в среднем составляет всего 10 мкм. В структурном отношении слезная пленка неоднородна.
Снаружи она покрыта тонкой пленкой липидов, препятствующей чрезмерному испарению влаги, а также теплоотдаче с поверхности эпителия роговицы и конъюнктивы.
Второй, водянистый слой (продукт секреции добавочных и главной слезных желез), составляет основу слезной пленки. Непрерывное его обновление обеспечивает метаболические, защитные и другие биологические функции слезной пленки.
Важным структурным составляющим водянистого слоя служит его муциновый компонент. Муцины продуцируют бокаловидные клетки конъюнктивы. Основная их функция заключается в придании гидрофобному эпителию роговицы гидрофильных свойств, позволяющих удерживать слезную пленку на роговице (рис. 1).
Нарушения процессов физиологического обновления слезной пленки у здоровых людей лежит в основе патогенеза синдрома «сухого глаза» (рис. 2). При этом они весьма разнообразны и могут касаться различных звеньев формирования и функционирования слезной пленки (схема 1):
— продукции слезы, муцинов и липидов;
— скорости испарения слезной пленки;
— формирования слезной пленки на поверхности эпителия роговицы.
КЛИНИЧЕСКАЯ КЛАССИФИКАЦИЯ СИНДРОМА
«СУХОГО ГЛАЗА»
Клиническая классификация синдрома «сухого глаза» представлена в таблице 1.
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ СИНДРОМА
«СУХОГО ГЛАЗА»
Рассматриваемое заболевание проявляет себя обилием неспецифических субъективных симптомов, которые сочетаются с менее выраженными объективными проявлениями патологии и определяют ее тяжесть.
Легкая клиническая форма ксероза характеризуется наличием микропризнаков заболевания, которые развиваются на фоне компенсаторно повышенной слезопродукции. На первый взгляд парадоксально, однако таких пациентов беспокоит слезотечение.
Причем оно заметно усиливается при воздействии на глаз неблагоприятных факторов внешней среды.
Особого внимания заслуживают специфические признаки ксероза. Характерна негативная реакция больных на закапывание в конъюнктивальную полость даже вполне индифферентных глазных капель, так как оно сопровождается ощущением жжения или рези в глазу. Закапывание же в него обычно раздражающих капель сопровождается появлением резко выраженных болей.
Встречается также симптом плохой переносимости кондиционированного воздуха, тепловентиляторов, ветра, дыма и смога. Аналогичные явления также наблюдают некоторые пациенты при просмотре телевизора, работе за компьютером или при чтении, особенно в вечернее время.
Среди объективных признаков специфическим, однако относительно редким симптомом служит характерное отделяемое из конъюнктивальной полости. При туалете век оно вследствие высокой вязкости вытягивается в виде тонких слизистых нитей, тягостно переносимых больными.
Достаточно демонстративным объективным признаком ксероза служит замедленное разлипание тарзальной и бульбарной конъюнктивы при оттягивании нижнего века, свидетельствующее о дефиците муцинов в конъюнктивальной полости.
Кроме рассмотренных специфических микропризнаков, у больных с легким роговично-конъюнктивальным ксерозом одновременно отмечены и косвенные его симптомы.
Клиническое течение глазного ксероза средней степени тяжести определяется, как правило, совокупностью тех же микропризнаков роговично-конъюнктивального ксероза, которые рассмотрены выше. Однако частота их обнаружения и степень выраженности заметно превышают таковые при легком ксерозе.
Кроме того, у таких больных уже отсутствует рефлекторное слезотечение и появляются признаки дефицита слезопродукции.
В частности, у них заметно уменьшаются или полностью отсутствуют у краев век слезные мениски. Место отсутствующего мениска обычно занимает отекшая и потускневшая конъюнктива, «наползающая» на свободный край века (так называемый конъюнктивохалазис).
Тяжелый роговично-конъюнктивальный ксероз встречается в виде одной из трех клинических форм — нитчатого кератита, «сухого» кератоконъюнктивита и рецидивирующей эрозии роговицы.
Нитчатый кератит характеризуется образованием на роговице единичных, а чаще множественных эпителиальных разрастаний в виде нитей, фиксированных одним концом к ее эпителию (рис. 3). Свободный конец такой нити смещается по роговице при мигании и раздражает глаз, что вызывает роговичный синдром, но, как правило, без воспалительных изменений конъюнктивы.
«Сухой» кератоконъюнктивит наряду с признаками нитчатого кератита и микропризнаками ксероза проявляет себя выраженными изменениями поверхности глазного яблока воспалительно-дегенеративного характера. При этом наблюдаются изменения рельефа эпителия роговицы в виде блюдцеобразных эпителизированных или неэпителизированных углублений, субэпителиальных ее помутнений различной выраженности, эпителиальных нитей (рис. 4). Она теряет в ряде случаев также свой блеск, становится тусклой и шероховатой. Зачастую расширяется и зона поверхностной перилимбальной васкуляризации. Бульбарная конъюнктива тускнеет, наблюдается ее «вялая» гиперемия и отек у краев век. При мигании она увлекается веками, смещаясь по глазному яблоку в большей степени, чем у здоровых людей. Течение заболевания хроническое, с частыми обострениями и ремиссиями.
Рецидивирующая эрозия роговицы характеризуется периодическим возникновением поверхностных микродефектов эпителия роговицы. Обычно они связаны со слипанием заднего ребра века с эпителием роговицы во сне вследствие дефицита липидного слоя слезной пленки. При пробуждении (или во время быстрой фазы сна) веко смещается относительно роговицы, отрывая часть ее эпителиальных клеток. Однако, несмотря на небольшую площадь, такие эрозии сохраняются достаточно долго (до 2-3 суток и более), медленно эпителизируясь (рис. 5). Характерен выраженный роговичный синдром, сменяющийся длительным дискомфортом даже по завершении эпителизации эрозии. Однако уже через 2-3 месяца, а иногда и раньше, заболевание обычно вновь рецидивирует.
Особо тяжелый роговично-конъюнктивальный ксероз развивается обычно у больных с полным или частичным несмыканием глазной щели вследствие лагофтальма различного генеза с нарушением иннервации роговицы, пемфигусом или с выраженным недостатком в организме витамина А. При этом заболевание проявляется в одной из четырех нозологических форм:
— кератит вследствие несмыкания глазной щели;
— ксеротическая язва роговицы;
— рубцующий пемфигоид (пемфигус глаза);
— ксероз конъюнктивы и роговицы на почве недостаточности витамина А.
Кератит вследствие несмыкания глазной щели достаточно хорошо известен каждому врачу, и поэтому не нуждается в подробном описании. Необходимо лишь иметь в виду, что у ослабленных больных он может осложниться развитием язвы с последующей перфорацией роговицы.
Ксеротическая язва роговицы характеризуется образованием дефекта роговицы с захватом ее стромы и тенденцией к дальнейшему углублению (чаще — без расширения по площади), вплоть до перфорации. Язва почти всегда локализуется в пределах открытой глазной щели (рис. 6). Клиническое течение заболевания затяжное с медленным прогрессированием, несмотря на активно проводимую терапию.
Рубцующий пемфигоид (так называемый пемфигус глаза) характеризуется изолированным поражением всех отделов конъюнктивы с прогрессирующим рубцеванием, укорочением сводов конъюнктивы и развитием сосудистого паннуса (рис. 7). Заболевание медленно, но упорно прогрессирует. Зрение снижается, когда помутнение захватывает оптическую зону роговицы.
Ксерофтальмия на почве выраженного авитаминоза А еще относительно недавно была характерна в основном для жителей (преимущественно детей) стран Южной и Восточной Азии, некоторых районов Африки, Ближнего Востока и Латинской Америки. Однако таких больных можно встретить и в нашей стране (дети с плохим усвоением витамина А, с тяжелой формой аллергии и т.п.). В патогенезе рассматриваемой патологии лежит недоразвитие эпителиальных и бокаловидных клеток конъюнктивы, дифференцирование которых в норме регулируют метаболиты витамина А. В результате развивается чешуйчатая метаплазия эпителия с последующей кератинизацией конъюнктивы.
Ксерофтальмия рассматриваемого генеза в своем развитии проходит несколько стадий, являющихся, с другой стороны, и самостоятельными нозологическими формами: стадию конъюнктивального ксероза (рис. 8), паренхиматозного ксероза роговицы, ксеротической язвы роговицы и, наконец, кератомаляции с последующей потерей глаза.
В заключение следует отметить, что в большинстве своем (пожалуй, за исключением случаев выраженного ксероза) клиническая картина синдрома «сухого глаза» характеризуется обилием неспецифических симптомов. При этом признаки, патогномоничные для рассматриваемой патологии, зачастую отступают на задний план, маскируясь косвенными симптомами.
В силу рассмотренных обстоятельств большое значение приобретают рационально спланированные диагностические мероприятия в отношении больных с данной патологией.
ДИАГНОСТИКА СИНДРОМА «СУХОГО ГЛАЗА»
Обследование пациентов с подозрением на рассматриваемое заболевание базируется на традиционных клинических методах и в сомнительных случаях дополняется постановкой специальных функциональных проб (схема 2).
Клиническое обследование больного складывается из сбора жалоб и анамнеза, ориентированного на выяснение возможных причин развития синдрома «сухого глаза», а также тщательного осмотра с помощью щелевой лампы свободного края век, роговицы и конъюнктивы.
Выяснение жалоб больного должно заключаться в активном исключении каждого субъективного симптома из перечня, представленного в таблице 2.
Сбор анамнеза должен быть целенаправлен на активный поиск общих заболеваний, которые могли бы вызвать синдром «сухого глаза». Перечень наиболее значимых из них представлен ниже.
1. Заболевания соединительной ткани (коллагенозы):
• первичный и вторичный синдром Съегрена;
• ревматоидный артрит;
• системная красная волчанка;
• узелковый периартериит (синдром Kussmaul);
• склеродермия.
2. Заболевания гемопоэтической и ретикулоэндотелиальной систем:
• ревматоидный артрит, сочетанный со спленомегалией и нейтропенией (синдром Фелти);
• аутоиммунный процесс отторжения трансплантата костного мозга, реакция «трансплантат против хозяина» и т.п.;
• гемолитическая анемия;
• хронический гепатит; первичный билиарный цирроз.
3. Эндокринные дисфункции:
• перименопауза;
• эндокринная и тиреотоксическая офтальмопатия;
• сахарный диабет.
4. Заболевания кожи и слизистых оболочек, приводящие к комбинированной недостаточности слезы и муцинов:
• пемфигус и рубцующий пемфигоид;
• токсический эпидермальный некролиз (синдром Лайла);
• эксфолиативный и герпетический дерматит и др.
Синдромом «сухого глаза» зачастую также осложняются и некоторые офтальмологические операции и повреждения органа зрения.
1. Кераторефракционные операции:
• кератомилез in situ (ЛАЗИК);
• субэпителиальная ФРК (ЛАСИК);
• фотоабляция роговицы (ФРК);
• передняя радиальная кератотомия.
2. Реконструктивные и прочие операции:
• вмешательства, сопровождающиеся нанесением разрезов на роговицу и конъюнктиву;
• экстирпация слезной железы.
3. Последствия повреждений органа зрения:
• деформация конъюнктивальной полости;
• укорочение век с неполным их смыканием;
• рубцовые изменения поверхности роговицы;
• рецидивирующая эрозия роговицы.
Следует также учитывать и артифициальные факторы, стимулирующие развитие роговично-конъюнктивального ксероза:
• кондиционированный воздух или воздух с примесью взвешенных пылевых частиц;
• усиленная конвекция воздуха от тепловентиляторов;
• электромагнитное излучение от компьютерных и телевизионных систем;
• мягкие и жесткие контактные линзы в случаях плохой индивидуальной их переносимости, дефекта подбора или погрешностей в использовании;
• косметические средства плохого качества, нанесенные на ресницы, кожу век и лица или в случаях их плохой индивидуальной переносимости;
• дым, в том числе от сигарет, смог;
• испарения различных химических веществ (лаки, краски, химические растворители и т.п.), в том числе от полимерных покрытий офисных помещений.
При расспросе больного необходимо также обращать внимание на возможное системное и местное применение им препаратов, нарушающих слезопродукцию или стабильность слезной пленки:
• средства, снижающие артериальное давление: α1- и α2-адреноблокаторы, β-адреноблокаторы;
• адреномиметические вещества;
• антиаритмические препараты;
• антидепрессанты;
• препараты для лечения язвенной болезни (холинолитики);
• «малые» транквилизаторы;
• антигистаминные препараты;
• оральные контрацептивные средства.
Необходимо отметить, что синдром «сухого глаза» могут стимулировать и некоторые глазные капли (при длительном местном применении): β-адреноблокаторы, холинолитики, глюкокортикостероиды, а также препараты, содержащие токсичные консерванты.
В ходе биомикроскопии глазной поверхности активный поиск должен быть направлен на выявление объективных микропризнаков ксероза (табл. 2). При этом следует воспользоваться диагностическими красителями: флюоресцеином натрия (окрашивает в зеленый цвет поверхностные дефекты эпителия роговицы), бенгальским розовым и лиссаминовым зеленым. Последние окрашивают, соответственно, в красный и зеленый цвет, погибшие и дегенерированные (но еще присутствующие на эпителиальной мембране роговицы и, главное, конъюнктивы) клетки, а также эпителиальные и слизистые нити (рис. 9).
В пользу диагноза синдрома «сухого глаза» свидетельствует обнаружение дегенеративных изменений на роговице и конъюнктиве в пределах открытой глазной щели (рис. 10).
Функциональное обследование больного показано в случаях, когда природа выявленных у него изменений остается неясной. Оно состоит из последовательной постановки двух специальных проб, позволяющих оценить стабильность прероговичной слезной пленки и измерить величину общей слезопродукции.
Определение стабильности слезной пленки осуществляют методом Norn M. (1969) после закапывания в конъюнктивальную полость 0,1% раствора флюоресцеина натрия. Первый разрыв в подкрашенной слезной пленке на открытом глазу (рис. 11) не должен возникнуть быстрее, чем через 10 секунд после последнего мигания.
Величину суммарной слезопродукции определяют пробой по Schirmer O. с помощью тонкой полоски (длиной 35 мм и шириной 5 мм) из фильтровальной бумаги. Полоску помещают одним концом за нижнее веко исследуемого глаза (рис. 12) и через 5 минут оценивают длину смоченной слезой части полоски. В норме смачивается не менее 15 мм тестовой полоски.
ЛЕЧЕНИЕ БОЛЬНЫХ С СИНДРОМОМ «СУХОГО ГЛАЗА»
Лечение пациентов с рассматриваемой патологией органа зрения предусматривает осуществление мероприятий следующей направленности (схема 3). Основные из них призваны купировать процессы высыхания и воспаления в тканях глазной поверхности, а также стабилизировать слезную пленку. Кроме того, большое значение также имеют лечебные мероприятия, направленные на компенсацию сопутствующих ксерозу изменений глаз и организма.
Увлажнение глазной поверхности и стабилизация слезной пленки являются основным направлением лечения больных с синдромом «сухого глаза». На практике оно включает следующие мероприятия:
— инстилляции препаратов «искусственной слезы» в виде глазных капель и гелей;
— стимулирование слезопродукции;
— обтурация слезоотводящих путей в целях сокращения оттока влаги из конъюнктивальной полости;
— пересадка слюнных желез слизистой рта в конъюнктивальную полость.
Первый этап лечения предусматривает использование в качестве базовых средств различных заменителей слезной жидкости (так называемых препаратов «искусственной слезы»), отличающихся в основном вязкостью и вариантом химического состава. Фармакологический эффект этих препаратов обусловлен их протезирующим действием на водянисто-муциновый слой прероговичной слезной пленки. Входящие в их состав гидрофильные полимеры (производные метилцеллюлозы и гиалуроновой кислоты, поливиниловый спирт, поливинилпирролидон и др.) смешиваются с остатками нативной слезы и образуют собственную прероговичную пленку. «Искусственную слезу» закапывают в конъюнктивальную полость больного глаза с периодичностью 4-6 раз в день. В результате разрывы слезной пленки возникают реже и существенно повышается ее стабильность. Ниже представлен перечень современных препаратов «искусственной слезы», зарегистрированных в нашей стране.
Препараты низкой вязкости:
— Слеза натуральная (Alcon);
— Оксиал (Santen);
— Офтолик (Promed Exports);
— Лакрисифи (Sifi);
— Хило-Комод (Ursapharm);
— Гипромелоза-П (Unimed Pharma);
— Дефислез (Синтез);
— Визмед-лайт (Robert′s Healthcare Int.).
Препараты средней вязкости:
— Лакрисин (Spofa);
— Визмед, Визмед-мульти (Robert′s Healthcare Int.).
Препараты с трансформационным эффектом (трансформируются из жидкости в гель при закапывании):
— Систейн (Alcon);
— Систейн Ультра (Alcon) /Доступен в России с февраля 2011 года/.
Глазные гели:
— Офтагель (Santen);
— Видисик (Bausch & Lomb);
— Визмед-гель (Robert′s Healthcare Int.).
Особо вязкие:
Вит-А-ПОС (Ursapharm).
Несмотря на достаточно большой ассортимент препаратов «искусственной слезы», каждый из них имеет свою «нишу» в лечении больных с рассматриваемым заболеванием. Так, препараты низкой вязкости более эффективны при легких формах, препараты средней вязкости и гели — при ССГ средней степени тяжести, а также тяжелых и особо тяжелых формах ксероза. Препараты Систейн и Систейн Ультра применяются при различной степени тяжести ССГ, так как способны становиться более или менее вязкими в зависимости от тяжести состояния (табл. 3). Препараты, содержащие в своем составе стимуляторы регенерации, целесообразно назначать при выраженных дегенеративных изменениях глазной поверхности, бесконсервантные «искусственные слезы» — при ношении контактных линз и при особо тяжелом синдроме «сухого глаза».
Стимуляция слезопродукции служит дополнительным медикаментозным способом увлажнения глазной поверхности. Среди различных мероприятий рассматриваемой направленности (магнитои лазеростимуляция, субконъюнктивальное введение трофических коктейлей на основе аутоплазмы крови) внимания заслуживает системное введение трентала. Так, по данным Луцевич Е.Э. и соавт. (2005), прием трентала по 100 мг — 2-3 раза в день в течение 2 мес. приводит к заметному увеличению основной слезопродукции.
Обтурацию слезоотводящих путей (полимерными обтураторами или хирургическими вмешательствами) используют либо при неэффективности медикаментозной терапии, либо при потребности в чрезмерно частом (свыше 6 раз в день) закапывании «искусственной слезы». Рассматриваемые мероприятия, как и операцию по пересадке слюнных желез в конъюнктивальную полость, обычно осуществляют в условиях офтальмологического стационара, куда и следует направить таких больных.
Купирование воспалительного процесса в тканях глазной поверхности служит важным звеном медикаментозной терапии синдрома «сухого глаза».
Среди препаратов рассматриваемой направленности наиболее доступными и достаточно эффективными оказались глюкокортикостероиды, безопасное применение которых возможно лишь при условии полной эпителизации роговицы. В указанных целях хорошо зарекомендовали себя инстилляции в конъюнктивальную полость дексаметазона в разведении 1:10 в гемодезе (или полиглюкине). Препарат закапывают с частотой 1-2 раза в день, продолжительность инстилляций определяют индивидуально.
Вместе с тем, даже при таком минимальном дозировании препарата, необходим контроль за толщиной роговицы, особенно в местах ее изначального истончения.
Системное применение тетрациклина (по 20 мг 2 раза в день курсами по 2 месяца) оказывает стимулирующий эффект на секрецию мейбомиевых желез век, продуцирующих липидный слой слезной пленки. Данное терапевтическое мероприятие призвано уменьшить испаряемость слезной пленки. Кроме того, клинический эффект тетрациклина связан с ингибированием выработки медиаторов воспалительной реакции в тканях глазной поверхности.
Инстилляции аутосыворотки крови (3-4 раза в день) наряду с эффектами «биологической искусственной слезы» позволяют уменьшить выраженность воспалительного процесса, а также стимулировать пролиферацию в тканях глазной поверхности за счет содержащихся в ней биологически активных веществ.
Существенным клиническим эффектом при тяжелом и особо тяжелом роговично-конъюнктивальном ксерозе обладают препараты 0,01% раствора циклоспорина-А (Restasis, фирма Allergan и др.). Препарат инстиллируют в конъюнктивальную полость больного глаза с частотой 2 раза в день в течение 3 месяцев, при необходимости курс лечения продлевают. Эффект этого известного цитостатика основан на уменьшении лимфоидной инфильтрации, а также на предупреждении выброса провоспалительных цитокинов в тканях слезных желез и конъюнктивы.
Метаболическая терапия показана больным с роговичноконъюнктивальным ксерозом, осложненным дегенеративными изменениями роговицы и конъюнктивы. Эффективными при ксерозе глазной поверхности являются препараты на основе искусственной слезы, содержащие в своем составе стимулятор регенерации декспантенол (Корнерегель, Bausch&Lomb; ХилозарКомод, Ursapharm, Гипромелоза-П, Unimed Pharma, Баларпан НЭП). Препараты инстиллируют в конъюнктивальную полость с частотой закапывания «искусственной слезы» соответствующей вязкости.
Отсутствие нормального блеска конъюнктивы, а также ее дегенеративные изменения служат показанием к 3-4-кратному местному применению препарата витамина А — ВитА-ПОС (Ursapharm), призванного нормализовать функцию бокаловидных клеток конъюнктивы, вырабатывающих муцин.
В норме поверхность наших глаз покрыта слёзной плёнкой, которая защищает их от высыхания, питает, а также препятствует проникновению вредных микроорганизмов и инородных частиц. Слёзы, в свою очередь, образуются в слёзных железах. Когда слёзная плёнка разрывается, рефлекторно происходит моргание, благодаря чему глаз снова увлажняется. В последние годы всё чаще причиной обращения к офтальмологу является нарушение данных процессов — так называемый синдром сухого глаза (по-научному — «сухой кератоконъюнктивит»). С возрастом заболеваемость увеличивается. По статистике женщины наиболее подвержены развитию заболевания.
Причины
К возникновению синдрома сухого глаза могут приводить два механизма — снижение образования слёзной жидкости либо чрезмерно быстрое её испарение с поверхности глаза. По статистике 75% людей, которые регулярно работают за компьютером, страдают синдромом сухого глаза. Концентрация нашего внимания на экране приводит к тому, что человек моргает в 3 раза реже, чем в норме, возникает зрительное напряжение. Неблагоприятная экологическая обстановка, работа в запылённых и загазованных помещениях, воздействие на слизистую оболочку кондиционированного воздуха либо отопления способствуют ускоренному испарению слёзной плёнки.
Многие заболевания и состояния также приводят к развитию синдрома сухого глаза:
- Сахарный диабет
- Анемия
- Дефицит витамина А
- Климакс
- Хронические заболевания глаз
- Травмы, ожоги глаз
- Синдром Шегрена — аутоиммунное заболевание, для которого характерно развитие сочетания симптомов сухого глаза и сухости во рту
- Заболевания щитовидной железы (при повышенном уровне тироксина и трийодтиронина наблюдается чрезмерное раскрытие глазной щели)
- Врождённые аномалии слёзной железы
Побочным эффектом некоторых препаратов (например, оральных контрацептивов, глюкокортикостероидов, антидепрессантов, противоаллергических, антиаритмических средств) также является сухость глаз. С возрастом выработка слёзной жидкости снижается, меняется её состав, поэтому пожилые люди находятся в группе риска по возникновению сухого кератоконъюнктивита. Доказано, у людей с избыточной массой тела слёзная жидкость имеет более низкое качество.
Несмотря на высокую кислородопроницаемость современных контактных линз, они в любом случае затрудняют доступ кислорода к тканям глаза. Около половины всех людей, которые носят линзы, предъявляют жалобы на синдром сухого глаза. Лазерные операции по коррекции зрения также нередко нарушают стабильность слёзной плёнки. Другая распространённая причина синдрома сухого глаза — использование глазных капель, содержащих консерванты.
Симптомы
Чаще всего первой жалобой таких пациентов является «песок в глазах», затем возникает слёзотечение, которое сменяется сильной сухостью. Характерны зуд, жжение, покраснение глаз, колебание остроты зрения в течение дня. Обычно поражаются оба глаза. Достаточно редко встречается выделение вязких слизистых нитей. Пациенты жалуются на усталость, стянутость глаз. Слизистая становится красной, возникают кровоизлияния. Глаза становятся крайне чувствительными к воздействию ветра, яркого света, кондиционированного воздуха. Также характерным признаком является возникновение болевого синдрома при использовании капель. Симптомы обычно наиболее выражены вечером после чтения или работы за компьютером.
Диагностика
Офтальмолог проведёт подробный расспрос, выяснит наличие травм и операций на органах зрения, уточнит, какие препараты вы принимаете и какие вредные профессиональные факторы имеете. Затем последует осмотр органа зрения, в сомнительных случаях также проводятся функциональные пробы. Тест Ширмера позволяет определить скорость образования слёзной жидкости, а тест Норна направлен на определение времени, за которое происходит разрыв слёзной плёнки. При подозрении на инфекционное происхождение конъюнктивита проводится посев мазка, а также выявление чувствительности микроорганизмов к антибиотикам. При необходимости офтальмолог назначит консультацию других узких специалистов (эндокринолога, аллерголога, ревматолога и т.д.).
Лечение
Терапия синдрома сухого глаза включает несколько направлений. Важной задачей является увлажнение глазной поверхности. С этой целью применяются препараты «искусственной слезы», которые различаются степенью вязкости и химическим составом. Компоненты данных препаратов связываются с естественной слезой человека, увеличивают её вязкость, уменьшают испарение. Нередко применяются методы, способные увеличить продукцию слёз — магнитостимуляция, лазеростимуляция, введение Трентала. С целью борьбы с воспалительным процессом применяются глюкокортикостероиды (например, Дексаметазон). По показаниям назначают антибиотики (мази с эритромицином или тетрациклином), длительность курса — 7-10 дней. Дополнительно могут применяться антигистаминные препараты.
Необходимо устранить неблагоприятные факторы окружающей среды — избегайте длительных зрительных нагрузок, по возможности уменьшите воздействие пыли, дыма, горячего и сухого воздуха — в помещении рекомендуется использовать увлажнители воздуха.
В редких случаях проводятся хирургические вмешательства, которые направлены на закрытие слёзных путей с целью устранения оттока слёзной жидкости.
Рекомендованные лекарства
- Видисик, 0,2%.
Глазной гель. Создает эффект увлажнения для конъюнктивы и роговицы, а также предупреждает образование повреждений эпителия и ускоряет его регенерацию. - Корнерегель, 5%.
Действующее вещество — Декспантенол, является предшественником пантотеновой кислоты, благодаря чему обладает теми же, что и она полезными свойствами, участвует во многих процессах обмена веществ. Корнерегель применяется при развитии повреждений роговицы. - Дефислез.
Увлажняет роговицу и защищает её от повреждающих воздействий. - Офтагель, 0,25%.
Преимуществом данного геля является способность увлажнять глаза на длительное время. Увеличивает вязкость слезы, образуя защитную увлажняющую пленку на поверхности роговицы. Уменьшает симптомы раздражения. - Катионорм.
Глазные капли увлажняют и защищают поверхность глаз.
Имеются противопоказания. Необходима консультация специалиста.
Осложнения
Отсутствие адекватного лечения синдрома сухого глаза влечёт за собой развитие грозных последствий, таких как бактериальные инфекции, изъязвления, необратимое помутнение роговицы. В наиболее тяжёлых случаях есть риск потерять зрение. При развитии осложнений возникают жалобы на острую боль в глазу, непроизвольное «зажмуривание», гнойные выделения.
Профилактика
Своевременно лечите заболевания глаз. Устраните воздействие вредных факторов (сухость, пыль в помещении), используйте только качественную косметику. Питайтесь разнообразно, пейте достаточно воды (30 мл на кг массы тела). При работе за компьютером делайте перерывы каждые 40 минут, проводите гимнастику для глаз, при использовании гаджетов чаще моргайте. Не носите контактные линзы дольше, чем рекомендует производитель. Используйте специальные очки, защищающие глаза от ультрафиолета и излучения монитора компьютера.
Синдром сухого глаза обычно является хронической проблемой. Самолечение недопустимо, только незамедлительное обращение к специалисту и соблюдение всех назначений врача позволят добиться хорошего результата в лечении.
Источники
- Бржеский В. В., Сомов Е. Е. // Роговично-конъюнктивальный ксероз (диагностика, клиника, лечение) — СПб.: «Левша».
-
Кашникова О. А. // Состояние слезной жидкости и способы стабилизации слезной пленки в фоторефракционной хирургии — Диссертация кандидата медицинских наук.
Информация представлена в ознакомительных целях и не является медицинской консультацией или руководством к лечению со стороны uteka.ru. Не занимайтесь самолечением, при появлении симптомов заболевания обратитесь к врачу.
Средний рейтинг 5 из 5 на основе 4 голосов
Слезозаместительная терапия синдрома «сухого глаза»
Искусственные заменители слезы
Одним из основных направлений лечения синдрома «сухого глаза» (ССГ) на современном этапе является применение искусственных заменителей слезы, содержащих водную основу и повышающих вязкость смазочных веществ на основе природных или синтетических полимеров. Данные компоненты, воздействуя на водный и муциновый слои прероговичной слезной пленки (СП), смешиваются с остатками нативной слезы и образуют собственную прероговичную СП [1]. Благодаря этому достигается гомеостатическое равновесие между постоянным испарением слезной жидкости и ее выработкой.
Искусственные заменители слезы в зависимости от степени вязкости подразделяются на средства низкой, средней, высокой вязкости и гели. К препаратам данной фармакологической группы предъявляются следующие требования [2]: стерильность; соответствие физиологическому значению рН естественной слезы (уровень pH=7,2–7,4); изотоничность; соответствующая осмолярность (181–354 мОсмоль/л); оптимальная вязкость, превышающая вязкость слезной жидкости, — 15–30 сПз или 5–15 мПа-с; бесцветность и прозрачность (без отрицательного влияния на оптические свойства глаза); отсутствие механических включений и риска загрязнения микрофлорой; отсутствие эффекта привыкания; хорошая переносимость и отсутствие токсичности; возможность применения при ношении контактных линз.
Фармацевтический рынок на сегодняшний день предлагает широкий ассортимент полимерных слезозаменителей (лубрикантов), содержащих полусинтетические (кармеллоза и гидроксипропилметилцеллюлоза) и синтетические полимеры (полиэтиленгликоль, пропиленгликоль, поливинилпирролидон, поливиниловый спирт, повидон, карбомер). В ряде препаратов используются природные полисахариды (натриевая соль гиалуроновой кислоты, гидроксипропилгуар, декстран, трегалоза, TS-полисахарид), обладающие максимальными восполняющими свойствами при патологии водного и муцинового слоев СП и стимулирующие регенерацию эпителия глазной поверхности [2, 3]. Помимо полимерной основы препараты искусственной слезы могут содержать электролиты, буферные растворы, регуляторы вязкости, а также консерванты, препятствующие росту микроорганизмов при вскрытии флакона [2].
Одним из традиционных компонентов искусственных слезозаменителей является гиалуроновая кислота (ГК), получившая широкое распространение благодаря образованию эффективной связи с водой, устойчивости к высыханию и отличной биосовместимости. ГК впервые была выделена из стекловидного тела глазного яблока в 1934 г. немецким биохимиком K. Meyer и его американским ассистентом J. Palmer, а позже была обнаружена также в слезной железе, эпителии роговицы, конъюнктиве и слезной жидкости [4]. Необходимо отметить, что офтальмологические препараты, изготовленные на основе ГК, полностью биосовместимы и при инстилляции в конъюнктивальную полость не вызывают чувства инородного тела [4, 5]. ГК является природным полимером и относится к группе полисахаридов, которые также называют полисахаридами соединительной ткани, мукополисахаридами или гликозаминогликанами [4, 6]. Данная группа веществ влияет на распределение воды в соединительной ткани, в т. ч. и в строме роговицы [7]. Так, например, ГК обладает выраженной способностью удерживать воду за счет большого количества гидроксильных групп, образующих водородные связи [7, 8]. Согласно исследованиям данная кислота способна удержать количество воды, в 1000 раз превышающее ее собственную массу [7]. При повышении градиента давления и температуры окружающей среды ГК снижает вязкоэластические свойства раствора [7, 8]. Помимо этого, ГК обладает противовоспалительными свойствами [4] и способна стимулировать миграцию эпителиоцитов, способствуя заживлению эрозий роговицы, устранению неровностей глазной поверхности и стабилизируя состояние СП [8]. I.C. You et al. отмечают, что наибольший терапевтический эффект наблюдается на фоне применения 0,3% раствора ГК: более высокая концентрация препарата благотворно влияет на процесс заживления эрозий роговицы, увеличивает плотность бокаловидных клеток конъюнктивы, снижает апоптоз эпителиоцитов роговой оболочки [9].
Другими компонентами искусственных заменителей слезы, применяемыми при лечении ССГ, являются карбоксиметилцеллюлоза и гидроксипропилцеллюлоза. Эти полисахариды увеличивают вязкость слезной жидкости, способствуют восстановлению эпителиальных клеток роговицы и применяются, как правило, в сочетании с ГК. Растворимая гидроксипропилцеллюлоза используется в препарате Lacrisert (Bausch&Lomb, США), который помещается в нижний конъюнктивальный свод и, растворяясь в течение 12 ч, утолщает СП. Препарат рекомендуется к применению у пациентов с умеренной и тяжелой степенью ССГ, однако противопоказан при высокой чувствительности к гидроксипропилцеллюлозе [6].
Гидроксипропилгуар — водорастворимый природный полисахарид, являющийся производным гуаровой камеди, наиболее эффективный и часто используемый компонент слезозаменителей, восполняющий муциновый слой СП. В составе капель с гидроксипропилгуаром обязательными составляющими являются борная кислота, при взаимодействии с которой образуется структурированный гелеобразный раствор, и сорбитол, препятствующий преждевременной связи гидроксипропилгуара с борат-ионами. Попадая на глазную поверхность, борная кислота взаимодействует с двухвалентными ионами кальция, магния и цинка слезной жидкости, благодаря чему связь с гидроксипропилгуаром становится более прочной. Образующаяся на поверхности роговицы тонкая высокомолекулярная пленка эффективно увлажняет глазную поверхность, повышает время разрыва СП, минимизирует испарение слезы за счет снижения ее осмолярности и препятствует тем самым высыханию роговицы [6, 10].
Большое число научных исследований последних лет посвящено изучению влияния природного дисахарида трегалозы на организм человека, обладающей способностью вызывать аутофагию клеток [11, 12]. Согласно экспериментальным исследованиям in vitro и in vivo трегалоза защищает клетки роговицы от высыхания, препятствует апоптозу эпителиоцитов роговицы и конъюнктивы и их ультрафиолет (УФ) -индуцированному окислительному повреждению [6, 13]. Установлено, что под воздействием этого дисахарида существенно снижается содержание конъюнктивальных провоспалительных цитокинов и восстанавливается осмотический баланс слезы у лабораторных мышей [6, 14]. При лечении поврежденной роговицы трегалозой отмечается быстрое купирование воспаления, подавляются формирование рубца и неоваскуляризация роговой оболочки. Отсутствие токсичных свойств у данного дисахарида позволяет применять его у человека в течение длительного времени [13]. Наибольший терапевтический эффект трегалозы наблюдается при совместном применении с ГК. Добавление трегалозы способствует улучшению переносимости и эффективности проводимого лечения с точки зрения облегчения симптомов (по данным опросника OSDI (Ocular Surface Disease Index — индекс поражения поверхности глаза)), по сравнению с инстилляциями фармакологического препарата, содержащего в своем составе только гиалуронат, что, по мнению исследователей, демонстрирует биопротекторное действие трегалозы [15].
Согласно клиническим исследованиям благотворное влияние на течение ССГ оказывает применение осмопротекторов. Установлено, что L-карнитин и эритрит подавляют активацию с-Jun-N-концевых киназ и митоген-активированных протеинкиназ, тем самым снижая гиперосмолярность слезной жидкости [16, 17]. L-карнитин, эритрит и бетаин оказывают значительное супрессивное действие на синтез и секрецию провоспалительных цитокинов и хемокинов, уменьшают апоптоз эпителиальных клеток. Кверцетин, эпигаллокахетин, N-пропилгаллат и галловая кислота препятствуют повреждению клеток активными формами кислорода, воздействуя на такой механизм развития ССГ, как окислительный стресс [6, 17].
Для профилактики роста микроорганизмов после вскрытия флакона с каплями многие производители включают в состав мультидозных форм слезозаменителей консерванты, известные своей токсичностью и неблагоприятным влиянием на глазную поверхность. В связи с этим отдельные фармацевтические фирмы разработали формы флаконов, препятствующие проникновению микроорганизмов внутрь флакона, исключив контаминацию раствора без применения консерванта. В настоящее время такими флаконами являются известный в России флакон системы COMOD (URSAFARM, Германия), а также Container-OSD (TRB Chemedica, Швейцария) и ABAK Bottle (Thea Pharmaceuticals, Франция). Помимо риска инфицирования и развития осложнений, связанных с применением консервантов, многоразовые флаконы с глазными каплями имеют и ряд других недостатков: их материал способен поглощать консерванты и действующие вещества (полиэтилен абсорбирует бензалкония хлорид), а красители, входящие в состав стенок флакона, могут проникать в лекарственный раствор. Для устранения этих побочных явлений отдельные производители наладили выпуск одноразовых тюбик-капельниц, содержащих дозу слезозаменителя для однократной инстилляции в оба глаза («single-dose» или «unit-dose») [18].
Бензалкония хлорид является наиболее часто используемым консервантом, входящим в состав большинства глазных капель, при этом данное вещество индуцирует апоптоз эпителиоцитов роговицы и конъюнктивы, оказывает токсическое действие на нервные окончания роговой оболочки и замедляет регенерацию повреждений роговицы. В эксперименте in vitro показано, что раствор бензалкония хлорида, превышающий концентрацию 0,005%, значительно нарушает липидный слой СП [19, 20]. Новые варианты консервантов оказывают менее губительное воздействие на глазную поверхность. Так, например, поликватерниум не оказывает детергентного действия и не разрушает липидный слой СП, благодаря чему нежелательные эффекты в отношении глазной поверхности сведены к минимуму [21]. Существует также группа окислительных консервантов, распадающихся при контакте со слезой. К ним относят перборат натрия — после инстилляции в конъюнктивальную полость консервант преобразуется в воду и кислород; а также стабилизированный оксихлорокомплекс — консервант, состоящий из хлорита, хлората натрия и диоксида хлора и распадающийся под действием света [21]. Однако необходимо отметить, что даже так называемые «исчезающие консерванты» могут оказывать некоторое негативное воздействие на глазную поверхность, поэтому предпочтительной формой слезозаменителей остаются бесконсервантные монодозные препараты [22].
Отдельную роль в составе слезозаменителей играет наличие электролитов. При ССГ их концентрация в слезной жидкости увеличивается вследствие испарения и/или недостаточной выработки слезы. Установлено, что относительно высокий уровень калия в слезной жидкости способствует защите эпителия роговицы от УФ-воздействия и поддержанию нормальной толщины роговицы. Кроме того, целостность и светорассеивающие свойства роговичного эпителия в значительной степени зависят от колебаний концентраций в слезе калия, кальция, магния, бикарбоната и хлорида натрия [6].
Биологические заменители слезы
Производство и применение биологических замени-телей слезы для лечения ССГ в настоящее время ограничено требованиями законодательства разных стран к препаратам крови, обязательным серологическим исследованием на наличие вируса иммунодефицита человека, гепатитов и других инфекций, а также коротким сроком хранения препаратов данной группы с соблюдением особого температурного режима. Однако, несмотря на указанные сложности, биологические заменители слезы имеют и ряд существенных преимуществ при лечении ССГ. Так, например, аутологичная сыворотка имеет pH, сходный с таковым слезной жидкости, а также содержит витамины и биологически активные вещества (эпителиальный фактор роста, фактор роста нервов и т. д.). Кроме того, сыворотка ингибирует высвобождение провоспалительных цитокинов, повышает количество бокаловидных клеток в конъюнктиве и стимулирует выработку муцина [23, 24]. Для применения в клинической практике на сегодняшний день разработано также много препаратов на основе тромбоцитов: обогащенная тромбоцитами плазма; плазма, обогащенная факторами роста; лизат тромбоцитов. Согласно результатам исследования J.L. Alio et al. инстилляции плазмы, обогащенной тромбоцитами, 4–6 р/сут больным ССГ способствуют уменьшению симптомов заболевания на 89% уже через 1 мес. после начала лечения [25].
Применение криоконсервированной амниотической мембраны при лечении ССГ купирует воспалительную реакцию за счет индукции апоптоза нейтрофилов и моноцитов, уменьшения инфильтрации нейтрофилами и макрофагами. Кроме того, доказана способность амниотической мембраны стимулировать регенерацию роговичных нервов благодаря присутствию фактора роста нервов [26].
Препараты, стимулирующие секрецию слезы
Еще одной группой препаратов для слезозаместительной терапии являются секретагоги — стимуляторы слезо-течения, которые доступны или находятся в стадии разработки в других странах. Существуют стимуляторы водного, муцинового и/или липидного слоев СП. Препарат Diquafosol tetrasodium (Diquas, Santen, Япония) одобрен к применению в качестве 3% офтальмологического раствора в Японии и Южной Корее. Данный препарат стимулирует водный компонент СП и секрецию муцина из эпителиальных и бокаловидных клеток конъюнктивы [27]. По данным Y.S. Byun, инстилляции Diquafosol tetrasodium способствуют эффективному заживлению эпителиальных дефектов роговицы [28]. Препарат Rebamipide (Mucosta; Otsuka pharmaceutical, Япония) в настоящее время одобрен в Японии для лечения ССГ как стимулятор муциноподобных гликопротеинов в роговичном эпителии, повышающий уровень экспрессии мукопротеинов MUC1, MUC4 и MUC16 [29, 30].
Альтернативным методом стимуляции слезопродукции при лечении ССГ является назальная нейростимуляция, основанная на усилении выработки слезной жидкости после химического или механического раздражения слизистой оболочки носовой полости с помощью специального устройства [31]. Интраназальный стимулятор TrueTear (Allergan, США) состоит из ручного блока-стимулятора с одноразовым гидрогелевым наконечником и наружного зарядного устройства. Согласно результатам клинических исследований применение интраназального стимулятора способствует значительному уменьшению симптомов сухости и раздражения глазной поверхности у больных ССГ (по данным опросника OSDI), а также улучшению показателей теста Ширмера и увеличению объема выработки слезы [32].
Противовоспалительная терапия синдрома «сухого глаза»
Консервативное лечение ССГ, особенно средней и тяжелой степени, на сегодняшний день невозможно без местной противовоспалительной терапии с назначением нестероидных противовоспалительных средств (НПВС), кортикостероидов, антиметаболитов. Однако применение препаратов данных фармакологических групп требует тщательного контроля за состоянием глазной поверхности больных ССГ в связи с риском развития осложнений (присоединение вторичной инфекции, изъязвление поверхности роговицы, транзиторное повышение офтальмотонуса, прогрессирование катаракты) [32].
В настоящее время для достижения противовоспалительного эффекта при лечении ССГ достаточно широко применяются инстилляции 0,05% раствора циклоспорина (Рестасис, Allergan, США) из группы антиметаболитов [33]. Механизм действия препарата связан с ингибированием серин/треонин фосфатазы (кальциневрин) и последующим снижением экспрессии генов, участвующих в активации Т-клеток. Следствием этого является подавление антиген-зависимой секреции активированными Т-лимфоцитами провоспалительных лимфокинов [34]. Согласно клиническим исследованиям инстилляции 0,05% раствора циклоспорина при лечении ССГ способствуют увеличению объема секретируемой слезы, повышению плотности бокаловидных клеток конъюнктивы, а также улучшают субъективные ощущения у больных, уменьшая при этом риск повреждения эпителия роговицы [35, 36].
Одно из базовых средств противовоспалительной терапии ССГ — 0,1% раствор дексаметазона фосфата, который блокирует факторы транскрипции: ядерный фактор κB и активатор белка, ингибируя тем самым транскрипцию интерлейкина-2. Помимо этого, под действием дексаметазона фосфата уменьшается число Т- и В-лимфоцитов, снижается выработка иммуноглобулинов и компонентов системы комплемента. Однако длительное применение данного препарата сопряжено с риском развития большого числа побочных эффектов. Под руководством профессора В.В. Бржеского для лечения ССГ разработан лекарственный препарат, содержащий 0,01% раствор дексаметазона фосфата, 6% раствор поливинилпирролидона и 1,5–5,5% раствор декстрозы, показавший высокую клиническую эффективность в комплексной терапии ССГ [34, 37].
Механизм действия НПВС связан с ингибированием циклооксигеназы в каскаде окисления арахидоновой кислоты, благодаря чему снижается синтез простагландинов, ответственных за развитие воспалительной реакции. Однако простагландины необходимы для синтеза белка и ДНК в эпидермальных клетках. Кроме того, НПВС, особенно при длительном местном применении, вызывают дистрофические изменения со стороны эпителия конъюнктивы и роговицы с развитием поверхностного точечного кератита. В связи с этим вопрос о целесообразности и эффективности применения препаратов данной фармакологической группы при лечении ССГ остается открытым [34, 38].
Для лечения дисфункции мейбомиевых желез как одной из основных причин ССГ многие исследователи рекомендуют системное и местное применение антибактериальных препаратов. Так, например, антибиотики тетрациклинового ряда (доксициклин) ингибируют продукцию бактериальных липаз, улучшая тем самым липидный профиль мейбомиевых масел. Местное применение азитромицина оказывает и антибактериальное, и противовоспалительное действие [39, 40].
Одним из новых препаратов с противовоспалительным действием для лечения ССГ является 5% раствор Lifitegrast (Xiidra, Novartis, Швейцария), представляющий собой функционально-ассоциированный антагонист антигена лимфоцитов-1 (Lymphocyte function-associated antigen-1, LFA-1). Препарат блокирует взаимодействие белков клеточной поверхности LFA-1 с молекулами межклеточной адгезии-1, а также ингибирует миграцию Т-клеток и высвобождение провоспалительных цитокинов при ССГ [41, 42].
В настоящее время при разработке препаратов для лечения ССГ с целью улучшения доступности лекарств используются нанотехнологии. Препаратами, изготовленными на основе данных технологий, являются KPI-121 (Kala Pharmaceuticals, США) — наночастичный препарат кортикостероида, а также лотепреднол этабонат и OTX-101 (Seciera, Sun Pharma, Индия) — наномицеллярные препараты циклоспорина и RGN-259 (ReGenTree, США) — синтетическая копия природного белка тимозина β4, который, как предполагается, способствует миграции эпителиоцитов роговицы и уменьшает выраженность воспаления [42].
Хирургические методы лечения синдрома «сухого глаза»
Хирургическое лечение ССГ проводится при тяжелых формах течения заболевания, когда фармакотерапия не позволяет достичь ожидаемого эффекта, что отрицательно сказывается на качестве жизни больного. Необходимо отметить, что оперативные вмешательства при ССГ сопряжены с риском повреждения роговицы и конъюнктивы и присоединения вторичной инфекции в послеоперационном периоде.
Одним из щадящих методов хирургического лечения заболевания является закрытие просвета слезных точек с помощью обтураторов для уменьшения оттока слезной жидкости и удержания ее на глазной поверхности. Обтураторы, состоящие из ателоколлагена — коллагена, предварительно обработанного протеазами, после установки в слезные точки превращаются в гель, который постепенно, в течение 1–16 нед. растворяется. Нерастворимые обтураторы слезных точек изготавливаются из силикона и имеют различный дизайн. Для временной окклюзии слезных точек используется также цианакрилатный клей. Кроме того, возможно проведение диатермокоагуляции нижней слезной точки. Основными осложнениями данных операций являются спонтанное выталкивание обтуратора из слезной точки и присоединение вторичной инфекции [43, 44].
Ранее, в особо тяжелых случаях ССГ с изменениями роговицы ксеротического характера, выполняли такие операции, как пересадка протока околоушной слюнной железы, трансплантация подчелюстной слюнной железы. В настоящее время указанные хирургические вмешательства выполняются довольно редко [45, 46]. К операциям, ограничивающим испаряемость слезной жидкости, относятся канторафия (ушивание век с медиального или латерального угла глазной щели) и тарзорафия (полное или частичное сшивание краев век). Также в настоящее время весьма успешно при хирургии ССГ используется биологическое покрытие роговицы с целью снижения патологического воздействия внешних факторов на глазную поверхность.
Немедикаментозные способы лечения синдрома «сухого глаза»
Соблюдение рекомендаций для исключения или минимизации воздействия внешних факторов риска, способствующих развитию и прогрессированию ССГ, позволяет существенно облегчить и/или улучшить состояние больного. Общеизвестно, что глазная поверхность наиболее подвержена воздействию ветра, низкой относительной влажности, пониженной или повышенной температуры, УФ-излучения, загрязняющих веществ, табачного дыма и др. [47–49]. На начальном этапе лечения больным ССГ рекомендуется использование увлажнителей воздуха или специальных очков для увлажнения воздуха рядом с глазом. Пользователям компьютеров и других гаджетов рекомендуется делать перерывы при зрительной работе и размещать монитор устройства ниже уровня глаз, благодаря чему уменьшается площадь открытой глазной поверхности [8].
В последние годы разработано большое количество пищевых добавок, содержащих омега-3 и омега-6 полиненасыщенные жирные кислоты (ПНЖК). Согласно научным исследованиям биодобавки с омега-3 ПНЖК способствуют повышению стабильности СП за счет модифицирования внутриклеточных липидов в слезных железах. Комбинация омега-3 и омега-6 ПНЖК также оказывает положительное влияние на качество и количество внутриклеточных липидов в мейбомиевых железах. При этом эффективность приема пероральных добавок существенно повышается, если основным компонентом добавки является омега-3 ПНЖК в отдельности или с меньшей долей омега-6 ПНЖК [50].
Заключение
На сегодняшний день существует большое число консервативных и хирургических методов лечения ССГ, применение которых позволяет облегчить течение заболевания и улучшить качество жизни больных. Выбор того или иного варианта лечения должен носить исключительно персонализированный характер, с обязательным учетом возраста больного и его рода деятельности, факторов риска и степени тяжести ССГ, наличия сопутствующих офтальмологических и системных заболеваний. При этом проводимое лечение не всегда обеспечивает достижение желаемого терапевтического эффекта с облегчением состояния больного. Поэтому поиск и разработка новых лечебно-профилактических мероприятий при лечении ССГ являются на сегодняшний день одной из актуальных проблем современной офтальмологии.
Сведения об авторах:
Татарникова Елена Борисовна — заочный аспирант кафедры офтальмологии, ORCID iD 0000-0003-3038-8117;
Кривошеина Ольга Ивановна — д.м.н., профессор, заведующая кафедрой офтальмологии, ORCID iD 0000-0001-7509-5858.
ФГБОУ ВО СибГМУ Минздрава России. 634050, Россия, г. Томск, Московский тракт, д. 2.
Контактная информация: Татарникова Елена Борисовна, e-mail: elenka.morozova.92@inbox.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 01.06.2020.
About the authors:
Elena B. Tatarnikova — distant postgraduate student of the Department of Ophthalmology, ORCID iD 0000-0003-3038-8117;
Olga I. Krivosheina — Doct. of Sci. (Med.), Professor, Head of the Department of Ophthalmology, ORCID iD 0000-0001-7509-5858.
Siberian State Medical University. 2, Moskovskiy tract, Tomsk, 634050, Russian Federation.
Contact information: Elena B. Tatarnikova, e-mail: elenka.morozova.92@inbox.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 01.06.2020.
КЛИНИЧЕСКАЯ МЕДИЦИНА
УДК 617.711-004.1
СОВРЕМЕННЫЕ КЛАССИФИКАЦИЯ И ФАРМАКОТЕРАПИЯ СИНДРОМА «СУХОГО ГЛАЗА»
Анисимова С.Г., Мазина Н.К., Абрамова Т.В.
ФГБОУ ВО «Кировский государственный медицинский университет» Минздрава России, Киров, Россия (610027, г. Киров, ул. К. Маркса, 112), e-mail: SvetLANa-43bk@mail.ru
В обзоре литературы проанализированы современные классификации синдрома «сухого глаза», учитывающие многофакторность заболевания. В зависимости от этиологии, механизмов и стадий развития заболевания приведены актуальные принципы лечения.
Ключевые слова: синдром «сухого глаза», слезная пленка, искусственные слезы, митохондрия.
MODERN CLASSIFICATION AND PHARMACOTHERAPY OF «DRY EYE» SYNDROME
Anisimova S.G., Mazina N.K., Abramova T.V.
Kirov State Medical University, Kirov, Russia (610027, Kirov, K. Marx Street, 112), e-mail: SvetLANa-43bk@mail.ru
The literature review analyzes the current classification of the dry eye syndrome taking into account the multifactorial nature of the disease. Some up-to-date treatment guidelines are described depending on the etiology, mechanisms and stages of the disease progression.
Key words: dry eye syndrome, tear film, artificial tears, mitochondrion.
В современном мире за последние два десятилетия достигнуты огромные успехи в лечении ССГ в связи с повышением знаний о патофизиологии заболевания [53]. Повышение знаний по диагностике и лечении ССГ обеспечивает улучшение качества жизни пациента и способствует предотвращению осложнений на ранних сроках заболевания [53].
Классификация ССГ
В 2003 году в Мадриде группой экспертов была предложена тройная классификация ССГ [54], которая позднее была модифицирована более широкой группой экспертов [55]: ССГ является многофакторным заболеванием, связанным с неадекватным взаимодействием между слезной пленкой и эпителием поверхности глаза, возникающим в результате качественных и количественных нарушений в одной или обеих структурах.
Мадридская тройная классификация с учетом многофакторности заболевания включает три крите-
рия: этиология (более 100 причин сгруппированы в 10 семейств), вид пораженных желез и тяжесть заболевания [54, 55].
На основании полиэтиологичности и многофакторности заболевания в 2002 г. В.В. Бржеский и соавт. предложили все случаи ССГ разделить на две клинические группы: синдромальный у пациентов с системными заболеваниями и симптоматический, развивающийся при анатомических изменениях глазной щели, воздействиях на роговицу и другое [2].
Клиническая классификация ССГ Е.Е. Сомова от 2002 г. включает в себя следующие проявления: хронические конъюнктивит и блефарит, их сочетания, рецидивирующие микро- и макроэрозии эпителия роговицы, сухой кератоконъюнктивит, ксероз конъюнктивы и роговицы, «нитчатый», буллезно-нитчатый кератит, кератомаляцию [10].
McCulley с соавторами предложили использовать термины ССГ: гипосекреторный и связанный с повышенным испарением [38]. В рамках конференции National Eye Institute, Bethesda были выделены две патогенетические группы ССГ [46, 43, 21]: дефицит продукции водянистого слоя из-за нарушения функции слезной железы и повышенное испарение слезной жидкости вследствие нарушения функций мейбомиевых желез.
В 2003 году в Москве профессором Г.С. Полуниным с соавторами была опубликована классификация ССГ также по этиологическому фактору: системно-органная, блефароконъюнктивальная, экзогенная, роговичная и комбинированной формы [8].
В 2007 году Международный комитет по ССГ (International Dry Eye Workshop, DEWS) выделил в развитии заболевания три основных постулата [27]:
1. Многофакторность этиологии заболевания.
2. Любые формы ССГ могут взаимодействовать и усиливать друг друга, образуя замкнутый круг. В звеньях патогенеза ССГ ведущая роль отведена гипер-осмолярности и воспалению.
3. Рациональная фармакотерапия ССГ в зависимости от тяжести заболевания.
Также Международный комитет разработал следующие классификации ССГ в зависимости от этиологии, механизмов и стадий развития заболевания [27]:
Недостаточность слезопродукции:
1. Ассоциированный с синдромом Шегрена: первичный и вторичный.
2. Неассоциированный с синдромом Шегрена: недостаточность слезы, нарушение иннервации, обструкция слезных протоков, системное влияние лекарственных препаратов.
Нарушение испарения слезной жидкости:
1. Внутренние причины: прием лекарственного препарата «Аккутан» (ретиноиды), снижение мигательных движений, нарушение формы век и разреза глазной щели, снижение мейбомиевого секрета желез.
2. Внешние причины: перенесенные заболевания передней поверхности глазного яблока (аллергические, инфекционные, вирусные), использование контактной коррекции, авитаминоз А, токсическое действие консервантов в глазных каплях.
По тяжести заболевания классификация представлена в таблице 1.
Таблица 1
Классификация ССГ по тяжести симптомов
Симптомы Степень тяжести ССГ
1 2 3 4
Дискомфорт (тяжесть и частота) Легкий, эпизодический (неблагоприятные факторы среды) Средний, эпизодический или хронический (может возникать независимо от действия неблагоприятных факторов среды) Тяжелый, частый или постоянный (независимо от действия факторов окружающей среды) Тяжелый, постоянный, значительно затрудняющий жизнедеятельность
Зрительные симптомы Нет или эпизодическая легкая усталость Эпизодические, легкие, ограничивающие деятельность Хронические и постоянные, ограничивающие деятельность Постоянные и значительно ограничивают деятельность
Инъекция конъюнктивы Нет или легкая Нет или легкая +/- +/++
Прокрашивание конъюнктивы Нет или легкое Непостоянное От умеренного до выраженного Выраженное
Тяжесть прокрашивания роговицы Нет или легкое Непостоянное Выраженное в центральной зоне Глубокие точечные эрозии
Поражение роговицы и нарушение слезной пленки Нет или легкое Включения, уменьшение слезного мениска Нитчатый кератит, нити муцина, увеличение включений Нитчатый кератит, нити муцина, увеличение включений, эрозирование
Поражение век и мейбомиевых желез Может наблюдаться дисфункция мейбомиевых желез (ДМЖ) Может наблюдаться ДМЖ Часто ДМЖ Трихиаз, ороговение, симблефарон
Время разрыва слезной пленки Непостоянное < 10 с < 5 с Незамедлительно
Проба Ширмера Непостоянная <10 мм/5 мин < 5 мм/5 мин <2 мм/5 мин
Таким образом, анализируя вышеизложенные классификации, ССГ является интегрированной патологией слезной пленки, век и поверхности глаза.
Современная фармакотерапия ССГ
Клиническая классификация ССГ отражает многообразие этиологических и патогенетических факторов, следовательно, проводимое лечение должно быть направлено на следующие аспекты:
1. Минимизация избыточного процесса испарения, гиперосмолярности.
2. Стабилизирование слезной пленки.
3. Предотвращение и лечение повреждений роговицы.
4. Стимулирование железистой секреции.
5. Повышение качества и объема слезной пленки.
6. Предотвращение воспалительного процесса
[33].
Современные подходы к лечению ССГ включают использование актуальных смазочных материалов (искусственные слезы или биологические заменители), системных антибиотиков (тетрациклин, доксициклин, миноциклин), актуальной противовоспалительной терапии (например, кортикостероиды или иммуномодуляторы, циклоспорин), диеты (употребление омега-3 жирных кислот), а также стимуляторов секреции (например, холинергические препараты) [32]. Кроме фармакологической коррекции заболевания важна роль контроля внешних факторов (например, влажность, электромагнитное излучение, дым, смог) [32].
По мнению Д.Ю. Майчука, комплексное лечение ССГ должно включать 3 аспекта [5]: обязательная противовоспалительная терапия, искусственные слезы, построение алгоритма патогенетической терапии на основе клинической картины ССГ.
Наиболее полно лечение было представлено на Международном комитете (DEWS) в 2007 году в зависимости от тяжести заболевания [27].
Искусственные слезы (смазывающие препараты)
При использовании только монотерапии искусственными слезами наблюдается снижение симптомов проявления ССГ, но они не могут быть полностью устранены [20].
Искусственные слезы должны обладать следующими свойствами:
1. Гипотонические или изотонические растворы, содержащие электролиты (калий, бикарбонаты), поверхностно-активные вещества, различные вязкие агенты.
2. В идеале не должны содержать консерванты.
3. Нейтральная или слабощелочная рН.
4. Осмолярность раствора должна составлять 181-354 мосмоль/л [42].
Электролиты или ионы зарекомендовали себя в лечении ССГ, например, калий участвует в поддержании равномерной толщины роговицы, эпителия, а гидрокарбонаты — муцина [25].
У пациентов с ССГ наблюдается гиперосмо-лярность (коллоидная осмолярность) слезы, которая вызывает биохимические и морфологические изме-
нения в эпителии. Таким пациентам рекомендованы слезы с гипоосмолярностью [35]. К таким искусственным слезам относятся Hypotears® (230 мосм/л (Novartis Ophtalmics, СЩА) и TheraTears® (181 мосм/л, Advanced Vision, США).
В составе слез в различных концентрациях используют поливиниловый спирт, полиэтиленгликоль, гликоль 400, пропиленгликоль и гидроксипропилцел-люлозу. Но все высоковязкие агенты имеют свойство насыхать на ресницах, вызывают косметический дискомфорт и пациент может отказаться от лечения. Для решения этой проблемы стали использовать препараты с агентами низкой вязкости. К таким агентам относится гидроксипропил-гуар, который добавлен в качестве гелеобразующего агента в раствор, содержащий гликоль 400 и пропиленгликоль, способного связываться с гидрофобными поврежденными участками, обеспечивая им временную защиту [18,19]. К этой группе относится препарат Систейн® (Alcon, США). Во флаконе глазные капли с pH 7.0 находятся в виде жидкости, после инстилляции в конъюнкти-вальную полость, где pH 7.5-7.8, преобразуется в гель, равномерно покрывая поверхность глаза.
Одним из активных компонентов выделена также гиалуроновая кислота 0,2%, которая себя положительно зарекомендовала в исследованиях [39]. Натриевая соль гиалуроновой кислоты является природным мукополисахаридом, гликозаминогликаном, обладающим мукомиметическим, репаративным и отчасти противовоспалительным эффектом [15]. Ре-паративное действие проявляется стимулированием регенерации эпителия роговицы и конъюнктивы за счет вовлечения в репаративный процесс рецептора натрия гиалуроната — молекулы СD44 [15]. Количество данного рецептора увеличивается с тяжестью ССГ [15]. Гиалуронат натрия редуцирует экспрессию СD44 выраженнее, чем карбоксиметилцеллюлоза [45]. В искусственных слезах используется в виде натриевой соли (натрия гиалуроната), в водной среде преобразуется в вязкий гель.
К таким препаратам относятся Хило-комод® (Ursapharm, Германия) и Вид-Комод® (Ursapharm, Германия). Отличительной особенностью Хило-ко-мода® является отсутствие консерванта, поэтому данный препарат можно применять и у пациентов с ССГ аллергического генеза. Вид-комод® содержит поливинилпиролидон, обладающий необходимой вязкостью и хорошими адгезивными свойствами по отношению к передней поверхности глаза [7].
На основе гиалуроновой кислоты созданы препараты Артелак Всплеск® и Артелак Баланс® (Baush & Lomb, Германия). Артелак Всплеск содержит 0,24% гиалуроновой кислоты, которая, связываясь с молекулами воды, быстро восстанавливает слезную пленку и показан при лечении транзиторного ССГ [3]. Артелак Баланс®, имеющий в составе 0,15% гиа-луроновой кислоты и витамин В12, обладающий ан-тиоксидантным действием, рекомендован при легкой и умеренной форме ССГ. Его применение приводит к уменьшению субъективных жалоб, понижению гипер-осмолярности и воспаления [59].
К этой группе относится препарат Оксиал® (Baush & Lomb, Германия), содержащий 0,15% гиа-луроновой кислоты, и показан для лечения ССГ хронической формы у лиц старше 55 лет [3].
Одной из новых разработок в улучшении муци-нового слоя слезной пленки является применение по-
лисахарида семян тамаринда, получаемого из семян растения Таmаrindus тйтса [22]. Компонентом семян является беззарядный нейтральный полисахарид, состоящий из основной (напоминающий целлюлозу) и боковых цепей (ксилоза и галактоксилоза) [22]. Наличие разветвленной структуры схоже со строением трансмембранных белков муцинового слоя слезной пленки с осмолярностью 300 мосм/кг, близкой к ос-молярности слезной пленки. Полисахарид также обладает способностью повышать свою вязкость с ростом рН, что в свою очередь увеличивает пребывание его на поверхности глазного яблока. К этой группе относится препарат Визин Чистая слеза® (Pfizer, США).
Ряд авторов отмечают, что искусственные слезы на гелевой основе обладают пролонгированным действием, формируя более устойчивую слезную пленку на поверхности роговицы [11]. Такими препаратами являются Офтагель (Santen, Финляндия), Видисик (Baush & Lomb, Германия), Систейн (Alcon, США), Хило-комод (Ursapharm, Германия) и Вид-Комод (Ursapharm, Германия).
Основным компонентом Офтагеля (Santen, Финляндия) является карбомер 974Р, 2,5 мг/г, относящийся к группе химически инертных нерастворимых и нетоксичных акриловых полимеров, который связывает воду на поверхности роговицы, компенсируя муциновый слой [11].
Основой препарата Видисик (Baush & Lomb, Германия) является полиакриловая кислота, которая при смыкании век преобразуется в жидкую фазу, а при открытых веках cтруктурируется в гелевую. Таким образом, создавая коллоидную систему, полиакриловая кислота способна изменяться под действием механических сил [11].
Таким образом, искусственные слезы достаточно эффективны в лечении ССГ. Выбор слезозаменителя производится путем пробных инстилляций препаратов в течение 2-3-х суток. Пациент самостоятельно, руководствуясь субъективными симптомами, определяет наиболее приемлемые для него капли и частоту их инсталляций. Жалобы, возникшие вновь, купируют последовательной инстилляцией препарата. Но следует иметь в виду, что частые (свыше 5 раз в день) инстилляции слезозаменителей способствуют вымыванию из конъюнктивальной полости нативной слезы.
Противовоспалительная терапия
Гиперосмолярность слезной жидкости при ССГ стимулирует выработку медиаторов воспаления, приводящих к дисфункции продуцирующих компонентов слезы клеток или их значительному сокращению с развитием «порочного» круга в патогенезе заболевания [36, 40].
Во многих масштабных исследованиях показана эффективность применения в лечении воспаления при ССГ селективного иммуносупрессивного препарата циклоспорина в различных лекарственных формах [51, 49]. При инстилляции эмульсии 0,05% отмечается улучшение субъективных симптомов, а при 0,1% — объективных. Исследования показали, что при применении циклоспорина А наблюдается увеличение плотности бокаловидных клеток до 200%. Кроме этого наблюдалось снижение экспрессии иммунных маркеров воспаления (HLA-DR), маркеров апоптоза клеток (FAS-зависимого апоптоза) и провоспали-тельного цитокина ИЛ-6 со стороны эпителиальных клеток конъюнктивы [17, 57]. При этом также наблю-
дается снижение инфильтрации желез лимфоидными клетками [31, 47].
Кортикостероиды также обладают противовоспалительным эффектом в лечении ССГ. В исследованиях лечения ССГ в комплексной терапии с добавлением кортикостероидов (метилпреднизолон или фторметалон плюс) в сравнении с искусственными слезами и обтурацией слезных каналов отмечалось снижение жалоб на раздражение роговицы и инструментально уменьшение зон прокрашивания роговицы флюоресцеином без побочных стероидных эффектов [13, 48]. В.В. Бржеский с соавторами в своих исследованиях показали клиническую эффективность применения 0,01% дексаметазона в сочетании с «гемодезом» [1]. Авторы рекомендуют инстилля-ции 0,05% раствора дексаметазона при наличии воспалительного процесса, фолликулярного конъюнктивита [1]. Кортикостероиды переносятся пациентами намного лучше, чем нестероидные противовоспалительные препараты [1].
Системные антибиотики из группы тетрацикли-нов (миноциклин, доксициклин) обладают тремя важными свойствами в лечении ССГ: антибактериальное, противовоспалительное, антиангиогенное. Антибактериальное свойство проявляется в бактерицидном действии за счет подавления синтеза белка, ингибиро-вания липазы, что способствует нормализации микрофлоры, улучшению состава мейбомиевого секрета [50]. Это свойство тетрациклинов, в частности док-сициклина, благотворно сказывается в лечении мей-бомиевого блефарита [50]. Противовоспалительное действие тетрациклинов проявляется в способности снижать активность коллагеназы, фосфолипазы А2, металлопротеиназы, интерлейкина-1и альфа-1 — фактора некроза опухоли [34]. Антиангиогенные свойства тетрациклинов проявились в купировании новообразования кровеносных сосудов в исследованиях на роговицах кроликов (миноциклин) [26]. Это в будущем будет иметь клиническое значение при таких заболеваниях, как розацеа и опухолевые процессы [58].
Препараты, стимулирующие секрецию
Ограничением к применению данной категории препаратов служит недостаток резервных возможностей слезопродукции.
К таким препаратам относится агонист P2Y2 рецепторов Диквафосол (разрешен к применению в Японии и Южной Корее), стимулирующий секрецию водного и муцинового компонентов слезной пленки [52]. Также в 2015 г. было доказано, что Диквафосол на 3% эффективнее улучшает состояние роговицы (по данным пробы с флюоресцеином, теста Ширме-ра, времени разрыва слезной пленки), чем гиалуронат натрия при той же частоте побочных эффектов [30, 29], но при их комбинации лечебный эффект выше, чем в отдельности [56].
Стимуляцией слезопродукции также обладают М-холиномиметик пилокарпин в дозе 5 мг перораль-но у пациентов с синдромом Шегрена. У таких пациентов наблюдалось улучшение состояния роговицы, но нарушалась рефракция в результате побочного эффекта в виде миоза и наблюдалась повышенная потливость [41, 44].
Стимуляция слезопродукции осуществляется также путем местного или системного использования препаратов, улучшающих микроциркуляцию конъюнктивы или слезной железы. Так, двухстороннее лимфотропное введение в течение 8 дней лекар-
ственной смеси, состоящей из 1,0 мл трентала и 2% раствора лидокаина, в точку на 1,0 см ниже и 1,0 см медиальнее вершины сосцевидного отростка, богатой лимфатическими узлами, приводит к купированию хронической ишемии и гипоксии. Тем самым увеличивается слезопродукция и состояние глазной поверхности [4].
Выявлено, что эффективными методами стимуляции продукции слезы при гиполакримии умеренной и значительной степеней выраженности являются системный прием пентоксифиллина и прямое или чрезкожное облучение сводов коньюнктивы гелий-неоновым лазером или их комбинация [6].
Биологические заменители слезной жидкости
В качестве заместителей слезы могут использоваться аутосыворотка, сыворотка пуповинной крови, а также секрет слюнных желез [23, 24].
Незаменимые жирные кислоты не могут синтезироваться самостоятельно в организме, поступают с пищей. Омега-6 жирные кислоты являются прекурсором арахидоновой кислоты и некоторых про-воспалительных медиаторов липидов (PGE2 и ЦГВ4) [28]. Омега-3 жирные кислоты (ЕРА в рыбьем жире) ингибируют синтез этих липидных медиаторов и образование ИЛ-1 и альфа-ФНО [28]. В исследованиях для улучшения состояния глазной поверхности рекомендуют прием перорально 2 раза в день линолевую и гамма-линолевую кислоты [14].
Таким образом, ССГ у каждого пациента имеет свои причины и свою индивидуальную патологию. В зависимости от тяжести заболевания на Международном подкомитете в 2007 году предложена следующая схема лечения [20, 37, 16]:
Уровень 1 (степень тяжести 1): Коррекция питания и действия неблагоприятных факторов среды, учитывая санитарно-гигиенические и образовательные нормы, устранение системных побочных эффектов при приеме лекарственных препаратов, применение слезозаменителей (капли, мази, гели), гигиена век.
Уровень 2 (степень тяжести 2, при неэффективности уровня 1): Слезозаменители без консервантов, противовоспалительные средства, применение антибиотиков тетрациклинового ряда (мейбомиит или ро-зацеа), окклюзия слезных точек при отсутствии воспаления, стимуляция секреции, применение очков с увлажняющей камерой.
Уровень 3 (степень тяжести 3, при неэффективности уровня 2): Применение препаратов аутосыво-роток, контактные лечебные линзы, постоянная обту-рация слезных точек.
Уровень 4 (степень тяжести 4, при неэффективности уровня 3): Системные противовоспалительные средства, хирургическое лечение.
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
В зависимости от классификации ССГ по этиологическому фактору профессором Г.С. Полуниным с соавторами предложены следующие схемы лечения [8].
1. Этиотропное лечение системно-органной формы ССГ: основная терапия (цитостатики, аминохино-линовые препараты), антибактериальные препараты (тобрекс, флоксал, нормакс и др.), противовоспалительная терапия (нестероидные противовоспалительные средства: наклоф, диклоф; кортикостероиды: дексаметазон и др.), десенсибилизирующая терапия (глюконат кальция + аскорбиновая кислота и др.); эфферентная терапия (гемосорбция, плазмаферез), репа-ративная восстанавливающая терапия (Корнерегель, Хилозар-Комод, ВитА-ПОС и др.).
2. Этиотропное лечение блефароконъюнкти-вальной формы ССГ: гигиена век (Блефаролосьон, Блефарогели 1 и 2), противовоспалительные и антисептические препараты (Тобрекс, Окуметил, Фуци-талмик, Флоксал и др.), антигистаминная терапия (Лекролин, Аллергодил и др.), физиолечение (маг-нитофорез, фонофорез, электрофорез), репаративная терапия (Корнерегель, Хилозар-Комод, ВитА-ПОС и
др.) [9].
3. Лечение роговичной формы ССГ: противовоспалительная: нестероидная терапия (Неванак, На-клоф, Диклофенак и др.), кортикостероидная терапия (Дексаметазон и др.), антибактериальная терапия (Тобрекс, Флоксал и др.), десенсибилизирующая терапия (Супрастин, Тавегил и др.), репаративная восстанавливающая терапия (Корнерегель, Хилозар-Ко-мод, ВитА-ПОС и др.).
4. Лечение экзогенной формы ССГ: репаративная восстанавливащая терапия (Корнерегель, Хило-зар-Комод, ВитА-ПОС и др.), средства для гигиены век (Блефаролосьон, Блефарогель 1, Блефарогель 2).
5. Лечение комбинированной формы ССГ.
Лечение пациентов с комбинированной формой
ССГ проводится с учетом каждого компонента, вызывающего ССГ.
Для профилактики и лечения ССГ разрабатываются методы системной фармакологической регуляции полноценной слезопродукции и восстановления клеток роговицы и конъюнктивы. Новое направление фармакологии — биоэнергетическая фармакология, которая изучает и разрабатывает способы медикаментозной коррекции нарушенных функций органов и систем через влияние на активность клеточных систем энергопродукции — митохондрий (МХ). В настоящее время основными средствами, регулирующими функции МХ органов и тканей, вовлеченных в патологический процесс, являются регуляторы энергетического обмена (РЭО), содержащие субстраты цикла трикарбоновых кислот (янтарную, глутаминовую, яблочную кислоты и их соли), или их композиции с кофакторами биологического окисления, биофла-воноидами. Для энерготропной фармакологической коррекции функций органа зрения применяются РЭО, содержащие янтарную кислоту (ЯК) [12].
Фармакологические регуляторы энергетического обмена оказывают следующие эффекты на организм в целом: повышение неспецифической резистентности организма и его систем, антистрессорный, антиишемический, иммуномодулирующий, цитопро-текторный, антигипоксический, антитоксический, антиоксидантный, антиацидотический (метаболический ацидоз), повышение фармакотерапии заболевания, снижение побочных эффектов лекарств [12]. В связи с этим для повышения клинико-экономической эффективности схем фармакотерапии распространенных заболеваний рекомендуется дополнительное применение препаратов, содержащих янтарную кислоту, в дозах, рекомендованных производителем [12]. Доказано, что применение препаратов янтарной кислоты до 40% повышает клиническую эффективность фармакотерапии основного заболевания, обеспечивая существенный фармакоэкономический эффект в виде снижения коэффициента «затраты-эффективность».
Таким образом, разработка препаратов, увеличивающих продукцию собственной слезы, является более перспективным и физиологичным направлением фармакотерапии. Дальнейший прогресс в рас-
сматриваемой области связан с внедрением лекарств, стимулирующих и сохраняющих нативную слезу без использования инвазивных методов лечения, которые были бы ориентированы на различные патогенетические типы ССГ и вдобавок обладали ресурсосберегающими свойствами и клинико-экономической эффективностью.
Список литературы
1. Бржеский В.В., Астахов Ю.С., Кузнецова Н.Ю. Заболевания слезного аппарата // Пособие для практикующих врачей. Санкт-Петербург, 2009. 108 с.
2. Бржеский В.В., Сомов Е.Е. Роговично-конъ-юнктивальный ксероз (диагностика, клиника, лечение). СПб.: «Сага». 2002. 142 с.
3. Егоров Е.А. Гиалуроновая кислота: применение в офтальмологии и терапии синдрома «сухого глаза» // Научно-клиническое рецензионное издание «Клиническая офтальмология». 2013. № 2. С. 71-73.
4. Еременко А.И., Янченко С.В. Возможности использования лимфотропной терапии в лечении синдрома «сухого глаза» // РМЖ «Клиническая офтальмология». 2010. № 1. С. 20.
5. Майчук Д.Ю. Патогенетическое обоснование лечения и профилактики вторичных нарушений слезообразования: автореф. дис. … д-ра мед. наук. Москва, 2005. 76 с.
6. Матевосова Э.А. Возможности стимуляции секреции слезы у больных с гиполакримией при синдроме «сухого» глаз // автореферат дис….кан.мед. наук. Москва. 2009. 24 с.
7. Мосунова Е.П., Абрамова Т.В. Опыт применения раствора Хило-комод фирмы Урсафарм при синдроме «сухого глаза» в Кировской областной клинической больнице // Новое в офтальмологии. 2010. № 2. С. 34-35.
8. Полунин Г.С., Сафонова Т.Н., Полунина Е.Г. Новая клиническая классификация синдрома сухого глаза// Рефракционная хирургия и офтальмология. 2003. № 3. С. 53-56.
9. Полунин Г.С., Каспарова Е. А., Полунина Е.Г., Забегайло А. Блефариты // Медицинская газета. 2007. № 31. С. 9.
10. Сомов Е. Е. Бржеский В.В. Краткое руководство по обследованию и лечению больных с синдромом «сухого глаза» // Руководство для врачей. Санкт-Петербург: Вель. 2003. 32 с.
11. Фалхут О.С., Полунина Е.В. Рациональный подход в диагностике и лечении синдрома «сухого глаза» // Медицинский совет. 2010. № 5-6. С.100-104.
12. Шешунов И.В., Мазина Н.К., Хазанов В.А., Мазин П.В. Фармако-экономические эффекты регуляторов энергетического обмена как фактор улучшения качества медицинской помощи // Экономика здравоохранения. 2006. № 12. С. 39-46.
13. Avunduk A.M., Avunduk M.C., Varnell E.D., Kaufman H.E. The comparison of efficacies of topical corticosteroids and nonsteroidal anti-inflammatory drops on dry eye patients: A clinical and immunocytochemical study // Am J Ophthalmol. 2003. № 136. Р. 593-602.
14. Barabino S., Rolando M,. Camicione P., [et al.] Systemic linoleic and gammalinolenic acid therapy in dry eye syndrome with an inflammatory component // Cornea. 2003. № 22. Р. 97-101.
15. Baudouin C. The pathology of dry eye // Surv Ophthalmol. 2001. Vol. 45. Suppl. 2. Р. 211-220.
16. Behrens A., Doyle J.J., Stern L., et al. Dysfunctional tear syndrome: A Delphi approach to treatment recommendations // Cornea 2006. № 25. P. 900-907.
17. Brignole F., Pisella P.J., De Saint Jean M., [et al.] Flow cytometric analysis of inflammatory markers in KCS: 6-month treatment with topical cyclosporine A // Invest Ophthalmol Vis Sci. 2001. № 42. P. 90-95.
18. Christiansen M., Cohen S., Rinehart J., [et al.] Clinical evaluation of an HP -guar gellable lubricant eye drop for the relief of dryness of the eye// Curr Eye Res. 2004. Vol. 28. P. 55-62.
19. Di Pascuale M.A., Goto E., Tseng S.C. Sequential changes of lipid tear film after the instillation of a single drop of a new emulsion eye drop in dry eye patients // Ophthalmology. 2004. Vol. 111. P. 783-791.
20. Dry Eye Workshop Management and therapy of dry eye disease: Report of the Management and Therapy Subcommittee of the International Dry Eye Workshop// Ocul Surf. 2007. Vol. 5, № 2. P. 163-178.
21. Foulks G.N. Treatment of dry eye disease by the non-ophthalmologist // Rheum Dis Clin North Am. 2008. Vol. 34, № 4. P. 987-1000.
22. Gayton J. L. Etiology, prevalence, and treatment of dry eye disease // Clin Ophthalmol. 2009. Vol. 3. P. 405-412.
23. Geerling G., Daniels J.T., Dart J.K., [et al.] Toxicity of natural tear substitutes in a fully defined culture model of human corneal epithelial cells// Invest Ophthalmol Vis Sci. 2001. P. 42948-42956.
24. Geerling G., Honnicke K., Schroder C., [et al.] Quality of salivary tears following autologous submandibular gland transplantation for severe dry eye // Graefes Arch Clin Exp Ophthalmol. 2000. № 238. P. 45-52.
25. Green K., MacKeen D.L., Slagle T., Cheeks L. Tear potassium contributesto maintenance of corneal thickness // Ophthalmic Res 1992. Vol. 24. P. 99-102.
26. Habif T.P. Clinical dermatology, 4th ed // St Louis:Mosby-Year Book. 2004. P. 162-189.
27. International Dry Eye Workshop. The definition and classification of dry eye disease: Report of the Definition and Classification Subcommittee of the International Dry Eye Workshop//Ocul Surf. 2007. Vol. 5, № 2. P. 75-92.
28. JamesM.J., Gibson R.A., ClelandL.G. Dietary polyunsaturated fatty acids and inflammatory mediator production // Am J Clin Nutr. 2000 №71(1 Suppl). P. 343-348.
29. Kamiya K., Nakanishi M., Ishii R., Kobashi H., Igarashi A., Sato N., Shimizu K. Clinical evaluation of the additive effect of diquafosol tetrasodium on sodium hyaluronate monotherapy in patients with dry eye syndrome: a prospective, randomized, multicenter study//Eye (Lond). 2012. № 26, Vol. 10. P. 1363-1368.
30. Keating G.M. Diquafosol ophthalmic solution 3 %: a review of its use in dry eye // Drugs. 2015. № 75, Vol. 8. P. 911-922.
31. Kunert K.S., Tisdale A.S., Stern M.E., Smith J.A. Analysis of topical cyclosporine treatment of patients with dry eye syndrome: effect on conjunctival lymphocytes // Arch Ophthalmol. 2000. № 118. P. 14891496.
32. LempM.A. Management of dry eye disease// Am J Manag Care. 2008. Vol. 14, № 3 (Suppl). P. 88-101.
33. Lemp M.A., Foulks G.N., Devgan U., Trattler W.B., Nichols K.K. The therapeutic role of lipids:
Managing ocular surface disease// Refractive Eyecare for Ophthalmologists. 2005. Vol. 9 (Suppl). P. 3-15.
34. Li D.Q., Luo L., Chen Z., [et al.] JNK and ER K MAP kinases mediate induction of IL -lbeta, TNF-alpha and IL -8 following hyperosmolar stress in human limbal epithelial cells // Exp Eye Res. 2006. № 82. P. 588-596.
35. Luo L., Li D., Corrales R., Pflugfelder S. Hyperosmolar saline is a proinflammatory stress on the mouse ocular surface// Eye Contact Lens 2005. Vol. 31. p. 186-193.
36. Luo L., Li D.Q., Doshi A., [et al.] Experimental dry eye stimulates productionof inflammatory cytokines and MMP-9 and activates MAP K signaling pathways on the ocular surface // Invest Ophthalmol Vis Sci. 2004. № 45. P. 4293-4301.
37. Matoba A.Y., HarrisD.J., MarkD.B., [etal.]Dry eye syndrome, American Academy of Ophthalmology. 2003.
38. McCulley J.P., Shine W.E., Aronowicz J. [et al.] Presumed Hyposecretory/Hyperevaporative KCS: Tear Characteristics// Trans Am Ophthalmol Soc. 2003. Vol. 101. P. 141-154.
39. Nelson J.D., Farris R.L. Sodium hyaluronate and polyvinyl alcohol artificial tear preparations a comparison in patients with keratoconjunctivitis sicca // Arch Ophthalmol. 1988. Vol. 106. P. 484-487.
40. Niederkorn J.Y., Stern M.E., Pflugfelder S.C., [et al.] Desiccating stress induces T cell-mediated Sjogren’s syndrome-like lacrimal keratoconjunctivitis // J Immunol. 2006. № 176. P. 3950-3957.
41. Papas A.S., Sherrer Y.S., Charney M., [ et al.] Successful treatment of dry mouth and dry eye symptoms in Sjogren’s syndrome patients with oral pilocarpine: A randomized, placebo-controlled, dose-adjustment study// J Clin Rheumatol. 2004. № 4. P. 169-177.
42. Perrigan D.M., Morgan A., Quintero S., [et al.] Comparison of osmolarity values of selected ocular lubricants // AR VO 2004 poster session 449.
43. Perry H.D. Dry eye disease: Pathophysiology, classification, and diagnosis // Am J Manag Care. 2008. Vol. 4, № 3 Suppl. P. 79-87.
44. Petrone D., Condemi J.J., Fife R., [et al.] Double-blind randomized placebocontrolled study of cevimeline in Sjogren’s syndrome patients with xerostomiaand keratoconjunctivitis sicca // Arthritis Rheum. 2002. № 46. P. 748-754.
45. Pflugfelder S. C., Solomon A. Dry eye // Ocular surface disease / Ed. by. — E. J. Holland, M. J. Mannis, Springer. New York. 2001. P. 49-57.
46. Pflugfelder S. C., Solomon A. Dry eye A. / Ocular surface disease // Ed. by. — New York. 2001. P. 49-57.
47. Pflugfelder S.C., Maskin S.L., Anderson B., [et al.] A randomized, doublemasked, placebo-controlled, multicenter comparison of loteprednol etabonate ophthalmic suspension, 0.5%, and placebo for treatment of keratoconjunctivitis sicca in patients with delayed tear clearance // Am J Ophthalmol. 2004. № 138. P. 444-457.
48. Sainz de la Maza Serra S.M., Simon Castellvi C., Kabbani O. Nonpreserved topical steroids and punctal occlusion for severe keratoconjunctivitis sicca// Arch Soc Esp Oftalmol. 2000. № 75. P. 751-756.
49. Sall K., Stevenson O.D., Mundorf T.K., Reis B.L. Two multicenter, randomized studies of the efficacy and safety of cyclosporine ophthalmic emulsion in moderate to severe dry eye disease // Ophthalmology. 2000. № 107. P. 631-639.
50. Shine W.E., McCulley J.P., Pandya A.G. Minocycline effect on Meibomian gland lipids in meibomianitis patients // Exp Eye Res. 2003. № 76. P. 417-420.
51. Stevenson D., Tauber J., Reis B.L. Efficacy and safety of cyclosporin A ophthalmic emulsion in the treatment of moderate-to-severe dry eye disease. A doseranging, randomized trial // Ophthalmology. 2000. № 107. P. 967-974.
52. Tauber J., Davitt W.F., Bokosky J.E., [et al.] Double-masked, placebo-controlled safety and efficacy trial of diquafosol tetrasodium (INS365) ophthalmic solution for the treatment of dry eye// Cornea. 2004. № 23. p. 784-792.
53. The Epidemiology of dry eye disease: report of the Epidemiology Subcommittee of the International Diy Eye Workshop / Ocul Surf. 2007. Vol. 5, № 2. P. 174.
54. The Madrid Triple Classification of Dry Eye / J. Murube [et al.] // Arch. Soc. Esp. Oftalmol. 2003. Vol. 78., № 11. P. 587-594.
55. The triple classification of dry eye for practical clinical use / J. Murube [et al.] // Eur. J. Ophthal. 2005. Vol. 15. P. 660-667.
56. Toda I., Ide T., Fukumoto T., Ichihashi Y., Tsubota K. Combination therapy with diquafosol tetrasodium and sodium hyaluronate in patients with dry eye after laser in situ keratomileusis//Am J Ophthalmol. 2014. № 157, Vol. 3. P. 616-622.
57. Turner K., Pflugfelder S.C., Ji Z., [et al.] Interleukin-6 levels in the conjunctival epithelium of patients with dry eye disease treated with cyclosporine ophthalmic emulsion// Cornea. 2000. №19. p.492-496.
58. Velicer C.M., Heckbert S.R., Lampe J.W., [et al.] Antibiotic use in relation to the risk of breast cancer // JAMA. 2004. № 291. P. 827-835.
59. Versura P., Profazio V., Giannaccare G., Fresina M., Campos E.C. Discomfort symptoms reduction and ocular surface parameters recovery with Artelac Rebalance treatment in mild-moderate dry eye // Eur J Ophthalmol. — 2013. №23, Vol. 4. P. 488-495.
References
1. Brzheskii V.V., Astakhov Y. S., Kuznetsova N. Yu. Zabolevaniya sleznogo apparata. Posobie dlya praktikuyushchikh vrachey (Diseases of the lacrimal apparatus. A Handbook for practitioners). Saint-Petersburg, 2009. 108 p.
2. Brzheskii VV, Somov E.E. Rogovichno-kon»yunktival’nyykseroz (diagnostika, klinika, lechenie) [Corneal conjunctival xerosis (diagnostics, clinic, treatment)]. SPb, Saga Publ., 2002. 142 p.
3. Egorov E. A., Nauchno-klinicheskoe retsenzionnoe izdanie «Klinicheskaya oftal’mologiya», 2013, no. 2, pp. 71015073.
4. Eremenko A. I., Yanchenko S. V., RMZh «Klinicheskaya oftal’mologiya», 2010, no. 1, p. 20.
5. Maychuk D.Yu. Patogeneticheskoe obosnovanie lecheniya i profilaktiki vtorichnykh narusheniy slezoobrazovaniya. Avtoreferat diss. doktora med. nauk [Pathogenetic substantiation of the treatment and prevention of secondary disorders of tear production. Abstract of Diss. Dr. med. Sciences]. Moskow, 2005, 76 p.
6. Matevosova E.A. Vozmozhnosti stimulyatsii sekretsii slezy u bol’nykh s gipolakrimiey pri sindrome «sukhogo» glaza. [The possibility of stimulating the secretion of tears in patients with hyponatremia in the syndrome of «dry» eye]. Abstract of Diss. Cand. of med. Sciences. Moskow, 2009, 24 p.
7. Mosunova, E. P., Abramova T. V, Novoe v oftal’mologii, 2010, no. 2, pp. 34-35.
8. Polunin G. S., Safonova T. N., Polunina E. G.,
Refraktsionnaya khirurgiya i oftal’mologiya, 2003, no. 3, pp. 53-56.
9. Polunin G. S., Kasparova E. A., Polunina E. G., Meditsinskaya gazeta, 2007, no. 31, P. 9.
10. Somov E. E., Brzheskii VV Kratkoe rukovodstvo po obsledovaniyu i lecheniyu bol’nykh s sindromom «sukhogo glaza». Rukovodstvo dlya vrachei [A quick guide to examination and treatment of patients with dry eye syndrome» // Manual for doctors]. Saint Petersburg, Vel Publ., 2003. 32 p.
11. Falgout O. S., Polunina E. V., Meditsinskiy sovet, 2010, no. 5-6, pp. 100-104.
12. 12 Sheshunov I. V., Mazina N. K., Khazanov V. A., Mazin P. V., Ekonomika zdravookhraneniya, 2006, no. 12, pp. 39-46.
13. Avunduk A.M., Avunduk M.C., Varnell E.D., Kaufman H.E. The comparison of efficacies of topical corticosteroids and nonsteroidal anti-inflammatory drops on dry eye patients: A clinical and immunocytochemical study. Am J Ophthalmol. 2003. No136. pp. 593-602.
14. Barabino S., Rolando M., Camicione P., [et al.] Systemic linoleic and gammalinolenic acid therapy in dry eye syndrome with an inflammatory component. Cornea. 2003. № 22. pp. 97-101.
15. Baudouin C. The pathology of dry eye. Surv Ophthalmol. 2001. Vol. 45. Suppl. 2. pp. 211-220.
16. Behrens A., Doyle J.J., Stern L., et al. Dysfunctional tear syndrome: A Delphi approach to treatment recommendations. Cornea. 2006. No 25. pp. 900-907.
17. Brignole F., Pisella P.J., De Saint Jean M., [et al.] Flow cytometric analysis of inflammatory markers in KCS: 6-month treatment with topical cyclosporine A. Invest Ophthalmol Vis Sci. 2001. № 42. pp. 90-95.
18. Christiansen M., Cohen S., Rinehart J., [et al.] Clinical evaluation of an HP -guar gellable lubricant eye drop for the relief of dryness of the eye. Curr Eye Res. 2004. Vol. 28. pp. 55-62.
19. Di Pascuale M.A., Goto E., Tseng S.C. Sequential changes of lipid tear film after the instillation of a single drop of a new emulsion eye drop in dry eye patients. Ophthalmology. 2004. Vol. 111. pp. 783-791.
20. Dry Eye Workshop Management and therapy of dry eye disease: Report of the Management and Therapy Subcommittee of the International Dry Eye Workshop. Ocul Surf. 2007. Vol. 5, No 2. pp.163-178.
21.Foulks G.N. Treatment of dry eye disease by the non-ophthalmologist. Rheum Dis Clin North Am. 2008. Vol. 34, № 4. pp. 987-1000.
22. Gayton J. L. Etiology, prevalence, and treatment of dry eye disease. Clin Ophthalmol. 2009. Vol. 3. pp. 405-412.
23. Geerling G., Daniels J.T., Dart J.K., [et al.] Toxicity of natural tear substitutes in a fully defined culture model of human corneal epithelial cells. Invest Ophthalmol Vis Sci. 2001. pp. 42948-42956.
24. Geerling G., Honnicke K., Schroder C., [et al.] Quality of salivary tears following autologous submandibular gland transplantation for severe dry eye. Graefes Arch Clin Exp Ophthalmol. 2000. № 238. pp. 45-52.
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
25. Green K., MacKeen D.L., Slagle T., Cheeks L. Tear potassium contributesto maintenance of corneal thickness. Ophthalmic Res. 1992. Vol. 24. pp. 99-102.
26.Habif T.P. Clinical dermatology, 4th ed. St Louis:Mosby-Year Book. 2004. pp. 162-189.
27. International Dry Eye Workshop. The definition and classification of dry eye disease: Report of the Definition and Classification Subcommittee of the International Dry Eye Workshop. Ocul Surf. 2007. Vol. 5, No 2. pp. 75-92.
28. James M.J., Gibson R.A. , Cleland L.G. Dietary polyunsaturated fatty acids and inflammatory mediator production . Am J Clin Nutr. 2000. No 71. 1 Suppl. pp. 343-348.
29.Kamiya K., Nakanishi M., Ishii R., Kobashi H., Igarashi A., Sato N., Shimizu K. Clinical evaluation of the additive effect of diquafosol tetrasodium on sodium hyaluronate monotherapy in patients with dry eye syndrome: a prospective, randomized, multicenter study. Eye (Lond). 2012. No 26, Vol. 10. pp. 1363-1368.
30. Keating G.M. Diquafosol ophthalmic solution 3 %: a review of its use in dry eye. Drugs. 2015. No 75, Vol. 8. pp. 911-922.
31.Kunert K.S., Tisdale A.S., Stern M.E., Smith J.A. Analysis of topical cyclosporine treatment of patients with dry eye syndrome: effect on conjunctival lymphocytes. Arch Ophthalmol. 2000. No 118. pp. 14891496.
32.Lemp M.A. Management of dry eye disease. Am J Manag Care. 2008. Vol. 14, No 3 (Suppl). pp. 88-101.
33.Lemp M.A., Foulks G.N., Devgan U., Trattler W.B., Nichols K.K. The therapeutic role of lipids: Managing ocular surface disease. Refractive Eyecare for Ophthalmologists. 2005. Vol. 9 (Suppl). pp. 3-15.
34. Li D.Q., Luo L., Chen Z., [et al.] JNK and ER K MAP kinases mediate induction of IL -1beta, TNF-alpha and IL -8 following hyperosmolar stress in human limbal epithelial cells. Exp Eye Res. 2006. No 82. pp. 588-596.
35.Luo L., Li D., Corrales R., Pflugfelder S. Hyperosmolar saline is a proinflammatory stress on the mouse ocular surface. Eye Contact Lens. 2005. Vol. 31. pp. 186-193.
36.Luo L., Li D.Q., Doshi A., [et al.] Experimental dry eye stimulates productionof inflammatory cytokines and MMP-9 and activates MAP K signaling pathways on the ocular surface. Invest Ophthalmol Vis Sci. 2004. No 45. pp. 4293-4301.
37.Matoba A.Y., Harris D.J., Mark D.B., [et al.] Dry eye syndrome, American Academy of Ophthalmology. 2003.
38.McCulley J.P., Shine W.E., Aronowicz J. [et al.] Presumed Hyposecretory/Hyperevaporative KCS: Tear Characteristics. Trans Am Ophthalmol Soc. 2003. Vol. 101. pp. 141-154.
39. Nelson J.D., Farris R.L. Sodium hyaluronate and polyvinyl alcohol artificial tear preparations a comparison in patients with keratoconjunctivitis sicca. Arch Ophthalmol. 1988. Vol. 106. pp. 484-487.
40.Niederkorn J.Y., Stern M.E., Pflugfelder S.C., [et al.] Desiccating stress induces T cell-mediated Sjogren’s syndrome-like lacrimal keratoconjunctivitis. J Immunol. 2006. No 176. pp. 3950-3957.
41.Papas A.S., Sherrer Y.S., Charney M., [ et al.] Successful treatment of dry mouth and dry eye symptoms in Sjogren’s syndrome patients with oral pilocarpine: A randomized, placebo-controlled, dose-adjustment study. J Clin Rheumatol. 2004. No 4. pp. 169-177.
42.Perrigan D.M., Morgan A., Quintero S., [et al.] Comparison of osmolarity values of selected ocular lubricants. AR VO 2004 poster session 449.
43. Perry H.D. Dry eye disease: Pathophysiology, classification, and diagnosis. Am J Manag Care. 2008. Vol. 4, No 3 Suppl. pp. 79-87.
44.Petrone D., Condemi J.J., Fife R., [et al.] Doubleblind randomized placebocontrolled study of cevimeline in Sjogren’s syndrome patients with xerostomiaand keratoconjunctivitis sicca. Arthritis Rheum. 2002. No 46. pp. 748-754.
45.Pflugfelder S. C., Solomon A. Dry eye. Ocular surface disease. Ed. by. — E. J. Holland, M. J. Mannis, Springer. 2001. pp. 49-57.
46. Pflugfelder S. C., Solomon A. Dry eye A. Ocular surface disease. Ed. by. — New York. 2001. pp. 49-57.
47.Pflugfelder S.C., Maskin S.L., Anderson B., [et al.] A randomized, doublemasked, placebo-controlled, multicenter comparison of loteprednol etabonate ophthalmic suspension, 0.5%, and placebo for treatment of keratoconjunctivitis sicca in patients with delayed tear clearance. Am J Ophthalmol. 2004. No 138. pp .444-457.
48. Sainz de la Maza Serra S.M., Simon Castellvi C., Kabbani O. Nonpreserved topical steroids and punctal occlusion for severe keratoconjunctivitis sicca. Arch Soc Esp Oftalmol. 2000. No 75. pp. 751-756.
49. Sall K., Stevenson O.D., Mundorf T.K., Reis B.L. Two multicenter, randomized studies of the efficacy and safety of cyclosporine ophthalmic emulsion in moderate to severe dry eye disease. Ophthalmology. 2000. No 107. pp. 631-639.
50. Shine W.E., McCulley J.P., Pandya A.G. Minocycline effect on Meibomian gland lipids in meibomianitis patients. Exp Eye Res. 2003. No 76. pp. 417-420.
51. Stevenson D., Tauber J., Reis B.L. Efficacy and safety of cyclosporin A ophthalmic emulsion in the treatment of moderate-to-severe dry eye disease. A doseranging, randomized trial. Ophthalmology. 2000. No 107. pp. 967-974.
52. Tauber J., Davitt W.F., Bokosky J.E., [et al.] Double-masked, placebo-controlled safety and efficacy trial of diquafosol tetrasodium (INS365) ophthalmic solution for the treatment of dry eye. Cornea. 2004. No 23. pp. 784-792.
53. The Epidemiology of dry eye disease: report of the Epidemiology Subcommittee of the International Dry Eye Workshop. Ocul Surf. 2007. Vol. 5, No 2. P. 174.
54. The Madrid Triple Classification of Dry Eye. J. Murube [et al.] Arch. Soc. Esp. Oftalmol. 2003. Vol.78, No 11. pp. 587-594.
55. The triple classification of dry eye for practical clinical use. J. Murube [et al.] Eur. J. Ophthal. 2005. Vol. 15. pp. 660-667.
56. Toda I., Ide T., Fukumoto T., Ichihashi Y., Tsubota K. Combination therapy with diquafosol tetrasodium and sodium hyaluronate in patients with dry eye after laser in situ keratomileusis. Am J Ophthalmol. 2014. No 157, Vol. 3. pp. 616-622.
57. Turner K., Pflugfelder S.C., Ji Z., [et al.] Interleukin-6 levels in the conjunctival epithelium of patients with dry eye disease treated with cyclosporine ophthalmic emulsion. Cornea. 2000. No 19. pp. 492-496.
58. Velicer C.M., Heckbert S.R., Lampe J.W., [et al.] Antibiotic use in relation to the risk of breast cancer. JAMA. 2004. No 291. pp. 827-835.
59. Versura P., Profazio V., Giannaccare G., Fresina M., Campos E.C. Discomfort symptoms reduction and ocular surface parameters recovery with Artelac Rebalance treatment in mild-moderate dry eye. Eur J Ophthalmol. 2013. No 23, Vol. 4. pp. 488-49
| Dry eye syndrome | |
|---|---|
| Other names | Dry eye, keratoconjunctivitis sicca, dry eye disease (DED), keratitis sicca |
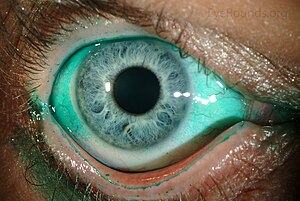 |
|
| Diffuse lissamine green staining in a person with severe dry eye.[1] | |
| Specialty | Ophthalmology, Optometry |
| Symptoms | Dry eyes, irritation, redness, discharge, blurred vision[2] |
| Complications | Corneal scarring[2] |
| Causes | Contact lenses, meibomian gland dysfunction, pregnancy, Sjögren syndrome, vitamin A deficiency, LASIK surgery, antihistamines, hormone replacement therapy, antidepressants[2][3][4] |
| Treatment | Artificial tears, wrap around glasses, changing certain medications[2] |
| Medication | Ciclosporin, steroid eye drops[2] |
| Frequency | ~20%[5] |
Dry eye syndrome, also known as keratoconjunctivitis sicca, is the condition of having dry eyes.[2] Symptoms include dryness in the eye, irritation, redness, discharge, blurred vision, and easily fatigued eyes. Symptoms range from mild and occasional to severe and continuous.[3] Dry eye syndrome can lead to blurred vision, instability of the tear film, increased risk of damage to the ocular surface such as scarring of the cornea, and changes in the eye including the neurosensory system.[2][6]
Dry eye occurs when either the eye does not produce enough tears or when the tears evaporate too quickly.[2] This can be caused by age, contact lens use, meibomian gland dysfunction,[7] pregnancy, Sjögren syndrome, vitamin A deficiency, omega-3 fatty acid deficiency, LASIK surgery, and certain medications such as antihistamines, some blood pressure medication, hormone replacement therapy, and antidepressants.[2][3][4] Chronic conjunctivitis such as from tobacco smoke exposure or infection may also lead to the condition.[2] Diagnosis is mostly based on the symptoms, though a number of other tests may be used.[8] Dry eye syndrome occasionally makes wearing contact lenses impossible.[2]
Treatment depends on the underlying cause. Artificial tears are usually the first line of treatment. Wrap-around glasses that fit close to the face may decrease tear evaporation.[9] Looking carefully at the medications a person is taking and, if safe, altering the medications may also improve symptoms if these medications are the cause. Some topical medications may be suggested to help treat the condition. The immunosuppressant cyclosporine (ciclosporin) may be recommended to increase tear production and, for short term use, topical corticosteroid medications are also sometimes helpful to reduce inflammation.[6] Another treatment that is sometimes suggested is lacrimal plugs that prevent tears from draining from the surface of the eye.
Dry eye syndrome is a common eye disease.[3] It affects 5–34% of people to some degree depending on the population looked at.[5] Among older people it affects up to 70%.[10] In China it affects about 17% of people.[11] The phrase «keratoconjunctivitis sicca» means «dryness of the cornea and conjunctiva» in Latin[12]
Signs and symptoms[edit]
Typical symptoms of dry eye syndrome are dryness, burning[13] and a sandy-gritty eye irritation that gets worse as the day goes on.[14] Symptoms may also be described as itchy, stinging or tired eyes.[13][15] Other symptoms are pain, redness, a pulling sensation, and pressure behind the eye.[4][13] There may be a feeling that something, such as a speck of dirt, is in the eye.[4][13] The resultant damage to the eye’s surface increases discomfort and sensitivity to bright light.[13] Both eyes usually are affected.[16]
There may also be a stringy discharge from the eyes. Although it may seem contradictory, dry eye can cause the eyes to water due to irritation. One may experience excessive tearing such as if something got into the eye. These reflex tears will not necessarily make the eyes feel better since they are the watery tears that are produced in response to injury, irritation, or emotion which lack the lubricating qualities necessary to prevent dry eye.[4]
Because blinking coats the eye with tears, symptoms are worsened by activities in which the rate of blinking is reduced due to prolonged use of the eyes.[13] These activities include prolonged reading, computer usage (computer vision syndrome), driving, or watching television.[4][13] Symptoms increase in windy, dusty or smoky (including cigarette smoke) areas, in dry environments high altitudes including airplanes, on days with low humidity, and in areas where an air conditioner (especially in a car), fan, heater, or even a hair dryer is being used.[4][13][14][16] Symptoms reduce during cool, rainy, or foggy weather and in humid places, such as in the shower.[13]
Most people who have dry eyes experience mild irritation with no long-term effects. However, if the condition is left untreated or becomes severe, it can produce complications that can cause eye damage, instability of the tear film, neurosensory changes, impaired vision, or (rarely) in the loss of vision.[4][6]
Causes[edit]
Any abnormality of any one of the three layers of tears produces an unstable tear film, resulting in symptoms of dry eyes.[14]
Increased evaporation[edit]
The most common cause of dry eye is increased evaporation of the tear film, typically as a result of meibomian gland dysfunction (MGD). The meibomian glands are two sets of oil glands that line the upper and lower eyelids and secrete the oily outer layer of the tear film—the lipid layer. These glands often become clogged due to inflammation caused by blepharitis and/or rosacea, preventing an even distribution of oil. The result is an unstable lipid layer that leads to increased evaporation of the tear film.[citation needed]
In severe cases of MGD, the meibomiam glands can atrophy and cease producing oil entirely.[citation needed]
Low humidity[edit]
Low humidity may cause dry eye syndrome.
Decreased tear production[edit]
Keratoconjunctivitis sicca can be caused by inadequate tear production from lacrimal hyposecretion.[13][14] The aqueous tear layer is affected, resulting in aqueous tear deficiency (ATD).[14] The lacrimal gland does not produce sufficient tears to keep the entire conjunctiva and cornea covered by a complete layer.[13] This usually occurs in people who are otherwise healthy. Increased age is associated with decreased tearing.[14] This is the most common type found in postmenopausal women.[13][17]
In many cases, aqueous deficient dry eye may have no apparent cause (idiopathic). Other causes include congenital alacrima, xerophthalmia, lacrimal gland ablation, and sensory denervation.[14] In rare cases, it may be a symptom of collagen vascular diseases, including relapsing polychondritis, rheumatoid arthritis, granulomatosis with polyangiitis, and systemic lupus erythematosus.[13][14][18][19] Sjögren syndrome and other autoimmune diseases are associated with aqueous tear deficiency.[13][14] Drugs such as isotretinoin, sedatives, diuretics, tricyclic antidepressants, antihypertensives, oral contraceptives, antihistamines, nasal decongestants, beta-blockers, phenothiazines, atropine, and pain relieving opiates such as morphine can cause or worsen this condition.[4][13][14] Infiltration of the lacrimal glands by sarcoidosis or tumors, or postradiation fibrosis of the lacrimal glands can also cause this condition.[14] Recent attention has been paid to the composition of tears in normal or dry eye individuals. Only a small fraction of the estimated 1543 proteins in tears are differentially deficient or upregulated in dry eye, one of which is lacritin.[20][21] Topical lacritin promotes tearing in rabbit preclinical studies.[22] Also, topical treatment of eyes of dry eye mice (Aire knockout mouse model of dry eye) restored tearing, and suppressed both corneal staining and the size of inflammatory foci in lacrimal glands.[23]
Additional causes[edit]
Excess screen time on computers, smartphones, tablets, or other digital devices can cause dry eye. «Humans normally blink about 15 times in one minute. However, studies show that we only blink about 5 to 7 times in a minute while using computers and other digital screen devices. Blinking is the eye’s way of getting the moisture it needs on its surface.»[24]
Aging is one of the most common causes of dry eyes because tear production decreases with age.[4] Several classes of medications (both prescription and OTC) have been hypothesized as a major cause of dry eye, especially in the elderly. Particularly, anticholinergic medications that also cause dry mouth are believed to promote dry eye.[25] Dry eye may also be caused by thermal or chemical burns, or (in epidemic cases) by adenoviruses. A number of studies have found that people with diabetes have an increased risk for the condition.[26]
About half of all people who wear contact lenses complain of dry eyes.[4] There are two potential connections between contact usage and dry eye. Traditionally, it was believed that soft contact lenses, which float on the tear film that covers the cornea, absorb the tears in the eyes.[4] The connection between a loss in nerve sensitivity and tear production is also the subject of current research.[27]
Dry eye also occurs or becomes worse after LASIK and other refractive surgeries, in which the corneal nerves which stimulate tear secretion[4] are cut during the creation of a corneal flap.[4] Dry eye caused by these procedures usually resolves after several months, but it can be permanent.[16] Persons who are thinking about refractive surgery should consider this.[4]
An eye injury or other problem with the eyes or eyelids, such as bulging eyes or a drooping eyelid can cause keratoconjunctivitis sicca.[15] Disorders of the eyelid can impair the complex blinking motion required to spread tears.[16]
Abnormalities of the mucin tear layer caused by vitamin A deficiency, trachoma, diphtheric keratoconjunctivitis, mucocutaneous disorders, and certain topical medications are also causes of keratoconjunctivitis sicca.[14]
Persons with keratoconjunctivitis sicca have elevated levels of tear nerve growth factor (NGF).[14] It is possible that this eye’s surface NGF plays an important role in ocular surface inflammation associated with dry eyes.[14]
Pathophysiology[edit]
Having dry eyes for a while can lead to tiny abrasions on the surface of the eyes.[15] In advanced cases, the epithelium undergoes pathologic changes, namely squamous metaplasia and loss of goblet cells.[14] Some severe cases result in thickening of the corneal surface, corneal erosion, punctate keratopathy, epithelial defects, corneal ulceration (sterile and infected), corneal neovascularization, corneal scarring, corneal thinning, and even corneal perforation.[13][14]
Another contributing factor may be lacritin monomer deficiency. Lacritin monomer, active form of lacritin, is selectively decreased in aqueous deficient dry eye, Sjögren syndrome dry eye, contact lens-related dry eye and in blepharitis.[21]
Diagnosis[edit]
Symptom assessment is a key component of dry eye diagnosis – to the extent that many believe dry eye syndrome to be a symptom-based disease. Several questionnaires have been developed to determine a score that would allow for a diagnosis. The McMonnies & Ho dry eye questionnaire is often used in clinical studies of dry eyes.[28]
Some tests allow patients to be classified into one of two categories, “aqueous-deficient” or “hyperevaporative.” Diagnostic guidelines were published in 2007 by the Dry Eye Workshop.[29] A slit lamp examination can be performed to diagnose dry eyes and to document any damage to the eye.[13][14] When realizing this test, the practitioner is testing the eyelid margin.[29]
A Schirmer’s test can measure the amount of moisture bathing the eye.[13] This test is useful for determining the severity of the condition.[4] A five-minute Schirmer’s test with and without anesthesia using a Whatman #41 filter paper 5 mm wide by 35 mm long is performed. For this test, wetting under 5 mm with or without anesthesia is considered diagnostic for dry eyes.[14]
If the results for the Schirmer’s test are abnormal, a Schirmer II test can be performed to measure reflex secretion. In this test, the nasal mucosa is irritated with a cotton-tipped applicator, after which tear production is measured with a Whatman #41 filter paper. For this test, wetting under 15 mm after five minutes is considered abnormal.[14]
A tear breakup time (TBUT) test measures the time it takes for tears to break up in the eye.[4] The tear breakup time can be determined after placing a drop of fluorescein in the cul-de-sac.[14][29]
A tear protein analysis test measures the lysozyme contained within tears. In tears, lysozyme accounts for approximately 20 to 40 percent of total protein content.[14]
A lactoferrin analysis test provides good correlation with other tests.[14]
The presence of the recently described molecule Ap4A, naturally occurring in tears, is abnormally high in different states of ocular dryness. This molecule can be quantified biochemically simply by taking a tear sample with a plain Schirmer test. Utilizing this technique it is possible to determine the concentrations of Ap4A in the tears of patients and in such way diagnose objectively if the samples are indicative of dry eye.[30]
The tear osmolarity test has been proposed as a test for dry eye disease.[31] Tear osmolarity may be a more sensitive method of diagnosing and grading the severity of dry eye compared to corneal and conjunctival staining, tear break-up time, Schirmer test, and meibomian gland grading.[32] Others have recently questioned the utility of tear osmolarity in monitoring dry eye treatment.[21]
Prevention[edit]
Avoiding refractive surgery (LASIK & PRK), limiting contact lens use, limiting computer screen use, avoiding environmental conditions can decrease symptoms.[33] Complications can be prevented by use of wetting and lubricating drops and ointments.[34]
Treatment[edit]
A variety of approaches can be taken to treat dry eye syndrome. Approaches include: avoidance of exacerbating factors (things that make it worse), tear stimulation and supplementation, increasing tear retention, eyelid cleansing, and treatment of eye inflammation.[35]
Conditions such as blepharitis can often co-exist and paying particular attention to cleaning the eyelids morning and night with mild soaps and warm compresses can improve both conditions.[35]
Avoiding exacerbating factors and environmental control[edit]
Dry eyes can be exacerbated by smoky environments, dust and air conditioning and by our natural tendency to reduce our blink rate when concentrating. Purposefully blinking, especially during computer use and resting tired eyes are basic steps that can be taken to minimise discomfort.[35] Rubbing one’s eyes can irritate them further, so should be avoided.[16] Dry, drafty environments and those with smoke and dust should be avoided.[13] This includes avoiding hair dryers, heaters, air conditioners or fans, especially when these devices are directed toward the eyes. Wearing glasses or directing gaze downward, for example, by lowering computer screens can be helpful to protect the eyes when aggravating environmental factors cannot be avoided.[16] Using a humidifier, especially in the winter, can help by adding moisture to the dry indoor air.[13][15][16][35]
Tear stimulation and supplementation[edit]
For mild and moderate cases, supplemental lubrication is the most important part of treatment.[14] Application of artificial tears is sometimes suggested every few hours and may provide temporary relief.[13] There are many different types of artificial tear on the market, however, there is no strong evidence to suggest that certain artificial tear formulations are superior to others in treating dry eye.[36]
Autologous serum eye drops[edit]
Eye drops that include autologous serum (serum taken from the same person’s blood and used in an eye drop formulation) are sometimes suggested to help supplement natural tears. The composition of serum has similarities to natural tears may mimic natural tears. Evidence supporting this approach shows that autologous serum may be superior to artificial tears at relieving symptoms in the short-term, however, there is no strong evidence that autologous serum eye drops are better than artificial tears or saline solution for long-term symptom relief.[37]
Additional options[edit]
Lubricating tear ointments can be used during the day, but they generally are used at bedtime due to poor vision after application.[14] They contain white petrolatum, mineral oil, and similar lubricants.[14] They serve as a lubricant and an emollient.[14] Application requires pulling down the lower eyelid and applying a small amount (0.25 in) inside.[14] Depending on the severity of the condition, it may be applied from every hour to just at bedtime.[14] It should never be used with contact lenses.[14] Specially designed glasses that form a moisture chamber around the eye may be used to create additional humidity.[16]
Medication[edit]
Inflammation occurring in response to tears film hypertonicity can be suppressed by mild topical corticosteroids or with topical immunosuppressants such as ciclosporin (Restasis).[38][39][6] Elevated levels of tear NGF can be decreased with 0.1% prednisolone.[14]
Topical corticosteroids[edit]
Topical corticosteroids are commonly prescribed for those whose dry eye syndrome symptoms may be caused by inflammation and may lead to a small to moderate improvement in dry-eye symptoms when compared to lubricants or artificial tear drop treatment alone.[6] It is not clear if topical corticosteroid treatment leads to an improvement in the quality of the tear film or the quantity of natural tears.[6] There are also risks to consider with long-term use of topical corticosteroid treatment including an increased risk of ocular hypertension, risk of cataract development, and increased risk of eye infections. For people who may benefit from topical corticosteroid treatment for dry eye syndrome, the ideal treatment regime, formulation of the topical preparations, and balance between potential risks of this medication is not clear.[6]
Ciclosporin (cyclosporin)[edit]
Topical ciclosporin (topical ciclosporin A, tCSA) 0.05% ophthalmic emulsion is an immunosuppressant that is commonly used to treat symptoms of dry eye syndrome.[14][40] The drug decreases surface inflammation with the goal of increasing tear production.[16] Some people find relief and report increased tear production, however, evidence of effectiveness from clinical trials is not strong and although some people may find relief, effectiveness may be inconsistent in different people.[40] Ciclosporin A treatment also comes with risks of adverse effects that are generally not serious but include a burning sensation.[40] Ciclosporin should not be used while wearing contact lenses,[14] during eye infections[4] or in people with a history of herpes virus infections.[16] Side effects include burning sensation (common),[4] redness, discharge, watery eyes, eye pain, foreign body sensation, itching, stinging, and blurred vision.[14][4] Long term use of ciclosporin at high doses is associated with an increased risk of cancer.[41][42] Cheaper generic alternatives are available in some countries.[43]
Other medications[edit]
Diquafosol, an agonist of the P2Y2 purinergic receptor, is approved in Japan for managing dry eye disease by promoting secretion of fluid and mucin from cells in the conjunctiva, rather than by directly stimulating the lacrimal glands.[44]
Lifitegrast was approved by the US FDA for the treatment of the condition in 2016.[45]
Varenicline (Tyrvaya by Oyster Point Pharma) was approved by the US FDA for the treatment of dry eye disease in October 2021.[46][47]
Oral n-acetylcysteine (NAC),[48] hyaluronic acid and/or rebamipide-based eye drops[49][50] may also be effective for dry eyes.
Perfluorohexyloctane (Miebo) was approved for medical use in the United States in May 2023.[51]
Conserving tears[edit]
There are methods that allow both natural and artificial tears to stay longer.[16]
In each eye, there are two puncta[52] – little openings that drain tears into the tear ducts.[4] There are methods to partially or completely close the tear ducts.[16] This blocks the flow of tears into the nose, and thus more tears are available to the eyes.[13] Drainage into either one or both puncta in each eye can be blocked.
Punctal plugs are inserted into the puncta to block tear drainage.[4] It is not clear if punctal plugs are effective at reducing dry eye syndrome symptoms.[53] Punctal plugs are thought to be «relatively safe», however, their use may result in epiphora (watery eyes), and more rarely, serious infection and swelling of the tear sac where the tears drain.[53] They are reserved for people with moderate or severe dry eye when other medical treatment has not been adequate.[4]
If punctal plugs are effective, thermal[16] or electric[14] cauterization of puncti can be performed. In thermal cauterization, a local anesthetic is used, and then a hot wire is applied.[16] This shrinks the drainage area tissues and causes scarring, which closes the tear duct.[16]
Other[edit]
There is evidence that long‐chain omega‐3 supplementation may be helpful,[54] however, fish- flax- and hemp-oil (omega-3) supplements do not appear to be effective in relieving symptoms.[55][56]
Surgery[edit]
In severe cases of dry eyes, tarsorrhaphy may be performed where the eyelids are partially sewn together. This reduces the palpebral fissure (eyelid separation), ideally leading to a reduction in tear evaporation.[13]
Prognosis[edit]
Keratoconjunctivitis sicca usually is a chronic problem.[16] Its prognosis shows considerable variance, depending upon the severity of the condition. Most people have mild-to-moderate cases, and can be treated symptomatically with lubricants. This provides an adequate relief of symptoms.[14]
When dry eyes symptoms are severe, they can interfere with quality of life.[4] People sometimes feel their vision blurs with use, or severe irritation to the point that they have trouble keeping their eyes open or they may not be able to work or drive.[13][4]
Epidemiology[edit]
Keratoconjunctivitis sicca is relatively common within the United States, especially so in older patients.[14] Specifically, the persons most likely to be affected by dry eyes are those aged 40 or older.[16] 10–20% of adults experience Keratoconjunctivitis sicca.[53] Approximately 1 to 4 million adults (age 65–84) in the USA are affected.[53]
While persons with autoimmune diseases have a high likelihood of having dry eyes, most persons with dry eyes do not have an autoimmune disease.[16] Instances of Sjögren syndrome and keratoconjunctivitis sicca associated with it are present much more commonly in women, with a ratio of 9:1. In addition, milder forms of keratoconjunctivitis sicca also are more common in women.[14] This is partly because hormonal changes, such as those that occur in pregnancy, menstruation, and menopause, can decrease tear production.[4][16]
In areas of the world where malnutrition is common, vitamin A deficiency is a common cause. This is rare in the United States.[34]
Racial predilections do not exist for this disease.[14]
Research[edit]
New treatment options are under development. Heating systems that try to unblock the oil glands in the eye have some preliminary evidence of benefit.[57]
Synonyms[edit]
Other names for dry eye include dry eye syndrome, keratoconjunctivitis sicca, dysfunctional tear syndrome, lacrimal keratoconjunctivitis, evaporative tear deficiency, aqueous tear deficiency, and LASIK-induced neurotrophic epitheliopathy.[2]
Other animals[edit]
Among other animals, dry eye can occur in dogs, cats, and horses.[58]
Dogs[edit]
Keratoconjunctivitis sicca is common in dogs. Most cases are caused by a genetic predisposition, but chronic conjunctivitis, canine distemper, and drugs such as sulfasalazine and trimethoprim-sulfonamide also cause the disease.[59] Symptoms include eye redness, a yellow or greenish discharge, corneal ulceration, pigmented cornea, and blood vessels on the cornea. Diagnosis is made by measuring tear production with a Schirmer tear test. Less than 15 mm of wetting by tears produced in a minute is abnormal.[59]
Tear replacers are a mainstay of treatment, preferably containing methylcellulose or carboxymethyl cellulose.[59] Ciclosporin stimulates tear production and acts as a suppressant on the immune-mediated processes that cause the disease. Topical antibiotics and corticosteroids are sometimes used to treat secondary infections and inflammation. A surgery known as parotid duct transposition is used in some extreme cases where medical treatment has not helped. This redirects the duct from the parotid salivary gland to the eye. Saliva replaces the tears. Dogs with cherry eye should have the condition corrected to help prevent this disease.[citation needed]
Breeds with a higher risk of dry eye compared to other breeds include:
- American Cocker Spaniel[60]
- Bloodhound[60]
- Boston Terrier[60]
- English Bulldog[60]
- Cavalier King Charles Spaniel[60]
- Lhasa Apso[60]
- Miniature Schnauzer[60]
- Pekingese[60]
- Pug[60]
- Samoyed[60]
- Shih Tzu[60]
- West Highland White Terrier[60]
Cats[edit]
Keratoconjunctivitis sicca is uncommon in cats.[61] Most cases seem to be caused by chronic conjunctivitis, especially secondary to feline herpesvirus.[59] Diagnosis, symptoms, and treatment are similar to those for dogs.
See also[edit]
- Conjunctivochalasis
References[edit]
- ^ Critser B. «Lissamine green staining in keratoconjunctivitis sicca». Eye Rounds. The University of Iowa. Archived from the original on 7 August 2016. Retrieved 29 July 2016.
- ^ a b c d e f g h i j k l «Facts About Dry Eye». NEI. February 2013. Archived from the original on 28 July 2016. Retrieved 29 July 2016.
- ^ a b c d Kanellopoulos AJ, Asimellis G (2016). «In pursuit of objective dry eye screening clinical techniques». Eye and Vision. 3: 1. doi:10.1186/s40662-015-0032-4. PMC 4716631. PMID 26783543.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z Meadows M (May–June 2005). «Dealing with Dry Eye». FDA Consumer Magazine. U.S. Food and Drug Administration. 39 (3): 8–9. PMID 16127813. Archived from the original on February 23, 2008.
- ^ a b Messmer EM (January 2015). «The pathophysiology, diagnosis, and treatment of dry eye disease». Deutsches Ärzteblatt International. 112 (5): 71–81, quiz 82. doi:10.3238/arztebl.2015.0071. PMC 4335585. PMID 25686388.
- ^ a b c d e f g Liu, Su-Hsun; Saldanha, Ian J; Abraham, Alison G; Rittiphairoj, Thanitsara; Hauswirth, Scott; Gregory, Darren; Ifantides, Cristos; Li, Tianjing (2022-10-21). Cochrane Eyes and Vision Group (ed.). «Topical corticosteroids for dry eye». Cochrane Database of Systematic Reviews. 2022 (10): CD015070. doi:10.1002/14651858.CD015070.pub2. PMC 9586197. PMID 36269562.
- ^ Puro DG (June 2020). «How goblet cells respond to dry eye: adaptive and pathological roles of voltage-gated calcium channels and P2X7 purinoceptors». American Journal of Physiology. Cell Physiology. 318 (6): C1305–C1315. doi:10.1152/ajpcell.00086.2020. PMC 7311746. PMID 32348177.
- ^ Tavares F, Fernandes RS, Bernardes TF, Bonfioli AA, Soares EJ (May 2010). «Dry eye disease». Seminars in Ophthalmology. 25 (3): 84–93. doi:10.3109/08820538.2010.488568. PMID 20590418. S2CID 207474207.
- ^ «Eye Drops for Dry Eyes | Science-Based Medicine». sciencebasedmedicine.org. 2021-05-04. Archived from the original on 2022-11-04. Retrieved 2022-11-04.
- ^ Ding J, Sullivan DA (July 2012). «Aging and dry eye disease». Experimental Gerontology. 47 (7): 483–490. doi:10.1016/j.exger.2012.03.020. PMC 3368077. PMID 22569356.
- ^ Liu NN, Liu L, Li J, Sun YZ (2014). «Prevalence of and risk factors for dry eye symptom in mainland china: a systematic review and meta-analysis». Journal of Ophthalmology. 2014: 748654. doi:10.1155/2014/748654. PMC 4216702. PMID 25386359.
- ^ Firestein GS (2013). Kelley’s textbook of rheumatology (9th ed.). Philadelphia: Elsevier/Saunders. p. 1179. ISBN 978-1437717389. Archived from the original on 2017-09-08.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x «Keratoconjunctivitis Sicca». The Merck Manual, Home Edition. Merck & Co. 2003-02-01. Archived from the original on 2006-11-12. Retrieved 2006-11-12.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al «Keratoconjunctivitis, Sicca». eMedicine. WebMD, Inc. January 27, 2010. Archived from the original on March 7, 2010. Retrieved September 3, 2010.
- ^ a b c d «Dry eyes». MedlinePlus Medical Encyclopedia. U.S. National Library of Medicine. 2006-10-04. Archived from the original on 2006-12-06. Retrieved 2006-11-16.
- ^ a b c d e f g h i j k l m n o p q r s «Dry eyes». Mayo Clinic. Mayo Foundation for Medical Education and Research. 2006-06-14. Archived from the original on 2007-03-24. Retrieved 2006-11-17.
- ^ Sendecka M, Baryluk A, Polz-Dacewicz M (2004). «[Prevalence and risk factors of dry eye syndrome]» [Prevalence and risk factors of dry eye syndrome]. Przeglad Epidemiologiczny (in Polish). 58 (1): 227–233. PMID 15218664. Archived from the original on 2016-02-22.
- ^ Puéchal X, Terrier B, Mouthon L, Costedoat-Chalumeau N, Guillevin L, Le Jeunne C (March 2014). «Relapsing polychondritis». Joint Bone Spine. 81 (2): 118–124. doi:10.1016/j.jbspin.2014.01.001. PMID 24556284.
- ^ Cantarini L, Vitale A, Brizi MG, Caso F, Frediani B, Punzi L, et al. (February–March 2014). «Diagnosis and classification of relapsing polychondritis». Journal of Autoimmunity. 48–49: 53–59. doi:10.1016/j.jaut.2014.01.026. PMID 24461536.
- ^ Zhou L, Zhao SZ, Koh SK, Chen L, Vaz C, Tanavde V, et al. (July 2012). «In-depth analysis of the human tear proteome». Journal of Proteomics. 75 (13): 3877–3885. doi:10.1016/j.jprot.2012.04.053. PMID 22634083.
- ^ a b c Karnati R, Laurie DE, Laurie GW (December 2013). «Lacritin and the tear proteome as natural replacement therapy for dry eye». Experimental Eye Research. 117: 39–52. doi:10.1016/j.exer.2013.05.020. PMC 3844047. PMID 23769845.
- ^ Samudre S, Lattanzio FA, Lossen V, Hosseini A, Sheppard JD, McKown RL, et al. (August 2011). «Lacritin, a novel human tear glycoprotein, promotes sustained basal tearing and is well tolerated». Investigative Ophthalmology & Visual Science. 52 (9): 6265–6270. doi:10.1167/iovs.10-6220. PMC 3176019. PMID 21087963.
- ^ Vijmasi T, Chen FY, Balasubbu S, Gallup M, McKown RL, Laurie GW, McNamara NA (July 2014). «Topical administration of lacritin is a novel therapy for aqueous-deficient dry eye disease». Investigative Ophthalmology & Visual Science. 55 (8): 5401–5409. doi:10.1167/iovs.14-13924. PMC 4148924. PMID 25034600.
- ^ «Computers, Digital Devices and Eye Strain». American Academy of Ophthalmology. 2020-03-03. Archived from the original on 2020-10-03. Retrieved 2023-01-19.
- ^ Fraunfelder FT, Sciubba JJ, Mathers WD (2012). «The role of medications in causing dry eye». Journal of Ophthalmology. 2012: 285851. doi:10.1155/2012/285851. PMC 3459228. PMID 23050121.
- ^ Kaiserman I, Kaiserman N, Nakar S, Vinker S (March 2005). «Dry eye in diabetic patients». American Journal of Ophthalmology. 139 (3): 498–503. doi:10.1016/j.ajo.2004.10.022. PMID 15767060.
- ^
- ^ Guo Y, Peng R, Feng K, Hong J (2016). «Diagnostic Performance of McMonnies Questionnaire as a Screening Survey for Dry Eye: A Multicenter Analysis». Journal of Ophthalmology. 2016: 6210853. doi:10.1155/2016/6210853. PMC 4884592. PMID 27293876.
- ^ a b c Messmer EM (January 2015). «The pathophysiology, diagnosis, and treatment of dry eye disease». Deutsches Ärzteblatt International. 112 (5): 71–81, quiz 82. doi:10.3238/arztebl.2015.0071. PMC 4335585. PMID 25686388.
- ^ Peral A, Carracedo G, Acosta MC, Gallar J, Pintor J (September 2006). «Increased levels of diadenosine polyphosphates in dry eye». Investigative Ophthalmology & Visual Science. 47 (9): 4053–4058. doi:10.1167/iovs.05-0980. PMID 16936123.
- ^ Tomlinson A (April 2007). «2007 Report of the International Dry Eye WorkShop (DEWS)» (PDF). The Ocular Surface. 5 (2). Archived (PDF) from the original on 2012-02-27.
- ^ American Academy of Ophthalmology Cornea/External Disease Panel (October 2011). «Dry Eye Syndrome PPP». American Academy of Ophthalmology. Archived from the original on 2012-03-09.
- ^ «10 Symptoms of Dry Eye Syndrome + Possible Causes». All About Vision. Archived from the original on 2018-04-03. Retrieved 2018-04-04.
- ^ a b «Dry eyes syndrome». MedlinePlus Medical Encyclopedia. U.S. National Library of Medicine. 2006-10-04. Archived from the original on 2006-11-19. Retrieved 2006-11-16.
- ^ a b c d
Lemp MA (April 2008). «Management of dry eye disease». The American Journal of Managed Care. 14 (3 Suppl): S88-101. PMID 18452372. Archived from the original on 2012-06-05. Retrieved 2008-07-25. - ^ Pucker AD, Ng SM, Nichols JJ (February 2016). «Over the counter (OTC) artificial tear drops for dry eye syndrome». The Cochrane Database of Systematic Reviews. 2016 (2): CD009729. doi:10.1002/14651858.CD009729.pub2. PMC 5045033. PMID 26905373.
- ^ Pan Q, Angelina A, Marrone M, Stark WJ, Akpek EK (February 2017). «Autologous serum eye drops for dry eye». The Cochrane Database of Systematic Reviews. 2017 (2): CD009327. doi:10.1002/14651858.CD009327.pub3. PMC 5510593. PMID 28245347.
- ^ Tatlipinar S, Akpek EK (October 2005). «Topical ciclosporin in the treatment of ocular surface disorders». The British Journal of Ophthalmology. 89 (10): 1363–1367. doi:10.1136/bjo.2005.070888. PMC 1772855. PMID 16170133.
- ^ Barber LD, Pflugfelder SC, Tauber J, Foulks GN (October 2005). «Phase III safety evaluation of cyclosporine 0.1% ophthalmic emulsion administered twice daily to dry eye disease patients for up to 3 years». Ophthalmology. 112 (10): 1790–1794. doi:10.1016/j.ophtha.2005.05.013. PMID 16102833.
- ^ a b c de Paiva, Cintia S.; Pflugfelder, Stephen C.; Ng, Sueko M.; Akpek, Esen K. (2019-09-13). «Topical cyclosporine A therapy for dry eye syndrome». The Cochrane Database of Systematic Reviews. 9 (9): CD010051. doi:10.1002/14651858.CD010051.pub2. ISSN 1469-493X. PMC 6743670. PMID 31517988.
- ^
«Restasis» (PDF). Allergan. January 2008. Archived (PDF) from the original on 2009-02-05. Retrieved 2008-07-23. - ^ Dantal J, Hourmant M, Cantarovich D, Giral M, Blancho G, Dreno B, Soulillou JP (February 1998). «Effect of long-term immunosuppression in kidney-graft recipients on cancer incidence: randomised comparison of two cyclosporin regimens». Lancet. 351 (9103): 623–628. doi:10.1016/S0140-6736(97)08496-1. PMID 9500317. S2CID 13063500.
60 patients developed cancers, 37 in the normal-dose group and 23 in the low-dose group (p<0.034); 66% were skin cancers (26 vs 17; p<0.05). The low-dose regimen was associated with fewer malignant disorders but more frequent rejection.
- ^
«Sun Pharma Product List». Sun Pharma. Archived from the original on 2007-02-13. Retrieved 2006-11-27. - ^ Koh S (May 2015). «Clinical utility of 3% diquafosol ophthalmic solution in the treatment of dry eyes». Clinical Ophthalmology. 9: 865–872. doi:10.2147/OPTH.S69486. PMC 4440420. PMID 26028958.
- ^ «FDA approves new medication for dry eye disease». FDA. July 12, 2016. Archived from the original on 13 July 2016. Retrieved 13 July 2016.
- ^ «Tyrvaya- varenicline spray». DailyMed. Archived from the original on 23 October 2021. Retrieved 22 October 2021.
- ^ «Oyster Point Pharma Announces FDA Approval of Tyrvaya (varenicline solution) Nasal Spray for the Treatment of the Signs and Symptoms of Dry Eye Disease» (Press release). Oyster Point Pharma. 18 October 2021. Retrieved 22 October 2021 – via PR Newswire.
- ^ Eghtedari, Yas; Oh, Lawrence J.; Girolamo, Nick Di; Watson, Stephanie L. (5 March 2022). «The role of topical N-acetylcysteine in ocular therapeutics». Survey of Ophthalmology. 67 (2): 608–622. doi:10.1016/j.survophthal.2021.07.008. PMID 34339721. S2CID 236884558. Archived from the original on 27 November 2022. Retrieved 5 March 2023 – via PubMed.
- ^ Hynnekleiv, Leif; Magno, Morten; Vernhardsdottir, Ragnheidur R.; Moschowits, Emily; Tønseth, Kim Alexander; Dartt, Darlene A.; Vehof, Jelle; Utheim, Tor P. (5 December 2022). «Hyaluronic acid in the treatment of dry eye disease». Acta Ophthalmologica. 100 (8): 844–860. doi:10.1111/aos.15159. PMC 9790727. PMID 35514082.
- ^ Kinoshita, Shigeru; Oshiden, Kazuhide; Awamura, Saki; Suzuki, Hiroyuki; Nakamichi, Norihiro; Yokoi, Norihiko; Rebamipide Ophthalmic Suspension Phase 3 Study Group (5 June 2013). «A randomized, multicenter phase 3 study comparing 2% rebamipide (OPC-12759) with 0.1% sodium hyaluronate in the treatment of dry eye». Ophthalmology. 120 (6): 1158–1165. doi:10.1016/j.ophtha.2012.12.022. PMID 23490326.
- ^ «Bausch + Lomb and Novaliq Announce FDA Approval of Miebo (Perfluorohexyloctane Ophthalmic Solution) for the Treatment of the Signs and Symptoms of Dry Eye Disease» (Press release). Bausch + Lomb Corporation. 18 May 2023. Retrieved 8 June 2023 – via Business Wire.
- ^ Carter SR (June 1998). «Eyelid disorders: diagnosis and management». American Family Physician. 57 (11): 2695–2702. PMID 9636333. Archived from the original on 2021-08-29. Retrieved 2014-12-31.
- ^ a b c d Ervin AM, Law A, Pucker AD (June 2017). «Punctal occlusion for dry eye syndrome». The Cochrane Database of Systematic Reviews. 2017 (6): CD006775. doi:10.1002/14651858.CD006775.pub3. PMC 5568656. PMID 28649802.
- ^ Downie, Laura E.; Ng, Sueko M.; Lindsley, Kristina B.; Akpek, Esen K. (2019-12-18). «Omega-3 and omega-6 polyunsaturated fatty acids for dry eye disease». The Cochrane Database of Systematic Reviews. 12 (12): CD011016. doi:10.1002/14651858.CD011016.pub2. ISSN 1469-493X. PMC 6917524. PMID 31847055.
- ^ «Fish oil supplements are ineffective for treating dry eyes». NIHR Evidence (Plain English summary). National Institute for Health and Care Research. 2018-07-03. doi:10.3310/signal-000612. S2CID 240442090. Archived from the original on 2022-09-21. Retrieved 2022-09-16.
- ^ The Dry Eye Assessment and Management Study Research Group (2018-05-03). «n−3 Fatty Acid Supplementation for the Treatment of Dry Eye Disease». New England Journal of Medicine. 378 (18): 1681–1690. doi:10.1056/NEJMoa1709691. ISSN 0028-4793. PMC 5952353. PMID 29652551.
- ^ Qiao J, Yan X (2013). «Emerging treatment options for meibomian gland dysfunction». Clinical Ophthalmology. 7: 1797–1803. doi:10.2147/OPTH.S33182. PMC 3772773. PMID 24043929.
- ^ Gelatt KN (June 2014). «Keratoconjunctivitis sicca | Nasolacrimal and Lacrimal Apparatus — Eye Diseases and Disorders». Merck Veterinary Manual. Archived from the original on 31 October 2020. Retrieved 28 October 2020.
- ^ a b c d Gelatt, Kirk N., ed. (1999). Veterinary Ophthalmology (3rd ed.). Lippincott, Williams & Wilkins. ISBN 978-0-683-30076-5.
- ^ a b c d e f g h i j k l Guiliano EA (2013). «Diseases and surgery of the canine lacrimal secretory system». In Gelatt KH (ed.). Veterinary Ophthalmology (5th ed.). Ames, Iowa: Wiley-Blackwell. p. 919. ISBN 9780470960400.
- ^ Stiles J (2013). «Feline ophthalmology». In Kern TJ (ed.). Veterinary Ophthalmology (5th ed.). Ames, Iowa: Wiley-Blackwell. p. 1483. ISBN 9780470960400.
Further reading[edit]
- Asbell P, Lemp MA (November 2006). Dry Eye Disease: The Clinician’s Guide to Diagnosis And Treatment. Thieme Medical Publishers. ISBN 978-1-58890-412-6. Archived from the original on 2009-09-24.
- Geerling G, Brewitt H (June 2008). Surgery for the Dry Eye: Scientific Evidence and Guidelines for the Clinical Management of Dry Eye Associated Ocular Surface Disease. S. Karger AG. ISBN 978-3-8055-8376-3. Archived from the original on 2013-01-28. Retrieved 2008-12-31.
- Latkany R (2007-04-03). The Dry Eye Remedy: The Complete Guide to Restoring the Health and Beauty of Your Eyes. Hatherleigh Press. ISBN 978-1-57826-242-7. Archived from the original on 2011-10-06.
- Maskin SL (2007-05-28). Reversing Dry Eye Syndrome: Practical Ways to Improve Your Comfort, Vision, and Appearance. Yale University Press. ISBN 978-0-300-12285-5.
- Patel S, Blades K (2003-04-10). The Dry Eye: A Practical Approach. Butterworth-Heinemann. ISBN 978-0-7506-4978-0. Archived from the original on 2011-06-07. Retrieved 2008-12-31.
External links[edit]
- Facts About the Cornea and Corneal Disease The National Eye Institute (NEI).
- Dry Eye Syndrome on NHS Choices
- Am.J.Managed Care — Dry Eye Disease: Pathophysiology, Classification, and Diagnosis
- Dry Eye Syndrome on eMedicine
- Nasolacrimal and Lacrimal Apparatus, The Merck Veterinary Manual

