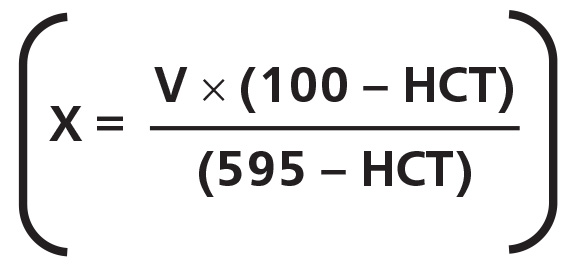Самое слабое звено в диагностике патологии системы гемостаза — преаналитический этап, который включает как подготовку пациента к выполнению исследования, так и саму процедуру забора и транспортировки образца крови в лабораторию. 80–85 % диагностических ошибок вызваны погрешностями на этом этапе, что объясняется высокой лабильностью и многофакторностью системы гемостаза.

Обычная скрининговая коагулограмма для одного пациента обходится более 10 рублей, расширенная — порядка 40 рублей в государственных клиниках, в частных дороже. Каждый дополнительный показатель (D-димер, активность факторов свертывания и пр.) увеличивает стоимость исследования как минимум на 20 рублей.
Ошибки на преаналитическом этапе и доставка некачественных образцов в лабораторию приводят к недостоверным результатам и делают все затраты бесполезными.
Подготовка пациента
На результаты могут повлиять экзогенные «варьирующие» факторы.
Физическая активность: спустя несколько минут физической активности в 2–3 раза увеличивается концентрация FVIII и фактора Виллебранда (vWF); может сохраняться на протяжении 12 часов. Происходит активация тромбоцитов и фибринолиза, увеличивается уровень D-димеров.
Длительный психологический стресс ведет к снижению активности FV, FVIII, FIX (сохраняется на протяжении нескольких дней). Стрессовые условия во время взятия крови приводят к гиперагрегации тромбоцитов.
Физиологические гормональные изменения влияют на активность всей системы свертывания и фибринолиз. Классическим примером является беременность. При физиологическом течении беременности наблюдается постепенный рост FVII и FX. Уровень FVIII и vWF увеличивается в 2–3 раза и сохраняется даже после родов. Формируется резистентность к протеину С (РС), активность протеина S (РS) снижается на 30 %.
Увеличивается уровень маркеров активации свертывания крови и растворимого фибрина. Изменения в системе фибринолиза связаны с ростом ингибиторов РАI-1, РАI-2 (плацентарного), постепенным ростом D-димеров.
При исследовании системы гемостаза у женщин приходится учитывать фазы месячного цикла и влияние гормональных препаратов. Уровни FVIII и vWF наименьшие в фолликулярной и наибольшие в лютеиновой фазе цикла. В период менопаузы наблюдается постепенный рост фибриногена и FVIII. Применение гормонозаместительной терапии (ГЗТ) вызывает АРС-резистентность и снижение PS.
Недостаточная стандартизация так называемых варьирующих долабораторных факторов приводит к диагностическим ошибкам и в итоге увеличивает продолжительность и стоимость диагностики и лечения пациента.
Памятка для пациента
- Кровь следует сдавать утром натощак, не менее чем через 8 ч после последнего приема пищи в условиях, которые не вызывают стресса.
- На протяжении 24 ч перед обследованием необходимо избегать физических нагрузок, употребления жирной пищи и приема алкоголя.
- В день обследования запрещается курить.
- Перед сдачей крови необходимо посидеть в течение 20–30 мин.
- При приеме варфарина рекомендуется с 17:00 до 19:00 принять всю дозу препарата с интервалом не менее 2 ч до или после приема пищи, с последующей сдачей анализа на МНО с 8:00 до 10:00.
Кстати, терминалы электронной очереди позволяют снизить влияние стрессового фактора на пациента, ожидающего взятия крови.
Что должен знать врач, направляющий пациента на обследование гемостаза
1. При назначении даты исследования врачу необходимо учитывать влияние лекарственных препаратов, принимаемых пациентом, на агрегацию тромбоцитов или параметры коагуляции (антикоагулянтов, тромболитиков, ингибиторов фибринолиза, антиагрегантов, оральных контрацептивов, НПВС, венотоников и др.). Эта информация вместе с диагнозом пациента должна быть отражена в бланке направления на исследование.
2. При высоком значении гематокрита стандартное количество цитрата в вакуумных пробирках оказывается избыточным для уменьшенного объема плазмы, что приводит к «ложной» гипокоагуляции. При значении гематокрита ниже 35 % возникает дефицит антикоагулянта в пробе, что может привести к «ложной» гиперкоагуляции в результатах и кровь может свернуться в пробирке еще до исследования. Для стабилизации образцов крови при нормальном значении гематокрита (35–50 %) рекомендуемое соотношение кровь/антикоагулянт 9:1. При отклонениях гематокрита от указанных величин следует изменить это соотношение в соответствии с формулой Ingram:
X — добавляемый объем 3,2 % цитрата, мл; V — конечный объем пробирки для крови, мл; HCT — показатель гематокрита у пациента, %.
3. Особенности подготовки к исследованиям системы гемостаза у женщин:
- С целью диагностики болезни Виллебранда у женщин детородного возраста следует брать кровь на исследование в 1–4-й дни месячного цикла (в дни максимальной кровопотери).
- С целью диагностики снижения РS и АРС-резистентности следует отменить прием оральных контрацептивов за 2 месяца перед обследованием.
- С целью диагностики врожденных нарушений свертывания крови у беременных (особенно болезни Виллебранда и недостатка РS) кровь необходимо брать не ранее, чем через 2 месяца после родов.
4. Диагностику волчаночного антикоагулянта (ВА) в остром периоде заболевания (до 3 месяцев) при приеме НОАК, прямых ингибиторов фактора Ха и тромбина проводить не рекомендуется во избежание получения ложноположительных результатов.
- при применении варфарина проводить исследование после того, как МНО опустится ниже 1,5, или через 1–2 недели после прекращения приема препарата; в случае необходимости продолжения АКТ препаратом выбора, который может быть назначен перед лабораторным исследованием на ВА, являются НМГ;
- последнее введение дозы НМГ должно проводиться за 12 и более часов до анализа крови на ВА. В случае применения НФГ следует отменить препарат за 2 дня до исследования ВА;
- при применении ривароксабана и дабигатрана проводить исследование через 3 дня после отмены препаратов или при переводе пациента на НМГ.
5. Мониторинг АКТ предполагает подбор дозы антикоагулянта, основанный на результатах лабораторных тестов. Крайне важно добиться от пациента правильного приема АК и следования графику.
Прием варфарина с 17:00 до 19:00 всей дозы одновременно с интервалом не менее 2 ч до или после приема пищи, с последующей сдачей анализа на МНО с 8:00 до 10:00.
Рекомендуемые уровни гипокоагуляции:
- высокий уровень МНО — от 3 до 4,5;
- средний уровень МНО — от 2 до 3;
- низкий уровень МНО — от 1,8 до 2,3.
Введение НМГ (далтепарина натрия, надропарина кальция, эноксапарина натрия) с 6:00 до 7:00 утра, сдача крови для исследования анти-Ха активности (НМГ) + антитромбина III (АТ) через 3–4 часа после введения с 10:00 до 11:00.
Целевой диапазон анти-Ха активности:
- для профилактических доз НМГ (п/к) 0,2–0,5 анти-Ха МЕ/мл;
- для лечебных (п/к) 0,5–1,5 анти-Ха МЕ/мл.
Прием ривароксабана (ксарелто) утром натощак с последующей сдачей крови для ис- следования анти-Ха активности (ривароксабан) + АТ через 1,5–2 ч после приема до 11:00.
Лабораторный контроль терапии НМГ и прямыми ингибиторами Ха-фактора рекомендован с учетом клинической ситуации в следующих случаях:
- при геморрагических проявлениях на фоне терапии;
- ОПН, ХПН;
- массе тела менее 50 и более 100 кг;
- длительной терапии (более 10 дней);
- риске кровотечений из-за сопутствующих заболеваний;
- терапии у беременных.

7. С целью диагностики наследственных и приобретенных тромбоцитопатий рекомендуется проводить исследование индуцированной агрегации тромбоцитов дважды:
- на момент обращения с геморрагическими проявлениями;
- повторно не ранее, чем через 14 дней после отмены приема всех препаратов, влияющих на агрегацию тромбоцитов, в т. ч. витаминов и БАДов.
Основные требования, обеспечивающие правильность тестирования показателей гемостаза:
- атравматическая флеботомия;
- полное заполнение пробирки кровью в соответствии с объемом антикоагулянта (9:1);
- использование 3,2 % (0,109 М) трехзамещенного двухводного цитрата натрия;
- полное и осторожное смешивание крови и антикоагулянта;
- транспортировка и хранение проб крови при комнатной температуре (18–25 °С);
- получение бестромбоцитарной плазмы центрифугированием крови в течение 1 ч после взятия;
- быстрое тестирование плазмы после центрифугирования.
Кровь следует брать утром натощак из локтевой вены иглой с широким просветом (0,8 мм). Преимущество имеют вакуумные пробирки, предназначенные для получения венозной крови, стабилизированной цитратом натрия в соотношении 9:1. Использование шприца не рекомендуется из-за активации тромбоцитов и факторов свертывания турбулентным движением крови и ее смешивания с воздухом во время заполнения.
Наложение манжеты при пункции локтевой вены оптимально в течение 1 минуты.
В ходе эксперимента при 3-минутном стазе, вызванном манжетой, ПВ укорачивалось на 3,1 %, содержание фибриногена повышалось на 10,1 %, D-димеров — на 13,4 %, активность FVII и FVIII увеличивалась на 10,6 % и 10,2 % соответственно.
Недостаточное перемешивание венозной крови и антикоагулянта может вызвать образование частичных сгустков небольшого размера, которые не видны в первичных пробирках. Проба запускается в работу, на исследования расходуются дорогостоящие реагенты и только по результатам исследования врач КДЛ может заподозрить наличие в пробе сгустков. В таких случаях выбраковка проводится на постаналитическом этапе лабораторного исследования.
Чем быстрее кровь доставлена в лабораторию, тем достовернее будет результат. Не нужно ждать 30 минут, как при получении сыворотки, чтобы сформировался сгусток. Работа ведется с плазмой, в которой, в отличие от сыворотки, есть фибриноген. Благодаря добавленному в пробирку антикоагулянту кровь не сворачивается.
По рекомендации CLSI, для тестирования плазменного звена гемостаза предпочтительным является 3,2 % (0,109 М) цитрат натрия. Применение именно этой концентрации дает меньшую частоту преаналитических ошибок, т. к. вызывает большую устойчивость лабильных факторов свертывания крови.
Для тестирования агрегационной способности тромбоцитов рекомендуется применение прямых ингибиторов тромбина и НФГ. Они оказывают наименьшее интерферирующее действие на агрегацию тромбоцитов. Очень важно сократить до минимума время между взятием крови и центрифугированием. До центрифугирования кровь необходимо хранить в закрытых пробирках только при комнатной температуре. Нарушение температурного режима может привести к гемолизу эритроцитов и активации тромбоцитов.
Врачи, направляющие пациентов на контроль эффективности антикоагулянтной терапии, должны помнить о необходимости соблюдения пациентами графика приема АК и мониторинга с помощью лабораторных исследований. Ведь последствиями пренебрежения правилами подготовки пациента могут быть такие угрозы, как ятрогенные (лекарственные) тромбозы и кровотечения, ложные суждения о наличии коагулопатии и в целом увеличение расходов на повторные исследования.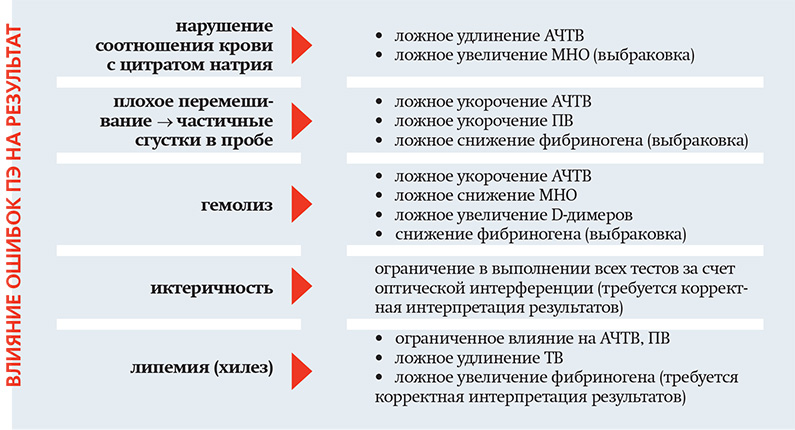
Автор статьи — Главный врач НКЦПГ им. Шмидта, к.м.н., врач высшей квалификационной категории Альтшулер Б.Ю.
Лабораторные исследования — более ранний и намного более чувствительный показатель состояния человека, чем его самочувствие. Результаты анализов отражают физико-химические свойства исследуемой пробы и дают объективную диагностическую информацию. Важные решения по тактике лечения врач зачастую принимает даже при небольших изменениях лабораторных показателей. Поэтому лабораторные исследования для диагностики и лечения заболеваний так важны. Однако результаты анализов далеко не всегда бывают правильными! Это связано с большим количеством факторов, способных оказать влияние на конечные результаты лабораторного тестирования.
Результаты лабораторных исследований подвержены влиянию биологической и аналитической вариации.
Биологическая вариация обусловлена внутрииндивидуальной вариацией, наблюдаемой у одного и того же человека, и межиндивидуальной вариацией, связанной с различиями между людьми.
К факторам, обуславливающим биологическую вариацию, относят:
-
Физиологические закономерности (влияние расы, пола, возраста, телосложения, характера физической активности и питания);
-
Влияние окружающей среды (климат, геомагнитные факторы, время года и суток, состав воздуха, воды и почвы в месте обитания, социально-бытовая среда);
-
Воздействие производственных и бытовых (алкоголь, никотин, наркотики) токсичных веществ, ятрогенных влияний (диагностические и лечебные процедуры, прием лекарственных средств);
-
Условия, предваряющие или сопровождающие взятие пробы (приём пищи и воды, физическая нагрузка, положение тела при взятии пробы, стрессорные и прочие факторы);
-
Время забора пробы, связанное с влиянием циркадных (суточных) ритмов и времени года;
-
Аналитическая вариация зависит от технологии анализа и используемого оборудования. Также к факторам, обуславливающим аналитическую вариацию, относят:
-
Методику взятия пробы (способ и погрешности процедуры, используемые средства, оборудование и консерванты);
-
Условия окружающей среды (температура, вибрации, тряска, интенсивность освещения) и продолжительность транспортировки биоматериала для исследования в лабораторию.
Недостоверные результаты могут быть вызваны ошибками, допущенными на разных этапах лабораторного исследования, затрудняя постановку диагноза и проведение адекватного лечения. Наиболее часто получение ошибочных результатов связано с внелабораторным (т.н. преаналитическим) этапом. Он включает в себя все стадии от назначения анализов врачом до поступления пробы в лабораторию. Именно с этим этапом связано 2/3 всех ошибочных результатов, которые могут обесценить проведенные исследования. Поэтому правильная организация преаналитического этапа – важнейший элемент обеспечения качества лабораторной диагностики.
Факторы, влияющие на правильность лабораторных исследований на преаналитическом этапе
Прием пищи
Режим питания, состав пищи, перерывы в её приёме оказывают существенное влияние на многие лабораторные показатели. После приема пищи содержание отдельных веществ в крови может повышаться или подвергаться изменениям в результате последующих гормональных эффектов. Наиболее значительно прием пищи повышает содержание в крови триглицеридов и глюкозы. Увеличивается также содержание лейкоцитов (т.н. постпрандиальный лейкоцитоз). Определение многих веществ может затрудняться мутностью, вызванной появлением в крови после приема пищи мельчайших жировых частиц (хиломикронов). Их концентрация достигает максимума через 2-2,5 часа после приема пищи, а, затем, постепенно снижается до незначительной в течение 8-10 часов. В это время целый ряд лабораторных исследований крови может быть невозможен. Голодание, тоже, может искажать результаты исследований. У здоровых людей после двух дней голодания увеличивается концентрация билирубина в крови, после еды его содержание в крови, наоборот, снижается. 3-х дневное голодание в 2-3 раза снижает концентрацию глюкозы в крови, увеличивает концентрацию триглицеридов. После 2-4-недельного голодания в крови снижается концентрация общего белка, холестерина, триглицеридов, мочевины и липопротеинов, повышается выведение почками креатинина и мочевой кислоты. На фоне длительного голодания организм переходит в режим экономии энергии, для чего снижает концентрацию в крови гормонов щитовидной железы – тироксина и трийодтиронина. Одновременно, голодание ведет к увеличению содержания в крови кортизола и дегидроэпиандростерона.
Некоторые продукты и режим питания могут влиять на результаты биохимического исследования крови и мочи. Употребление жирной пищи может повысить в крови концентрацию калия, триглицеридов и активность щелочной фосфатазы. Потребление большого количества мяса, то есть пищи с высоким содержанием белка, может увеличить концентрацию в крови мочевины, аммиака и солей кальция в моче. Пища с высоким содержанием ненасыщенных жирных кислот может вызвать снижение в крови концентрации холестерина. Бананы, ананасы, томаты, авокадо богаты серотонином. При их употреблении за 2-3 дня до исследования мочи на содержание 5-оксииндолуксусной кислоты даже у здорового человека её концентрация может стать повышенной. Диета с низким содержанием соли может приводить к повышению уровня альдостерона в 3-5 раз. Напитки, богатые кофеином, увеличивают концентрацию в крови свободных жирных кислот, стимулируют выброс надпочечниками катехоламинов и повышают активность ренина.
Прием алкоголя
Алкоголь снижает в крови концентрацию глюкозы, повышает концентрацию молочной кислоты, мочевой кислоты и триглицеридов. Прямое токсическое воздействие алкоголя на печень повышает активность в крови печеночных ферментов. Повышенное содержание в крови углевод-дефицитного трансферрина, холестерина, мочевой кислоты, активности гамма-глутамилтрансферазы (ГГТ) и увеличение среднего объема эритроцитов свидетельствует о хроническом алкоголизме.
Физическая нагрузка
Может оказывать как временное, так и продолжительное влияние. Преходящие изменения вначале проявляются снижением, а затем увеличением концентрации свободных жирных кислот в крови, двухкратным повышением концентрации аммиака и трехкратным — молочной кислоты. 1-2 часовые активные занятий в спортзале или 1-2 часовая игра в футбол приводит к временным изменениям активности креатинфосфокиназы (КФК), которые наблюдаются при обширных трансмуральных инфарктах. В меньшей степени повышается активность аспартатаминотрансферазы (АСТ) и лактатдегидрогеназы (ЛДГ). Эта ферментативная активность остается повышенной в течение суток. Физические упражнения влияют на показатели гемостаза: активируют свертывание крови и функциональную активность тромбоцитов. Длительная физическая нагрузка увеличивает концентрацию в крови половых гормонов, таких как тестостерон, андростендион и лютеинизирующий гормон (ЛГ).
При длительном постельном режиме, иммобилизации, малоподвижном образе жизни и ограничении физической активности повышается протромботический потенциал крови, возрастает риск спонтанного тромбообразования. Также, при длительной иммобилизации увеличивается выделение с мочой норадреналина, кальция, хлора, фосфатов, аммиака, в крови возрастает активность щелочной фосфатазы.
Курение
Никотин и другие содержащиеся в табачной продукции вещества (их более 2000) изменяют секрецию некоторых биологически активных веществ. Курение приводит к увеличению концентрации гемоглобина, количества и объёма эритроцитов, снижает количество лейкоцитов. У курильщиков повышается концентрация карбоксигемоглобина, катехоламинов и кортизола. Изменение концентрации этих гормонов приводит к снижению количества эозинофилов; содержание нейтрофилов, моноцитов и свободных жирных кислот увеличивается. Потребление большого количества сигарет сопровождается также повышением активности гамма-глутамилтрансферазы (ГГТ).
Эмоциональный стресс
Страх, испуг в момент взятия крови, боязнь операции, волнение перед визитом к врачу может влиять на результаты лабораторных исследований. Стрессорные воздействия сопровождаются временным лейкоцитозом; в крови снижается концентрация железа; увеличивается уровень катехоламинов, альдостерона, кортизола, инсулина, пролактина, ангиотензина, ренина, соматотропного гормона, тиреотропного гормона (ТТГ), повышается концентрация альбумина, глюкозы, холестерина, фибриногена. Сильное беспокойство, сопровождаемое глубоким и учащенным дыханием, вызывает дисбаланс кислотно-щелочного равновесия со снижением концентрации в крови молочной и жирных кислот.
Пол пациента
Практически для всех лабораторных показателей установлены достоверные половые различия. В большей степени это относится к содержанию в крови гормонов (прогестерона, эстрадиола, тестостерона, 17-ОН прогестерона, лютеинизирующего гормона, фолликулостимулирующего гормона, пролактина), транспортных белков и биологически активных соединений. В меньшей степени это относится к другим соединениям и форменным элементам крови, но и там различия могут быть существенны.
Возраст пациента
Содержание в крови большинства диагностически значимых веществ зависит от возраста и может значительно изменяться от рождения до старости. Наиболее ярко возрастные изменения проявляются в содержании гемоглобина, билирубина, активности щелочной фосфатазы, показателей липидного обмена, половых гормонов, адренокортикотропного гормона (АКТГ), альдостерона, ренина, гормон роста, паратгормона, дегидроэпиандростерона. С возрастом может меняться содержание маркеров онкологической настороженности, например простатаспецифического антигена (ПСА).
Расовая принадлежность
Для некоторых лабораторных показателей установлены различия нормальных значений между людьми отдельных рас. В сложных клинических ситуациях эти различия нужно учитывать при оценке результатов лабораторных исследований.
Индивидуальные уровни нормальных значений
Установленные нормальные (референтные) значения лабораторных показателей, дифференцированные в зависимости от пола, возраста и технологии анализа, характеризуют группу людей в целом. Однако, внутри любой возрастно-половой группы между отдельными здоровыми людьми наблюдаются также индивидуальные различия. Для некоторых лабораторных показателей эти различия между людьми одного пола и возраста могут быть многократными. С развитием лабораторных технологий, повышением точности исследований, накоплением медицинских знаний таким различиям придается все большее значение. Причина в том, что результаты исследований, присущие одному здоровому человеку, могут говорить о патологическом процессе в организме другого человека, особенно при рассмотрении их в динамике.
Беременность
Беременность является нормальным физиологическим процессом, который сопровождается перестройкой работы многих органов, значительными изменениями выработки половых и тиреоидных гормонов, транспортных белков, адренокортикотропного гормона (АКТГ), ренина, а также целого ряда биохимических и гематологических показателей. Для правильной интерпретации результатов нужно знать срок беременности, когда была взята исследуемая проба крови.
Менструальный цикл
Содержание женских половых гормонов изменяется в широком диапазоне в зависимости от фазы менструального цикла. Оценка результата таких исследований возможна только с привязкой к фазам цикла, для каждой из которых характерны свои диапазоны нормальных значений. Перед исследованием следует уточнить у врача оптимальные дни для взятия крови на анализ уровня фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ), пролактина, прогестерона, эстрадиола, 17-ОН-прогестерона, андростендиона, ингибина и антимюллерова гормона (АМГ). Изменения гормонального фона могут также отражаться на результатах биохимических и гематологических лабораторных исследований. Для правильной интерпретации результатов важно точно указать день менструального цикла, когда была взята исследуемая проба крови.
Биологические ритмы
Все процессы в организме человека подвержены циклическим ритмам, таким, как циркадные и сезонные. Их влияние отражается на результатах лабораторных исследований. Циркадные (суточные) ритмы наиболее выражены для кортизола, адренокортикотропного гормона (АКТГ), альдостерона, пролактина, ренина, тиреотропного гормона (ТТГ), паратгормона и тестостерона. Отклонения их концентрации от среднесуточных значений могут достигать 400%, что обязательно должно приниматься во внимание. Например, циркадный ритм кортизола может быть причиной недостоверных результатов теста на толерантность к глюкозе, если он проводится во второй половине дня. Определяя индивидуальный циркадный ритм секреции гормона, когда в течение суток берется несколько проб анализируемого материала, в сопроводительных документах необходимо указывать точное время взятия каждой из них.
На циркадные ритмы, общие для всех людей, могут накладываться индивидуальные ритмы сна, еды и физической активности. В некоторых случаях следует учитывать сезонные влияния. Например, содержание гормона щитовидной железы трийодтиронина летом на 20% ниже, чем зимой. Содержание тестостерона, наоборот, несколько возрастает в теплое время года.
Прием лекарственных препаратов
Влияние лекарственных препаратов на результаты лабораторных тестов может быть двояким. Нужно различать действие препаратов:
а) Прием которых ожидаемо приводит к изменению результатов лабораторных исследований и действие которых контролируется по этим результатам. При проведении такого мониторинга точное время взятия крови является очень важным параметром для правильной интерпретации результатов.
б) Лабораторный контроль за действием которых не предусмотрен, но которые способны повлиять на правильность результатов лабораторных исследований. Эти препараты и их метаболиты могут привести к получению неправильных результатов лабораторных исследований, оказывая незапланированное влияние на физиологические процессы или негативно воздействовать на технологии лабораторного анализа. Например, уровень тиреотропного гормона (ТТГ) снижается при лечении допамином, концентрация тиреоидных гормонов тироксина и трийодтиронина изменяется при введении фуросемида, даназола, амиодарона и салицилатов, а применение некоторых антиантацидных препаратов может повышать уровень пролактина у мужчин. Присутствие в биологическом материале контрацептивов, салицилатов, андрогенов может специфически (перекрестные реакции) или не специфически (интерференция) влиять на результаты лабораторных исследований при определении стероидных и тиреоидных гормонов, а также связывающих белков крови. Это лишь краткая иллюстрация множества возможных воздействий. Проведение медикаментозной терапии, могущей искажать результаты анализа, следует обязательно учитывать при назначении лабораторных исследований.
По этим причинам лекарства, мешающие лабораторному анализу, если они назначены не по жизненным показаниям; принимают после взятия биоматериала. Это относится и к любым внутривенным инфузиям. Загрязнение лабораторных проб инфузионными растворами — обычная и часто встречающаяся причина получения неправильных результатов лабораторных исследований. Для исключения этого пробы следует брать из другой руки, из вены, в которую не проводится вливание. Рекомендуется информировать лабораторию о том, когда и какое вливание было проведено пациенту и когда была взята проба крови.
Диагностические и лечебные мероприятия
На результаты лабораторных исследований могут повлиять оперативные вмешательства, эндоскопия, диализ, внутривенные инфузии, пункции, инъекции, биопсии, пальпация, общий массаж, тепловые процедуры, эргометрия, функциональные тесты, введение рентгеноконтрастных веществ, лучевая и химиотерапия. Например, уровень простатаспецифического антигена (ПСА) может быть повышен в течение нескольких дней после массажа простаты, пальцевого исследования прямой кишки или катетеризации мочевого пузыря. Любые манипуляции с молочной железой или тепловые процедуры (например, сауна) приводят к увеличению уровня пролактина. Чтобы предотвратить такое влияние, пробы необходимо забирать до выполнения диагностических процедур, способных исказить результаты теста.
Прочие факторы
Среди прочих факторов, влияющих на результаты лабораторных исследований, имеют значение географическое положение местности, высота над уровнем моря и температура окружающей среды.
Положение тела при заборе крови
Положение тела пациента также влияет на ряд показателей. Переход из положения лёжа в положение сидя или стоя приводит к гидростатическому проникновению воды и фильтрующихся веществ из внутрисосудистого пространства в межклеточное (т.н. интерстициальное), составляющее 1/6 общего объема тела. Клетки крови, вещества, имеющие большую молекулярную массу и связанные с ними не могут проникнуть в ткани и остаются в сосудистом русле. Поэтому их концентрация в крови повышается, в среднем на 5-15%. С этим связана стандартизация положения пациента при взятии крови.
Способ и место забора крови
Участок тела пациента, используемый для взятия крови и техника забора также могут оказать существенное влияние на результаты лабораторных исследований. Лучшее место для забора крови на анализы — локтевая вена. Венозная кровь — лучший материал не только для определения биохимических, гормональных, серологических, иммунологических показателей, но и для общеклинического исследования. Это обусловлено тем, что применяемые в настоящее время гематологические анализаторы, с помощью которых проводят общеклинические исследования, предназначены для работы с венозной кровью. В странах, где их производят, они сертифицированы и стандартизированы для работы только с венозной кровью. Выпускаемые калибровочные и контрольные материалы также предназначены для работы гематологических анализаторов именно с венозной кровью. Помимо этого, при заборе крови из пальца есть методические особенности, которые стандартизировать очень трудно: попадание в образец значительных количеств тканевой (межклеточной) жидкости, нарушение периферического кровотока, необходимость в разведении образца и др., что приводит к ошибкам, низкой точности и воспроизводимости результатов.
Использование капиллярной крови для исследований свертывающей системы (системы гемостаза) не приемлемо в принципе. Это связано с неизбежным попаданием в образец значительных количеств тканевой (межклеточной) жидкости. Тканевая жидкость содержит тканевый тромбопластин, активирующий свертывающую систему, что приведет к получению совершенно неправильных результатов.
Важны также способ и продолжительность наложения жгута на руку при заборе крови. Наложение жгута на период более 2 мин при заборе крови из вены может привести к увеличению концентрации в пробе белков, факторов коагуляции и клеточных элементов.
Капиллярную кровь из пальца для лабораторных исследований допустимо использовать лишь в следующих случаях:
-
При ожогах, занимающих большую площадь поверхности тела пациента.
-
При наличии у пациента очень мелких вен или их плохой доступности.
-
При выраженном ожирении пациента с затрудненным доступом к венам.
-
При установленной склонности к венозному тромбозу.
-
У новорождённых.
Пункцию артерий для забора крови используют редко (преимущественно для исследования газового состава артериальной крови).
Хранение и транспортировка биологических материалов
Чувствительность компонентов биологических материалов, имеющих диагностическое значение и изучаемых в лабораториях, очень различна. Некоторые из этих компонентов способны выдерживать хранение и транспортировку при соблюдении определенных условий, другие – нет. По экономическим соображениям принято считать, что с использованием современных систем забора, методов консервации, соблюдении температурных режимов, хранение и транспортировка биологических материалов в течение ограниченного времени допустимы.
В ряде случаев это так. Тем не менее, известно, что многие важнейшие лабораторные показатели допускают очень ограниченную задержку между забором биологического материала и началом исследования. Ситуация еще больше осложняется тем, что одни компоненты лучше сохраняются при охлаждении, тогда как другие, наоборот, в таких условиях претерпевают ускоренную деградацию. Как очевидно, это значительно затрудняет хранение и транспортировку биологических материалов, учитывая, что компоненты с такими разными свойствами зачастую содержатся в одной пробирке. Нужно также учитывать различие между декларируемыми и реальными условиями сбора, хранения и доставки биологических материалов. При этом, стабильность многих компонентов крови и мочи в условиях лабораторной практики остается неизвестной.
Согласно ГОСТ Р 53079.4-2008 «Обеспечение качества клинических лабораторных исследований. Часть 4. Правила ведения преаналитического этапа», время доставки образцов в лабораторию не должно превышать 30-60 минут (для мочи – 90 минут), время от забора крови до ее центрифугирования (обязательный этап биохимических и коагулологических исследований) не должно превышать 1 часа. Также, согласно этому документу и другим авторитетным рекомендациям:
-
Не рекомендуется транспортировка образцов цельной крови, используемой, в частности, для проведения ее клинического анализа.
-
Определение скорости оседания эритроцитов (СОЭ) требует начала исследования не позднее 2-х часов с момента забора крови.
-
Моча, собранная для общего анализа крови, может храниться не более 2-х часов, причем применение консервантов нежелательно.
-
Для достоверного дифференциального подсчета лейкоцитарной формулы мазок крови должен быть приготовлен не позднее 3-х часов после ее забора.
Установлено, что в пробах крови, полученных от пациентов с выявленной патологией, могут усиливаться изменения, обычно наблюдаемые под влиянием времени и температуры. Это еще больше сокращает время допустимого хранения и транспортировки биологических материалов, поскольку стабильность компонентов может отличаться у разных пациентов.
Известно, что наименьшей стабильностью обладают показатели, характеризующие состояние свертывающей системы крови. Стандартным условием является проведение общих скрининговых исследований свертывающей системы в течение максимум 4-х часов с момента забора крови. Для т.н. интегральных исследований свертывающей системы крови (исследование тромбодинамики, тромбоэластография) временная задержка, связанная с транспортировкой образцов, недопустима в принципе – получение неправильных, дезориентирующих врача результатов происходит уже после 30-45-минутного промедления. Исследование тромбоцитарного звена свертывающей системы крови еще более уникально – это единственное из более чем 2500 лабораторных исследований, ведущееся на живых клетках. Последнее абсолютно исключает как транспортировку, так и любую задержку начала работы. Все сказанное тем более важно, что судить о состоянии свертывающей системы крови по концентрации или активности отдельных ее компонентов нельзя – значение имеет работа всей системы в целом.
Периодичность лабораторных исследований
Повторные исследования широко используются для оценки эффективности проводимого лечения и прогнозировании исхода заболевания, лекарственном мониторинге, постановке симуляционных тестов. Чтобы избежать получения ошибочных результатов, интервалы между исследованиями должны выбираться с учетом продолжительности «жизни» определяемого вещества в организме, динамики его накопления и выведения при нормальных и патологических процессах, фармакокинетических свойств лекарственных препаратов.
ЮНИТЕКА:
Системы взятия крови:
06.04.2022
Особенности преаналитического этапа при коагулологических исследованиях
Вакуумные пробирки с цитратом натрия используются для исследования плазменного и тромбоцитарного звена системы гемостаза. Цитрат натрия – единственный антикоагулянт, который удовлетворяет всем требованиям к стабилизации пробы для выполнения этого вида исследований. Цитрат натрия останавливает реакции свертывания крови, связывая ионы кальция, при этом, в отличие от других антикоагулянтов, в частности, ЭДТА и гепарина, не вызывает изменений в иных звеньях системы гемостаза.
Концентрация цитрата натрия
ВАЖНО! В вакуумных системах для взятия крови применяют раствор цитрата натрия в концентрации 109 ммоль/л (0,109 М) или 129 ммоль/л (0,129 М), что соответствует 3,2% и 3,8% 2-водного трехзамещенного цитрата натрия. При выборе пробирок с цитратом натрия следует обращать внимание не на процентную концентрацию цитрата, а на его молярную концентрацию!
В настоящее время, в соответствии с рекомендациями Института Клинических Лабораторных Стандартов (CLSI), предпочтительным является применение пробирок с концентрацией цитрата натрия 3,2% (109 ммоль/л)!
«Правильная» молярность цитрата натрия принципиально важна в Ca-зависимых тестах! Это наиболее часто выполняемые тесты для диагностики плазменного звена системы гемостаза, в частности ПВ и АЧТВ. Все контрольные материалы и калибраторы, которые предназначены для работы с Ca — зависимыми тестами, произведены на основе концентрации цитрата 109 ммоль/л. И если кровь пациента берется в пробирку с концентрацией цитрата 3,8% (129 ммоль/л), то такой образец содержит больше цитрата, чем контрольный материал, с которым его будут сравнивать. Соответственно, количество Ca2+, который будет нейтрализовываться цитратом, прежде чем вступить в реакцию и запустить свертывание, будет больше. А, поскольку кальция в тесте (плазме пациента) и контрольной плазме добавляется одно и то же количество, соответственно, на тест его останется меньше, и это приведет к удлинению ПВ и АЧТВ.
Согласно требованиям ВОЗ, во избежание существенных диагностических ошибок при определении Международного Нормализованного Отношения (МНО), для теста протромбинового времени следует использовать 0,109 М (109 ммоль/л) раствор трехзамещенного цитрата натрия в соотношении кровь: антикоагулянт = 9:1. Другие международные источники также рекомендуют использовать в тесте ПВ раствор трехзамещенного цитрата натрия в концентрации (109 ммоль/л). Раствор цитрата натрия с концентрацией 129 ммоль/л (3,8%) не должен быть использован в данном тесте*.
Пробирки с цитратом натрия в концентрации 3,8% (129 ммоль/л) используются для исследования тромбоцитарного звена системы гемостаза.
*Информация получена с сайта компании НПО Ренам – крупнейшего российского производителя наборов реагентов для оценки системы гемостаза: http://www.renam.ru/citrat-natriya-vybor-koncentracii-3-2-ili-3-8
Соотношение кровь:антикоагулянт
Важным моментом на преаналитическом этапе коагулологических исследований является четкое соблюдение соотношения кровь:антикоагулянт 9:1. Взятие меньшего количества крови, чем определено ее номинальным объемом, (т. е., недостаточное заполнение пробирки), изменяет соотношение плазмы к антикоагулянту, что, в свою очередь, изменяет коэффициент разведения белков плазмы, а относительный избыток цитрата может нарушить процессы рекальцификации и активации свертывания крови. Если пробирка для взятия крови содержит от 80% до 90% целевого объема заполнения, возможно незначительное артефактное удлинение ПВ и АЧТВ. Однако, если пробирки заполнена кровью менее чем на 80% от ее номинального объема заполнения, ПВ и АЧТВ будут ложно завышены даже у здоровых пациентов, а влияние на другие тесты коагуляции может быть смещенным непредсказуемо. Ложное завышение ПВ и АЧТВ в недостаточно заполненных пробирках более выражено при концентрации цитрата 3,8% в сравнении с 3,2%. Поэтому Международный совет по стандартизации в гематологии (ICSH) категорически не рекомендует анализировать образцы крови пациента из пробирок, заполненных менее, чем на 80% от номинального объема.
Вероятность того, что объем крови может быть больше номинального менее вероятна, поскольку объем вакуума в пробирках четко дозирован и сила аспирации не позволяет избытку крови попасть в пробирку.
Влияние гематокрита
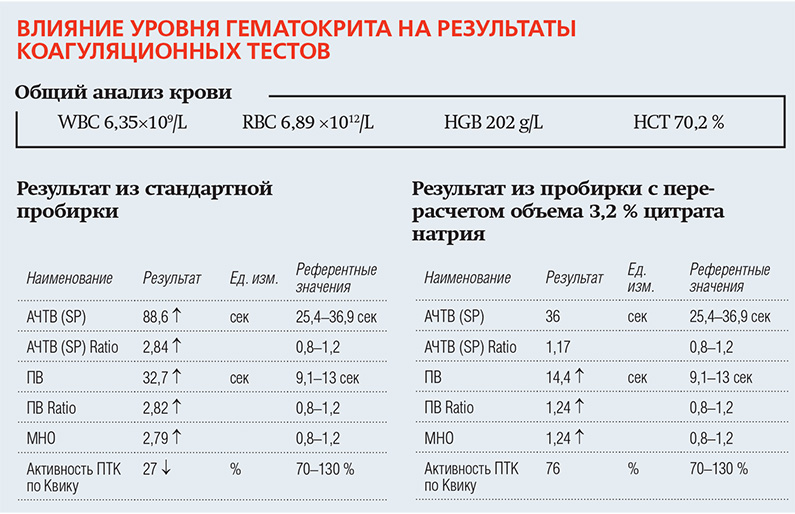
Так как весь связываемый цитратом кальций находится в плазме, то весьма важным при фиксированном соотношении объемов цельная кровь/антикоагулянт 9:1 является учет величины гематокрита в полученном образце крови. При высоком гематокрите (более 55%) возможна «передозировка» пробы раствором цитрата натрия (особенно 3,8% цитратом), что при ее дальнейшем анализе вызовет ложное удлинение значений протромбинового времени и АЧТВ. По сути, в таких образцах соотношение антикоагулянта к плазме изменено так же, как и в недостаточно заполненных образцах.
Институт клинических и лабораторных стандартов (CLSI) Всемирная федерация гемофилии акцентируют внимание на необходимости корректировки соотношения цитрат / кровь при гематокрите> 55%. Для этого рекомендовано использовать формулу:

где C — объем цитрата в миллилитрах (мл), который следует добавить к объему крови (V) в мл для образования образца крови с антикоагулянтом.
Пример: Для Hct 70% при объеме взятия крови 4,5 мл перед добавлением антикоагулянта, получается следующий результат:
то есть, 0,25 мл цитрата необходимо смешивают с 4,5 мл крови.
Если у пациента тяжелая анемия, объем плазмы увеличивается, так что после смешивания с тринатрий цитратом в пробирке может быть достаточно остаточного кальция для продолжения коагуляции в образце, что приводит к активации и возможному сокращению АЧТВ наряду с потреблением факторов свертывания крови, в том числе фибриногена. Однако низкий гематокрит в меньшей степени влияет на результаты, поэтому обычно нет необходимости корректировать соотношение цитрата к крови для образцов, взятых у пациентов с анемией.
Последовательность взятия образцов крови
При взятии крови для выполнения гемостазиологических тестов очень важно во время венепункции не допустить попадания в пробирку с цитратом частичек поврежденных тканей, а также других антикоагулянтов. Это важно, поскольку даже минимальное количество тромбина, который образуется при активации свертывания, резко ускоряет ферментные реакции гемостаза, что ведет к ложному укорочению времени основных скрининговых тестов – АЧТВ и ПВ и искажению других параметров. А попадание в пробу крови других антикоагулянтов может частично заблокировать определенные звенья системы гемостаза и тоже оказать значительное влияние на результаты анализа. В связи с этим, Международный совет по стандартизации в гематологии (ICSH) рекомендует использовать следующую последовательность взятия образцов крови:
1. Пробирка без наполнителя
2. Пробирка с цитратом натрия
3. Пробирка для сыворотки с активаторами свертывания или без них, с гелем или без него
4. Пробирки с гепарином с гелем или без него
5. Пробирки с ЭДТА
6. Пробирки с ингибитором глюкозы
7. Другие пробирки
Если кровь берется только на гемостаз, сначала необходимо взять кровь в пустую пробирку, затем в пробирку с цитратом.
В соответствии с рекомендациями Института Клинических Лабораторных Стандартов (CLSI) после взятия крови в пробирку с цитратом, необходимо, осторожно переворачивая пробирку, проверить полученный образец на предмет образования сгустков. При выявлении сгустков, образец, естественно, отбраковывается.
Сразу после взятия крови в пробирку с раствором цитрата необходимо осторожно перемешать содержимое, переворачивая пробирку 3–4 раза.
Условия центрифугирования
- Плазма, обогащенная тромбоцитами – 5 — 7 мин. при 150 — 200 g. Эта плазма используется только для выполнения функциональных тестов тромбоцитов (агрегации, адгезии, трансформации). Оптимальным вариантом является отдельная пробирка с цитратом для этих исследований. Одна часть обогащенной плазмы отбирается для выполнения тестов, а вторая повторно центрифугируется для получения бедной тромбоцитами плазмы, которая является контролем для данных тестов.
- Плазма, бедная тромбоцитами (концентрация тромбоцитов < 10 000 /мкл) — 10 — 15 мин. при 1 500 — 2 000 g. Эта плазма является основным материалом для выполнения большинства гемостазиологических исследований: скрининговых тестов коагуляции и фибринолиза, а также для определения факторов, маркеров и ингибиторов различных звеньев свертывающей системы.
- Плазма, свободная от тромбоцитов (концентрация тромбоцитов < 1 000 /мкл) – 20 — 30 мин. при 2 000 — 3 000 g. Этот вид материала оптимален для выполнения тестов, на результаты которых могут повлиять как сами тромбоциты, так и секретируемые ими биологически активные вещества, например, тромбоцитарные факторы 3 и 4, протеин S. К таким тестам, в частности, относятся тесты на антифосфолипидные антитела, включая волчаночный антикоагулянт. Плазма, свободная от тромбоцитов также используется для случаев, когда материал требуется заморозить из-за невозможности его быстрого исследования, так как замораживание вызывает повреждение тромбоцитов и выброс их факторов в пробу с соответствующим изменением результатов тестов.
Надежность процедуры центрифугирования следует проверять каждые шесть месяцев или после ремонта центрифуги, чтобы убедиться в том, что количество тромбоцитов в плазме находится в допустимых пределах.
Транспортировка и хранение проб
Допустимый интервал времени между взятием образца и его исследованием зависит от температуры, при которой образец транспортируется и хранится.
В соответствии с рекомендациями Института Клинических Лабораторных Стандартов (CLSI) образцы, предназначенные для исследования показателей гемостаза следует обрабатывать и хранить следующим образом:
- Образцы для определения ПВ, не центрифугированные или центрифугированные с плазмой, оставшейся поверх клеток, в закрытой пробирке необходимо хранить при температуре от +18 до +24°C. Они должны быть протестированы в течение 24 часов с момента сбора образца. Хранение при температуре от +2 до +4 °C может привести к холодовой активации фактора VII и, следовательно, повлиять на результаты ПВ. Если пациент находится на терапии гепарином или на пероральной антикоагулянтной терапии препаратами на основе кумарина, ПВ может изменяться в зависимости от времени хранения образца, если только в состав используемого набора реагентов не входит нейтрализатор гепарина.
- Образцы для рутинных анализов АЧТВ у пациентов (которые не находятся на терапии гепарином), не центрифугированные или центрифугированные с плазмой, оставшейся поверх клеток в закрытой пробирке, необходимо хранить при температуре от +2 до +4°C или от +18 до +24°C. Они должны быть протестированы в течение четырех часов с момента сбора образца.
- Образцы для анализа АЧТВ, предположительно содержащие нефракционированный гепарин, хранят при температуре от +2 до +4°C или от +18 до +24°C. Их следует центрифугировать в течение одного часа после взятия, а плазму протестировать в течение четырех часов с момента сбора образца. Если планируется транспортировка пробы для исследования, например, в централизованную лабораторию, то во избежание перемешивания отцентрифугированного образа, необходимо после центрифугирования плазму удалить и провести исследование в течение четырех часов.
- Образцы для других анализов (например, тромбиновое время, протеин С, фактор V и фактор VIII) необходимо хранить при температуре от +2 до +4°C или от +18 до +24°C. Они должны быть отцентрифугированы и протестированы в течение четырех часов с момента взятия образца.
- Если невозможно провести определение ПВ в течение 24 часов и АЧТВ и других показателей плазменного звена системы гемостаза в течение 4 часов, плазму следует заморозить. Она может храниться при температуре — 20°C до двух недель или при -70°C — до шести месяцев. Замороженные образцы плазмы следует быстро размораживать при температуре 37°C при осторожном перемешивании. После размораживания их следует анализировать немедленно, или, если это невозможно, допустимо проведение исследования в течение двух часов, но при этом образец до проведения исследования должен храниться при температуре +4°C. Следует учитывать, что замораживание плазмы может повлиять на результат определения АЧТВ.
Список литературы:
1. Kitchen S, Adcock DM, Dauer R, et al. International Council for Standardisation in Haematology (ICSH) recommendations for collection of blood samples for coagulation testing. Int J Lab Hematol. 2021;43:571–580.
2. NCCLS. Collection, Transport, and Processing of Blood Specimens for Testing Plasma-Based Coagulation Assays; Approved Guideline—Fourth Edition. NCCLS document H21-A4 (ISBN 1-56238-521-6). NCCLS, 940 West Valley Road, Suite 1400, Wayne, Pennsylvania 19087-1898 USA, 2003.
3. Вавилова Т.В., Гильманов А.Ж., Мамаев А.Н. Коагулологические исследования. — Клиническая лабораторная диагностика. Национальное Руководство: в 2 т. -Том 1 / под ред. В.В.Долгова, В.В.Меньшикова. –М., ГЭОТАР-Медиа, 2012. –С.749-815.
4. Влияние концентрации цитрата натрия на результаты коагулологических исследований. http://www.renam.ru/citrat-natriya-vybor-koncentracii-3-2-ili-3-8
5. Крюкова В. А. Современные представления о преаналитике коагулологических исследований. Тромбоз, гемостаз и реология, №3 (27), октябрь 2006 г.
6. Преаналитический этап в гемостазиологии / А.А.Козлов, А.Л.Берковский, Е.В.Сергеева, А.В.Суворов – М.: Принт. 2013. – 48 с.
Ошибки гематологических исследований
Часть 2
Попова Анна Борисовна,
Постникова Ольга Ивановна,
Жулина Анастасия Анатольевна
ГБПОУ НО «НМК»
1.2.1 Возможные ошибки лабораторных исследований крови
Лабораторный этап обработки проб крови вносит свой вклад в погрешность результатов, которые можно разделить на три вида: случайные, систематические и грубые.
Случайными называются неопределенные по величине и знаку ошибки, в появлении которых не наблюдается закономерности. Случайные ошибки сопутствуют любому измерению, как бы тщательно оно не проводилось, и проявляются в некотором различии результатов измерения одного и того же элемента, выполненного данным методом. Эти развития обусловлены колебаниями:) свойств пробы — негомогенность, неравномерность перемешивания;) точности измерительного инструмента — пипеток, мерной посуды, термо- и фотометрических приборов, счетных камер;) точности работы персонала лаборатории — неточное пипетирование или считывание результатов, ошибка утомления, неверный подбор класса точности инструментов, психологическая ошибка, например, оказание предпочтения каким-либо цифрам и т.д.Величина случайной ошибки характеризует воспроизводимость результатов исследований.
К систематическим ошибкам относятся погрешности, происходящие от определенных причин. Одинаковые по знаку, они либо увеличивают, либо уменьшают истинные результаты. После выяснения причины, вызывающей систематическую ошибку, ее можно устранить или ввести поправочный коэффициент.Причиной систематических ошибок являются:методические ошибки, обусловленные возможностью метода анализа; наиболее серьезная, и трудно устранимая причина искажений результатов;ошибки, зависящие от применяемых приборов и реактивов, определяются точностью приборов, загрязнением реактивов продуктами разрушения тары, взаимодействием с воздушной средой и испарениями других реактивов и др.;ошибки оперативные, происходящие от неправильного или неточного выполнения операции, например, изменение времени окрашивания, неправильное выливание растворов из пипеток;ошибки индивидуальные, зависящие от личных способностей оператора, его органов чувств, привычек.Величина систематической ошибки влияет на всю серию определений и характеризует правильность результатов анализа.
Грубыми ошибками называют полученные одиночные значения анализируемого параметра, выходящие за пределы допустимой величины погрешностей. Причиной грубых ошибок может стать неправильная доза препарата, ошибки в расчетах, небрежность или недостаточная тщательность в работе. Необходимо отличать грубые ошибки от показателей, характеризующих резкие изменения исследуемых параметров; последние проверяются повторными или параллельными анализами.
Среди способов выявления случайных ошибок в лабораторной практике применяют анализ двух (или нескольких) параллельных проб а также последовательное проведение анализов повторно у одного и того же животного. Расхождение результатов свидетельствует об ошибке.Если все или большинство результатов, полученных в течение дня, отличается от обычных значений возможно присутствие систематической ошибки. В поисках ее причин полезным подспорьем являются записи в лабораторном журнале, анализ которых позволяет выявить значение новой партии реактива, составление нового калибровочного графика или реактива, отключение для профилактики холодильника или термостата, замена ламп в фотометре и т.д. Использование автоматических устройств для анализа ведет к сокращению числа случайных ошибок, но увеличивает необходимость контроля за систематическими погрешностями.Таким образом, высокая точность измерений, отражающая близость их результатов к истинному значению измеряемой величины, соответствует малым значениям ошибок всех видов и обеспечивается наряду с контролем всех элементов клинико-диагностических исследований унификацией и стандартизацией методов анализа
Основными источниками ошибок при подсчете эритроцитов являются:
-
Неточное взятие крови в пипетку.Образование сгустка, поглощающего часть клеток и занижающего результатисследования.
-
Недостаточное перемешивание содержимого пробирки перед заполнением камеры.
-
Неправильная подготовка камеры: недостаточное притирание покровных стекол;неравномерное заполнение камеры, образование пузырьков воздуха.
-
Подсчет эритроцитов сразу после заполнения камеры, не выжидая 1 минуту.
-
Подсчет меньшего, чем требуется по методике, количества квадратов.
-
Плохо вымытые камера, пробирки, пипетка, капилляр для взятия крови;недостаточно просушенные пробирки и пипетки.
-
Использование недоброкачественного разводящего раствора.
Основные источники ошибок при подсчете лейкоцитов в камере:
-
Неправильное соотношение объемов крови и уксусной кислоты, взятые в пробирку.
-
Неправильно подготовленный раствор уксусной кислоты (при концентрации большей, чем 5%, часть лейкоцитов может лизироваться, что приведет к занижению результата).
-
Длительное нахождение пробы при температуре выше 28°С, что может ускорить лизис лейкоцитов в образце и привести к занижению результата.
-
Неправильное заполнение камеры Горяева. Как и при подсчете эритроцитов, камеру необходимо оставлять на 1 минуту для оседания клеток.
-
Недостаточно хорошо отмытая после предыдущего определения камера Горяева.Оставшиеся в камере лейкоциты могут завышать результаты анализа.
1.3 Организация и обеспечение качества на постаналитическом этапе
Как и преаналитический этап, этот этап можно разделить на внутрилабораторную и внелабораторную части.
Основной элемент внутрилабораторной части постаналитического этапа проверка квалифицированным лабораторным специалистом результата анализа на предмет его аналитической достоверности, биологической вероятности или правдоподобия, а также сопоставления каждого результата с референсными интервалами. На этапе проверки результатов исследований важно учитывать факторы, препятствующие определению аналита (такие как гемолиз, липемия, избыточная желтушность, парапротеинемия и др) и являющиеся критериями отказа. Степень влияния этих факторов часто зависит от метода измерения аналита, поэтому на преаналитической стадии сомнительная проба может быть принята на исследование. Форматированию бланков отчёта уделяют особое внимание: используется группировка результатов по патофизиологическому принципу с указанием референсных значений, что значительно упрощает трактовку результатов. Эта часть этапа заканчивается подписью (авторизацией) бланка отчёта, т. е. формированием конечного продукта лабораторного процесса и передачей его клиницисту.
Внелабораторная часть — это, прежде всего, оценка лечащим врачом клинической значимости информации о состоянии пациента, полученной в результате лабораторного исследования. Авторизованный отчёт с результатами лабораторных исследований поступает клиницисту, который интерпретирует полученную лабораторную информацию, сопоставляет её с данными собственного наблюдения за пациентом и результатами других видов исследований и использует её для оказания пациенту медицинской помощи.Как и для преаналитического этапа, основная форма контроля качества проведения постаналитического этапа — это периодические внешние и внутренние проверки (аудит).
2. Автоматические методы анализа клеток крови
Гемограммой называют профиль исследований, состоящий из определения количества лейкоцитов, эритроцитов, гематокритной величины и концентрации гемоглобина. Автоматизация в гематологии предлагает новый подход к дифференцированию лейкоцитов. В большинстве случаев отклонения лейкоцитарной формулы от нормального распределения требуют дополнительного исследования мазка крови под микроскопом. На основе анализа тысяч клеток гематологические анализаторы способны представлять данные в виде гистограмм — распределений клеток по размерам. Большинство анализаторов представляет в виде гистограмм распределение по размерам тромбоцитов, лейкоцитов и эритроцитов.Все многообразие гематологических приборов можно разделить на 3 класса с учетом их технической характеристики.класс — полуавтоматические счетчики клеток крови определяющие обычно от 4 до 10 параметров (лейкоциты, эритроциты, гемоглобин, гематокрит, средний объем эритроцита, среднее содержание гемоглобина в эритроците, средняя концентрация гемоглобина в эритроцитарной массе, тромбоциты, средний объем тромбоцита).
Данные приборы в большинстве своем используют в работе предварительно разведенную кровь, поэтому комплектуются дилютерами. В основе подсчета и анализа клеток в счетчиках лежит кондуктометрический метод.класс — автоматические анализаторы, проводящие анализ цельной крови и определяющие до 20 параметров, включая расчетные показатели красной крови и тромбоцитов по объему, а так же проводящие частичную дифференцировку лейкоцитов по 3 параметрам (гранулоциты, лимфоциты и «средние клетки», состоящие преимущественно из эозинофилов и базофилов).
В основе подсчета и дифференцировки клеток в анализаторах данного класса лежит кондуктометрический метод, который дополняется системами внутреннего контроля качества, волюметрического контроля и т.д.класс — высокотехнологические гематологические анализаторы, позволяющие проводить развернутый анализ крови, включая полную дифференцировку лейкоцитов по 5 параметрам (нейтрофилы, эозинофилы, базофилы, моноциты и лимфоциты), гистограммы распределения лейкоцитов, эритроцитов и тромбоцитов по объему, скетограммы. В основе работы приборов этого класса лежит комбинация кондуктометрического метода с другими методами (рассеяние лазерного луча, радиочастотный, цитохимический, использование различный дифференцирующих лизатов и т.д.).
Работа с гематологическими анализаторами требует предельной аккуратности и точности, строгого соблюдения требований соответствующих инструкций к прибору. Большинство ошибок и неточностей при работе с гематологическим анализаторами связано с техническими погрешностями: низкое качество разводящих жидкостей, погрешности при заборе крови, грязная посуда, удлинение интервала времени между забором крови или приготовлением разведений и подсчетом клеток и т.п. Однако существует категория ошибок, связанных с особенностью патологических образцов крови.
Концентрация гемоглобина (HGB).В большинстве гематологических анализаторов для определения концентрации гемоглобина используется цианметгемоглобиновый колориметрический или спектрофотометрический метод.
Причины возможных ошибок при определении концентрации гемоглобина:
-
Технические ошибки: нарушение правил забора крови, нарушение инструкции к анализатору, попадание в пробу моющих средств, остатков спирта с пальца пациента, низкое качество реактивов и т.д.
-
Связанные с особенностями исследуемой крови припатологи (завышение результатов анализа): высокий лейкоцитоз (>30·109/л), парапротеинемия (преципитация патологических иммуноглобулинов), агглютинация эритроцитов при парапротеинемиях, аутоиммцнных процессах, уремия (при гиперосмолярности плазмы нарушается лизис эритроцитов), гиперлипопроитеинемия, гипербилирубинемия, внутрисосудистый гемолиз.
Количество эритроцитов в единице объема крови (RBC).
Количество гематологическими анализаторами определяется кондуктометрическим методом.Причины ошибок при подсчете эритроцитов следующие:
-
Технические (см. HGB)
-
Связанные с особенностями исследуемой крови (внутрисосудистый гемолиз эритроцитов, агглютинация эритроцитов, наличие большого числа микро- и шизоцитов (эти элементы паодсчитываютсяангализатором как тромбоциты)
-
Высокий лимфоцитоз (>50·109/л) с преобладанием малых лимфоцитов.
Количество лейкоцитов (WBC).
Увеличение или снижение количества лейкоцитов интерпретируется соответственно клиническому случаю (лейкоцитозы, лейкопении, лейкемоидные реакции и др.) параллельно с анализом изменений в лейкоцитарной формуле.
Причины ошибок при подсчете лейкоцитов:
-
Технические (см. HGB)
-
Связанные с особенностями исследуемой крови
-
Наличие аутоантител к лейкоцитам, формирование агглютинатов лейкоцитов, которые прибор считает как одну клетку
-
Наличия хрупких, легко разрушающихся клеток при лейкозах, тяжелых интоксикациях
В большинстве гематологических анализаторов используется кондуктометрический метод, позволяющий дифференцировать лейкоциты в зависимости от их объема. Результаты исследования отражены в лейкоцитарных гистограммах и цифровом выражении относительного и абсолютного количества различных форм лейкоцитов. В зависимости от категории прибора подсчитывается количество одного, двух, трех и более видов лейкоцитов.Точная дифференцировка лейкоцитов на отдельные популяции, выявление тонких морфологических изменений в клетках возможны только с помощью микроскопического исследования окрашенного мазка крови. Дифференцированный подсчет лейкоцитов гематологическим анализатором — это скрининг, при котором все патологические результаты подлежат последующему микроскопическому исследованию.
Количество тромбоцитов (PLT).
Число тромбоцитов в автоматических счетчиках определяется прямым кондуктометрическим методом. Подсчитываются частицы объемом 2-30 фл.
Ошибки при определении количества тромбоцитов:
-
Технические: неправильное взятие крови (трудности в нахождении вены, венозный застой, повреждение эндотелия и др.) способствуют агрегации тромбоцитов, образованию микросгустков.
-
Ошибки, связанные с особенностями исследуемой крови (наличие антител к тромбоцитам, в результате чего наступает агрегация тромбоцитов, прилипание тромбоцитов к лейкоцитам (сателлитизм) при больших лейкоцитозах).
-
Завышение количества тромбоцитов отмечается при большом количестве микроцитов и шизоцитов.
3. Особенности влияния различных факторов на результаты исследования крови
Изменения клеточного состава периферической крови наблюдается как при патологии, так и в различных физиологических состояниях организма.
На показатели крови могут оказывать влияние физическая и эмоциональная нагрузка, сезонные, климатические, метеорологические условия, время суток, прием пищи, курение и т. д. Так при интерпретации результатов необходимо учитывать такие данные, как возраст, пол, активность пациента и положение его тела в момент взятие крови.С точки зрения физиологии, «нормальными» величинами лабораторных показателей считают значения, определенные у тщательно обследованных групп пациентов среднего возраста без объективных признаков патологии. Показатели, нормальные для группы одного возраста, пола, условий обитания, режима использования и т.д. отражают влияние межиндивидуальных колебаний исследуемых величин и определяют нормативы.
Клеточные и химический состав крови не является постоянным, поскольку отражает количественные и качественный изменения, происходящие при непрерывной смене физиологических процессов в организме: смена физической активности и покоя, приема пищи. Смена сна и бодрствования, влияние биологических ритмов. Эти факторы влияют на индивидуальные колебания показателей крови и соответствуют форме и степени реактивности организма каждого пациента.
Регулярные изменения состава крови наблюдаются в течение суток — суточные ритмы. Хорошо изучены суточные колебания содержания электролитов, стероидов, фосфатов, липидов, сахара, холестерина, кортизола и некоторых других показателей. Для ограничения влияния суточных вариаций на результаты анализа необходимо всегда брать пробы в одно и тоже время дня.Чрезмерное возбуждение пациента во время фиксации и взятии крови может приводить к изменению показателей кислотно-щелочного равновесия, сахара, многих гормонов, количества эозинофилов и лимфоцитов.
Значительные сдвиги активности ферментов связаны с физической нагрузкой. В зависимости от положения тела в пространстве варьируют показатели белка, кальция, калия, альбумина, аспартатаминотрансферазы, кислой и щелочной фосфатаз, фосфора и холестерина.
Еще более возрастает роль лечебных мероприятий, располагающих арсеналом средств интенсивного воздействия физических (тепловые процедуры, разряды тока, ультрафиолетовое облучение, воздействие УВЧ), химических (лекарственные препараты), или биологических (сыворотки, вакцины, аутогематерапия) факторов.
Особым фактором воздействия является оперативное вмешательство, которое, как и любая травма приводит к закономерным неспецифическим изменениям метаболизма, носящим циклический характер.
Большинство современных лечебных средств влияет на результаты лабораторных исследований за счет либо фармакологической (в организме), либо технологической (при анализе пробы) интерференции. К механизмам фармакологической интерференции, или, говоря иначе, наложению изменений за счет лекарственных веществ на показатели данного состояния организма можно отнести:а) изменение интенсивности патологического процесса;б) побочное действие на деятельность различных органов и систем;в) общий токсический эффект при передозировке или кумуляция;Технологическая интерференция лекарства или его метаболитов проявляется во время лабораторного исследования, т.е. ее можно воспроизвести, добавляя определенное вещество к пробе сыворотки крови. Влияние технологической интерференции может носить физический, химический или биологический характер, когда, например, она оказывает воздействие на клеточный состав крови.
4. Информативность и достоверность гематологических тестов
С диагностической точки зрения предметом исследования крови для получения информации о состоянии организма служат:а) структурные характеристики — форма и строение клеток, наличие химических соединений определенной структуры;б) количественные характеристики — размеры и соотношения структурных компонентов клеток, число определенных клеточных элементов, их соотношение, концентрация химических соединений;в) функциональные характеристики — осуществления цикла развития и созревания клеток, кругооборота и превращения химических веществ.
Для определения достоверности полученных результатов лабораторных исследований они должны быть выражены в цифровой форме, по меньшей мере в двоичной системе ответов -да, нет-, используемой в качественной оценке проб. Однако в гематологии все еще значительное распространение имеют словесные формы описания формы, цвета, плотности и гомогенности окраски клеток и их компонентов, соотношения их размеров. С развитием и совершенствованием методов исследования, использования цитометрических и цитофотометрических устройств объективность подученных результатов возрастает.Использование лабораторных показателей для выявления патологии состоит в обнаружении отличия между показателями крови исследуемого и их значениями в норме. При этом необходимо учитывать величину изменчивости биологических систем и колеблемость их параметров в границах гомеостаза в ответ на внешние и внутренние факторы воздействия.
Данные лабораторного исследования являются случайной величиной, так как подвержены влиянию следующих факторов:) биологических, определяющих биологическую вариацию результатов лабораторных исследований в пределах нормальных величин;) диагностических и лечебных мероприятий, проводимых обследуемому, включая реакцию животного на фиксацию, манипуляции иди присутствие исследователя;) условия взятия, хранения и транспортировки биологической пробы, влияние консервантов и антикоагулянтов — доаналитическая вариация;) условия лабораторного анализа: ошибки метода, реактивов, приборов, лаборантов — аналитическая вариация;) патологических, определяющих отклонения результатов гематологических исследований за пределы нормальных величин — патологическая вариация.
Как случайные величины результаты лабораторных исследований крови образуют вариационный ряд с характерным для него расположением большинства величин вблизи его центральной части и рассеиванием к краям ряда, создавая определенное распределение, В связи с тем, что очень многие эмпирические распределения биологических признаков, характеризующихся непрерывной вариацией, приближаются к нормальному распределению, этот вид распределения занимает важнейшее место в биологической статистике.При многократном повторном исследовании, когда имеют место в основном аналитические факторы вариации (см. условие 4.), результаты анализов обычно подчиняются закону нормального распределения.
Биологические данные, то есть признаки в популяции здоровых и больных, испытывающие влияние биологических факторов вариации, могут не подчиняться закону нормального распределения. В таком случае для статической обработки результатов может быть уместным их преобразование в логарифмы и получении логарифмического нормального распределения.