Фотобанк StylishBag
МЕНЮ
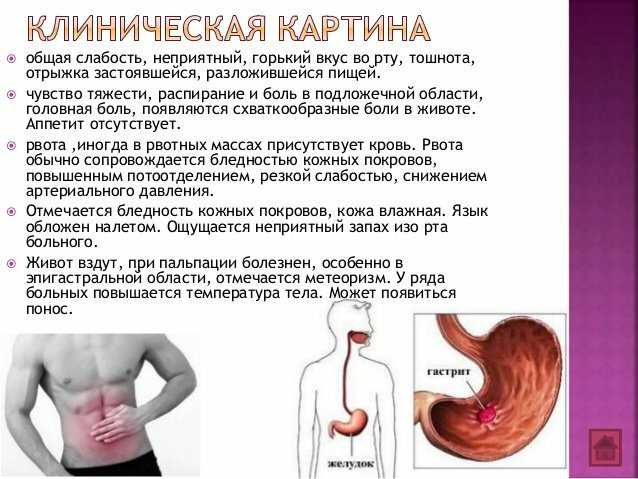
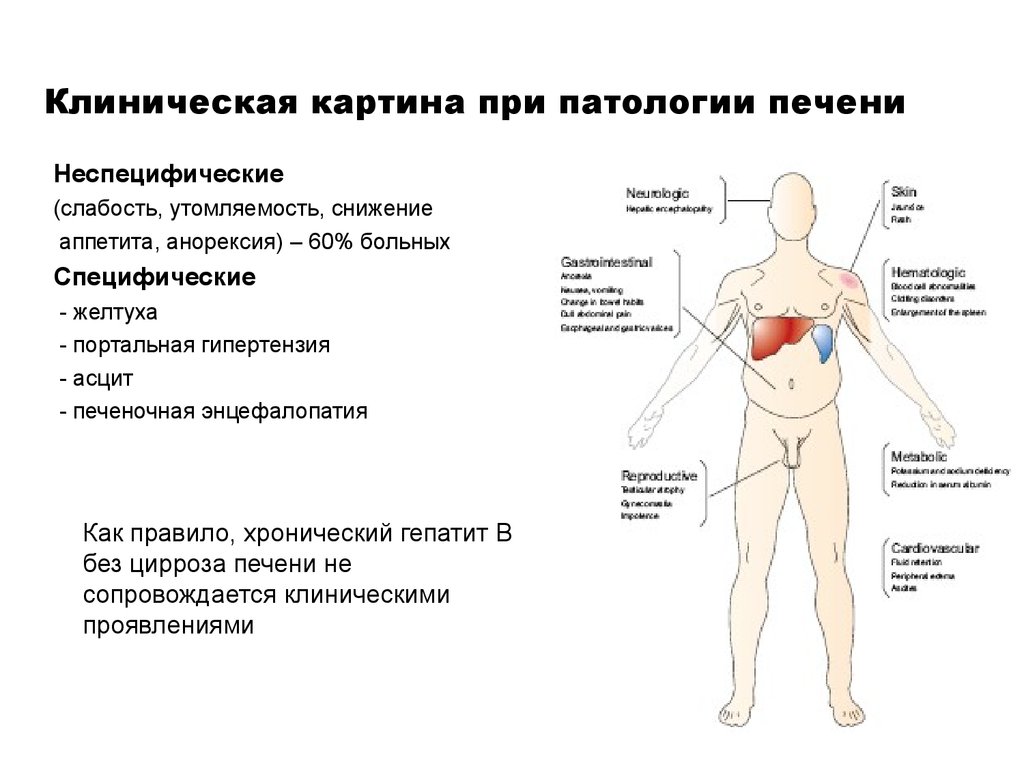
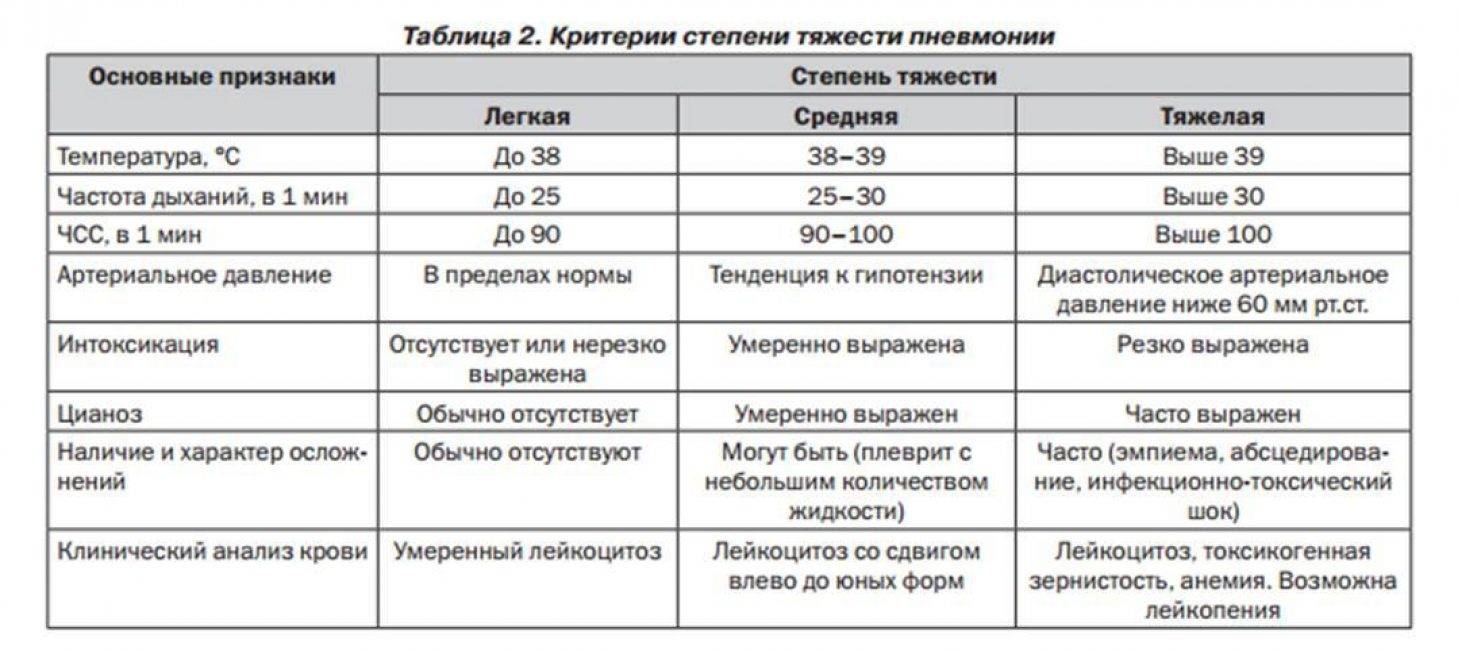
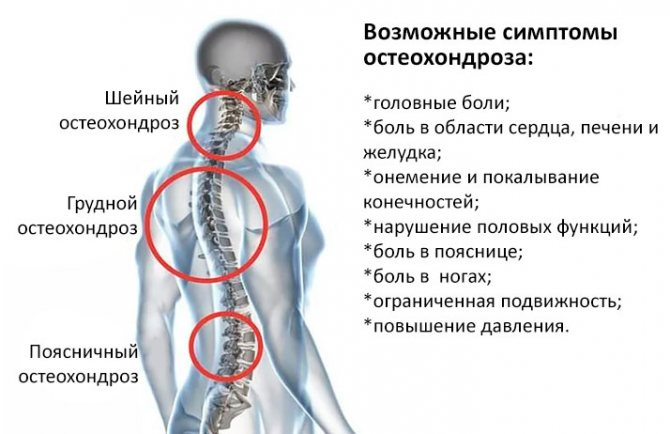
Клиническая картина протекает легко ошибка — 98 фото
Обновлено: 21.09.2023
Читайте также:
- Определение понятия окружающая среда проекта — 94 фото
- План подключения энергопринимающих устройств образец — 86 фото
- Стиль одежды женский рисунок карандашом — 93 фото
Отек легких: клинические формы (часть II)
Для цитирования: Чучалин А.Г. Отек легких: клинические формы (часть II). РМЖ. 2006;4:170.
Современное представление об отеке легких позволяет выделить два принципиальных патогенетических процесса, с которыми связывают его развитие. Первый патофизиологический процесс, в основе которого лежит развитие отека легких, обусловлен повышением гидростатического давления в микрососудах малого круга кровообращения. Согласно закону Старлинга жидкость, электролиты и белки выходят за пределы сосудистой стенки и аккумулируются в интерстициальной ткани. Следующим этапом патологических изменений в легких является этап накопления жидкости на поверхности альвеол, что и становится причиной резкого ухудшения газообменной функции легких, приводящей к развитию гипоксемии. Вторая форма патофизиологических изменений при отеке легких связана с процессом нарушения проницаемости эндотелиальных клеток альвеолярных капилляров. При этом типе патологических изменений сосудистая проницаемость нарушается вследствие острого повреждения легочной ткани, которое может происходить при сепсисе, пневмонии и некоторых других заболеваниях. Клиническими формами, которые соответствуют указанным патофизиологическим процессам, являются кардиогенный отек легких и респираторный дистресс-синдром. К кардиогенной форме отека легких близко стоит остро протекающая форма отека легких, которая также встречается преимущественно при заболеваниях сердца или сосудов. Ко второй форме, которую иногда обозначают как некардиогенный отек легких, помимо респираторного дистресс-синдрома, относят также неврогенный отек легких, отек легких, который индуцируется приемом определенных лекарственных средств (например, героина, салицилатов), переливанием крови и кровезаменителей.
Современное представление об отеке легких позволяет выделить два принципиальных патогенетических процесса, с которыми связывают его развитие. Первый патофизиологический процесс, в основе которого лежит развитие отека легких, обусловлен повышением гидростатического давления в микрососудах малого круга кровообращения. Согласно закону Старлинга жидкость, электролиты и белки выходят за пределы сосудистой стенки и аккумулируются в интерстициальной ткани. Следующим этапом патологических изменений в легких является этап накопления жидкости на поверхности альвеол, что и становится причиной резкого ухудшения газообменной функции легких, приводящей к развитию гипоксемии. Вторая форма патофизиологических изменений при отеке легких связана с процессом нарушения проницаемости эндотелиальных клеток альвеолярных капилляров. При этом типе патологических изменений сосудистая проницаемость нарушается вследствие острого повреждения легочной ткани, которое может происходить при сепсисе, пневмонии и некоторых других заболеваниях. Клиническими формами, которые соответствуют указанным патофизиологическим процессам, являются кардиогенный отек легких и респираторный дистресс-синдром. К кардиогенной форме отека легких близко стоит остро протекающая форма отека легких, которая также встречается преимущественно при заболеваниях сердца или сосудов. Ко второй форме, которую иногда обозначают как некардиогенный отек легких, помимо респираторного дистресс-синдрома, относят также неврогенный отек легких, отек легких, который индуцируется приемом определенных лекарственных средств (например, героина, салицилатов), переливанием крови и кровезаменителей.
Таким образом, современные подходы к классификации отека легких построены на патогенетических принципах. Выделяют следующие формы отека легких: кардиогенный отек легких (КОЛ), некардиогенный отек легких (НОЛ), остро протекающий отек легких (ОПОЛ), неврогенный отек легких (НЕОЛ) и другие редкие формы отека легких. Принципиально выделены формы, при которых ведущим патогенетическим механизмом является повышение гидростатического давления (КОЛ, ОПОЛ) и повышение сосудистой проницаемости (НОЛ, НЕОЛ). Это деление в определенной степени носит условный характер. Так, у больного, переносящего НОЛ, может развиться дисфункция левого желудочка, которая и приведет к развитию КОЛ. В другой клинической ситуации, когда больной с заболеванием сердца и с признаками застойной сердечной недостаточности переносит острый респираторный дистресс-синдром, т.е. у одного и того же больного может развиться как кардиогенный, так и некардиогенный отек легких. Разделительной точкой этих двух принципиально различных по патогенетическим механизмам формам отека легких является давление заклинивания. Если оно превышает 18 мм рт.ст., то отек легких развился вследствие высокого гидростатического давления. В противоположной ситуации, когда при отеке легких давление заклинивания ниже 18 мм рт.ст., отек развивается вследствие повышенной проницаемости сосудистой стенки альвеолярных капилляров.
Кардиогенный отек легких (КОЛ) – один из частых синдромов, которые встречаются в практике врача, и он всегда рассматривается, как одно из наиболее тяжело протекающих осложнений, а порой является жизнеугрожающим проявлением. Основным клиническим проявлением КОЛ является развитие респираторного дистресса. У больного человека можно наблюдать тахипноэ, он жалуется на одышку, в дыхании участвует вспомогательная мускулатура грудной клетки; он вынужден занять положение ортопноэ, регистрируется тахикардия или же другие формы нарушения ритма сердца, снижается сатурация кислорода (< 90%). Проявления респираторного дистресса возникают вследствие систолической или диастолической дисфункции левого желудочка. Дисфункция левого желудочка лежит в основе повышения давления в капиллярах и аккумуляции жидкости в интерстициальной ткани и альвеолярном пространстве. От врача требуется системный подход в оценке клинической картины, проведения необходимых лабораторных исследований, в ряде случаев – прямое измерение давления заклинивания с тем, чтобы с высокой степенью вероятности поставить диагноз КОЛ. В практической медицине всегда возникает необходимость эту форму отека легких дифференцировать с остро протекающей формой (ОПОЛ) и некардиогенным отеком легких (НОЛ). ОПОЛ всегда протекает при проявлениях острой дыхательной недостаточности, возникшей вследствие повышения давления в легочных капиллярах, которое может ассоциироваться, (а может, и нет) с развитием дисфункции левого желудочка. Эта форма отека легких развивается у больных со стенозом почечной артерии, при массивном переливании крови или же ее заменителей, которые вводятся внутривенно. Иначе говоря, по клиническим проявлениям остро протекающая форма отека легких схожа с КОЛ, но при ней сердце может быть интактным. НОЛ отличается от КОЛ тем, что давление заклинивания не превышает физиологического уровня.
Патофизиологической характеристикой КОЛ является транссудация избыточного количества жидкости в легочную ткань вследствие вторичной природы повышения давления в левом предсердии. Этот гемодинамический феномен, в свою очередь, развивается вследствие повышения давления в легочных венах и легочных капиллярах. Изменения в гемодинамике малого круга кровообращения при КОЛ происходят в условиях, при которых отсутствует первичное повышение проницаемости эндотелиальных клеток капилляров и эпителиальных клеток дистального отдела дыхательных путей. Завершающим этапом развития отека является фильтрация жидкости, обедненной содержанием белка; жидкость, помимо аккумуляции в интерстиции, заполняет альвеолы, что значительно нарушает диффузию кислорода и диоксида углерода.
Компенсаторными механизмами в период развития КОЛ является частичная активация ренин-ангиотензин и симпатической нервной системы, результатом чего является развитие тахикардии. Повышение внутрисосудистого сопротивления рассматривается, с одной стороны, как компенсаторный механизм, направленность которого связана с уменьшением фильтрации жидкости из сосудов в интерстиций; с другой стороны, повышение сопротивления в сосудах приводит к ухудшению гемодинамических расстройств при отеке легких. Ответом на эту приспособительную реакцию является тахикардия и, как ее следствие – укорочение времени диастолы, что приводит к снижению способности левого желудочка наполняться кровью. Повышение сосудистого сопротивления увеличивает работу сердца, что, в свою очередь, приводит к повышению потребности миокарда в кислороде. В конечном счете, этот тип приспособительной реакции может привести к увеличению конечного диастолического давления и тем самым способствовать утяжелению течения отека легких. Количество жидкости, которое накапливается в интерстиции, в значительной степени регламентируется состоянием лимфатической системы, которая в данном случае выполняет дренирующую функцию. Через лимфатические сосуды удаляется избыточное количество жидкости, которое фильтровалось через стенку сосуда. Адаптация лимфатических сосудов к меняющимся гемодинамическим условиям колеблется от человека к человеку. При остром повышении гидростатического давления в легочных капиллярах она не успевает приспособиться, т.е. временной фактор в реализации дренажной функции лимфатических сосудов имеет значение. Так, КОЛ может развиться при давлении заклинивания менее 18 мм рт.ст., и лимфатическая система не успевает приспособиться к быстрым изменениям. Однако при хронической сердечной недостаточности, когда давление заклинивания может превышать 25 мм рт.ст., можно констатировать активную дренажную функцию лимфатических сосудов, регулирующих обмен воды у данной категории больных.
Этиология КОЛ характеризуется большой и разнообразной группой заболеваний, при которых в патологический процесс вовлекается сердце. Эти болезни объединяет одно из трех необходимых гемодинамических условий: нарушения систолы левого предсердия, систолическая или диастолическая дисфункция.
Хроническое нарушение систолической функции левого предсердия, с которым связывают развитие отека легких, часто сопровождается тахикардией, как это бывает при мерцании и трепетании предсердий, желудочковой тахикардии, повышении температуры тела, что и приводит, в конечном счете, к снижению времени наполнения левого желудочка кровью. Эти процессы могут развиться также при увеличении объема циркулирующей крови (как это может происходить у женщин в период беременности или же при большой солевой нагрузке). Наиболее типичная ситуация складывается у больных митральным стенозом, развившемся вследствие ревматической лихорадки. Другими заболеваниями, при которых развивается нарушение систолической функции левого предсердия, являются миксома левого предсердия, тромб ушка левого предсердия (или же он сформировался на поверхности искусственного клапана). При этих формах патологического поражения сердца происходит повышение конечного диастолического давления, что и препятствует эффективной работе левого предсердия. Острая недостаточность работы митральных клапанов может развиться вследствие дисфункции папиллярных мышц, разрыва хорды, но чаще всего это происходит у больных, переносящих инфаркт миокарда. Некоторые больные с ишемической болезнью сердца имеют не очень выраженную митральную регургитацию в состоянии покоя, однако она становится клинически значимой при возрастании физической нагрузки. Гемодинамические изменения могут происходить при неизменном коронарном кровотоке, а наступать вследствие нарушения пространственной ориентации папиллярной мышцы, возникающей в период физической нагрузки.
Дисфункция левого желудочка является наиболее частой причиной развития КОЛ. В настоящее время принято разделять систолическую, диастолическую дисфункцию и перегрузку левого желудочка в целом, а также обструкцию выходного тракта левого желудочка.
Систолическая дисфункция возникает вследствие нарушения контрактильной функции левого желудочка, что приводит к уменьшению фракции выброса из полости левого желудочка и, как следствие этих изменений, приводит к повышению давления в малом круге кровообращения. Систолическая дисфункция чаще всего развивается вследствие хронического заболевания коронарных сосудов, гипертонической болезни, клапанного поражения миокарда; причиной может явиться и идиопатическая дилатационная кардиомиопатия. Более редкими заболеваниями, при которых развивается систолическая дисфункция левого желудочка, являются миокардиты, вызванные вирусом Coxsackie B, гипотиреоз, токсины, как, например, антрациклины. Снижение фракции выброса при систолической дисфункции приводит к активизации ренин-ангиотензин-альдостероновой и симпатической нервной системы. Компенсаторной реакцией при этих метаболических процессах является увеличение ретенции натрия и воды, что способствует развитию отека легких.
Диастолическая дисфункция предполагает увеличение ригидности желудочка и снижение комплайнса, что проявляется в период диастолы левого желудочка. Чаще эти гемодинамические изменения возникают при хронических заболеваниях сердечной мышцы: гипертрофическая и рестриктивная кардиомиопатия, а также во время острой ишемии миокарда и при развитии гипертонического криза. Конечным эффектом этих изменений в функции левого желудочка является повышение конечного диастолического давления. Развитию отека легких содействует также сопутствующая систолическая дисфункция левого желудочка, снижение коронарного кровообращения в период диастолы, результатом чего является развитие субэндокардиальной ишемии и аритмии сердца. С помощью эхокардиографии выявляется диастолическая дисфункция. Данный метод может быть применен даже при острых состояниях, таких как гипертонический криз, инфаркт миокарда и другие острые состояния, которые встречаются в практике кардиолога.
Перегрузка левого желудочка объемом может возникнуть при разрыве межсептальной перегородки, при недостаточности аортальных клапанов, при некоторых заболеваниях почек. Разрыв септальной перегородки является одним из грозных осложнений у больных инфарктом миокарда, возникающим, как правило, на 5-7 день от начала его развития. При недостаточности аортальных клапанов как остро возникший, так и хронически протекающий отек легких развивается вследствие увеличения объема крови левого желудочка, что и является причиной повышения конечного диастолического давления, повышения давления левого предсердия и, в конечном счете, развития отека легких. Недостаточность аортальных клапанов чаще всего возникает у больных с инфекционным эндокардитом, при разрыве аневризмы аорты или вследствие травмы грудной клетки.
Обструкция выходного тракта левого желудочка возникает при критических параметрах аортального стеноза, включая суправальвулярный и субвальвулярный стеноз, гипертрофической кардиомиопатии, а также злокачественной форме артериальной гипертонии. Хроническая обструкция выходного тракта левого желудочка приводит к развитию гипертрофии левого желудочка, которая, в свою очередь, обусловливает развитие систолической и диастолической дисфункции левого желудочка.
Диагностика кардиогенного и некардиогенного отека легких основана на клинической картине респираторного дистресса. По общим клиническим признакам часто бывает трудно разграничить эти две формы отека легких. Необходимо учитывать историю заболевания или заболеваний, предшествующих возникновению респираторного дистресса, и выполнить определенную программу обследования, включая и методы прямого измерения центральной гемодинамики.
Характерными жалобами для больных с КОЛ являются кашель и одышка. Интенсивность одышки возрастает и становится даже за короткое время осмотра больных мучительной для больного человека, и это – один из ведущих признаков отека легких. Одышке предшествует тахипноэ. В респираторном цикле участвует вспомогательная мускулатура верхнего плечевого пояса, грудной клетки, диафрагма и мышцы брюшного пресса. Необходимо при осмотре больных фиксировать внимание на группах мышц, участвующих в респираторном цикле, выделив особенно признаки парадоксального дыхания: сокращение диафрагмы и мышц грудной клетки находятся в противофазе. Данный признак свидетельствует об утомлении дыхательных мышц и рассматривается как прогностически неблагоприятный. Сочетание тахипноэ и признаков утомления дыхательных мышц, как правило, наблюдается в фазу альвеолярного отека. Эта форма одышки имеет ряд характерных жалоб, которые более специфичны для больных с сердечной недостаточностью. К этим жалобам относится чувство нехватки воздуха, затруднение, которое испытывает больной человек при вдохе, иногда жалоба носит более общий характер, как ощущение утомления или общее затруднения при дыхании. Однако следует отметить, что тяжесть состояния больного требует незамедлительной помощи, поэтому сбор анамнеза и обследование больного должно проводиться в предельно короткое время и высокопрофессионально. При проведении аускультации легких выслушиваются влажные хрипы. Они локализуются изначально в верхних отделах, но в случаях развернутой клинической картины отека легких влажные хрипы начинают выслушиваться повсеместно. Если они исчезают в задних базальных отделах легких, то это, как правило, свидетельствует о скоплении свободной жидкости в плевральной полости. У некоторой категории больных с КОЛ при аускультации легких выслушиваются сухие рассеянные хрипы, часто возникает необходимость проводить дифференциальный диагноз с бронхиальной астмой. Появление сухих рассеянных хрипов у больных с отеком легких объясняется особенностями нарушения микроциркуляции. При интерстициальной фазе отека легких развитие бронхообструкции связывают с отеком слизистой дыхательных путей, включая и дистальный отдел. Однако когда отек легких приобретает развернутый характер, то доминируют в аускультативной картине влажные хрипы. Клиническая практика многообразна, и среди больных с КОЛ встречаются те, у которых сочетанное заболевание сердца и легких, поэтому врачи могут встречаться с больными с КОЛ, протекающей на фоне выраженной обструкции дыхательных путей (бронхиальная астма, обструктивный бронхит и другие формы легочной патологии). Отек легких может протекать как на фоне повышенных, так и пониженных цифр артериального давления. Уровень артериального давления имеет большое значение в выборе неотложных мероприятий у больных с КОЛ. Следует подчеркнуть, что гипотензия может указывать на выраженную желудочковую дисфункцию или же развитие кардиогенного шока. Аускультация сердца часто выявляет ритм галопа у больных с отеком легких, что всегда свидетельствует о тяжести гемодинамических расстройств у этой категории больных. Переполнение яремных вен шеи свидетельствует о дисфункции не только левых отделов сердца, но и правых. Всегда следует обратить внимание на отечность нижних конечностей. Если у больных не было признаков хронической сердечной недостаточности, до того как у них развился КОЛ, то отечность не определяется.
Терапию следует начинать незамедлительно, не дожидаясь получения данных лабораторного исследования. Однако желательно, приступая к ингаляциям кислорода, определить сатурацию кислорода с тем, чтобы установить выраженность гипоксемии. При этом необходимо исходить из показателей сатурации: если сатурация ниже 90% , то больной с отеком легких расценивается как с гипоксемией. Чем ниже показатели сатурации кислорода, тем степень гипоксемии выражена больше. Особенно неблагоприятно при отеке легких сочетание таких признаков, как парадоксальное дыхание, ритм галопа, гипотензия и сатурация ниже 88%. В плановом порядке проводится исследование крови и мочи, исключаются признаки почечной и печеночной недостаточности. Диагностическое значение приобретает оценка ишемии миокарда, поэтому исследуется активность ферментов, исключающих или подтверждающих повреждение миокарда. Эти данные необходимо сопоставить с ЭКГ, исследование которой предназначено для установления характера нарушения ритма сердца и ишемии или некроза миокарда. Совокупность электрокардиографических и энзимологических исследований направлена на поиск биологических маркеров некроза сердечной мышцы. Измерение уровня мозгового натрийуретического пептида позволяет подтвердить кардиологическую природу отека легких. Тест чувствителен в 90%, специфичен в 74% и его предсказуемость составляет 81%. Концентрация пептида повышается до 731 pg/ml, когда норма не выше 47 pg/ml. В настоящее время разработаны методы, позволяющие проводить экспресс-диагностику у постели больного с отеком легкого. Важным этапом в обследовании больного имеет рентгенография органов грудной клетки (рис. 1). С помощью рентгенографического метода может быть установлена фаза интерстициального или альвеолярного отека легких, скопление транссудата в плевральной полости, изменения размеров сердца. Изначально отек легких проявляется скоплением жидкости в области корней легких. В рентгенологии этот признак получил название «бабочки». Жидкость в плевральных полостях отсутствует, если отек легких не развился на фоне предшествующей хронической сердечной недостаточности.
Постановка катетера Swan–Ganz в легочную артерию позволяет получить принципиально важную информацию прямого измерения показателей центральной гемодинамики и провести дифференциальный диагноз с некардиогенным отеком легких. Высокоспецифичным тестом в дифференциации КОЛ и НОЛ является измерение давления заклинивания. Если оно превышает 18 мм рт.ст., то речь идет о развитии КОЛ. Однако в клинической практике встречаются больные, страдающие смешанной патологией, когда у одного и того же человека с заболеванием сердца развился респираторный дистресс-синдром. Такое диагностическое решение может быть принято при мониторировании давления заклинивания. Так, если в течение 24-48 часов при проведении лечебных мероприятий удалось нормализовать показатели давления заклинивания, но при этом в клинической картине продолжают доминировать симптомы респираторного дистресса, то можно говорить о сочетании у больного как кардиогенного, так и некардиогенного отека легких.
Остро прогрессирующий отек легких (ОПОЛ) выделяется в самостоятельную форму, так как он имеет целый ряд особенностей клинической картины и патофизиологических механизмов его развития. ОПОЛ – клинический синдром, который характеризуется внезапным и бурным проявлениям респираторного дистресса. Он возникает вследствие быстрого скопления жидкости в интерстициальной ткани, т.е. гидростатическое давление в легочных капиллярах резко повышается за предельно короткое время; давление в левом предсердии и легочных венах также быстро повышается.
Патофизиологической особенностью при развитии ОПОЛ является увеличение транссудата, в котором определяется низкое содержание белка, в интерстиции легочной ткани и альвеолярном пространстве. Вследствие изменившихся гемодинамических условий происходит нарушение диффузии кислорода и диоксида углерода, т.е. при ОПОЛ у больных за короткий промежуток времени прогрессивно снижается сатурация кислорода. Высокая скорость накопления жидкости в интерстициальной ткани приводит к значительному повышению гидростатического давления как в капиллярах легочной ткани, так и в интерстиции. Однако повышения давления заклинивания, как это происходит при КОЛ, не происходит. Этот признак и позволил выделить с патофизиологической точки зрения эти, казалось бы, две близкие клинические формы отека легких. Необходимо добавить, что и лимфатическая система не успевает адаптироваться к резко изменившимся гемодинамическим условиям, поэтому ее дренажная функция не способна адекватно реагировать на количество жидкости, накапливающейся в интерстиции. Этиологическим фактором развития ОПОЛ, как и при КОЛ, является изменение функционального состояния миокарда. Однако в случае развития ОПОЛ изменения в миокарде происходят настолько стремительно, что это и становится причиной вышеуказанных изменений. Внезапное падение сократительной способности миокарда приводит к острому увеличению конечного диастолического давления левого желудочка, что, в свою очередь, является причиной повышения давления в полости левого предсердия. Но, как уже отмечалось, увеличения давления заклинивания на этой стадии развития отека легких не происходит. Компенсаторным механизмом является повышение активности ренин-ангиотензиновой и симпатической нервной системы, результатом деятельности которых является тахикардия и повышение сосудистой сопротивляемости.
Основная группа заболеваний, при которых возникает такое грозное осложнение, как развитие ОПОЛ, связана с поражением миокарда; в основе повреждения миокарда лежит его ишемия. Ишемия миокарда развивается в предельно короткий промежуток времени и приводит к падению как систолической, так и диастолической функции миокарда; ударный объем сердца резко снижается. С развитием систолической дисфункции падает фракция выброса левого желудочка, что очень скоро приводит к повышению диастолического давления в полости желудочка. Развитие дисфункции миокарда усугубляет степень выраженности ишемии миокарда. ОПОЛ может также развиться при внезапных патологических изменениях митральных или аортальных клапанов. Быстро сформировавшаяся митральная или аортальная регургитация может вызвать глубокую ишемию миокарда. Эти патологические изменения также являются причиной развития острого отека легких. Перфорация створок аортального клапана приводит к регургитации и повышению давления в полости левого желудочка. В клинической практике подобная картина встречается у больных с септическим эндокардитом, при разрыве расслаивающейся аневризмы аорты, осложнениях, возникших после имплантации искусственного клапана, при травматическом поражении аорты.
Острая регургитация митрального клапана, которая осложняется развитием ОПОЛ, возникает при разрыве хорд, что наблюдается при миксомах сердца. Другой причиной развития острой митральной регургитации является инфаркт миокарда, поражающий папиллярную мышцу; осложнения, возникающие после имплантации митрального клапана. ОПОЛ возникает при митральном стенозе, что может свидетельствовать о высокой степени стеноза и значительном повышении давления в полости левого предсердия. Клиническими особенностями ОПОЛ, которые отличают ее от КОЛ, является группа заболеваний, при которых встречается остро протекающая форма отека легких. Так, у больных с реноваскулярной гипертензией возникают эпизоды ОПОЛ. Это группа больных, у которых предрасполагающим фактором к развитию злокачественной гипертонии является стеноз ренальной артерии; более чем в 25% случаев у них возникает такое грозное осложнение, каким является ОПОЛ. Особенно часто ОПОЛ возникает у больных с двусторонним поражением почечных артерий. Причиной развития отека легких у больных с реноваскулярной гипертонией является высокая систоло-диастолическая артериальная гипертония, приводящая к повышению конечного диастолического давления, в то время как систолическая дисфункция левого желудочка или же митральная регургитация не имеют гемодинамически значимого влияния у данной категории больных. Необходимо подчеркнуть, что диастолическая дисфункция является определяющим звеном в патогенезе ОПОЛ и может встречаться при большой группе заболеваний, которые сопровождаются высокой температурой, глубокой анемии, при сепсисе, тиреотоксическом кризе, а также при нарушениях ритма сердца.
Основными клиническими проявлениями ОПОЛ являются кашель и одышка, впрочем, эти же симптомы в основном формируют клиническую картину КОЛ. Однако имеется отличие. Кашель и особенно одышка быстро развиваются. Одышка перерастает в ощущение удушья. Вся клиническая картина свидетельствует о предельно тяжелом состоянии; тяжесть обусловлена выраженностью респираторного дистресса. В предельно короткое время необходимо собрать основные анамнестические данные. Постараться определить болезнь и ее осложнения, приведшие к развитию ОПОЛ. Прогностически неблагоприятными признаками ОПОЛ является тахипноэ, участие вспомогательной мускулатуры верхнего плечевого пояса и грудной клетки в акте дыхания, повсеместно над грудной клеткой выслушиваются влажные хрипы, а также тахикардия, дисаритмия и гипотензия. Последние признаки свидетельствуют о диастолической дисфункции левого желудочка. Лабораторная диагностика не отличается от той, которая проводится в случаях КОЛ. Необходимо подчеркнуть, что давление заклинивания сохраняется в пределах физиологической нормы, являясь дифференциальным диагностическим признаком с кардиогенным отеком легких. Учитывая остроту клинических проявлений ОПОЛ, необходимо проводить дифференциальную диагностику с тромбоэмболией легочной артерии, тяжелой формой пневмонии, инфарктом миокарда. В случае дифференциальной диагностики с тромбоэмболией необходимо ориентироваться на данные ЭКГ, рентгенологических методов исследования. Высокоспецифичным методом диагностики тромбоэмболии легочной артерии является проведение ангиопульмонографии. Однако следует подчеркнуть, что характер аускультативной картины легких при ОПОЛ и тромбоэмболии имеет отличия. Если в первом случае превалирует картина влажного легкого, то во втором влажные хрипы появляются гораздо позже и причина тому – развитие инфарктной пневмонии.
Одним из осложнений, возникающих при развитии пневмонии, является острая дыхательная недостаточность. Причинами возникновения дыхательной недостаточности является или респираторный дистресс-синдром, или же остро прогрессирующий отек легких. Выраженная гипоксемия и другие признаки респираторного дистресса побуждают к проведению дифференциальной диагностики этих двух форм отека легких. Необходимо подчеркнуть, что при ОПОЛ достаточно выражена аускультативная картина влажных хрипов, отражающих альвеолярную фазу отека легких. Другим диагностически различимым признаком является ответ на проводимую терапию. Прогноз более благоприятен при ОПОЛ, чем при некардиогенном отеке легких.
Некардиогенный отек легких (НОЛ) развивается вследствие повышенной фильтрации жидкости через сосудистую стенку легочных капилляров. Транскапиллярная фильтрация возрастает не за счет повышения гидростатического давления, а преимущественно за счет повышенной сосудистой проницаемости. В интерстициальной ткани накапливается избыточное количество жидкости, в это же самое время дренирующая функция лимфатических сосудов по разным причинам снижена. НОЛ определяется как состояние, при котором радиографическими методами устанавливается скопление жидкости в интерстициальной ткани, в альвеолярном пространстве, но при этом давление заклинивания не превышает 18 мм рт.ст. Накопившаяся жидкость и белок в интерстициальной ткани начинают заполнять поверхность альвеол, что приводит к значительному ухудшению диффузии кислорода и диоксида углерода. У больных развиваются признаки респираторного дистресса, значительно снижается сатурация кислорода. Ведущей причиной развития НОЛ является респираторный дистресс-синдром взрослых. Реже эта форма отека легких встречается при высокогорной болезни и несколько чаще – при определенной группе неврологических заболеваний.
Механизмы, с которыми связывают повышение сосудистой проницаемости, являются предметом интенсивных научных исследований. В отличие от кардиогенного отека легких при этой форме жидкость, которая аккумулируется в интерстициальной ткани легких, содержит белок, составляя 60% от белка плазмы крови, в то время как при КОЛ количество белка не превышает 40%. Таким образом, в современных руководствах по этой проблеме подчеркивается высокая проницаемость капилляров легких при формировании респираторного синдрома взрослых. НОЛ встречается при большой и разнообразной по своей природе группе заболеваний. Наиболее часто НОЛ встречается при следующих заболеваниях: сепсис, острые инфекционные заболевания дыхательных путей, ингаляционное проникновение в дыхательные пути токсических субстанций (отравление ракетным топливом и другие токсические вещества), травма, при вдыхании кокаина, острое радиационное повреждение легких, у больных в постоперационном периоде после коронаропластики. Следует подчеркнуть, что перечисленные заболевания отличает разная клиническая картина и разный патогенез заболевания, однако объединяет единый сценарий развития респираторного дистресс-синдрома взрослых. Повышенная проницаемость стенки микрососудов легких возникает в ответ на повышенную концентрацию цитокинов, таких как интерлейкин-1, интерлейкин-8, фактор некроза опухоли и некоторых других. Высокая активность маркеров воспалительной реакции частично обусловлена повышенной миграцией нейтрофилов из сосудистого русла в очаги воспалительного повреждения легочной ткани. Необходимо отметить, что нейтрофилы изменяются под влиянием воспалительной реакции. Так, например, меняется экспрессия генов, с которыми связана продукция нейтрофильной эластазы, дефензинов и целый ряд других медиаторов воспалительной реакции.
Провести дифференциальный диагноз между респираторным дистресс-синдромом взрослых, который классифицируется как некардиогенный отек легких, от кардиогенного отека легких не всегда представляется возможным. Однако это разделение носит принципиальный характер, так как методы лечения и исход заболевания существенно разнятся. С клинических позиций очень важно установить непосредственную болезнь и ее осложнения, приведшие к развитию НОЛ или КОЛ. Поэтому указания на инфаркт миокарда или же сепсис могут помочь в принятии диагностического решения. Однако порой встречаются больные, у которых дифференциальный диагноз затруднен даже при самом тщательном сборе анамнеза. Так, у больного с сепсисом возможно поражение эндокарда, с последующей перфорацией клапанов сердца и развитием острого прогрессирующего отека легких. В другой клинической ситуации у больного могут наблюдаться обе формы отека легких. Существенным подспорьем является измерение давления заклинивания; в случаях неясной природы респираторного дистресса рекомендуется постановка катетера Swan-Ganz с тем, чтобы исследовать параметры центральной гемодинамики и определить уровень давления заклинивания. Для респираторного дистресс-синдрома взрослых характерны цифры ниже 18 мм рт.ст. Показатели давления заклинивания являются разделительной точкой, которая позволяет с высокой степенью достоверности предположить, какой патогенетический механизм привел к развитию острой дыхательной недостаточности. Если в основе произошедших гемодинамических нарушений лежит повышение гидростатического давления в легочных капиллярах, то давление заклинивания будет выше физиологической нормы. Если давление заклинивания в пределах физиологической нормы или даже ниже, то можно говорить о преобладании механизма повышенной сосудистой проницаемости, т.е. о развитии респираторного дистресс-синдрома взрослых.
Другим заболеванием легких, которое сопровождается развитием НОЛ, является диффузный альвеолярный геморрагический синдром. При развитии этой формы патологии развивается синдром анемии, хотя кровохарканье может быть минимальным. Так, при описании некоторых форм геморрагической лихорадки (Ханта вирус и некоторые другие формы) отмечалась картина некардиогенного отека легких. Среди других заболеваний числится и рак легких, при котором развитие НОЛ возникает при массивном метастазировании. Ошибочный диагноз может возникнуть при лимфомах легких. Эта категория больных нуждается в проведении расширенных методов диагностики, включая и пункционную биопсию легких.
НОЛ описан при высокогорной болезни. Обычно развитие отека легких наступало у отдельных индивидуумов, которых быстро поднимали на высоту 3000-4000 м над уровнем моря. В небольшом проценте случаев он носил фатальный характер и заканчивался смертельным исходом. В основе развития этой формы некардиогенного отека легких лежит вазоконстрикторная реакция на высотную гипоксию.
Одним из патогенетических механизмов, который может привести к развитию некардиогенного отека легких, является реакция легочных сосудов на реперфузию. Чаще всего эта форма легочной патологии встречается у больных хирургического профиля, которым было проведено массивное переливание растворов, белковых субстанций и препаратов крови. В основе НОЛ лежит развитие повышенной сосудистой проницаемости, которая появилась в ответ на реперфузию. Описан НОЛ, возникший у больных после разрешения пневмоторакса и плеврита. При эвакуации свободной жидкости из плевральной полости более 1,5 литров (особенно, если удаление жидкости происходило быстро) появлялись признаки отека легких. В некоторых клинических случаях это осложнение развивалось через 24 ч после того, как была проведена процедура. Эти формы НОЛ характеризовались высоким процентом летальности. Механизмы развития отека легких при патологии плевры изучены мало.
Серьезную клиническую проблему составляет категория больных, злоупотребляющих наркотическими средствами. Среди известных наркотических средств НОЛ чаще встречался при использовании героина и метадона. Отек легких развивается к концу первых суток, после приема наркотических средств. Рентгенография выявляет неоднородное скопление жидкости в разных участках легких. Точный механизм некардиогенного отека легких при использовании наркотических средств установить не удалось. Предположительно патогенетическую роль играют сами токсические субстанции, оказывая влияние на сосудистую проницаемость капилляров легочной ткани. Вторичные эффекты при использовании наркотических средств, такие как гипоксия, отек головного мозга, ацидоз, другие метаболические расстройства, а также гипервентиляция, играют патогенетическую роль в развитии НОЛ.
Токсическое действие салицилатов может осложниться развитием отека легких. Этот вариант некардиогенного отека легких описан у пожилых людей с хронической интоксикацией салицилатами. Острое повреждение легочных структур при интоксикации этой группой лекарственных соединений может сопровождаться повышением сосудистой проницаемости, приводящей к интенсивному накоплению жидкости в интерстициальной ткани. Бикарбонат соды является достаточно эффективным средством в купировании хронической интоксикации салицилатами и НОЛ.
Описаны случаи некардиогенного отека легких при тромбоэмболии легочной артерии. Подчеркивается, что отек легких происходил при выпоте жидкости в плевральную полость. В данном случае речь идет не об острой фазе отека легких, а о стадии формирования инфарктной пневмонии. Один из патогенетических механизмов, объясняющий развитие отека легких, связывают с нарушением дренажной функции лимфатических сосудов при инфарктной пневмонии. В пользу этого предположения свидетельствует тот факт, что отек легких происходил при выпоте в плевральную полость, т.е. имеются в виду нарушения лимфотока в плевральной полости и в легочной ткани.
Нейрогенный отек легких (НЕОЛ) возникает вследствие увеличения количества жидкости в интерстициальной ткани, а также ее пропитывания на поверхность альвеол. Отек обычно развивается очень быстро после повреждения центральных структур головного мозга. Эти клинические проявления трактуются, как острый респираторный дистресс-синдром, хотя патофизиологические механизмы и прогноз значительно отличаются от некардиогенного отека легких.
НЕОЛ развивается у лиц с травмами головы. Часто с этой клинической проблемой врачи встречаются при военных действиях, когда пораженные поступают в госпитали с травмой головы. В мирное время это проблема пострадавших в транспортных авариях. Необходимо отметить, что процент развития отека легких у этой категории пострадавших очень высок, иначе говоря, отек легких в высоком проценте случаев встречается при черепно-мозговой травме. Продолжительность отека легких может быть в течение нескольких дней и в последующем разрешиться. Отек сопровождается тахипноэ, при котором в акте дыхания участвует вспомогательная мускулатура грудной клетки. Отечная жидкость, которая выделяется из дыхательных путей, может содержать небольшое количество крови. Легочное кровотечение не характерно для этой категории больных, поэтому если оно отмечено, то необходимо исключать другие болезни. При аускультации легких выявляются влажные хрипы, которые выслушиваются как в верхних, так и в нижних отделах легких. При рентгенографии выявляются застойные признаки в легких, при этом размеры сердца не изменены. Гемодинамические параметры, такие как артериальное давление, давление заклинивания, сердечный выброс – в пределах физиологической нормы. Эти признаки являются важными в проведении дифференциальной диагностики между различными формами отека легких. Итак, типичным для НЕОЛ являются нормальные показатели сердечного выброса и давления заклинивания, что более характерно для больных с острым респираторным дистресс-синдромом. Возникают трудности в проведении дифференциального диагноза с аспирационной пневмонией, которая достаточно часто осложняет лечение больных с черепно-мозговой травмой. Необходимо ориентироваться на отсутствие гнойного бронхиального секрета и двустороннее поражение легких в случаях развития НЕОЛ. В процессе наблюдения за больным появляется больше возможностей установить характер поражения легких. Так, аспирационная пневмония имеет склонность к абсцедированию, развитию плеврита, ее разрешение происходит в течение 2-3 недель, в то время как отек легких разрешается в более короткие сроки. Необходимо также исключать застойную сердечную недостаточность и острый респираторный дистресс-синдром, которые могут развиться у человека, получившего травму головы. Диагноз НЕОЛ представляется достаточно затруднительным. Необходимо исключить заболевания, при которых развивается респираторный дистресс-синдром. После черепно-мозговой травмы другой частой причиной развития НЕОЛ является эпилепсия. Судорожный период эпилепсии может осложниться развитием НЕОЛ. Особенностью этой формы патологии человека является то, что отек легких возникает не в период судорог, а тогда, когда они прекратились. Прогноз у больных с эпилепсией и НЕОЛ принято считать неблагоприятным. У этой категории больных наиболее высок риск внезапной смерти, так как летальность у них выше, чем при других формах эпилепсии. НЕОЛ может осложнять течение геморрагического инсульта, особенно часто он развивается при субарахноидальном кровоизлиянии. У некоторых больных с инсультом НЕОЛ развивается несколько дней спустя после того, как он произошел. Патогенетические механизмы НЕОЛ остаются малоизученной областью, несмотря на то, что эта форма отека легких было описана более 100 лет назад.
Существует несколько теорий, с позиций которых делаются попытки объяснить развитие отека легких. Большое место отводится роли гипоталамуса в возникновении НЕОЛ. Важным механизмом является повышение внутричерепного давления, которое сопровождается активацией симпатического отдела нервной системы. Экспериментально удалось получить модель НЕОЛ при поражении дистального отдела ствола головного мозга (medulla oblongata), и считается, что это критическая зона, с которой связывают развитие неврогенного отека легких. Подтверждением этой гипотезы служат фармакологические эффекты фентоламина. Он способен блокировать центральные a-адренергические рецепторы и тем самым способствовать купированию НЕОЛ. Центральные механизмы оказывают влияние на движение жидкости из микрососудов легких в интерстициальную ткань, а также на уровень онкотического давления в интерстиции. Другой патогенетический механизм развития отека легких связан с эффектом вазоконстрикции.
Таким образом, патогенетическая особенность неврогенного отека легких состоит в том, что в нем участвуют центральные механизмы ствола головного мозга, локальные изменения в гемодинамике легких затрагивают регулирующие механизмы гидростатического и онкотического давления как сосудов, так и интерстициальной ткани. Эти механизмы дополняются участием вазоспастических реакций малого круга кровообращения и их повышенной проницаемостью. В нарушении гемодинамических реакций легких принимает участие и нарушение функции левого желудочка. Таким образом, патогенез неврогенного отека легких вобрал в себя механизмы как кардиогенного, так и некардиогенного отека легких. В этом его отличие от других клинических форм отека легких.
Итак, опыт современной клинической практики позволяет выделить определенные формы отека легких: кардиогенный, некардиогенный, остро протекающий отек легких, неврогенный, а также такие редкие формы отека легких, какими является отек легких при высокогорной болезни, отравлении лекарственными веществами, и некоторые другие формы. Современный классификационный подход по выделению различных клинических форм отека легких построен на патогенетическом принципе. Так, выделены формы, при которых ведущим патогенетическим механизмом является повышение гидростатического давления в альвеолярных капиллярах легких: кардиогенный отек легких, остро протекающий отек легких. В противоположность этой форме выделены клинические формы отека легких, при которых ведущим патогенетическим механизмом является повышение сосудистой проницаемости: некардиогенный отек легких, отек легких при высокогорной болезни, неврогенный отек легких.
На клинические проявления отека легких оказывает влияние основное заболевание. Особую роль в оценке степени тяжести отека легких играет состояние сферы сознания больного человека, характеристика его гемодинамики и респираторной функции (особенно газообмена). Центральное место в клинической картине отека легких занимает респираторный дистресс, основным проявлением которого является одышка. Тахипноэ, диспноэ, удушье – это цепь клинических проявлений отека легких, имеющих разную прогностическую ценность.
Все статьи номера
Каждый больной строго индивидуален, и у каждого болезнь протекает по-разному…
Ненаследственные болезни протекают неодинаково, а их лечение проводится в зависимости от генетической конституции человека, чего не может не учитывать врач.
Но у одного человека эти заболевания развиваются и прогрессируют с большой скоростью, а у другого болезнь протекает медленнее и легче.
Причём порой побочное лечение сопутствующих болезней протекает одновременно с лечением основного заболевания, когда человек не ставит конкретную цель излечения их.
Болезнь протекала скоротечно, и врачи ничем не могли помочь.
Привет! Меня зовут Лампобот, я компьютерная программа, которая помогает делать
Карту слов. Я отлично
умею считать, но пока плохо понимаю, как устроен ваш мир. Помоги мне разобраться!
Спасибо! Я стал чуточку лучше понимать мир эмоций.
Вопрос: преклонность — это что-то нейтральное, положительное или отрицательное?
Его собственная болезнь протекала в менее определённой, агрессивной форме.
Во многих случаях гипертоническая болезнь протекает бессимптомно (в частности, без головной боли).
Гипертоническая болезнь протекает неравномерно.
Иногда болезнь протекает мягко и мало изменяет суставы.
Болезнь протекает волнообразно, но прогрессирует неуклонно: постепенно у больного поражаются всё новые и новые суставы с последующей их грубой деформацией.
Но всё оказалось напрасно: теперь инкубационный период болезни протекал десятилетиями.
Каждое обострение болезни протекало по-разному: на сей раз мне удалось обойтись без длительной госпитализации, и, несмотря на муки, жизнь продолжалась.
Даже если болезнь протекает легко, разумней переждать несколько дней в домашней изоляции.
При уходе за больными заразилось ещё несколько человек, но у них болезнь протекала легче, и смертельных исходов не наблюдалось.
Что ещё более опасно – 90 % клинических проявлений гипертонической болезни протекают скрыто, из-за чего опасные процессы можно просто не заметить.
Смертность остаётся на уровне 2% в мире, а примерно 1% активных случаев болезни протекает в тяжёлой форме.
Утверждать можно, что каждая болезнь протекает быстрее, когда она не поддерживается психической причиной.
Однако у разных людей сердечные болезни протекают по-разному.
Они быстро заражались всеми болезнями, с какими соприкасались даже слегка, и болезни протекали очень тяжело, а лечебная магия на них не действовала.
Болезнь протекает вяло, как при гриппе.
А, как известно, у тех, кто всю жизнь привык много работать, эта болезнь протекает особенно остро.
Очевидно, что в нашу жизнь вмешался очень сильный вредоносный фактор, не имеющий (с позиции массажиста) своего конкретного воздействия, но усугубляющий любую перегрузку организма, заставляя болезни протекать более остро, с осложнениями.
Болезнь протекает циклически от обострения к ремиссии.
Сама болезнь протекала молниеносно – человек умирал за пару недель от внутренних кровоизлияний, которые невозможно остановить.
– Прости, при всём желании я не могу сказать даже приблизительно, у каждого болезнь протекает по-своему.
И самое главное, что витафагия, как айсберг, – большая часть болезни протекает подспудно.
Потом я заболел, и болезнь протекала мучительно.
Ей было уже под восемьдесят, а в этом возрасте болезни протекают очень вяло.
Любой цвет имеет массу оттенков, так одна и та же болезнь протекает совсем иначе у разных людей, даже у родственников.
Если психическая болезнь протекает в тяжёлой форме, то больные неспособны справиться даже с собственными потребностями и не могут обслужить себя (одеться, обуться, поесть, посетить туалет).
Эта скверная болезнь протекала в тяжёлой форме: сначала поднималась высокая температура, делавшая человека беспомощным, угнетала и высасывала силы; болела голова, бросало в дрожь.
Болезнь протекает странно, то отпуская её из цепких лап, то вновь забирая.
– Помимо пациентов, у которых болезнь протекала неожиданно легко, в моей практике было 18 человек, о которых можно с уверенностью сказать: да, это самоисцеление.
Зачастую болезни протекают атипично, плохо поддаются лечению.
Вот почему болезнь протекает волнообразно: с периодическими ухудшениями и улучшениями.
Болезнь протекала долго, выматывая и отбирая все силы.
Пришедший на дом участковый врач сказал, что сейчас (то есть в этом сезоне) многие болеют гонконгским гриппом, болезнь протекает довольно тяжело с высокой температурой и даёт осложнения на бронхи и лёгкие.
У его жены после заражения болезнь протекала легко, даже легче, чем у него: основной признак – побледнение кожи – не был выраженным.
Примерно у 25 % пациентов болезнь протекала тяжело и прогрессировала в острый респираторный дистресс-синдром.
То, что у разных людей болезни протекают сходным образом, знали давно, но эти знания были разрозненными.
На начальных стадиях развития болезнь протекает бессимптомно.
На ранних стадиях базедова болезнь протекает практически незаметно.
Болезнь протекала медленно и мучительно, со всевозможными симптомами и признаками, а переход к здоровому периоду мог наступить внезапно, в течение всего одной ночи.
При благоприятном течении язвенная болезнь протекает без осложнений, с чередованием периодов обострения, продолжающихся от трёх до восьми-девяти недель, и периодов ремиссии, продолжительность которых может колебаться от нескольких месяцев до нескольких лет.
Но у одних болезнь протекает достаточно легко и без осложнений, у других же – незначительная простуда провоцирует тяжёлые болезни.
– Не знаем, мамаша, не знаем, у каждого по-разному. Болезнь протекает индивидуально, это зависит не только от нас.
Версия: Справочник заболеваний MedElement
Категории МКБ:
Левожелудочковая недостаточность (I50.1)
Общая информация
Краткое описание
Левожелудочковая недостаточность
Острый отек легкого } с упоминанием о болезни сердца
Острый легочный отек } БДУ или сердечной недостаточности
Сердечная астма
Левосторонняя сердеч ная недостаточность
Острая левожелудочковая недостаточность
ОЛЖН — это острая сердечная недостаточность, обусловленная островозникшим нарушением систолической и (или) диастолической функции ЛЖ и характеризующаяся клинической симптоматикой остро развившегося венозного застоя в малом круге кровообращения. Проявляется крайне тяжелыми клиническими синдромами: кардиогенным шоком, отеком легких, острым легочным сердцем
Одним из частых и наиболее тяжелых клинических вариантов ОСН является отек легких, ведущим симптомом которого является выраженная нарастающая одышка в покое.
Облачная МИС «МедЭлемент»
Классификация
В зависимости от типа гемодинамики, от того, какой желудочек сердца поражен, а также от некоторых особенностей патогенеза различают следующие клинические варианты ОСН.
С застойным типом гемодинамики:
— правожелудочковую (венозный застой в большом круге кровообращения);
— левожелудочковую (сердечная астма, отек легких).
С гипокинетическим типом гемодинамики (синдром малого выброса — кардиогенный шок):
— аритмический шок;
— рефлекторный шок;
— истинный шок.
По длительности течения отека легких различают:
— молниеносный приводит к летальному исходу в течение нескольких минут;
— острый (до 4 ч) обычно наблюдается при инфаркте миокарда, черепно-мозговой травме, анафилактическом шоке и др. Клинически характеризуется столь бурным течением, что даже немедленные реанимационные мероприятия не всегда предупреждают летальный исход;
— подострый отличается волнообразным течением: симптомы его нередко нарастают постепенно, то усиливаясь, то ослабевая. Чаще это свойственно эндогенной интоксикации (печеночная недостаточность, уремия и др.);
— затяжной (от 12 ч до нескольких суток) возникает, если заболевание протекает на фоне хронической сердечной недостаточности, хронических неспецифических заболеваний легких. При этом такие характерные клинические признаки отека легких, как одышка, цианоз, пенистая мокрота и влажные хрипы в легких, могут отсутствовать.
Классификация по Киллипу основана на клинической симптоматике и результатах рентгенографии органов грудной клетки. Классификация применяется преимущественно для сердечной недостаточности при инфаркте миокарда, но может применяться при сердечной недостаточности de novo.
Выделяют четыре стадии (класса) тяжести:
I – нет признаков СН.
II – СН (влажные хрипы в нижней половине легочных полей, третий тон, признаки венозной гипертензии в легких).
III – тяжелая СН (явный отек легких; влажные хрипы распространяются более чем на нижнюю половину легочных полей).
IV – кардиогенный шок (Ј САД 90 мм рт. ст. с признаками периферической вазоконстрикции: олигурия, цианоз, потливость).
Этиология и патогенез
Этиология
— Острый инфаркт миокарда
— Воспалительные заболевания миокарда (тяжело протекающие диффузные миокардиты различной этиологии).
— Кардиомиопатии любой природы.
— Внезапно возникшая перегрузка ЛЖ вследствие выраженного роста сопротивления изгнанию крови в аорту (гипертонический криз при эссенциальной и симптоматической артериальной гипертензии).
— Внезапно возникшая перегрузка ЛЖ объемом при увеличении объема циркулирующей крови (массивные внутривенные инфузии).
— Быстро наступившая и выраженная декомпенсация хронической сердечной недостаточности.
— Остро возникшие тяжелые нарушения сердечного ритма (пароксизмальная мерцательная аритмия, трепетание предсердий, желудочковая тахикардия, атриовентрикулярная блокада и т.д).
— Травмы сердца
Патогенез. В основе приступа сердечной астмы лежит внезапно возникающая острая левожелудочковая недостаточность — патологический синдром, характеризующийся падением сократительной способности левого желудочка, с соответствующим уменьшением ударного объема сердца, при сохраненном, или даже повышенном венозном возврате, что вызывает повышение внутрисосудистого давления в малом круге кровообращения. Жидкость из сосудистого русла начинает «пропотевать» в интерстициальное пространство.
Происходит увеличение расстояния между эндотелиальными клетками капилляров, что позволяет макромолекулам выходить в интерстициальное пространство. Формируется интерстициальный отек легких. Дальнейшее повышение внутрисосудистого давления приводит к разрыву плотных соединений между клетками, выстилающими альвеолы, и попадании в альвеолы жидкости, содержащей эритроциты и макромолекулы. Клинически это проявляется появлением мелкопузырчатых влажных хрипов. При углублении разрыва альвеолярно-капиллярной мембраны жидкость затапливает альвеолы и дыхательные пути. С этого момента развивается яркая клиническая картина альвеолярного отека легких с развитием признаков ОДН. Одним из патогенетических факторов возникновения ОДН является вспенивание при каждом вдохе попавшей в альвеолы жидкости, что вызывает обструкцию дыхательных путей. Так, из 100 мл пропотевшей плазмы образуется 1 — 1,5 л пены. Пена не только нарушает проходимость дыхательных путей, но и разрушает сурфактант альвеол, это вызывает снижение растяжимости легких, увеличивается нагрузка на дыхательные мышцы, усиливается гипоксия и отек.
Диффузия газов через альвеолярно-капиллярную мембрану также нарушается и из-за расстройств лимфообращения, ухудшения коллатеральной вентиляции легких, дренажной функции и капиллярного кровотока. Возникает шунтирование крови и нарастает гипоксия. С точки зрения патофизиологии, приступ сердечной астмы есть начинающийся альвеолярный отек легких.
Эпидемиология
Распространенность ОСН составляет 0,4–2,0% населения европейских стран, является причиной примерно 20% от всех госпитализаций среди пациентов старше 65 лет. Летальность при ОСН, в частности при отеке легких, в зависимости от этиологии колеблется от 50 до 80%
В 60–70% случаев причиной развития отека легких является ишемическая болезнь сердца (ИБС), у 26% пациентов причиной развития отека легких является хроническая сердечная недостаточность (ХСН), у 9% – острые нарушения ритма, у 3% – патология клапанов . В пожилом возрасте среди причин развития отека легких преобладает ИБС, тогда как в молодом возрасте среди этиологических факторов превалируют дилатационная кардиомиопатия, пороки сердца и миокардиты. Важно отметить, что ОСН может развиться и без предшествующей патологии, т.е. начало заболевания протекает в виде отека легких.
Клиническая картина
Клинические критерии диагностики
Сердечная астма характеризуется следующими проявлениями:
— резко выраженное удушье;
— сильное чувство страха смерти и беспокойство;
— дыхание частое, поверхностное, одышка инспираторного или смешанного типа;
— вынужденное полувозвышенное или сидячее положение больного;
— выраженный акроцианоз;
— кожа, покрытая холодным потом;
— пульс нитевидный, часто аритмичный;
— артериальная гипотензия (однако, у больных артериальной гипертензией возможно высокое артериальное давление);
— глухость сердечных тонов, протодиастолический ритм галопа, акцент II тона на легочной артерии;
— мелкопузырчатые хрипы и крепитация в нижних отделах легких;
Альвеолярный отек легких имеет следующую симптоматику:
— клокочущее дыхание, на расстоянии слышны крупнопузырчатые влажные хрипы, проводящиеся из трахеи и крупных бронхов (симптом «кипящего самовара»);
— кашель с отделением пенистой, розовой мокроты;
— вынужденное, полувозвышенное или сидячее положение;
— акроцианоз, холодный пот;
— нитевидный, аритмичный пульс;
— артериальная гипотензия;
— глухость тонов сердца, протодиастолический ритм галопа;
— акцент II тона на легочной артерии;
— притупление перкуторного звука в нижних отделах легких;
— крепитация и влажные хрипы над нижними отделами легких и выше;
Cимптомы, течение
Сердечная астма (интерстициальный отек легких) возникает в любое время суток, но чаще в ночные или предутренние часы. Провоцируют приступ физические нагрузки, переохлаждение, психоэмоциональное напряжение, кошмарные сновидения, переход больного из вертикального в горизонтальное положение, при этом легочный объем крови увеличивается в среднем на 300 мл. Удушье возникает или усиливается внезапно. Эквивалентом одышки может быть пароксизмальный кашель. Больной вынужден занять сидячее положение, свесив ноги с постели (положение ортопноэ). В акте дыхания участвует вспомогательная дыхательная мускулатура. Появляются цианоз губ и ногтей, испарина, экзофтальм. Больные возбуждены, беспокойны. Конечности холодные. Могут быть явления бронхоспазма из-за отека слизистой оболочки бронхов. Кашель сухой, поверхностный или надсадный, одышка до 40—60 в мин. Характерна тахикардия. АД, как правило, повышено. При перкуссии легких отмечается коробочный звук за счет острой эмфиземы легких. Дыхание громкое, усиленное. При явлениях бронхоспазма выслушиваются сухие свистящие рассеянные хрипы. Влажные хрипы на этом этапе заболевания не определяются. Тоны сердца выслушиваются с трудом из-за шумного дыхания и хрипов; могут определяться увеличенная болезненная печень, отеки нижних конечностей.
Альвеолярный отек легких характеризуется резкой дыхательной недостаточностью: выраженной одышкой, нарастающим диффузным цианозом. Сознание больных спутано. По мере увеличения отека углубляется заторможенность, вплоть до комы. Лицо одутловато, вены шеи набухшие. Кожные покровы влажные, при инсульте горячие за счет гипертермии центрального генеза. Хрипы в легких слышны на расстоянии как клокотанье. На губах больных пузырится пена. Розовый цвет ее обусловлен проникающими в альвеолы форменными элементами крови, что характерно для гриппа, крупозной пневмонии. Грудная клетка расширена; при перкуссии перкуторный звук мозаичный: участки тимпанита чередуются с очагами притупления. При аускультации легких наряду с сухими хрипами выслушивается масса звучных разнокалиберных влажных хрипов (от мелко- до крупнопузырчатых). Аускультативная картина динамична; лучше всего хрипы слышны в верхних и средних отделах легких. АД чаще повышено, если отек возникает не на фоне шока, но в терминальной стадии АД прогрессивно снижается, пульс становится нитевидным, дыхание поверхностным, затем по типу Чейна — Стокса. Больной без сознания. Смерть наступает в результате асфиксии.
Клиническая картина острой левожелудочковой недостаточности
Диагностика
Рентгенологическое исследование помогает утвердить клиническое предположение отека легких. При прямой и боковой проекциях в период интерстициального отека легких находят так называемые линии Керли (тонкие линии, сопровождающие висцеральную и междолевую плевру в базально-латеральных и прикорневых отделах легочных путей), отражающие отечность междольковых перегородок, усиление легочного рисунка в связи с инфильтрацией периваскулярной и перибронхиальной межуточной ткани, особенно в прикорневых зонах. При этом корни легких теряют свою структуру, очертания их становятся размытыми. На всем протяжении легочных полей отмечается понижение их прозрачности, определяется нечеткость легочного рисунка: в периферических отделах видна отечность.
Рентгенографические признаки кардиогенного и некардиогенного отека легких
Пульсоксиметрия (определяет концентрацию связывания кислорода с гемоглобином), выявляет низкую концентрацию кислорода, ниже 90%;
Измерение центрального венозного давления (давление кровотока в крупных сосудах) при помощи флеботонометра Вальдмана, подключённому к пунктированной подключичной вене. При отёке лёгких повышается центральное венозное давление 12мм/рт.ст.;
Электрокардиография (ЭКГ) позволяет определить, изменения со стороны сердца, в случае если отёк лёгких, связан с сердечной патологией. На ЭКГ могут регистрироваться: признаки инфаркта миокарда или ишемии, аритмии, признаки гипертрофии стенок, левых отделов сердца;
Трансторакальная эхокардиография позволяет оценить функцию миокарда и состояние клапанов, а также помочь установить причину отека легких . Трансторакальная эхокардиография должна быть первым методом оценки функции левого желудочка и клапанов у тех больных, у которых данные истории заболевания, осмотра и рентгеновского исследования не выявили причины отека легких . Как известно, при некоторых заболеваниях, лежащих в основе возникновения ОСН, лишь срочное хирургическое вмешательство способно улучшить прогноз. Наиболее важным диагностическим методом при определении показаний к операции является именно эхокардиография.
Катетеризация легочной артерии, используемая для измерения давления заклинивания легочной артерии (ДЗЛА), рассматривается как «золотой стандарт» при оценке причины отека легких. Катетеризация легочной артерии также позволяет мониторировать давление заклинивания легочной артерии, сердечный выброс и системное сосудистое сопротивление в процессе лечения.
Лабораторная диагностика
Данные лабораторные исследования позволяют уточнить этиологию синдрома ОСН, а также определить тактику ведения пациента.
определение концентрации газов в артериальной крови: парциальное давление углекислого газа 35мм/рт.ст.; и парциальное давление кислорода 60 мм/рт.ст.;
Биохимический анализ крови: применяется для дифференциации причин вызвавших отёк лёгких (инфаркт миокарда или гипопротеинемия). Если отёк лёгких, вызван инфарктом миокарда, то повышается в крови уровень тропонинов 1нг/мл и МВ фракции креатинфосфокиназы 10% от её общего количества.
В том случае, если причиной отёка лёгких стала гипопротеинемия (низкий уровень белка в крови), в этом случае, снижается уровень общего белка < 60г/л, и альбуминов < 35г/л. При увеличении мочевины, выше 7,5 ммоль/л и креатинина выше 115 мкмоль/л, свидетельствует о почечной этиологии отёка лёгких;
Коагулограмма (свёртывающая способность крови) изменяется при отёке лёгких, вызванного, тромбоэмболией легочной артерии. Увеличение фибриногена 4 г/л, увеличение протромбина 140%
Согласно рекомендациям Российского научного общества кардиологов в плане обследования используется ряд лабораторных тестов.
Лабораторные исследования у больных, госпитализированных с ОСН
Одной из современных методик диагностики и прогнозирования ОСН является определение уровня мозгового натрийуретического пептида (МНП) Использование в сочетании со стандартными диагностическими процедурами определения уровня МНП может улучшить точность диагноза ОСН Влияние МНП на прогноз определяется его способностью отражать нарушение систолической функции сердца, ведущей к развитию СН. Концентрация МНП коррелирует с повышением КДД, которое четко связано с появлением одышки при СН.
Дифференциальный диагноз
Дифференциально-диагностическим признаком острой левожелудочковой недостаточности с бронхиальной астмой может служить диссоциация между тяжестью состояния и (при отсутствии выраженного экспираторного характера одышки и «немых зон») скудностью аускультативной картины.
При одышке дифференциальную диагностику проводят с:
— спонтанным пневмотораксом (одышка сочетается с болевым синдромом);
— центральной одышкой (внутричерепной процесс);
— психогенной одышкой (тахипноэ);
— Приступом стенокардии.
Также кардиогенный отек легких дифференцируют с другими этиологическими формами ОЛЖН.
Провести дифференциальный диагноз между респираторным дистресс-синдромом взрослых, который классифицируется как некардиогенный отек легких, от кардиогенного отека легких не всегда представляется возможным. Однако это разделение носит принципиальный характер, так как методы лечения и исход заболевания существенно разнятся. Существенным подспорьем является измерение давления заклинивания; в случаях неясной природы респираторного дистресса рекомендуется постановка катетера Swan-Ganz с тем, чтобы исследовать параметры центральной гемодинамики и определить уровень давления заклинивания. Для респираторного дистресс-синдрома взрослых характерны цифры ниже 18 мм рт.ст. Если давление заклинивания в пределах физиологической нормы или даже ниже, то можно говорить о преобладании механизма повышенной сосудистой проницаемости, т.е. о развитии респираторного дистресс-синдрома взрослых.
Другим заболеванием легких, которое сопровождается развитием НОЛ, является диффузный альвеолярный геморрагический синдром. При развитии этой формы патологии развивается синдром анемии, хотя кровохарканье может быть минимальным. Среди других заболеваний числится и рак легких, при котором развитие НОЛ возникает при массивном метастазировании. Ошибочный диагноз может возникнуть при лимфомах легких. Эта категория больных нуждается в проведении расширенных методов диагностики, включая и пункционную биопсию легких.
НОЛ описан при высокогорной болезни. Обычно развитие отека легких наступало у отдельных индивидуумов, которых быстро поднимали на высоту 3000-4000 м над уровнем моря. В небольшом проценте случаев он носил фатальный характер и заканчивался смертельным исходом. В основе развития этой формы некардиогенного отека легких лежит вазоконстрикторная реакция на высотную гипоксию.
Также НОЛ встречается у больных хирургического профиля, которым было проведено массивное переливание растворов, белковых субстанций и препаратов крови. В основе НОЛ лежит развитие повышенной сосудистой проницаемости, которая появилась в ответ на реперфузию. Описан НОЛ, возникший у больных после разрешения пневмоторакса и плеврита. При эвакуации свободной жидкости из плевральной полости более 1,5 литров (особенно, если удаление жидкости происходило быстро) появлялись признаки отека легких. В некоторых клинических случаях это осложнение развивалось через 24 ч после того, как была проведена процедура. Эти формы НОЛ характеризовались высоким процентом летальности. Механизмы развития отека легких при патологии плевры изучены мало.
Серьезную клиническую проблему составляет категория больных, злоупотребляющих наркотическими средствами. Среди известных наркотических средств НОЛ чаще встречался при использовании героина и метадона. Отек легких развивается к концу первых суток, после приема наркотических средств. Рентгенография выявляет неоднородное скопление жидкости в разных участках легких. Точный механизм некардиогенного отека легких при использовании наркотических средств установить не удалось.
Токсическое действие салицилатов может осложниться развитием отека легких. Этот вариант некардиогенного отека легких описан у пожилых людей с хронической интоксикацией салицилатами. Острое повреждение легочных структур при интоксикации этой группой лекарственных соединений может сопровождаться повышением сосудистой проницаемости, приводящей к интенсивному накоплению жидкости в интерстициальной ткани.
Описаны случаи некардиогенного отека легких при тромбоэмболии легочной артерии.
Нейрогенный отек легких (НЕОЛ) возникает вследствие увеличения количества жидкости в интерстициальной ткани, а также ее пропитывания на поверхность альвеол. Отек обычно развивается очень быстро после повреждения центральных структур головного мозга. Эти клинические проявления трактуются, как острый респираторный дистресс-синдром, хотя патофизиологические механизмы и прогноз значительно отличаются от некардиогенного отека легких. НЕОЛ развивается у лиц с травмами головы. Часто с этой клинической проблемой врачи встречаются при военных действиях, когда пораженные поступают в госпитали с травмой головы. В мирное время это проблема пострадавших в транспортных авариях. Необходимо отметить, что процент развития отека легких у этой категории пострадавших очень высок, иначе говоря, отек легких в высоком проценте случаев встречается при черепно-мозговой травме. Продолжительность отека легких может быть в течение нескольких дней и в последующем разрешиться. Отек сопровождается тахипноэ, при котором в акте дыхания участвует вспомогательная мускулатура грудной клетки. Отечная жидкость, которая выделяется из дыхательных путей, может содержать небольшое количество крови. Легочное кровотечение не характерно для этой категории больных, поэтому если оно отмечено, то необходимо исключать другие болезни. При аускультации легких выявляются влажные хрипы, которые выслушиваются как в верхних, так и в нижних отделах легких. При рентгенографии выявляются застойные признаки в легких, при этом размеры сердца не изменены. Гемодинамические параметры, такие как артериальное давление, давление заклинивания, сердечный выброс – в пределах физиологической нормы. Эти признаки являются важными в проведении дифференциальной диагностики между различными формами отека легких.
После черепно-мозговой травмы другой частой причиной развития НЕОЛ является эпилепсия. Судорожный период эпилепсии может осложниться развитием НЕОЛ. Особенностью этой формы патологии человека является то, что отек легких возникает не в период судорог, а тогда, когда они прекратились. Прогноз у больных с эпилепсией и НЕОЛ принято считать неблагоприятным. У этой категории больных наиболее высок риск внезапной смерти, так как летальность у них выше, чем при других формах эпилепсии. НЕОЛ может осложнять течение геморрагического инсульта, особенно часто он развивается при субарахноидальном кровоизлиянии. У некоторых больных с инсультом НЕОЛ развивается несколько дней спустя после того, как он произошел.
Осложнения
Лечение
При отеке легких, за редким исключением (нитроглицерин под язык или нитраты в виде аэрозоля), препараты должны вводиться внутривенно, что по сравнению с другими способами обеспечивает наиболее быстрый, полный, предсказуемый и управляемый эффект.
Согласно рекомендациям Европейского и Российского общества специалистов по сердечной недостаточности, целью неотложного лечения является быстрая стабилизация гемодинамики и уменьшение симптомов ОСН.
Комплексная терапия отека легких включает следующее:
— Прежде всего больному придают сидячее положение, ноги должны быть опущены.
— Сублингвально дают нитроглицерин (1-2 таблетки), или изо Мак ретард (1 капсулу).
— Внутривенно медленно вводят 1 мл 1 % раствора морфина гидрохлорида или 2-4 мл 0,25% раствора дроперидола в 5-10 мл 5% раствора глюкозы.
— Проводят оксигенотерапию через носовые катетеры. В стадии альвеолярного отека легких для пеногашения ингаляцию кислорода делают с парами спирта (70 — 96 %) или 10 % спиртового раствора антифомсилана.
— Накладывают жгуты на нижние конечности.
Необходимо поддержание SaО2 в нормальных пределах (95–98%). Для этой цели наиболее часто используют ингаляцию кислорода, предпочтение следует отдавать неинвазивной вентиляции с положительным давлением (НВПД). Скорость подачи кислорода должна быть неменее 4-8 л/мин через носовые катетеры.
Показаниями к ИВЛ с интубацией трахеи являются:
— признаки слабости дыхательных мышц (уменьшени е частоты дыхания в сочетании с нарастанием гиперкапнии и угнетением сознания);
— тяжелое нарушение дыхания (для уменьшения работы дыхания);
— необходимость защиты дыхательных путей от регургитации содержимого желудка;
— устранение гиперкапнии и гипоксемии у больных без сознания после длительных реанимационных мероприятий или введения лекарственных средств;
— необходимость санации трахеобронхиального дерева для предупреждения обтурации бронхов и ателектазов.
— Необходимость в немедленной инвазивной вентиляции может возникнуть при отеке легких на фоне ОКС.
МЕДИКАМЕНТОЗНАЯ ТЕРАПИЯ ОСН
Ее долгое время начинали с введения морфина. Сегодня также можно говорить, что наркотические анальгетики показаны пациентам с тяжелой СН, особенно при наличии возбуждения или для купирования ангинозного статуса. Морфин вводят внутривенно болюсно в дозе 3 мг, возможно повторное введение. При гиповолемии морфин следует применять с большой осторожностью.Морфин противопоказан при отеке легких, сочетающемся с геморрагическим инсультом; при бронхиальной астме; хроническом легочном сердце.
Следующая группа лекарственных средств, которую широко используют, — это диуретики.
Лечение диуретиками следует начинать с осторожностью. Теперь подход к диуретической терапии стал более осторожным и взвешенным. Имеются четкие рекомендации по применению диуретиков при ОСН:
— Применение агрессивной монотерапии диуретиками не является необходимым для большинства больных.
— Диуретики следует применять только в случаях перегрузки организма жидкостью.
— Диуретики не являются препаратами первой линии для большинства пациентов, могут быть эффективны при добавлении к нитратам. Нитраты должны являться препаратами выбора. Если имеются признаки перегрузки жидкостью, применяют диуретики. Внутривенно вводят фуросемид в начальной дозе 20—40 мг. Далее она может быть увеличена с учетом показателей функции почек,уровня BNP. Высокие дозы фуросемида не рекомендованы из-за возможности ухудшения функции почек.
Вазодилататоры показаны в качестве средств первой линии при лечении большинства больных с ОСН. В России в основном используют нитраты. В низких дозах они вызывают дилатацию только венозных сосудов, при увеличении дозы — также и артерий, включая коронарные артерии.
Лечение нитратами может быть начато с сублингвального применения нитроглицерина или изосорбида динитрата. При неэффективности первой сублингвальной дозы нитроглицерина возможно повторное его применения через 10 мин. Наиболее эффективным является внутривенное введение нитратов (нитроглицерин 20 мкг/мин с увеличением дозы до 200 мкг/мин или изосорбида динитрат 1—10 мг/ч).
Дозу нитратов необходимо титровать по уровню среднего АД, оптимальной считается доза, когда среднее АД снизится на 10 мм рт.ст.Дозу нитратов необходимо уменьшить,если систолическое АД достигнет 90—100 мм рт.ст., или полностью прекратить введение при дальнейшем снижении его
Другая группа лекарственных препараты, без которых трудно обойтись в лечении ОСН, это инотропные средства. их необходимо применять с осторожностью и только по показаниям. Инотропные средства показаны при наличии периферической гипоперфузии (артериальная гипотония, ухудшение функции почек) вне зависимости от наличия застоя в легких и отека легких, рефрактерных к лечению диуретиками и вазодилататорами в оптимальных дозах. Внутривенную инфузию допамина в дозе >2 мкг/кг мин можно использовать для инотропной поддержки при ОСН, сопровождающейся артериальной гипотонией. Инфузия низких доз <2-3 мкг/кгмин способна улучшить почечный кровоток и усилить диурез при острой декомпенсации СН с артериальной гипотонией и олигурией
Показанием к назначению сердечных гликозидов при ОСН может служить СН, вызванная тахикардией, например при мерцании предсердий, в том случае, если назначение бета-адреноблокаторов не дает желаемого снижения ЧСС. В таких случаях эффективный контроль сердечного ритма позволяет добиться положительного влияния на клиническую картину.Абсолютными противопоказаниями к назначению сердечных гликозидов являются брадикардия, АВ-блокада II и III степени, остановка синусового узла, синдром каротидного синуса, синдром Вольфа — Паркинсона —Уайта, гипертрофическая обструктивная кардиомиопатия, гипокалиемия и гиперкальциемия.
Тактика лечения острой левожелудочковой сердечной недостаточности
При артериальной гипотонии:
— дофамин (5-20 мкг/кг/мин), обладает высокой a-адренергической активностью, быстро повышает АД, при этом значительно учащает ЧСС, обладает аритмогенным действием
— если АД менее 80 мм рт. ст., добавить норадреналин (0,5 – 30 мкг/мин), начать внутриаортальную баллонную контрапульсацию
— при нормализации АД и сохранении отека легких – фуросемид в/в и в/в ниропруссид натрия или нитроглицерин (10-100 мг/мин)
При нормальном или высоком АД:
— фуросемид (0,5- 1 мг/кг в/в)
— нитроглицерин (0,5 мг под язык каждые 5 мин)
— нитропруссид натрия (0,1-5 мкг/кг/мин) – мощный артериолярный и венозный вазодилататор, вводят, пока ДЗЛА не снизится до 15-18 мм рт.ст. (не снижать АД сис. менее 90 мм. рт. ст.) или вводят в/в нитроглицерин (расширяет больше венулы, под его влиянием сердечный выброс увеличивается в меньшей степени, чем под влиянием нитропруссида).
Если после проведенных мероприятий сердечная недостаточность сохраняется (сохраняется выраженное снижение насосной функции левого желудочка) – добавляют добутамин 2,5-20 мкг/кг/мин (синтетический катехоламин, обладает инотропным действием, в отличие от дофамина не существенно увеличивает ЧСС и в большей степени снижает давление наполнения левого желудочка, обладает менее выраженным аритмогенным действием; дозу увеличивают так, чтобы добиться повышения сердечного выброса и снижения ДЗЛА) или амринон (обладает одновременно инотропным и сосудорасширяющим действием, ингибирует фосфодиэстеразу, тем самым отличаясь от катехоламинов).
При стабилизации состояния продолжают прием диуретиков, нитратов, ИАПФ.
Госпитализация
После купирования нарушений гемодинамики все больные с острой сердечной недостаточностью подлежат госпитализации в кардиореанимационные отделения. При торпидном течении ОСН госпитализация осуществляется специализированными кардиологическими или реанимационными бригадами. Пациентов с кардиогенным шоком следует по мере возможности госпитализировать в стационары, где имеется кардиохирургическое отделение.
Информация
Информация
- http://www.eurolab.ua/encyclopedia/565/44927/
- Неотложная кардиология / Е.И. Чазов, С.Н. Терещенко, С.П. Голицын. — М.: Эксмо, 2011.— 224 с.— (Профессиональная медицина).
- Неотложная скорая медицинская помощь: Руководство для врача Под общей ред. проф. В.В.Никонова Электронная версия: Харьков, 2007. Подготовлена кафедрой медицины неотложных состояний, медицины катастроф и военной медицины ХМАПО
- Национальные рекомендации ВНОК И ОССН по диагностике и лечению ХСН (третий пересмотр) Утверждены конференцией оССН 15 декабря 2009 года Комитет по подготовке текста: Мареев В. Ю., Агеев Ф. Т., Арутюнов Г. П., Коротеев А. В., Ревишвили А. Ш.
- Кардиология. Национальное руководство /под редакцией Беленкова Ю.Н., Оганова Р.Г., 2007
- Внутренние болезни. В 10 книгах. Книга 5: Пер. с англ./ Под ред. Е. Браунвальда, К. Дж. Иссельбахера, Р. Г. Петерсдорфа и др. — М.: Медицина.— 1995. — 448 с: ил
- Окороков А. Н. Диагностика болезней внутренних органов: Т. 7. Диагностика болезней сердца и сосудов.: — М.: Мед. лит., 2003. — 416 с.: ил.
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
COVID-19, как правило, проявляется симптомами поражения органов дыхания, однако было бы ошибочным упрощением считать его локальным респираторным заболеванием. Даже при нетяжелой форме COVID-19 рано и
часто повреждается нервная система, нередко инфицирован кишечник. Вместе с тем, опасность диссеминации инфекционного процесса и развития тяжелого системного заболевания связана главным образом с поражением лег-
ких. Присоединение к бронхопневмонии-альвеолиту инфекционного тромботического микроваскулита (эндотелиита) не только образует субстрат дыхательной недостаточности, но и создает опасность выхода вирусов в кровоток. Развивается вирусный сепсис, а воспалительный тромбоз повреждает новые участки сосудистого русла. В связи с этим или в
результате непосредственной вирусной инвазии в патологический процесс могут вовлекаться многие ткани и органы. В настоящем обзоре рассматриваются молекулярные, клеточные и клинические проявления и осложнения нового
коронавирусного заболевания.
До недавнего времени коронавирусы казались безобидными возбудителями незначительных вспышек ничем не примечательных и легко протекающих острых респираторных (или кишечных) заболеваний. В то же время в природных резервуарах – в организме экзотических азиатских животных обитало множество похожих микроорганизмов. Жизнь быстро изменяется. С одной стороны, в процессе непрерывной регенерации у вирусов меняются генетические свойства, что позволяет им лучше приспосабливаться к условиям обитания и находить новых хозяев. С другой стороны, люди все чаще беспечно приближаются к микробиологическим опасностям и могут не только заражаться, но и стремительно распространять инфекции, обладая возможностями быстрого перемещения на большие расстояния.
В 2003 г. впервые была отмечена крупная вспышка тяжелого острого респираторного коронавирусного заболевания (Severe Acute Respiratory Syndrome – SARS), возникшая в Китае. В 2012 г. мир вновь содрогнулся, когда на Ближнем Востоке разразилась еще более опасная коронавирусная болезнь с поражением органов дыхания – Middle East Respiratory Syndrome (MERS). Заболевания в обоих случаях распространились за пределы первичных очагов заражения. Обе эпидемии характеризовались высокой вероятностью тяжелого течения болезни и смерти (их частота составила, соответственно, около 10% и 35%) и унесли 774 и 858 человеческих жизней (данные ВОЗ) [1,2].
Наконец, в декабре 2019 г. в Китае началась эпидемия нового инфекционного заболевания, которая быстро приобрела беспрецедентный, планетарный масштаб. Пандемию вызвал очередной представитель семейства коронавирусов – SARS-CoV-2. Заболевание получило официальное название COVID-19 (сокращение от COronaVIrus Diseаse 2019).
Следует отметить значительное совпадение (на 85%) геномов SARS-CoV и SARSCoV-2 [3-5] и почти полное геномное сходство возбудителя новой болезни с вирусами, в природе обитающими в летучих мышах (Китай) [3] и ящерицах (Малайзия) [6]. В начале декабря 2020 г. в мире вирусом SARS-CoV-2 заразились более 70 млн человек, а умерли около 1,5 млн. При уровне смертности, меньшем, чем при SARS и, тем более, MERS, новое заболевание уже вызвало в тысячи раз больше смертей, чем две предыдущие эпидемии коронавирусных инфекций (SARS и MERS). Это связано прежде всего с высокой контагиозностью нового возбудителя. Один заболевший в начале эпидемии заражал до 3-4 здоровых людей [7-8]. Противоэпи демические меры позволяют ограничить опасность инфицирования.
Анализ течения болезни в крупных когортах пациентов, инфицированных SARS-CoV-2 [9], показывает, что в большинстве случаев (около 80%) заболевание протекает в бессимптомной, малосимптомной (легкой) или средне-тяжелой тяжелой форме острого катарального заболевания верхних дыхательных путей. Примерно у 15% пациентов наблюдается тяжелое течение заболевания, которое сопровождается поражением легких (пневмонией) с дыхательной недостаточностью, но чаще заканчивается выздоровлением. Наконец, приблизительно в 5% случаев прогрессирование заболевания достигает критической глубины из-за поражения не только легких, но и других органов с развитием их функциональной недостаточности и крайне высоким риском смерти (около 50%) [10].
Нетяжелые формы COVID-19 заканчиваются в течение двух недель самопроизвольным выздоровлением и обычно приводят к формированию иммунной устойчивости к повторному заражению. В клиническом течении наиболее тяжелых и опасных случаев заболевания можно наблюдать следующую последовательность событий. От момента заражения до появления симптомов проходит несколько дней. В клинику в условиях эпидемии больные обычно поступают лишь к концу следующей недели в связи с уже значительно выраженными проявлениями болезни, наиболее соответствующей тяжелой пневмонии [11]. В дальнейшем зачастую прогрессирует дыхательная и может возникать полиорганная недостаточность, требующая перевода больных в отделения интенсивной терапии, где в среднем на протяжении недели продолжается борьба за их жизнь [12]. Если наступает смерть, то чаще – к концу третьей недели [13]. Выписка из стационара становится возможной обычно лишь на 4-й неделе от момента поступления. Однако после этого на протяжении недель и даже месяцев возможны и персистирование инфекции, и развитие осложнений [14-16].
Специфическим рецептором SARS-CoV-2, обеспечивающим развитие болезни у человека, служит трансмембранный ангиотензинпревращающий фермент второго типа (АПФ2). Этот рецептор-фермент связан с клеточной мембраной и скудно представлен в кровотоке в растворимой форме. АПФ2 является карбоксипептидазой, как и другой ангиотензинпревращающий фермент (АПФ), который уже давно и хорошо известен. АПФ и АПФ2 отличаются и в структурном, и в функциональном отношении, и в тропности к лекарственным препаратам, но, главное, они занимают ключевые позиции в разнонаправленных каскадах регуляции жизнедеятельности, представленных в самых разных тканях и органах [17].
Внедрение вируса в клетку происходит «в два счета». Во-первых, на поверхности клетки будущего хозяина фрагмент S-протеина вируса прочно связывается с АПФ2 [5,18]. Во-вторых, благодаря воздействию кофермента – трансмембранной протеиназы TMPRSS2 – этот связанный фрагмент отщепляется, а вирус вместе с оставшейся частью S-протеина обычно вселяется в клетку хозяина, чтобы использовать ее для собственной репликации [19]. После этого очередное поколение вирусов готово к инфицированию новых клеток.
Уникальная структура S-белка SARS-CoV-2 обеспечивает ему аффинность к рецептору АПФ2, которая в 10-20 раз превышает таковую у SARS-CoV [20]. В то же время вероятность заражения людей SARS-CoV-2 зависит и от генетически обусловленного состояния (экспрессии) АПФ2. Экспрессия рецептора неодинакова в разных тканях. Кроме того, она зависит от возраста, пола и расы [21-23]. Мужчины (мальчики в том числе) заболевают значительно чаще, чем женщины [24], что может быть связано как с расположением гена АПФ2 в Х-хромосоме, так и с активирующим влиянием андрогенов на экспрессию АПФ2 [25,26].
Хронические заболевания легких и сердца, сахарный диабет, опухоли сопровождаются усилением экспрессии АПФ2, что приводит к увеличению риска заболевания и смерти от COVID-19 [24,27,28]. Аналогичный эффект могут давать и некоторые лекарства, в частности нестероидные противовоспалительные препараты [29].
Для первичного заражения организма необходимо присутствие рецепторов, чувствительных к возбудителю, в ткани, расположенной на границе с окружающей средой. Эпителий носо- и ротоглотки открыт для встречи с воздушно-капельной инфекцией и обычно поражается в первую очередь, чему способствует довольно сильная экспрессия АПФ2 [30]. SARS-CoV-2 может проникать внутрь организма человека и через наружные выстилки глаз (роговица и конъюнктива) [31], а также через отростки нервов, представленных в носо- и ротоглотке, гортани и трахее, так как в них также имеются рецепторы (АПФ2). Наконец, при попадании в рот извне и при заглатывании больным инфицированной слюны или мокроты вирусы могут достигать тонкого кишечника, где сильно экспрессированные рецепторы способны поддержать заражение.
При любом указанном первичном доступе, как предполагается, возможно вторичное заражение. Типичный сценарий экспансии этого заболевания связан прежде всего с респираторным трактом (на всем протяжении которого представлены клеточные рецепторы вируса с максимумом экспрессии в трахее). Инфекционный процесс из рото- и носоглотки может продвигаться по слизистой оболочке в дистальном направлении вплоть до терминальных бронхиол и альвеол. Вместе с тем продолжается вирусная контаминация вдыхаемого в легкие воздуха [31]. В результате, несмотря на слабую экспрессию АПФ2 в альвеолярном эпителии, непрерывному заражению подвергается значительный объем дыхательной паренхимы обоих легких. В подавляющем большинстве случаев (более 90%) пневмония сочетается с трахеобронхитом, т.е. является бронхопневмонией. Раньше и в большей степени страдают пневмоциты 2-го типа, ответственные за выработку сурфактанта и регенерацию пневмоцитов 1-го типа, обеспечивающих газообмен.
Инфицирование пневмоцитов 2-го типа сопровождается быстрой транскриптомной перестройкой, непосредственно приводящей к доминированию воспалительного внутриклеточного сигнального пути NF-κB, вызывающего экспрессию цитокинов, хемокинов и молекул адгезии, утрату экспрессии сурфактанта, повреждение и гибель этих клеток [32]. В ткани легкого развивается диффузный пневмонический процесс, сопровождающийся некрозами и реактивной атипией эпителия, инфильтрацией воспалительными клетками альвеол и интерстиция, выраженной фибринозномуцинозной экссудацией в альвеолах и их спадением, интерстициальным отеком, формированием фиброза и гиалиновых перегородок в межальвеолярных пространствах. Такой тип поражения более всего соответствует синдрому повреждения альвеол (альвеолиту) и является типичным морфологическим субстратом острого респираторного дистресс-синдрома (ОРДС). Этому патологическому состоянию вполне соответствует и картина изменений, видимая при компьютерной томографии легких – двухсторонние, диффузно расположенные и местами сливающиеся затенения («матовые стекла»), а также прогрессирующая (острая) дыхательная недостаточность.
Однако ОРДС при данном заболевании имеет атипичные черты. Это осложнение, как правило, развивается более чем через неделю после начала заболевания и уже поэтому не соответствует общепринятому Берлинскому определению этого синдрома, в соответствии с которым он развивается не позже 7-го дня [33]. Другими особенностями являются резистентность к респираторной терапии (ИВЛ) и аномально слабая растяжимость ткани легких [34-37].
Атипичность ОРДС при данном заболевании связана с закономерным присоединением к трахеобронхиту и альвеолиту воспалительно-тромботического поражения микрососудов легких. Возникновение в них третьего тяжелого патологического процесса (в научных публикациях его стали обозначать сокращением MicroCLOTS – microvascular COVID-19 lung vessels obstructive thromboinflammatory syndrome) [38] связано с тем, что эпителий, пораженный SARS-CoV-2, в альвеолах отделен от эндотелия лишь базальной мембраной, которая в условиях деструктивного воспаления рано или поздно не справляется с барьерной функцией. Тогда в инфекционный процесс посредством представленных в эндотелиоцитах рецепторов (АПФ2) вовлекаются альвеолярные капилляры. Разрушив и их, вирусы прорываются в системный кровоток. Наступает перелом в течении заболевания, означающий генерализацию инфекции.
Заметить это удалось не сразу, ведь даже тщательные макро- и микроскопические исследования не позволяют увидеть при аутопсии органoв и тканей умерших от COVID-19 многие специфические проявления вирусных поражений. Они постепенно открываются при целенаправленном применении специальных методов (электронномикроскопических, иммуногистохимических, молекулярно-генетических) [39].
В середине апреля (то есть на 4-м месяце пандемии и активного изучения болезни) в журнале Lancet были выдвинуты две концепции, важные для понимания существа тяжелой формы COVID-19 и внутренне связанные между собой. С одной стороны, Z. Varga и соавт. [40] впервые продемонстрировали существование при этом заболевании эндотелиита легочной и внелегочной локализации, а также присутствие в воспалительном субстрате лимфоцитов и вирусов. С другой стороны, H. Li и соавт. [41] высказали гипотезу о том, что тяжелая форма COVID-19 представляет собой вирусный сепсис и в значительной мере обосновали эту концепцию наблюдениями за клиническими проявлениями, течением и исходами заболевания. Ими было отмечено, что в тот момент не было фактов, свидетельствовавших о «широкой диссеминации вирусов». Первые данные в поддержку этой концепции были предъявлены синхронно демонстрацией диссеминированного вирусного эндотелиита. В дальнейшем с помощью специальных морфологических методов было получено много дополнительных подтверждений вирусного эндотелиита, развившегося в самых разных органах и тканях [42,43].
Кроме того, был установлен факт циркуляции вирусов SARS-CoV-2 в кровотоке [44-48]. Вероятность выявления этого феномена – вирусемии, а точнее SARS-CoV-2-РНК-емии, зависит от тяжести и стадии инфекции [46,48], но также и от точности метода. Для такой диагностики подходит не столько классический метод ПЦР (RT-PCR), сколько его усовершенствованная разновидность – droplet digital PCR (ddPCR) – высокочувствительный метод количественной диагностики [47].
Совокупность накопленных данных позволяет считать, что инфицирование эндотелия легочных капилляров является предпосылкой для прорыва вирусов в кровоток и диссеминация инфекции. Свиде тельствовать об этом может появление внелегочных поражений, РНК-емии, клинико-функциональных признаков сепсиса, современные критерии которого зафиксированы в третьем согласованном международном определении (Sepsis-3) [49].
Васкулит сопровождается массивным выходом в кровь из поврежденных органелл инфицированных эндотелиальных клеток (телец Вайбеля-Палладе) мощных факторов свертывания – VIII и VWF (Виллебранда) [50-52]. Кроме того, вирусы SARS-CoV-2 посредством рецепторов (АПФ2) [(53] или альтернативным путем [54] инфицируют тромбоциты, существенно нарушая их генетическую программу. Это выражается в морфологических и функциональных нарушениях тромбоцитов, в частности, в увеличенной экспреcсии факторов адгезии (Р-селектина), усиленной генерации тромбоксана А2, повышенной готовности тромбоцитов к адгезии и агрегации с переходом на фибриноген и коллаген, значительном увеличении числа циркулирующих в крови тромбоцитарно-лейкоцитарных агрегатов и постепенном снижении числа тромбоцитов несмотря на значительное увеличение выработки тромбопоэтина [52-54].
Тромботический микроваскулит (microCLOTS) – это самая типичная патоморфологическая форма, а легкие – наиболее частая локализация среди многообразных сосудистых поражений, вызванных COVID-19. Тромботический микроваскулит имеет диффузный и зачастую прогрессирующий характер, отягощает прогноз, выявляясь к моменту смерти почти в 100% случаев [55]. Васкулит характерен и для других острых респираторных вирусных инфекций. Но в отличие от них, в частности, от гриппа (H1N1), при COVID-19 вирусы присутствуют внутри эндотелиоцитов, приводят к деструкции их мембран, массивному окклюзирующему тромбозу альвеолярных микрососудов, почти на порядок превышающему таковой при гриппе, активному непроникающему неоваскулогенезу [56].
С внешней стороны микрососуды образованы перицитами. Эти мезенхимальные клетки, ответственные, как предполагается, за регуляцию тонуса, проницаемости (включая газообмен) и регенерацию сосудов [57], располагают сильно экспрессированными рецепторами вируса – АПФ2 [58]. Они могут инфицироваться и в результате этого погибать [59].
При COVID-19, особенно у обездвиженных пациентов с тяжелой формой этого заболевания, находящихся на ИВЛ в отделениях интенсивной терапии, чрезвычайно часто развиваются тромбозы глубоких вен нижних конечностей, причем в подобных ситуациях не только профилактические, но даже лечебные режимы антикоагулянтной терапии оказываются малоэффективными, почти неотвратимо возникают тромбоэмболии легочной артерии [60]. Мета-анализ 20 опубликованных исследований более чем у 1988 пациентов с COVID-19, как выживших, так и умерших, показал, что частота распознанных венозных тромбоэмболических осложнений в среднем составляет 31%, тромбоза глубоких вен – 20%, а тромбоэмболии легочных артерий – 19% [61]. При аутопсии же тромбоз глубоких вен выявляют в 40-60% случаев, а тромбоэмболии легочных артерий оказываются непосредственной причиной смерти у каждого третьего-пятого больного COVID-19 [62].
Артериальные тромбозы встречаются при COVID-19 тоже весьма часто, хотя, может быть, реже, чем венозные тромбоэмболии. Сейчас, в разгаре пандемии, трудно избежать неопределенности в суждениях по этому и многим другим вопросам, где требуются надежные статистические данные. Это обусловлено множеством ситуационных факторов: разнобой выборок и критериев оценок, нестабильность во всем – в базисных представлениях о происходящем, в заболеваемости, обращае мости за помощью, диагностике и лечении, в возможностях оказания такой помощи, в смертности, в состоянии экономики, психологического климата и т.д. Пандемия как социальное потрясение стало мощнейшим фактором, оказывающим влияние на структуру неинфекционной заболеваемости и смертности, подобно тому, как войны, стихийные бедствия влияют на эти процессы. В частности, на гребне роста заболеваемости COVID-19 во многих странах мира отмечены значительное снижение числа обращений за медицинской помощью по поводу инфаркта миокарда, инсульта, других сердечно-сосудистых осложнений и в то же время увеличение числа случаев смерти вне клиник, а среди тех, кто все же обратился за медицинской помощью, – доли больных с наиболее тяжелыми формами заболеваний [63-67]. Изменились логистические схемы госпитализации этих больных в связи с перепрофилированием клиник. Эти и многие другие обстоятельства могут влиять на выводы авторов о частоте артериальных тромбозов и их соотношении с венозными закупорками.
Судя по систематизированному анализу, в который были включены многие исследования, выполненные в разных странах мира (совокупно 537 наблюдений), частота артериальных тромбозов у больных COVID-19, госпитализированных в отделения интенсивной терапии, составляет 4,4%. Эти поражения локализовались в большинстве случаев в артериях нижних конечностей (39%) и в мозговых артериях (24%), реже в магистральных артериях (аорте, общей подвздошной, общей сонной артериях и в плечеголовном стволе – в 19%), в коронарных артериях (9%), верхней брыжеечной артерии (8%). Несколько артерий одновременно были тромбированы почти у каждого пятого больного [68].
В то же время, по данным крупной больничной сети в Нью-Йорке (3334 последовательных госпитализаций по поводу COVID-19), один или несколько тромботических эпизодов были отмечены у 16% больных, причем преобладали артериальные тромбозы – у 11,1% больных (у 1,6% – ишемический инсульт, у 8,9% – инфаркт миокарда, у 1,1% – иные артериальные эмболии), а венозные тромбозы наблюдались у 6,2% больных, в том числе тромбомэболия легочной артерии у 3,2% и тромбоз глубоких вен у 3,9% [69].
В основном артериальные тромбозы наблюдались у пациентов пожилого возраста с вероятными или явными преморбидными поражениями сосудов. Однако обращают на себя внимание многочисленные отдельные случаи [70-73] и серии наблюдений [74-76] больных COVID-19 молодого возраста без типичных факторов риска атеротромбоза, но с новым коронаровирусным заболеванием. В разгар пандемии весной 2020 г. отмечено 7-кратное увеличение числа госпитализаций в клиники Нью-Йорка больных в возрасте моложе 50 лет с инсультом по сравнению с тем же периодом предыдущего года [74].
Среди разнообразных патологических состояний, связанных с COVID-19, обращает на себя внимание поражение миокарда, сопровождающееся выходом в кровь тропонина из поврежденных или некротизированных кардиомиоцитов. Вероятность выявления таких повреждений зависит от чувствительности тест-систем, критериев оценки и, особенно, от клинических обстоятельств (тяжести, стадии инфекционного заболевания, сопутствующих заболеваний). Частота повреждений миокарда достигает у госпитализированных больных 38% [77], а в среднем составляет 20%, судя по данным крупного мета-анализа (26 исследований в целом примерно у 12000 пациентов) [78]. Повреждение миокарда у больных с тяжелым течением COVID-19, в том числе находящихся в отделениях интенсивной терапии, наблюдается в 13 раз чаще, чем у пациентов с нетяжелой формой заболевания [79]. Риск смерти у больных с повреждениями миокарда увеличивается примерно в 4 раза и более [80].
Причины повреждений миокарда разнообразны. В части случаев (не вполне определенной, но скорей всего не доминирующей) это коронарогенные некрозы, т.е. острые проявления ишемической болезни сердца, выступающей в качестве пре- и коморбидного состояния. У пациентов, госпитализированных в отделения интенсивной терапии, возникают вторичные (сопутствующие) повреждения, связанные со стрессом, цитокиновым штормом, гипоксией, аритмиями, сепсисом, токсическим действием лекарств и т.д., т.е. с факторами, сопутствующими тяжело протекающему инфекционному заболеванию. Обращают на себя внимание многочисленные описания при COVID-19 отдельных случаев стрессорной кардиомиопатии (тако-тсубо), которая в обычных обстоятельствах встречается очень редко. В когортном ретроспективном исследовании выявлен более чем 4-кратный прирост ее частоты [81]. Признаки такого «ковид-тсубо» в крупном международном проспективном исследовании при эхокариографии отмечены у 2% пациентов с COVID-19 [82], т.е. весьма часто, при том, что любые эхокардиографические изменения были выявлены в 55% случаев [83].
Принципиально важно обратить внимание на возможность повреждений сердца, непосредственно связанных с проникновением вируса в его ткани. Проблема инфекционных поражений сердца, не только кардита (мио-, эндо- и перикардита), но и васкулита – одна из самых актуальных и загадочных в современной кардиологии. Тем более сложно сейчас охарактеризовать эти патологические процессы в ситуации с новой вирусной инфекцией. Однако это необходимо уже потому, что немало больных умирают от фульминантного миокардита, внутрисердечного тромбоэндокардита или, наоборот, тампонады сердца.
Для понимания возможных путей проникновения вирусов в миокард и механизмов поражения его цитоструктур полезно заглянуть в недавно созданный атлас распределения рецепторов коронавируса в разнообразных клетках, представленных в сердце [84]. Эти рецепторы имеются в кардиомиоцитах, но экспрессированы в них слабо (как, впрочем, и в пневмоцитах, тем не менее подверженных инфицированию). Экспрессия АПФ2 сильнее выражена в макрофагах и максимально в перицитах, выстилающих микрососуды снаружи, но связанных со многими другими клетками, прежде всего с эндотелиоцитами. Эти клетки микрососудов и иммуноциты, по-видимому, и опосредуют инфицирование SARS-CoV-2 и играют ведущую роль в развитии миокардита [85].
Что касается фактического присутствия возбудителя (SARS-CoV-2), то в форме РНК вирус закономерно выявляется в ткани сердца в значительной части аутопсий, хотя и необязательно в сочетании с признаками миокардита [85-87]. Прижизненно вирус обнаруживают как в биоптатах эндомиокарда (на фоне явного миокардита) с помощью электронной микроскопии [88] или ПЦР, так и в перикардиальном выпоте (ПЦР) при явном перикардите [89], причем пока это уникальные наблюдения. При стандартных морфологических исследованиях отмечаются лимфоцитарно-макрофагальная и иногда эозинофильная инфильтрация, некрозы, выраженная интерстициальная отечность миокарда, проявления васкулита (эндотелиита), сопутствующего экссудативного (лимфоцитарного) перикардита [90-92]. Перикардит встречается нередко, признаки тампонады перикарда отмечены в одном из эхокардиографических исследований в 20% случаев [92]. Васкулиты (эндотелииты, периваскулиты, тромбоваскулиты) хотя и упоминаются при описании кардита у пациентов, перенесших COVID-19, не стали пока предметом глубоких исследований [90,93-95]. Впрочем, пока это можно отнести и ко многим другим аспектам обсуждаемой проблемы.
Клинические признаки миокардита довольно сложно различить в картине тяжело протекающего COVID-19, а эффективный инструментарий специфической диагностики миокардита (магнитно-резонансная томография сердца, биопсия миокарда) в красной зоне инфекционного госпиталя, как правило, недоступен. Поэтому неудивительно, что во многих случаях миокардит не распознается [90,96-98]. В то же время, судя по данным крупного когортного проспективного исследования [99], у пациентов, переживших острую стадию инфекционного процесса и выписанных из стационара, при выполнении магнитно-резонансной томографии спустя примерно 2 месяца после установления диагноза COVID-19 в 60% случаев определялись признаки воспалительного поражения миокарда. Высоко чувстви тель ным методом небольшую тропонинемию обнаруживали у 71% пациентов, причем в 5% случаев она была выраженной. Кроме того, у пациентов по сравнению с контролем была снижена фракция выброса левого желудочка и увеличены его размеры и масса. При эндомиокардиальной биопсии, выполненной у трех наиболее тяжелых пациентов из этой когорты, во всех случаях был подтвержден текущий лимфоцитарный миокардит. Важно подчеркнуть, что не только это, но и несколько других исследований показывают возможность выявления признаков кардита и присутствия вирусной РНК в миокарде после кажущегося выздоровления от COVID19 [96,97], если это заболевание было легким, протекало латентно и не было подтверждено ПЦР-анализом мазков из слизистой оболочки носоглотки [97,100]
Что касается эндокардита, то имеются лишь единичные описания бактериальных форм этой патологии, сопутствующей или осложняющей COVID-19 [101-103]. Причем отмечается запоздалое распознавание, трудности дифференциальной диагностики и заметное снижение выявляемости бактериального эндокардита в реальных условиях пандемии [104-105]. Эндокардит – лифоцитарный и тромботический (марантический) – несмотря на редкость прижизненного выявления [90,106] скорее можно считать закономерным и частым осложнением, они отмечены в 11% вскрытий [107].
Для COVID-19 характерны нарушения в гемопоэзе, морфологическом составе и функциональном состоянии клеток крови. При стандартном анализе периферической крови наиболее частым отклонением от нормы является лимфопения, которая чаще встречается у тяжелых больных с неблагоприятным прогнозом жизни [108], как правило, в сочетании с нарастающей тромбоцитопенией (о которой упоминалось при рассмотрении проблемы тромбозов), а иногда с нейтрофильным лейкоцитозом или нейтропенией. При типировании клеток у больных с таким течением заболевания «аварийные» нарушения миелопоэза, сопровождающиеся выходом в циркулирующую кровь атипичных, незрелых и аномально функционирующих моноцитов и нейтрофилов, выявляют часто [109].
Поломки в кроветворении могут быть грубыми, например, проявляться в форме гемофагоцитарного синдрома (лимфогистиоцитоза) [110-111], характеризующегося гиперпродукцией гистиоцитов и цитотоксических T-лимфоцитов, цитопениями, повреждениями тканей, лихорадкой, другими тяжелыми воспалительными явлениями и неблагоприятным прогнозом [112]. В целом это весьма редкое патологическое состояние, особенно у взрослых людей. Клинические проявления гемофагоцитарного синдрома трудно различить в картине тяжело протекающего основного заболевания, поэтому о его частоте при COVID-19 судить трудно. Однако складывается впечатление, что сосуществование синдрома и COVID-19, описанное не только в отдельных случаях, но и в сериях наблюдений, является не случайным явлением, а патогенетически обусловленной закономерностью [110,113-115].
Вопрос о причинах и механизмах развития цитотоксических повреждений, дисплазий, да и «банальных» цитопений крови имеет принципиальное значение для рассмотрения COVID-19 как системного инфекционного заболевания. Ответ на этот вопрос в публикациях, как правило, сводится к обсуждению феномена «цитокинового шторма».
В клинической картине тяжело протекающего COVID-19 обычно резко выражены симптомы инфекционного воспаления – лихорадка, ознобы, проявления интоксикации. Еще на самом раннем этапе изучения заболевания было замечено, что этим симптомам и тяжести состояния больных соответствует высокое содержание в крови и в пораженных тканях воспалительных цитокинов (интерлейкинов 1β, 2, 6, 7, 10, фак то ра некроза опухоли-α, гранулоцитного колонийстимулирующего фактора, моноцитарного хемоатрактантного протеина 1, макрофагального воспалительного протеина 1-α и т.д.), причем некоторые из них, в частности, интерлейкин 6, имеют неблагоприятное прогностическое значение [116-118]. Это послужило предпосылкой для применения иммуносупрессивных и антицитокиновых препаратов, включая глюкокортикостероиды. Возникла тенденция придавать ранее известному феномену с образным названием «цитокиновый шторм» значение чуть ли не основополагающей концепции патогенеза COVID-19. Однако феномен неспецифичен и встречается при разных заболеваниях, а концепция, охватывающая как первичные (вызванные вирусом) повреждения, так и последующие каскадные реакции на них со стороны поврежденных клеток иммунной и ряда других регуляторных систем организма, представляется слишком аморфной.
Препятствием к изучению гематоцитотоксических воздействий вируса SARS-CoV-2 было то обстоятельство, что в клетках периферической крови, как правило, не обнаруживаются вирус или его РНК, тем более репликация вирусов, да и экспрессия рецепторов к нему в целом слишком слабая. Тем временем стали появляться любопытные альтернативные факты. В эксперименте с клеточной культурой Т-лимфоцитов было показано, что эти перевиваемые клети подвержены эффективному инфицированию SARS-CoV-2 (в отличие от SARS-CoV), хотя и без последующей репликации вирусов внутри них [119]. Был выявлен и цитотоксический эффект вируса в отношении тромбоцитов, вызывающий их гиперреактивность [54,122-123]. Наконец, в самое последнее время удалось открыть несколько новых фактов, важных для понимания гематоцитотоксичности SARS-CoV-2. Экспрессия вирусных рецеп торов (АПФ2) оказывается достаточно сильной в родоначальных клетках крови, она слабее в клеткахпредшественницах и представлена в небольшом пуле периферических моноцитов. Взаимодействие S-протеина с названными клетками хотя и не приводит к проникновению вирусов в них, тем не менее, в клетках-родоначальницах/предшественницах вирус вызывает подавление колониеобразующей способности, а в периферических моноцитах запускает их трансформацию в макрофаги [124].
Желудочно-кишечный тракт поражается примерно у каждого четвертого госпитализированного (тяжелого) пациента с COVID-19 [125]. Возбудители могут проникать в кишечник в форме как внешних загрязнений, так и собственной мокроты. Они инфицируют железистые и покровные эпителиальные клетки преимущественно тонкого кишечника, находя здесь сильно экспрессированные рецепторы и другие условия для внутриклеточной репликации [126-128]. Развиваются симптомы энтерита, чаще нетяжелого. Вирусы выявляют в мазках из прямой кишки дольше, чем в мазках из рото- и носоглотки, у большинства взрослых больных – на протяжении 10 дней, но иногда и позже, особенно у получающих лечение глюкокортикостероидами и детей [129]. Описаны случаи выделения вирусов из кишечника на протяжении полутора месяцев [130].
Воспаление кишечника может носить затяжной характер, не ограничиваться кишечной стенкой, а распространяться на лимфатические пути, лимфатические узлы и кровеносные сосуды [131]. Обращают на себя внимание многочисленные описания мезентериальных ишемических осложнений у больных без иных предпосылок к их возникновению [132-135].
При новом коронавирусном заболевании довольно часто (почти у каждого второго тяжелого больного) отмечаются лабораторные признаки нетяжелой печеночно-клеточной недостаточности, что может быть связано не только с основным заболеванием, но и с преморбидными фоном, лекарственной агрессией, гипоксией [136]. Тяжелая острая печеночная недостаточность, а также гепатит с лимфоцитарной инфильтрацией и доказанным присутствием вирусных включений в ткани печени встречаются довольно редко [136-141]. Вирусы обнаруживают в воспаленном эндотелии, в эпителии желчных ходов, где экспрессия АПФ2 максимальна, но также и в гепатоцитах [139,142].
Острое повреждение почек типично для больных с тяжелым течением COVID-19 и наблюдается с частотой до 37-57% [143-144]. Развитие этого осложнения более вероятно у пациентов с исходно скомпрометированными почками и при действии ряда повреждающих факторов: гипоксия, гемодинамические нарушения, сепсис, рабдомиолиз, токсическое действие лекарств. В то же время SARS-COV-2 может играть непосредственную повреждающую роль [145,146]. Рецепторы АПФ2 в почках представлены богато и экспрессированы преимущественно в щеточной кайме проксимальных канальцев, в меньшей степени в сосудистом эндотелии, подоцитах, мезангиальных клетках, париетальных эпителиальных клетках капсулы Боумена, клетках дистальных канальцев и собирательных трубок [145,147-149]. У больных COVID-19 в названных структурах сосудистого, гломерулярного и тубулярного отделов почек при биопсийном или аутопсийном исследовании (обычно в сочетании с типичными для острого повреждения почек изменениями) были обнаружены вирусы или их РНК [39-40,84,150,151]. Показано, что SARS-COV-2 может выделяться с мочой [152-154].
Самые частые нереспираторные проявления нового коронавирусного заболевания, по-видимому, связаны с поражением возбудимых тканей – мозга, органов чувств, периферической нервной системы, мышц [155,156] и отмечаются более чем у 80% пациентов. Некоторые симптомы, например, головная боль, нарушения обоняния и вкуса, возникают рано и часто (до 90%) [157], оказываются первыми, иногда единственными и стойкими проявлениями болезни. Многие тяжелые неврологические расстройства возникают в разгаре тяжело протекающего COVID-19 или в его отдаленном периоде.
Структура «нейроковида» чрезвычайно пестрая: периферическая нейропатия, нейромиопатия, нейроваскулит, энцефалопатия, паркинсонизм, психозы, инсульт, миелит, энцефалит и т.д. В их основе лежат разные, зачастую множественные механизмы, но в основном универсальные, подобные тем, посредством которых SARS-CoV-2 вызывает повреждение легких и других органов и систем. Это механизмы нейроинвазивности (цитотоксичности), инфицирование эндотелия, воспаление и тромбоз сосудов, иммуновоспалительные (цитокиновые и аутоиммунные) повреждения.
Нейроинвазивные свойства коронавирусов науке известны давно. Еще в 1980 г. было описано их присутствие в аутопсийных образцах ткани мозга больных рассеянным склерозом [158], а в XXI веке были продемонстрированы нейроинвазивные свойства возбудителей SARS и MERS [159,160]. Нейротропность и нейроинвазивность нового коронавируса являются предметом активных исследований.
Обращают на себя внимание случаи развития нейроковида, в том числе тяжелых форм (менингит, энцефалит, миелит), без предшествующих типичных респираторных проявлений [161-163]. Это порождает вопросы о том, что же в этих случаях служит входными воротами для инфекции, каким образом возбудитель может преодолевать гематоэнцефалический барьер при гематогенной диссеминации первично респираторной инфекции? Считается, что из слизистой оболочки носоглотки по аксонам и синапсам представленных здесь нервов, в том числе обонятельного нерва [164], посредством периневральных клеток или параназальных лимфатических путей [165,166] инфекция может проникать в мозг. Имеются экспериментальные данные, позволяющие предполагать, что перенос через гематоэнцефалический барьер, а также размножение SARS-CoV-2 обеспечивают эпителиоциты сосудистого сплетения мозга, клетки, играющие роль биологического вирусного хаба-инкубатора [167,168]. Однако этот и многие другие аспекты нейроинвазивности вируса еще только предстоит изучить. А пока факт заражения мозга в основном подтверждается выявлением вирусной РНК в цереброспинальной жидкости у больных COVID-19 с острыми осложнениями в форме энцефалита или миелита [169-172]. В части подобных случаев в цереброспинальной жидкости вирусная РНК не обнаруживается, однако в ней присутствуют антитела к вирусу и избыточное количество цитокинов (нейрокинов) [173,174]. Обращает на себя внимание описание при микроглиоза, вероятно, связанных с цитокиновыми нарушениями [175]. Наконец, необходимо отметить, что и COVID-19 в целом, и нейроковид, в частности, сопряжены с опасностью развития аутоиммунных расстройств. Это выражается в том, что у тяжелых больных довольно часто появляются антифосфолипидные аутоантитела в крови [176,177], а спорадически развиваются тяжелые клинические нарушения, в том числе тромбозы прецеребальных артерий, инсульт [178,179], демиелинизирующие нейропатические синдромы – Guillain-Barré и Miller-Fisher [180,181]. осложненном течении COVID-19 феномена нейронофагии и
COVID-19 может сопровождаться кожными симптомами, иногда довольно выраженными и стойкими: высыпания (эриматозно-папулезно-везикулярные), кожная пурпура, сетчатое ливедо или акральные синюшные пятна, как при обморожениях [182]. При исследованиях биоптатов измененной кожи установлено, что субстратом является тромботический васкулит с присутствием в пораженных эндотелии SARS-CoV-2 (эндотелиит) [40,183-184]. Встречается поражение слизистых оболочек рта, уретры и глаз [185-187].
Новое коронавирусное заболевание не прекращает поражать многоликостью. В потоке тревожных новостей, появлявшихся в конце первого полугодия пандемии, обратили на себя внимание сообщения из разных стран мира о вспышках необычного заболевания у детей [188-192]. В Великобритании оно было описано под названием «педиатрический синдром мультисистемного воспаления у детей, по времени совпадающий с SARS-CoV-2» (Paediatric Multisystem Inflammatory Syndrome temporally associated with SARS-CoV-2, PIMSTS), в США – «мультисистемный воспалительный синдром у детей» (Multisystem Inflammatory Syndrome in Children – MIS-C). В некоторых странах его стали называть «кавасаки-подобным заболеванием». Позже появилось и все чаще используется краткое обозначение «кава-ковид». Картина заболевания, «вспыхнувшего» у детей, напоминала болезнь Кавасаки. Это тяжелое заболевание, встречающееся в возрасте до 5 лет, является системным васкулитом неизвестной этиологии с вовлечением артерий мелкого и среднего калибра и проявлениями со стороны многих органов и тканей (сердца, кожи, слизистых облочек, глаз, респираторной системы, желудочно-кишечного тракта и т.д.), а также выраженной воспалительной активностью [193].
В начале пандемии считалось, что новым коронавирусным заболеванием дети и юноши заражаются чрезвычайно редко, составляя лишь 1% совокупности диагностированных случаев [194]. Однако в сериях наблюдений кава-ковида в подавляющем большинстве случаев имелись лабораторные подтверждения данной инфекции. Поэтому вспышки COVID-19 у детей, тем более с такой тяжелой симптоматикой, и вызвали удивление и беспокойство. Позже, в том числе благодаря изучению кава-ковида, было установлено, что в действительности речь идет о редком распознавании заболевания из-за стертости клинической картины, в частности, респираторных симптомов у большинства пациентов этой возрастной группы, а не о неподверженности детей заражению SARS-CoV-2. Хотя летальные исходы у детей крайне маловероятны, тяжелое течение заболевания (в том числе с выраженным воспалением и нереспираторными проявлениями) у них вполне возможно [195-197], более того, встречается даже чаще, чем при гриппе [196].
Лишь некоторые описанные клинические наблюдения кава-ковида из педиатрической практики полностью соответствуют критериям болезни Кавасаки, в частности, возрастному критерию – до 5 лет, многие юные пациенты все же старше [188-192]. Более того, становится очевидным, что случаи заболевания COVID-19 с выраженной воспалительной симптоматикой, множественными респираторными и нереспираторными клиническими проявлениями, наблюдаемые у взрослых пациентов [198], во многом напоминают каваковид у детей. Поэтому и у детей, и у взрослых имеет место коронавирусная болезнь с теми или иными системными проявлениями, описанию и систематизации которых и был посвящен этот обзор.
Итак, новое коронавирусное заболевание COVID-19 обычно проявляется нетяжелой локальной (респираторной) симптоматикой, а иногда (чаще у детей) протекает латентно. При таком спокойном начале инфекционного процесса существует опасность его трансформации в тяжелое системное заболевание с вовлечением не только дыхательной, но и ряда других систем организма и развитием сепсиса.
По современным представлениям, ключевым моментом заражения, развития локальной инфекции, трансформации в системное тяжело протекающее заболевание является взаимодействие S-протеина вируса с рецептором наружной мембраны клеток пациента. Это приводит к проникновению вируса в клетки, что создает условия для репликации и вызывает развитие некроза или только нарушения специфических клеточных функций и апоптоза.
Широкое анатомическое представительство рецепторов обеспечивает альтернативность путей первичного заражения и генерализации инфекционного процесса. Типичным сценарием перехода от локальной к системной форме заболевания является транслокация инфекционного процесса в альвеолах легких: вирусы выходят за пределы пневмоцитов и заражают перициты и эндотелиоциты альвеолярных микрососудов, а после их разрушения проникают в циркулирующую кровь. Вирусемия сопровождается тромботическим васкулитом и метастазированием инфекции в органы, развивается вирусный сепсис. Таким представляется сценарий тяжелого течения заболевания COVID-19 с респираторными и экстрапульмональными системными проявлениями и тревожным прогнозом.
Используемые источники
- World Health Organization. Summary of probable SARS cases with onset of illness from 1 November 2002 to 31 July 2003, https: //www.who.int/csr/sars/country/table2004_04_21/en/ (2003, accessed 28 March 2020).
- World Health Organization. Middle East respiratory syndrome coronavirus (MERS-CoV). MERS Monthly Summary, November 2019, http: //www.who.int/emergencies/mers-cov/en/ (2019, accessed 27 March 2020).
- Lu R, Zhao X, Li J, et al. Genomic characterization and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding. Lancet 2020;395(10224):565-74.
- Zhu N, Zhang D, Wang W, et al. A novel coronavirus from patients with pneumonia in China, 2019. N Engl J Med 2020;382:727-33.
- Zhou P, Yang XL, Wang XG, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature 2020;579:270-3.
- Lam TT, Shum MH, Zhu HC, et al. Identifying SARS-CoV-2 related coronaviruses in Malayan pangolins. Nature 2020;583(7815):282-5.
- Li Q, Guan X, Wu P, et al. Early transmission dynamics in Wuhan, China, of novel Coronavirus-infected pneumonia. N Engl J Med 2020;382:1199-207.
- Wang H, Wang Z, Dong Y, et al. Phase-adjusted estimation of the number of Coronavirus Disease 2019 cases in Wuhan, China. Cell Discov 2020;6:10.
- Wu Z, McGoogan JM. Characteristics of and important lessons from the Coronavirus Disease 2019 (COVID-19) outbreak in China: Summary of a report of 72 314 cases from the Chinese Center for Disease Control and Prevention. JAMA 2020;323(13):1239-42.
- Guan WJ, Ni ZY, Hu Y, et al. Clinical characteristics of coronavirus disease 2019 in China. N Engl J Med 2020;382(18):1708-20.
- Borobia AM, Carcas AJ, Arnalich F, et al. A cohort of patients with COVID-19 in a major teaching hospital in Europe. J Clin Med 2020;9(6):1733.
- Yang X, Yu Y, Xu J, et al. Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study. Lancet Respir Med 2020;8(5):475-81.
- Verity R, Okell LC, Dorigatti I, et al. Estimates of the severity of coronavirus disease 2019: a model-based analysis Lancet Infect Dis 2020;20(6):669-77.
- Kang H, Wang Y, Tong Z, et al. Retest positive for SARS-CoV-2 RNA of “recovered” patients with COVID-19: Persistence, sampling issues, or re-infection? J Med Virol 2020:92(11):2263-5.
- Kang H, Bernabei R, Landi F; et al. Persistent symptoms in patients after acute COVID-19. JAMA 2020;324(6):603-5.
- Wang X, Zhou Y, Jiang N, et al. Persistence of intestinal SARS-CoV-2 infection in patients with COVID-19 leads to re-admission after pneumonia resolved. Int J Infect Dis 2020:433-35.
- Kreutz R, Algharably EAE, Azizi M, et al. Hypertension, the renin-angiotensin system, and the risk of lower respiratory tract infections and lung injury: implications for COVID-19. Cardiovasc Res 2020;116:1688-99.
- Lu R, Zhao X, Li J, et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding. Lancet 2020;395:565-74.
- Hoffmann M, Kleine-Weber H, Schroeder S, et al. SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease inhibitor. Cell 2020;181(2):271-80.
- Wrapp D, Wang N, Corbett KS, et al. Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation. Science 2020;367(6483):1260-3.
- Devaux CA, Rolain JM, Raoult D. ACE2 receptor polymorphism: Susceptibility to SARS-CoV-2, hypertension, multi-organ failure, and COVID-19 disease outcome. J Microbiol Immunol Infect 2020;53(3):425-35.
- Ghazizadeh Z, Majd H, Richter M, et al. Androgen regulates SARS-CoV-2 receptor levels and is associated with severe COVID-19 symptoms in men. bioRxiv 2020;2020.05.12.091082.
- Lippi G, Lavie CJ, Henry BM, et al. Do genetic polymorphisms in angiotensin converting enzyme 2 (ACE2) gene play a role in coronavirus disease 2019 (COVID-19)? Clin Chem Lab Med 2020;58(9):1415-22
- Jutzeler CR, Bourguignon L, Weis CV, et al. Comorbidities, clinical signs and symptoms, laboratory findings, imaging features, treatment strategies, and outcomes in adult and pediatric patients with COVID-19: A systematic review and meta-analysis. Travel Med Infect Dis 2020;37:101825.
- Grasselli G, Zangrillo A, Zanella A, et al. Baseline characteristics and outcomes of 1591 patients Iinfected with SARS-CoV-2 admitted to ICUs of the Lombardy region, Italy. JAMA 2020;323:32250385.
- Gemmati D, Bramanti B, Serino ML, et al. COVID-19 and individual genetic susceptibility/receptivity: role of ACE1/ACE2 genes, immunity, inflammation and coagulation. Might the double X-chromosome in females be protective against SARS-CoV-2 compared to the single X-chromosome in males? Int J Mol Sci 2020;21(10):3474.
- Li MY, Li L, Zhang Y, Wang XS. Expression of the SARS-CoV-2 cell receptor gene ACE2 in a wide variety of human tissues. Infect Dis Poverty 2020;9(1):45.
- Algharably EAE, Azizi M, Dobrowolski P, et al. Hypertension, the reninangiotensin system, and the risk of lower respiratory tract infections and lung injury: implications for COVID-19. Cardiovasc Res 2020;116(10):1688-99.
- Pinto BGG, Oliveira AER, Singh Y, et al. ACE2 expression is increased in the lungs of patients with comorbidities associated with severe COVID-19. J Infect Dis 2020;222(4):556-3.
- Aguiar JA, Tremblay BJ, Mansfield MJ, et al. Gene expression and in situ protein profiling of candidate SARS-CoV-2 receptors in human airway epithelial cells and lung tissue. Eur Respir J 2020;56(3):2001123.
- Leonardi A, Rosani U, Brun P. Ocular surface expression of SARS-CoV-2 receptors. Ocul Immunol Inflamm 2020;28(5):735-8.
- Mitchell S, Vargas J, Hoffmann A. Signaling via the NFκB system. Wiley Interdiscip Rev Syst Biol Med 2016;8(3):227-41.
- ARDS Definition Task Force, Ranieri VM, Rubenfeld GD, et al. Acute respiratory distress syndrome: the Berlin Definition. JAMA 2012;307(23):2526-33.
- Gattinoni L, Chiumello D, Caironi P, et al. COVID-19 pneumonia: different respiratory treatments for different phenotypes? Intensive Care Med 2020;46(6): 1099-102.
- Grasselli G, Tonetti T, Protti A, et al. Pathophysiology of COVID-19-associated acute respiratory distress syndrome: a multicentre prospective observational study. Lancet Respir Med 2020:S2213-2600(20)30370-2.
- Marini JJ, Gattinoni L. Management of COVID-19 respiratory distress. JAMA 2020;323(22):2329-30.
- Li X, Ma X. Acute respiratory failure in COVID-19: is it «typical» ARDS? Crit Care 2020;24(1):198.
- Ciceri F, Beretta L, Scandroglio AM, et al. Microvascular COVID-19 lung vessels obstructive thromboinflammatory syndrome (MicroCLOTS): an atypical acuterespiratory distress syndrome working hypothesis. Crit Care Resusc 2020;22:95-7.
- Remmelink M, De Mendonça R, et al. Unspecific post-mortem findings despite multiorgan viral spread in COVID-19 patients. Crit Care 2020;24(1):495.
- Varga Z, Flammer AJ, Steiger P, et al. Endothelial cell infection and endotheliitis in COVID-19. Lancet 2020;395(10234):1417-8.
- Li H, Liu L, Zhang D, et al. SARS-CoV-2 and viral sepsis: observations and hypotheses. Lancet 2020;395:1517-20.
- Santonja C, Heras F, Núñez L, et al. COVID-19 chilblain-like lesion: immunohistochemical demonstration of SARS-CoV-2 spike protein in blood vessel endothelium and sweat gland epithelium in a polymerase chain reaction-negative patient. Br J Dermatol 2020;183(4):778-80.
- Colmenero I, Santonja C, et al. SARS-CoV-2 endothelial infection causes COVID-19 chilblains: histopathological, immunohistochemical and ultraestructural study of 7 paediatric cases. Br J Dermatol 2020;183(4):729-37.
- Huang C, Wang Y, Li X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet 2020;395:497-506.
- Chen W, Lan Y, Yuan X, et al. Detectable 2019-nCoV viral RNA in blood is a strong indicator for the further clinical severity. Emerg Microbes Infect 2020; 9(1):469-73.
- Eberhardt KA, Meyer-Schwickerath C, Heger E, et al. RNAemia corresponds to disease severity and antibody response in hospitalized COVID-19 patients. Viruses 2020;12(9):E1045.
- Veyer D, Kernéis S, Poulet G, et al. Highly sensitive quantification of plasma SARS-CoV-2 RNA shelds light on its potential clinical value. Clin Infect Dis 2020 Aug 17:ciaa1196.
- Hogan CA, Stevens BA, Sahoo MK, et al. High frequency of SARS-CoV-2 RNAemia and association with severe disease. Clin Infect Dis 2020 Sep 23:ciaa1054.
- Singer M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 2016;315(8): 801-10.
- Escher R, Breakey N, Lämmle B. Severe COVID-19 infection associated with endothelial activation. Thromb Res 2020;190:62.
- Escher R, Breakey N, Lämmle B. ADAMTS13 activity, von Willebrand factor, factor VIII and D-dimers in COVID-19 inpatients. Thromb Res 2020;192:174-5.
- Goshua G, Pine AB, Meizlish ML, et al. Endotheliopathy in COVID-19-associated coagulopathy: evidence from a single-centre, cross-sectional study. Lancet Haematol 2020;7(8):e575-82.
- Zhang S, Liu Y, Wang X, et al. SARS-CoV-2 binds platelet ACE2 to enhance thrombosis in COVID-19. J Hematol Oncol 2020;13(1):120.
- Manne BK, Denorme F, Middleton EA, et al. Platelet gene expression and function in patients with COVID-19. Blood 2020;136(11):1317-29.
- Lax SF, Skok K, Zechner P, et al. Pulmonary arterial thrombosis in COVID-19 with fatal outcome: results from a prospective, single-center, clinicopathologic case series. Ann Int Med 2020:73(5):350-61.
- Ackermann M, Verleden SE, Kuehnel M, et al. Pulmonary vascular endothelialitis, thrombosis, and angiogenesis in Covid-19. N Engl J Med 2020;383(2):120-8.
- Hung CF, Wilson CL, Schnapp LM. Pericytes in the lung. Adv Exp Med Biol 2019;1122:41-58.
- Chen L, Li X, Chen M, Feng Y, et al. The ACE2 expression in human heart indicates new potential mechanism of heart injury among patients infected with SARS-CoV-2. Cardiovasc Res 2020;116(6):1097-100.
- Cardot-Leccia N, Hubiche T, Dellamonica J, et al. Pericyte alteration sheds light on micro-vasculopathy in COVID-19 infection. Intensive Care Med 2020;46: 1777-8.
- Llitjos JF, Leclerc M, Chochois C, et al. High incidence of venous thromboembolic events in anticoagulated severe COVID-19 patients. J Thromb Haemost 2020;18:1743-6.
- Di Minno A, Ambrosino P, Calcaterra I, et al. COVID-19 and venous thromboembolism: A meta-analysis of literature studies. Semin Thromb Hemost 2020; 46(7):763-771.
- Wichmann D, Sperhake JP, Lütgehetmann M, et al. Autopsy findings and venous thromboembolism in patients with COVID-19: A prospective cohort study. Ann Intern Med 2020;173(4):268-77.
- Bhatt AS, Moscone A, McElrath EE, et al. Fewer hospitalizations for acute cardiovascular conditions during the COVID-19 pandemic. J Am Coll Cardiol 2020; 76(3):280-8.
- Diegoli H, Magalhães PSC, Martins SCO, et al. Decrease in hospital admissions for transient ischemic attack, mild, and moderate stroke during the COVID-19 era. Stroke 2020;51(8):2315-21.
- Mafham MM, Spata E, Goldacre R, et al. COVID-19 pandemic and admission rates for and management of acute coronary syndromes in England. Lancet 2020;396(10248):381-9.
- Settelmeier S, Rassaf T, Giannitsis E, et al. Capacity changes in German certified chest pain units during COVID-19 outbreak response. Clin Res Cardiol 2020:109(12):1469-75.
- Zaleski AL, Taylor BA, McKay RG, et al. Declines in acute cardiovascular emergencies during the COVID-19 pandemic. Am J Cardiol 2020;129:124-5.
- Cheruiyot I, Kipkorir V, Ngure B, et al. Arterial thrombosis in Coronavirus Disease 2019 patients: A rapid systematic review. Ann Vasc Surg 2020:70:273-81.
- Bilaloglu S, Aphinyanaphongs Y, et al. Thrombosis in hospitalized patients with COVID-19 in a New York City health system. JAMA 2020;324(8):799-801.
- Alkhaibary A, Abbas M, Ahmed ME, et al. Common carotid artery occlusion in a young patient: can large-vessel stroke be the initial clinical manifestation of Coronavirus Disease 2019? World Neurosurg 2020;144:140-2.
- Fara MG, Stein LK, Skliut M, et al. Macrothrombosis and stroke in patients with mild Covid-19 infection. J Thromb Haemost 2020;18(8):2031-3.
- Gunasekaran K, Amoah K, Rajasurya V, et al. Stroke in a young COVID-19 patient. QJM 2020;113(8):573-4.
- Veyre F, Poulain-Veyre C, Esparcieux A, et al. Femoral arterial thrombosis in a young adult after nonsevere COVID-19. Ann Vasc Surg 2020:69:85-8
- Oxley TJ, Mocco J, Majidi S, et al. Large-vessel stroke as a presenting feature of Covid-19 in the Young. N Engl J Med 2020;382(20):e60.
- Taylor BES, Khandelwal P, Rallo MS. Outcomes and spectrum of major neurovascular events among COVID-19 patients: a 3-center experience. Neurosurg Open 2020;1.13
- Khan M, Ibrahim RH, Siddiqi SA, et al. COVID-19 and acute ischemic stroke A case series from Dubai, UAE. Int J Stroke 2020;15(6):699-700.
- Gemcioglu E, Erden A, Davutoglu M, et al. Acute ischemic stroke in a lupus anticoagulant-positive woman with COVID-19. J Clin Rheumatol 2020;26(6):236-7.
- Deng Q, Hu B, Zhang Y, et al. Suspected myocardial injury in patients with COVID-19: Evidence from front-line clinical observation in Wuhan, China. Int J Cardiol 2020;311:116-21.
- Bavishi C, Bonow RO, Trivedi V, et al. Acute myocardial injury in patients hospitalized with COVID-19 infection: A review. Prog Cardiovasc Dis 2020;63(5): 682-9.
- Li B, Yang J, Zhao F, et al. Prevalence and impact of cardiovascular metabolic diseases on COVID-19 in China. Clin Res Cardiol 2020;109(5):531-8.
- Shi S, Qin M, et al. Association of cardiac injury with mortality in hospitalized patients with COVID-19 in Wuhan, China. JAMA Cardiol 2020;5:802-10.
- Jabri A, Kalra A, Kumar A, et al. Incidence of stress cardiomyopathy during the Coronavirus Disease 2019 pandemic. JAMA Netw Open 2020;3(7):e2014780.
- Koutroumpakis E, Taylor T, Damaraju S, et al. “Covidsubo”: stress-induced cardiomyopathy by novel Coronavirus Disease 2019. Cardiology 2020 Sep 28:1-5.
- Dweck M, Bularga A, Hahn RT, et al. Global evaluation of echocardiography in patients with COVID-19. Eur Heart J Cardiovasc Imaging 2020;21(9):949-58.
- Chen L, Li X, Chen M, Feng Y, et al. The ACE2 expression in human heart indicates new potential mechanism of heart injury among patients infected with SARS-CoV-2. Cardiovasc Res 2020;16(6):1097-100.
- Bradley BT, Maioli H, Johnston R, et al. Histopathology and ultrastructural findings of fatal COVID-19 infections in Washington State: a case series. Lancet 2020;396(10247):320-32.
- Sekulic M, Harper H, Nezami BG, et al. Molecular detection of SARS-CoV-2 infection in FFPE samples and histopathologic findings in fatal SARS-CoV-2 cases. Am J Clin Pathol 2020;154(2):190-200.
- Lindner D, Fitzek A, Bräuninger H, et al. Association of cardiac infection with SARS-CoV-2 in confirmed COVID-19 autopsy cases. JAMA Cardiol 2020: e203551.
- Tavazzi G, Pellegrini C, Maurelli M, et al. Myocardial localization of coronavirus in COVID-19 cardiogenic shock. Eur J Heart Fail 2020;22(5):911-5.
- Farina A, Uccello G, Spreafico M, et al. SARS-CoV-2 detection in the pericardial fluid of a patient with cardiac tamponade. Eur J Intern Med 2020;76:100-1.
- Коган Е.А., Березовский Ю.С., Куклева А.Д. и др. Лимфоцитарный миокардит у пациентов с COVID-19. Архив патологии 2020;82(5):57-62. [Kogan EA, Berezovsky YS, Kukleva AD, et al. Lymphocytic myocarditis in patients with COVID-19 (4 autopsy cases)]. Arkh Patol 2020;82(5):57-62 (In Russ.)].
- Коган Е.А., Березовский Ю.С., Благова О.В. и др. Миокардит у пациентов с COVID-19, подтвержденный результатами иммуногистохимического исследования. Кардиология 2020;60(7):4-10 [Kogan EA, Berezovskiy YuS, Blagova OV, et al. Miocarditis in patients with COVID-19 confirmed by immunohistochemical study. Kardiologiia 2020;60(7):4-10 (In Russ.)].
- Ho JS, Sia CH, Chan MY, et al. Coronavirus-induced myocarditis: A meta-summary of cases. Heart Lung 2020; 49(6):681-5.
- Sawalha K, Abozenah M, Kadado AJ, et al. Systematic review of COVID-19 related myocarditis: Insights on management and outcome. Cardiovasc Revasc Med 2020:S1553-8389(20)30497-8.
- Jacobs W, Lammens M, Kerckhofs A, et al. Fatal lymphocytic cardiac damage in coronavirus disease 2019 (COVID-19): autopsy reveals a ferroptosis signature. ESC Heart Fail 2020:7(6):3772-81.
- Buja LM, Wolf DA, Zhao B, et al. The emerging spectrum of cardiopulmonary pathology of the coronavirus disease 2019 (COVID-19): Report of 3 autopsies from Houston, Texas, and review of autopsy findings from other United States cities. Cardiovasc Pathol 2020;48:107233.
- Fox SE, Li G, Akmatbekov A, Harbert JL, et al. Unexpected features of cardiac pathology in COVID-19 infection. Circulation 2020;142(11):1123-5.
- Pietsch H, Escher F, Aleshcheva G, et al. Proof of SARS-CoV-2 genomes in endomyocardial biopsy with latency after acute infection. Int J Infect Dis 2020:102:70-2.
- Clark DE, Parikh A, Dendy JM, et al. COVID-19 myocardial pathology evaluated through screening cardiac magnetic resonance (COMPETE CMR). medRxiv [Preprint] 2020:2020.08.31.20185140.
- Kariyanna PT, Sutarjono B, Grewal E, et al. A systematic review of COVID-19 and myocarditis. Am J Med Case Rep 2020;8(9):299-305.
- Puntmann VO, Carerj ML, Wieters I, et al. Outcomes of cardiovascular magnetic resonance imaging in patients recently recovered from Coronavirus Disease 2019 (COVID-19). JAMA Cardiol 2020:e203557.
- Wenzel P, Kopp S, Göbel S, et al. Evidence of SARS-CoV-2 mRNA in endomyocardial biopsies of patients with clinically suspected myocarditis tested negative for COVID-19 in nasopharyngeal swab. Cardiovasc Res 2020;116(10):1661-3.
- Amir M, Djaharuddin I, Sudharsono A, et al. COVID-19 concomitant with infective endocarditis: A case report and review of management. Int J Infect Dis 2020; 98:109-12.
- Garatti A, Castelvecchio S, Daprati A, et al. Clinical course of COVID-19 infection in patients urgently operated of cardiac surgical procedures. Ann Surg 2020;272(4):e275-9.
- Sanders DJ, Sutter JS, Tatooles A, et al. Endocarditis complicated by severe aortic insufficiency in a patient with COVID-19: diagnostic and management implications. Case Rep Cardiol 2020;2020:8844255.
- Cosyns B, Motoc A, Arregle F, et al. A plea not to forget infective endocarditis in COVID-19 era. JACC Cardiovasc Imaging 2020:3(11):2470-1.
- Van Camp G, De Beenhouwer H, Beles M, et al. Disturbing effect of lockdown for COVID-19 on the incidence of infective endocarditis: a word of caution. Clin Res Cardiol 2020:109(12):1573-76.
- Balata D, Mellergård J, Ekqvist D, et al. Non-bacterial thrombotic endocarditis: A presentation of COVID-19. Eur J Case Rep Intern Med 2020;7(8):001811.
- Hanley B, Naresh KN, Roufosse C, et al. Histopathological findings and viral tropism in UK patients with severe fatal COVID-19: a post-mortem study. Lancet Microbe 2020t;1(6):e245-53.
- Huang I, Pranata R. Lymphopenia in severe coronavirus disease-2019 (COVID19): systematic review and meta-analysis. J Intensive Care 2020;8:36.
- Schulte-Schrepping J, Reusch N, Paclik D, et al. Severe COVID-19 is marked by a dysregulated myeloid cell compartment. Cell 2020;182(6):1419-40. 14
- Prilutskiy A, Kritselis M, Shevtsov A, et al. SARS-CoV-2 infection-associated hemophagocytic lymphohistiocytosis. Am J Clin Pathol 2020;154(4):466-74.
- Hayden A, Park S, Giustini D, et al. Hemophagocytic syndromes (HPSs) including hemophagocytic lymphohistiocytosis (HLH) in adults: A systematic scoping review. Blood Rev 2016;30(6):411-20.
- Quan C, Li C, Ma H, Li Y, Zhang H. Immunopathogenesis of coronavirusinduced acute respiratory distress syndrome (ARDS): potential infection-associated hemophagocytic lymphohistiocytosis. Clin Microbiol Rev 2020;34:e00074-20.
- Prieto-Pérez L, Fortes J, Soto C, et al. Histiocytic hyperplasia with hemophagocytosis and acute alveolar damage in COVID-19 infection. Mod Pathol 2020; 33(11)2139-46.
- Soy M, Atagündüz P, Atagündüz I, et al. Hemophagocytic lymphohistiocytosis: a review inspired by the COVID-19 pandemic. Rheumatol Int 2020:1–12.
- Bhaskar S, Sinha A, Banach M, et al. Cytokine storm in COVID-19-immuno pathological mechanisms, clinical considerations, and therapeutic approaches: the REPROGRAM Consortium position paper. Front Immunol 2020;11:1648.
- Hojyo S, Uchida M, Tanaka K, et al. How COVID-19 induces cytokine storm with high mortality. Inflamm Regen 2020;40:37.
- Tang Y, Liu J, Zhang D, et al. Cytokine storm in COVID-19: the current evidence and treatment strategies. Front Immunol 2020;11:1708.
- Wang X, Xu W, Hu G, et al. SARS-CoV-2 infects T lymphocytes through its spike protein-mediated membrane fusion. Cell Mol Immunol 2020;1-3.
- Zhang S, Liu Y, Wang X, et al. SARS-CoV-2 binds platelet ACE2 to enhance thrombosis in COVID-19. J Hematol Oncol 2020;13(1):120.
- Koupenova M, Freedman JE. Platelets and COVID-19: inflammation, hyperactivation and additional questions. Circ Res 2020;127(11):1419-21.
- Zhang S, Liu Y, Wang X, et al. SARS-CoV-2 binds platelet ACE2 to enhance thrombosis in COVID-19. J Hematol Oncol 2020; 13(1):120.
- Ropa J, Cooper S, Capitano ML, et al. Human hematopoietic stem, progenitor, and immune cells respond ex vivo to SARS-CoV-2 spike protein. Stem Cell Rev Rep 2020:1–13.
- Ferm S, Fisher C, Pakala T, et al. Analysis of gastrointestinal and hepatic manifestations of SARS-CoV-2 infection in 892 patients in Queens, NY. Clin Gastroenterol Hepatol 2020;18(10):2378-9.
- Gu J, Han B, Wang J. COVID-19: gastrointestinal manifestations and potential fecal-oral transmission. Gastroenterology 2020;158(6):1518-9.
- Zhang H, Li HB, Lyu JR, et al. Specific ACE2 expression in small intestinal enterocytes may cause gastrointestinal symptoms and injury after 2019-nCoV infection. Int J Infect Dis 2020;96:19-24.
- Lamers MM, Beumer J, van der Vaart J, et al. SARS-CoV-2 productively infects human gut enterocytes. Science 2020; 369(6499):50-4.
- Ling Y, Xu SB, Lin YX, et al. Persistence and clearance of viral RNA in 2019 novel coronavirus disease rehabilitation patients. Chin Med J (Engl) 2020;133(9): 1039-43.
- Wu Y, Guo C, Tang L, et al. Prolonged presence of SARS-CoV-2 viral RNA in faecal samples. Lancet Gastroenterol Hepatol 2020;5(5):434-5.
- Mönkemüller K, Fry L, Rickes S. COVID-19, coronavirus, SARS-CoV-2 and the small bowel. Rev Esp Enferm Dig 2020;112(5):383-8.
- Vartanoglu Aktokmakyan T, Tokocin M, Meric S, et al. Is mesenteric ischemia in COVID-19 patients a surprise? Surg Innov 2020:1553350620962892.
- Stahl K, Bräsen JH, Hoeper MM, et al. Direct evidence of SARS-CoV-2 in gut endothelium. Intensive Care Med 2020;46(11):2081-2.
- Cheung S, Quiwa JC, Pillai A, et al. Superior mesenteric artery thrombosis and acute intestinal ischemia as a consequence of COVID-19 infection. Am J Case Rep 2020;21:e925753.
- Parry AH, Wani AH, Yaseen M. Acute mesenteric ischemia in severe Coronavirus-19 (COVID-19): possible mechanisms and diagnostic pathway. Acad Radiol 2020;27(8):1190.
- Polak SB, Van Gool IC, Cohen D, et al. A systematic review of pathological findings in COVID-19: a pathophysiological timeline and possible mechanisms of disease progression. Mod Pathol 2020;1-11.
- Tian Y, Rong L, Nian W, et al. Review article: gastrointestinal features in COVID-19 and the possibility of faecal transmission. Aliment Pharmacol Ther 2020;51(9):843-51.
- Wichmann D, Sperhake JP, Lütgehetmann M, et al. Autopsy findings and venous thromboembolism in patients with COVID-19: a prospective cohort study. Ann Intern Med 2020;173(4):268-77.
- Wang Y, Liu S, et al. SARS-CoV-2 infection of the liver directly contributes to hepatic impairment in patients with COVID-19. J Hepatol 2020;73: 807-16.
- Sonzogni A, Previtali G, Seghezzi M, et al. Liver histopathology in severe COVID 19 respiratory failure is suggestive of vascular alterations. Liver Int 2020;40(9): 2110-6.
- Melquist S, Estepp K, Aleksandrovich Y, et al. COVID-19 presenting as fulminant hepatic failure: A case report. Medicine (Baltimore) 2020;99(43):e22818.
- Fiel MI, El Jamal SM, Paniz-Mondolfi A, et al. Findings of severe hepatic SARSCoV-2 Infection. Cell Mol Gastroenterol Hepatol 2020:S2352-345X(20)30158-2.
- Hirsch JS, Ng JH, Ross DW, et al. Acute kidney injury in patients hospitalized with COVID-19. Kidney Int 2020;98(1):209-18.
- Fisher M, Neugarten J, Bellin E, et al. AKI in hospitalized patients with and without COVID-19: a comparison study. J Am Soc Nephrol 2020;31(9):2145-57.
- Martinez-Rojas MA, Vega-Vega O, Bobadilla NA. Is the kidney a target of SARSCoV-2? Am J Physiol Renal Physiol 2020;318(6):F1454-62.
- Hassanein M, Radhakrishnan Y, Sedor J, et al. COVID-19 and the kidney. Cleve Clin J Med 2020;87(10):619-31.
- Hamming I, Timens W, Bulthuis ML, et al. Tissue distribution of ACE2 protein, the functional receptor for SARS coronavirus. A first step in understanding SARS pathogenesis. J Pathol 2004;203(2):631-7.
- Mizuiri S, Ohashi Y. ACE and ACE2 in kidney disease. World J Nephrol 2015; 4:74-82.
- Ye M, Wysocki J, William J, et al. Glomerular localization and expression of Angiotensin-converting enzyme 2 and Angiotensin-converting enzyme: implications for albuminuria in diabetes. J Am Soc Nephrol 2006;17(11):3067-75.
- Menter T, Haslbauer JD, Nienhold R, et al. Postmortem examination of COVID19 patients reveals diffuse alveolar damage with severe capillary congestion and variegated findings in lungs and other organs suggesting vascular dysfunction. Histopathology 2020;77(2):198–209.
- Su H, Yang M, Wan C, et al. Renal histopathological analysis of 26 postmortem findings of patients with COVID-19 in China. Kidney Int 2020;98(1):219-27.
- Peng L, Liu J, Xu W, et al. SARS-CoV-2 can be detected in urine, blood, anal swabs, and oropharyngeal swabs specimens. J Med Virol 2020:92(9):1676-80.
- Sun J, Zhu A, Li H, et al. Isolation of infectious SARS-CoV-2 from urine of a COVID-19 patient. Emerg Microbes Infect 2020;9(1):991-3.
- Kim JM, Kim HM, Lee EJ, et al. Detection and isolation of SARS-CoV-2 in serum, urine, and stool specimens of COVID-19 patients from the Republic of Korea. Osong Public Health Res Perspect 2020;11(3):112-7.
- Mao L, Jin H, Wang M, et al. Neurologic manifestations of hospitalized patients with Coronavirus Disease 2019 in Wuhan, China. JAMA Neurol 2020;77:683-90.
- Helms J, Kremer S, Merdji H, et al. Neurologic features in severe SARS-CoV-2 infection. N Engl J Med 2020; 382(23):2268-70.
- Lechien JR, Chiesa-Estomba CM, De Siati DR, et al. Olfactory and gustatory dysfunctions as a clinical presentation of mild-to-moderate forms of the coronavirus disease (COVID-19): a multicenter European study. Eur Arch Otorhinolaryngol 2020;277(8):2251-61.
- Burks J, DeVald B, Jankovsky LD, et al. Two coronaviruses isolated from central nervous system tissue of two multiple sclerosis patients. Science 1980;209:933-4.
- Ding Y, He L, Zhang Q, Huang Z, et al. Organ distribution of severe acute respiratory syndrome (SARS) associated coronavirus (SARS-CoV) in SARS patients: implications for pathogenesis and virus transmission pathways. J Pathol 2004; 203(2):622-30.
- Li Z, He W, Lan Y, et al. The evidence of porcine hemagglutinating encephalo mye litis virus induced nonsuppurative encephalitis as the cause of death in piglets. Peer J 2016;4:e2443.
- Bodro M, Compta Y, Llansó L, et al. Increased CSF levels of IL-1β, IL-6, and ACE in SARS-CoV-2-associated encephalitis. Neurol Neuroimmunol Neuro inflamm 2020;7(5):e821.
- Naz S, Hanif M, Haider MA, et al. Meningitis as an initial presentation of COVID-19: a case report. Front Public Health 2020;8:474.
- Etemadifar M, Salari M, Murgai AA, et al. Fulminant encephalitis as a sole manifestation of COVID-19. Neurol Sci 2020;41(11):3027-9.
- Fenrich M, Mrdenovic S, Balog M, et al. SARS-CoV-2 dissemination through peripheral nerves explains multiple organ injury. Front Cell Neurosci 2020;14:229.
- Brann DH, Tsukahara T, Weinreb C, et al. Non-neuronal expression of SARSCoV-2 entry genes in the olfactory system suggests mechanisms underlying COVID-19-associated anosmia. Sci Adv 2020;6(31):eabc5801.
- Bostancıklıoğlu M. SARS-CoV2 entry and spread in the lymphatic drainage system of the brain. Brain Behav Immun 2020;87:122-3.
- Pellegrini L, Albecka A, Mallery DL, et al. SARS-CoV-2 infects the brain choroid plexus and disrupts the blood-CSF barrier in human brain organoids. Cell Stem Cell 2020:27(6):951-61.
- Deffner F, Scharr M, Klingenstein S, et al. Histological evidence for the enteric nervous system and the choroid plexus as alternative routes of neuroinvasion by SARS-CoV2. Front Neuroanat 2020;14:596439.
- Moriguchi T, Harii N, Goto J, et al. A first case of meningitis/encephalitis associated with SARS-Coronavirus-2. Int J Infect Dis 2020;94:55-8.
- Espíndola OM, Brandão CO, Gomes YCP, et al. Cerebrospinal fluid findings in neurological diseases associated with COVID-19 and insights into mechanisms of disease development. Int J Infect Dis 2020:102:155-62.
- Fadakar N, Ghaemmaghami S, Masoompour SM et al. A first case of acute cerebellitis associated with Coronavirus Disease (COVID-19): a case report and literature review. Cerebellum 2020;19(6):911-4.
- Kamal YM, Abdelmajid Y, Al Madani AAR. Cerebrospinal fluid confirmed COVID-19-associated encephalitis treated successfully. BMJ Case Rep 2020; 13(9):e237378.
- Benameur K, Agarwal A, Auld SC et al. Encephalopathy and encephalitis associated with cerebrospinal fluid cytokine alterations and Coronavirus Disease, Atlanta, Georgia, USA, 2020. Emerg Infect Dis 2020;26(9):2016-21.
- Andriuta D, Roger PA, Thibault W, et al. COVID-19 encephalopathy: detection of antibodies against SARS-CoV-2 in CSF. J Neurol 2020;267(10):2810-1.
- Al-Dalahmah O, Thakur KT, Nordvig AS, et al. Neuronophagia and microglial nodules in a SARS-CoV-2 patient with cerebellar hemorrhage. Acta Neuropathol Commun 2020;8(1):147.
- Zuo Y, Estes SK, Gandhi AA, et al. Prothrombotic antiphospholipid antibodies in COVID-19. medRxiv [Preprint] 2020:2020.06.15.20131607.
- Borghi MO, Beltagy A, Garrafa E, et al. Anti-phospholipid antibodies in COVID19 are different from those detectable in the anti-phospholipid syndrome. Front Immunol 2020;11:584241.
- Gemcioglu E, Erden A, Davutoglu M, et al. Acute ischemic stroke in a lupus anticoagulant-positive woman with COVID-19. J Clin Rheumatol 2020;26(6):236-7.
- Aubignat M, Godefroy O. COVID-19 and ischemic stroke: Should we systematically look for lupus anticoagulant and antiphospholipid antibodies? Rev Neurol (Paris) 2020;176(6):505-6.
- Dalakas MC. Guillain-Barré syndrome: The first documented COVID-19-triggered autoimmune neurologic disease: More to come with myositis in the offing. Neurol Neuroimmunol Neuroinflamm 2020;7(5):e781.
- Ray A. Miller Fisher syndrome and COVID-19: is there a link? BMJ Case Rep 2020;13(8):e236419.
- Marzano AV, Cassano N, Genovese G et al. Cutaneous manifestations in patients with COVID-19: a preliminary review of an emerging issue. Br J Dermatol 2020;183(3):431-42.
- Santonja C, Heras F, Núñez L, et al. COVID-19 chilblain-like lesion: immunohistochemical demonstration of SARS-CoV-2 spike protein in blood vessel endothelium and sweat gland epithelium in a polymerase chain reaction-negative patient. Br J Dermatol 2020;183(4):778-80.
- Colmenero I, Santonja C, Alonso-Riaño M, et al. SARS-CoV-2 endothelial infection causes COVID-19 chilblains: histopathological, immunohistochemical and ultraestructural study of 7 paediatric cases. Br J Dermatol 2020;183(4):729-37.
- Douglas KAA, Douglas VP, Moschos MM. Ocular manifestations of COVID-19 (SARS-CoV-2): A critical review of current literature. In Vivo 2020;34(3 Suppl):1619-28.
- Singh C, Tay J, Shoqirat N. Skin and mucosal damage in patients diagnosed with COVID-19: a case report. J Wound Ostomy Continence Nurs 2020;47(5):435-8.
- Cruz Tapia RO, Peraza Labrador AJ, Guimaraes DM, et al. Oral mucosal lesions in patients with SARS-CoV-2 infection. Report of four cases. Are they a true sign of COVID-19 disease? Spec Care Dentist 2020;40(6):555-60.
- Pouletty M, Borocco C, Ouldali N, et al. Paediatric multisystem inflammatory syndrome temporally associated with SARS-CoV-2 mimicking Kawasaki disease (Kawa-COVID-19): a multicentre cohort. Ann Rheum Dis 2020;79(8):999-1006.
- Verdoni L, Mazza A, Gervasoni A, et al. An outbreak of severe Kawasaki-like disease at the Italian epicentre of the SARS-CoV-2 epidemic: an observational cohort study. Lancet 2020;395(10239):1771-8.
- Toubiana J, Poirault C, Corsia A, et al. Kawasaki-like multisystem inflammatory syndrome in children during the covid-19 pandemic in Paris, France: prospective observational study. BMJ 2020; 369:m2094.
- Whittaker E, Bamford A, Kenny J, et al. Clinical characteristics of 58 children with a pediatric Iinflammatory multisystem syndrome temporally associated with SARS-CoV-2. JAMA 2020;324(3):259-69.
- Feldstein LR, Rose EB, Horwitz SM, et al. Multisystem inflammatory syndrome in U.S. children and adolescents. N Engl J Med 2020;383(4):334-46.
- Hedrich CM, Schnabel A, Hospach T. Kawasaki Disease. Front Pediatr 2018;6: 198.
- Wu Z, McGoogan JM. Characteristics of and important lessons from the Coro navirus Disease 2019 (COVID-19) outbreak in China: summary of a report of 72 314 cases from the Chinese Center for Disease Control and Prevention. JAMA 2020;323(13):1239-42.
- Götzinger F, Santiago-García B, Noguera-Julián A, et al. COVID-19 in children and adolescents in Europe: a multinational, multicentre cohort study. Lancet Child Adolesc Health 2020;4(9):653-61.
- Duarte-Salles T, Vizcaya D, Pistillo A, et al. Baseline characteristics, management, and outcomes of 55,270 children and adolescents diagnosed with COVID19 and 1,952,693 with influenza in France, Germany, Spain, South Korea and the United States: an international network cohort study. medRxiv [Preprint] 2020:2020.10.29.20222083.
- Swann OV, Holden KA, Turtle L, et al. Clinical characteristics of children and young people admitted to hospital with covid-19 in United Kingdom: prospective multicentre observational cohort study. BMJ 2020;370:m3249.
- Morris SB, Schwartz NG, Patel P, et al. Case series of multisystem inflammatory syndrome in adults associated with SARS-CoV-2 infection United Kingdom and United States, March-August 2020. MMWR Morb Mortal Wkly Rep 2020; 69(40):1450-6.
Версия на английском языке









.ppt/slide_8.jpg)