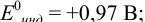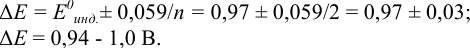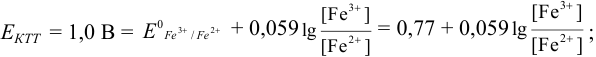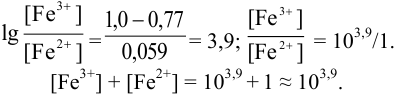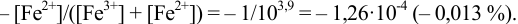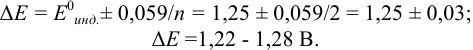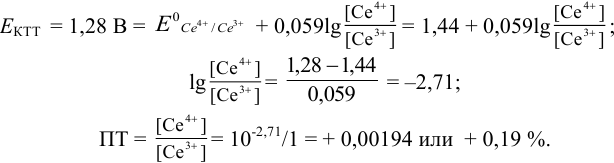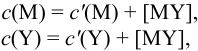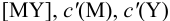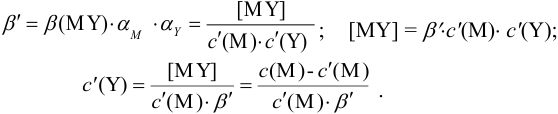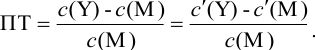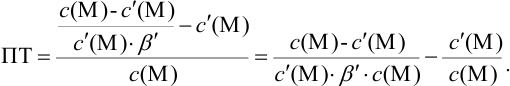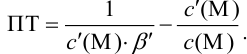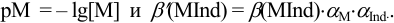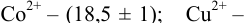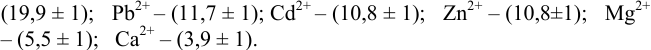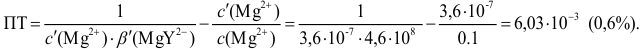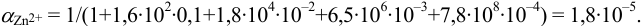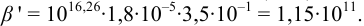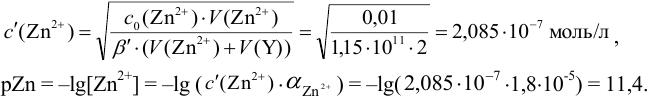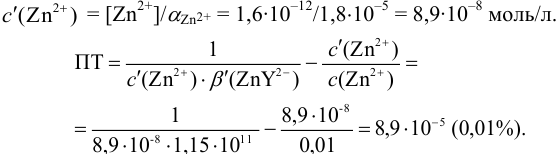1.5.1 Протонную
ошибку можно рассчитать ОТ [Н+]
,%
,
(25)
где V-
исходный объем определяемого вещества,
мл;
VD—
объем добавленного титранта, мл;
рТ- показатель
титрования индикатора.
1.5.2 Гидроксидную
ошибку можно рассчитать ОТ [ОН—],
%
(26)
1.5.3 Кислотная
ошибка возникает,если при недотитровании
слабых кислот в растворе остается
небольшое количество кислоты в
молекулярной форме (ОТА)
,%
(27)
1.5.4 Основная ошибка
появляется
при недотитровании слабого основания
(ОТВ),
%
(28)
Примеры решения
задач.
Пример 1
На титрование
смеси, состоящей из карбонатов натрия
и калия массой 0,4 г израсходовали 22,00 мл
0,3М HCl.
Вычислить массовую долю (%) Na2CO3
и К2СО3
в смеси.
Решение:
Обозначим: w –
количество Na2CO3
в % — (доля Na2CO3),
(100-w) – количество
К2СО3
в % — (доля К2СО3)
%сод
=
qA=
qA
= nA
· ЭA
где %сод
— процентное
содержание.
nA
· ЭA
=
,
т.е. nA
· ЭA
·
100 = % сод
·
а
n=
n=
В точке эквивалентности
количество эквивалентов в смеси равно
n+
n=
n
Подставляем
числовые значения
+
=
Тогда
ω
= 46,12% Na2CO3
а массовая доля
К2СО3
находится из разности
100 – 46,12 = 53,88% К2СО3
Пример 2
Навеску хлорида
аммония обработали избытком щелочи.
Выделившийся аммиак поглотил 50 мл
0,5120М HCl
и раствор разбавили до 250 мл. На титрование
50 мл полученного раствора израсходовали
23,73 мл 0,05М КОН (К = 0,9740). Вычислить массу
NH3,
которая содержалась в хлориде аммония.
Решение
Итак, количество
HCl
в исходном растворе кислоты составляе
n=
С учетом разбавления
до 250 мл
n=
Количество КОН,
пошедшего на титрование HCl,
взятого в избытке
n=
Количество аммиака
считаем: n=
n
– n
Пример 3
Чему должен быть
равен титр раствора К2Сr2О7,
чтобы 1 мл его, израсходованный на
титрование FeCl2,
полученного из навески руды 0,2 г
соответствовал точно 0,5% железа.
Решение
6Fe2++
Сr2О72-
+14H+
→ 6Fe3++
2Сr3+
+7H2O
% =
q
=
1 мл К2Сr2О7
титрует 0,001 г Fe,
т.е. это
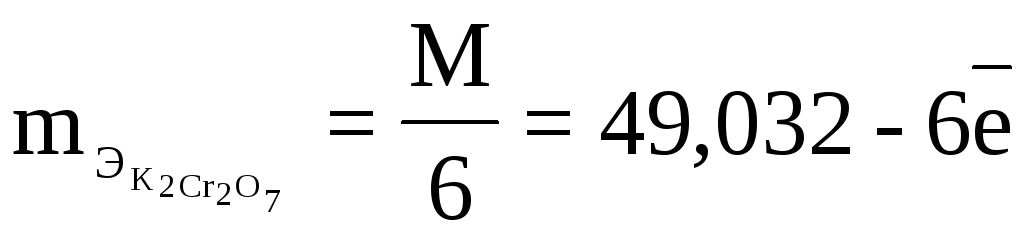
по 3
ТВ/А=
ТВ=
Подставляем
числовые значения
ТВ=
Пример 4
Для определения
свободного Р2О5
в суперфосфате,
содержащуюся в водном растворе его
Н3РО4
титруют NaOH,
причем образуется NaH2PO4.
Чему равен Т,
если на 0,1035г Н2С2О4
расходуется 25,15 мл данного раствора
NaOH?
Решение
Н3РО4
+ NaOH
= NaH2РO4+НОН
2Н3РО4
=Р2О5
+ 3Н2О
fэкв
(Р2О5)=1/2
Р2О5
+ 3Н2О
= 2Н3РО4
25,15 мл NaOH
титруют 0,1035г Н2С2О4
1 мл NaOH
титрует x
г Н2С2О4
х =
Это Т(ТВ/А)
ТВ/А=
ТВ=— это Т
Т=
Пример 5
На титрование с
фф навески массой 0,4478 г, состоящей из
Na2CO3,
NaHCO3
и NaCl
потребовалось
18,80 мл 0,1998М раствора НCl.
При титровании с мо на ту же навеску
израсходовали 40,00 мл раствора кислоты.
Вычислить массовую долю (%) Na2CO3
и NaHCO3
в смеси.(фф- фенолфталеин, мо- метилоранж)
Решение
При титровании
смеси с фф протекает реакция
Na2CO3
+ НCl
= NaCl
+ NaHCO3
в присутствии мо
Na2CO3
+ 2НCl
= 2NaCl + H2О
+ CO2
NaHCO3
+
НCl
= NaCl + H2О
+ CO2
Следовательно,
при титровании смеси в присутствии фф
с раствором хлороводородной кислоты
взаимодействует только один компонент
смеси Na2CO3
и количество
его легко определить по формуле (18)
Тогда
Как следует из
приведенных реакций, объем раствора
НCl,
затраченный на титрование гидрокарбоната
натрия, в присутствии мо можно представить
так
VHCl
MO
= 2VHCl
фф
Отсюда
Пример 6
Для определения
содержания формальдегида в пестициде
навеску препарата массой 3,017 г обработали
50,00 мл 1 М раствора NaOH
(K=0,9022)
в присутствии пероксида водорода. При
нагревании произошла реакция
НСОН + ОН—
+ Н2О2
= НСОО—
+ 2Н2О
При охлаждении
избыток щелочи оттитровали 20,12 мл
раствора НCl
с ТНCl
= 0,03798. Вычислить массовую долю (%)
формальдегида в препарате пестицида.
Решение
Сущность обратного
титрования отражает формула
С учетом условий
задачи выражаем число молей реагирующих
веществ
n(HCl)=
Составляем расчетное
уравнение
—
Подставив числовые
выражения, получаем
ωx
= 20,86 %
Иногда в ходе
анализа целесообразно осуществить
двойное и даже тройное замещение.
Например, в случае тройного замещения
можно схематично написать реакции в
следующем виде
Даны вещества А,В,
С, D.
S
– заместитель
ZAA
+ ZBB
+ ….→ Z1S1
+….
Z1S1
+ ZCC
+ ….→ Z2S2
+….
Z2S2
+ ZDD
+ ….→ Z3S3
+….
Третий заместитель
S3
титруют титрантом Т
Z3S3
+ ZTT
+ … → ZPP+…
Массу и массовую
долю (%) определяемого вещества в таком
случае вычисляют по формулам
%сод
=
Пример 7
Навеску сплава,
содержащего свинец, массой 0,3526г растворили
в азотной кислоте. Свинец осаждают в
виде хромата, осадок отфильтровывают,
отмывают от избытка хромата и растворяют
в соляной кислоте. В растворе хромат-ионы
определяют иодометрически. На титрованиие
выделившегося иода израсходовано 25,85
мл 0,0500 М раствора Na2S2O3.
Рассчитать массовую долю свинца в сплаве
(Мол. масса (Pb)
207,19)
Решение
Уравнение реакций
можно представить в следующем виде
Pb2+
+ CrOPbCrO4
(ZA=Z1=1)
2 PbCrO4
+ 2H3O+↔
2 Pb2++
Cr2O+3H2O
(Z1=2;
Z2=1)
Cr2O+6J—+14
H3O+↔3J2+2Cr3+
+21H2O
(Z2=1;
Z3=3)
J2
+2S2O↔2J—+S4
O(Z3=1;
ZT=2)
Массовую долю
свинца вычисляют по формуле
ωPb,%
=
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
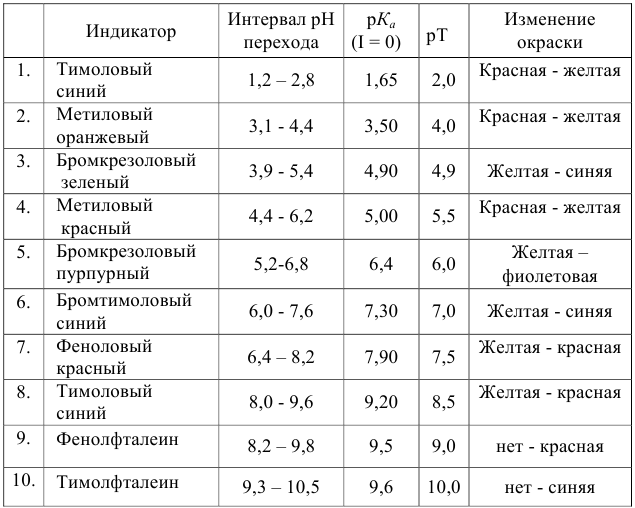
Расчет индикаторных погрешностей кислотно-основного титрования
Согласно ионно-хромофорной теории индикаторов, интервал перехода окраски индикатора 
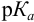
Таблица 8.12
Важнейшие кислотно-основные индикаторы
При правильно выбранном индикаторе индикаторная ПТ не должна превышать заданную погрешность измерения объема раствора в титриметрии. Типы (виды) индикаторных ПТ кислотно-осиовиого титрования и названия, встречающиеся в разных учебниках и сборниках задач, происхождение погрешностей и формулы для расчета приведены в табл. 8.13. Формулы легко выводятся из определения погрешности титрования как отношения недотитро-ванного или перетитрованного количества кислоты или основания к первоначально взятому для титрования (то есть к произведению 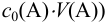
Таблица 8.13
Индикаторные погрешности кислотно-основного титрования
Пример 8.28.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании а) 
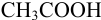
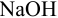
Решение:
а). Как следует из табл. 8.4 и рис. 8.1(1), для случая титрования 

Однако используемые для расчета ПТ формулы показывают, что чем ближе рТ и 

Рассчитаем величину ПТ с двумя индикаторами: с рТ < 

С индикатором метиловым красным (рТ 5,5 < 
С индикатором фенолфталеином (рТ 9,0 > 
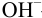
В данном случае оба индикатора пригодны, поскольку вычисленные значения ПТ не превышают заданную погрешность титрования (0,4%), но с метиловым красным систематическая индикаторная погрешность меньше.
б). При титровании 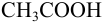



Например, при выборе фенолфталеина (рТ = 9,0):
а при выборе тимолфталеина (рТ = 10,0) погрешность возрастает в 10 раз:
Выбор фенолфталеина приводит к меньшей индикаторной погрешности титрования 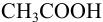
При титровании с индикаторами, для которых рТ < рНтэ, в растворе остается неоттитрованная слабая кислота, т. е. присутствует НА-ошибка (кислотная) со знаком «-» (см. табл. 8.13). Если использовать индикатор бромтимоловый синий (рТ 7,0), то вычисленная ПТ не удовлетворяет заданной точности, индикатор не пригоден:
или при проведении расчета по приближенной формуле:
Пример 8.29.
Какой индикатор позволяет оттитровать 0,1000 М гидразин 

Решение:
Реакция титрования:
приводит к образованию слабой сопряженной кислоты 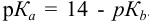
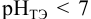
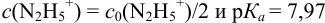
Сравнивая рТ индикаторов и 
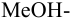
и с метиловым красным (рТ 5,5):
Из предложенных индикаторов метиловый красный позволяет провести титрование гидразина с меньшей погрешностью.
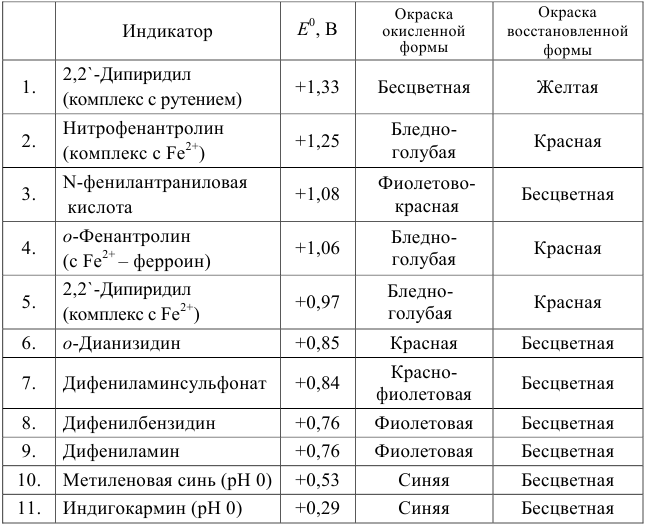
Расчет индикаторных погрешностей окислительно-восстановительного титрования
При использовании окислительно-восстановительных (редокс) индикаторов потенциал в ТЭ 

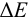
Таблица 8.14
Примеры распространенных окислительно-восстановительных индикаторов
Полуреакция восстановления и интервал перехода индикатора:
Наиболее часто в полуреакции восстановления (окисления) индикатора участвуют 2 электрона. Для индикаторов №1 — №6 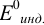
- сравнить
для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.
Например, если 
Сумма числителя и знаменателя здесь составляет 100 % титруемого вещества. Индикатор считается пригодным, если ПТ не превышает 0,1 -0,2%.
Пример 8.30.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании раствора соли 

Решение:
Как следует из табл. 8.8 и рис. 8.3 (кривая 1, пример 8.25), область скачка (при относительной погрешности измерения объема 0,1 %) на кривой титрования 0,95 — 1,26 В, а 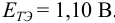
Выберем для рассмотрения порядка расчета два индикатора:
а) с 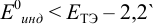
б) с 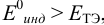
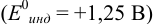
В случае а) интервал перехода индикатора:
Изменение окраски заканчивается при 
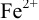



Тогда: ПТ =
В случае б) интервал перехода индикатора нитрофенантролина в виде комплекса с 
Изменение окраски заканчивается при 

Тогда количество 

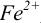
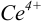
Таким образом, оба выбранных индикатора оказались приемлемыми.
Расчет индикаторных погрешностей комплексонометрического титрования
В конечной точке титрования общие концентрации определяемого иона с(М) и титранта c(Y) можно представить выражениями {для упрощения записи в общем виде упустим заряды ионов):
где 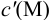
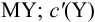
Условные константы устойчивости (см. выражение 8.16) связывают
Отсюда относительная погрешность титрования (ПТ) определяется выражением (с учетом (8.18) и (8.19)):
Подставляем в это уравнение выражение для 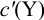
Вблизи ТЭ 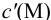
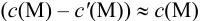
следовательно:
Выражение (8.21) тождественно выражению: 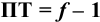
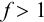
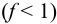
Конечная точка титрования определяется интервалом перехода окраски индикатора (интервалом рМ, в котором индикатор меняет свою окраску):
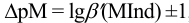
Интервал перехода окраски 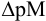
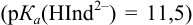
Пример 8.31.
Рассчитайте погрешность титрования 0,1 ОМ раствора 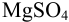

Решение:
В данных условиях 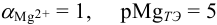
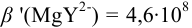
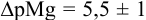
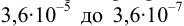

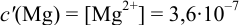
Погрешность титрования 
Пример 8.32.
Докажите возможность использования индикатора эриохром черный Т для титрования 0,010 М раствора 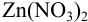

Решение:
1. Рассчитаем условную константу 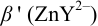
Общие константы устойчивости для аммиачных комплексов 
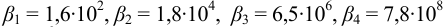

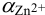
По табл. 7 и табл. 4 приложения находим 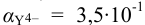
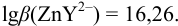

В точке эквивалентности:
Интервал перехода окраски индикатора эриохром черный Т в случае титрования ионов цинка при pH 10: 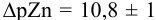
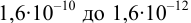

2. Конечная точка титрования наступает при [

Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:
Величина рТ индикатора, соответствующая конечной точке титрова ния, как правило, не совпадает с рН раствора в точке эквивалентности. Вследствие несовпадения, в точке эквивалентности раствор либо перетитро ван, либо недотитрован, т. е. раствор содержит некоторое количество тит ранта или определяемого вещества. При титровании слабых кислот могут таким образом появиться либо кислотная ошибка – ∆НА, либо гидроксидная
– ∆ОН ошибка. При титровании слабых оснований – щелочная ошибка –
∆МОН или водородная – ∆Н. При титровании сильных кислот сильными ос нованиями (или наоборот) могут, таким образом, получаться либо водород ная ошибка, либо гидроксидная.
Кислотная ошибка рассчитывается следующим образом:
НА 10 рК рТ 100 .
Из этой формулы можно вывести другую, которая позволит определить какие индикаторы могут быть пригодны для титрования растворов слабых кислот: рТ ≥ рК + 3.
Гидроксидная ошибка рассчитывается по формуле
Щелочная ошибка рассчитывается формуле
МОН 10 рТ рК 14 100 .
Из этой формулы можно вывести другую, которая позволит определить, какие индикаторы могут быть пригодны для титрования растворов слабых оснований: рТ ≤ 11 – рК.
Водородная ошибка рассчитывается следующим образом:
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
2. ОСАДИТЕЛЬНОЕ ТИТРОВАНИЕ (СЕДИМЕТРИЯ)
При осадительном титровании в результате реакции образуются мало растворимые соединения, прочность которых обусловливает остаточное со держание в точке эквивалентности веществ, вступающих во взаимодействие.
Их диссоциация по уравнению
АmВn ↔ mAn+ + nBm (2.1) описывается по закону действующих масс соответствующей константой – произведением растворимости, вида
ПР = An m B m n. (2.2) Расчет кривой титрования проводится с использованием данной константы, которую предварительно переводят в логарифмический вид:
lg ПР lgA n lgB m ,
где п – 1, 2, 3 или рПР = рА + рВ. (2.3) Количество единиц на шкале ординат, где откладывается величина рА
или рВ, обусловливает величина рПР, а на оси абсцисс откладывается объ ем добавленного раствора титранта.







НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
РАСЧЕТНЫЕ ФОРМУЛЫ ДЛЯ
|
Титруемое вещество |
Состав титриметрической |
|
|
до титрования |
после титрования |
|
|
Сильная кислота НА |
СНА = [Н+] рН = – lg [H+] |
H+, A+ pH = – lg[H+] (1 –f) |
|
Сильное основание В |
[B] = [OH] pH = 14 + lgCB |
B, BH+ pH = 14 + lg[CB (1 – f)] |
|
Слабая кислота НА |
HA, H+ – ионизация рН = 1 ( lg ) 2 pK C A |
НА, А буферная смесь pH pK lg C A (1 f ) A C f A |
|
Слабое основание В |
В, ВН+ – ионизация рН=14– 1 ( lg ) 2 pK B C B |
В, ВН+ – буферная смесь рН = 14 – рК + lg C B (1 f ) В C B f |
|
Политропная кислота 1 т. э. 2 т. э. |
H2A, H+ – ионизация рН = 1 ( pK lg C ) 2 1 A A |
Н2А, НА – буферная смесь рН = рК1,А– lg A C (1 f ) C A f A2, HA – буферная смесь рН = рК – lg C A (1 f ) 2,А C A f |
|
Политропное основание 1 т. э. 2 т. э. |
B, BH+ – ионизация рН = 14 – 1 ( pK lg C 2 1, B B |
ВН+, В – буферная смесь рН = 14 – рК1,В + lg B C (1 f ) C B f pH = 14 – pK + lg C B (1 f ) 2,B C B f |
ПОСТРОЕНИЯ КРИВЫХ ТИТРОВАНИЯ
Таблица 6


НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
|
смеси и формулы расчета рН |
|
|
в точке эквивалентности |
после точки эквивалентности |
|
А–, [H+], [OH–] pH = 7 |
А–, ОН– рН = 14 – рОН = 14 + lg[CB(f – 1)] |
|
ВН+ рН = 7 |
ВН+, Н+ рН = – lg[CA(f – 1)] |
|
А гидролиз рН = 7 + 1 ( pK lg C ) 2 A A |
А–, OН– рН = 14 + lg[CB(f – 1)] |
|
ВН+ гидролиз рН = 7 – 1 ( pK lg C ) 2 B B |
BH+, H+ H = – lg[CA(f – 1)] |
|
НА гидролиз, ионизация рН = 1 ( pK pK ) 2 1, A 2, A А2 гидролиз рН = 7 + 1 ( pK lg C ) 2 2, A СОЛИ |
A2–, HA– – буферная смесь рН = рК C A (1 f ) 1 2,А– lg C f 1 A А2–, ОН– рН = 14 + lg[CB(f1 – 1)] |
|
ВН+ гидролиз, ионизация рН = 14 – 1 ( pK pK ) 2 1, B 2, B ВН22+ гидролиз рН = 14 – 1 ( pK lg C ) 2 2, B СОЛИ |
BH+, BH22+ – буферная смесь рН = 14 – рК C B ( f 1) 1 2,В + lg C 1 f B ВН22+, Н+ Н = – lg[CA(f1 – 1)] |
Кривые титрования хлорида, бромида и йодида солью серебра приведе ны на рис. 4. Каждую из кривых, приведенных на рисунке, можно рассчи тать, исходя из значений произведения растворимости соответствующего галогенида серебра.
Рассмотрим пример расчета кривой титрования при осаждении хлорид ионов раствором азотнокислого серебра.
Пример. Рассчитать и построить кривую титрования 100 см3 0,1 м рас твора NaCl 0,1 м раствором AgNO3. Расчеты произвести для точек, когда оттитровано 0; 25; 50; 99; 99,9; 100; 100,1; 101,0 и 110 % от количества хлоридионов в пробе. Произведение растворимости AgCl равно 1· 1010.
16
14
12
10
8
6
4
2
0
0 50 100 150 200
% оттитрованности
Ряд1
Ряд2
Ряд3
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ

Концентрацию [Cl] в каждый момент времени до достижения точки эквивалентности при титровании можно представить в виде суммы
[Cl] = [Cl]н + [Cl]ос,
где [С1] концентрация хлорид иона в начальный момент титрования
[С1] = СNaCl;
[C1]н – концентрация неосажденного хлорида, моль/дм3;
[С1]ос – концентрация хлоридионов, созданная в результате раство рения, хотя и незначительного, осадка в этих условиях. Она соизмерима с [С1]н только вблизи точки эквивалентности, поэтому на других участках кривой ею пренебрегают.
Значение [С1]н определяется по формуле, аналогичной (1.6);
где Vx и Сx – объем и молярная концентрация эквивалента титруемого рас твора хлорида;
Vt и Сt – объем и молярная концентрация эквивалента раствора титранта – AgNO3.
Концентрацию [Ag+] в каждый момент времени или данной расчетной точке кривой титрования рассчитывают, исходя из [C1]н, величины ПРAgCl и выражения (2.3) – pAg = pПР – рС1.
Например, рассчитаем [C1]н и [Ag+], когда оттитровано 25 % от коли чества хлорид ионов в исходном (начальном) растворе:
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
рAg = – lg [1,66· 109]
или
pAg = рПР – рС1 = 10 – 1,22 = 8,78.
Концентрация [Cl] в точке эквивалентности определяется выражением
(2.2). Так как в точке эквивалентности [Ag+] = [Cl], то
[Cl]2 = [Ag+]2 =ПРAgCl

ПРAgCl
или в логарифмическом виде
рС1 = рАg = 1/2 рПР.
После прохождения точки эквивалентности, когда в растворе появляет ся избыток ионов серебра, его концентрация определяется выражением

Vt Vx
Концентрацию хлоридионов рассчитывают исходя из [Ag+], величины
ПРAgCl и выражения (2.3):
рС1 = рПРAgCl – рAg.
Например, рассчитаем [Cl] и [Ag+], когда оттитровано 101 % от эквива лентного количества хлоридионов в исходном растворе:
рCl = – lg [2,04 · 107]
или рС1 = рПР – рAg = 10 – 3,31 = 6,69.
Данные о титровании 100 см3 0,1 м раствора NaCl 0,1 м раствором
AgNO3 представлены в табл.7.
Подобно анализу по методу нейтрализации, и в этом случае взаимодей ствие более концентрированных растворов расширяет область скачка на
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
кривой титрования (иногда скачок титрования называют областью эквива лентности). Увеличение скачка титрования наблюдается также при получе нии осадка с более низким значением произведения растворимости
(см. рис.4).
В табл. 8 представлены произведения растворимости (ПР) некоторых соединений, для которых возможен расчет кривых осадительного титрова ния. Оно применяется при условии, что существует удобный способ уста новления точки эквивалентности. Для этого используют индикаторы.
Таблица 7
Результаты титрования 100 см3 0,1 м раствора NaCl 0,1 м раствором AgNO3
|
% |
Vt |
Vt·Ct |
Vx+ Vt |
[Cl]H |
pCl |
pAg |
|
0 |
0 |
100 |
0,1 |
1 |
– |
|
|
25 |
25 |
2,5 |
125 |
6 · 102 |
1,22 |
8,78 |
|
50 |
50 |
5,0 |
150 |
3,3 · 102 |
1,48 |
8,52 |
|
90 |
90 |
9,0 |
190 |
5,26 · 103 |
2,28 |
7,72 |
|
99,9 |
99,9 |
9,99 |
199,9 |
5,03 · 104 |
3,29 |
6,71 |
|
100 |
100 |
10,0 |
200 |
1,0 · 105 |
5,0 |
5,0 |
|
Ag+] |
||||||
|
100,1 |
100,1 |
10,01 |
200,1 |
5,2 · 105 |
5,72 |
4,28 |
|
101,0 |
101,0 |
10,1 |
201,0 |
4,95 · 107 |
6,69 |
3,31 |
|
110,0 |
110,0 |
11,0 |
210,0 |
4,75 · 103 |
7,67 |
2,33 |
(Материал взят из книги Расчет и построение кривых титрования в объемном методе анализа — Федоров В. А., Комиссаренков А. А.)

Индикаторные ошибки кислотно-основного титрования 1

Водородная ошибка возникает, когда недотитрована сильная кислота, перетитровано сильное или слабое основание Водородная ошибка – отношение количества ионов водорода n(H+) в конце титрования к первоначально взятому количеству вещества n(X) n(H+)к. т. X(H+) = ———— · 100% n(X) 2

n(X) = С(1/z Х) · V(X) С(1/z Х) – молярная концентрация эквивалента первоначально взятого вещества V(X) – объем первоначально взятого вещества n(H+)к. т. = [H+]к. т. · Vк. т. – объем в конце титрования Vк. т. = V(X) + V(Т) 3
![[H+]к. т. · (V(X) + V(Т)) X(H+) = —————— · 100% С(1/z Х) · [H+]к. т. · (V(X) + V(Т)) X(H+) = —————— · 100% С(1/z Х) ·](https://present5.com/presentation/3/139200531_169966086.pdf-img/139200531_169966086.pdf-4.jpg)
[H+]к. т. · (V(X) + V(Т)) X(H+) = —————— · 100% С(1/z Х) · V(X) р. Нк. т. = р. ТInd [H+]к. т = 10–р. Н = 10–р. Т · (V(X) + V(Т)) X(H+) = ————— · 100% С(1/z Х) · V(X) 4

Гидроксильная ошибка обусловлена наличием гидроксид-ионов в конце титрования и возникает, когда недотитровано сильное основание, перетитрована сильная или слабая кислота n(OH–)к. т. X(OH–) = ———— · 100% n(X) n(OH–)к. т = [OH–]к. т. · (V(X) + V(Т)) n(X) = С(1/z Х) · V(X) [OH–]к. т. · (V(X) + V(Т)) X(OH–) = ————— · 100% С(1/z Х) · V(X) 5
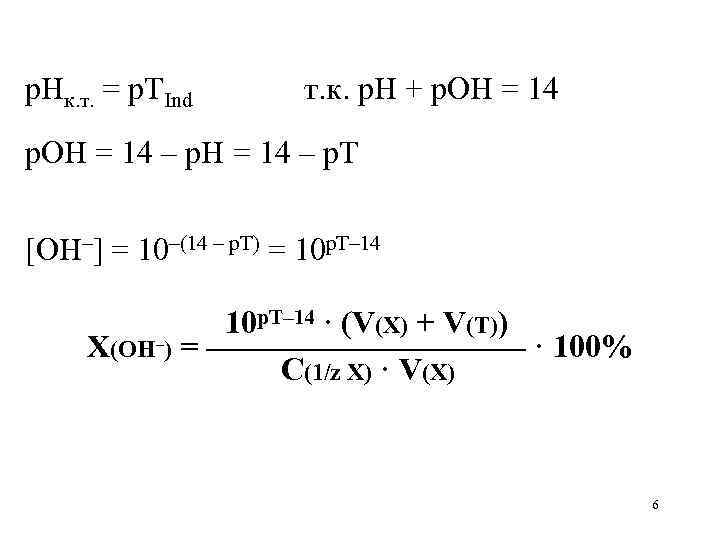
р. Нк. т. = р. ТInd т. к. р. Н + р. ОН = 14 – р. Т [OH–] = 10–(14 – р. Т) = 10 р. Т– 14 · (V(X) + V(Т)) X(OH–) = ————— · 100% С(1/z Х) · V(X) 6

Кислотная ошибка возникает, когда остается недотитрованной слабая кислота Кислотная ошибка – отношение концентрации недотитрованной кислоты в конце титрования к ее оттитрованной части HA + KOH H 2 O + KA [HA]к. т. X(HA) = ———— · 100% [A–]к. т. Оттитрованная часть кислоты будет определяться анионами соли 7
![HAк. т. H+к. т. + A–к. т. [H+]к. т. · [A–]к. т. Kк-ты = HAк. т. H+к. т. + A–к. т. [H+]к. т. · [A–]к. т. Kк-ты =](https://present5.com/presentation/3/139200531_169966086.pdf-img/139200531_169966086.pdf-8.jpg)
HAк. т. H+к. т. + A–к. т. [H+]к. т. · [A–]к. т. Kк-ты = ——————— [HA]к. т. [H+]к. т. ———= ——— [A–]к. т. Kк-ты [H+]к. т. X(HA) = ———— · 100% Kк-ты 8
![р. Нк. т. = р. ТInd [H+]к. т = 10–р. Н = 10–р. Т р. Нк. т. = р. ТInd [H+]к. т = 10–р. Н = 10–р. Т](https://present5.com/presentation/3/139200531_169966086.pdf-img/139200531_169966086.pdf-9.jpg)
р. Нк. т. = р. ТInd [H+]к. т = 10–р. Н = 10–р. Т Kк-ты = 10–р. К 10–р. Т X(HA) = ———— · 100% 10–р. Кк-ты X(HA) =10 р. Кк-ты–р. Т · 100% 9

Основная ошибка возникает, когда остается недотитрованным слабое основание Основная ошибка – отношение концентрации неоттитрованного основания в конце титрования к его оттитрованной части [BOH]к. т. X(BOH) = ———— · 100% [B+]к. т. 10
![Аналогично с кислотной ошибкой можно показать [BOH]к. т. [OH–]к. т. ————— = ————— [B+]к. Аналогично с кислотной ошибкой можно показать [BOH]к. т. [OH–]к. т. ————— = ————— [B+]к.](https://present5.com/presentation/3/139200531_169966086.pdf-img/139200531_169966086.pdf-11.jpg)
Аналогично с кислотной ошибкой можно показать [BOH]к. т. [OH–]к. т. ————— = ————— [B+]к. т. Kосн [OH–]к. т. X(BOH) = ———— · 100% Kосн Т. к. [OH–]к. т. = 10 р. Т– 14 Kосн = 10–р. Косн 11
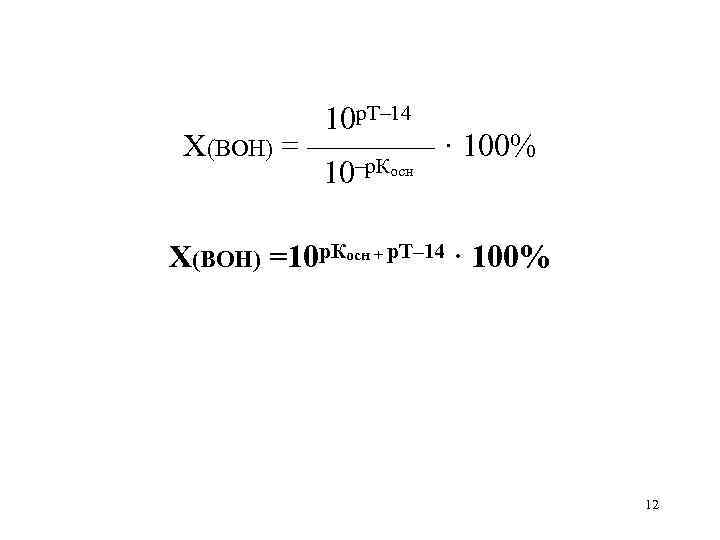
10 р. Т– 14 X(BOH) = ———— · 100% 10–р. Косн X(BOH) =10 р. Косн + р. Т– 14 · 100% 12

Вычислить ошибку титрования 0, 2 н. раствора HCl 0, 2 н. раствором Na. OH с индикатором метиловым оранжевым. р. Т(м/о) = 4 ошибка водородная 10–р. Т · (V(X) + V(Т)) X(H+) = ————— · 100% С(1/z Х) · V(X) 10– 4 · (10 + 10) X(H+) = ——————— · 100 = 0, 1% 0, 2 · 10 Индикаторная ошибка должна быть 0, 1% 13

Вычислить индикаторную ошибку титрования 0, 2 н. раствора HCl 0, 2 н. раствором Na. OH с индикатором фенолфталеином р. Т(ф/ф) = 9 ошибка гидроксильная 10 р. Т– 14 · (V(X) + V(Т)) X(OH–) = ————— · 100% С(1/z Х) · V(X) 109– 14 · (10 + 10) X(OH–) = ——————— · 100 = 0, 01 % 0, 2 · 10 14

Вычислить ошибку титрования 0, 1 н. раствора муравьиной кислоты 0, 1 н. раствором сильного основания с индикатором метиловым красным р. Т(м/к) = 5 р. К(HCOOH) = 3, 76 р. Нт. э. = 7 + ½ р. Кк-ты + ½ lg Cсоли = 8, 38 Раствор недотитрован ошибка кислотная 15

X(HA) =10 р. Кк-ты–р. Т · 100% X(HA) =103, 76– 5 · 100 = 5, 7 % Индикатор использовать нельзя. 16

Чему равна ошибка титрования 0, 1 н. раствора аммиака 0, 1 н. раствором HCl с индикатором крезоловым пурпуровым р. Т(к/п) = 8 р. К(NH 4 OH) = 4, 75 р. Нт. э. = 7 – ½ р. Косн – ½ lg Cсоли = 5, 10 Раствор недотитрован ошибка основная X(BOH) =10 р. Косн + р. Т– 14 · 100% X(BOH) =104, 75 + 8– 14 · 100 = 5, 6% 17

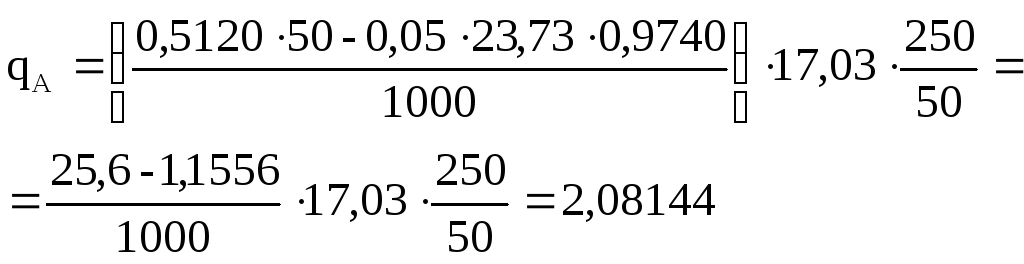
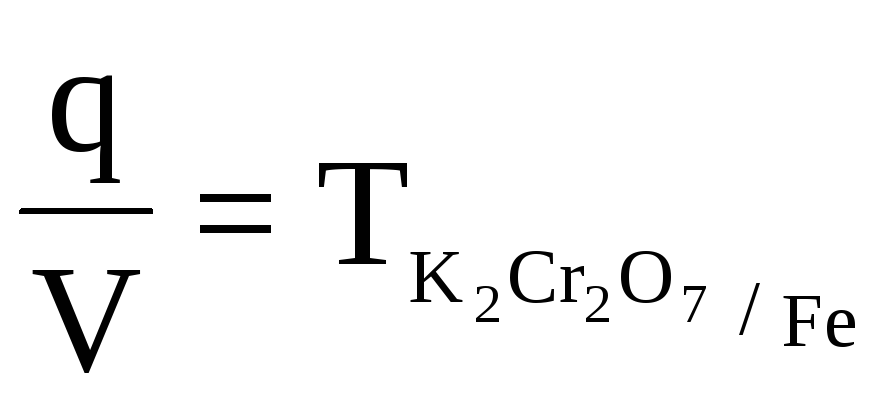


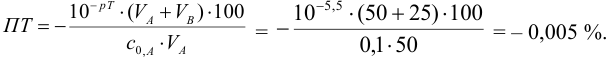
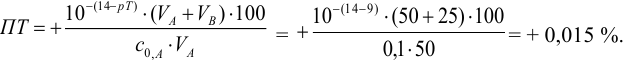
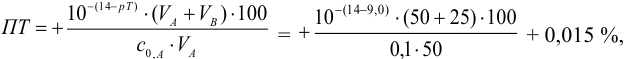
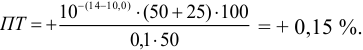
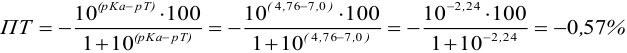
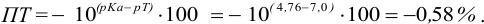
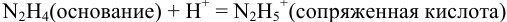
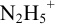
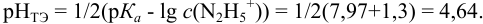
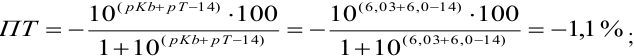
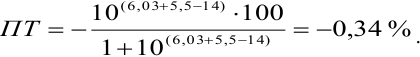

 для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.
для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.