Кислотная ошибка. Как видно из рис. 17-8, в растворах с pH меньше 1 типичный стеклянный электрод дает ошибку, противоположную по знаку щелочной ошибке, поэтому в этой области получаются завышенные значения pH. Величина ошибки зависит ог ряда факторов и обычно плохо воспроизводится. Причины возникновения кислотной ошибки изучены недостаточно. [c.432]
Зависимость потенциала стеклянного электрода от pH выражается кривой с минимумом (рис. 8). Положение максимума зависит от сорта стекла и определяется величиной Таким образом, в щелочных растворах (pH > 12) измерения pH со стеклянным электродом приводят к так называемой «щелочной ошибке». Аналогично при pH < О наличие минимума создает «кислотную ошибку», которая, по-видимому, связана с анионной функцией стеклянного электрода в сильнокислой среде. [c.52]
Отклонение от водородной функции стеклянного электрода определяется сортом стекла и отношением активностей ионов водорода и металла в растворе. Такое отклонение носит название «щелочной или кислотной ошибки » стеклянного электрода. [c.97]
Из приведенных примеров видно, что водородная функция стеклянного электрода нарушается в сильнощелочной и в сильнокислой области. Для большинства электродов в кислых растворах ошибка в измерении pH становится заметной только при pH < 2 и достигает достаточно большой величины при pH, близких к нулю. Кислотная ошибка приводит к завышению результатов определения pH по сравнению с истинными. Ее природа до сих пор детально не выяснена. Одно из предположений состоит в том, что в кислой среде с высокой ионной силой активность воды по обеим сторонам стеклянной мембраны не остается одинаковой, и поэтому в воде возникает концентрационная ячейка, потенциал которой также входит в измеряемую разность потенциалов. Кислотные ошибки трудно устранить, но, к счастью, они невелики. [c.187]
Характеристики электрода в значительной степени определяются природой стеклянной мембраны. При высоких значениях pH (>10) многие электроды дают щелочную ошибку, т. е. наблюдаемое значение pH ниже истинного значения. Величина щелочной ошибки зависит от природы и концентрации ионов щелочных металлов, а также от температуры. На другом конце шкалы pH неправильные показания могут быть следствием кислотной ошибки. В растворах очень сильных кислот наблюдаемые значения pH выше истинных значений. [c.415]
Кислотная ошибка. При pH меньше нуля величины pH, полученные со стеклянным электродом, несколько завышены. [c.449]
Дол [ ], исходя из своей теории стеклянного электрода, согласно которой через стеклянную мембрану проникают гидратированные протоны, объясняет кислые ошибки стеклянного электрода изменением активности воды по одну сторону мембраны при повышении кислотности в растворах. В нашей предыдущей работе [ ], исследуя поведение стеклянного электрода в спиртах в широкой области pH, мы уже показали несостоятельность этой точки зрения. [c.176]
II слабощелочных растворов. При больших pH наблюдаются отклонения от этого уравнения, значения которых зависят от сорта стекла, природы катионов раствора и pH среды. Эти отклонения называются щелочной ошибкой стеклянного электрода. В сильнокислых средах наклон зависимости Лет — pH также не совпадает с предс1йзываемым уравнением ( 1.67). Однако эта кислотная ошибка не зависит от природы анионов и катионов. Потенциал стеклянного электрода не искажается в присутствии каких-либо окислительно-восстановительных систем, в растворах солей тяжелых и благородных металлов, так называемых электродных ядов (сернистых, мышьяковистых и других соединений), органических веществ. Стеклянный электрод можно применять в окрашенных и мутных растворах, в средах, не обладающих буферностью, вблизи точки нейтрализации, причем скорость установления стдостаточно велика. Стеклянные микроэлектроды позволяют определить pH в небольших объемах жидкости и очень удобны для измерения pH в биологических объектах. [c.155]
Вычисленные концентрации ионов аммония, подобно соответствующим концентрациям в табл. 78в, вообще выще, чем концентрации ионов аммония, установленные при помощи стеклянного электрода. Расхождение может, конечно, обусловливаться систематической экспериментальной ошибкой при определении концентрации иона аммония. Но оно может быть также вызвано тем, что часть имеющейся аммонийной соли адсорбируется углем, или, скорее, тем, что предположение, на котором основаны расчеты, а именно, что уголь связывает весь осаждающийся кобальт в виде гидроокиси кобальта, оказывается необязательно правильным. pH изучаемых равновесных растворов непосредственно не определяли, а вычисляли на основании найденных концентраций аммиака и аммонийной соли. При этом было принято, что показатель константы кислотной диссоциации иона аммония при 30° и рассматриваемых ионных силах (0,172 и 0,173 соответственно, см. стр. 287) равен 9,10. При рассчитанном значении pH 10,55 не только аквопентаммин-, но также и диаквотетраммин-ионы полностью превращаются в гид-роксо-комплекс. Поэтому можно было вычислить константы гидролиза прямо из уравнений [c.282]
Ряд исследователей представили информацию о щелочной ошибке стеклянных электродов в неводных средах. Так, Вегман и др. [85] изучали щелочную ошибку в уксусной кислоте. Харлоу [86] исследовал влияние малых количеств иона калия в титранте (0,25 М. гидроксид тетрабутиламмония) на электродную функцию в смеси 80% пиридина и 20% изопропанола и обнаружил уменьшение чувствительности электрода к изменениям кислотности. Величина эффекта изменялась от электрода к электроду и зависела от состава стекла и предварительной его обработки. Систематическое изучение щелочной ошибки стеклянного электрода в изопропаноле проводили Карлберг и Юханссон [87], которые сравнивали поведение стеклянного и водородного электродов в изопропаноле. Ими установлено, что стеклянные электроды, показывающие малую щелочную ошибку в воде, в изопропаноле ведут себя идеально. Двухвалентные ионы вызывают меньшие отклонения потенциала от его идеального значения, чем одновалентные. При перенесении электродов из щелочных в кислотные растворы наблюдается гистерезис, но это явление не отмечается при обратном перенесении. Таким образом, титрование следует проводить от кислотных к щелочным растворам, а не наоборот. [c.296]
В работе [103] изучалось электродное поведение в жидком аммиаке при —38 °С. Катионоселективные электроды обратимы к про-тонированкому растворителю (NHJ) и поэтому могут применяться для измерения активности ионов NH при введении поправок на щелочную ошибку электродов. При переходе от воды к жидкому аммиаку как растворителю резко изменяется ряд селективности стеклянного электрода. Описан также метод определения констант кислотности слабых кислот в жидком аммиаке с помощью стеклянного электрода [104]. [c.301]
Основы аналитической химии Часть 2 (1979) — [
c.432
]
Определение рН теория и практика (1968) — [
c.283
,
c.285
]
Щелочная и кислотная погрешность
•При измерении pH с помощью стеклянного электрода возникает два типа погрешностей (отклонение от теоретического отклика):
•Первый из них называется щелочной погрешностью. Она обусловлена способностью мембраны реагировать наряду с протонами на присутствие других катионов. По мере снижения активности протонов эти ионы становятся потенциал определяющими.
•Второй тип погрешности определения pH с помощью стеклянного электрода — кислотная погрешность. Она обусловлена тем, что потенциал мембраны зависит от активности контактирующей с ней воды. При активности воды, равной единицы, потенциал электрода описывается уравнением Нернста. Но в очень кислых растворах активность воды меньше единицы (заметное количество расходуется на сольватацию протонов) и поэтому при измерении pH возникает положительная погрешность. Подобного типа погрешность возникает также из- за уменьшения активности воды при высокой концентрации растворенных солей или при добавлении неводного растворителя, например, этанола.


Калибровка электродов
•Стандартный потенциал для каждого электрода имеет свою величину. Со временем эта величина меняется
•Электроды нужно периодически калибровать
•Стеклянный электрод перед каждым измерением рН калибруется по стандартным буферным растворам с точно известным рН

Фторид-селективный электрод
•Определяемый ион: фторид-анион F—
•Материал мембраны: монокристалл LaF3 + EuF2
•Диапазон измерения, моль/л: 10-5 — 10-1
•Диапазон pH: 4.5.- 8.0
•Рабочая температура, °С: 5 – 50
•Существенно мешают определению активности фторид-ионов только катионы, образующие комплексные соединения с фторид-ионами – Al3+, Fe3+, Ce4+, Si4+, Li+, Th4+.

Буферный раствор общей ионной силы (БРОИС, англ. TISAB)
Для обеспечения постоянства ионной силы (а также величины pH) анализируемого раствора к нему добавляют кондиционирующие растворы в соотношении 1:1. При определении фторид-ионов таким растворов является — TISAB:
Состав TISAB 1M NaCl + ацетатная буферная смесь pH=5 + цитрат-ионы (~10-3 M) для связывания Al3+

Электроды с (поли)кристаллическими мембранами
•Практическое значение имеет ионселективный электрод с мембраной из сульфида серебра, пригодный для измерения концентрации (активности) и Ag+— и S2--ионов.
•AgS является превосходным электродно-активным веществом и обладает малой
растворимостью (Ks~10-51 моль3∙л-3), высокой устойчивостью к окислителям и восстановителям, низким электрическим сопротивлением.
•Серебро этим электродом может быть определено в интервале от 1 до 10-7 М, а в некоторых условиях и до 10-12 М и ниже. В столь же низких концентрациях могут быть определены и сульфид-ионы.
•На основе сульфида серебра можно изготовить множество других ионселективных
мембран. Например, в результате прессования смесей порошков Ag2S и галогенидов либо псевдогалогенидов серебра AgX (X = Cl, Вг, I, SCN) получаются мембраны, которые чувствительны не только к ионам Ag+ и S2-, но и X—. В соответствии с уравнением гетерогенного равновесия активность ионов серебра на поверхности мембраны однозначно связана с активностью ионов Х—. Потенциал такого электрода определяется выражением:

Состав наиболее распространенных кристаллических мембран
Определяемый ион
Cl—
Br—
I—
SCN—
S2-
Ag+
Cu2+
Pb2+
Cd2+
Состав мембраны
AgCl или AgCl+Ag2S AgBr или AgBr+Ag2S AgI или AgI+Ag2S AgSCN+Ag2S
Ag2S
Ag2S
Cu1,8Se или CuS+Ag2S PbS+Ag2S CdS+Ag2S

Жидкостные ионоселективные электроды
Конструкция электродов с жидкими мембранами аналогична конструкции твердых мембранных электродов, только вместо твердой мембраны в корпус электрода вклеена пористая гидрофобная мембрана из пластика, которая пропитывается
ионочувствительной органической жидкостью. Внутрь электрода залит стандартный раствор. В качестве токоотвода используют хлор-серебряный полуэлемент. Внутренний стандартный раствор представляет собой 0,1 М раствор хлорида калия и 0,1 М раствор соли измеряемого иона.
Пример: Ca-селективный электрод, содержит в качестве жидкого ионита кальциевую соль алкилфосфорной кислоты, растворенную в диалкилфенилфосфонате:
E = E0мембр –
0,0291lgaCa2+

Ионофоры, применяемые в ИСЭ с жидкой мембраной
Соседние файлы в папке Лекции
- #
- #
- #
- #
- #
- #
15.04.20192.52 Mб92Диаграмма Яблонского 400.tif
- #
Щелочная ошибка — стеклянный электрод
Cтраница 1
Щелочная ошибка стеклянных электродов является следствием наличия у них не только водородной, но и металлической функции.
[2]
Стабильность, электропроводность и щелочная ошибка стеклянных электродов предположительно связываются с ионными свойствами модифицирующих элементов ( например, щелочных и щелочноземельных катионов), находящихся в пустотах решетки стекла.
[3]
На рис. 2 представлены данные по щелочным ошибкам стеклянных электродов из натриево-силикатных стекол. По нашим измерениям, перелом кривой в области фазовой границы между тридимитом и дисиликатом натрия получается менее резким, чем по Хаббарду.
[5]
Этот ряд точно соответствует характеру влияния окислов на величину щелочных ошибок стеклянных электродов, но окислы, улучшающие химическую устойчивость стекол, увеличивают ошибки, а окислы, понижающие химическую устойчивость, понижают и щелочные ошибки электродов.
[6]
Кривые ошибок стеклянных электродов и кривые химической устойчивости стекол имеют одинаковый ход концентрационной зависимости. Однако не следует считать, что щелочные ошибки стеклянного электрода вызываются растворением стекла его мембраны.
[7]
Таким образом, вырисовывается парадоксальная картина. С одной стороны, окислы, увеличивающие химическую устойчивость стекол т увеличивают щелочные ошибки стеклянного электрода. С другой стороны, пока замена Si02 на ВаО увеличивает химическую устойчивость стекол, щелочные ошибки стеклянных электродов уменьшаются. Когда количество ВаО, введенного в стекло за счет кремнезема, достигает примерно-12 %, дальнейшее введение Ва. Одновременно начинают резко увеличиваться щелочные ошибки стеклянных электродов.
[9]
Уравнение (VI.67) строго справедливо для кислых, нейтральных и слабощелочных растворов. При больших рН наблюдаются отклонения от этого уравнения, величины которых зависят от сорта стекла, природы катионов раствора и рН среды. Эти отклонения называются щелочной ошибкой стеклянного электрода.
[11]
Уравнение (VI.67) строго справедливо для кислых, нейтральных и слабощелочных растворов. При больших рН наблюдаются отклонения от этого уравнения, значения которых зависят от сорта стекла, природы катионов раствора и рН среды. Эти отклонения называются щелочной ошибкой стеклянного электрода. Однако эта кислотная ошибка не зависит от природы анионов и катионов. Потенциал стеклянного электрода не искажается в присутствии каких-либо окислительно-восстановительных систем, в растворах солей тяжелых и благородных металлов, так называемых электродных ядов ( сернистых, мышьяковистых и других соединений), органических веществ. Стеклянный электрод можно применять в окрашенных и мутных растворах, в средах, не обладающих буферностью, вблизи точки нейтрализации, причем скорость установления ЕСт достаточно велика. Стеклянные микроэлектроды позволяют определить рН в небольших объемах жидкости и очень удобны для измерения рН в биологических объектах.
[12]
Увеличение концентрации ионов металла ( Na или К) также способствует возрастанию сопротивления гелевого слоя. В растворах, где отмечается щелочная ошибка стеклянного электрода, граница между гелевым слоем и неизменной толщей стекла движется значительно медленнее, чем при воздействии на электрод нейтральных растворов. С другой стороны, граница между гелевым слоем и раствором движется много быстрее вследствие растворения стекла. Следовательно, толщина гелевого слоя уменьшается со временем при нахождении электрода в щелочных растворах. С этой точки зрения очевидно, что ионообменные свойства гелевого слоя определяют функцию стеклянного электрода.
[13]
Таким образом, вырисовывается парадоксальная картина. С одной стороны, окислы, увеличивающие химическую устойчивость стекол т увеличивают щелочные ошибки стеклянного электрода. С другой стороны, пока замена Si02 на ВаО увеличивает химическую устойчивость стекол, щелочные ошибки стеклянных электродов уменьшаются. Когда количество ВаО, введенного в стекло за счет кремнезема, достигает примерно-12 %, дальнейшее введение Ва. Одновременно начинают резко увеличиваться щелочные ошибки стеклянных электродов.
[14]
Систематическое изучение щелочной ошибки стеклянного электрода в изопропаноле проводили Карлберг и Юханссон [87], которые сравнивали поведение стеклянного и водородного электродов в изопропаноле. Ими установлено, что стеклянные электроды, показывающие малую щелочную ошибку в воде, в изопропаноле ведут себя идеально. Двухвалентные ионы вызывают меньшие отклонения потенциала от его идеального значения, чем одновалентные. При перенесении электродов из щелочных в кислотные растворы наблюдается гистерезис, но это явление не отмечается при обратном перенесении. Таким образом, титрование следует проводить от кислотных к щелочным растворам, а не наоборот.
[15]
Страницы:
1
2
In chemistry, pH ( pee-AYCH), also referred to as acidity or basicity, historically denotes «potential of hydrogen» (or «power of hydrogen»).[1] It is a scale used to specify the acidity or basicity of an aqueous solution. Acidic solutions (solutions with higher concentrations of hydrogen (H+) ions) are measured to have lower pH values than basic or alkaline solutions.
The pH scale is logarithmic and inversely indicates the activity of hydrogen ions in the solution
where [H+] is the equilibrium molar concentration (mol/L) of H+ in the solution. At 25 °C (77°F), solutions with a pH less than 7 are acidic, and solutions with a pH greater than 7 are basic. Solutions with a pH of 7 at 25 °C are neutral (i.e. have the same concentration of H+ ions as OH− ions, i.e. the same as pure water). The neutral value of the pH depends on the temperature and is lower than 7 if the temperature increases above 25 °C. The pH range is commonly given as zero to 14, but a pH value can be less than 0 for very concentrated strong acids or greater than 14 for very concentrated strong bases.[2]
The pH scale is traceable to a set of standard solutions whose pH is established by international agreement.[3] Primary pH standard values are determined using a concentration cell with transference by measuring the potential difference between a hydrogen electrode and a standard electrode such as the silver chloride electrode. The pH of aqueous solutions can be measured with a glass electrode and a pH meter or a color-changing indicator. Measurements of pH are important in chemistry, agronomy, medicine, water treatment, and many other applications.
History[edit]
In 1909, the Danish chemist Søren Peter Lauritz Sørensen introduced the concept of pH at the Carlsberg Laboratory,[4] originally using the notation «pH•«, with H• as a subscript to the lowercase p. The concept was later revised in 1924 to the modern pH to accommodate definitions and measurements in terms of electrochemical cells.
For the sign p, I propose the name ‘hydrogen ion exponent’ and the symbol pH•. Then, for the hydrogen ion exponent (pH•) of a solution, the negative value of the Briggsian logarithm of the related hydrogen ion normality factor is to be understood.[4]
Sørensen did not explain why he used the letter p, and the exact meaning of the letter is still disputed.[5] Sørensen described a way of measuring pH using potential differences, and it represents the negative power of 10 in the concentration of hydrogen ions. The letter p could stand for the French puissance, German Potenz, or Danish potens, all meaning «power», or it could mean «potential». All of these words start with the letter p in French, German, and Danish, which were the languages in which Sørensen published: Carlsberg Laboratory was French-speaking; German was the dominant language of scientific publishing; Sørensen was Danish. He also used the letter q in much the same way elsewhere in the paper, and he might have arbitrarily labelled the test solution «p» and the reference solution «q»; these letters are often paired.[6] Some literature sources suggest that «pH» stands for the Latin term pondus hydrogenii (quantity of hydrogen) or potentia hydrogenii (power of hydrogen), although this is not supported by Sørensen’s writings.[7][8][9]
In modern chemistry, the p stands for «the negative decimal logarithm of», and is used in the term pKa for acid dissociation constants,[10] so pH is «the negative decimal logarithm of H+ ion concentration», while pOH is «the negative decimal logarithm of OH- ion concentration».
Bacteriologist Alice Catherine Evans, who influenced dairying and food safety, credited William Mansfield Clark and colleagues, including herself, with developing pH measuring methods in the 1910s, which had a wide influence on laboratory and industrial use thereafter. In her memoir, she does not mention how much, or how little, Clark and colleagues knew about Sørensen’s work a few years prior.[11] She said:
In these studies [of bacterial metabolism] Dr. Clark’s attention was directed to the effect of acid on the growth of bacteria. He found that it is the intensity of the acid in terms of hydrogen-ion concentration that affects their growth. But existing methods of measuring acidity determined the quantity, not the intensity, of the acid. Next, with his collaborators, Dr. Clark developed accurate methods for measuring hydrogen-ion concentration. These methods replaced the inaccurate titration method of determining the acid content in use in biologic laboratories throughout the world. Also they were found to be applicable in many industrial and other processes in which they came into wide usage.[11]
The first electronic method for measuring pH was invented by Arnold Orville Beckman, a professor at the California Institute of Technology in 1934.[12] It was in response to a request from the local citrus grower Sunkist, which wanted a better method for quickly testing the pH of lemons they were picking from their nearby orchards.[13]
Definition[edit]
pH[edit]
The pH of a solution is defined as the decimal logarithm of the reciprocal of the hydrogen ion activity, aH+.[14] Mathematically, pH is expressed as:
For example, for a solution with a hydrogen ion activity of 5×10−6 (i.e., the concentration of hydrogen ions in moles per litre), the pH of the solution can be calculated as follows:
The concept of pH was developed because ion-selective electrodes, which are used to measure pH, respond to activity. The electrode potential, E, follows the Nernst equation for the hydrogen ion, which can be expressed as:
where E is a measured potential, E0 is the standard electrode potential, R is the gas constant, T is the temperature in kelvins, F is the Faraday constant. For H+, the number of electrons transferred is one. The electrode potential is proportional to pH when pH is defined in terms of activity.
The precise measurement of pH is presented in International Standard ISO 31-8 as follows:[15] A galvanic cell is set up to measure the electromotive force (e.m.f.) between a reference electrode and an electrode sensitive to the hydrogen ion activity when they are both immersed in the same aqueous solution. The reference electrode may be a silver chloride electrode or a calomel electrode, and the hydrogen-ion selective electrode is a standard hydrogen electrode.
- Reference electrode | concentrated solution of KCl || test solution | H2 | Pt
Firstly, the cell is filled with a solution of known hydrogen ion activity and the electromotive force, ES, is measured. Then the electromotive force, EX, of the same cell containing the solution of unknown pH is measured.
The difference between the two measured electromotive force values is proportional to pH. This method of calibration avoids the need to know the standard electrode potential. The proportionality constant, 1/z, is ideally equal to 
In practice, a glass electrode is used instead of the cumbersome hydrogen electrode. A combined glass electrode has an in-built reference electrode. It is calibrated against buffer solutions of known hydrogen ion (H+) activity proposed by the International Union of Pure and Applied Chemistry (IUPAC).[16] Two or more buffer solutions are used in order to accommodate the fact that the «slope» may differ slightly from ideal. To calibrate the electrode, it is first immersed in a standard solution, and the reading on a pH meter is adjusted to be equal to the standard buffer’s value. The reading from a second standard buffer solution is then adjusted using the «slope» control to be equal to the pH for that solution. Further details, are given in the IUPAC recommendations.[14] When more than two buffer solutions are used the electrode is calibrated by fitting observed pH values to a straight line with respect to standard buffer values. Commercial standard buffer solutions usually come with information on the value at 25 °C and a correction factor to be applied for other temperatures.
The pH scale is logarithmic and therefore pH is a dimensionless quantity.[17]
p[H][edit]
This was the original definition of Sørensen in 1909,[18] which was superseded in favor of pH in 1924. [H] is the concentration of hydrogen ions, denoted [H+] in modern chemistry. More correctly, the thermodynamic activity of H+ in dilute solution should be replaced by [H+]/c0, where the standard state concentration c0 = 1 mol/L. This ratio is a pure number whose logarithm can be defined.
It is possible to measure the concentration of hydrogen ions directly using an electrode calibrated in terms of hydrogen ion concentrations. One common method is to titrate a solution of known concentration of a strong acid with a solution of known concentration of strong base in the presence of a relatively high concentration of background electrolyte. By knowing the concentrations of the acid and base, the concentration of hydrogen ions can be calculated and the measured potential can be correlated with concentrations. The calibration is usually carried out using a Gran plot.[19] This procedure makes the activity of hydrogen ions equal to the numerical value of concentration.
The glass electrode (and other ion selective electrodes) should be calibrated in a medium similar to the one being investigated. For instance, if one wishes to measure the pH of a seawater sample, the electrode should be calibrated in a solution resembling seawater in its chemical composition.
The difference between p[H] and pH is quite small, and it has been stated that pH = p[H] + 0.04.[20] However, it is common practice to use the term «pH» for both types of measurement.
pOH[edit]
pOH is sometimes used as a measure of the concentration of hydroxide ions, OH−. pOH values are derived from pH measurements. The concentration of hydroxide ions in water is related to the concentration of hydrogen ions by
where KW is the self-ionization constant of water. Taking logarithms
So, at room temperature, pOH ≈ 14 − pH. However this relationship is not strictly valid in other circumstances, such as in measurements of soil alkalinity.
Measurement[edit]
pH Indicators[edit]
| Average pH of common solutions | ||
|---|---|---|
| Substance | pH range | Type |
| Battery acid | < 1 | Acid |
| Gastric acid | 1.0 – 1.5 | |
| Orange juice | 3.3 – 4.2 | |
| Vinegar | 4-5 | |
| Black coffee | 5 – 5.03 | |
| Milk | 6.5 – 6.8 | |
| Pure water at 25 °C | 7 | Neutral |
| Sea water | 7.5 – 8.4 | Base |
| Ammonia | 11.0 – 11.5 | |
| Bleach | 12.5 | |
| 1 M NaOH | 14 |
pH can be measured using indicators, which change color depending on the pH of the solution they are in. By comparing the color of a test solution to a standard color chart, the pH can be estimated to the nearest whole number. For more precise measurements, the color can be measured using a colorimeter or spectrophotometer. Universal indicator is a mixture of several indicators that can provide a continuous color change over a range of pH values, typically from about pH 2 to pH 10. Universal indicator paper is made from absorbent paper that has been impregnated with universal indicator. An alternative method of measuring pH is using an electronic pH meter, which directly measures the voltage difference between a pH-sensitive electrode and a reference electrode.
Non-aqueous solutions[edit]
pH values can be measured in non-aqueous solutions, but they are based on a different scale from aqueous pH values, because the standard states used for calculating hydrogen ion concentrations (activities) are different. The hydrogen ion activity, aH+, is defined[21][22] as:
where μH+ is the chemical potential of the hydrogen ion, 
pH is an example of an acidity function, but there are others that can be defined. For example, the Hammett acidity function, H0, has been developed in connection with superacids.
Unified absolute pH scale[edit]
In 2010, a new approach to measuring pH was proposed, called the «unified absolute pH scale». This approach allows for a common reference standard to be used across different solutions, regardless of their pH range. The unified absolute pH scale is based on the absolute chemical potential of the proton, as defined by the Lewis acid–base theory. This scale is applicable to liquids, gases, and even solids.[23] The advantages of the unified absolute pH scale include consistency, accuracy, and applicability to a wide range of sample types. It is precise and versatile because it serves as a common reference standard for pH measurements. However, implementation efforts, compatibility with existing data, complexity, and potential costs are some challenges.
Extremes of pH measurements[edit]
The measurement of pH can become difficult at extremely acidic or alkaline conditions, such as below pH 2.5 (ca. 0.003 mol/dm3 acid) or above pH 10.5 (above ca. 0.0003 mol/dm3 alkaline). This is due to the breakdown of the Nernst equation in this conditions when using a glass electrode. There are several factors contribute to this problem. Firstly, liquid junction potentials may not be independent of pH.[24] Secondly, the high ionic strength of concentrated solutions can affect the electrode potentials. At high pH the glass electrode may be affected by «alkaline error», because the electrode becomes sensitive to the concentration of cations such as Na+ and K+ in the solution.[25] To overcome these problems, specially constructed electrodes are available.
Runoff from mines or mine tailings can produce some extremely low pH values.[26]
Applications[edit]
Pure water has a pH of 7 at 25°C, meaning it is neutral. When an acid is dissolved in water, the pH will be less than 7, while a base, or alkali, will have a pH greater than 7. A strong acid, such as hydrochloric acid, at concentration 1 mol dm−3 has a pH of 0, while a strong alkali like sodium hydroxide, at the same concentration, has a pH of 14. Since pH is a logarithmic scale, a difference of one in pH is equivalent to a tenfold difference in hydrogen ion concentration.
Neutrality is not exactly 7 at 25°C, but 7 serves as a good approximation in most cases. Neutrality occurs when the concentration of hydrogen ions ([H+]) equals the concentration of hydroxide ions ([OH−]), or when their activities are equal. Since self-ionization of water holds the product of these concentration [H+] × [OH−] = Kw, it can be seen that at neutrality [H+] = [OH−] = √Kw, or pH = pKw/2. pKw is approximately 14 but depends on ionic strength and temperature, and so the pH of neutrality does also. Pure water and a solution of NaCl in pure water are both neutral, since dissociation of water produces equal numbers of both ions. However the pH of the neutral NaCl solution will be slightly different from that of neutral pure water because the hydrogen and hydroxide ions’ activity is dependent on ionic strength, so Kw varies with ionic strength.
When pure water is exposed to air, it becomes mildly acidic. This is because water absorbs carbon dioxide from the air, which is then slowly converted into bicarbonate and hydrogen ions (essentially creating carbonic acid).
- CO
2+ H
2O ⇌ HCO−
3+ H+
pH in soil[edit]
The United States Department of Agriculture Natural Resources Conservation Service, formerly Soil Conservation Service classifies soil pH ranges as follows:[27]
| Denomination | pH range |
|---|---|
| Ultra acidic | < 3.5 |
| Extremely acidic | 3.5–4.4 |
| Very strongly acidic | 4.5–5.0 |
| Strongly acidic | 5.1–5.5 |
| Moderately acidic | 5.6–6.0 |
| Slightly acidic | 6.1–6.5 |
| Neutral | 6.6–7.3 |
| Slightly alkaline | 7.4–7.8 |
| Moderately alkaline | 7.9–8.4 |
| Strongly alkaline | 8.5–9.0 |
| Very strongly alkaline | 9.0–10.5 |
| Hyper alkaline | > 10.5 |
In Europe, topsoil pH is influenced by soil parent material, erosional effects, climate and vegetation. A recent map[28] of topsoil pH in Europe shows the alkaline soils in Mediterranean, Hungary, East Romania, North France. Scandinavian countries, Portugal, Poland and North Germany have more acid soils.
pH in plants[edit]
Plants contain pH-dependent pigments that can be used as pH indicators, such as those found in hibiscus, red cabbage (anthocyanin), and grapes (red wine). Citrus fruits have acidic juice primarily due to the presence of citric acid, while other carboxylic acids can be found in various living systems. For instance, muscle activity results in the production of lactic acid. The protonation state of phosphate derivatives, including ATP, is pH-dependent. Hemoglobin, an oxygen-transport enzyme, is also affected by pH in a phenomenon known as the Root effect.
pH in the ocean[edit]
The pH of seawater plays an important role in the ocean’s carbon cycle. There is evidence of ongoing ocean acidification (meaning a drop in pH value): Between 1950 and 2020, the average pH of the ocean surface fell from approximately 8.15 to 8.05.[29] Carbon dioxide emissions from human activities are the primary cause of ocean acidification, with atmospheric carbon dioxide (CO2) levels exceeding 410 ppm (in 2020). CO2 from the atmosphere is absorbed by the oceans. This produces carbonic acid (H2CO3) which dissociates into a bicarbonate ion (HCO−
3) and a hydrogen ion (H+). The presence of free hydrogen ions (H+) lowers the pH of the ocean.
Three pH scales in oceanography[edit]
The measurement of pH in seawater is complicated by the chemical properties of seawater, and three distinct pH scales exist in chemical oceanography.[30] In practical terms, the three seawater pH scales differ in their pH values up to 0.10, differences that are much larger than the accuracy of pH measurements typically required, in particular, in relation to the ocean’s carbonate system.[30] Since it omits consideration of sulfate and fluoride ions, the free scale is significantly different from both the total and seawater scales. Because of the relative unimportance of the fluoride ion, the total and seawater scales differ only very slightly.
As part of its operational definition of the pH scale, the IUPAC defines a series of buffer solutions across a range of pH values (often denoted with National Bureau of Standards (NBS) or National Institute of Standards and Technology (NIST) designation). These solutions have a relatively low ionic strength (≈0.1) compared to that of seawater (≈0.7), and, as a consequence, are not recommended for use in characterizing the pH of seawater, since the ionic strength differences cause changes in electrode potential. To resolve this problem, an alternative series of buffers based on artificial seawater was developed.[31] This new series resolves the problem of ionic strength differences between samples and the buffers, and the new pH scale is referred to as the total scale, often denoted as pHT. The total scale was defined using a medium containing sulfate ions. These ions experience protonation, H+ + SO2−
4↔ HSO−
4, such that the total scale includes the effect of both protons (free hydrogen ions) and hydrogen sulfate ions:
- [H+]T = [H+]F + [HSO−
4]
An alternative scale, the free scale, often denoted pHF, omits this consideration and focuses solely on [H+]F, in principle making it a simpler representation of hydrogen ion concentration. Only [H+]T can be determined,[32] therefore [H+]F must be estimated using the [SO2−
4] and the stability constant of HSO−
4, K*
S:
- [H+]F = [H+]T − [HSO−
4] = [H+]T ( 1 + [SO2−
4] / K*
S )−1
However, it is difficult to estimate K*
S in seawater, limiting the utility of the otherwise more straightforward free scale.
Another scale, known as the seawater scale, often denoted pHSWS, takes account of a further protonation relationship between hydrogen ions and fluoride ions, H+ + F− ⇌ HF. Resulting in the following expression for [H+]SWS:
- [H+]SWS = [H+]F + [HSO−
4] + [HF]
However, the advantage of considering this additional complexity is dependent upon the abundance of fluoride in the medium. In seawater, for instance, sulfate ions occur at much greater concentrations (>400 times) than those of fluoride. As a consequence, for most practical purposes, the difference between the total and seawater scales is very small.
The following three equations summarize the three scales of pH:
- pHF = −log [H+]F
- pHT = −log([H+]F + [HSO−
4]) = −log[H+]T - pHSWS = −log(H+]F + [HSO−
4] + [HF]) = −log[v]SWS
pH of various body fluids[edit]
-
pH of various body fluids[33]
Compartment pH Gastric acid 1.5–3.5[34] Lysosomes 4.5[33] Human skin 4.7[35] Granules of chromaffin cells 5.5 Urine 6.0 Cytosol 7.2 Blood (natural pH) 7.34–7.45[33] Cerebrospinal fluid (CSF) 7.5 Mitochondrial matrix 7.5 Pancreas secretions 8.1
In living organisms, the pH of various body fluids, cellular compartments, and organs is tightly regulated to maintain a state of acid-base balance known as acid–base homeostasis. Acidosis, defined by a pH below 7.35, is the most common disorder of acid–base homeostasis and occurs when there is an excess of acid in the body. In contrast, alkalosis is characterized by excessively high blood pH.
Blood pH is usually slightly basic, with a pH of 7.365, referred to as physiological pH in biology and medicine. Plaque formation in teeth can create a local acidic environment that results in tooth decay through demineralization. Enzymes and other proteins have an optimal pH range for function and can become inactivated or denatured outside this range.
pH calculations[edit]
When calculating the pH of a solution containing acids and/or bases, a chemical speciation calculation is used to determine the concentration of all chemical species present in the solution. The complexity of the procedure depends on the nature of the solution. Strong acids and bases are compounds that are almost completely dissociated in water, which simplifies the calculation. However, for weak acids, a quadratic equation must be solved, and for weak bases, a cubic equation is required. In general, a set of non-linear simultaneous equations must be solved.
Water itself is a weak acid and a weak base, so its dissociation must be taken into account at high pH and low solute concentration (see amphoterism). It dissociates according to the equilibrium
- 2 H2O ⇌ H3O+ (aq) + OH− (aq)
with a dissociation constant, Kw defined as
where [H+] stands for the concentration of the aqueous hydronium ion and [OH−] represents the concentration of the hydroxide ion. This equilibrium needs to be taken into account at high pH and when the solute concentration is extremely low.
Strong acids and bases[edit]
Strong acids and bases are compounds that are essentially fully dissociated in water. This means that in an acidic solution, the concentration of hydrogen ions (H+) can be considered equal to the concentration of the acid. Similarly, in a basic solution, the concentration of hydroxide ions (OH-) can be considered equal to the concentration of the base. The pH of a solution is defined as the negative logarithm of the concentration of H+, and the pOH is defined as the negative logarithm of the concentration of OH-. For example, the pH of a 0.01M solution of hydrochloric acid (HCl) is equal to 2 (pH = −log10(0.01)), while the pOH of a 0.01M solution of sodium hydroxide (NaOH) is equal to 2 (pOH = −log10(0.01)), which corresponds to a pH of about 12.
However, self-ionization of water must also be considered when concentrations of a strong acid or base is very low or high. For instance, a 5×10−8M solution of HCl would be expected to have a pH of 7.3 based on the above procedure, which is incorrect as it is acidic and should have a pH of less than 7. In such cases, the system can be treated as a mixture of the acid or base and water, which is an amphoteric substance. By accounting for the self-ionization of water, the true pH of the solution can be calculated. For example, a 5×10−8M solution of HCl would have a pH of 6.89 when treated as a mixture of HCl and water. The self-ionization equilibrium of solutions of sodium hydroxide at higher concentrations must also be considered.[36]
Weak acids and bases[edit]
A weak acid or the conjugate acid of a weak base can be treated using the same formalism.
- Acid HA: HA ⇌ H+ + A−
- Base A: HA+ ⇌ H+ + A
First, an acid dissociation constant is defined as follows. Electrical charges are omitted from subsequent equations for the sake of generality
and its value is assumed to have been determined by experiment. This being so, there are three unknown concentrations, [HA], [H+] and [A−] to determine by calculation. Two additional equations are needed. One way to provide them is to apply the law of mass conservation in terms of the two «reagents» H and A.
C stands for analytical concentration. In some texts, one mass balance equation is replaced by an equation of charge balance. This is satisfactory for simple cases like this one, but is more difficult to apply to more complicated cases as those below. Together with the equation defining Ka, there are now three equations in three unknowns. When an acid is dissolved in water CA = CH = Ca, the concentration of the acid, so [A] = [H]. After some further algebraic manipulation an equation in the hydrogen ion concentration may be obtained.
Solution of this quadratic equation gives the hydrogen ion concentration and hence p[H] or, more loosely, pH. This procedure is illustrated in an ICE table which can also be used to calculate the pH when some additional (strong) acid or alkaline has been added to the system, that is, when CA ≠ CH.
For example, what is the pH of a 0.01M solution of benzoic acid, pKa = 4.19?
For alkaline solutions, an additional term is added to the mass-balance equation for hydrogen. Since the addition of hydroxide reduces the hydrogen ion concentration, and the hydroxide ion concentration is constrained by the self-ionization equilibrium to be equal to ![{\displaystyle {\frac {K_{w}}{{\ce {[H+]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/671c1d10d6bce20ed4de57be093835a6aad5019f)
General method[edit]
Some systems, such as with polyprotic acids, are amenable to spreadsheet calculations.[37] With three or more reagents or when many complexes are formed with general formulae such as ApBqHr, the following general method can be used to calculate the pH of a solution. For example, with three reagents, each equilibrium is characterized by an equilibrium constant, β.
Next, write down the mass-balance equations for each reagent:
Note that there are no approximations involved in these equations, except that each stability constant is defined as a quotient of concentrations, not activities. Much more complicated expressions are required if activities are to be used.
There are three non-linear simultaneous equations in the three unknowns, [A], [B] and [H]. Because the equations are non-linear and their concentrations may range over many powers of 10, the solution of these equations is not straightforward. However, many computer programs are available which can be used to perform these calculations. There may be more than three reagents. The calculation of hydrogen ion concentrations, using this approach, is a key element in the determination of equilibrium constants by potentiometric titration.
See also[edit]
- pH indicator
- Arterial blood gas
- Chemical equilibrium
- pCO2
- pKa
References[edit]
- ^ Jensen, William B. (2004). «The Symbol for pH» (PDF). Journal of Chemical Education. 81 (1): 21. Bibcode:2004JChEd..81…21J. doi:10.1021/ed081p21. Archived (PDF) from the original on 14 December 2019. Retrieved 15 July 2020.
- ^ Lim, Kieran F. (2006). «Negative pH Does Exist». Journal of Chemical Education. 83 (10): 1465. Bibcode:2006JChEd..83.1465L. doi:10.1021/ed083p1465.
- ^ Covington, A. K.; Bates, R. G.; Durst, R. A. (1985). «Definitions of pH scales, standard reference values, measurement of pH, and related terminology» (PDF). Pure Appl. Chem. 57 (3): 531–542. doi:10.1351/pac198557030531. S2CID 14182410. Archived (PDF) from the original on 24 September 2007.
- ^ a b Sørensen, S. P. L. (1909). «Über die Messung und die Bedeutung der Wasserstoffionenkonzentration bei enzymatischen Prozessen» (PDF). Biochem. Z. 21: 131–304. Archived (PDF) from the original on 15 April 2021. Retrieved 22 March 2021.
Original German: Für die Zahl p schlage ich den Namen Wasserstoffionenexponent und die Schreibweise pH• vor. Unter dem Wasserstoffionexponenten (pH•) einer Lösungwird dann der Briggsche Logarithmus des reziproken Wertes des auf Wasserstoffionenbezagenen Normalitäts faktors de Lösungverstanden.
Two other publications appeared in 1909, one in French and one in Danish. - ^ Francl, Michelle (August 2010). «Urban legends of chemistry». Nature Chemistry. 2 (8): 600–601. Bibcode:2010NatCh…2..600F. doi:10.1038/nchem.750. ISSN 1755-4330. PMID 20651711. Archived from the original on 6 August 2020. Retrieved 21 July 2019.
- ^ Myers, Rollie J. (2010). «One-Hundred Years of pH». Journal of Chemical Education. 87 (1): 30–32. Bibcode:2010JChEd..87…30M. doi:10.1021/ed800002c.
- ^ Otterson, David W. (2015). «Tech Talk: (11) pH Measurement and Control Basics». Measurement and Control. 48 (10): 309–312. doi:10.1177/0020294015600474. S2CID 110716297. Retrieved 16 June 2022.
- ^ Lian, Ying; Zhang, Wei; Ding, Longjiang; Zhang, Xiaoai; Zhang, Yinglu; Wang, Xu-dong (2019). «Nanomaterials for Intracellular pH Sensing and Imaging». Novel Nanomaterials for Biomedical, Environmental and Energy Applications. Micro and Nano Technologies: 241–273. doi:10.1016/B978-0-12-814497-8.00008-4. ISBN 9780128144978. S2CID 104410918. Retrieved 16 June 2022.
- ^ Bradley, David (21 February 2018). «When it comes to caustic wit and an acid tongue, mind your Ps and Qs». Materials Today. Retrieved 16 June 2022.
- ^ Nørby, Jens (2000). «The origin and the meaning of the little p in pH». Trends in Biochemical Sciences. 25 (1): 36–37. doi:10.1016/S0968-0004(99)01517-0. PMID 10637613.
- ^ a b Evans, Alice C. (1963). «Memoirs» (PDF). NIH Office of History. National Institutes of Health Office of History. Archived from the original (PDF) on 15 December 2017. Retrieved 27 March 2018.
- ^ «Origins: Birth of the pH Meter». Caltech Engineering & Science Magazine. Archived from the original on 6 November 2018. Retrieved 11 March 2018.
- ^ Tetrault, Sharon (June 2002). «The Beckmans». Orange Coast. Orange Coast Magazine. Archived from the original on 15 April 2021. Retrieved 11 March 2018.
- ^ a b Covington, A. K.; Bates, R. G.; Durst, R. A. (1985). «Definitions of pH scales, standard reference values, measurement of pH, and related terminology» (PDF). Pure Appl. Chem. 57 (3): 531–542. doi:10.1351/pac198557030531. S2CID 14182410. Archived (PDF) from the original on 24 September 2007.
- ^ Quantities and units – Part 8: Physical chemistry and molecular physics, Annex C (normative): pH. International Organization for Standardization, 1992.
- ^ Covington, A. K.; Bates, R. G.; Durst, R. A. (1985). «Definitions of pH scales, standard reference values, measurement of pH, and related terminology» (PDF). Pure Appl. Chem. 57 (3): 531–542. doi:10.1351/pac198557030531. S2CID 14182410. Archived (PDF) from the original on 24 September 2007.
- ^ Gold, Victor, ed. (2019). The IUPAC Compendium of Chemical Terminology: The Gold Book (4 ed.). Research Triangle Park, NC: International Union of Pure and Applied Chemistry (IUPAC). doi:10.1351/goldbook.p04525.
- ^ «Carlsberg Group Company History Page». Carlsberggroup.com. Archived from the original on 18 January 2014. Retrieved 7 May 2013.
- ^ Rossotti, F.J.C.; Rossotti, H. (1965). «Potentiometric titrations solution containing the background electrolyte». J. Chem. Educ. 42. doi:10.1021/ed042p375.
- ^ Mendham, J.; Denney, R. C.; Barnes, J. D.; Thomas, M. J. K. (2000), Vogel’s Quantitative Chemical Analysis (6th ed.), New York: Prentice Hall, ISBN 0-582-22628-7, Section 13.23, «Determination of pH»
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the «Gold Book») (1997). Online corrected version: (2006–) «activity (relative activity), a«. doi:10.1351/goldbook.A00115
- ^ International Union of Pure and Applied Chemistry (1993). Quantities, Units and Symbols in Physical Chemistry, 2nd edition, Oxford: Blackwell Science. ISBN 0-632-03583-8. pp. 49–50. Electronic version.
- ^ Himmel, Daniel; Goll, Sascha K.; Leito, Ivo; Krossing, Ingo (16 August 2010). «A Unified pH Scale for All Phases». Angewandte Chemie International Edition. 49 (38): 6885–6888. doi:10.1002/anie.201000252. ISSN 1433-7851. PMID 20715223.
- ^ Feldman, Isaac (1956). «Use and Abuse of pH measurements». Analytical Chemistry. 28 (12): 1859–1866. doi:10.1021/ac60120a014.
- ^ Mendham, J.; Denney, R. C.; Barnes, J. D.; Thomas, M. J. K. (2000), Vogel’s Quantitative Chemical Analysis (6th ed.), New York: Prentice Hall, ISBN 0-582-22628-7, Section 13.19 The glass electrode
- ^ Nordstrom, D. Kirk; Alpers, Charles N. (March 1999). «Negative pH, efflorescent mineralogy, and consequences for environmental restoration at the Iron Mountain Superfund site, California». Proceedings of the National Academy of Sciences of the United States of America. 96 (7): 3455–62. Bibcode:1999PNAS…96.3455N. doi:10.1073/pnas.96.7.3455. PMC 34288. PMID 10097057. Archived from the original on 23 September 2017. Retrieved 4 November 2018.
- ^ Soil Survey Division Staff. «Soil survey manual.1993. Chapter 3, selected chemical properties». Soil Conservation Service. U.S. Department of Agriculture Handbook 18. Archived from the original on 14 May 2011. Retrieved 12 March 2011.
- ^ Ballabio, Cristiano; Lugato, Emanuele; Fernández-Ugalde, Oihane; Orgiazzi, Alberto; Jones, Arwyn; Borrelli, Pasquale; Montanarella, Luca; Panagos, Panos (2019). «Mapping LUCAS topsoil chemical properties at European scale using Gaussian process regression». Geoderma. 355: 113912. Bibcode:2019Geode.355k3912B. doi:10.1016/j.geoderma.2019.113912. PMC 6743211. PMID 31798185.
- ^ Terhaar, Jens; Frölicher, Thomas L.; Joos, Fortunat (2023). «Ocean acidification in emission-driven temperature stabilization scenarios: the role of TCRE and non-CO2 greenhouse gases». Environmental Research Letters. 18 (2): 024033. Bibcode:2023ERL….18b4033T. doi:10.1088/1748-9326/acaf91. ISSN 1748-9326. S2CID 255431338.
- ^ a b Zeebe, R. E. and Wolf-Gladrow, D. (2001) CO2 in seawater: equilibrium, kinetics, isotopes, Elsevier Science B.V., Amsterdam, Netherlands ISBN 0-444-50946-1
- ^ Hansson, I. (1973). «A new set of pH-scales and standard buffers for seawater». Deep-Sea Research. 20 (5): 479–491. Bibcode:1973DSRA…20..479H. doi:10.1016/0011-7471(73)90101-0.
- ^ Dickson, A. G. (1984). «pH scales and proton-transfer reactions in saline media such as sea water». Geochim. Cosmochim. Acta. 48 (11): 2299–2308. Bibcode:1984GeCoA..48.2299D. doi:10.1016/0016-7037(84)90225-4.
- ^ a b c Boron, Walter, F.; Boulpaep, Emile L. (13 January 2012). Medical Physiology: A Cellular And Molecular Approach (2nd ed.). Elsevier Health Sciences, Saunders. pp. 652–671. ISBN 9781455711819. OCLC 1017876653. Archived from the original on 8 May 2022. Retrieved 8 May 2022.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ^ Marieb, Elaine N.; Mitchell, Susan J. (30 June 2011). Human anatomy & physiology. San Francisco: Benjamin Cummings. ISBN 9780321735287. Archived from the original on 8 May 2022. Retrieved 8 May 2022.
- ^ Lambers, H.; Piessens, S.; Bloem, A.; Pronk, H.; Finkel, P. (1 October 2006). «Natural skin surface pH is on average below 5, which is beneficial for its resident flora». International Journal of Cosmetic Science. 28 (5): 359–370. doi:10.1111/j.1467-2494.2006.00344.x. ISSN 1468-2494. PMID 18489300. S2CID 25191984. Archived from the original on 21 March 2022. Retrieved 8 May 2022.
- ^ Maloney, Chris. «pH calculation of a very small concentration of a strong acid». Archived from the original on 8 July 2011. Retrieved 13 March 2011.
- ^ Billo, E.J. (2011). EXCEL for Chemists (3rd ed.). Wiley-VCH. ISBN 978-0-470-38123-6.
External links[edit]
Wikimedia Commons has media related to pH.
2. ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
2.1. Потенциометрия
Лабораторная работа № 6. Потенциометрическое титрование.
2.2.Фотометрический анализ
Лабораторная работа № 7. Фотометрическое определение железа в виде тиоцианатных комплексов.
Лабораторная работа № 8 Фотометрическое определение железа с сульфосалициловой кислотой
2.3. Эмиссионный спектральный анализ
Лабораторная работа № 9 Пламенно-фотометрическое определение натрия
в водопроводной воде методом калибровочного графика
2.1. Потенциометрия
Потенциометрический метод анализа основан
на измерении электродного потенциала, величина которого обусловлена концентрацией
(точнее, активностью) потенциалопределяющего компонента раствора.
Для расчета электродного потенциала (Е, В) служит уравнение Нернста:
где Е0 – стандартный потенциал, В; R — универсальная газовая постоянная (8,313 Дж);
Т — абсолютная температура, К; F — число Фарадея (96 490 Кл);
n — заряд потенциалоопределякщего иона, а — его активность.
После введения численных значений величин R и Т, (температуру принимают равной 298 К (25° С),
и учета коэффициента перехода от натуральных логарифмов к десятичным (2,3026) получают уравнение:
Активность ионов связана с концентрацией с оотношением а = f*с,
где f — коэффициент активности. В разбавленных растворах коэффициент активности близок к единице,
для бесконечно раз¬бавленных растворов уравнение Нернста имеет вид:
Потенциометрический метод анализа подразделяется на прямую потенциометрию (ионометрия) и
потенциометрическое титрование. Прямая потенциометрия основана на измерении потенциала
индикаторного электрода и расчете концентрации определяемых ионов по уравнению Нернста.
В основе потенциометрического титро-вания лежит резкое изменение потенциала индикаторного электрода
в точке эквивалентности. Используемый в потенциометрических определениях гальванический элемент включает два
электрода, которые погружают в один раствор (гальванический элемент без переноса)
или в два различных по составу раствора, соединенных жидкост-ным контактом (цепь с переносом).
Электроды
По назначению электроды делятся на индикаторные и электроды сравнения. Электрод, потенциал
которого зависит от активности (концентрации) определяемых ионов в растворе, называют индикаторным.
Электрод, потенциал которого не зависит от концентрации определяемых ионов, называется электродом сравнения.
В потенциометрическом методе анализа применяют индикаторные электроды двух классов:
1.Электронообменные электроды, на межфазных границах которых протекают реакции, сопровождающиеся переходом электронов.
2.Мембранные или ионоселективные электроды на межфазных границах которых протекают ионообменнные процессы.
К таким электродам относится стеклянный электрод, который очень часто используется в потенциометрии.
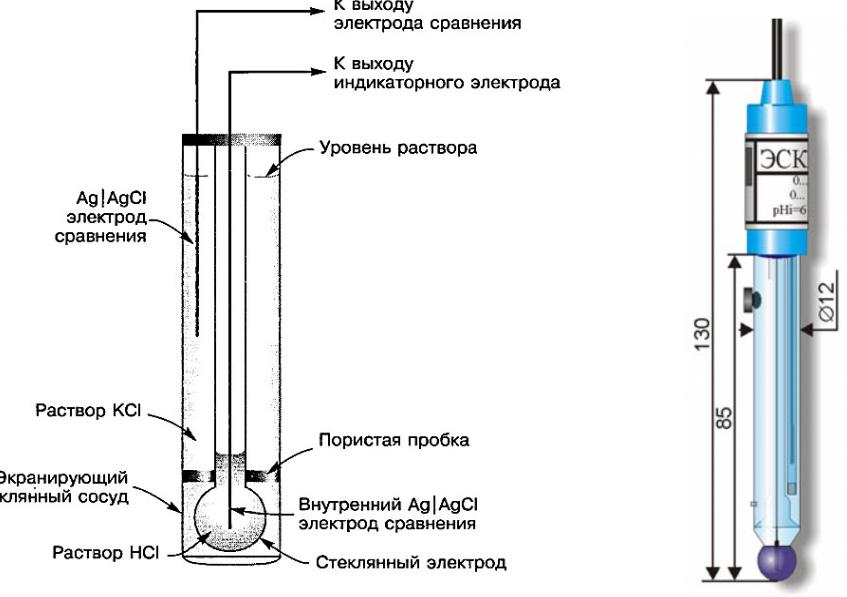
Устройство комбинированного стеклянного электрода
Рис.1. Стеклянный мембранный электрод. 1 – стеклянная мем-брана, чувствительная к изменению рН;
2 – внутренний раствор; 3 – внутренний электрод сравнения; 4 – внешний раствор сравнения;
5 – внешний электрод сравнения; 6 – отверстие для заполнения элек-трода; 7 – электрический контакт.
Электродом является стеклянный шарик (мембрана) диамет-ром 15-20 мм с толщиной стенок 0,06 — 0.1 мм,
изготовленный из стекла особого состава (Me2O·Al2O3·SiO2 где Me — Li, Na),
расположенный на конце стеклянной трубки (рис.1). Внутри шарика — раствор
с определенным значением рН (0,1-0,01 M HCI), в который погружен электрод сравнения хлорсеребряный или каломельный.
Перед работой стеклянный электрод некоторое время вымачивается в 0,1 M HCI.
При этой ионы H+ из раствора обмениваются на ионы Na+ из мембраны, и в системе
устанавливается равновесие:
SiONa+ + H+ <↔> SiOH+ + Na+
стекло раствор стекло раствор
Если подготовленный таким образом электрод опустить в раствор, содержащий ионы Н+,
произойдет обмен ионами водорода между анализируемым раствором и внешней поверхностью
мембраны, т.е. протекает электродная реакция
H+ <↔> Н+
раствор стекло,
приводящая к возникновению потенциала. Величина этого потенциала зависят от активности ионов
Н+ в анализируемом растворе:
На внутренней поверхности стекла также возникает потенциал, который остается постоянным в растворе с
постоянной активностью ионов водорода.
Для определения рН в исследуемый раствор погружается стеклянный индикаторный электрод и
хлорсеребряный электрод сравнения (иногда вся система комбинируется в одном электроде – комбинированный электрод).
ЭДС такой ячейки складывается из алгебраической суммы потенциалов, возникающих на отдельных поверхностях
разделов фаз; испытуемый раствор — внешняя поверхность стекла (Е1),
внутренняя поверхность стекла — стандартный раствор кислоты (Е2),
стандартный раствор — вспомогательный хлорсеребряный электрод (E3)
и потенциал электрода сравнения, погруженного в исследуемый раствор (Е4):
Э.д.с.= Е1 + Е2 + Е3 + Е4.
Переменным, зависящим от pH исследуемого раствора, является только Е1, поэтому:
Э.д.с.= K+ Е1=K+ E0 + 0,059 lgaH+ = K + E0 + 0,059 pH
Стеклянный электрод пригоден для измерения рН от 0 до 10, При рН > 10 возникает «щелочная ошибка»
вследствие обмена ионов Na+ из раствора. Для особых сортов стекла,
содержащего Сs, La щелочная ошибка мала и измерения можно проводить до рН =14. Кроме того,
точность показаний стеклянного электрода снижается в присутствии белков и других органических соединений с
большими молекулам, способными адсорбироваться на поверхности стекла.
Правила работы со стеклянным (комбинированным) электродом
Подготовленный к работе электрод хранят в дистиллированной воде или 0,1 М растворе HCI.
Перед проведением измерений электрод следует тщательно промыть дистиллированной водой.
Перед погружением в буферный раствор остатки воды удалить осторожным промоканием фильтровальной бумагой.
При погружении электрода в исследуемые растворы следует следить за глубиной погружения:
место выхода электрического контакта с внутренним раствором электрода должны находиться в
исследуемом растворе. При проведении титрования следует избегать повреждения мембраны
якорьком магнитной мешалки, поэтому расстояние от дна стакана для титрования до мембраны
должно быть 1,5 см. После окончания измерения электрод следует промыть и погрузить в стаканчик с дистиллированной водой.
Прибор для потенциометрических измерений.
В данной работе измерение pH проводится некомпенсационным методом на приборе рН-метре «Mera-ELWRO»,
имеющем вы-сокое входное сопротивление (~1012 Ом). Расположение регуляторов
на верхней панели прибора показано на рис.2/
Рис.2. Верхняя панель рН-метра.
1 — клемма для подключения комбинированного электрода;
2 — кнопка включения питания;
3 — регулировка температуры;
4 — механический нуль;
5 — переключатель вида работ;
6 — регулятор настройки по буферным растворам;
7- шкала pH.
Порядок работы на pH-метре
1. Подключить pH–метр к сети 220 B с помощью сетевого шну-ра;
2. Комбинированный стеклянный электрод подключить pH-метру в положение «1»;
3. Положение стрелки прибора должно соответствовать значе-нию шкалы 0. Для установки механического нуля можно вос-пользоваться «4»;
4. Включить прибор нажатием кнопки «2» за 20-30 мин. до про-ведения измерений;
5. С помощью регулятора »3″ установить нужное значение тем-пературы по шкале температур. Переключатель «5» при этом должен находиться в положении «Т»;
6. При проведении измерений рН в интервале 0 – 14 переключа-тель «5» установить в положение «14 рH», Для точных измерений рН в интервале 0 – 2,8 переключатель установить в положение «2,8 рН»;
7. Проверить настройку прибора по двум буферным растворам pH = 4,02 и рH = 9,18. Для этого электрод последовательно по-грузить в стаканчик с соответствующим буферным раствором. В случае несов¬падения показании по шкале прибора с соответст-вующим значением рН провести настройку с помощью регуля-тора «6»;
8. После проведения настройки можно приступать к измерению рН исследуемого раствора.
9. После окончания работы прибор выключись, вернув регулятор «5» в положение «Т», отжав кнопку «2»и отключив от сети.
Графические способы установления точки эквивалентности при потенциометрическом титровании.
Графические способы определения точки эквивалентности представлены на рис.3.
Потенциал в точке эквивалентности (Eт.э.) и соответствующий объем титранта, находят в
точке перегиба кривой титрования (в се-редине скачка).
Рис.3. Кривые потенциометрического титрования: А – интегральная кривая, Б – дифференциальная кривая.
Лабораторная работа № 6 Потенциометрическое титрование. Определение хлороводородной кислоты
с помощью комбинированного стеклянного электрода.
Определение основано на потенциометрическом титровании сильной кислоты по кислотно-основному методу.
Необходимые аппаратура, посуда и реактивы
1. рН-метр.
2. Стеклянный электрод, комбинированный с хлорсеребряным электродом сравнения.
3. Магнитная мешалка.
4. Бюретка на 25 мл.
5. Пипетка на 10 мл.
6. Мерная колба емкостью 50 мл.
7. Стакан для титрования.
8. Раствор NaOH, 0,1 M.
9. Буферные растворы с рН=4,02; рН=9,18.
10. Дистиллированная вода.
Порядок выполнения работы
1. Подготовить pH-метр к работе.
2. Полученную в мерной колбе (Vмк) задачу доводят до метки дистиллированной водой и перемешивают.
3. Заполняют бюретку 0,1 М раствором NaOH.
4. В стакан для титрования помещают якорь магнитной мешалки, вносят аликвоту анализируемой задачи (Vал) и разбавляют небольшим количеством дистиллированной воды с учетом правил погружения комбинированного электрода.
5. Стакан с титруемым раствором устанавливают на мешалку и погружают в него стеклянный электрод.
6. Устанавливают бюретку в положение, удобное для титрования;
7. Включают мешалку.
8. Проводят ориентировочное титрование, добавляя титрант равномерными порциями по 0,5 мл, и измеряя pH после каждой порции титранта. Результаты заносят в таблицу 6.
Таблица 5
Значения Q -критерия (при Р = 0,95)
| VNaOH, мл | 0 | 0,5 | 1 | 1,5 | … | N |
| рH | ||||||
| ΔpH |
9. По максимальному значению ΔpH приблизительно определяют точку эквивалентности;
10. Выполняют точное титрование новой аликвотной порции задачи при тех же условиях,
прибавляя вблизи точки эквивалентности по 0,1 мл титранта;
11. Результаты записывают в таблицу 7.
12. Объем 0,1 М NaOH в точке эквивалентности (VNaOH) находят из дифференциальной кривой титрования,
построенных в координатах ∆pH/∆V – V ( рис.4).
Таблица 7
Результаты второго (точного) титрования
| VNaOH, мл | ΔV | рH | ΔpH | ΔpH /ΔV |
14. Количество кислоты в задаче рассчитывают по формуле:

2.2.Фотометрический анализ
Фотометрический анализ включает спектрофотометрию, фотоколориметрию и визуальную фотометрию, которую
обычно называют колориметрией.
Каждое вещество поглощает определенные (характерные только для него) длины волн,
т. е. длина волны поглощаемого излучения индивидуальна для каждого вещества, и на этом основан
качественный анализ по светопоглощению.
Основой количественного фотометрического анализа является закон Бугера— Ламберта—Бера:
(1)
где I0, I – интенсивности потоков света, направленного на поглощающий раствор и
прошедшего через него; с — концентрация вещества, моль/л; l — толщина светопоглощающего слоя, см;
ε — молярный коэффициент светопоглощения.
Из уравнения (13.1) следует (I/I0) = 10 – εlc, откуда
lg(I/I0) = –εlc, или –lg(I/I0) = А = εlc,
где А — оптическая плотность раствора.
Часто используют также величину, называемую пропусканием, Т:
Пропускание связано с оптической плотностью раствора соотношением
–lgT = –lg(I/I0) = A. (2)
Из уравнений (13.1) и (13.2) получается еще одно выражение для закона Бугера—Ламберта—Бера:
А = ε1с.
Графически зависимость оптической плотности от концентрации окрашенного вещества,
если выполняется закон Бугера— Ламберта—Бера, выражается прямой, проходящей через начало координат.
Эта зависимость соблюдается при выполнении определенных условий (работа с разбавленными растворами,
монохроматичность падающего света и т. д.).
Возможности современных измерительных приборов таковы, что позволяют измерять величину А от 0,02 до 3,0.
Однако для получения удовлетворительных по точности результатов значения измеряемой оптической плотности
должны находиться в пределах 0,05 < А < 1,0. (3)
Для определения концентрации анализируемого вещества наиболее часто используют следующие методы:
1) метод молярного коэффициента светопоглощения; 2) метод градуировочного графика; 3) метод добавок;
4) метод дифференциальной фотомет¬рии; 5) метод фотометрического титрования.
Фотометрическим методом можно определять также компоненты смеси двух и более веществ.
Эти определения основаны на свойстве аддитивности оптической плотности:
Асм=А1+А2+…+An
или
Асм=l(ε1*с1+ ε2*с2+… εn*сn).
где Асм — оптическая плотность смеси; A1, ε1; с1 —
соответственно оптическая плотность, молярный коэффициент светопоглощения и концентрация первого компонента смеси;
А2, ε2, с2 — те же величины для второго компонента смеси и т. д.
Расчет концентрации веществ, находящихся в смеси, может быть выполнен либо графическим, либо аналитическим методом.
A NAME=» Общие рекомендации»>
Общие рекомендации
Общие рекомендации по выполнению лабораторных работ.
При выполнении настоящего практикума, необходимо:
1) cтрого следовать методике приготовления растворов (соблюдайте порядок сливания реагентов,
поддерживайте нужную кислотность);
2) выполнять правила приготовления растворов, отбора аликвот, измерения объемов и пр.;
3) соблюдать чистоту кювет для измерения светопоглощения.
Перед заполнением кювету ополаскивают небольшой порцией исследуемого раствора
во избежание его разбавления остатками воды после промывания кюветы;
4) кювету заполнять до такого уровня, чтобы весь световой по-ток проходил через слой раствора. Кюветы устанавливать в строго определенное положение во избежание «кюветной» ошибки;
5) ознакомиться с описанием прибора и порядком измерений;
6) по окончании работы выключить прибор, вымыть посуду и кюветы и сдать их лаборанту. Привести в порядок рабочее место.
A NAME=» Порядок работы на фотоэлектроколориметре ФЭК-56М»>
Порядок работы на фотоэлектроколориметре ФЭК-56М
Прибор предназначен для измерения оптиче¬ской плотности растворов пределах от 0 до 1,3;
большие оптические плотности измеряются менее точно.
Принцип работы фотоэлектроколориметров состоит в сравнении интенсивности потоков света,
прошедшего через раствори¬тель (I0) и через исследуемый раствор (I). Внешний вид и оптическая схема
ФЭК-56М представлена на рис. 4 и 5.
Рис. 4. Внешний вид фотоэлектроколориметра ФЭК-56М:
1 – источник света (лампа накаливания); 2 – шторка; 3 – кюветное от-деление;
4 – барабан светофильтров; 5, 6 – левый и правый барабаны; 7 – микроамперметр;
8 , 9 – шкалы для считывания показаний.
Для измерения светопоглощения выбирают спектральную область, в которой чувствительность анализа наиболее высокая.
Фо-тоэлектроколориметр ФЭК-56М снабжен кассетой с девятью светофильтрами (табл.8).
При выборе светофильтра необходимо знать области поглощения света веществом (его спектр).
Таблица 8
Характеристики светофильтров
| № светоф. | Длина волны в максимуме пропускания, нм | Ширина полосы пропускания, нм |
| 1 | 290-340 | 35 |
| 2 | 340-390 | 25 |
| 3 | 360-440 | 45 |
| 4 | 400-480 | 40 |
| 5 | 455-525 | 35 |
| 6 | 510-565 | 25 |
| 7 | 565-615 | 25 |
| 8 | 640-690 | 20 |
| 9 | 730-770 | 20 |
Как известно, ощущение цвета возникает в результате воздействия на зрительный нерв
электромагнитного излучения с длинами волн 380-760 нм (т. н. видимая часть спектра).
Суммарное действие электромагнитных излучений во всем указанном интервале вызывает ощущение белого цвета.
При отсутствии в видимой части спектра определенного интервала длин волн возникнет ощущение цветности.
Если вещество поглощает луч какого-либо цвета (назовем его спектральным),
оно окрашивается в так называемый дополнительный цвет. Именно он возникает в зрительном аппарате,
если из белого луча изымается спектральный цвет. Например, если вещество поглощает свет с длиной волны
590 нм (желтый), то оно окрашено в синий цвет (425 нм).
В соответствии с вышесказанным, цвет светофильтра должен являться дополнительным по отношению к
окраске раствора (табл.9).
Таблица 9
Соотношение окраски растворов и характеристики светофильтров
| Окраска раствора | Поглощаемая длина волны, нм | Цвет светофильтра | Длина волны пропускаемого света, нм |
| Зеленовато-желтая | 400 | Фиолетовый | 400-430 |
| Желтая | 425 | Синий | 420-450 |
| Оранжевая | 450 | Зеленовато-синий | 430-460 |
| Красная | 490 | Синевато-зеленый | 460-500 |
| Пурпурная | 510 | Зеленый | 490-530 |
| Фиолетовая | 530 | Зеленовато-желтый | 520-550 |
| Синяя | 590 | Желтый | 590 |
| Сине-зеленая | 640 | Красный | 600-650 |
Рис. 5. Оптическая схема ФЭК-56М. 1 – источник света; 2 – сменный светофильтр;
3 – призма; 4 – зеркала; 5 – кюветы с рас-творами; 6 – раздвижные диафрагмы с измерительными барабанами;
7 – фотоэлементы; 8 – усилитель; 9 – микроамперметр.
A NAME=» Порядок работы на приборе ФЭК-56М»>
ППорядок работы на приборе ФЭК-56М
Порядок работы на приборе ФЭК-56М:
1. Включить блок питания и лампу накаливания за 30 минут до на-чала измерений для предварительного прогрева.
2. Световые пучки перекрыть шторкой.
3. Рукояткой «нуль» установить стрелку микроамперметра на «0».
4. С помощью рукоятки с цифрами 1- 8 (левая панель) устанавли-вают нужный светофильтр.
5. Правый и левый барабаны устанавливают на «0» по шкале све-топропускания (черного цвета).
6. Открывают шторку. Положение стрелки микроамперметра не должно измениться. Закрывают шторку.
7. На пути левого светового пучка устанавливают кювету с раство-рителем на все время измерений. На пути правого пучка кювету с исследуемым раствором и рядом еще одну кювету с растворителем. Все кюветы должны быть одинаковыми.
8. Правый барабан устанавливают на 100 делений по шкале свето-пропускания (черная).
9. Открывают шторку и вращением левого барабана устанавливают стрелку микроамперметра на «0».
10. Поворотом рукоятки заменяют кювету с исследуемым раство-ром на кювету с растворителем на пути правого пучка света. Стрелка микроамперметра смещается. Вращением правого бараба-на вновь выводят стрелку на «0» (левый барабан остается в преж-нем положении). По красной шкале правого барабана отсчитывают величину оптической плотности исследуемого раствора за вычетом оптической плотности растворителя при данном светофильтре. Из-мерения проводят три раза, данные записывают в журнал.
Описанный порядок измерений (растворитель → раствор → растворитель) позволяет исключить ошибку,
связанную с нелиней-ностью характеристик фотоэлементов, т.к. потоки света, поступающие на фотоэлемент,
остаются неизменными как в начале, так и в конце измерения.
Во время измерений барабаны следует подводить к нужному положению каждый раз с одной и той же стороны,
чтобы исключить люфт в механизме.
По окончанию работы закрывают шторку, выключают электропитание, вынимают кюветы,
промывают их дистиллированной водой, сушат и убирают в футляр.
Лабораторная работа № 7 Фотометрическое определение железа в виде тиоцианатных комплексов
Метод основан на образовании интенсивно окрашенных комплексов железа (III) с тиоцианат-ионами.
В зависимости от рН и концентрации реагента образуются комплексные соединения с разным количеством лигандов:
от [Fe(SCN)]2+ до [Fe(SCN)6]3–, причем их спектральные характеристики различны.
Поэтому для получения воспроизводимых и точных результатов следует обеспечить постоянство
концентрации (желательно большой) тиоцианат-ионов во всех растворах.
При соблюдении этого условия растворы тиоцианатных комплексов железа подчиняются закону Бугера-Ламберта-Бера
в широком диапазоне концентраций железа. Выбрав светофильтр и фотометрируя анализируемый раствор,
можно точно определить концентрацию ионов железа по предварительно построенному калибровочному графику.
Реактивы. Железоаммонийные квасцы NH4Fe(SO4)2 ∙12Н2О,
стандартный раствор с содержанием железа 0,15 мг/мл (раствор 1).
Тиоцианат калия (аммония) KSCN (NH4/sub>SCN), 10% -й раствор. Хлороводородная кислота НС1, 2М раствор.
Посуда. Колбы мерные (50 и 100 мл). Пипетка (20 мл). Бюретка (25 мл)
Порядок выполнения работы
1.Выбор светофильтра
Необходимо выбрать такой светофильтр, чтобы поглощение света раствором тиоцианатных комплексов железа было максимальным.
Приготовление раствора тиоцианатных комплексов железа
20 мл стандартного раствора железо-аммонийных квасцов NH4Fe(SО4)2
с концентрацией железа 2 мг/мл, подкислен¬ного соляной кислотой,
вносят пипеткой на 20 мл в мерную колбу на 100 мл и при перемешивании доводят до метки дистиллированной водой.
Этим раствором (назовем его №1), имеющим концентрацию железа 0,4 мг/мл, будем пользоваться для приготовления
всех растворов железа (III) в данной работе.
10 мл раствора №1 вносят в мерную колбу на 50 мл, подкисляют 5 мл 2М HCl,
добавляют 5 мл 10% -ного раствора тиоцианата аммония NH4SCN и при перемешивании
доводят до метки дистиллированной водой.
На фотоэлектроколориметре ФЭК-56М, пользуясь кюветами на 10 мм, измеряют оптическую плотность этого раствора
при всех девяти светофильтрах. Полученные данные заносят в журнал в виде таблицы.
Таблица 9
Соотношение окраски растворов и характеристики светофильтров
| № светофильтра | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| Оптическая плотность |
По этим данным строят кривую светопоглощения в координатах оптическая плотность – номер светофильтра
(длина волны) и по графику выбирают такой светофильтр, при котором оптическая плотность максимальна.
2. Построение калибровочного (градуировочного) графика оптическая плотность — концентрация железа
Приготовление растворов тиоцианата железа с различной концентрацией железа
В три мерные колбы на 50 мл вводят соответственно 5, 8, 10 мл раствора № 1 (концентрация железа (III) в
котором 0,4 мг/мл). В каждую из колб добавляют для подкисления по 5 мл 2М HCl и по 5 мл 10%-ного
раствора тиоцианата аммония (или калия), при пере-мешивании растворы доводят до метки дистиллированной водой.
Затем проводят измерения оптических плотностей растворов на ФЭК — 56М при выбранном светофильтре.
Данные измерений заносят в журнал. На основании этих данных строят градуировочный график в осях
оптическая плотность (ось ординат) — концентрация железа (ось абсцисс).
В данной работе измерения оптической плотности растворов на ФЭК-56М можно проводить как с пустой кюветой на пути
второго луча (луча сравнения), так и с кюветой заполненной растворителем (с добавками).
В первом случае градуировочный график не пойдет через начало координат, во втором случае должен проходить
через начало координат. Оба способа измерений для данной работы пригодны, но при этом следует применять его как
для построения градуировочного графика, так и при измерении оптической плотности исследуемого раствора.
3.Определение железа в исследуемом растворе
Анализируемый раствор (задача) в колбе вместимостью 100 мл
(V1)
доводят до метки водой. 20 мл (Vп) этого раствора вводят в колбу на 50 мл (V2),
добавляют 5 мл 2М НС1, 5 мл 10% раствора тиоцианата калия (аммония) и доводят до метки
дистиллированной водой при перемешивании. Измеряют оптическую плотность этого раствора при выбранной длине волны.
С помощью градуировочного графика определяют концентрацию железа.
Рассчитывают массу железа в исследуемом растворе, учитывая все произведенные разбавления.
Лабораторная работа № 8 Фотометрическое определение железа с сульфосалициловой кислотой
Железо (III) образует с сульфосалициловой кислотой ряд комплексов, состав и окраска которых зависят от кислотности раствора.
При рН = 3 образуется соединение фиолетового цвета состава 1:1. Светопоглощение этого комплекса
максимально при 510 нм (ε = 1600). При рН = 4 – 9 образуется соединение состава 1:2, имеющее красный цвет,
а при рН = 9 – 11,5 – желтое комплексное соединение состава 1 : 3 (λмах = 416 нм, ε = 4000).
При рН =12 комплекс разлагается с выделением гидроксида железа.
Железо(II) не образует окрашенных соединений с сульфосалициловой кислотой. Однако в аммиачной
среде Fe(II) легко окисляется до Fe(III), поэтому в этих условиях можно определять суммарное содержание железа.
Определение содержания железа выполняется фотометрическим методом по реакции образования желтого комплекса с
сульфосалициловой кислотой в аммиачной среде. При изменении кислотности может получиться комплекс другого состава,
имеющий фиолетовую или розо¬вую окраску. В этом случае в колбу, где проходит колориметрическая реакция,
следует добавить больше аммиака — столько, сколько нужно для появления желтой окраски.
Реактивы. Кислота сульфосалициловая C7H6O6S,
25%-й раствор. Квасцы железоаммонийные NH4Fe(SO4)2∙ 12H2O (к).
Аммиак NH3, водный 10% -й раствор. Кислота серная H2SO4 (х.ч.) 0,05М раствор.
Посуда. Пипетка градуированная (10 мл) и простая (2 мл). Колбы мерные (50 и 100 мл). Цилиндры мерные
(10 и 25 мл).
Аппаратура. Фотоэлектроколориметр ФЭК–56М.
Порядок выполнения работы:
1.Приготовление стандартных растворов сульфосалицилата железа.
В мерные колбы на 50 мл поместить 0, 2, 4, 6, 8 и 10 мл стандартного раствора железо-аммонийных
квасцов, в каждую колбу добавить 3 мл раствора сульфосалициловой кислоты, 1 мл серной кислоты и довести
до метки дистиллированной водой.
2. Снятие спектра поглощения сульфосалицилата железа, выбор светофильтра и расчет молярного коэффициента
светопоглощения.
Самый концентрированный раствор наливают в кювету фотоэлектроколориметра (l=1 см); в качестве раствора
сравнения берут воду. Измеряют оптическую плотность полученного раствора для всех светофильтров или в диапазоне
длин волн 400 – 600 нм. Строят кривую светопоглощения в координатах оптическая плотyость – длина волны и выбирают
для дальнейшей работы светофильтр, соответствующий максимуму поглощения света окрашенным соединением (λmax).
По данным измерений рассчитывают молярный коэффициент светопоглощения сульфосалицилатного комплекса железа при λтах.
где Аmах — оптическая плотность окрашенного раствора при длине волны λтах;
l – толщина светопоглощающего слоя (здесь l = 1 см); скомпл — концентрация комплексного
соединения железа (она равна концентрации железа в окрашенном растворе), моль/л.
3. Построение градуировочного графика. Для построения градуировочного графика измеряют
оптическую плотность приготовленных стандартных растворов железоаммонийных квасцов,
содержащих различные количества железа.
Измеряют оптическую плотность стан¬дартных растворов (Аст) в выбранных
условиях (три параллельных измерения для каждого раствора) и строят градуировочный график в координатах
оптическая плотность – концентрация железа. Данные заносят в таблицу.
4. Фотометрирование исследуемого раствора. Полученную задачу в колбе на 50 мл (V1)
довести до метки дистиллированной водой. Перемешать, отобрать аликвоту 10 мл (Vп) и
поместить ее в колбу на 50 мл (V2), добавить 3 мл сульфосалициловой кислоты,
1 мл серной кислоты и довести до метки дистиллированной водой.
Измерить оптическую плотность Ах (три параллельных определения)
при выбранном светофильтре (l = 1 см). Концентрацию железа в исследуемом растворе (сх)
определить по градуировочному графику. Рассчитать содержание ионов железа в полученной задаче.
A NAME=» 2.3. Эмиссионный спектральный анализ»>
2.3. Эмиссионный спектральный анализ
Основные количественные соотношения
Эмиссионный спектральный анализ основан на получении и изучении спектров испускания (эмиссионных спектров).
По положению и относительной интенсивности отдельных линий в этих спектрах проводят
качественный спектральный анализ. Сравнивая интенсивность специально выбранных спектральных
линий в спектре пробы с интенсивностью тех же линий в спектрах эталонов,
определяют содержание элемента, выполняя, таким образом, количественный спектральный анализ.
Качественный спектральный анализ основан на индивидуальности эмиссионных спектров каждого элемента
и сводится, как правило, к определению длин волн линий в спектре и установлению принадлежности
этих линий тому или иному элементу.
Количественный спектральный анализ основан на том, что интенсивность спектральных линий
элемента зависит от концентрации этого элемента в пробе.
Зависимость интенсивности спектральной линии
от концентрации имеет сложный характер.
При небольшой концентрации определяемого вещества и в нешироком интервале
концентраций интенсивность излучения I линейно зависит от концентрации с:
I = ас,
что упрощает построение градуировочного графика и сам анализ. Эти условия обычно выполняются
при работе пламенного фотометра.
Фотометрия пламени — разновидность эмиссионного спектрального анализа. Метод основан на
фотометрировании излучения элементов в пламени. Точность метода 1 – 4 %. Принцип метода:
анализируемый раствор, с помощью специального распылителя, действующего под давлением сжатого воздуха,
в виде аэрозоля, вводится в пламя горелки, работающей на каком-либо горючем газе (ацетилене,
водороде, пропане, бензиновом газе и т.п.). Возникающее в пламени излучение определяемого элемента
(а точнее, его наиболее интенсивную спектральную линию) отделяют с помощью соответствующего
светофильтра от излучения других элементов. Попадая на фотоэлемент, это отфильтрованное излучение,
вызывает фототок, который измеряется мик¬роамперметром. При определенных условиях отсчеты по микроамперметру
пропорциональны концентрации определяемого элемента в растворе. Невысокая температура пламени,
являющегося источником возбуждения, обуславливает простоту спектра. Спектр содержит лишь немногие,
а именно, легко возбуждаемые линии элементов.
При введении раствора в пламя в виде частиц аэрозоля протекает ряд процессов: испарение растворителя,
при этом из аэрозоля «раствор — газ» образуется аэрозоль «твердое тело – газ»; испарение твердых солей,
с образованием их паров; диссоциация солей с образованием атомов, радикалов или новых молекул; возбуждение атомов
, вследствие соударения с частицами газа пламени и переход их из основного состояния
(с минимальной энергией E0) В возбужденное состояние (например, с энергией Е1).
Время жизни атомов в возбужденном состоянии порядка 10-8 сек.
Возбужденные атомы самопроизвольно излучают свет, переходя из возбужденного состояния в основное состояние.
Переходы между этими состояниями приводят к возникновению спектра, который характерен для данного вида атомов.
Таким образом, атомы каждого элемента имеют свой характерный спектр. Наиболее интенсивными линиями
спектра атомов явля-ются резонансные линии, обусловленные переходом из нижнего возбужденного состояния
(состояния с минимальной избыточной энергией) в основное состояние.
Длина волны резонансного излучения различна для атомов различных элементов,
например: λCa=423 нм, λNa =589 нм, λLi =671 нм, λK=767 нм и т.д.
Таким образом, используя определенный светофильтр, удается отфильтровать излучение атомов
соответствующего элемента. Интенсивность же данного излучения зависит от числа данных атомов в пламени,
т.е. в конечном итоге от их концентрации в анализируемом растворе. Таким образом, измеряя интенсивность излучения
определенной длины волны можно решать задачу количественного анализа.
Пламенно-фотометрический анализ проводят, сравнивая интенсивность свечения при распылении и введении
в пламя анализируемого раствора с интенсивностью свечения при введении стандартного раствора
с известной концентрацией того же элемента. Естественно,
что при переходе от измерений анализируемого раствора к изменениям стандартного раствора все
условия анализа должны сохраняться постоянными.
Приборы и техника измерений
Фотометр фотоэлектрический пламенный ПФМ.Этот прибор предназначен для количественного анализа
элементов методом пламенной эмиссионной спектроскопии. В качестве горючего газа используются ацетилен,
пропан-бутан в баллонах или природный газ. Монохроматизаторами служат интерференционные светофильтры:
в комплект прибора входят светофильтры для определения Li, Na, К, Са. По требованию заказчика могут быть
поставлены светофильтры, позволяющие определять Sr, Rb, Cs, Ba, В, Сr, Мn и Mg. Приемником излучения является
мультищелочной фотоэлемент Ф-9, измерительным прибором – микроамперметр М-907.
Оптическая схема пламенного фотометра ПФМ приведена на рис.6.
Рис. 6. Оптическая схема пламенного фотометра ПФМ: 1 – защитное стекло смотрового окна;
2 – рефлектор; 3 – горелка; 4 – диаф¬рагма; 5 – конденсор; 6 – светофильтр; 7 – ирисовая диафрагма;
8 – линза; 9 – защитное стекло перед фотоэлементом; 10 – фотоэлемент.
Комплект фотометра ПФМ (рис. 7) состоит из двух блоков: блока компрессора 17 и фотометра 3.
Блок компрессора соединяется с фотометром электрическим шнуром (через разъем) и шлангом для подачи воздуха.
Измерения с помощью фотометра ПФМ выполняют следующим образом.
1. С помощью штепсельной вилки подсоединяют фотометр к электрической сети. Включают тумблер 9 (рис. 7)
и прогревают электросхему в течение 15 мин.
2. Ручку «диафрагма» 13 устанавливают в положение, соответствующее полному перекрытию светового потока,
ручку 6 – в положение «1000» (минимальная чувствительность фотометра) и ручками «грубо» 8
и «точно» 11 устанавливают стрелку микроамперметра на нуль.
3. Пригласить преподавателя и выполнить следующие операции:
а) открыть кран на генераторе бензинового газа,
б) открыть на 1 оборот (360º) регулятор на генераторе бензино-вого газа,
в) проверить положение регулятора давления воздуха на фотометре (позиция 2 на рис.8),
он должен находиться в крайнем положении при вращении по часовой стрелке,
г) открыть регулятор газа. Поставить стаканчик с дистиллированной водой, опустить в него
полихлорвиниловую трубочку распылителя, тумблером 10 включить компрессор и одновременно нажать кнопку поджига пламени.
Выполнение измерений:
1. Ирисовую диафрагму установить в положение 60-70.
2. Ручкой 12 устанавливают необходимый светофильтр. В данной работе «Na».
3. Постоянную диафрагму установить в положение 1. При измерении серии растворов ирисовую и постоянную
диафрагмы нужно выбрать так, чтобы показания прибора для всей серии растворов укладывались в пределы шкалы
микроамперметра без переключения чувствительности.
Рис. 7. Пламенный фотометр ПФМ: 1 – ротаметр для измерения расхода газа;
2 – смотровое окно для наблюдения за пламенем; 3 – фотометр; 4 – манометр;
5 – микроамперметр; 6 – ручка чувстви-тельности; 7– окно сигнальной лампы;
8, 11 – ручки потенциомет-ров «грубо» и «точно»; 9, 10 – тумблеры включения прибора и компрессора;
12 – ручка переключения светофильтров; 13 – ручка перекрытия светового пучка;
14 – кнопка поджигания пламени горелки; 15 – ручка регулятора давления воздуха;
16 – ручка регулятора расхода газа; 17 – компрессор.
4. При распылении дистиллированной воды выставить стрелку микроамперметра на нуль.
5. Перенести трубочку распылителя в наиболее концентрирован-ный раствор и через 15 секунд с помощью регулятора чувствитель-ности и диафрагм выставить стрелку микроамперметра на 100 де-лений.
6. Перенести трубочку распылителя в дистиллированную воду и через 30 секунд проверить не отклонилась ли стрелка микроампер-метра от нулевого положения. Если отклонилась то потенциомет-ром «точно» снова установите ее на нуль.
8. Поочередно ввести в пламя стандартные растворы, начи¬ная с наиболее разбавленного, и каждый раз снимать показания микро-амперметра. Перед фотометрированием очередного раство¬ра про-мывают систему дистиллированной водой, проверяя каж¬дый раз, не изменилось ли нулевое положение стрелки микроам¬перметра. Если стрелка отклонилась от нулевого положения, ручками 8 и 11 ее снова устанавливают на нуль.
9. Во время измерений расход газа и давление воздуха долж¬ны быть постоянными.
10. По окончании работы закрывают вентиль подачи газа сначала на баллоне, а затем на редукторе. Промывают горелку дистиллиро-ванной водой через распылитель. Отключают комп¬рессор и выклю-чают питание фотометра.
Лабораторная работа № 9 Пламенно-фотометрическое определение натрия в
водопроводной воде методом калибровочного графика
Определение натрия основано на на фотометрировании излучения атомов натрия в пламени горелки.
Длина волны излучения атомов натрия равна 589 нм.
Реактивы. Хлорид натрия NaCl (х.ч.), дистиллированная вода.
Посуда. Колбы мерные (100 и 500 мл). Стаканы для взятия навесок (20–50 мл).
Пипетки градуированные (5, 10 и 20 мл).
Аппаратура. Пламенный фотометр ПФМ.
Выполнение работы:
Стандартные растворы, содержащие 2,5; 5,0; 10,0; 15,0; 20,0 мкг/мл натрия,
готовят разбавлением стандартного раствора с концентрацией 500 мкг/мл натрия.
Для этого помещают 0,5; 1,0; 2,0; 3,0; 4,0 мл исходного стандартного раствора в мерные колбы
на 100 мл доводят до метки дистиллированной водой и тщательно перемешивают.
Приготовленные растворы наливают в полиэтиленовые стаканы и распыляют в пламени горелки,
записывая отклонения стрелки микроамперметра. Перед определением устанавливают соответствующий
светофильтр. При переходе от одного раствора к другому систему промывают, опуская всасывающий капилляр
в стакан с дистиллированной водой. Также фотометрируют пробу водопроводной воды или задачу,
полученную от преподавателя. Данные заносят в таблицу.
| Номер раствора | 1 | 2 | 3 | 4 | 5 | Задача |
| С(Na) в стандартном растворе (мкг/мл) | ||||||
| Отсчеты по микроамперметру фотометра (дел.) |
По полученным данным строят график в координатах «показание прибора – концентрация ионов натрия».
По калибровочному графику находят концентрацию ионов натрия в пробе.


![{\displaystyle {\ce {pH}}=-\log(a_{{\ce {H+}}})\thickapprox -\log([{\ce {H+}}])}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5cee635c4839a5a266cfa10c541a8c7e21d2707e)





![{\displaystyle [{\ce {OH^-}}]={\frac {K_{{\ce {W}}}}{[{\ce {H^+}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0e914d2d8665e01b649b6ecc09acdb2bb823b33c)




![{\displaystyle K_{w}={\ce {[H+][OH^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4bbddc96ecfaf0a74d351c6ce2c7de2eb8c01688)
![{\displaystyle K_{a}={\frac {{\ce {[H] [A]}}}{{\ce {[HA]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f29a403e204523dcc5d4345e9da4125d6bccc8e0)
![{\displaystyle C_{{\ce {A}}}={\ce {[A]}}+{\ce {[HA]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9ebde93fda69a21943e8842a9a32da905b2f645e)
![{\displaystyle C_{{\ce {H}}}={\ce {[H]}}+{\ce {[HA]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/920b90697a63b1c14c8302e733fc525ba0d9585b)
![{\displaystyle [{\ce {H}}]^{2}+K_{a}[{\ce {H}}]-K_{a}C_{a}=0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/46348613cafd9be4dcf2b772575b5af47f080d54)
![{\displaystyle C_{\ce {H}}={\frac {[{\ce {H}}]+[{\ce {HA}}]-K_{w}}{\ce {[H]}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e4eaeb404231cb0a9a118cd2972dc991b67adaab)
![{\displaystyle [{\ce {A}}_{p}{\ce {B}}_{q}{\ce {H}}_{r}]=\beta _{pqr}[{\ce {A}}]^{p}[{\ce {B}}]^{q}[{\ce {H}}]^{r}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0116cc100cbe49e89c845e94bfb7cfa9d41efdf4)
![{\displaystyle {\begin{aligned}C_{\ce {A}}&=[{\ce {A}}]+\Sigma p\beta _{pqr}[{\ce {A}}]^{p}[{\ce {B}}]^{q}[{\ce {H}}]^{r}\\C_{\ce {B}}&=[{\ce {B}}]+\Sigma q\beta _{pqr}[{\ce {A}}]^{p}[{\ce {B}}]^{q}[{\ce {H}}]^{r}\\C_{\ce {H}}&=[{\ce {H}}]+\Sigma r\beta _{pqr}[{\ce {A}}]^{p}[{\ce {B}}]^{q}[{\ce {H}}]^{r}-K_{w}[{\ce {H}}]^{-1}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3d204f0d1baca5254f67602e86ba0091a004b673)














