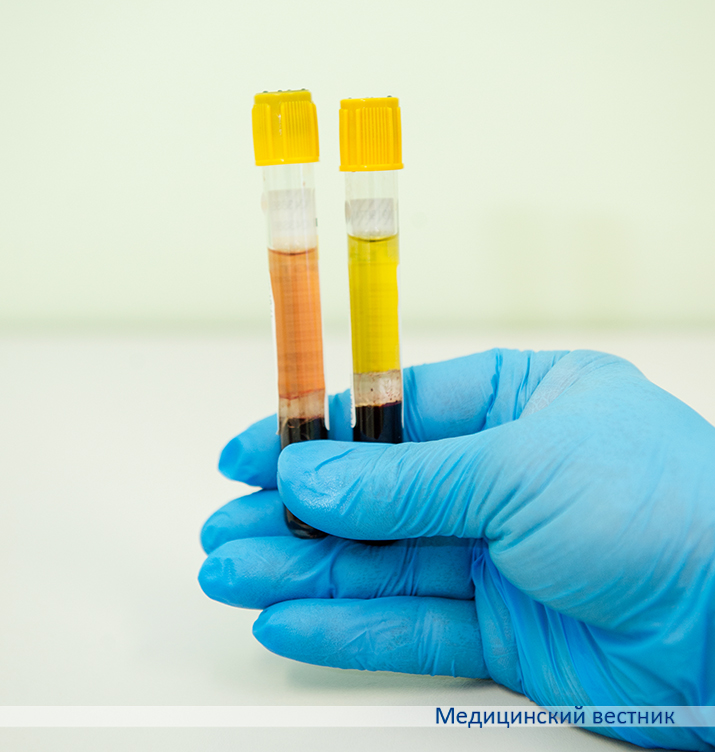
В практике клинициста бывают неординарные ситуации, связанные с лабораторными исследованиями. Врач назначает анализы и получает результаты, совершенно не укладывающиеся в клиническую картину. Например, пациент тяжелый, и логично, что должны быть изменения, но их нет. Или наоборот, здоровый человек проходит медосмотр, а у него показатели общего анализа крови за пределами нормы. Как правило, основной причиной подобных казусов являются дефекты преаналитического этапа.
О наиболее распространенных ошибках при заборе венозной крови для диагностических исследований рассказала заведующая клинико-диагностической лабораторией Городской гинекологической больницы Минска Дина Жуковская.
Лабораторная диагностика

- неправильная предварительная подготовка пациента к сдаче анализа,
- несоблюдение инструкций и технических требований в момент забора крови,
- нарушение условий при транспортировке образцов в лабораторию.
Основным регламентирующим документом, в котором подробно прописаны преаналитический этап и все требования к нему, является «Инструкция о порядке организации преаналитического этапа лабораторных исследований», утвержденная приказом Минздрава № 1123 от 10.11.2015.
Дина Жуковская:
При соблюдении врачами и средним медперсоналом всех рекомендаций, прописанных в этом документе, количество ошибок можно минимизировать.
В Инструкции изложена подготовка пациента с учетом особенностей каждого исследования, указано, какие одноразовые системы для каких видов исследований предназначены, описаны техники забора крови, в частности венозной, при которой чаще всего совершаются ошибки.
Кровь из вены или из пальца?
Дина Жуковская:
Венозная кровь является лучшим биологическим материалом для гематологических, биохимических, гормональных, серологических и иммунологических показателей. В настоящее время практически все исследования выполняются из венозной крови, это стандарт.
Исследование капиллярной крови из пальца у взрослых и детей, пяточки у новорожденных допускается только в случаях, когда технически затруднена возможность венопункции:
- при ожогах большой площади,
- склонности пациента к венозному тромбозу,
- выраженном ожирении,
- острых состояниях, связанных с гипотонией, и др.
В зависимости от цели может проводиться анализ цельной крови, сыворотки или плазмы крови. В пробирках или системах, предназначенных для каждого вида, находятся коагулянты/антикоагулянты.
Маркировка и антикоагулянты
Согласно приказу Минздрава № 1123, к применению разрешены два типа стандартных одноразовых систем:
- шприц-пробирка с поршневым или вакуумным способом забора крови,
- вакуумная система.
Каждая из них имеет несколько вариантов:
- по виду исследования,
- реагенту-наполнителю,
- размеру,
- объему пробы.
Вакуумные системы исключают контакт персонала с кровью пациента. Они подлежат процедуре государственной регистрации для применения в учреждениях здравоохранения (как государственных, так и коммерческих).
Дина Жуковская:
По международным стандартам сейчас все одноразовые вакуумные системы промаркированы крышками по цвету, чтобы средний медперсонал не мог случайно перепутать. При заборе сразу нескольких видов анализов наполнение пробирок должно быть строго последовательным. Вначале берется кровь в пробирки без антикоагулянтов, затем — с антикоагулянтами во избежание загрязнения ими иглы.
Желтый. Перед доставкой в лабораторию эти пробирки необходимо отцентрифугировать и получить сыворотку — идеальный биологический материал для определения биохимических показателей, гормонов, онкомаркеров. Современные системы для транспортировки сыворотки содержат специальный гель, который отделяет чистую сыворотку от сгустков эритроцитов и предотвращает смешивание. Если в учреждении систем с гелем нет, то перед транспортировкой полученную сыворотку нужно переместить во вторичную пробирку.
Голубой. В системе содержится антикоагулянт — цитрат натрия. Забор крови на коагулограмму проводится только в эту пробирку. Исследуются плазма крови, факторы свертывания, антикоагулянтный потенциал и т. д.
Зеленый. В системе находится антикоагулянт гепарин. При смешивании с гепарином цельной крови полученный образец исследуется на газы крови, так называемый анализ КОС (кислотно-основное состояние), и другие биохимические показатели.
Фиолетовый. В системе находится консервант ЭДТА. Используется цельная кровь при самом распространенном, простом и в то же время информативном ОАК, иммунологическом определении группы крови. Также может использоваться плазма при некоторых клинико-химических исследованиях.
Помимо систем важен грамотный выбор диаметра иглы, которой берется кровь. Какие вены какими иглами пунктировать? Этот навык возможно приобрести только постоянной практикой и накоплением опыта. Существуют современные системы с камерой визуализации, что позволяет в момент пункции видеть, попала ли игла в вену.
Некоторые медсестры с большим опытом применения обычных пробирок для забора крови и техники перетягивания вен жгутом испытывают неуверенность при использовании одноразовых вакуумных систем. По мнению Дины Жуковской, следует уделять больше внимания обучению этим навыкам и закреплению их на курсах повышения квалификации.
Важный момент — перемешивание
При заборе венозной крови нужно не только наполнить нужную пробирку, но и правильно перемешать, чтобы произошел контакт крови с антикоагулянтом, напыленным на стенках.
Техника перемешивания крови с антикоагулянтом тоже имеет значение. Не нужно пробирку трясти, взбалтывать, необходимо сделать около 10 ротирующих движений, затем перейти к наполнению следующей пробирки.
Дина Жуковская:
Иногда медсестра не придает этому значения, поэтому тщательного перемешивания не происходит. В таком случае общий анализ крови обязательно будет с погрешностями из-за агрегации тромбоцитов.
Бывает, что эти микросгустки даже видны невооруженным глазом, но чаще не видны. И только на конечном этапе, когда мы потратили время, реагенты, врач ждет результат, а мы видим аномалию с запредельной тромбоцитопенией. Наша лаборатория оснащена современными анализаторами, которые в таких случаях сразу выдают звуковой сигнал и текстовое сообщение: «Внимание! Агрегация тромбоцитов!»
Сколько крови брать?
Вакуумные одноразовые системы облегчают задачу: нужный объем четко обеспечивается вакуумом. Но есть нюансы: при соблюдении техники забора скорость наполнения пробирки будет такой, что она заполнится ровно до метки. Только в этом случае достигается правильное соотношение кровь/антикоагулянт.
Если в момент пункции вены и забора крови возникают препятствия (медсестра долго не может попасть в вену, начинает искать другую вену, кровь идет плохо из-за неадекватно подобранного диаметра иглы), то правильное соотношение кровь/антикоагулянт не будет достигнуто. Такой образец не следует отправлять в лабораторию!
Дина Жуковская:
Исследование этой пробы не имеет смысла, потому что результат будет заведомо недостоверным. Несоблюдение техники сразу видно по метке на пробирке. И если мы получаем некачественный образец, то даже не берем его для исследования, чтобы не терять время, а связываемся с отделением для решения вопроса о повторном заборе крови у данного пациента.
Поэтому если медсестра понимает, что не соблюла технику забора крови, система не наполнилась до метки, будет лучше, если она сама примет решение и не станет направлять такой образец на исследование.
Что делать, если медсестра не может попасть в вену?
Помогают более опытные сестры, обычно это медсестры-анестезисты.
Если пациенту назначен только ОАК, а у него очень плохие вены, то допускается забор капиллярной крови.
В случае тяжелого состояниях пациента, срочной необходимости анализа и невозможности обеспечить венозный доступ к периферическим венам выполняется катетеризация центральных вен. Это делается врачом, чаще всего в отделениях реанимации.
Дина Жуковская:
Из отделения звонят нам, и наш фельдшер-лаборант берет кровь из пальца. Но, повторюсь, такой вариант подходит лишь для общего анализа крови. Для всех остальных исследований нужна только венозная кровь. Если возможно перенести анализ на следующий день, то лучше так и поступить, особенно если пациент нервничает.
За рубежом пациентам в стационарах, как правило, ставят периферические катетеры, которые используются для внутривенных инфузий лекарственных средств. Это удобно и для персонала, и для пациента, особенно если назначений много. У нас такой подход пока не получил повсеместного распространения, хотя тоже применяется, особенно в педиатрической практике.
Особенности взятия образца крови из катетера
Взятие образцов крови для исследований из установленного ранее катетера для внутривенной инфузии лекарственных средств допускается, но только при строгом соблюдении определенных условий.
Запрещен забор крови для исследования системы гемостаза (коагулограмма) из катетера, обработка которого проводилась гепарином. Необходимо обеспечить другой венозный доступ.
В катетере есть так называемая гепариновая заглушка, когда для предотвращения тромбирования вводится гепариновый раствор с физраствором в соотношении 100:1. Поэтому перед взятием крови на исследование из катетера его следует промыть физраствором в объеме, равном объему катетера, и обязательно утилизировать первые 5 мл взятой из катетера крови. Нужно, чтобы даже следов гепарина не оказалось в образце!
Дина Жуковская:
Иначе мы получим неадекватный результат, в частности, нехарактерное удлинение АЧТВ. Иногда мы вообще не можем определить этот показатель, потому что кровь совсем не сворачивается, и понятно, что у живого человека такого не может быть. В таком случае звоним в отделение или пишем в примечании: «Повторите коагулограмму. Вероятно попадание гепарина в образец».
У тяжелых пациентов в ОРИТ: при крайней необходимости срочного взятия образца крови на общий анализ у пациента, который в это время находится на инфузии через венозный или артериальный катетер, кровь берется из другого доступа. Медсестра обязательно должна указать в сопроводительном бланке факт того, что кровь бралась в момент инфузии, а также лекарственное средство. В лаборатории при выдаче результата будет учтен момент делюции (разведения) пробы.
Транспортировка образцов
Доставка образцов с биоматериалом в лабораторию осуществляется в наиболее возможный короткий промежуток времени.
В учреждении со своей лабораторией герметично закрытые пробирки, установленные вертикально в штативы, относятся в лабораторию.
При транспортировке в централизованную лабораторию штативы с образцами крови помещаются в специальные промаркированные термоконтейнеры, оборудованные хладагентами для поддержания температуры 2–8 °С.
Основные требования при транспортировке: избегать перепадов температур, резких колебаний, воздействий прямых солнечных лучей, нахождения рядом с нагревательными приборами или оборудованием.
Дина Жуковская:
Недочеты, которые встречаются на данном этапе, обычно происходят в момент сбора образцов в отделении. Так, приходилось наблюдать ситуации, когда штативы стояли на подоконнике над батареей отопления или на столе у окна под яркими солнечными лучами. Конечно, клетки, ферменты в пробирках разрушаются — и качество таких образцов резко снижается.
Самое главное — достоверный результат
Дина Жуковская:
Согласно данным ВОЗ, более 70 % врачебных решений принимается на основании результатов лабораторных исследований. Они помогают поставить верный диагноз, назначить эффективное лечение, а в экстренной ситуации — коренным образом повлиять на тактику оказания помощи и спасти пациенту жизнь. Но самое главное в данном процессе — получить достоверные результаты. Они зависят от совместных усилий врачей, среднего медперсонала, специалистов лаборатории. В нашем учреждении этот процесс хорошо отлажен.
Актуальность
Часто у лечащего врача возникают претензии к лабораторным анализам, т. е. происходит не совпадение клинической картины с лабораторными показателями. Нарушение преаналитики является одной из самых частых причин этой проблемы. Данная статья поможет разобраться с этой нелепой, но весьма серьезной задачей.
Что такое преаналитика? Преаналитика – это все процедуры, выполняемые до начала проведения лабораторных исследований, которые непосредственно влияют на результат лабораторного анализа.
Оптимально проведенная преаналитическая подготовка является основным условием точной и полной лабораторной диагностики.
Зачем нужно врачам знать преаналитику? При нарушении преаналитического этапа врачи собственноручно готовят предпосылки для заведомо ложных результатов лабораторного анализа.
Статистика
Затраты времени на этапах лабораторного исследования:
Преаналитическии этап вне лаборатории – 20,20%
Преаналитическии этап в лаборатории – 37,10%
Аналитическии этап – 25,10%
Постаналитическии этап – 13,60%
Отправка результатов – 4%
Анализ ошибок показывает, что около 40% ошибок совершается на преаналитическом этапе при выполнении исследований в плановом порядке и около 60% ошибок происходит на преаналитическом этапе при неотложных анализах. (M.Plebani, P.Carraro, 1997).
Из чего состоит преналитическии этап вне лаборатории?
— Назначение анализов
— Подготовка пациента (психологическая и физическая)
— Заполнение направления.
— Взятие биоматериала.
— Хранение и доставка биоматериала.
На каждом из выше указанных составных может быть допущена ошибка.
Общие правила при подготовке к исследованию крови:
1. Кровь сдается в утренние часы натощак (или в дневные и вечерние часы, спустя 4-5 часов после последнего приема пищи). За 1-2 дня до исследования исключить из рациона продукты с высоким содержанием жиров.
2. Показатели крови могут существенно меняться в течение дня, поэтому рекомендуется все анализы сдавать в утренние часы.
3. Накануне исследования (в течение 24 часов) исключить алкоголь, интенсивные физические нагрузки, прием лекарственных препаратов (по согласованию с врачом).
4. За 1-2 часа до сдачи крови воздержаться от курения, не употреблять сок, чай, кофе, можно пить негазированную воду. Исключить физическое напряжение (бег, быстрый подъем по лестнице), эмоциональное возбуждение. За 15 минут до сдачи крови рекомендуется отдохнуть, успокоиться.
5. Не следует сдавать кровь для лабораторного исследования сразу после физиотерапевтических процедур, инструментального обследования, рентгенологического и ультразвукового исследований, массажа и других медицинских процедур.
6. При контроле лабораторных показателей в динамике рекомендуется проводить повторные исследования в одинаковых условиях – в одной лаборатории, сдавать кровь в одинаковое время суток и пр.
7. Кровь для исследований нужно сдавать до начала приема лекарственных препаратов или не ранее, чем через 10 — 14 дней после их отмены. Для оценки контроля эффективности лечения любыми препаратами нужно проводить исследование спустя 7 – 14 дней после последнего приема препарата. Если Вы принимаете лекарства, обязательно предупредите об этом лечащего врача.
Общие правила применимы ко всем анализам, но для некоторых исследований требуется специальная подготовка и дополнительные ограничения.
Влияние некоторых факторов на результат анализов.
Психический стресс
Степень влияния психического стресса (страх перед взятием крови, предоперационный стресс и т.д.) на лабораторные результаты часто недооценивается. Между тем, под его влиянием может наблюдаться увеличение секреции гормонов (альдостерона, ангиотензина, катехоламинов, кортизола, пролактина, ренина, соматотропина, ТСГ, вазопрессина) и повышение концентрации альбумина, фибриногена, глюкозы, инсулина, лактата и холестерина.
Наложение жгута
Что происходит, когда жгут накладывается на весь период времени при взятии пробы? При использовании давления ниже уровня систолического, внутри капилляров поддерживается эффективное фильтрационное давление. Как следствие, жидкость и низкомолекулярные соединения перемещаются из внутрисосудистого пространства в интерстициальное. Макромолекулы, вещества, связанные с белками и клетки крови не проникают через стенку капилляров, таким образом, их концентрация заметно возрастает, тогда как концентрации низкомолекулярных веществ не изменяются.
Длительность наложения жгута и изменения уровней исследуемых параметров
Сравнение: через 1 мин. через 3 мин.
Параметры Отклонение в %
Билирубин +8
Холестерин +5
Креатинин -9
Креатинкиназа -4
Железо +7
Глюкоза -9
γ-Глютамилтрансфераза -10
Калий +5
Положение тела
Изменение положения тела – из горизонтального в вертикальное – приводит к увеличению уровня ряда показателей.
Параметры Увеличение в %
Гематокрит 13
Эритроциты 15
Холестерин высокой плотности 10
Альдостерон 15
Ренин 60
Взятие пробы из катетера
Если пробы берут из венозных или артериальных инфузионных катетеров, канюлю следует промыть изотоническим солевым раствором в объеме, соизмеримом с объемом катетера. Прежде чем взять пробу, выбросить первые 5 мл крови, полученной из катетера. Взятиепроб для исследований свертывающей системы из катетеров, обработанных гепарином, неприемлемо. Для гепарин-зависимых методов (тромбиновое время, АЧТВ) рекомендуется
предварительно отбросить объем крови, вдвое превышающий объем катетера; первая порция взятой затем крови может быть использована для выполнения исследований, не относящихся к системе гемостаза; последующая порция цитратной крови может использоваться только для определения нечувствительных к присутствию гепарина аналитов: протромбинового времени, рептилазного времени, фибриногена по Clauss, АТ III, мономеров фибрина. Важно, чтобы перед взятием крови в пробирку с раствором цитрата натрия не было длительной паузы, в течение которой кровь в катетере может «застаиваться».
Высота над уровнем моря
Содержание некоторых компонентов крови подвержено значительным изменениям в зависимости от высоты над уровнем моря. С увеличением высоты значительное повышение наблюдается в отношении, например реактивного белка (до 65% на высоте 3600 м), гематокрита и гемоглобина (до 8% на высоте 1400 м) и мочевой кислоты. Адаптация к высоте занимает недели, а возвращение к значениям на уровне моря происходит в течение нескольких дней. Значительное снижение величин с ростом высоты над уровнем моря обнаружено в отношении мочевого креатинина, клиренса креатинина, эстриола (до 50% на высоте 4200 м), осмоляльности сыворотки, ренина плазмы и трансферрина сыворотки.
1 Мошкин А., Долгов В. Обеспечение качества в клинической лабораторной диагностике.. — М.: 2004. – С. 26-43.
2 Преаналитический этап. Пробоподготовка. West Medica
3 Преаналитика: практические советы и методы. SARSTEDT AG & Co.
Түйін: преаналитикалық кезенде көптеген факторлар зертханалық зертудің нәтижесіне әсер ететің зертхана дәрігерлері жақсы түсінеді. Ал клиникалық дәрігердің көбісі бұл жағдайдың маңызың ескермейді. Осы салалардың әсерінен зертханалық зертудің нәтижесін дәрігерлер дұрыс талдамауына және дұрыс ем шара жасамауына алып келеді.
Resume: physicians of Clinical Laboratory Diagnostics had recognized that, in the preanalytical phase, many factors can affect to the results of laboratory tests. Most of physicians don’t know of their influence. Ignorance of this factors may lead to misinterpretation of the result and take on a patient the wrong action.
Взятие венозной крови: некоторые вопросы преаналитики
Как цитировать:
Сапенко Т.П. Взятие венозной крови: некоторые вопросы преаналитики. Лабораторная служба.
2012;(2):34‑38.
Sapenko TP. Venous blood sampling: some issues of preanalytics. Laboratory Service. 2012;(2):34‑38. (In Russ.)

Манипуляции на преаналитическом этапе лабораторных исследований — основной источник ошибок и некорректных результатов. По данным литературы, погрешности на преаналитическом этапе являются причиной более 60% недостоверных результатов. На собственно аналитическом этапе исследования вносится, по тем же данным, не более 20% ошибок; при этом некоторая их часть также обусловлена предшествующими нарушениями на преаналитическом этапе (рис. 1).
Преаналитический этап начинается гораздо раньше, чем обычно описывается в учебных пособиях. Необходимо помнить, что любой лечебный процесс включает не только оценку диагностической ценности теста, но и необходимость назначения контролирующих, сопутствующих и дополнительных процедур и исследований. Поэтому назначение исследования и подготовку пациента к взятию биоматериала также следует рассматривать как составляющие преаналитического этапа.
Взятие биоматериала, транспортировка, хранение и пробоподготовка делятся на внелабораторную и лабораторную части. Основная задача этих этапов — обеспечение стабильности (сохранности) полученных биоматериалов и сведение к минимуму влияния различных факторов, изменяющих их качество.
Правильно проведенная преаналитическая подготовка — одно из основных условий точной лабораторной диагностики.
В настоящее время большинство клиник применяет вакуумный способ взятия венозной крови. Этот способ максимально удобен как для пациента, так и для медицинского персонала.
Компания «Greiner Bio-One» (Австрия) — один из ведущих производителей вакуумных систем для взятия биоматериала. Такие системы обеспечивают максимальную безопасность медицинского работника при взятии венозной крови благодаря тому, что полностью исключается контакт крови с окружающей средой. Однако даже при хорошем опыте работы с такими системами порой могут возникать проблемы.
Современные требования к получению биоматериала подробно описаны в Национальных Стандартах, однако, выполняя эти требования, медицинский персонал часто сталкивается с целым рядом сложностей:
1. Кровь не поступает в пробирку.
Возможно несколько причин этого, и для каждой из них существует свой способ решения:
2. При венепункции внезапно ток крови быстро прекращается, не наполнив пробирку.
В данном случае медицинский персонал должен обращать внимание на следующие возможные причины и знать пути решения проблемы:
3. Гемолиз в пробирке.
Гемолиз (повреждение эритроцитов во время взятия крови) — процесс повреждения эритроцитов, при котором гемоглобин выходит из них в окружающую среду. Кровь или взвесь эритроцитов превращается в прозрачную красную жидкость («лаковая кровь»). Гемолиз может сделать пробу непригодной для анализа. Основные причины и способы решения проблем следующие:
Подробнее остановимся на процедуре «прямого» переноса крови из шприца в вакуумную пробирку, когда пробку прокалывают иглой шприца, и кровь с усилием выдавливают поршнем. Данная процедура имеет ряд недостатков:
1. Перенос образца происходит под избыточным давлением, что приводит к вспениванию крови, гемолизу и денатурации белков.
Денатурация белков:
— искажает результаты, связанные с определением активности и концентрации всех белков и ферментов, активность которых напрямую зависит от сферической конфигурации молекулы белка;
— приводит к повышению мутности образца, что искажает результаты фотометрических методик;
гемолиз — основная причина отказа лаборатории принять образец к исследованию. Любая гемолитичная проба считается заведомо некорректной.
2. Перенос образца крови в пробирку с реагентами обусловливает необходимость точного дозирования, при выдавливании крови поршнем часто пробирка переполняется.
3. Манипуляции с открытой иглой несут риск ранения персонала контаминированной иглой.
Использование специального держателя для безопасного переноса крови из шприца в пробирку позволяет избежать этих проблем.
Держатель для переноса крови из шприца в пробирку из линии продукции VACUETTE предназначен для корректного переноса проб крови из шприцев. Конструкция держателя исключает риск травмы медицинского персонала и облегчает перенос крови без дополнительных манипуляций. Держатель соответствует рекомендациям H3-A5 CLSI (Институт клинических и лабораторных стандартов). Выполните следующие действия: наберите пробу крови в шприц, используя процедуру, принятую в Вашем медицинском учреждении (рис. 2, а),
Кроме того, при исследовании ряда показателей возможны другие ошибки, связанные с невыполнением специальных требований к преаналитическому процессу для данного параметра.
1. Определенное время взятия крови. В некоторых случаях кровь необходимо брать в определенное время: при приеме некоторых лекарственных препаратов, натощак и/или вследствие суточных колебаний биологических параметров (циркадного ритма). Важно, чтобы взятие таких проб производилось в течение строго установленного промежутка времени. Следует дать необходимые указания персоналу, проводящему венепункции, чтобы он точно соблюдал эти правила.
Примеры исследований, при которых требуется взятие крови в определенный промежуток времени:
— исследования показателей, изменяющихся в течение суток (например, глюкоза, кортикостероиды и другие гормоны, железо сыворотки крови);
— мониторинг терапии (например, протромбиновое время, АЧТВ, концентрация салициловой кислоты, дигоксина и других лекарственных препаратов).
Во многих из перечисленных ситуаций необходимо точно записывать на бланке направления дозу препарата и время его последнего приема, а также время взятия крови.
2. Особенности взятия крови для отдельных исследований:
— определение содержания алкоголя в крови. При взятии пробы для определения содержания алкоголя в крови дезинфекцию места венепункции следует проводить не содержащим спирт веществом (например, мылом);
— образцы для культивирования крови. При взятии, транспортировке и хранении образцов для культивирования крови необходимо соблюдать определенные временные и температурные условия. Кроме того, существуют различия в объеме крови, необходимой для культивирования. Обычно на один анализ необходимо взять 10-20 мл крови взрослого и 1-2 мл крови новорожденного;
— микроэлементы. В линии продукции VACUETTE представлены специальные пробирки для определения концентрации микроэлементов.
3. Особенности взятия крови с помощью катетеров. Существует ряд систем, качество которых имеет большое значение при проведении лабораторной диагностики у пациентов в клиниках ургентных состояний. В первую очередь это касается катетеров и фистул.
Возможные ошибки
Постоянные катетеры обычно устанавливаются пациентам, находящимся в тяжелом состоянии, получающим массивную инфузионную терапию. Взятие проб крови из постоянных катетеров может привести к ошибочным результатам исследований из-за неполного промывания всей длины катетера. Это приводит к контаминации образца лекарственными средствами и/или разбавлению образца крови (рис.3).
Промывание катетеров
Перед взятием пробы нужно удалить из катетера достаточное количество крови, чтобы быть уверенным, что проба не разбавлена и не контаминирована. Объем удаляемой крови зависит от внутреннего объема конкретного катетера. Для исследования системы гемостаза кровь рекомендуется сливать в количестве не менее 6 объемов катетера (5-7 мл), для других исследований — не менее 2 мл.
Если пациенту в экстренной ситуации при неотложной терапии установлена игла-бабочка с металлической силиконизированной иглой для внутривенного введения лекарственных препаратов или для взятия крови, то ее можно оставлять в вене на срок от 36 до 48 ч. Иглы-бабочки системы VACUETTE компании «Greiner Bio-One» (Австрия) предназначены для взятия венозной крови у детей и пациентов с труднодоступными венами для проведения быстрой и безболезненной венепункции. В линии продукции VACUETTE для взятия венозной крови есть как стандартные иглы-бабочки, так и иглы-бабочки SAFETY с механизмом защиты от укола иглой (рис. 4).
Инфузионная терапия
Если пациенту внутривенно вводятся растворы, по возможности не следует брать кровь из этой же руки. Показано, что кровь, взятая проксимальнее места внутривенной инфузии, разбавлена вводимым раствором. Кроме того, раствор может содержать исследуемый аналит. Результаты исследования крови в этом случае будут ошибочными. Необходимо найти место для взятия крови на другой руке. Иногда внутривенная инфузия может проводиться с обеих рук.
Удовлетворительные образцы могут быть получены при взятии крови дистальнее места внутривенной инфузии. Для этого рекомендуется следующее:
— отключить капельницу как минимум за 2 мин до венепункции;
— наложить жгут дистальнее места инфузии;
— выбрать вену, в которую не проводится инфузия;
— провести венепункцию.
На бланке направления должно быть отмечено, что этот образец брался из руки, в которую проводилась внутривенная инфузия.
Если вены недоступны, рекомендуется взять капиллярную кровь.
Из-за возможного возникновения ошибок при исследованиях следует избегать взятия крови из места внутривенной инфузии в течение первых 2 сут после ее отмены (рис. 5).
В заключение следует отметить, что в данной статье мы рассмотрели только некоторые вопросы, влияющие на преаналитический этап. Проблемы, связанные с преаналитическим этапом лабораторных исследований, не могут быть решены одним сотрудником и требуют совместных действий врачей, медицинских сестер и другого персонала лаборатории, участвующих в рабочем процессе лечебного учреждения. Надеемся, что рассмотренные выше ошибки, которые возникают при работе с вакуумными пробирками, и способы их решения, а также особенности взятия венозной крови позволят читателям произвести правильную оценку и повысить качество исследований.
Мы используем файлы cооkies для улучшения работы сайта. Оставаясь на нашем сайте, вы соглашаетесь с условиями
использования файлов cооkies. Чтобы ознакомиться с нашими Положениями о конфиденциальности и об использовании
файлов cookie, нажмите здесь.
Банк тестовых заданий
ПМ.03 «Проведение лабораторных биохимических исследований»
Специальность «Лабораторная диагностика»
1. ДЛЯ ПРИГОТОВЛЕНИЯ 1000 МЛ 3% РАСТВОРА ПЕРЕКИСИ ВОДОРОДА ИЗ 30% РАСТВОРА НЕОБХОДИМО ВЗЯТЬ
=100 мл 30% раствора и 900 мл воды
-10 мл 30% раствора и 990 мл воды
-200 мл 30% раствора и 800 мл воды
-1 мл 30% раствора и 999 мл воды
2. ДЛЯ ПРИГОТОВЛЕНИЯ 0,5 Л 3%-НОГО РАСТВОРА ХЛОРАМИНА НЕОБХОДИМО ВЗВЕСИТЬ СУХОГО ВЕЩЕСТВА
=15 г
-6 г
-9 г
-12 г
3. ПОД ДИАГНОСТИЧЕСКОЙ ЧУВСТВИТЕЛЬНОСТЬЮ ЛАБОРАТОРНОГО ТЕСТА ПОДРАЗУМЕВАЕТСЯ
= вероятность положительного результата теста в присутствии болезни
-вероятность отрицательного результата теста в отсутствии болезни
-минимальное количество исследуемого вещества, которое можно обнаружить в плазме крови
-способность отличать исследуемое вещество от других соединений
4. ДЛЯ ПОЛУЧЕНИЯ БЕДНОЙ ТРОМБОЦИТАМИ ПЛАЗМЫ СТАБИЛИЗИРОВАННУЮ КРОВЬ ЦЕНТРИФУГИРУЮТ
=при 3000 об/мин в течение 15 минут
-при 2000 об/мин в течение 5 минут
-при 1000 об/мин в течение 5 минут
-при 1000 об/мин в течение 10 минут
5. ПРИ ЗАБОРЕ КРОВИ ДЛЯ ИССЛЕДОВАНИЯ ПОКАЗАТЕЛЕЙ КОАГУЛЯЦИОННОГО ГЕМОСТАЗА НЕЛЬЗЯ
=накладывать жгут более 60 с
-использовать силиконированные пробирки с цитратом натрия
-использовать вакуумные системы с колпачками голубого цвета
-обрабатывать место прокола 70% спиртом
6. В КАЧЕСТВЕ АНТИКОАГУЛЯНТА ПРИ ЗАБОРЕ КРОВИ ДЛЯ ИССЛЕДОВАНИЯ ПОКАЗАТЕЛЕЙ КОАГУЛЯЦИИ ИСПОЛЬЗУЮТ
=цитрат натрия
-ЭДТА
-Гепарин
-оксалат натрия
7. СООТНОШЕНИЕ КРОВЬ: ЦИТРАТ НАТРИЯ ПРИ ЗАБОРЕ КРОВИ ДЛЯ ОПРЕДЕЛЕНИЯ ПОКАЗАТЕЛЕЙ КОАГУЛЯЦИИ СОСТАВЛЯЕТ
=9:1
-7:2 40
-4:1
-10:2
8. ОШИБКИ ДИАГНОСТИКИ НАРУШЕНИЙ ГЕМОСТАЗА МОГУТ ВОЗНИКНУТЬ В РЕЗУЛЬТАТЕ СЛЕДУЮЩИХ ДЕЙСТВИЙ НА ЭТАПЕ ЗАБОРА КРОВИ
=длительное наложение жгута
-кратковременное (до 60 с) наложение жгута
-забора крови в вакуумные системы
-забор крови самотеком
9. ПОНЯТИЮ «ОНКОТИЧЕСКОЕ ДАВЛЕНИЕ» СООТВЕТСТВУЕТ СЛЕДУЮЩЕЕ ОПРЕДЕЛЕНИЕ
=коллоидно-осмотическое давление, обусловленное присутствием белков
-внешняя сила, которую необходимо приложить к раствору, чтобы прекратить осмос
-самопроизвольный процесс выравнивания концентрации вещества в растворе
-свойство раствора — способность вызывать движение воды в клетку или из клетки
10. ПОНЯТИЮ «ОСМОЛЯРНОСТЬ» СООТВЕТСТВУЕТ СЛЕДУЮЩЕЕ ОПРЕДЕЛЕНИЕ
=концентрация осмотически активных веществ в расчете на 1 кг воды
-количество осмотически активных частиц в 1 л раствора
-свойство раствора — способность вызывать движение воды в клетку или из клетки
-самопроизвольный процесс выравнивания концентрации вещества в растворе
11. ПОНЯТИЮ «ТОНИЧНОСТЬ» СООТВЕТСТВУЕТ СЛЕДУЮЩЕЕ ОПРЕДЕЛЕНИЕ
=свойство раствора – способность вызывать движение воды в клетку или из клетки
-концентрация растворенных частиц в единице объема раствора
-концентрация осмотически активных веществ в расчете на массу воды
-внешняя сила, которую необходимо приложить к раствору, чтобы прекратить осмос
12. ЭЛЕКТРОФОРЕЗ БЕЛКОВ СЫВОРОТКИ КРОВИ ПРОВОДЯТ ПРИ РН БУФЕРА
=6,8
-5,6
-9,3
-7,4
13. ПРИ ХРАНЕНИИ ЦЕЛЬНОЙ КРОВИ ИЗ КЛЕТОК В ПЛАЗМУ ПЕРЕХОДЯТ
=ионы калия
-хлориды
-ионы натрия
-железо
14. ТОЧНЫМ СЧИТАЕТСЯ РАСТВОР
=0,1 н NaOH с К =1,01
-0,1 н HCl с K=0,91
-0,1 н NaOH с К = 1,07
-0,1 н NaOH с К = 1,09
15. МОЛЯРНОСТЬ И НОРМАЛЬНОСТЬ СОВПАДАЮТ ДЛЯ РАСТВОРОВ
=HCl
-Н2SO4
-H3PO4
-H2SiO3
16. ПРИБЛИЗИТЕЛЬНЫМИ СЧИТАЮТСЯ РАСТВОРЫ, КОНЦЕНТРАЦИЯ КОТОРЫХ ВЫРАЖЕТСЯ
=массовой долей (мг/дл)
-моль/л
-г/мл (титр)
-экв/л
17. КАЛИБРОВОЧНЫЙ КОЭФФИЦИЕНТ (ФАКТОР)
РАССЧИТЫВАЮТ ПО ФОРМУЛЕ
=F = Cстандарта : Естандарта
-F = Cопыта х Еопыта
-F = Cстандарта х Естандарта
-F = Естандарта : Сстандарта
18. МОЧУ СЛЕДУЕТ ХРАНИТЬ ПРИ ТЕМПЕРАТУРЕ
=+4оС
-0оС
— -20оС
-+37оС
19. ЭДТА И ОКСАЛАТЫ НЕЛЬЗЯ ИСПОЛЬЗОВАТЬ КАК АНТИКОАГУЛЯНТЫ ПРИ ЗАБОРЕ КРОВИ ДЛЯ ОПРЕДЕЛЕНИЯ
=общего кальция
-холестерина
-общего белка
-триглицеридов
20. К ОШИБКЕ НА ЭТАПЕ ВЗЯТИЯ КРОВИ ОТНОСИТСЯ
=кровь берется шприцем с последующим переливанием крови в вакуумную пробирку
-на пробирку нанесена вся необходимая информация о пациенте
-пробирки после наполнения кровью переворачиваются 5-8 раз
-пробирки наполняются кровью по уровню меток
21. СКРИНИНГ В БИОХИМИЧЕСКИХ ИССЛЕДОВАНИЯХ ИСПОЛЬЗУЕТСЯ С ЦЕЛЬЮ
=выявления заболевания в доклинической стадии
-распознавания болезни и постановки диагноза
-проведения контроля за лечением пациента
-прогнозирования исхода заболевания
22. МОНИТОРИНГ В БИОХИМИЧЕСКИХ ИССЛЕДОВАНИЯХ ИСПОЛЬЗУЕТСЯ С ЦЕЛЬЮ
=контроля за динамикой лечением пациента
-выявления заболевания в доклинической стадии
-оценки исхода и последствий болезни
-распознавания болезни и установление ее причины
23. НА ПРЕАНАЛИТИЧЕСКОМ ЭТАПЕ ЛАБОРАТОРНЫХ БИОХИМИЧЕСКИХ ИССЛЕДОВАНИЙ
=проводят подготовку биологического материала
-исследуют уровень аналитов в биологическом материале
-оформляют бланк результатов исследований
-доводят информацию о полученных результатах до врача
24. НА ПОСТАНАЛИТИЧЕСКОМ ЭТАПЕ ЛАБОРАТОРНЫХ БИОХИМИЧЕСКИХ ИССЛЕДОВАНИЙ
=проводят оформление результатов исследования
-проводят идентификацию пациента и пробы биоматериала
-определяют уровень аналитов в биоматериале
-оформляют направление на исследование
25. К ОБЯЗАННОСТЯМ МЕДИЦИНСКОГО ЛАБОРАТОРНОГО ТЕХНИКА ОТНОСИТСЯ
=подготовка биоматериала к исследованию
-распределение работы между сотрудниками
-ведение отчетной ежемесячной документации
-осуществление контроля за работой сотрудников
26. СОГЛАСНО ПРАВИЛАМ РАБОТЫ С КОНТРОЛЬНЫМ МАТЕРИАЛОМ, ДОПУСТИМО
=однократно замораживать и размораживать жидкую форму контрольного материала
-работать с контрольным материалом без перчаток
-использовать контрольный материал в качестве стандартного раствора
-проводить оттаивание контрольного материала после замораживания его жидкой формы при +45оС на водяной бане
27. ОТКЛОНЕНИЕ РЕЗУЛЬТАТА ИЗМЕРЕНИЯ ОТ ИСТИННОГО ЗНАЧЕНИЯ ИЗМЕРЯЕМОЙ ВЕЛИЧИНЫ НАЗЫВАЕТСЯ
=погрешностью измерений
-точностью измерений
-сходимостью измерений
-межсерийной воспроизводимостью
28. КАЧЕСТВО ИЗМЕРЕНИЙ, ОТРАЖАЮЩЕЕ БЛИЗОСТЬ ИХ РЕЗУЛЬТАТОВ К ИСТИННОМУ ЗНАЧЕНИЮ ИЗМЕРЯЕМОЙ ВЕЛИЧИНЫ НАЗЫВАЕТСЯ
=точностью измерений
-правильностью измерений
-межсерийной воспроизводимостью
-внутрисерийной воспроизводимостью
29. ДЛЯ ПОЛУЧЕНИЯ СЫВОРОТКИ КРОВИ ЧАЩЕ ДРУГИХ ИСПОЛЬЗУЮТ ВАКУУМНЫЕ ПРОБИРКИ С КРЫШКОЙ
=красного цвета
-голубого цвета
-зеленого цвета
-лилового цвета
30. ПРОБИРКИ ДЛЯ ВЗЯТИЯ КРОВИ С КРЫШКАМИ ЗЕЛЕНОГО ЦВЕТА СОДЕРЖАТ
=гепарин
-ЭДТА
-цитрат натрия
-кремнезем
31. ВАКУУМНЫЕ ПРОБИРКИ ДЛЯ ВЗЯТИЯ КРОВИ С КРЫШКАМИ ГОЛУБОГО ЦВЕТА СОДЕРЖАТ
=цитрат натрия
-кремнезем
-гепарин
-ЭДТА
32. ДЛЯ ВЗЯТИЯ КРОВИ НА ИССЛЕДОВАНИЕ КОНЦЕНТРАЦИИ ГЛЮКОЗЫ ИСПОЛЬЗУЮТ ПРОБИРКИ С КРЫШКОЙ
=серого цвета
-фиолетового цвета
-оранжевого цвета
-голубого цвета
33. ПРОБИРКИ ДЛЯ ПОЛУЧЕНИЯ ПЛАЗМЫ КРОВИ НА ОПРЕДЕЛЕНИЕ ГЛЮКОЗЫ СОДЕРЖАТ
=оксалат натрия и фторид натрия
-ЭДТА
-цитрат натрия
-гепарин
34. ВЗЯТИЕ ВЕНОЗНОЙ КРОВИ СЛЕДУЕТ ПРОВОДИТЬ, СОБЛЮДАЯ СЛЕДУЮЩИЙ ПОРЯДОК С УЧЕТОМ ЦВЕТА КРЫШЕК ВАКУУМНЫХ ПРОБИРОК
=белая, красная, голубая, фиолетовая, зеленая, серая
-голубая, серая, зеленая, фиолетовая, белая, красная
-серая, фиолетовая, белая, голубая, красная, зеленая
-фиолетовая, голубая, красная, серая, зеленая, белая
35. ХИЛЕЗНОЙ НАЗЫВАЕТСЯ СЫВОРОТКА КРОВИ
=мутная
-ярко-желтого цвета
-желтая, прозрачная
-красного цвета
36. ХИЛЕЗНОСТЬ СЫВОРОТКИ КРОВИ ОБУСЛОВЛЕНА БОЛЬШИМ СОДЕРЖАНИЕМ
=жиров
-гемоглобина
-билирубина
-белков
37. ИКТЕРИЧНОЙ НАЗЫВАЕТСЯ СЫВОРОТКА КРОВИ
=насыщенно-оранжевая
-бледно-желтая, прозрачная
-с красным оттенком
-мутная
38. ИКТЕРИЧНОСТЬ СЫВОРОТКИ КРОВИ ОБУСЛОВЛЕНА БОЛЬШИМ СОДЕРЖАНИЕМ
=билирубина
-жиров
-гемоглобина
-белков
39. К ГЕМОЛИЗУ НА ЭТАПЕ ЗАБОРА КРОВИ МОЖЕТ ПРИВЕСТИ
=длительное наложение жгута
-обработка места венепункции спиртом
-использование вакуумных пробирок
-неправильный порядок заполнения вакуумных пробирок кровью
40. ГЕМОЛИТИЧНОСТЬ СЫВОРОТКИ КРОВИ ОБУСЛОВЛЕНА БОЛЬШИМ СОДЕРЖАНИЕМ
=гемоглобина
-альбуминов
-жиров
-билирубина
41. НА АНАЛИТИЧЕСКОМ ЭТАПЕ ЛАБОРАТОРНЫХ БИОХИМИЧЕСКИХ ИССЛЕДОВАНИЙ
=определяют уровень аналитов в биоматериале
-проводят центрифугирование пробирок с кровью
-оценивают правдоподобность полученных результатов
-оформляют бланк результатов исследований
42. НОРМАЛЬНОЕ ЗНАЧЕНИЕ РН АРТЕРИАЛЬНОЙ КРОВИ РАВНО
=7,35-7,45
-7,35-7,60
-7,2-7,8
-7,0-7,45
43. В СЫВОРОТКЕ КРОВИ ОТСУТСТВУЕТ (ЮТ)
=фибриноген
-преальбумин
-альбумин
-глобулины
44. ПРИ ПОЛОЖИТЕЛЬНОЙ РЕАКЦИИ ФЕЛЛИНГА НА ГЛЮКОЗУ В МОЧЕ НАБЛЮДАЕТСЯ
=красный осадок
-черный осадок
-синее окрашивание
-фиолетовое окрашивание
45. МОНОМЕРАМИ БЕЛКОВ ЯВЛЯЮТСЯ
=аминокислоты
-мононуклеотиды
-жирные кислоты
-глюкоза
46. ТРИГЛИЦЕРИНЫ СОСТОЯТ ИЗ ОСТАТКОВ
=глицерина и жирных кислот
-аминокислот
-мононуклеотидов
-галактуроновой кислоты и глюкозамина
47. ГОМОПОЛИСАХАРИДОМ ЯВЛЯЕТСЯ
=гликоген
-мальтоза
-гепарин
-лактоза
48. ПЕРВИЧНУЮ СТРУКТУРУ БЕЛКОВ СТАБИЛИЗИРУЮТ СВЯЗИ
=пептидные
-гликозидные
-водородные
-ионные
49. ФЕРМЕНТЫ ПО ХИМИЧЕСКОЙ СТРУКТУРЕ ЯВЛЯЮТСЯ
=белками
-углеводами
-липидами
-нуклеотидами
50. ПРОБА СЕЛИВАНОВА ИСПОЛЬЗУЕТСЯ ДЛЯ ОБНАРУЖЕНИЯ В МОЧЕ
=фруктозы
-лактозы
-мальтозы
-глюкозы
51. ПРОБА ВЕЛЬКА ИСПОЛЬЗУЕТСЯ ДЛЯ ОБНАРУЖЕНИЯ В МОЧЕ
=лактозы
-фруктозы
-глюкозы
-пентоз
52. ПРОБЫ БИАЛЯ ИСПОЛЬЗУЕТСЯ ДЛЯ ОБНАРУЖЕНИЯ В МОЧЕ
=пентоз
-фруктозы
-мальтозы
-лактозы
53. В РЕЗУЛЬТАТЕ ДЕНАТУРАЦИИ СОХРАНЯЕТСЯ СТРУКТУРА БЕЛКОВ
=первичная
-вторичная
-третичная
-четвертичная
54. БЕЛКИ ДЕНАТУРИРУЮТ ПРИ ТЕМПЕРАТУРЕ
=+90оС
-+4оС
-+37оС
—20оС
55. ГЕМОЛИЗ ЭРИТРОЦИТОВ ПРИВОДИТ К ПОВЫШЕНИЮ АКТИВНОСТИ В ПЛАЗМЕ КРОВИ
=аланинаминотрансферазы
-щелочной фосфатазы
-кислой фосфатазы
-альфа-амилазы
56. АКТИВНОСТЬ КИСЛОЙ ФОСФАТАЗЫ В ПЛАЗМЕ КРОВИ УВЕЛИЧИВАЕТСЯ ПРИ
=карциноме простаты
-инфаркте миокарда
-остром панкреатите
-вирусном гепатите
57. ПРИ ТРАВМЕ СКЕЛЕТНЫХ МЫШЦ В ПЛАЗМЕ КРОВИ УВЕЛИЧИВАЕТСЯ АКТИВНОСТЬ
=креатинкиназы
-кислой фосфатазы
-альфа-амилазы
-липазы
58. ДЛЯ ДИАГНОСТИКИ ОСТРОГО ПАНКРЕАТИТА В СЫВОРОТКЕ КРОВИ ИССЛЕДУЮТ АКТИВНОСТЬ
=альфа-амилазы
-кислой фосфатазы
-лактатдегидрогеназы
-альдолазы
59. ДЛЯ ДИАГНОСТИКИ ВИРУСНОГО ГЕПАТИТА В СЫВОРОТКЕ КРОВИ ИССЛЕДУЮТ АКТИВНОСТЬ
=аланинаминотрансферазы
-кислой фосфатазы
-гамма-глутамилтранспептидазы
-альфа-амилазы
60. ДЛЯ ДИАГНОСТИКИ СОСТОЯНИЯ КОСТНОЙ ТКАНИ В СЫВОРОТКЕ КРОВИ ИССЛЕДУЮТ АКТИВНОСТЬ
=щелочной фосфатазы
-аланинаминотрансферазы
-аспартатаминотрансферазы
-кислой фосфатазы
61. С ЦЕЛЬЮ РАННЕЙ ДИАГНОСТИКИ ИНФАРКТА МИОКАРДА В СЫВОРОТКЕ КРОВИ ИССЛЕДУЮТ АКТИВНОСТЬ
=креатинкиназы-МВ
-креатинкиназы-ММ
-лактатдегидрогеназы
-аспартатаминотрансферазы
62. ОПТИМИЗИРОВАННЫЙ МЕТОД РАЙТМАНА-ФРЕНКЕЛЯ ДЛЯ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ АЛТ И АСТ ОТНОСИТСЯ К
=колориметрическим методам по конечной точке
-кинетическим колориметрическим методам
-кинетическим УФ методам
-турбидиметрическим методам
63. ПРЯМОЙ ОПТИЧЕСКИЙ ТЕСТ ВАРБУРГА ИСПОЛЬЗУЕТСЯ ДЛЯ ОПРЕДЕЛЕНИЯ В СЫВОРОТКЕ КРОВИ АКТИВНОСТИ
=ЛДГ кинетическим методом
-АЛТ кинетическим методом
-АЛТ по методу Райтмана-Френкеля
-альфа-амилазы кинетическим методом
64. НЕПРЯМОЙ ОПТИЧЕСКИЙ ТЕСТ ВАРБУРГА ИСПОЛЬЗУЕТСЯ ДЛЯ ОПРЕДЕЛЕНИЯ В СЫВОРОТКЕ КРОВИ АКТИВНОСТИ
=АЛТ кинетическим методом
-АЛТ по методу Райтмана-Френкеля
-альфа-амилазы кинетическим методом
-ЛДГ кинетическим методом
65. МИЛЛИМОЛЯРНЫЙ ПОКАЗАТЕЛЬ ПОГЛОЩЕНИЯ ДЛЯ НАДН2 РАВЕН:
=6,22 л/(ммоль·см)
-5,22 л/(ммоль·см)
-7,22 л/(ммоль·см)
-8,22 л/(ммоль·см)
66. КОФЕРМЕНТОМ АЛАНИНАМИНОТРАНСФЕРАЗЫ ЯВЛЯЕТСЯ
=пиридоксальфосфат
-флавинадениндинуклеотид
-флавинмононуклеотид
-никотинамидадениндинуклеотид
67. КОФЕРМЕНТОМ ЛАКТАТДЕГИДРОГЕНАЗЫ ЯВЛЯЕТСЯ
=никотинамидадениндинуклеотид
-пиридоксальфосфат
-флавинмононуклеотид
-тиаминпирофосфат
68. НЕДОСТАТОЧНОСТЬ ВИТАМИНА «D» В ДЕТСКОМ ВОЗРАСТЕ ПРИВОДИТ К РАЗВИТИЮ
=рахита
-бери-бери
-цинги
-остепороза
69. АВИТАМИНОЗ ВИТАМИНА «С» ПРИВОДИТ К РАЗВИТИЮ
=цинги
-рахита
-бери-бери
-ксерофтальмии
70. КСЕРОФТАЛЬМИЯ РАЗВИВАЕТСЯ ПРИ НЕДОСТАТОЧНОСТИ ВИТАМИНА
=А
-D
-Е
-С
71. ТИРОКСИН СИНТЕЗИРУЕТСЯ И СЕКРЕТИРУЕТСЯ
=щитовидной железой
-поджелудочной железой
-корой надпочечников
-половыми железами
72. ИНСУЛИН СИНТЕЗИРУЕТСЯ И СЕКРЕТИРУЕТСЯ
=поджелудочной железой
-гипоталамусом
-надпочечниками
-плацентой
73. К СТЕРОИДНЫМ ГОРМОНАМ ОТНОСИТСЯ
=прогестерон
-инсулин
-тироксин
-глюкагон
74. ОСНОВНЫМ ПОКАЗАТЕЛЕМ ДЛЯ ОЦЕНКИ УГЛЕВОДНОГО ОБМЕНА ЯВЛЯЕТСЯ
=глюкоза
-галактоза
-фруктозамин
-гликированный гемоглобин
75. В ЭНЗИМАТИЧЕСКОМ МЕТОДЕ ОПРЕДЕЛЕНИЯ ГЛЮКОЗЫ ИСПОЛЬЗУЕТСЯ ФЕРМЕНТ
=глюкозооксидаза
-холестеролоксидаза
-лактатдегидрогеназа
-уреаза
76. В РЕЗУЛЬТАТЕ ОКИСЛЕНИЯ ГЛЮКОЗЫ В ГЛЮКОЗООКСИДАЗНОМ МЕТОДЕ ОБРАЗУЕТСЯ
=глюконовая кислота
-глюкуроновая кислота
-глюкозамин
-сорбитол
77. ПЕРОКСИДАЗА В ЭНЗИМАТИЧЕСКОМ КОЛОРИМЕТРИЧЕСКОМ ГЛЮКОЗООКСИДАЗНОМ-ПЕРОКСИДАЗНОМ МЕТОДЕ ОПРЕДЕЛЕНИЯ ГЛЮКОЗЫ КАТАЛИЗИРУЕТ РЕАКЦИЮ
=восстановления пероксида водорода
-окисления пероксида водорода
-восстановления глюкозы
-окисления глюкозы
78. ДЛЯ ПРЕОБРАЗОВАНИЯ КОНЦЕНТРАЦИИ ГЛЮКОЗЫ В ЦЕЛЬНОЙ КРОВИ В ВЕЛИЧИНУ, ЭКВИВАЛЕНТНУЮ EЕ КОНЦЕНТРАЦИИ В ПЛАЗМЕ, ИСПОЛЬЗУЮТ КОЭФФИЦИЕНТ
=1,11
-1,5
-2,2
-2,5
79. ПРИНЦИП ДЕТЕКЦИИ НА БИОХИМИЧЕСКОМ АНАЛИЗАТОРЕ С ПРИМЕНЕНИЕМ «СУХОЙ ХИМИИ»
=отражательная фотометрия
-абсорбционная фотометрия
-амперометрия
-нефелометрия
80. К ЭНЗИМОПАТИЯМ УГЛЕВОДНОГО ОБМЕНА ОТНОСИТСЯ
=галактоземия
-болезнь Дауна
-фенилкетонурия
-адреногенитальный синдром
81. ПРИЧИНА САХАРНОГО ДИАБЕТА – НЕДОСТАТОЧНОСТЬ ГОРМОНА
=инсулина
-адреналина
-тироксина
-глюкагона
82. КОНЦЕНТРАЦИЮ ЛАКТАТА В КРОВИ ОПРЕДЕЛЯЮТ С ЦЕЛЬЮ
=оценки уровня тканевой гипоксии
-контроля за лечением больных сахарным диабетом
-диагностики сахарного диабета
-оценки уровня гликемии за предшествующие 2 месяца
83. КОНЦЕНТРАЦИЮ ФРУКТОЗАМИНА В ПЛАЗМЕ КРОВИ ОПРЕДЕЛЯЮТ С ЦЕЛЬЮ
=мониторинга лечения сахарного диабета
-диагностики сахарного диабета
-скрининга сахарного диабета 1-го типа
-скрининга сахарного диабета 2-го типа
84. ОПРЕДЕЛЕНИЕ УРОВНЯ СИАЛОВЫХ КИСЛОТ В ПЛАЗМЕ КРОВИ ИСПОЛЬЗУЮТ ДЛЯ ДИАГНОСТИКИ ЗАБОЛЕВАНИЙ
=соединительной ткани
-мышечной ткани
-поджелудочной железы
-печени
85. В НОРМЕ КОНЦЕНТРАЦИЯ ГЛЮКОЗЫ В ЦЕЛЬНОЙ КАПИЛЛЯРНОЙ КРОВИ СОСТАВЛЯЕТ
=3,3-5,5 ммоль/л
-2,5-3,5 ммоль/л
-4,5-6,1 ммоль/л
-5,5- 7,6 ммоль/л
86. В НОРМЕ КОНЦЕНТРАЦИЯ ГЛЮКОЗЫ В ПЛАЗМЕ, ПОЛУЧЕННОЙ ИЗ ВЕНОЗНОЙ КРОВИ, СОСТАВЛЯЕТ
=3,9-6,1 ммоль/л
-2,5-3,5 ммоль/л
-3,5-5,1 ммоль/л
-5,5-7,8 ммоль/л
87. В НОРМЕ УРОВЕНЬ ГЛИКЕМИИ ЧЕРЕЗ 2 ЧАСА ПОСЛЕ ПРОВЕДЕНИЯ ПГТТ СОСТАВЛЯЕТ
=менее 7,8 ммоль/л
-более 9,5 ммоль/л
-более 11,0 ммоль/л
-более 7,8 ммоль/л, но менее 11 ммоль/л
88. ПРИ САХАРНОМ ДИАБЕТЕ УРОВЕНЬ ГЛИКЕМИИ ЧЕРЕЗ 2 ЧАСА ПОСЛЕ ПРОВЕДЕНИЯ ПГТТ СОСТАВЛЯЕТ
=более 11,1 ммоль/л
-менее 7,8 ммоль/л
-не более 9,0 ммоль/л
-более 7,8 ммоль/л, но менее 11 ммоль/л
89. В КАЧЕСТВЕ ДИАГНОСТИЧЕСКОГО КРИТЕРИЯ САХАРНОГО ДИАБЕТА ВЫБРАН УРОВЕНЬ ГЛИКИРОВАННОГО ГЕМОГЛОБИНА
=≥6,5%
-≥7,3%
-≥8,5%
-≥4,5%
90. К ИНСУЛИНЗАВИСИМЫМ ТКАНЯМ ОТНОСИТСЯ
=жировая ткань
-почки
-тонкий кишечник
-мозг
91. ЖЕЛЧНЫЕ КИСЛОТЫ ВЫПОЛНЯЮТ РОЛЬ
=) эмульгирующую
-структурную
-энергетическую
-рецепторную
92. ТЕРМИН «ХОЛЕМИЯ» ОЗНАЧАЕТ ПОВЫШЕНИЕ В ПЛАЗМЕ КРОВИ КОНЦЕНТРАЦИИ
=желчных кислот
-холестерина
-кетоновых тел
-липопротеинов низкой плотности
93. К КЕТОНОВЫМ ТЕЛАМ ОТНОСИТСЯ
=ацетоуксусная кислота
-глицеральдегид-3-фосфат
-глицерол-3-фосфат
-молочная кислота
94. ОБНАРУЖИТЬ КЕТОНОВЫЕ ТЕЛА В МОЧЕ МОЖНО С ПОМОЩЬЮ ПРОБЫ
=Легаля (Ланге)
-Селиванова
-Биаля
-Велька
95. ЭНДОГЕННЫЕ ТРИАЦИЛГЛИЦЕРИНЫ ОТ ПЕЧЕНИ К ТКАНЯМ ТРАНСПОРТИРУЮТСЯ В СОСТАВЕ
=ЛПОНП
-ЛПНП
-ЛПВП
-хиломикронов
96. ЭКЗОГЕННЫЕ ТРИАЦИЛГЛИЦЕРИНЫ ОТ КИШЕЧНИКА К ТКАНЯМ ТРАНСПОРТИРУЮТСЯ В СОСТАВЕ
=хиломикронов
-ЛПНП
-ЛППП
-ЛПВП
97. К АНТИАТЕРОГЕННЫМ ЛИПОПРОТЕИНАМ ОТНОСЯТСЯ
=ЛПВП
-ЛПНП
-ЛПОНП
-хиломикроны
98. ИНДЕКС АТЕРОГЕННОСТИ В НОРМЕ СОСТАВЛЯЕТ
=02.мар
-03.апр
-05.июн
-07.авг
99. В НОРМЕ ИНДЕКС МАССЫ ТЕЛА ДЛЯ ВЗРОСЛОГО ЗДОРОВОГО ЧЕЛОВЕКА СОСТАВЛЯЕТ
=20-25
-15-19
-26-28
-30-35
100. ГЕПАРИН НЕ ПРИМЕНЯЕТСЯ В КАЧЕСТВЕ АНТИКОАГУЛЯНТА ДЛЯ ПОЛУЧЕНИЯ ПЛАЗМЫ КРОВИ С ЦЕЛЬЮ ОПРЕДЕЛЕНИЯ
=ЛПНП и ЛПОНП
-кетоновых тел
-триглицеринов
-фосфолипидов
101. ИНДЕКС АТЕРОГЕННОСТИ РАСЧИТЫВАЮТ С ЦЕЛЬ ОЦЕНКИ РИСКА РАЗВИТИЯ
=атеросклероза
-ожирения
-жировой инфильтрации печени
-кетоза
102. В ЭНЗИМАТИЧЕСКОМ КОЛОРИМЕТРИЧЕСКОМ МЕТОДЕ ОПРЕДЕЛЕНИЯ ОБЩЕГО ХОЛЕСТЕРИНА ПО КОНЕЧНОЙ ТОЧКЕ ИСПОЛЬЗУЕТСЯ СЛЕДУЮЩЕЕ СОЧЕТАНИЕ ФЕРМЕНТОВ
=холестеролэстераза, холестеролоксидаза, пероксидаза
-холестеролэстераза, холестеролоксидаза, каталаза
-холестролоксидаза, пероксидаза
-холестеролоксидаза, каталаза
103. К ЛИПОТРОПНЫМ ВЕЩЕСТВАМ ОТНОСИТСЯ
=холин
-глюкоза
-холестерин
-глицин
104. АЗОТИСТОЕ РАВНОВЕСИЕ НАБЛЮДАЕТСЯ
= взрослого здорового человека
-у детей первого года жизни
-у беременных женщин
-в период восстановления после тяжелой болезни
105. КИСЛОТНОСТЬ ЖЕЛУДОЧНОГО СОКА СОЗДАЕТСЯ
=соляной кислотой
-молочной кислотой
-уксусной кислотой
-серной кислотой
106. ПРИ ПОЛОЖИТЕЛЬНОЙ БИУРЕТОВОЙ РЕАКЦИИ РАЗВИВАЕТСЯ ОКРАШИВАНИЕ
=фиолетовое
-красное
-оранжевое
-зеленое
107. НОРМА ОБЩЕГО БЕЛКА В СЫВОРОТКЕ КРОВИ ВЗРОСЛЫХ ЛЮДЕЙ СООТВЕТСТВУЕТ
=65-85 г/л
-35-45 г/л
-55-65 г/л
-90-100 г/л
108. В РЕЗУЛЬТАТЕ ГНИЕНИЯ ТРИПТОФАНА В ТОЛСТОМ КИШЕЧНИКЕ ОБРАЗУЕТСЯ
=индол
-фенол
-крезол
-скатол
109. ОСНОВНЫМ СПОСОБОМ ОБЕЗВРЕЖИВАНИЯ АММИАКА В ОРГАНИЗМЕ ЯВЛЯЕТСЯ
=синтез мочевины
-образование аммонийных солей
-синтез аспарагина
-образование глутамина
110. АММИАК ОБРАЗУЕТСЯ В РЕЗУЛЬТАТЕ РЕАКЦИЙ
=дезаминирования аминокислот
-декарбоксилирования аминокислот
-трансаминирования аминокислот
-синтеза мочевины
111. КОНЦЕНТРАЦИЯ МОЧЕВИНЫ В ПЛАЗМЕ КРОВИ В НОРМЕ СОСТАВЛЯЕТ
А) 2,5-8,3 ммоль/л
Б) 0,5-1,9 ммоль/л
В) 9,5-10,4 ммоль/л
Г) 10,6-12,7 ммоль/л
112. ПРИЧИНА ФЕНИЛКЕТОНУРИИ – НАСЛЕДСТВЕННАЯ НЕДОСТАТОЧНОСТЬ ФЕРМЕНТА
=фенилаланингидроксилазы
-аспартатаминотрансферазы
-фенилаланинаминотрансферазы
-оксидазы гомогентизиновой кислоты
113. РАСЧЕТ КЛИРЕНСА ЭНДОГЕННОГО КРЕАТИНИНА ИСПОЛЬЗУЮТ С ЦЕЛЬЮ ОЦЕНКИ ФУНКЦИИ
=почек
-печени
-поджелудочной железы
-легких
114. ПРОБА РЕБЕРГА-ТАРЕЕЕВА ИСПОЛЬЗУЕТСЯ ДЛЯ ОПРЕДЕЛЕНИЯ
=скорости клубочковой фильтрации
-клиренса эндогенной мочевины
-мочевой кислоты в сыворотке крови
-мочевины в сыворотке крови
115. ПРЯМОЙ БИЛИРУБИН ПО-ДРУГОМУ НАЗЫВАЕТСЯ
=связанный
-непрямой
-несвязанный
-не конъюгированный
116. ПРИ ГЕМОЛИТИЧЕСКОЙ ЖЕЛТУХЕ ОБЩИЙ БИЛИРУБИН В ПЛАЗМЕ КРОВИ ПОВЫШАЕТСЯ ЗА СЧЕТ ФРАКЦИИ
=непрямого билирубина
-прямого билирубина
-конъюгированного билирубина
-связанного билирубина
117. ПРИ ОБТУРАЦИОННОЙ ЖЕЛТУХЕ ОБЩИЙ БИЛИРУБИН В ПЛАЗМЕ КРОВИ ПОВЫШАЕТСЯ ЗА СЧЕТ ФРАКЦИИ
=прямого билирубина
-непрямого билирубина
-не конъюгированного билирубина
-несвязанного билирубина
118. С МОЧОЙ И КАЛОМ В НОРМЕ ВЫВОДИТСЯ СЛЕДУЮЩИЙ ПРОДУКТ РАСПАДА ГЕМОГЛОБИНА
=стеркобилин
-непрямой билирубин
-мезобилиноген
-биливердин
119. ОПРЕДЕЛЕНИЕ ПОРФОБИЛИНОГЕНА В МОЧЕ ПРОВОДЯТ С ЦЕЛЬЮ ДИАГНОСТИКИ
=порфирии
-α–талассемии
-β–талассемии
-гемолитической желтухи
120. СТЕРКОБИЛИНОГЕН ОБРАЗУЕТСЯ В
=кишечнике
-гепатоцитах
-клетках РЭС
-селезенке
121. МОЧЕВАЯ КИСЛОТА ОБРАЗУЕТСЯ В РЕЗУЛЬТАТЕ
=распада пуриновых нуклеотидов
-распада пиримидиновых нуклеотидов
-синтеза пуриновых нуклеотидов
-синтеза пиримидиновых нуклеотидов
122. ПОНЯТИЮ «ГИПЕРУРИКЕМИЯ» СООТВЕТСТВУЕТ ПОВЫШЕНИЕ УРОВНЯ
=мочевой кислоты в крови
-мочевой кислоты в моче
-мочевины в крови
-мочевины в моче
123. ПОНЯТИЮ «ТРАНСКРИПЦИЯ» СООТВЕТСТВУЕТ СИНТЕЗ
=РНК на матрице ДНК
-дочерней ДНК на матрице материнской ДНК
-белка на матрице м-РНК
-ДНК на матрице РНК
124. К БЕЛКАМ ОСТРОЙ ФАЗЫ ВОСПАЛЕНИЯ ОТНОСИТСЯ
=С-реактивный белок
-альбумин
-эритропоэтин
-липопротеины высокой плотности
125. К ОНКОМАРКЕРАМ ОТНОСИТСЯ
=альфа-фетопротеин
-преальбумин
-альбумин
-гамма-глобулин
126. МАКСИМАЛЬНЫЙ ПОДЪЕМ ГЛЮКОЗЫ У ЗДОРОВОГО ЧЕЛОВЕКА ОТМЕЧАЕТСЯ ЧЕРЕЗ (____МИНУТ) ПОСЛЕ ЕДЫ
=60
-120
-190
-90
127. ЦВЕТНАЯ РЕАКЦИЯ ЯФФЕ (С ПИКРИНОВОЙ КИСЛОТОЙ В ЩЕЛОЧНОЙ СРЕДЕ) ИСПОЛЬЗУЕТСЯ ДЛЯ ОПРЕДЕЛЕНИЯ
=креатинина
-мочевины
-билирубина
-мочевой кислоты
128. К КОЛИЧЕСТВЕННЫМ МЕТОДАМ ОБРАБОТКИ ЭЛЕКТРОФОРЕГРАММ ОТНОСИТСЯ
=денситометрия
-турбидиметрия
-нефелометрия
-амперометрия
129. СА-125 ИСПОЛЬЗУЕТСЯ ДЛЯ СКРИНИНГА ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ
=яичников
-печени
-легких
-простаты
130. ПСА ИСПОЛЬЗУЕТСЯ ДЛЯ СКРИНИНГА ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ
=простаты
-поджелудочной железы
-печени
-легких
131. АЛЬФА-ФЕТОПРОТЕИН ИСПОЛЬЗУЕТСЯ ДЛЯ ДИАГНОСТИКИ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ
=печени
-яичников
-матки
-легких
132. ТАЛАССЕМИЯ ОТНОСИТСЯ К
=гемоглобинопатиям
-порфириям
-парапротеинемиям
-диспротеинемиям
133. К ПАТОЛОГИЧЕСКИМ ТИПАМ ГЕМОГЛОБИНА ОТНОСИТСЯ
=Hb S
-Hb F
-Hb E
-Hb A
134. В ПЛАЗМЕ КРОВИ ПРИСУТСТВУЮТ СЛЕДУЮЩИЕ НИЗКОМОЛЕКУЛЯРНЫЕ ЭЛЕКТРОЛИТЫ
=NaCl и NaHCO3
-глюкоза и мочевина
-креатинин и креатин
Г) мочевая кислота и лактат
135. В ПЛАЗМЕ КРОВИ ПРИСУТСТВУЮТ СЛЕДУЮЩИЕ ВЫСОКОМОЛЕКУЛЯРНЫЕ ПОЛИЭЛЕКТРОЛИТЫ
=альбумины и глобулины
-аммиак и мочевина
-аминокислоты и их амиды
-индикан и мочевая кислота
136. В ПЛАЗМЕ КРОВИ ПРИСУТСТВУЕТ СЛЕДУЮЩИЕ НИЗКОМОЛЕКУЛЯРНЫЕ НЕЭЛЕКТРОЛИТЫ
=глюкоза и мочевина
-NaCl и Са2НРО4
-Н2СО3 и NaHCO3
-альбумины и глобулины
137. НЕСАХАРНЫЙ ДИАБЕТ РАЗВИВАЕТСЯ ПРИ
=недостаточной секреции антидиуретического гормона
-избыточной секреции альдостерона
-избыточной секреции антидиуретического гормона
-недостаточной секреции альдостерона
138. К МАКРОЭЛЕМЕНТАМ ОТНОСИТСЯ А) кальций
=йод
-селен
-железо
139. К МИКРОЭЛЕМЕНТАМ ОТНОСИТСЯ
=медь
-калий
-кальций
-натрий
140. ОСНОВНЫМ ВНЕКЛЕТОЧНЫМ КАТИОНОМ ЯВЛЯЕТСЯ
=Na+
-K+
-Са2+
-Мg2+
141. ОСНОВНЫМ ВНУТРИКЛЕТОЧНЫМ КАТИОНОМ ЯВЛЯЕТСЯ
=К+
-Са2+
-Мg2+
-Na+
142. К МИКРОЭЛЕМЕНТАМ ОТНОСИТСЯ
=йод
-калий
-кальций
-натрий
143. ТРАНСПОРТНОЙ ФОРМОЙ ЖЕЛЕЗА В ПЛАЗМЕ КРОВИ ЯВЛЯЕТСЯ
=трансферрин
-альбумин
-гаптоглобин
-ферритин
144. АНЕМИЯ РАЗВИВАЕТСЯ В РЕЗУЛЬТАТЕ ДЕФИЦИТА В ОРГАНИЗМЕ
=железа
-марганца
-кальция
-фтора
145. НЕДОСТАТОЧНОСТЬ ВИТАМИНА «D» ПРИВОДИТ К НАРУШЕНИЮ ОБМЕНА
=кальция
-железа
-калия
-натрия
146. НАИБОЛЬШАЯ ЧАСТЬ ИОДА В ОРГАНИЗМЕ ЧЕЛОВЕКА НАХОДИТСЯ В СОСТАВЕ
=щитовидной железы
-костной ткани
-поджелудочной железы
-мышечной ткани
147. ЖЕЛЕЗО ЗАПАСАЕТСЯ В СОСТАВЕ
=ферритина
-трансферрина
-гемоглобина
-эритропоэтина
148. АТОМ ЖЕЛЕЗА ВХОДИТ В СОСТАВ
=гемоглобина
-церулоплазмина
-супероксиддисмутазы
-пепсина
149. АЛЬДОСТЕРОН РЕГУЛИРУЕТ
=водно-электролитный обмен
-фосфорно-кальциевый обмен
-обмен липидов
-обмен белков
150. ЗАПАСЫ ЖЕЛЕЗА В ОРГАНИЗМЕ ОЦЕНИВАЮТ, ОПРЕДЕЛЯЯ В СЫВОРОТКЕ КРОВИ СОДЕРЖАНИЕ
=ферритина
-общего железа
-общей железосвязывающей способности сыворотки (ОЖСС)
-трансферриновых рецепторов (TfR)
151. ТРАНСПОРТНЫЙ ФОНД ЖЕЛЕЗА ОЦЕНИВАЮТ НА ОСНОВЕ ОПРЕДЕЛЕНИЯ
=сывороточного железа (СЖ) и общей железосвязывающей способность сыворотки (ОЖСС)
-ферритина в сыворотке крови
-уровня трансферриновых рецепторов (TfR) в сыворотке крови
-уровня эритропоэтина в сыворотке крови
152. В НОРМЕ РН ПЛАЗМЫ АРТЕРИАЛЬНОЙ КРОВИ СОСТАВЛЯЕТ
=7,4 ± 0,04
-6,5 ± 0,05
-7,8 ± 0,03
-7,2 ± 0,05
153. РН ПЛАЗМЫ АРТЕРИАЛЬНОЙ КРОВИ НЕ СОВМЕСТИМОЕ С ЖИЗНЬЮ СОСТАВЛЯЕТ
=8,2
-7,35
-7,44
-7
154. КОНЕЧНЫМ ПРОДУКТОМ АНАЭРОБНОГО ОКИСЛЕНИЯ ГЛЮКОЗЫ В ТКАНЯХ ЧЕЛОВЕКА ЯВЛЯЕТСЯ
=молочная кислота
-ацетоуксусная кислота
-пировиноградная кислота
-уксусная кислота
155. ГИПЕРХЛОРЕМИЧЕСКИЙ МЕТАБОЛИЧЕСКИЙ АЦИДОЗ РАЗВИВАЕТСЯ В РЕЗУЛЬТАТЕ
=потери бикарбонатов через ЖКТ (диарея)
-тканевой гипоксии
-накопления в крови лактата
-накопления в крови кетоновых тел
156. В НОРМЕ АНИОННЫЙ ИНТЕРВАЛ СОСТАВЛЯЕТ
=10-18 ммоль/л
-19-22 ммоль/л
-23-25 ммоль/л
-26-35 ммоль/л
157. ПОНЯТИЮ «ГИПЕРКАПНИЯ» СООТВЕТСТВУЕТ СЛЕДУЮЩЕЕ ОПРЕДЕЛЕНИЕ
=увеличение в крови содержания углекислого газа
-уменьшение в крови содержания углекислого газа
-увеличение в крови содержания угарного газа
-увеличение в крови содержания карбоксигемоглобина
158. ПОНЯТИЮ «АЦИДОГЕНЕЗ» СООТВЕТСТВУЕТ ПРОЦЕСС
=образования и секреции Н+ в просвет почечного канальца
-образования NH4+ в просвете почечного канальца
-образования аммонийных солей в почечных канальцах
-секреции калия в почечных канальцах
159. АЦИДОЗ С ВЫСОКИМ АНИОННЫМ ИНТЕРВАЛОМ ВОЗНИКАЕТ ПРИ
=накопления в крови лактата
-потерях бикарбонатов через ЖКТ (диарея)
-уменьшении секреции кислот почками
-экзогенной кислотной нагрузке (HCl, хлорид аргинина)
160. ПО-ДРУГОМУ ПЛАЗМЕННЫЙ ФАКТОР I НАЗЫВАЕТСЯ
=фибриноген
-плазминоген
-проконвертин
-фибриназа
161. ДЛЯ ОЦЕНКИ ВНЕШНЕГО ПУТИ АКТИВАЦИИ ГЕМОСТАЗА ИСПОЛЬЗУЮТ ОПРЕДЕЛЕНИЕ
=протромбинового времени (ПВ)
-активированного частичного тромбинового времени (АЧТВ)
-длительности кровотечения (ДК)
-фибриногена
162. ДЛЯ ОЦЕНКИ ВНУТРЕННЕГО ПУТИ АКТИВАЦИИ ГЕМОСТАЗА ИСПОЛЬЗУЮТ ОПРЕДЕЛЕНИЕ
=активированного частичного тромбинового времени (АЧТВ)
-протромбинового времени (ПВ)
-длительности кровотечения (ДК)
-фибриногена
163. С ЦЕЛЬЮ МОНИТОРИНГА ГЕПАРИНОТЕРАПИИ В ПЛАЗМЕ КРОВИ ОПРЕДЕЛЯЮТ
=АПТВ (активированное парциальное тромбопластиновое время)
-ПВ (протромбиновое время)
-МНО (международное нормализованное отношение)
-ДК (длительность кровотечения)
164. С ЦЕЛЬЮ МОНИТОРИНГА ТЕРАПИИ НЕПРЯМЫМИ АНТИКОАГУЛЯНТАМИ ИСПОЛЬЗУЮТ ЗНАЧЕНИЕ
=МНО (международное нормализованное отношение)
-АПТВ (активированное парциальное тромбопластиновое время)
-фибриногена
-ДК (длительность кровотечения)
165. К АНТИКОАГУЛЯНТАМ НЕПРЯМОГО ДЕЙСТВИЯ ОТНОСИТСЯ
=варфарин
-гепарин
-антитромбин
-протеин С
166. ОПРЕДЕЛЕНИЕ D-ДИМЕРА ИСПОЛЬЗУЕТСЯ С ЦЕЛЬЮ
=исключения тромбоза любой локализации
-оценки внешнего пути активации коагуляции
-оценки внутреннего пути активации коагуляции
-выявления наследственных аномалий факторов плазмокоагуляции
167. КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ УРОВНЯ D-ДИМЕРА В ПЛАЗМЕ КРОВИ ПРОВОДЯТ С ПОМОЩЬЮ МЕТОДА
=фотоколориметрии
-иммунотурбидиметрии
-нефелометрии
-электроамперометрии
168. РЕФЕРЕНТНЫЕ ВЕЛИЧИНЫ СОДЕРЖАНИЯ D-ДИМЕРА В ПЛАЗМЕ КРОВИ МЕНЕЕ
=0,5 мкг/мл (FEU)
-1,0 мкг/мл (FEU)
-2,25 мкг/мл (FEU)
-5,15 мкг/мл (FEU)
169. К КАРДИОМАРКЕРАМ ОТНОСИТСЯ
=тропонин Т
-альфа-амилаза
-липаза
-альдолаза
170. ДЛЯ ДИАГНОСТИКИ ИНФАРКТА МИОКАРДА ИСПОЛЬЗУЮТ СЛЕДУЮЩИЙ НАБОР БИОХИМИЧЕСКИХ ТЕСТОВ
=тропонин-Т, миоглобин, МВ-КК
-альфа-амилаза, липаза, СРБ, АЛТ
-АЛТ, АСТ, ЩФ, билирубин, общий белок, альбумин
-ОХС, ХС-ЛПВП, ХС-ЛПНП, ИА 58
171. ЛИПИДНЫЙ ПРОФИЛЬ ВКЛЮЧАЕТ СЛЕДУЮЩИЙ НАБОР БИОХИМИЧЕСКИХ ТЕСТОВ
=ОХС, ХС-ЛПВП, ХС-ЛПНП, ИА
-АЛТ, АСТ, ЩФ, билирубин, общий белок, альбумин
-альфа-амилаза, липаза, СРБ, АЛТ
-тропонин-Т, миоглобин, МВ-КК
172. ПЕЧЕНОЧНАЯ ПАНЕЛЬ ВКЛЮЧАЕТ СЛЕДУЮЩИЙ НАБОР БИОХИМИЧЕСКИХ ТЕСТОВ
=АЛТ, АСТ, ЩФ, билирубин, общий белок, альбумин
-ОХС, ХС-ЛПВП, ХС-ЛПНП, ИА
-тропонин-Т, миоглобин, МВ-КК
-альфа-амилаза, липаза, СРБ, АЛТ
173. ПРИНЦИП МЕТОДА ФОТОКОЛОРИМЕТРИИ ЗАКЛЮЧАЕТСЯ В
=определении оптической плотности окрашенного раствора
-оценке светопоглощения мутного раствора
-оценке рассеивания дисперсной системы
-различиях сорбируемости компонентов смеси
174. ПРИНЦИП МЕТОДА НЕФЕЛОМЕТРИИ ЗАКЛЮЧАЕТСЯ В
=оценке рассеивания дисперсной системы
-оценке светопоглощения мутного раствора
-использовании антитела, меченного изотопом
-различиях сорбируемости компонентов смеси
175. ПРИНЦИП МЕТОДА ТУРБИДИМЕТРИИ ЗАКЛЮЧАЕТСЯ В
=оценке светопоглощения мутного раствора
-оценке рассеивания дисперсной системы
-использовании антитела, меченного изотопом
-различиях сорбируемости компонентов смеси
176. ПРИНЦИП МЕТОДА ЭЛЕКТРОФОРЕЗА ЗАКЛЮЧАЕТСЯ В
=различиях скорости миграции частиц под действием электрического тока
-различиях сорбируемости компонентов смеси
-использовании антитела, меченного изотопом
-оценки светопоглощения мутного раствора
177. ПРИНЦИП МЕТОДА РАДИОИММУННОГО АНАЛИЗА ЗАКЛЮЧАЕТСЯ В
=использовании антитела, меченного изотопом
-миграции частиц под действием электрического тока
-различиях сорбируемости компонентов смеси
-оценки светопоглощения окрашенного раствора
178. ПРИНЦИП ТЕХНОЛОГИИ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ (ПЦР) ЗАКЛЮЧАЕТСЯ В
=увеличение концентрации фрагментов НК
-использовании антитела, меченного изотопом
-миграции частиц под действием электрического тока
-различиях сорбируемости компонентов смеси
179. ПРИНЦИП МЕТОДА ХРОМАТОГРАФИИ ЗАКЛЮЧАЕТСЯ В
=различиях сорбируемости компонентов смеси
-использовании антитела, меченного изотопом
-миграции частиц под действием электрического тока
-оценки светопоглощения окрашенного раствора
180. ПРИНЦИП МЕТОДА ИММУНОФЕРМЕНТНОГО АНАЛИЗА (ИФА) ЗАКЛЮЧАЕТСЯ В
=во взаимодействии антитела и антигена
-увеличение концентрации фрагментов ДНК
-использовании антитела, меченного изотопом
-миграции частиц под действием электрического тока
181. ЭФИР АКРИДИНА ИСПОЛЬЗУЕТСЯ В КАЧЕСТВЕ МЕТКИ В МЕТОДЕ
=ИХЛА
-РИА
-ИФА
-ПЦР
182. ПЕРОКСИДАЗА ИСПОЛЬЗУЕТСЯ В КАЧЕСТВЕ МЕТКИ В МЕТОДЕ
=ИФА
-РИА
-ИХЛА
-ПЦР
183. АЗИД НАТРИЯ В ОБЛАСТИ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ ИСПОЛЬЗУЕТСЯ В КАЧЕСТВЕ
=консерванта
-антикоагулянта
-эмульгатора
-хромогена
184. В СОСТАВ БАЗОВОЙ БИОХИМИЧЕСКОЙ ПАНЕЛИ ВХОДЯТ СЛЕДУЮЩИЕ БИОХИМИЧЕСКИЕ ПОКАЗАТЕЛИ
=АЛТ, АСТ, общий белок, креатинин, мочевина, глюкоза, холестерин общий, билирубин общий, железо
-общий белок, белковые фракции, С-реактивный белок, ревматоидный фактор
-фосфор неорганический, витамин D, паратиреоидный гормон, кальцитонин, остеокальцин, кальций ионизированный
-железо, ОЖСС, трансферрин, ферритин, витамин В12, фолаты, эритропоэтин
185. БИОХИМИЧЕСКУЮ ДИАГНОСТИКУ АНЕМИЙ ПРОВОДЯТ С ПОМОЩЬЮ СЛЕДУЮЩИХ ТЕСТОВ
= железо, ОЖСС, трансферрин, ферритин, витамин В12, фолаты, эритропоэтин
-ПВ (МНО), фибриноген, креатинкиназа-МВ, тропонин I, холестерин общий, холестерин-ЛПНП, СРБ
-глюкоза, HbА1с, инсулин, С-пептид, антитела к инсулину, антитела к бета-клеткам поджелудочной железы
-АЛТ, АСТ, щелочная фосфатаза, ГГТ, билирубин общий, билирубин прямой
186. ДИАГНОСТИКУ ПАТОЛОГИИ СОЕДИНИТЕЛЬНОЙ ТКАНИ ПРОВОДЯТ С ИСПОЛЬЗОВАНИЕМ СЛЕДУЮЩИХ БИОХИМИЧЕСКИХ ТЕСТОВ
=общий белок, белковые фракции, СРБ, РФ, антистрептолизин-0
-железо, ОЖСС, трансферрин, ферритин, витамин В 12, эритропоэтин
-холестерин общий, холестерин ЛПВП, холестерин-ЛПНП
-АЛТ, АСТ, щелочная фосфатаза, гамма-ГТ, альфа-амилаза
187. ДЛЯ ДИАГНОСТИКИ ОСТЕОПОРОЗА ИСПОЛЬЗУЮТ СЛЕДУЮЩИЕ БИОХИМИЧЕСКИЕ ТЕСТЫ
=фосфор неорганический, витамин D, паратиреоидный гормон, кальцитонин, остеокальцин, кальций ионизированный
-холестерин общий, холестерин-ЛПНП, СРБ, гомоцистеин, натрий, калий, хлор
-холестерин общий, ХС-ЛПВП, ХС-ЛПНП, триглицериды, коэффициент атерогенности
-АЛТ, АСТ, щелочная фосфатаза, гамма-ГТ, общий белок, белковые фракции
188. ДЛЯ ПОЧЕЧНОЙ НЕДОСТАТОЧНОСТИ ХАРАКТЕРНО СЛЕДУЮЩЕЕ СОЧЕТАНИЕ БИОХИМИЧЕСКИХ ПОКАЗАТЕЛЕЙ ПЛАЗМЫ КРОВИ
=повышение концентрации мочевины и креатинина
-снижение концентрации мочевины и креатинина
-повышение коллоидно-осмотического давления
-повышение скорости клубочковой фильтрации
189. ДЛЯ ДИАГНОСТИКИ ОСТРОГО ПАНКРЕАТИТА ИСПОЛЬЗУЮТ СЛЕДУЮЩИЕ БИОХИМИЧЕСКИЕ ТЕСТЫ
=активность альфа-амилазы и липазы
-активность креатинкиназы и уровня миоглобина
-концентрация мочевины и креатинина
-концентрация глюкозы и мочевины
190. ДЛЯ ДИАГНОСТИКИ ОСТРОГО ВИРУСНОГО ГЕПАТИТА ИСПОЛЬЗУЮТ СЛЕДУЮЩИЕ БИОХИМИЧЕСКИЕ ТЕСТЫ
=активность АЛТ, АСТ, концентрация общего билирубина
-активность альфа-амилазы и активность липазы
— активность общей креатинкиназы и уровень тропонинов
-активность щелочной фосфатазы и уровень общего кальция
Лабораторная практика традиционно делится на три этапа: преаналитический, аналитический и постаналитический.
Преаналитическая фаза включает в себя правильный отбор образцов, предоставление информации о пациенте, сбор и маркировку образцов, обработку образцов, сортировку, титрование и центрифугирование. Любой из этих шагов может быть пропущен, что приведет к неточным результатам, которые приписываются преаналитической фазе.
Преаналитические ошибки при исследовани общего анализа крови чаще всего вызваны неверным пониманием запроса на анализ, неправильной маркировкой, контаминацией места отбора, гемолизом, сгустками, недостаточным количеством образцов, проблемами хранения и несоответствующей пропорцией крови к антикоагулянту или неправильным выбором антикоагулянта.
Общая частота неточностей в лабораторных работах, согласно G. Lippi et.al. (2010), варьируется от 0,1% до 3,0%. Считается, что преаналитические ошибки составляют от 46% до 68,2% ошибочных диагнозов, в то время как аналитические ошибки, которые были в центре внимания более ранних исследований, составляют лишь около 10% всех ошибочных диагнозов (Hammerling J., 2013). Кроме того, преаналитические ошибки составляют от 18,5% до 47% всех лабораторных ошибок.
Наиболее распространенными преаналитическими ошибками являются отсутствие медицинской информации, неподходящие контейнеры и потерянные образцы.
Несмотря на то, что существуют международные стандарты отбора проб крови и стандартизации процесса тестирования, соблюдение руководящих принципов здесь крайне низкое, особенно тогда, когда лабораторный персонал не привлекается, а медсестры или врачи выполняют забор крови, частота преаналитических ошибок становится очень высокой.
Кроме того, критерии отбраковки образцов различаются в разных лабораториях. Не хватает профессиональных данных по отчетности, анализу первопричин и стратегиям предотвращения лабораторных ошибок (Lima-Oliveira G, et.al., 2012).
Наиболее распространенной преаналитической ошибкой являются изменения условий хранения из-за задержки при транспортировке, на которые приходится 19,45%, за которыми следуют пробы, забракованные из-за неверных медицинских записей- 19,16%. Общее количество забракованных разбавленных проб составляет 16,35%, а количество забракованных проб из-за неправильных пробирок составляет 16,01%). Отклоняется гемолизированных образцов — 15,13%. Немеченые образцы отклоняются в количестве 10,01%, а образцы со сгустками составляют 3,88% от общего числа забракованных образцов (Toor N., et. al., 2023)
Низкая удовлетворенность пациентов напрямую связана с лабораторными ошибками и высокими затратами как для пациентов, так и для системы лабораторных услуг.
Негативное влияние лабораторных ошибок на лечение пациентов не ограничивается тем фактом, что они увеличивают время обработки, требуют дополнительных заборов крови и приводят к неточным диагнозам и неподходящим лекарствам; они также наносят ущерб репутации лаборатории и подрывают доверие пациентов к диагностическим услугам. Было подсчитано, что лабораторная ошибка оказывает негативное влияние на результаты лечения пациентов до 24,4% (Lippi G., et.al., 2006).
Этот процесс приводит к увеличению финансовой нагрузки на систему здравоохранения. Согласно исследованию S. Green (2013), расходы на преаналитические ошибки составляют от 0,23% до 1,2% всего операционного бюджета больниц.
Сбор крови
Количество и концентрация дикалийэтилендиаминтетрауксусной кислоты (EDTA) в пробирке для сбора крови требуют, чтобы кровь собиралась до определенной отметки на пробирке. Если собрано слишком мало крови, разбавление образца может привести и к изменению параметров. Относительный избыток EDTA в таких случаях также влияет на морфологию клеток крови.
Транспортировка крови
Транспортировка образца должна исключать высокую температуру. Фрагментация эритроцитов при этом является признаком избыточного тепла. Ложно высокое количество лейкоцитов (WBC) при высокой температуре встречается чаще, чем ложно низкое. Известно, что в определенных ситуациях гематологические анализаторы обеспечивают ложное PLT, когда истинное количество тромбоцитов является адекватным.
Физиологические и физические факторы, влияющие на показатели общего анализа крови
Несколько физиологических и физических факторов могут повлиять на результаты CBC и затруднить установление референтных значений. Физиологические факторы включают возраст, этническую принадлежность, пол, сезон, время суток, питание, болезни, стресс, травмы др.
К важным физическим факторам относятся место забора крови, наличие и тип антикоагулянта, а также обработка и подготовка образцов (Dyer D.Cervasio S.,2008). Любая интерпретация результатов должна учитывать эти факторы.
Преаналитические ошибки результатов общего анализа крови
Потеря образца
Отсутствие полноценного запроса на анализ
Неправильная маркировка (19,16% преаналитических ошибок)
Сбор крови
Контаминация места, в котором производится забор крови
Недостаточное количество образца крови
Неправильный выбор антикоагулянта, относительный избыток или дефицит EDTA (16,45% преаналитических ошибок)
Неправильные пробирки (16,01%)
Гемолиз in vitro (15,13% преаналитических ошибок)
Наличие сгустков крови (3,88% преаналитических ошибок)
Транспортировка
Задержка транспортировки (19, 45% преаналитических ошибок)
Неподходящие контейнеры
Высокая температура окружающей среды при транспортировке
<RBC (фрагментация эритроцитов)
WBC >
Неправильное хранение
Высокая температура окружающей среды при хранении
<RBC (фрагментация эритроцитов)
WBC >
Первоначальное замораживание с последующим охлаждением
Нарушение срока хранения образца крови при определенной температуре
Хранение крови
Отложенный анализ проб по организационным, техническим причинам или проверке сомнительных результатов, которые необходимо уточнить — не редкость в клинической практике. Кроме того, реорганизация лабораторных служб по всему миру влечет за собой объединение небольших лабораторий в более крупные, что особенно важно в эпоху новых инициатив в области общественного здравоохранения. Большое количество образцов отправляется из периферийных центров в централизованную лабораторию на большие расстояния, тем самым происходит задержка на 12-24 часа или даже более. Более того, в выходные дни этот интервал может превышать 36 часов. Это важно уситывать в связи с тем, что CBC является наиболее часто проводимым лабораторным тестом, дающим основную и ценную информацию не только для облегчения диагностики и направления дальнейшего тестирования, но и для мониторинга состояния пациента, включая оценку эффективности терапии.
В большинстве случаев мы не можем сразу провести анализ, поэтому информацией о том, как долго мы можем хранить образцы для получения надежных результатов, должны владеть как сотрудники лаборатории, так и врачи.
В литературе большинства производителей автоматических анализаторов часто упоминается, что образцы крови, хранящиеся либо при комнатной температуре, либо при 4 ± 2°C (в холодильнике) до 24 часов, как правило, дают надежные результаты для общего анализа крови и автоматизированного дифференциального подсчета лейкоцитов. Однако, хранение при комнатной температуре может вызвать изменения этилендиаминтетраацетата (EDTA) и количественное влияние хранения на кровь, поскольку известно, что клеточные элементы обладают ограниченной стабильностью в EDTA. В то же время, было отмечено, что хранение в холодильнике крови с антикоагулянтом EDTA улучшает стабильность общего анализа крови (Gulati G., et.al., 2002).
В соответствии с рекомендациями Международного комитета по гематологической стандартизации, максимальные интервалы хранения для общего и лейкоцитарного подсчета с автоматическим дифференциальным подсчетом стабильны при 4°C в течение как минимум 24 ч или даже до 72 ч, при этом существенные различия зависят от типа автоматизированного анализатора клеток крови.
Для CBC образцы можно надежно хранить в течение 24 часов. Для более длительного хранения лучшим выбором будет охлаждение (при 4 °C). Интересно, что в некоторые моменты времени (1, 2 и 4 часа) PLT немного ниже. Хранение при 4 °C показало гораздо большую стабильность. За исключением 8 часов, до 3 дней статистических изменений не было. Преимущества холодильной камеры (4 ° C) очевидны для длительного хранения. Стоит отметить, что хранение образцов более 12 часов для метаболической панели может привести к ненадежным результатам. Разные авторы сообщают, что некоторые анализы крови стабильны до 72 часов после сбора, если хранить их при 4 ° C в холодильнике.
Повреждение эритроцитов при хранении тесно связано с их внутренним энергетическим метаболизмом. Поскольку в эритроцитах нет митохондрий, полностью зависящих от гликолиза для получения энергии, молочная кислота, образующаяся в процессе гликолиза, будет снижать внутреннее значение рН клеток, тем самым снижая уровень метаболизма клеток и уменьшая производство АТP, что приводит к снижению уровня фосфорилирования фосфопротеинов и утрате деформируемости клеточной мембраны. Снижение уровня АТP в свою очередь уменьшает синтез 2,3-дифосфоглицериновой кислоты, а уменьшение значения рН и концентрации 2-магне3-дифосфоглицериновой кислоты сдвигает кривую кислородной диссоциации гемоглобина влево. АТP также является агонистом NO-синтазы. NO и гемоглобин в эритроцитах объединяются с образованием SNOHb и Hb(Fe~II) NO, которые участвуют в транспорте и метаболизме NO. Уменьшение АТP также влияет на ионный насос на клеточной мембране, что приводит к увеличению уровня К + в депонированной крови (Li L., et.al., 2022).
Некоторые параметры, связанные с эритроцитами, такие как RBC, HB и MCHC менее стабильны при хранении при 4 °C, на что может повлиять первоначальное замораживание с последующим охлаждением (Lombardi G., et al., 2011). RDW значительно увеличивается после 24-часового хранения при комнатной температуре. Возможной причиной этого изменения может быть повышенный MCV (de Baca M., et.al., 2006).
По данным D. Gunawardena et.al. (2017) среди параметров CBC лейкоциты (WBC), эритроциты (RBC), HB, MCH, нейтрофилы и лимфоциты стабильны при всех температурах (4 ± 2°С, 23 ± 2°С и 31 ± 2°С.) до 48 часов. Моноциты, эозинофилы, MCH, HCT и SV-RDW показали статистически значимые изменения при 23 ± 2°C и 31 ± 2°C. Значительное снижение количества тромбоцитов (PLT) и увеличение MPV и количества базофилов наблюдались при всех исследуемых температурах вплоть до 48 часов.
Увеличение MPV наблюдается при всех температурах, причем этот показатель не считается очень стабильным для образцов крови, хранящихся в течение длительного времени. Его значения изменяются в первый период времени (1 час) и не имеют различий для температуры хранения (Wu D-W., et.al., 2017). Четыре дня при 4 °C изменяют морфологию, движение и агрегацию тромбоцитов (Mahmoodi M., et al., 2006). MPV может иметь отношение к изменениям формы тромбоцитов, связанным со временем и формой, от дисковидной до сферической и набухания. Возможно, что тробмоциты, которые показывают повышение MPV, не будут подсчитаны машиной как тромбоциты, а будут помечены отдельно, что приведет к снижению PLT. Это говорит о том, что лучше всего оценивать PLT в течение 6 часов после забора крови.
Во всех случаях результаты CBC обычно более стабильны, чем различные биохимические, например, метаболические панели и предоставляют надежные результаты даже через 24 часов хранения.
Эритроциты, хранящиеся с добавлением прогестерона, имеют более высокие уровни АТP, меньший спонтанный лизис, более высокую осмотическую резистентность и более высокое поглощение метиленового синего в течение времени хранения, чем клетки, хранение которых происходит без добавления прогестерона. Этот гормон, по-видимому, находится в устойчивом равновесии между плазмой и эритроцитами в течении 42 дней хранения, и его количество в плазме почти вдвое больше, чем в клетках. После повторных промываний солевым раствором около 10% прогестерона остается прикрепленным к эритроцитам. Специфическая связь прогестерона с популяциями эритроцитов различной плотности показывает, что высокая удельная активность достигается в популяциях клеток низкой плотности (молодые клетки) в течение всего времени хранения (DeVenuto F., S M Wilson S.,1976).
.
Трансфузиология
Во время хранения компонентов крови ex vivo биореактивные вещества, накопленные в среде хранения и вызвавшие изменения в эритроцитах, предоставили постоянные доказательства непрерывных изменений, приводящих к дисфункции эритроцитов и способны оказывать неблагоприятное воздействие на переливаемого хозяина (Gacko M., et.al., 2004). Удаление лейкоцитов и тромбоцитов как источника свободных радикалов в компонентах эритроцитов влияет на защиту оксидоредуктивного баланса в компонентах эритроцитов во время хранения.
Лейкоредуцирование или лейко-истощение относится к снижению количества лейкоцитов менее чем 5 × 10 6 остаточных донорских лейкоцитов в конечном продукте крови при сохранении 85% жизнеспособного исходного RBC. Наличие лейкоцитов в компонентах крови является причиной нескольких осложнений.
Лейкоредуцирование предотвращает фебрильные реакции, накопление цитокинов / хемокинов, избегая фебрильной негемолитической реакции трансфузии (FNHTR), уменьшая передачу цитомегаловируса и невосприимчивость к переливанию тромбоцитов (в концентратах тромбоцитов).
Несмотря на использование аддитивных растворов, изменения морфологии и метаболизма эритроцитов ожидаются при хранении пакетов с кровью с лейко-редукцией и без нее. Хранение эритроцитов вызывает некоторые сложные структурные и биохимические изменения, которые называются поражением хранения эритроцитов (RCSL)
Биохимические изменения включают снижение активности фермента глюкозо-6-фосфатдегидрогеназы (G6PD) в качестве антиоксидантного фермента, увеличение везикуляции эритроцитов, потеря мембран эритроцитов, лизис мембран эритроцитов, снижение уровня 2,3-дифосфоглицерата (2,3- DPG), аденозинтрифосфат (АТФ) и снижение уровня глутатионредуктазы (GSH). Эти процессы сопровождаются снижением рН, увеличением активности фермента ЛДГ и концентрацией лактата.
Эти изменения приводят к снижению функции и выживаемости эритроцитов после переливания. G6PD является важным ферментом в метаболизме эритроцитов и ключевым ферментом окислительного пентозофосфатного пути (PPP). В PPP никотинамид-аденин-динуклеотид-фосфат (NADP) превращается в его восстановленную форму, NADPH, которая необходима для GSH-опосредованной защиты от окислительного стресса поддерживая целостность эритроцитов.
Также наблюдаются некоторые биохимические изменения концентратов эритроцитов при анаэробном гликолизе. В частности, наблюдается увеличение уровней калия (K +) и лактата и одновременное снижение уровней pH, глюкозы и натрия (Na +). Время хранения не влияет на уровни кальция (Ca ++) в концентратах RBC.
Активность ферментов лактатдегидрогеназы и К + в эритроцитах значительно выше (в 20-160 раз), чем в плазме, и можно ожидать, что гемолиз приведет к увеличению этих аналитов.
Cтатистически значимое увеличение активности лактат дегидрогеназы было показано в течение периода хранения в нефильтрованных эритроцитах. Активность фермента LDH в нефильтрованном эритроците по сравнению с LR-RBC увеличилась с 14-го дня хранения и была статистически признана значимой. Такие показатели, как MCV, MCH и MCHC, меньше всего влияли на хранение. Другие авторы обнаружили, что MCV увеличился, а MCHC значительно снизился в течение периода хранения, которые оценивались каждую неделю. (Grezelbash B., et.al., 2018).
J. Latham et al. (1982) наблюдали увеличение концентрации не только лактата, лактатдегидрогеназы, но и гемоглобина во время хранения. Консистенция свободного Hb и скорость гемолиза также были выше в нефильтрованном RBC по сравнению с LR-RBC во время хранения. Эти наблюдения указывают на возможное вовлечение лейкоцитов в большее повреждение эритроцитарной мембраны и благоприятное влияние лейкоредуцирования на качество сохраняемых единиц эритроцитов. Эти различия могут быть связаны с биологически активными веществами, такими как цитокины и гистамин, которые высвобождаются из лейкоцитов во время хранения, что оказывает непосредственное воздействие на мембрану эритроцитов и приводит к некоторым структурным и биохимическим изменениям.
Согласно предложению Castro O., et.al. (2003), общая концентрация гемоглобина, лактатдегидрогеназа и концентрация лактата являются маркерами гемолиза.
Sonker А. et.al. (2014) также сообщили, что лейко-фильтрованный RBC показывает меньшее повышение K +, LDH и гемолиза к концу периода хранения по сравнению с их нефильтрованными единицами. Присутствие лейкоцитов может быть причиной усиленного окислительного стресса. Эти авторы отметили, что активность ферментов LDH, гемолиз и повреждение клеточных мембран (калий, LDH, свободный гемоглобин) усиливаются в компонентах крови с высоким содержанием лимфоцитов.
Дельта – проверки
Преаналитические ошибки, которые могут повлиять на результаты CBC, включают смешивание образцов, неправильное получение образца и нарушение целостности образца между моментом, когда образец был получен и когда он был доставлен в лаборатории.
Дельта-проверки — процесс маркировки различий в конкретных аналитах между последовательными анализами, являются одним из способов выявления таких проблем. Такие проверки эффективны при обнаружении некоторых вариантов преаналитических ошибок.
Среди обычно оцениваемых показателей CBC средний объем клеток, или MCV, и средняя концентрация клеточного гемоглобина, или MCHC, пригодны для дельта -проверок лучше всего. И тот, и другой показатель чрезвычайно стабильны в течении короткого срока — 24 часа. Например, суточный биологический коэффициент вариации MCV у здоровых людей составляет всего 0,5%. Даже в ситуациях быстрого изменения других параметров эритроцитов, таких как острое кровоизлияние, MCV и MCHC не будут значительно изменяться в течение суток, поскольку ответ ретикулоцитов на острую кровопотерю не начинается в течение первых двух-трех дней. За исключением переливания эритроцитов и редко острого внутрисосудистого гемолиза, нет неотложных ситуаций в состоянии пациента, которые бы значительно изменили эти показатели в краткосрочной перспективе. В случае острого гемолиза с гемоглобинемией, MCHC может быть изменен, в отличие от MCV, который будет оставаться стабильным.
Из других проблем, связанных с анализом образца, гемолиз образца также поддается обнаружению с помощью дельта-проверок на основе MCHC. В этом сценарии RBC уменьшается, без изменений в HB и MCV, что приводит к увеличению MCHC.
Загрязнение образцов внутривенной жидкостью и изменения количества клеток из-за свертывания образцов теоретически могут быть обнаружены дельта-проверками HB и HCT, а также изменениями значений RBC, WBC и PLT. Однако нецелесообразно использовать дельта-проверки любого из этих показателей для обнаружения такого образца, поскольку быстрые изменения любого из них являются обычными у госпитализированных пациентов, причем, частота ложноположительных результатов будет здесь неприемлемо высокой. Тем не менее, внутривенное загрязнение приводит к пропорциональному снижению всех этих показателей.
Следует также отметить, что выполнение дельта-проверок на MCHC имеет дополнительное преимущество для обнаружения неисправности анализатора, поскольку MCHC рассчитывается на основе трех параметров эритроцитов RBC, HB и MCV, которые измеряются непосредственно на большинстве гематологических анализаторов. Следовательно, проблемы в любом из этих измерений будут влиять на MCHC. Выбор пределов достоверности для дельта-проверок зависит от ряда факторов, в том числе от желаемого баланса чувствительности и специфичности и оцениваемой популяции пациентов. Статистический подход к дельта-проверкам может быть достигнут путем получения пар точек данных пациентов из репрезентативной популяции. Пределы, охватывающие желаемую долю населения (например, 95% или 99%), могут быть легко выбраны (Savage R., 2006).
Температура хранения
Гемоглобин, количество эритроцитов, количество лейкоцитов, средний корпускулярный гемоглобин остаются стабильными в течение по меньшей мере 24 часов при температуре 33 ° C. Гематокрит, средний корпускулярный объем и количество тромбоцитов стабильны в течение менее четырех часов при 33 ° C. Все вышеперечисленные параметры стабильны при 22 ° С и 4 ° С. Дифференциальная оценка HCT, MCV, PLT показала нестабильность в течение четырех часов при температуре 33 ° C.
Некоторые параметры, связанные с эритроцитами, такие как RBC, HB и MCHC, менее стабильны при хранении при 4 ° C, поскольку на них может повлиять первоначальное замораживание с последующим охлаждением Изменение HCT и MCHC, несомненно, является следствием изменения MCV, поскольку эти параметры частично получены из последнего показателя.
Гемолиз in vitro
Термин «гемолиз» происходит от латинского слова hemo (кровь) и лизиса (взломать) и означает разрушение клеток крови. Лаборанты обычно ограничивают значение понятия «гемолиз» эритроцитами (процесс, называемый эритролизом), которые составляют наибольший процент эритроцитов крови и игнорируют состояние других клеток крови. В связи с этим подходом методы оценки гемолиза зависят «исключительно» от измеренного количества свободного гемоглобина (fHB), выделившегося из разрушенных эритроцитов. Напротив, небольшое количество авторов описывают «гемолиз» как разрушение всех типов клеток крови, а именно панцитолиз и заявляют, что лейкоциты и тромбоциты также могут поддвергаться гемолизу. Стоит отметить, что лейкоциты могут способствовать повышению уровня калия в состоянии лизиса.
Гемолиз может происходить in vivo, при патологических состояниях или in vitro в связи с преаналитическими ошибками.
Гемолиз in vitro в преаналитической фазе является основной проблемой, с которой сталкиваются клинические лаборатории. Определяемый как разрыв мембраны эритроцита с экстравазацией гемоглобина и других внутриклеточных компонентов в окружающую плазму, гемолиз можно обнаружить визуально во время лабораторной оценки из-за изменения окраски плазмы от розового до красного после центрифугирования образца.
Гемолиз in vitro обычно возникает в результате неадекватного забора крови, включая такие факторы, как использование игл малого диаметра, попадание остатков спирта с кожи в образец, трудности с поиском венозного доступа, маленькие и хрупкие вены, которые легко травмируются, и попытки неудовлетворительной пункции. Кроме того, неправильное обращение с образцами, такое как недостаточное заполнение пробирки для сбора, приводящее к избытку антикоагулянта, сильное встряхивание образца, воздействие чрезмерно высоких или низких температур и центрифугирование на очень высокой скорости в течение длительного периода времени, также являются факторами, которые могут нарушить структурная целостность клеток крови (Lippi G., et.al., 2008).
Факторы, способствующие гемолизу in vitro вследствие неадекватного забора крови
Использование игл малого размера
Попадание остатков спирта с кожи в образец
Трудности с поиском венозного доступа
Маленькие и хрупкие вены, которые легко травмируются
Неоднократные попытки плохой пункции
Было показано, что с течением времени количество эритроцитов значительно снижается из-за гемолиза. Повышенная проницаемость клеток будет определяться увеличением MCV — индекса, отражающего набухание эритроцитов. Изменение HCT и MCHC явно является следствием изменения MCV, поскольку эти параметры частично получены из MCV (Buoro S., et al., 2016).
В работе G. de Longe et.al. (2018) образцы с высокой степенью гемолиза превышали спецификации качества для желаемой систематической ошибки, демонстрируя снижение эритроцитов (4,7%), гематокрита (6,6%), MCV (0,6%) и увеличение параметров: RDW (1,3%), MCH (1,5%), MCHC (2,5%) и количество тромбоцитов (36,7%). В то время как образцы с легкой степенью гемолиза имели умеренное увеличение MCH (0,6%), MCHC (0,7%) и количества тромбоцитов (1,4%). Авторами было замечено, что RCB имел погрешность -6,4% (от -22,8% до 10,0%), а HCT — погрешность -8,3% (от -25,7% до 9,2%), превышающую допустимые нормы ±1,7% для проб с высокой степенью гемолиза. Так, эти показатели могут быть занижены до 22,8% для эритроцитов и до 25,7% для HCT или завышены до 10,0% и 9,2% соответственно.
Стоит отметить, что принцип измерения MCV сильно различается в зависимости от используемого гематологического анализатора. с помощью метода импеданса образцы с высокой степенью гемолиза могут демонстрировать умеренное изменение MCV (увеличение на 0,6%) с последующим увеличением RDW на 1,3%, что представляет собой широкий разброс примерно в 12%, оценивая пределы согласия и их доверительные интервалы.
Гемолиз образца крови, взятого для CBC
Высокая степень гемолиза
Снижение RBC (4,7%), HCT (6,6%), MCV (0,6%)
Увеличение RDW (1,3%), MCH (1,5%), MCHC (2,5%)
Отсутствии изменений HB
Увеличение PLT (36,7%)
Низкая степень гемолиза
Увеличение MCH (0,6%), MCHC (0,7%), PLT (1,4%)
Сравнение образцов с разной степенью гемолиза показало снижение количества эритроцитов и гематокрита и увеличение средней концентрации корпускулярного гемоглобина и количества тромбоцитов в образцах с высокой степенью гемолиза. Согласно принятой клинической точке зрения, образцы с высокой степенью гемолиза превышают желаемую погрешность, демонстрируя снижение RBC, HCT и MCV, а также увеличение RDW, MCH, MCHC, PLT. Однако образцы с легкой степенью гемолиза показали лишь незначительное увеличение среднего корпускулярного гемоглобина, средней концентрации корпускулярного гемоглобина и количества тромбоцитов. (de Jonge G., et.al.,2018).
Выяснение интерференционных механизмов гемолиза необходимо для более точного решения проблемы гемолиза in vitro. Гемолизированные образцы влияют на результаты испытаний по нескольким механизмам, таким как: композиционные помехи (из-за разницы между внутриклеточной и внеклеточной концентрацией аналитов), помехи сигнала в инструментальных измерениях и химической помехи в аналитических реакциях. Эти интерференционные механизмы могут сосуществовать в различных сочетаниях. Отказ от результатов анализа гемолизированных образцов может привести к задержке в диагностике, что угрожает безопасности пациента, а запрос дополнительного образца увеличивает рабочую нагрузку лаборанта и стоимость исследования.
Вполне возможно, что клеточный дебрис и строма, образующиеся в результате распада эритроцитов, могут вызывать существенные аналитические помехи в подсчете тромбоцитов