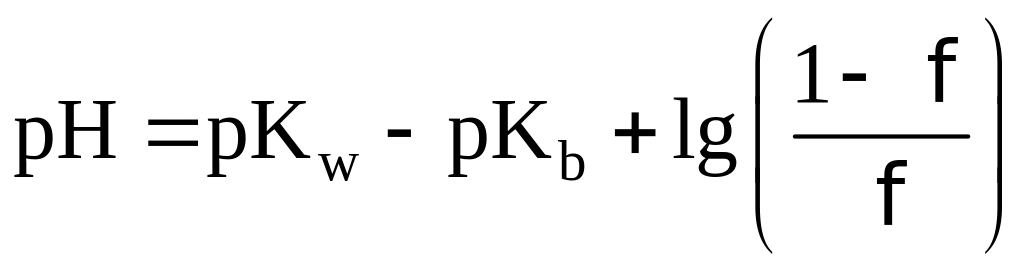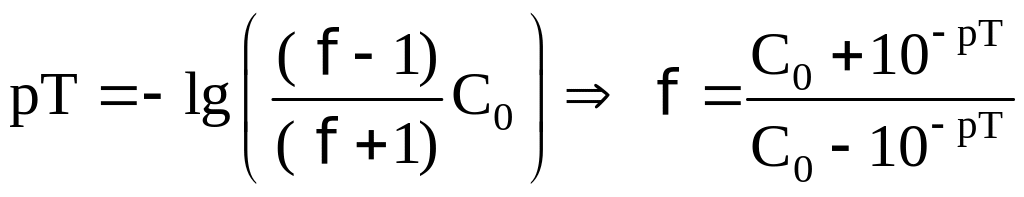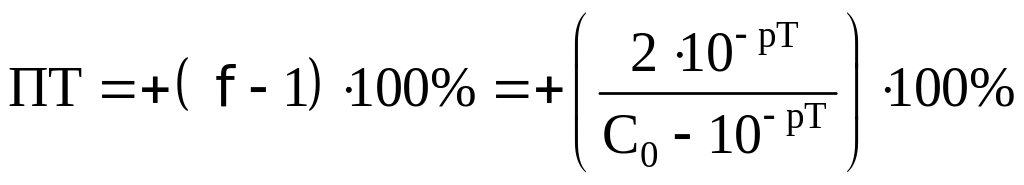Индикаторные погрешности титрования
При титровании возможны случайные и
систематические погрешности. Случайные
погрешности связаны с измерением объема
и массы навески, но и значительную часть
погрешности титрования составляют
систематические погрешности, в частности,
индикаторная.
Случайные погрешности обрабатываются
по законам математической статистики.
Индикаторные погрешности связаны с
тем, что pT индикатора не
совпадает со значением pH
в ТЭ. Конечная точка титрования с данным
индикатором не совпадает с ТЭ.
При недотитровывании:
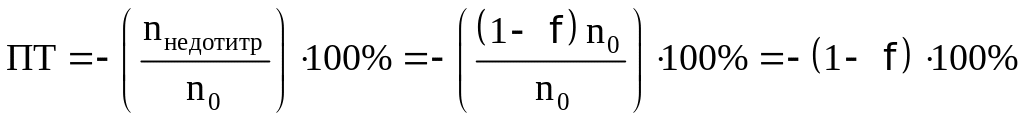
При перетитровывании:
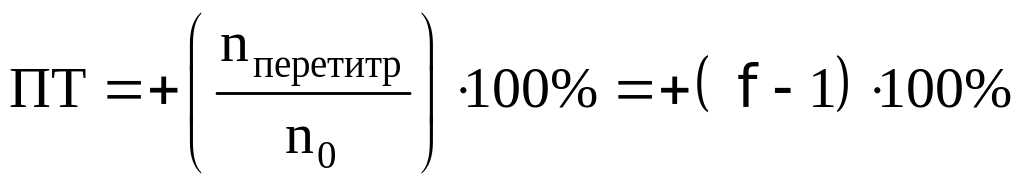
Возьмем индикаторы хризоидин (pT=5,50)
и хлорфеноловый красный (pT
= 5,80). В данном случае в КТТ pH
будет больше, чем pH в ТЭ
(pH = 5,28), а, следовательно,
в растворе будет неотитрованное
основание. Эта погрешность, обусловленная
содержанием неоттитрованного основания,
называется щелочной, будет определяться
уравнением
.
На данном этапе титрования pH
будет определяться по формуле
.
В КТТ pH раствора равен
pT. Следовательно, можно
найти и f
в КТТ:
.
Отсюда,
.
Посчитаем ПТ для данных индикаторов:
хризоидин:
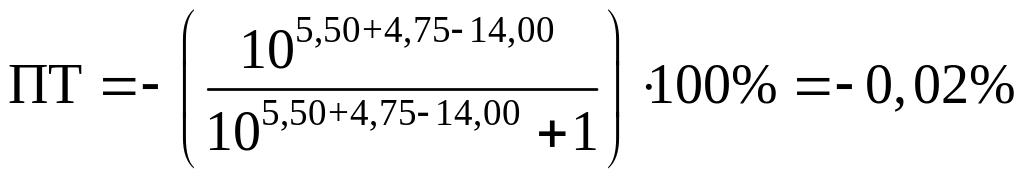
хлорфеноловый красный:
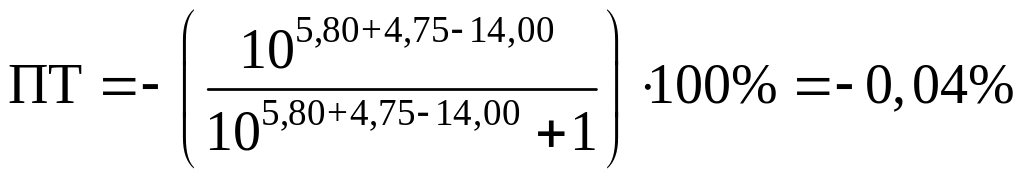
Оба эти индикатора подойдут для нашего
титрования. Рассмотрим ПТ для индикатора
розоловая кислота (pT=7,1).
По данной формуле получается ПТ=–0,70%,
что превышает обычно задаваемое значение
погрешности (±0,2%).
Рассмотрим же теперь случай, когда мы
используем индикаторы с pT
меньшим, чем pH в ТЭ. В КТТ
раствор будет перетитрован, и pH
будет определяться концентрацией
сильной кислоты (водородная погрешность),
и в нашей задаче определяться уравнением
.
Погрешность будет определяться по
формуле
Возьмем для примера индикаторы лакмоид
(pT=5,20), ализариновый красный
C (pT=4,45) и
бромфеноловый синий (pT=3,80).
pH раствора в КТТ равен
pT:
.
.
Рассчитаем ПТ для наших индикаторов:
Лакмоид:

Ализариновый красный C:
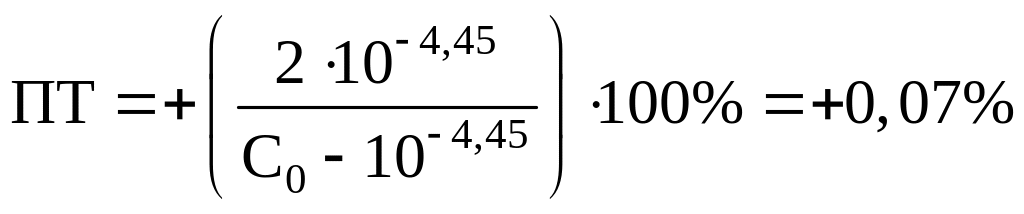
Бромфеноловый синий:

Вполне очевидно, что из двух предложенных
индикаторов наиболее подходящим является
ализариновый красный C.
Учитывая все расчеты, приходим к выводу,
что самыми подходящими для нашего опыта
индикаторами являются хризоидин (с
интервалом перехода 4,0 – 7,0, оранжевая
– желтая) и лакмоид (4,0 – 6,4, красная –
синяя).
Выводы
По кривой титрования аммиака можно
сделать ряд выводов.
В ходе титрования заметно плавное
уменьшение pH и заметен
скачок в области точки эквивалентности.
Скачок титрования полностью находится
в кислой области.
Точка эквивалентности расположена при
pH 5,28 и, очевидно, не
совпадает с точкой нейтральности. Скачок
титрования 0,1 М аммиака в пределах ±0,1%
от точки эквивалентности находится в
пределах pH от 6,25 до 4,30 и
составляет примерно 2 единицы pH,
что намного меньше скачка сильной щелочи
(6 единиц pH). С уменьшением
концентрации и увеличением температуры
скачок уменьшается.
В нашем случае одними из самых подходящих
являются лакмоид и хризоидин.
Окислительно-восстановительное титрование
Метод основан на реакциях
окисления-восстановления. Их называют
по применяемому тированному раствору
реагента, например: перманганатометрия,
йодометрия, бихроматометрия. В этих
методах в качестве титрантов применяют,
соответственно, KMnO4,
I2, K2Cr2O7.
В основе метода лежит изменение
окислительно-восстановительного
потенциала, обусловленного протеканием
окислительно-восстановительной реакции
между титрантом и определяемым веществом.
В процессе титрования происходит
изменение концентраций окисленной и
восстановленной форм, а, следовательно,
изменяется окислительно-восстановительный
потенциал титруемого раствора, включающей
две редоксопары.
В соответствии с уравнением Нернста
окислительно-восстановительный потенциал
для любой редоксопары:
Для каждого отдельного метода
окислительно-восстановительного
титрования используются свои стандартные
растворы.
Рассмотрим наш случай – перманганатометрия.
Рабочим раствором этого метода является
раствор перманганата калия KMnO4,
он неустойчив из-за реакции с водой,
катализируемый диоксидом марганца и
на свету:
Поэтому растворы перманганата калия
следует готовить, используя чистую воду
(органические примеси в воде могут
реагировать с
и давать MnO2, ускоряющий
разложение реагента), отфильтровать от
диоксида марганца и хранить в темных
склянках; раствор следует выдержать
несколько недель для окончания протекания
всех процессов. Очевидно, что раствор
следует стандартизировать, для чего
используют оксалат натрия и другие
восстановители. Реакция
катализируется ионами Mn2+.
Первые капли перманганата даже в горячем
растворе обесцвечиваются очень медленно.
В ходе титрования концентрация ионов
Mn2+ возрастает и
скорость реакции увеличивается: реакция
автокаталитическая.
Титр перманганата калия можно установить
также по оксиду мышьяка(III)
или металлическому железу.
В перманганатометрии применяют также
растворы восстановителей – слои Fe(II),
щавелевую кислоту и некоторые другие
– для определения окислителей методом
обратного титрования. Соединения Fe(II)
на воздухе медленно окисляются, особенно
в нейтральном растворе. Подкисление
замедляет процесс окисления, однако
обычно рекомендуется перед применением
раствора Fe(II)
в анализе проверить его титр. Оксалаты
и щавелевая кислота в растворе медленно
разлагаются. Этот процесс ускоряется
на свету, поэтому растворы оксалатов
рекомендуется хранить в темных склянках.
Подкисленные растворы оксалатов более
устойчивы, чем нейтральные или щелочные.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
1.
Окислительно-восстановительное
титрование
1
2.
Mэкв(X) = fэкв · М(X)
f = 1/z
z – число электронов, принимающих участие в
окислительно-восстановительной реакции
2
3.
10FeSO4 + 2KMnO4 + 8H2SO4 2MnSO4 +
5Fe2(SO4)3 + K2SO4 + 8H2O
MnO4 + 8H+ + 5ē Mn2+ + 4H2O
2Fe2+ 2ē Fe23+
3
4.
10FeSO4 + 2KMnO4 + 8H2SO4 2MnSO4 +
5Fe2(SO4)3 + K2SO4 + 8H2O
MnO4 + 8H+ + 5ē Mn2+ + 4H2O
2Fe2+ 2ē Fe23+
fэкв(KMnO4) = 1/5,
M(1/5KMnO4) = M(KMnO4) /5;
fэкв(FeSO4) = 1
M(FeSO4) = M(FeSO4)/1
4
5.
I2 + 2Na2S2O3 2NaI + Na2S4O6
I2 + 2ē 2I
2S2O32 2ē S4O62
5
6.
I2 + 2Na2S2O3 2NaI + Na2S4O6
I2 + 2ē 2I
2S2O32 2ē S4O62
fэкв(I2) = 1/2
M(1/2 I2) = M(I2)/2;
fэкв(Na2S2O3) = 1
M(Na2S2O3) = M(Na2S2O3)/1
6
7.
6KI + K2Cr2O7 + 7H2SO4 3I2 + Cr2(SO4)3 +
K2SO4 + 7H2O
Cr2O72 + 14H+ + 6ē Cr23+ + 7H2O
2I 2ē I2
7
8.
6KI + K2Cr2O7 + 7H2SO4 3I2 + Cr2(SO4)3 +
K2SO4 + 7H2O
Cr2O72 + 14H+ + 6ē Cr23+ + 7H2O
2I 2ē I2
fэкв(K2Cr2O7) = 1/6
Mэкв(K2Cr2O7) = M(K2Cr2O7)/6
fэкв(KI) = 1
M(KI) = M(KI)/1
8
9.
H2SO4
CH4
CH3—CH2OH
CH3OH
H
HCOH
H
H
CH3—COOH
H
H
H
9
10.
–4
–2
CH4
CH3OH
–3
–1
CH3—CH2OH
+1
HCOH
–3
-1
+3
CH3—COOH
10
11.
O O
OH OH
H
+1
H +2
+1
O
O
+2
CHOH
O
CHOH
CH2OH
CH2OH
C21+ – 2е
O
C22+
fэкв(Аск.к.) = 1/2
Mэкв(Аск.к.) = M(Аск.к.)/2
11
12.
Перманганатометрия
Титрант – 0,02 М или 0,1 М (1/5 KMnO4) или
0,1 н. раствор KMnO4
По точной навеске приготовить нельзя, т.к.
сильный окислитель.
Готовят раствор приблизительно нужной концентрации, выдерживают 7-10 дней или
кипятят 10 минут для окисления восстановителей, содержащихся в воде
Фильтруют через стеклянный фильтр.
12
13.
Стандартизацию проводят по щавелевой кислоте H2C2O4 2H2O, оксалату натрия Na2C2O4,
оксиду мышьяка (III) As2O3, металлическому
железу.
Стандартизацию проводят только в сернокислой
среде.
16HCl + 2KMnO4 5Cl2 + 2MnCl2 + 2KCl +8H2O
Индикатор – сам титрант.
13
14.
Стандартизация 0,1 н. по щавелевой кислоте
60-70 0С
5H2C2O4 + 2KMnO4 + 3H2SO4 2MnSO4 +
10CO2 + K2SO4 + 8H2O
C2O42– – 2е 2CO2
14
15.
Этикетка:
0,02 М или 0,1 М (1/5KMnO4) или 0,1 н.
К = 0,9972
Хранят в темном месте, в склянках темного
стекла
свет
4KMnO4 + 2H2O 4MnO2 + 4 KOH + 3H2O
По ГФ XIII стандартизация по тиосульфату
натрия
15
16.
Применение:
прямая перманганатометрия
Железа (II) сульфат:
10FeSO4 + 2KMnO4 + 8H2SO4 5Fe2(SO4)3 +
K2SO4 + 2MnSO4 + 8H2O
2Fe2+ – 2е Fe23+
Сэкв(KMnO4)·Mэкв(FeSO4)
Т(KMnO4/FeSO4) = ————————————
1000
16
17.
m(FeSO4) = V(KMnO4)·K·T(KMnO4/FeSO4)
V(KMnO4)·K·T(KMnO4/FeSO4)·100
(FeSO4) = ——————————————, %
а(FeSO4)
17
18.
Перекись водорода:
5H2O2 + 2KMnO4 + 3H2SO4 5O2 + K2SO4 +
2MnSO4 + 8H2O
O22– – 2е O2
Сэкв(KMnO4)·Mэкв(H2O2)
Т(KMnO4/H2O2) = ————————————
1000
18
19.
Аскорбиновая кислота:
O O
OH OH
H
H
5
+ 2KMnO4 + 3H2SO4
O
5
CHOH
O
CHOH
CH2OH
CH2OH
O
C21+ – 2е
+ 2MnSO4 + K2SO4 + 8H2O
O
C22+
Сэкв(KMnO4)·Mэкв(Аск.к.)
Т(KMnO4/Аск.к.) = ————————————
1000
19
20.
обратная перманганатометрия
Натрия нитрит:
5NaNO2 + 2KMnO4(изб.) + 3H2SO4 5NaNO3 +
2MnSO4 + K2SO4 + 3H2O
2KMnO4(ост.) + 10KI + 8H2SO4 2MnSO4 + 5I2
+ 6K2SO4 + 8H2O
I2 + 2Na2S2O3 2NaI + Na2S4O6
20
21.
(VKMnO4 K VNa2S2O3 K) Т(Na2S2O3/NaNO2) 100
(NaNO2)= (%)
а (NaNO2)
Сэкв(Na2S2O3) Мэкв(NaNO2)
Т(Na2S2O3/NaNO2) =
1000
NO2– + H2O – 2е
N3+ – 2е
NO3– + 2H+
N5+
21
22.
5NaNO2 + 2KMnO4(изб.) + 3H2SO4 5NaNO3 +
2MnSO4 + K2SO4 + 3H2O
NO2– + H2O – 2е NO3– + 2H+
| 5
MnO4– + 8H+ + 5е Mn2+ + 4H2O | 2
5NO2– + 2MnO4– + 16H+ + 5H2O
5NO3– + 10H+ + 2Mn2+ + 8H2O
или
5NO2– + 2MnO4– + 6H+ 5NO3– + 2Mn2+ + 3H2O
22
23.
Кривые окислительно-восстановительного
титрования
Выражают зависимость величины потенциала
от концентрации титранта
23
24.
Задача. Рассчитать и построить кривую титрования соли Fe (II) раствором перманганата
калия, если
Eo (Fe3+/Fe2+) = + 0,77 B;
Eo (MnO4–/Mn2+) = + 1,51 B
Какой из индикаторов можно использовать в
данном случае?
24
25.
2,2 – Дипиридил (комплекс с рутением)
Ео = 1,33 В
Дифениламин-2,2 –дикарбоновая кислота
Ео = 1,26 В
Комплекс 1,10-фенантролина с Fe (II)
Ео = 1,14 В
Фенилантраниловая кислота Ео = 1,08 В
Дифениламин
Ео = 0,76 В
Метиленовый голубой
Ео = 0,53 В
Индиготетрасульфоновая кислота Ео = 0,36 В
25
26.
5Fe2+ + MnO4– + 8H+ 5Fe3+ + Mn2+ + 4H2O
В начале титрования и до т.э. в растворе будут:
Fe2+, Fe3+ ,Mn2+
Потенциал системы будет определяться парой
восстановителя Fe3+/Fe2+
Величина потенциала может быть вычислена по
уравнения Нернста:
E = Eo + 0,059/1 lg[Fe3+]/[Fe2+]
26
27.
В точке эквивалентности:
E = (mEoв-ля + nEoок-ля )/(m + n)
27
28.
5Fe2+ + MnO4– + 8H+ 5Fe3+ + Mn2+ + 4H2O
за т. э. в растворе будут:
Fe3+, MnO4– и Mn2+
Потенциал будет определяться парой
окислителя MnO4– /Mn2+
Величина потенциала вычисляется по
уравнению Нернста:
E = Eo + 0,059/5 lg[MnO4–][H+]8/[Mn2+]
28
29.
Пусть концентрация ионов водорода равна 1 М
Доб-но
От-но
KMnO4–
в%
[Fe3+]
———
[Fe2+]
9
9
9/91 10-1
-1
0,77–0,059=0,71В
50
50
50/50=1
0
0,77 В
99
99
99/1 102
2
0,77+0,059 2=0,89В
3
0,77+0,059 3=0,95В
99,9
100
99,9 99,9/0,1 103
[Fe3+]
lg ———
[Fe2+]
E=Eo +0,059/1
lg [Fe3+]/[Fe2+]
E = (mEoв-ля+nEoок-ля )/(m+n)=(1 0,77+5 1,51)/(1+5)
=1,39 29B
30.
Доб-но
Изб-к
KMnO4–
в%
100,1
0,1
[MnO4–][H+]8
————— lgдроби E=Eo +0,059/5lgдр
[Mn2+]
0,1/100 10-3 -3
1,51+(0,059/5) (-3) =
1,475 B
101
1
1/100=10-2
-2
1,51+(0,059/5) (-2)
= 1,486 B
110
10
10/100=10-1
-1
1,51+(0,059/5) (-1)
= 1,498 B
30
31.
Скачок от 0,95 В до 1,475 В
2,2 – Дипиридил (комплекс с рутением)
Ео = 1,33 В
Дифениламин-2,2 –дикарбоновая кислота
Ео = 1,26 В
Комплекс 1,10-фенантролина с Fe (II)
Ео = 1,14 В
Фенилантраниловая кислота Ео = 1,08 В
Дифениламин Ео = 0,76 В
Метиленовый голубой Ео = 0,53 В
Индиготетрасульфоновая кислота Ео = 0,36 В
31
32.
Интервал изменения окраски индикаторов
Ind(ок) + ne Ind(вос)
0,059
[Ind(ок)]
E = Eo + ——— lg ————
n
[Ind(вос)]
[Ind(ок)]
———— = 10 – наблюдаем окраску окисленной
[Ind(вос)]
формы
E = Eo + 0,059/n lg10 = Eo + 0,059/n
32
33.
[Ind(ок)]
——— = 0,1 – наблюдаем окраску восстановл.
[Ind(вос)]
формы
E = Eo + 0,059/n lg 0,1 = Eo – 0,059/n
E = Eo ± 0,059/n
33
34.
Индикаторы окислительно-восстановительного
титрования
1. Специфические – индикаторы, которые взаимодействуют с одной из форм окислительновосстановительной пары с изменением
окраски (крахмал)
2. Редокс-индикаторы — вещества, которые при
определенном потенциале раствора окисляются или восстанавливаются с изменением
окраски
34
35.
Редокс-индикаторы:
1. Обратимые
E = Eo ± 0,059/n
Дифениламин Ео = 0,76 В
бесцветный – фиолетовый
м.р. в воде, готовят 1% р-р в концентр. H2SO4
Ферроин – комплекс Fe(II) с о-фенантролином
Ео = 1,14 В
[FeL3]2+ – e [FeL3]3+
красная
бледно-голубая
Фенилантраниловая кислота (Ео = 1,08 В) и др.
35
36.
2. Необратимые
Метиловый оранжевый
Метиловый красный,
Нейтральный красный
При окислении необратимо исчезает окраска
раствора
36
37.
Индикаторные ошибки окислительновосстановительного титрования
Индикаторная ошибка рассчитывается по
формуле:
n’(X)
Х = ———— · 100
n(X)
n’(X) – количество неоттитрованного вещества
(или избыточно прибавленного титранта)
n(X) – количество вещества, взятого для
титрования
37
38.
Задача. Рассчитать ошибку титрования железа
сульфата (II) раствором KMnO4 в сернокислой
среде при [H+] = 1 моль/л с индикатором
дифениламином (Ео = 0,76 В).
Потенциал системы в т.э.:
E = (mEoв-ля+nEoок-ля )/(m+n)=(1 0,77+5 1,51)/(1+5)
=1,39 B
38
39.
Таким образом,
Изменение окраски произойдет при 0,76 В
Т.э. наступит при 1,39 В, следовательно,
раствор недотитрован.
Потенциал системы рассчитывался по паре
[Fe3+]/[Fe2+] (Eo = 0,77 В) и закончили
титровать при 0,76 В
E = Eo + 0,059/1 lg[Fe3+]/[Fe2+]
0,76 = 0,77 + 0,059/1 lg[Fe3+]/[Fe2+]
39
40.
lg[Fe3+]/[Fe2+] = – 0,169
[Fe3+]
0,68
———— = 0,68 = ———
[Fe2+]
1
n’(X)
Х = ———— · 100
n(X)
n’(X) = 1 (количество неоттитрованного в-ва)
n(X) = 1 + 0,68 (количество вещества, взятого
для титрования)
40
41.
Ошибка титрования составит:
1
Х = ———— · 100 = 59,5 %
1 + 0,68
Индикаторная ошибка д.б. не более 0,1 %.
41
42.
Задача. Рассчитать и построить кривую
титрования соли олова (II) раствором соли
железа (III), если Eo (Fe3+/Fe2+) = + 0,77 B и
Eo (Sn4+/Sn2+) = + 0,15 B.
Какой из индикаторов вы выберете?
Дифениламин Ео = 0,76 В
Метиленовый голубой Ео = 0,53 В
Индиготетрасульфоновая кислота Ео = 0,36 В
Нейтральный красный Ео = 0,24 В
Рассчитать ошибку титрования с индикатором –
метиленовый голубой
42
43.
Sn2+ + 2Fe3+ Sn4+ + 2Fe2+
В начале титрования и до т.э. в растворе будут:
Sn2+, Sn4+, Fe2+
Потенциал системы будет определяться парой
восстановителя Sn4+/Sn2+,
Величина потенциала вычисляется по
уравнению Нернста:
E = Eo + 0,059/2 lg[Sn4+]/[Sn2+]
43
44.
В точке эквивалентности:
E = (mEoв-ля + nEoок-ля )/(m + n)
E = (2 · 0,15 + 1· 0,77) / 3 = 0,36 B
44
45.
Sn2+ + 2Fe3+ Sn4+ + 2Fe2+
за т. э. в растворе будут:
Fe3+, Sn4+, Fe2+
Потенциал будет определяться парой
окислителя Fe3+/Fe2+
Величина потенциала вычисляется по
уравнению Нернста:
E = Eo + 0,059/1 lg[Fe3+]/[Fe2+]
45
46.
Доб-но
Fe3+
От-но
в%
[Sn4+]
———
[Sn2+]
[Sn4+]
lg ———
[Sn2+]
E
9
9
9/91 10-1
-1
0,12 В
50
50
50/50 1
0
0,15 В
90
90
90/10 101
1
0,18 В
99
99
99/1 102
2
0,21 В
99,9
99,9
99,9/0,1 103
3
0,24 В
100
0,36 B
46
47.
Доб-но
Fe3+
Изб-к
в%
100,1
0,1
0,1/100 10-3
-3
0,59 B
101
1
1/100=10-2
-2
0,65 B
110
10
10/100=10-1
-1
0,71 B
[Fe3+]
———
[Fe2+]
[Fe3+]
lg ———
[Fe2+]
E
Скачок от 0,24 В до 0,59 В
Метиленовый голубой Ео = 0,53 В
Индиготетрасульфоновая кислота Ео = 0,36 В
Нейтральный красный Ео = 0,24 В
47
48.
Изменение окраски произойдет при 0,53 В
Т.э. наступит при 0,36 В, следовательно,
раствор перетитрован.
Потенциал системы рассчитывался по паре
окислителя [Fe3+]/[Fe2+] (Eo = 0,77 В)
Закончили титровать при 0,53 В
E = Eo + 0,059/1 lg[Fe3+]/[Fe2+]
0,53 = 0,77 + 0,059/1 lg[Fe3+]/[Fe2+]
48
49.
lg[Fe3+]/[Fe2+] = – 6,949
[Fe3+]
1·10–7
———— = 1·10–7 = ———
[Fe2+]
1
1·10–7
Х = ——— · 100 = 1·10–5 %
1
n’(X) = 1·10–7 (количество избыточно прибавленного титранта)
n(X) = 1 + 1·10–7 1 (количество вещества,
взятого для титрования)
49
50.
Дихроматометрия
Титрант – 0,0167 М или 0,1 М (1/6 K2Cr2O7)
или 0,1 н. раствор K2Cr2O7
Стандартный раствор можно приготовить по
точной навеске
Cr2O72 + 14H+ + 6ē 2Cr3+ + 7H2O
fэкв(K2Cr2O7) = 1/6
Mэкв(K2Cr2O7) = M(K2Cr2O7)/6
50
51.
K2Cr2O7 – оранжевая окраска
Cr3+ – зеленоватая окраска, однако
интенсивности цвета не хватает для фиксации
конечной точки титрования
Ind – дифениламин, дифениламинсульфоновая
кислота и др.
51
52.
а(K2Cr2O7)теор=Сэкв(K2Cr2O7)·Mэкв(K2Cr2O7)·V (л)
а(K2Cr2O7)прак
Сэкв(K2Cr2O7)прак = —————————
Mэкв(K2Cr2O7) · V(л)
Сэкв(K2Cr2O7)прак
K = ————————
Сэкв(K2Cr2O7)теор
52
53.
Применение:
прямая дихроматометрия
Железа (II) сульфат:
6FeSO4 + K2Cr2O7 + 7H2SO4 3Fe2(SO4)3 +
Cr2(SO4)3 + K2SO4 + 7H2O
2Fe2+ – 2е Fe23+
Сэкв(K2Cr2O7)·Mэкв(FeSO4)
Т(K2Cr2O7/FeSO4) = ———————————
1000
53
54.
Расчет массы и массовой доли (%)
m(FeSO4) = V(K2Cr2O7)·K·T(K2Cr2O7/FeSO4)
V(K2Cr2O7)·K·T(K2Cr2O7/FeSO4)·100
(FeSO4) = ——————————————, %
а(FeSO4)
54
55.
Калия иодид:
6KI + K2Cr2O7 + 7H2SO4 3I2 + Cr2(SO4)3 +
4K2SO4 + 7H2O
2I– – 2е I2
Сэкв(K2Cr2O7)·Mэкв(KI)
Т(K2Cr2O7/KI) = ——————————
1000
55
56.
Кислота аскорбиновая:
O O
OH OH
H
3
O
+ K2CrO4 + 4H SO
2
4
O
H
CHOH
O
CHOH
CH2OH
CH2OH
C21+ – 2е
+ Cr2(SO4)3 + K2SO4 + 7H2O
O
C22+
С(1/6K2Cr2O7)·M(1/2Аск.к.)
Т(K2Cr2O7/Аск.к.) = ———————————
1000
56
57.
Обратная дихроматометрия применяется для
определения спирта этилового:
3CH3CH2OH + 2K2Cr2O7 + 8H2SO4
избыток
3CH3COOH + 2Cr2(SO4)3 + 2K2SO4 + 11H2O
K2Cr2O7 + 6KI + 7H2SO4 3I2 + Cr2(SO4)3 +
остаток
4K2SO4 + 7H2O
I2 + 2Na2S2O3 2NaI + Na2S4O6
57
58.
Расчет массовой доли (%)
(V(K2Cr2O7) K V(Na2S2O3) K) Т(Na2S2O3/Сп) 100
(Сп) = (%)
а (CH3CH2OH)
Сэкв(Na2S2O3) Мэкв(Спитра)
Т(Na2S2O3/Сп) =
1000
-1
CH3—CH2OH – 4 е
+3
CH3—COOH
58
59.
Преимущества дихроматометрии перед
перманганатометрией
1. Титрант можно приготовить по точной
навеске
2. Титрование можно проводить в присутствии
HCl
Eo(Cr2O72–/2Cr3+) = 1,33 B
Eo(Cl2/2Cl–) = 1,33 B
При титровании Cl– не окисляются Cr2O72–ионами
59
Редоксиметрия,
ее варианты. Пример расчета кривой титрования. Основные особенности.
Окислительно-восстановительное
титрование.
В основе данного метода лежат реакции окисления-
восстановления. В качестве титранта могут применяться растворы окислителя или
восстановителя.
Особенности
окислительно-восстановительного титрования:
1. Сравнительно низкие скорости реакций.
2. Сложный механизм протекания реакций.
3. Критерий применимости реакции для титрования: DE0 = E0ок — E0восст
не менее 0,2В, в этом случае константа равновесия оказывается достаточно высокой.
В окислительно-восстановительном титровании используют
индикаторы двух типов:
1. Дающие окрашенные соединения с окисленной или
восстановленной формой.
2. Редоксиндикаторы, изменяющие окраску при изменении
потенциала системы (слабые окислители
или восстановители, имеющие различную окраску окисленной и воссстановленной
формы).
Также используют безиндикаторное титрование, если одна
из форм (или обе) имеют окраску.
По
применяемому в
окислительно-восстановительном титровании титранту
различают:
1. Перманганатометрию;
2. Иодометрию;
3. Хроматометрию;
4. Броматометрию;
5. Цериметрию;
6. Ванадатометрию.
Построение кривых окислительно-восстановительного
титрования.
При окислительно-восстановительном титровании в растворе
протекают полуреакции
Любой участник этих полуреакций
может быть как титрантом, так и титруемым веществом. Так, если титрантом
является Ох1, то титруемое вещество – Red2 если титрант Ох2,
титруемое вещество – Red1. И наоборот, в качестве
титрантов могут выступать Red1, или Red2, а титруемыми веществами будут
Ох2 и Ох1 соответственно.
Для каждой полуреакции в
соответствии с уравнением Нернста (влиянием ионной силы пренебрегаем)
При титровании между титрантом и
титруемым веществом протекает реакция
После добавления каждой порции
титранта в растворе устанавливается равновесие и ‘встема приобретает потенциал
Е, зависящий от соотношения концентраций исходных веществ и продуктов. Поэтому
логично в качестве изменяющегося параметра при построении кривых титрования
использовать потенциал системы. При равновесии потенциалы полуреакций равны E = E1 = E2 поэтому для расчета Е можно
использовать и уравнение (I), и уравнение (II). При выборе уравнения руководствуются
соображениями удобства и простоты вычислений. До точки эквивалентности удобно использован
уравнение для полуреакции с участием титруемого вещества, после точки
эквивалентности — уравнение полуреакции с участием титранта. Действительно, до
точки эквивалентности весь
добавленный титрант превращен в сопряженную форму, поэтому для расчета
потенциала сначала необходимо вычислить константу равновесия, чтобы найти
равновесную концентрацию титранта. Расчет упрощается, можно
воспользоваться полуреакцией с участием
титруемого вещества, поскольку концентрации окисленной и восстановленной форм
его найти легко: количество сопряженной формы титруемого вещества,
образовавшейся при титровании, г количеству добавленного титранта. За точкой
эквивалентности картина обратная: все титруемое вещество превращено в сопряженную
форму и равновесная концентрация исходной формы ничтожно мала. Чтобы найти ее,
опять необходим константу равновесия реакции. Поэтому удобнее воспользоваться полуреакцией
с участием титранта, концентрацией окисленной и восстановленной форм которого
найти легко: в результате титрования образуется столько же сопряженной формы
титранта, сколько же вещества сдержалось в исходном растворе.
При построении кривых
окислительно-восстановительного титрования потенциал до начала титрования не
рассчитывают, поскольку в исходном растворе известна концентрация только одной
из сопряженных форм титруемого вещества.
До точки эквивалентности. Пусть
титруемое вещество — восстановитель, тогда
Если титруемое вещество —
окислитель, то
За точкой эквивалентности. Если
титруемое вещество восстановитель, а титрант – окислитель, то
в случае, если титрант –
восстановитель,
В точке эквивалентности неудобно
рассчитывать потенциал ни полуреакции титранта, ни полуреакции титруемого
вещества, поскольку в обоих случаях концентрация одной из сопряженных форм
исчезающе мала. Чтобы не прибегать к громоздким вычислениям с использованием
константы равновесия (хотя это и возможно), используем следующий несложный
прием. Запишем уравнение Нернста в точке эквивалентности для каждой полуреакции
Сложим оба уравнения,
предварительно умножив их на n1, и n2 соответственно
Обратим внимание на выражение
под знаком логарифма. В точке эквивалентности концентрации реагирующих веществ
находятся в стехиометрических отношениях:
другими словами,
Следовательно, величина под
знаком логарифма равна 1 и
Как видно, во все уравнения для
расчета Е входят величины стандартных потенциалов. Если в процессе титрования
возможно протекание конкурирующей реакции или нельзя пренебречь ионной силой,
стандартные потенциалы следует заменить формальными.
На величину скачка на кривой
окислительно-восстановительного титрования влияет ряд факторов.
Природа титруемого вещества и
титранта. Чем больше разница стандартных потенциалов титруемого вещества и
титранта, тем больше скачок титрования.
Величина рН. Если в полуреакциях
окисления-восстановления участвуют ионы водорода, их концентрация входит в
уравнение Нернста и, следовательно, или величину скачка титрования. В этом
случае вместо стандартного потенциала испод формальный
где m — стехиометрический коэффициент
при H+
Конкурирующие реакции
комппексообразования с участием окисленной или восстановленной форм. В этом
случае, также как и в предыдущем, при расчете кривых титрования следует
пользоваться формальными потенциалами вместо стандартных.
Пример1 . Постройте кривую титрования 100.0 мл 0.1000 М
раствора сульфата железа(П) 0.1000 М раствором сульфата церия (IV) в 1 М серной
кислоте.
Решение. В справочных таблицах есть
формальные потенциалы пар Fe(III)/Fe(II) и Ce(IV)/Ce(III) в 1 М
растворе серной кислоты:;
Воспользуемся ими для расчета
кривой титрования. В данном случае титруемое вещество — восстановитель, титрант
— окислитель.
До точки эквивалентности
В точке эквивалентности
За точкой эквивалентности
Величина
скачка увеличивается:
1.
При увеличении
концентрации реагирующих веществ.
2.
При увеличении
разности стандартных потенциалов редокс-пар.
3.
При увеличении
температуры титрования.
4.
Величина скачка
зависит от концентрации ионов гидроксония в соответствии с уравнением Нернста.
Если разность потенциалов редокс-пар более 0,5 В, то
возможно дифференцированное титрование смеси окислителей или восстановителей.