В протолитометрии
различают 4 вида индикаторных
ошибок: водородная, гидроксильная,
кислотная и основная.
-
Водородная
(Н+) ошибка
возникает при титровании сильных
электролитов (сильное – сильное)
и обусловлена избытком протонов в
растворе. Эта ошибка имеет место, если
сильная кислота
недотитрована, а сильное основание
– перетитровано. -
Гидроксильная
(ОН–) ошибка
также характерна для титрования
системы сильное – сильное и возникает
при избытке гидроксо—групп
в растворе. Сильная кислота при этом
будет перетитрована, а сильное
основание – недотитровано. -
Кислотная
ошибка проявляется при титровании
слабой кислоты сильным основанием,
в том случае, когда слабая кислота
недотитрована и в растворе избыток
протонов. -
Основная ошибка
характеризует систему слабое
основание
сильная кислота в момент, когда
слабое основание недотитровано, т.е.
при избытке в растворе гидроксо-групп.
Так как при
титровании слабых электролитов в
качестве титранта обычно используют
сильный электролит (щелочь или кислоту),
то в перетитрованном растворе
избыток титранта создает погрешность
1-го или 2-го типа: водородную или
гидроксильную ошибку.
Главным критерием
применимости того или иного индикатора
является значение индикаторной ошибки,
которая не должна превышать 0,5%. Если
погрешность выше, то такой индикатор
применять нельзя.
4.3. Методы и способы титрования. Титр, титр по определяемому веществу
Аналитическая
характеристика каждого титриметрического
метода включает наиболее существенные
его особенности: приготовление и свойства
рабочих растворов, виды кривых титрования,
погрешности определения, способы
индикации точки эквивалентности и
практическое применение. На основании
этого все методы титрования
классифицируют
по 2-м признакам: типу
реакции,
лежащей в основе
метода
и способу проведения анализа.
Каждый вид титрования имеет свои
особенности и закономерности и может
осуществляться различными способами.
Как видно из схемы (рис. 4.9), в зависимости
от типа
реакции,
лежащей в основе метода, различают 4-ре
вида
титрования:
-
кислотно-основное
или метод нейтрализации (протолитометрия); -
окислительно-восстановительное
(редоксиметрия); -
комплексометрическое;
-
осадительное
(метод седиментации).

Рисунок
4.9 – Классификация методов титрования
в соответствии с типом химической
реакции (где L
– комплексный ион; МеL
– образовавшийся комплекс; А – осаждаемое
вещество, В – титрант, АВ – осадок).
4.3.1 Способы титрования.
Так как напрямую,
реакцией с титрантом, можно анализировать
далеко не любое вещество, особенно, если
оно неустойчиво на воздухе, то для
решения подобных задач было разработано
несколько приемов
(способов)
проведения анализа. Они
позволяют заменять неустойчивые,
в данных условиях соединения,
на эквивалентное количество более
устойчивого, которое не подвергается
гидролизу или окислению. Известны
следующие основные способы
проведения титриметрического анализа:
-
прямое
титрование; -
реверсивное;
-
обратное титрование
или титрование по остатку; -
косвенное
титрование или по замещению (по
заместителю).
В таблице 4.1 показаны
области применения различных способов
в зависимости от вида титрования.
Таблица 4.1 –
Применение различных видов и способов
титрования.
|
название метода |
частное название метода; (рабочий раствор) |
вещества, |
||
|
прямым |
обратным |
косвенным |
||
|
Протолито-метрия |
Ацидиметрия
(кислоты: |
основания;
соли, образован-ные сильным |
соли слабых оснований и сильных кислот; органические соединения |
|
|
Алкалиметрия
(щелочи: |
кислоты;
соли, образован-ные слабым |
|
|
|
|
Редокси-метрия |
Перманганато-метрия |
восстановители |
окислители |
вещества, реагирующие с восстанови-телями |
|
Иодометрия
( и |
восстановители |
восстановители |
окислители; кислоты |
|
|
Комплексо-метрия |
Комплексоно- метрия (ЭДТА) |
катионы, образующие с ЭДТА комплексы |
катионы в водо-нерастворимых катионы,
для которых отсутствует |
катионы, образующие с ЭДТА |
|
Метод |
Аргентометрия
( |
Анионы, образую-щие с |
катионы, образующие |
|
Рассмотрим подробнее
суть различных способов титрования.
1. Прямое
титрование заключается в
непосредственном взаимодействии
титранта и титруемого вещества. В
процессе титрования к аликвоте или
навеске вещества постепенно добавляют
раствор титранта, объем которого точно
фиксируют в Т. Э. В качестве титранта
используют рабочий раствор известной
концентрации. Расчет содержания вещества
в образце выполняют по закону эквивалентов:
=
(4.1)
где
– количество моль-эквивалентов
анализируемого вещества в титруемом
образце; а
количество
моль-эквивалентов титранта, вступившего
в реакцию с определяемым компонентом
А.
Концентрацию
компонента А в растворе вычисляют
по формуле:
(4.2)
где
– молярная концентрация эквивалента
(нормальность) титруемого раствора
(определяемого компонента), моль-экв/л;
– объем аликвоты титруемого раствора,
мл;
–
концентрация и
объем титранта в
точке эквивалентности. При титровании
методом отдельных навесок формула
(4.2) преобразуется в выражение (4.3):
(4.3)
Метод применяется
во всех случаях, когда нет каких-либо
ограничений. Например, при анализе
кислот, определении жесткости воды.
2. Реверсивное
титрование – это разновидность
прямого титрования, когда рабочий и
титруемый растворы меняют местами. В
этом случае для анализа отбирают
аликвоты рабочего раствора, а в Т.Э.
измеряют израсходованный на
титрование объем анализируемого
раствора. Вычисления проводят также,
как и в прямом титровании, по формулам
(4.2) или (4.3). Метод позволяет ограничить
площадь поверхности раствора,
контактирующей с воздухом, при
стандартизации относительно неустойчивых
соединений, как например NaOH.
Титрование по
заместителю (косвенное) и титрование
по остатку (обратное) основаны
на использовании вспомогательного
раствора, взаимодействующего с
определяемым компонентом. Такой прием
позволяет выполнять анализ химически
нестойких объектов или же при отсутствии
подходящего индикатора.
В косвенном
титровании сначала осуществляют
реакцию определяемого вещества
А со вспомогательным раствором
В, а затем титруют
эквивалентное количество
образовавшегося продукта реакции
С (заместитель). Этот способ
можно представить в виде схемы: А + В
С + (т-т) , исходя из которой запишем
выражение для закона эквивалентов:
=
=
.
(4.4)
Из равенства (4.4)
следует, что
=
и расчет можно также выполнять по
формулам (4.2) и (4.3), используемых для
прямого титрования. Для полноты реакции
вспомогательный раствор всегда берут
с небольшим избытком. Такой метод
титрования реализуется в йодометрии.
В обратном
титровании также сначала протекает
реакция между определяемым
веществом А и
взятым в избытке вспомогательным
раствором В, но затем титруют
остаток не прореагировавшего
вспомогательного раствора. Поэтому
необходимо точно знать концентрацию
вспомогательного раствора В и его
объем, взятый для анализа. Определение
компонента А выполняется согласно
схеме: А + В
Вост + (т-т). Исходя из
условий титрования, закон эквивалентов
можно записать в виде:
–
=
.
(4.5)
Откуда имеем:
=
.
(4.6)
Если все вещества
взяты в виде растворов, то формула (4.6)
примет вид
(4.7)
Если хотя бы одно
из веществ взято в сухом виде (известна
его масса), то следует воспользоваться
выражением (4.6) и записать значение
для каждого из веществ индивидуально.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
1.
Индикаторные ошибки
кислотно-основного титрования
1
2.
Водородная ошибка возникает, когда
недотитрована сильная кислота,
перетитровано сильное или слабое основание
Водородная ошибка – отношение количества
ионов водорода n(H+) в конце титрования к
первоначально взятому количеству вещества
n(X)
n
(H+)к.т.
X(H+) = ———— · 100%
n(X)
2
3.
n(X) = Сэкв(Х) · V(X)
Сэкв(Х) – молярная концентрация эквивалента
первоначально взятого вещества
V(X) – объем первоначально взятого вещества
n(H+)к.т. = [H+]к.т.· Vк.т.
Vк.т. – объем в конце титрования
Vк.т. = V(X) + V(Т)
3
4.
+] · (V(X) + V(Т))
[H
к.т.
+
X(H ) = ——————————— · 100%
С(1/z Х) · V(X)
рНк.т. = рТInd
[H+]к.т = 10–рН = 10–рТ
–рТ · (V(X) + V(Т))
10
X(H+) = ————————— · 100%
Сэкв(Х) · V(X)
4
5.
Гидроксильная ошибка обусловлена наличием
гидроксид-ионов в конце титрования и возникает, когда недотитровано сильное основание,
перетитрована сильная или слабая кислота
n(OH–)к.т.
X(OH–) = ———— · 100%
n(X)
n(OH–)к.т = [OH–]к.т. · (V(X) + V(Т))
n(X) = Сэкв(Х) · V(X)
–]
[OH
·
(V
(X) + V(Т))
к.т.
X(OH–) = —————————— · 100%
Сэкв(Х) · V(X)
5
6.
рНк.т. = рТInd
т.к. рН + рОН = 14
рОН = 14 – рН = 14 – рТ
[OH–] = 10–(14 – рТ) = 10рТ–14
рТ–14 · (V(X) + V(Т))
10
X(OH–) = —————————— · 100%
Сэкв(Х) · V(X)
6
7.
Кислотная ошибка возникает, когда остается
недотитрованной слабая кислота
Кислотная ошибка – отношение концентрации
недотитрованной кислоты в конце титрования
к ее оттитрованной части
HA + KOH H2O + KA
[HA]к.т.
X(HA) = ———— · 100%
[A–]к.т.
Оттитрованная часть кислоты будет
определяться анионами соли
7
8.
HAк.т. H+к.т. + A–к.т.
[H+]к.т. · [A–]к.т.
Kк-ты = ———————
[HA]к.т.
[HA]к.т. [H+]к.т.
———=
———
[A–]к.т.
Kк-ты
[H+]к.т.
X(HA) = ———— · 100%
Kк-ты
8
9.
рНк.т. = рТInd
[H+]к.т = 10–рН = 10–рТ
Kк-ты = 10–рК
10–рТ
X(HA) = ———— · 100%
10–рКк-ты
X(HA) =10рКк-ты–рТ · 100%
9
10.
Основная ошибка возникает, когда остается
недотитрованным слабое основание
Основная ошибка – отношение концентрации
неоттитрованного основания в конце
титрования к его оттитрованной части
[BOH]к.т.
X(BOH) = ———— · 100%
[B+]к.т.
10
11.
Аналогично с кислотной ошибкой можно
показать
[BOH]к.т.
[OH–]к.т.
—————
=
—————
[B+]к.т.
Kосн
[OH–]к.т.
X(BOH) = ———— · 100%
Kосн
Т.к. [OH–]к.т. = 10рТ–14
Kосн = 10–рКосн
11
12.
10рТ–14
X(BOH) = ———— · 100%
10–рКосн
X(BOH) =10рКосн + рТ–14 · 100%
12
13.
Вычислить ошибку титрования 0,2 н. раствора
HCl 0,2 н. раствором NaOH с индикатором
метиловым оранжевым.
рТ(м/о) = 4
ошибка водородная
–рТ · (V(X) + V(Т))
10
X(H+) = ————————— · 100%
Сэкв(Х) · V(X)
–4 · (10 + 10)
10
X(H+) = ——————— · 100 = 0,1%
0,2 · 10
Индикаторная ошибка должна быть 0,1%
13
14.
Вычислить индикаторную ошибку титрования
0,2 н. раствора HCl 0,2 н. раствором NaOH с
индикатором фенолфталеином
рТ(ф/ф) = 9
ошибка гидроксильная
рТ–14 · (V(X) + V(Т))
10
X(OH–) = —————————— · 100%
Сэкв(Х) · V(X)
9–14 · (10 + 10)
10
X(OH–) = ——————— · 100 = 0,01 %
0,2 · 10
14
15.
Вычислить ошибку титрования 0,1 н. раствора
муравьиной кислоты 0,1 н. раствором сильного основания с индикатором метиловым
красным
рТ(м/к) = 5
рК(HCOOH) = 3,76
рНт.э. = 7 + ½ рКк-ты + ½ lg Cсоли = 8,38
Раствор недотитрован ошибка кислотная
15
16.
X(HA) =10рКк-ты–рТ · 100%
X(HA) =103,76–5 · 100 = 5,7 %
Индикатор использовать нельзя.
16
17.
Чему равна ошибка титрования 0,1 н. раствора
аммиака 0,1 н. раствором HCl с индикатором
крезоловым пурпуровым
рТ(к/п) = 8
рК(NH4OH) = 4,75
рНт.э. = 7 – ½ рКосн – ½ lg Cсоли = 5,10
Раствор недотитрован ошибка основная
X(BOH) =10рКосн + рТ–14 · 100%
X(BOH) =104,75 + 8–14 · 100 = 5,6%
17
ЛЕКЦИЯ 15 1
Индикаторы кислотно-основного титрования 2
Требования, предъявляемые к кислотноосновным индикаторам 1. Индикатор должен быть чувствительным, чтобы расход индикатора был как можно меньше 2. Равновесие между двумя формами должно устанавливаться быстро 3. Обе формы или одна из форм должны быть интенсивно окрашены 4. Интервал перехода окраски индикатора не должен быть большим 3
Теории кислотно-основных индикаторов • Ионная теория • Хромофорная теория • Ионно-хромофорная теория 4
Ионная теория: кислотно-основные индикаторы меняют свой цвет при изменении концентрации ионов водорода в растворе, т. е. при изменении р. Н среды. HInd кислая красная H+ + Ind– основная желтая 5
Недостатки: 1. Не объясняет природы наличия и изменения окраски индикаторов 2. Не связывает окраску индикаторов с их строением 3. На переход окраски требуется какое время, в то время как ионные реакции протекают быстро 6
Хромофорная теория: изменение окраски индикатора обусловлено обратимой перегруппировкой атомов в молекуле, в результате которой появляются или исчезают группы, обуславливающие цвет раствора Хромофорные группы: –N=N–, =C=S, –N=O и др Ауксохромные группы: –NH 2, –OH, –OCH 3 и др. 7
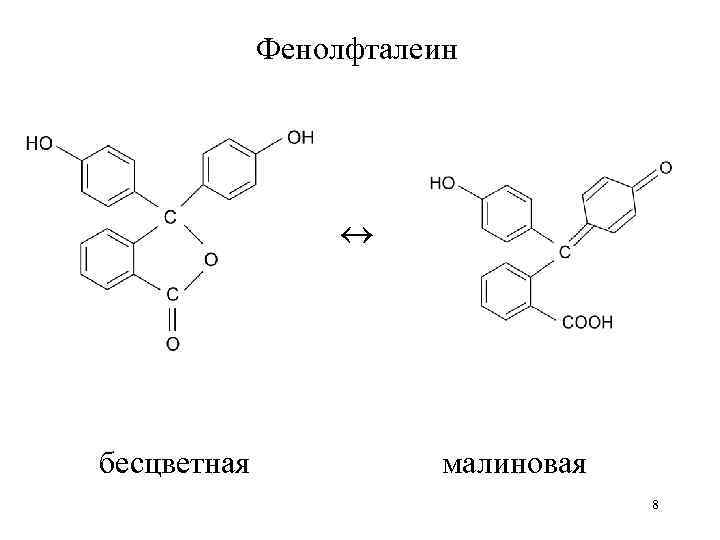
Фенолфталеин бесцветная малиновая 8
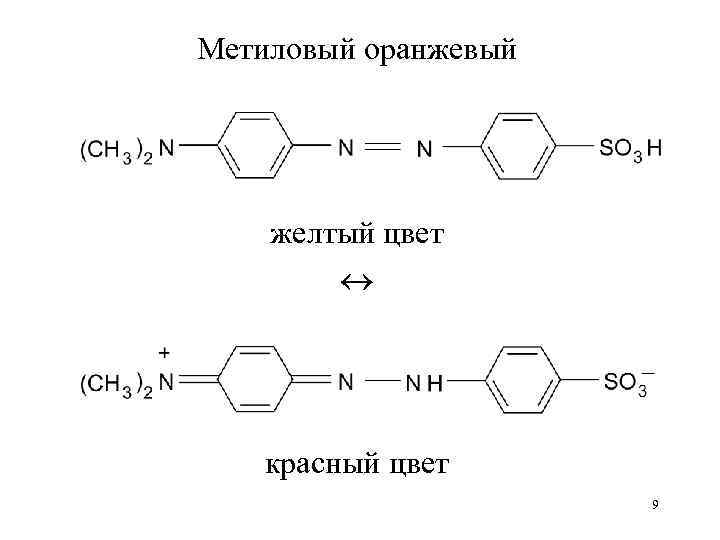
Метиловый оранжевый желтый цвет красный цвет 9
На таутомерные превращения требуется некоторое время, поэтому окраска индикатора изменяется не мгновенно, очевидна взаимосвязь между окраской и строением молекул Не объясняет, почему изменение происходит при изменении р. Н раствора 10
Ионно-хромофорная теория индикаторов: отщепление протона или гидроксид-иона привод к перегруппировке атомов в молекуле, что приводит к изменению цвета индикатора Объясняет: Изменение цвета раствора при изменении р. Н Изменение окраски во времени Связывает изменение окраски с его структурой 11
HInd кислая красная H+ + Ind– основная желтая [H+] · [Ind–] KInd = —————— [HInd] 12
[H+] [HInd] = KInd · ——— [Ind–] p. H = p. KInd + lg ——— [HInd] Соотношение [Ind–]/[HInd] зависит от р. Н р-ра Человеческий глаз замечает изменение окраски при 10 -кратном избытке одной из форм 13
[Ind–]/[HInd] 10 – наблюдается окраска основной формы [Ind–] (желтая) p. H = p. KInd + 1 [Ind–]/[HInd] 10 – наблюдается окраска кислой формы [HInd] (красная) p. H = p. KInd – 1 14
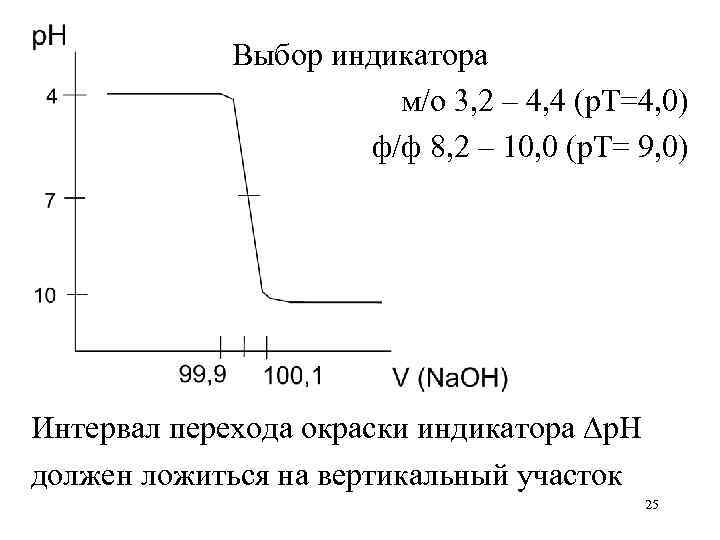
Интервал перехода окраски индикатора: p. H = p. KInd ± 1 p. H не всегда охватывает две единицы р. Н, т. к. соотношение концентраций двух форм, необходимое для наблюдения изменения окраски индикатора, [Ind–]/[HInd] не всегда равно 10 и зависит от природы индикатора м/о p. H = 3, 2 – 4, 4 красная – желтая м/к p. H = 4, 2 – 6, 2 красная – желтая ф/ф p. H = 8, 2 – 10, 0 бесцветная – малиновая 15
Индикаторы часто характеризуют не интервалом перехода окраски индикатора, а показателем титрования р. Т – это значение р. Н, при котором наиболее резко происходит изменение окраски индикатора. м/о p. H = 3, 2 – 4, 4 м/к p. H = 4, 2 – 6, 2 ф/ф p. H = 8, 2 – 10, 0 р. Т = 4, 0 р. Т = 5, 5 р. Т = 9, 0 16
Классификация кислотно-основных индикаторов: 1. По строению: — трифенилметановые индикаторы (ф/ф, ф/к) — нитроиндикаторы (о-, м-, п-нитрофенолы) — других структурных типов (лакмус, индофенол, нейтральный красный и др. ) 2. По способу применения: — внутренние (ф/ф, ф/к, м/о, т/ф и др. ) — внешние ( лакмусовая бумага /красная, нейтральная, синяя/, куркумовая бумага, ф/ф бумага) 17
3. По составу: — индивидуальные: (фенолфталеин, метиловый оранжевый и др. ) — смешанные (более резкое изменение окраски): * смесь двух индикаторов (фенолфталеин + тимолфталеин) * смесь индикатора с красителем (фенолфталеин + метиленовый синий) 4. По цветности: одноцветные (ф/ф), двухцветные (м/о) 18
Кривые кислотно-основного титрования Отображают графическую зависимость р. Н титруемого раствора от объема прибавленного титранта или от степени оттитрованности Анализ кривой титрования позволяет подобрать оптимальные условия титрования (концентрация реагентов, индикатор) 19
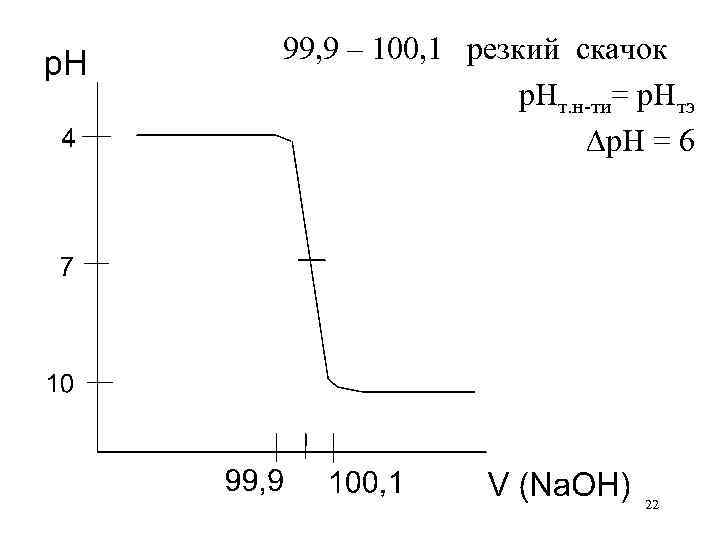
Расчет, построение и анализ кривой титрования сильной кислоты сильным основанием HCl + Na. OH Na. Cl + H 2 O C(HCl) = C(Na. OH) = 0, 1 M Изменением объема пренебрегаем до ТЭ : р. Н = –lg. Cк-ты ТЭ: р. Н = 7 после ТЭ: р. Н = 14 + lg. Сосн 20
Доб Отт. Ост-к щ. к. % 0 0 100 90 90 10 99 99 1 99, 9 0, 1 100 — изб-к щ. % 100, 1 — 101 — 110 — 0, 1 1 10 Конц к-ты С 10– 1 С 10– 2 С 10– 3 С — р. Н р-ра –lg. C –lg 10– 1 С –lg 10– 2 С –lg 10– 3 С — р. Н С=0, 1 М –lg 10– 1=1 –lg 10– 2=2 –lg 10– 3=3 –lg 10– 4=4 7 конц. щ. 10– 3 С 14+lg 10– 4=10 10– 2 С 14+lg 10– 3=11 10– 1 С 14+lg 10– 2=12 21
99, 9 – 100, 1 резкий скачок р. Нт. н-ти= р. Нтэ р. Н = 6 22
От чего зависит скачок титрования? p. H = р. Н 100, 1 – р. Н 99, 9 = 14+lg 10– 3 С – (–lg 10– 3 С) = = 14 – 3 + lg. C = 8 + 2 lg. C Скачок зависит от: — Температуры (с увеличением tо р. Кводы уменьшается, скачок уменьшается) — Концентрации (с уменьшением концентрации скачок уменьшается) 23
Как зависит скачок титрования от концентрации? p. H = 8 + 2 lg. C С моль/л 1 p. H 8 0, 1 8– 2=6 0, 01 8– 4=4 0, 001 8– 6=2 0, 0001 8– 8=0 24
Выбор индикатора м/о 3, 2 – 4, 4 (р. Т=4, 0) ф/ф 8, 2 – 10, 0 (р. Т= 9, 0) Интервал перехода окраски индикатора p. H должен ложиться на вертикальный участок 25
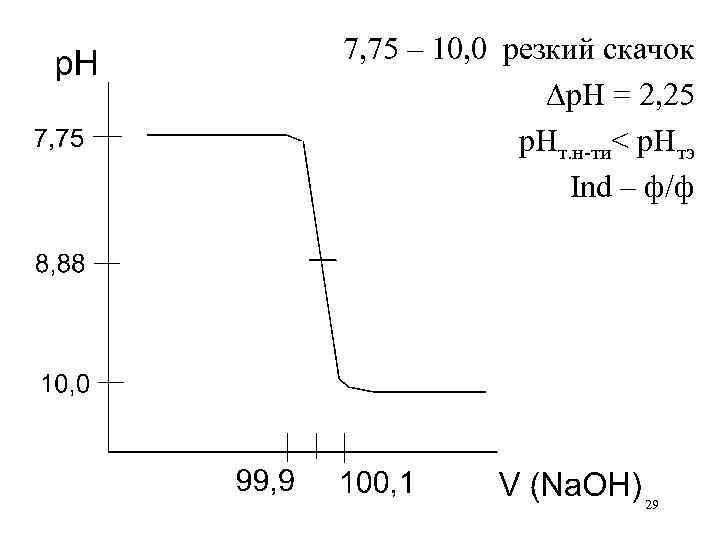
Расчет, построение и анализ кривой титрования слабой кислоты сильным основанием CH 3 COOH + Na. OH CH 3 COONa + H 2 O C(HA) = C(BOH) = 0, 1 M p. K(CH 3 COOH) = 4, 76 Изменением объема пренебрегаем В начальный момент: слабая кислота р. Н = ½ p. Kк-ты – ½ lg. Cк-ты 26
До ТЭ: слабая кислота и ее соль Ссоли р. Н = p. Kк-ты + lg——— Ск-ты ТЭ: соль сильного основания и слабой кислоты р. Н = 7 + ½ p. Kк-ты + ½ lg. Cсоли За ТЭ: избыток щелочи и соль (гидролиз подавляется) р. Н = 14 + lg. Сосн 27
Доб. Отт-но Конц. Ссоли —— щел. к-ты, % к-ты соли Ск-ты — — С 90 90 10– 1 С 9· 10– 1 С 9 10 р. Кк+lg 10 5, 75 99 99 10– 2 С 99· 10– 2 С 99 102 р. Кк+lg 102 6, 75 99, 9 10– 3 С 999· 10– 2 С 999 103 р. Кк+lg 103 7, 75 — ½p. Kк– ½lg. Cк р. Н С=0, 1 0 100 — р. Н р-ра 2, 88 — изб-к щ. % 100, 1 — 0, 1 С конц. щ. 10– 3 С 7+½p. Kк+ ½lg. Cс 8, 88 — 14+lg 10– 3 С 10 101 — 1 10– 2 С — 14+lg 10– 2 С 11 110 — 10 10– 1 С — 14+lg 10– 1 С 12 28
7, 75 – 10, 0 резкий скачок р. Н = 2, 25 р. Нт. н-ти< р. Нтэ Ind – ф/ф 29
От чего зависит скачок титрования? p. H=р. Н 100, 1– р. Н 99, 9=14+lg 10– 3 С – (р. Кк + lg 103) = = 14 – 3 + lg. C – р. Кк– 3 = 8 + lg. C – р. Кк Скачок зависит от: — Температуры (с увеличением tо р. Кводы уменьшается, скачок уменьшается) — Концентрации (с уменьшением концентрации скачок уменьшается) — Природы кислоты (чем слабее кислота, тем меньше скачок) 30
Как зависит скачок титрования от силы кислоты? p. H = 8 + lg. C – р. Кк С = 0, 1 моль/л p. H = 7 – р. Кк Если р. Кк 7 p. H = 0 скачка не будет, и нельзя подобрать индикатор 31
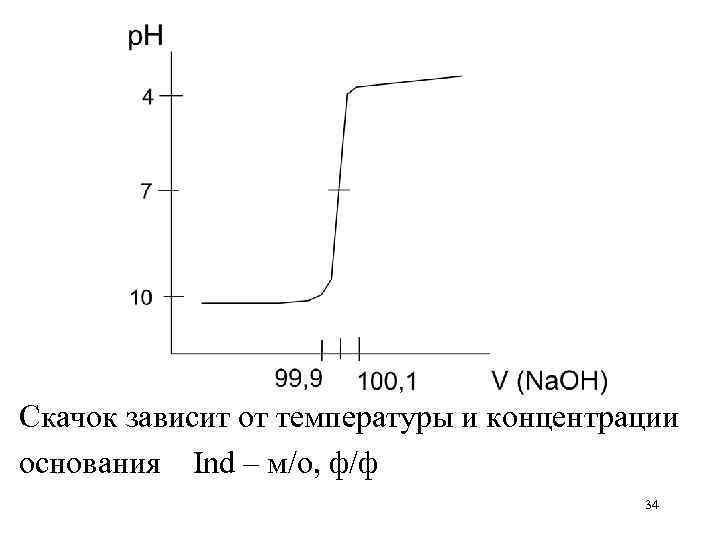
Расчет, построение и анализ кривой титрования сильного основания сильной кислотой Na. OH + HCl Na. Cl + H 2 O C(Na. OH) = C(HCl) = 0, 1 M Изменением объема пренебрегаем до ТЭ : р. Н = 14 + lg. Сосн ТЭ: р. Н = 7 после ТЭ: р. Н = –lg. Cк-ты 32
Доб к. Отт. щ. % 0 0 90 90 99 99 99, 9 100 100, 1 — 101 — 110 — Ост-к щ. % Конц щ-чи 100 С 10 10– 1 С 1 10– 2 С 0, 1 10– 3 С — — изб-к конц. к. % к. 0, 1 10– 3 С 1 10– 2 С 10 10– 1 С р. Н р-ра р. Н С=0, 1 М 14+lg. C 14+lg 10– 1 С 14+lg 10– 2 С 14+lg 10– 3 С — 13 12 11 10 7 –lg 10– 3 С –lg 10– 2 С –lg 10– 1 С 4 3 2 33
Скачок зависит от температуры и концентрации основания Ind – м/о, ф/ф 34
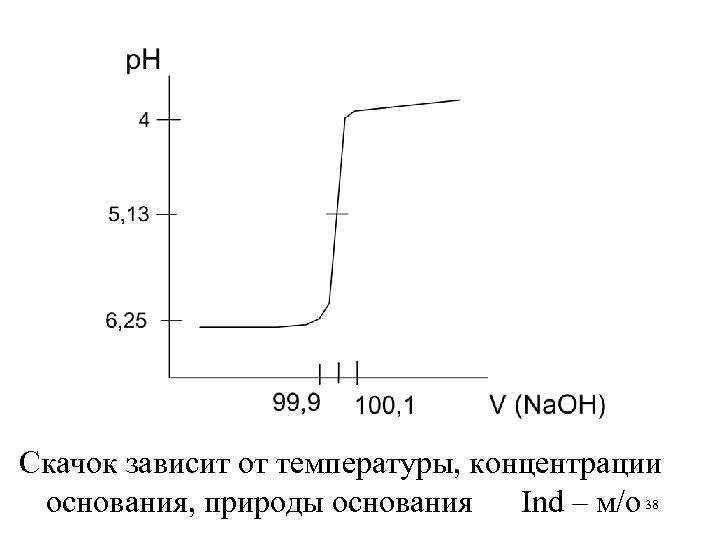
Расчет, построение и анализ кривой титрования слабого основания сильной кислотой NH 4 OH + HCl NH 4 Cl + H 2 O C(NH 4 OH) = C(HCl) = 0, 1 M р. К(NH 4 OH)=4, 75 Изменением объема пренебрегаем В начальный момент: слабое основание р. Н =14 – ½ p. Kосн + ½ lg. Cосн 35
До ТЭ: слабое основание и его соль Ссоли р. Н =14 – p. Kосн – lg——— Сосн ТЭ: соль сильной кислоты и слабого основания р. Н = 7 – ½ p. Kосн – ½ lg. Cсоли За ТЭ: избыток кислоты и соль (гидролиз подавляется) р. Н = – lg. Ск-ты 36
Доб. Отт-но Конц. Ссоли —— К-ты. осн, % осн соли Сосн 0 — С 90 90 10– 1 С 99 99 10– 2 С — 9· 10– 1 С — р. Н р-ра р. Н С=0, 1 14–½p. Kо+½lg. Cо 12, 13 9 10 14–р. Ко–lg 10 8, 25 99· 10– 2 С 99 102 14–р. Ко–lg 102 7, 25 99, 9 10– 3 С 999· 10– 2 С 999 103 14–р. Ко– lg 103 6, 25 100 — изб-к к. % 100, 1 — 0, 1 С конц. к. 10– 3 С 101 — 1 110 — 7–½p. Kо–½lg. Cс 5, 13 — –lg 10– 3 С 4 10– 2 С — –lg 10– 2 С 3 10– 1 С — –lg 10– 1 С 37 2
Скачок зависит от температуры, концентрации основания, природы основания Ind – м/о 38
Расчетные формулы р. Н при титровании слабой двухосновной к-ты сильным основанием H 2 SO 3 + 2 Na. OH Na 2 SO 3 + H 2 O Нач: H 2 SO 3 р. Н = ½ p. K 1 к-ты – ½ lg. Cк-ты До 1 ТЭ: H 2 SO 3 + Na. HSO 3 1 ТЭ: Na. HSO 3 Ссоли р. Н = p. K 1 к-ты + lg——— Ск-ты p. K 1 к-ты + p. K 2 к-ты р. Н = ——————— 2 39
До 2 ТЭ: Na. HSO 3 + Na 2 SO 3 Ссоли р. Н = p. K 2 к-ты + lg——— Ск-ты 2 ТЭ: Na 2 SO 3 р. Н = 7 + ½ p. K 2 к-ты + ½ lg. Cсоли За 2 ТЭ: щелочь + соль р. Н = 14 + lg. Сосн 40
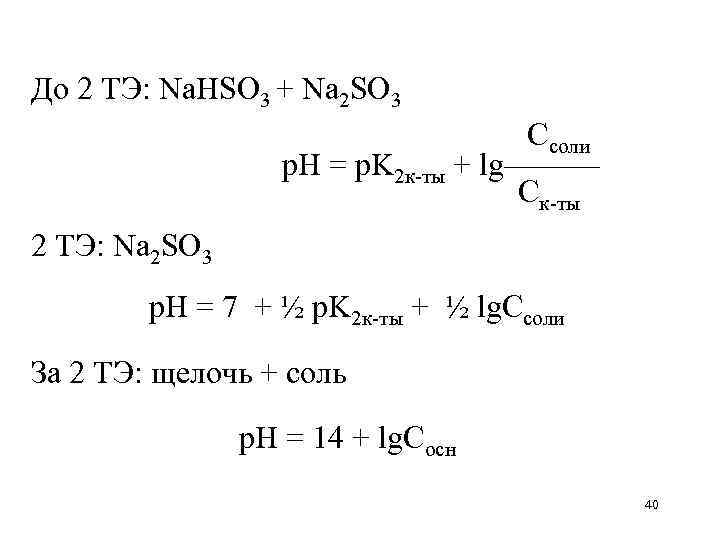
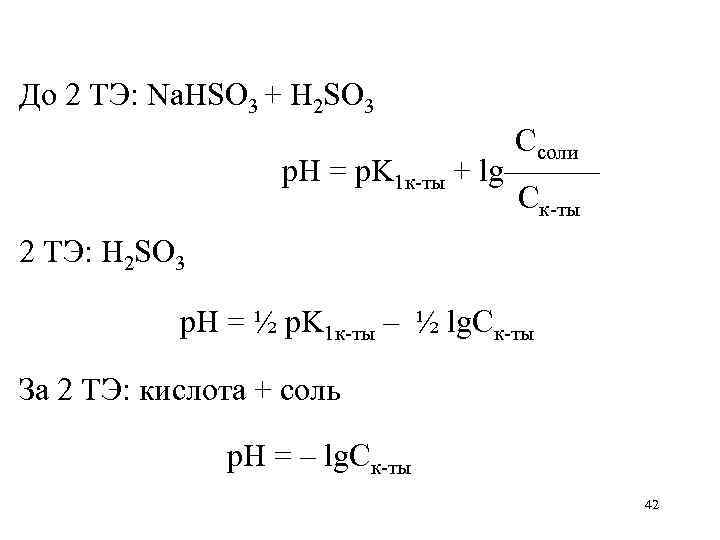
Расчетные формулы р. Н при титровании соли слабой двухосновной к-ты сильной кислотой Na 2 SO 3 + 2 HCl H 2 SO 3 + 2 Na. Cl Нач: Na 2 SO 3 р. Н = ½ p. K 1 к-ты – ½ lg. Cк-ты До 1 ТЭ: Na 2 SO 3 + Na. HSO 3 1 ТЭ: Na. HSO 3 Ссоли р. Н = p. K 2 к-ты + lg——— Ск-ты p. K 1 к-ты + p. K 2 к-ты р. Н = ——————— 2 41
До 2 ТЭ: Na. HSO 3 + H 2 SO 3 Ссоли р. Н = p. K 1 к-ты + lg——— Ск-ты 2 ТЭ: H 2 SO 3 р. Н = ½ p. K 1 к-ты – ½ lg. Cк-ты За 2 ТЭ: кислота + соль р. Н = – lg. Ск-ты 42
Индикаторные ошибки кислотно-основного титрования Индикаторные ошибки обусловлены несовпадением р. Н конца титрования (р. ТInd) и р. Н точки эквивалентности 43
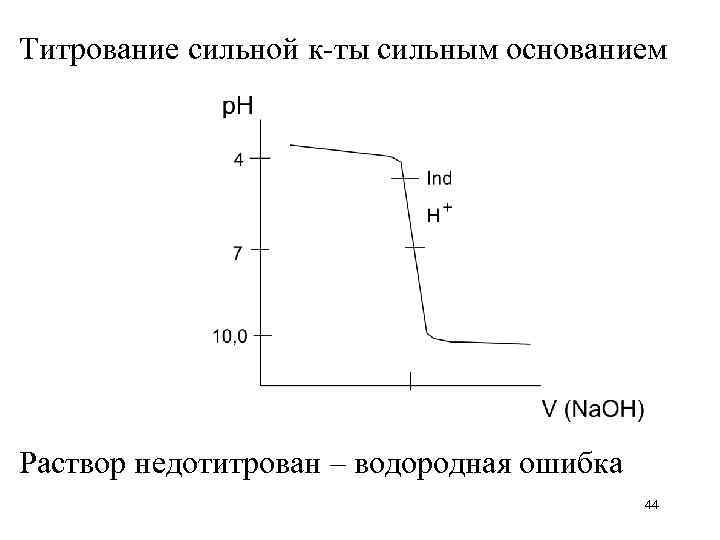
Титрование сильной к-ты сильным основанием Раствор недотитрован – водородная ошибка 44
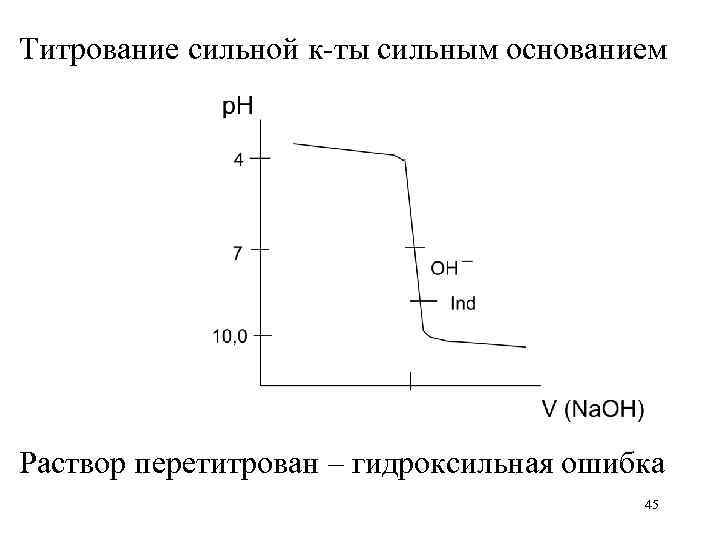
Титрование сильной к-ты сильным основанием Раствор перетитрован – гидроксильная ошибка 45
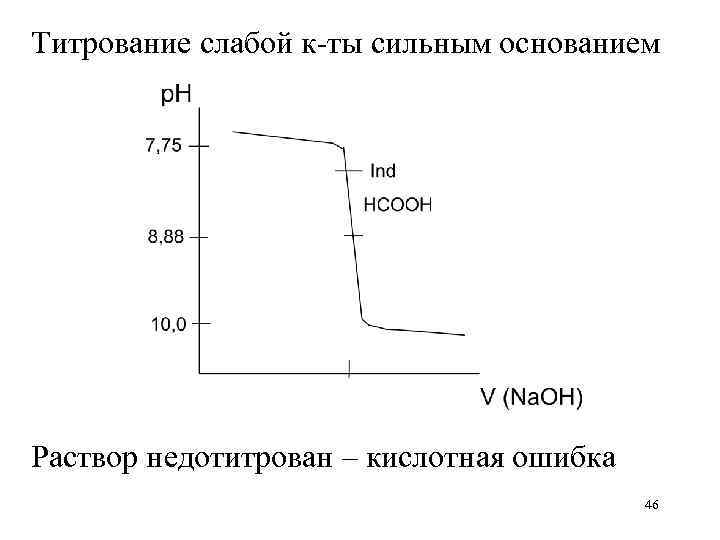
Титрование слабой к-ты сильным основанием Раствор недотитрован – кислотная ошибка 46
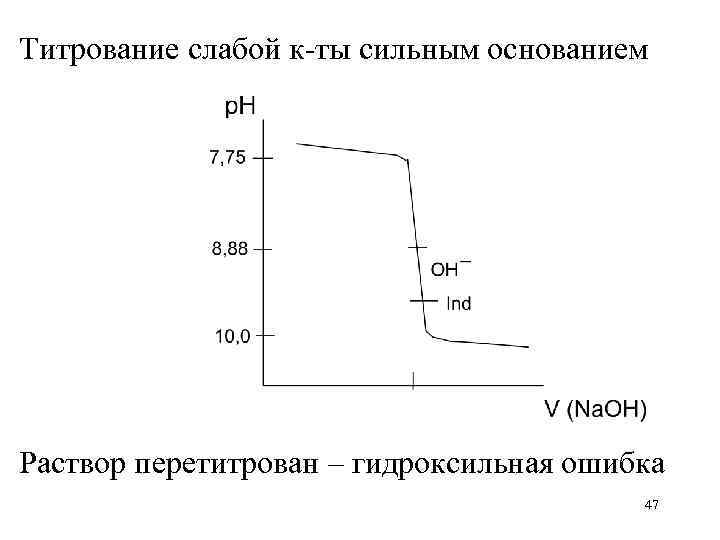
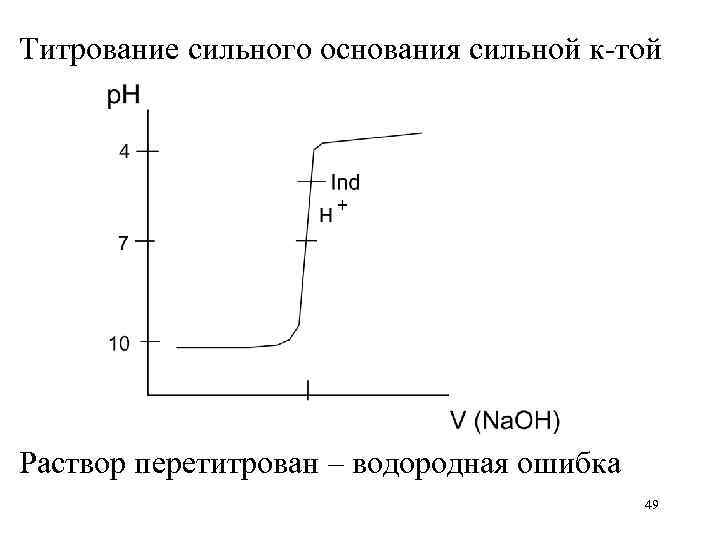
Титрование слабой к-ты сильным основанием Раствор перетитрован – гидроксильная ошибка 47
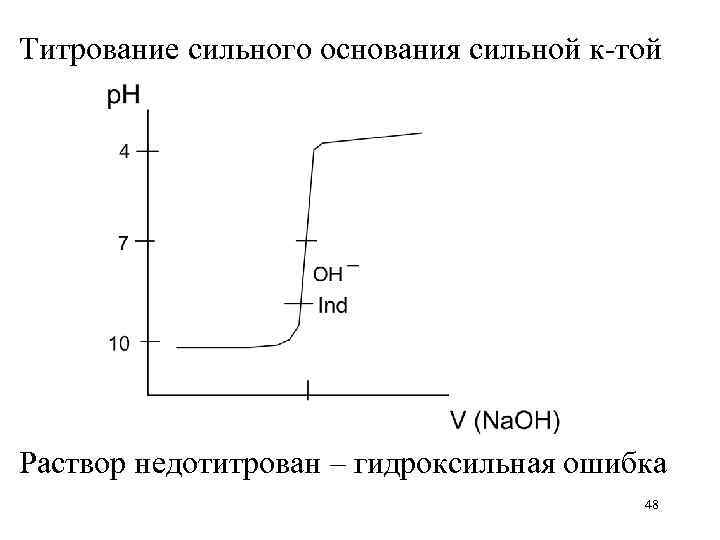
Титрование сильного основания сильной к-той Раствор недотитрован – гидроксильная ошибка 48
Титрование сильного основания сильной к-той Раствор перетитрован – водородная ошибка 49
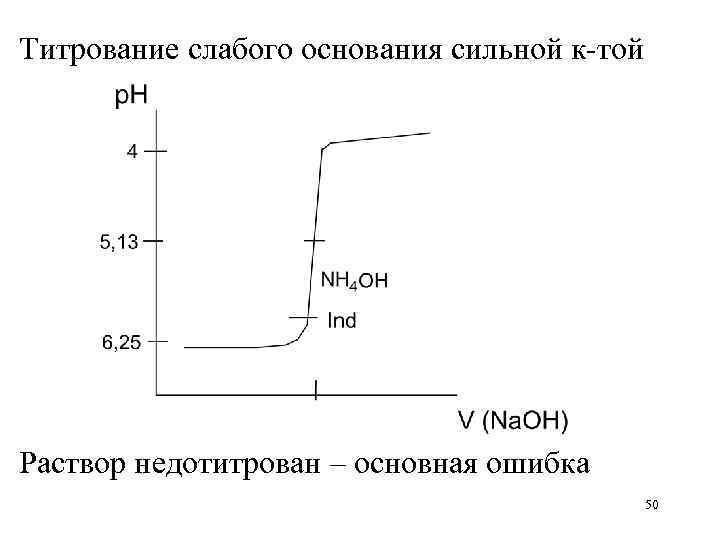
Титрование слабого основания сильной к-той Раствор недотитрован – основная ошибка 50
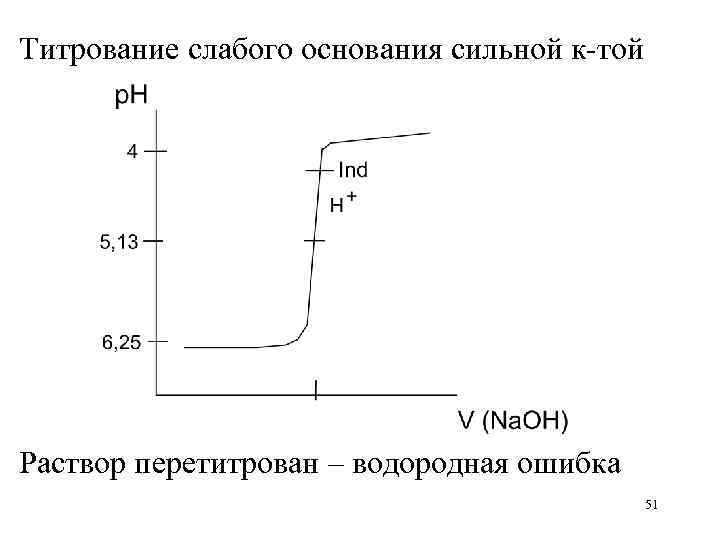
Титрование слабого основания сильной к-той Раствор перетитрован – водородная ошибка 51
52










![HInd кислая красная H+ + Ind– основная желтая [H+] · [Ind–] KInd = —————— HInd кислая красная H+ + Ind– основная желтая [H+] · [Ind–] KInd = ——————](https://present5.com/presentation/3/139200531_169966084.pdf-img/139200531_169966084.pdf-12.jpg)
![[H+] [HInd] = KInd · ——— [Ind–] p. H = p. KInd + lg [H+] [HInd] = KInd · ——— [Ind–] p. H = p. KInd + lg](https://present5.com/presentation/3/139200531_169966084.pdf-img/139200531_169966084.pdf-13.jpg)
![[Ind–]/[HInd] 10 – наблюдается окраска основной формы [Ind–] (желтая) p. H = p. KInd [Ind–]/[HInd] 10 – наблюдается окраска основной формы [Ind–] (желтая) p. H = p. KInd](https://present5.com/presentation/3/139200531_169966084.pdf-img/139200531_169966084.pdf-14.jpg)