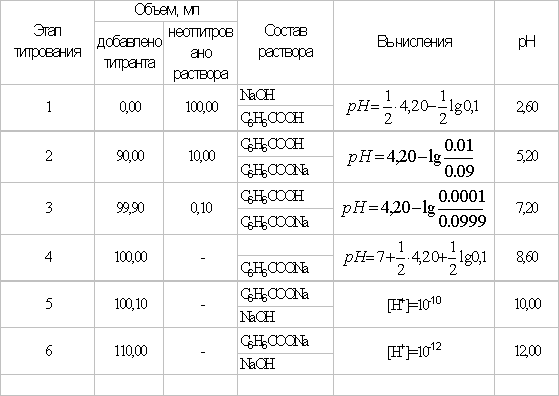
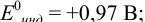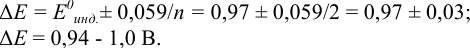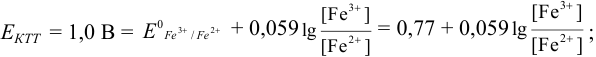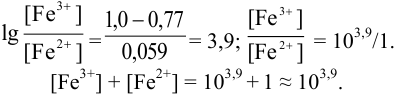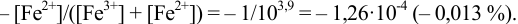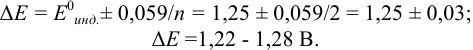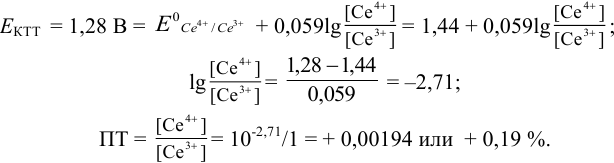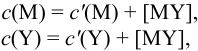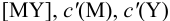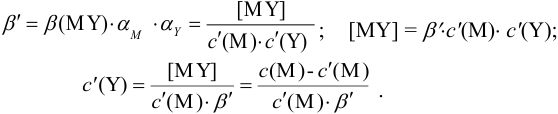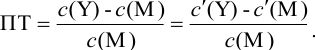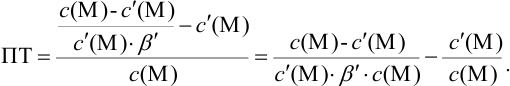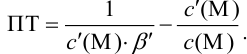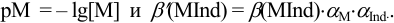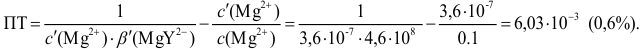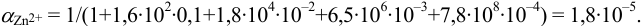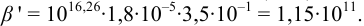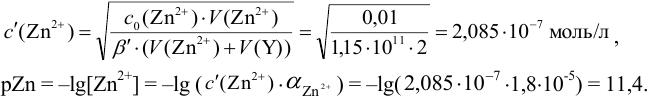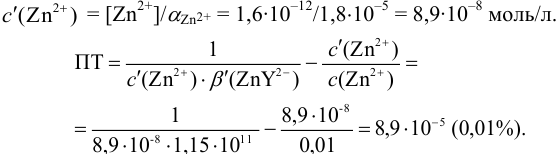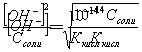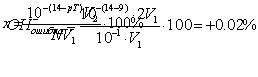Индикаторные погрешности титрования
Индикаторная погрешность вызвана
несовпадением конечной точки титрования
с точкой эквивалентности.
Общий вид форму для расчета ПТ такой
же, как и в кислотно-основном титровании:
или
Знак “+” означает, что раствор
перетитрован, “–” – что недотитрован.
Рассмотрим случай, когда раствор будет
недотитрован, т.е. f
< 1. Получится, что значение потенциала
в КТТ меньше, чем значение в ТЭ.
,
т.е. потенциал в КТТ будет определяться
по этой формуле, он будет равен значению
показателя титрования
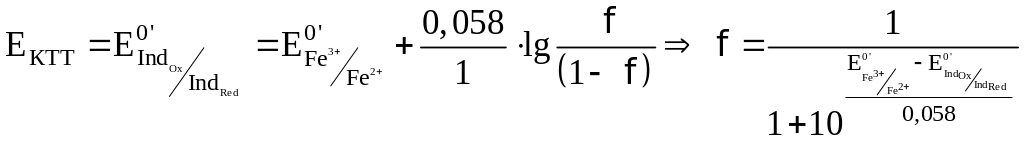
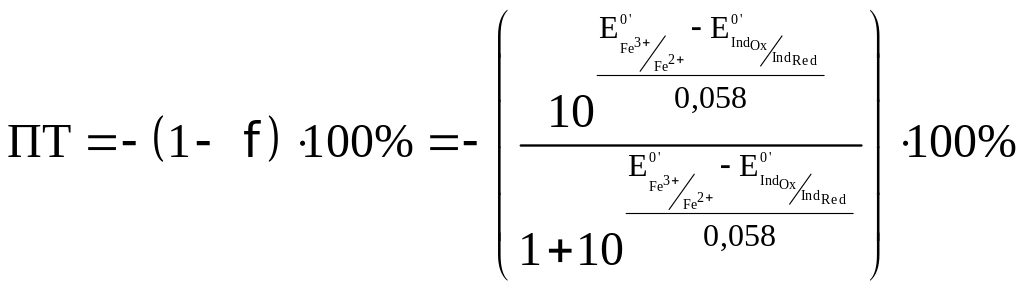
Подставим вместо
значение
для дифениламина (0,75 В) для двух случаев
– с H3PO4
и без нее.
— без H3PO4.
— с участием H3PO4,
что как раз удовлетворяет нашему условию.
Подсчитаем то же самое для дифениламинсульфонат
натрия или бария:
— без H3PO4
— с H3PO4
– еще более удовлетворяет нашей
задаче, причем можно даже не добавлять
в раствор фосфорную кислоту.
Для N-фенилантраниловой
кислоты ПТ и вовсе имеет еще более низкие
значения.
Т.е., из всех предложенных наиболее
подходящим является последний индикатор.
Выводы
По кривой титрования железа(II)
можно сделать ряд выводов.
В ходе титрования заметно плавное
уменьшение значений E и
заметен скачок в области точки
эквивалентности.
Точка эквивалентности расположена при
E 1,25 В, причем при
использовании защитной смеси с добавлением
фосфорной кислоты он уменьшается до
1,24 В. Скачок титрования 0,1 М железа(II)
в пределах ±0,1% от точки эквивалентности
находится в пределах значений E
от 0,85 до 1,31 В и составляет 0,46 В, причем
при добавлении защитной смеси он
увеличивается. Теперь он уже лежит в
пределах значений от 0,77 В до 1,31 В и
составляет примерно 0,54 В, что больше
скачка титрования того же раствора
железа(II), но уже без
защитной смеси.
Для определения конечной точки титрования
железа(II) методом
бихроматометрии используют редокс-индикаторы
такие как, дифениламин, N-фенилантраниловая
кислота и другие производные дифениламина.
Причем в некоторых случаях уже можно
будет обходиться без добавления в
титруемый раствор фосфорной кислоты.
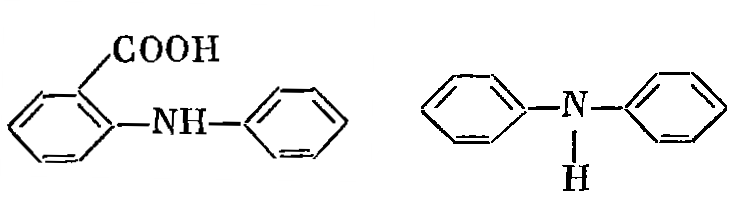
Рисунок
4. Редокс-индикаторы N-фенилантраниловая
кислота и дифениламин
Литература
-
Ю.А Золотов, Е.Н.Дорохова, В.И.Фадеева и
др.; под ред. Ю.А.Золотова. – Основы
аналитической химии: Кн. 2. Методы
химического анализа. – М.: Высш. шк.,
1996. – 461 с. -
В.П.Васильев. – Аналитическая химия:
Кн. 1: Титриметрические и гравиметрический
методы анализа. – М.: Дрофа, 2004. – 368 с. -
А.Т.Пилипенко, И.В.Пятницкий. –
Аналитическая химия: кн. 1. – М.: Химия,
1990. – 480 с. -
Ф.Х.Кудашева, Е.С.Кручкова, А.В.Сидельников.
– Расчет кривых титрования по степени
оттитрованности. Методические указания.
– Уфа: Изд-е Башкирского ун-та, 2002. – 36
с. -
Ф.Х.Кудашева, Е.С.Кручкова, В.М.Пухова,
Г.Б.Боголюк, Р.Н.Ширяева, А.В.Сидельников.
– Справочное пособие по аналитической
химии. – Уфа: Изд-е Башкирского ун-та,
2001. – 60 с.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
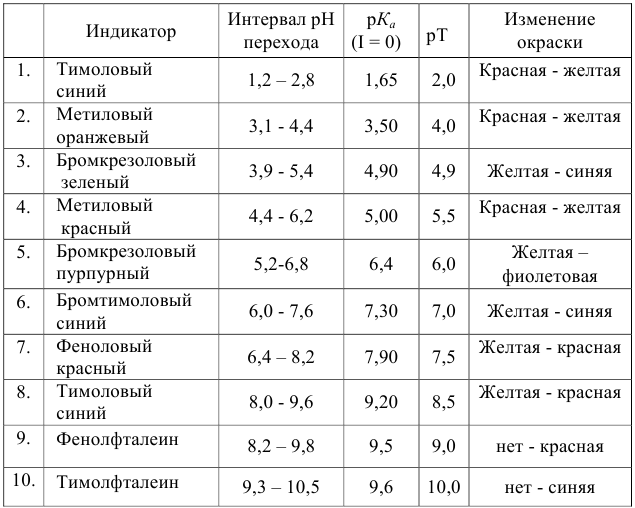
Расчет индикаторных погрешностей кислотно-основного титрования
Согласно ионно-хромофорной теории индикаторов, интервал перехода окраски индикатора 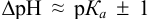
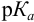
Таблица 8.12
Важнейшие кислотно-основные индикаторы
При правильно выбранном индикаторе индикаторная ПТ не должна превышать заданную погрешность измерения объема раствора в титриметрии. Типы (виды) индикаторных ПТ кислотно-осиовиого титрования и названия, встречающиеся в разных учебниках и сборниках задач, происхождение погрешностей и формулы для расчета приведены в табл. 8.13. Формулы легко выводятся из определения погрешности титрования как отношения недотитро-ванного или перетитрованного количества кислоты или основания к первоначально взятому для титрования (то есть к произведению 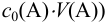
Таблица 8.13
Индикаторные погрешности кислотно-основного титрования
Пример 8.28.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании а) 
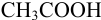
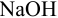
Решение:
а). Как следует из табл. 8.4 и рис. 8.1(1), для случая титрования 

Однако используемые для расчета ПТ формулы показывают, что чем ближе рТ и 

Рассчитаем величину ПТ с двумя индикаторами: с рТ < 

С индикатором метиловым красным (рТ 5,5 < 
С индикатором фенолфталеином (рТ 9,0 > 
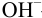
В данном случае оба индикатора пригодны, поскольку вычисленные значения ПТ не превышают заданную погрешность титрования (0,4%), но с метиловым красным систематическая индикаторная погрешность меньше.
б). При титровании 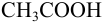



Например, при выборе фенолфталеина (рТ = 9,0):
а при выборе тимолфталеина (рТ = 10,0) погрешность возрастает в 10 раз:
Выбор фенолфталеина приводит к меньшей индикаторной погрешности титрования 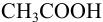
При титровании с индикаторами, для которых рТ < рНтэ, в растворе остается неоттитрованная слабая кислота, т. е. присутствует НА-ошибка (кислотная) со знаком «-» (см. табл. 8.13). Если использовать индикатор бромтимоловый синий (рТ 7,0), то вычисленная ПТ не удовлетворяет заданной точности, индикатор не пригоден:
или при проведении расчета по приближенной формуле:
Пример 8.29.
Какой индикатор позволяет оттитровать 0,1000 М гидразин 

Решение:
Реакция титрования:
приводит к образованию слабой сопряженной кислоты 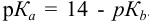
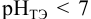
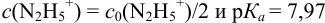
Сравнивая рТ индикаторов и 
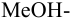
и с метиловым красным (рТ 5,5):
Из предложенных индикаторов метиловый красный позволяет провести титрование гидразина с меньшей погрешностью.
Расчет индикаторных погрешностей окислительно-восстановительного титрования
При использовании окислительно-восстановительных (редокс) индикаторов потенциал в ТЭ 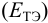

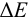
Таблица 8.14
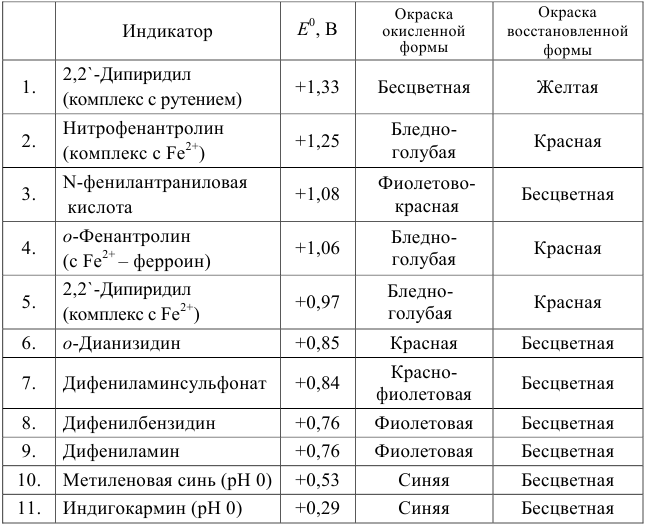
Примеры распространенных окислительно-восстановительных индикаторов
Полуреакция восстановления и интервал перехода индикатора:
Наиболее часто в полуреакции восстановления (окисления) индикатора участвуют 2 электрона. Для индикаторов №1 — №6 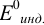
- сравнить
для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.
Например, если 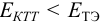
Сумма числителя и знаменателя здесь составляет 100 % титруемого вещества. Индикатор считается пригодным, если ПТ не превышает 0,1 -0,2%.
Пример 8.30.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании раствора соли 

Решение:
Как следует из табл. 8.8 и рис. 8.3 (кривая 1, пример 8.25), область скачка (при относительной погрешности измерения объема 0,1 %) на кривой титрования 0,95 — 1,26 В, а 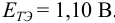
Выберем для рассмотрения порядка расчета два индикатора:
а) с 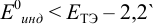
б) с 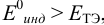
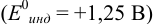
В случае а) интервал перехода индикатора:
Изменение окраски заканчивается при 



Тогда: ПТ =
В случае б) интервал перехода индикатора нитрофенантролина в виде комплекса с 
Изменение окраски заканчивается при 

Тогда количество 

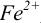
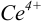
Таким образом, оба выбранных индикатора оказались приемлемыми.
Расчет индикаторных погрешностей комплексонометрического титрования
В конечной точке титрования общие концентрации определяемого иона с(М) и титранта c(Y) можно представить выражениями {для упрощения записи в общем виде упустим заряды ионов):
где 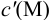
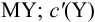
Условные константы устойчивости (см. выражение 8.16) связывают
Отсюда относительная погрешность титрования (ПТ) определяется выражением (с учетом (8.18) и (8.19)):
Подставляем в это уравнение выражение для 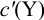
Вблизи ТЭ 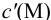
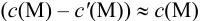
следовательно:
Выражение (8.21) тождественно выражению: 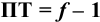
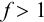
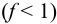
Конечная точка титрования определяется интервалом перехода окраски индикатора (интервалом рМ, в котором индикатор меняет свою окраску):
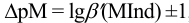
Интервал перехода окраски 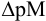
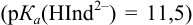
Пример 8.31.
Рассчитайте погрешность титрования 0,1 ОМ раствора 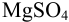

Решение:
В данных условиях 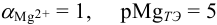
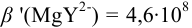
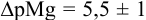
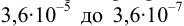

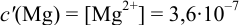
Погрешность титрования 
Пример 8.32.
Докажите возможность использования индикатора эриохром черный Т для титрования 0,010 М раствора 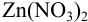

Решение:
1. Рассчитаем условную константу 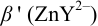
Общие константы устойчивости для аммиачных комплексов 
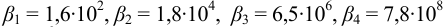

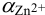
По табл. 7 и табл. 4 приложения находим 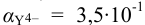
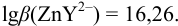

В точке эквивалентности:
Интервал перехода окраски индикатора эриохром черный Т в случае титрования ионов цинка при pH 10: 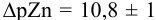
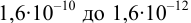

2. Конечная точка титрования наступает при [
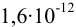

Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:
Тетриметрия
Тетриметрия
Содержание:
1. Основные понятия тетриметрии:
1.1 Сущность титрования;
1.2 Стандартные растворы;
1.3 Кривые титрования;
1.4 Индикаторы.
2. Кислотно-основное титрование:
2.1 Расчеты рН;
2.2 Таблица;
2.3 Кривая титрования;
2.4 Погрешности титрования;
2.5 Выводы;
3. Используемая литература.
Основные понятия тетриметрии.
Сущность титрования.
Процесс приливания одного раствора, находящегося в бюретке, к другому раствору для определения концентрации одного
из них при известной концентрации другого называется титрованием.
Взаимодействие между определенным веществом и реактивом должно идти в определенных стехиометрических отношениях. Отклонение
от этого требования наблюдается в ряде случаев; чаще всего причиной этих ограничений являются следующие обстоятельства:
1. Особенности самого определяемого вещества, которое взаимодействует с реактивом не только по одному уравнению основной реакции, то
есть наряду с основной реакцией идут побочные процессы.
2. Присутствие посторонних веществ, которые также реагируют с другим реактивом.
Реакция между определяемым веществом и реактивом должна идти с большей скоростью, что особенно важно в прямом
титровании.
Одно из важных условий применения реакции – найти подходящий индикатор для определения конца титрования.
Стандартные растворы.
Стандартными растворами называются растворы с точно известной концентрацией. Существует два способа их приготовления:
1. Берут на аналитических весах точную навеску соответствующего вещества, растворяют ее в мерной колбе и доводят объем
раствора водой до метки. Этим способом можно готовить титрованные растворы только тех веществ, которые удовлетворяют ряду требований:
1.1 Вещество должно быть химически чистым, т.е. не должно содержать посторонних примесей в
таких количествах, которые могут повлиять на точность анализов (не более 0,05-0,1%).
1.2 Состав вещества должен строго соответствовать формуле. Например, кристаллогидраты должны содержать ровно
столько воды, сколько соответствует их формулам.
1.3 Вещество должно быть устойчивым при хранении и в твердом виде и в растворе, т.к. иначе
легко нарушилось бы соответствие состава формуле.
2. Если вещество не удовлетворяет перечисленным выше требованиям , то сначала готовят раствор его приблизительно нужной молярности.
Параллельно с этим готовят также стандартный раствор какого-нибудь подходящего исходного вещества, как описано выше. Далее, оттитровав один из указанных
растворов другим и зная концентрацию раствора исходного вещества, вычисляют точную концентрацию раствора данного
вещества.
Кривые титрования.
Кривые титрования являются графическим изображением изменений рН раствора при постепенном прибавлении
рабочего раствора к определенному количеству испытуемого раствора. На оси абсцисс записывают количество прибавленного рабочего раствора, а на оси ординат
– значение рН раствора. Отдельные точки кривой титрования рассчитывают по обычным формулам для вычисления рН растворов соответствующих электролитов.
Индикаторы.
При титровании необходимо установить количество рабочего раствора, эквивалентное количеству
определяемого вещества. Для этой цели к исследуемому раствору приливают постепенно титрант до тех пор, пока не будет достигнуто эквивалентное
отношение. Этот момент называется точкой эквивалентности. Признаком достижения точки эквивалентности служит приобретение раствором определенного
значения рН. Поэтому в качестве индикаторов метода нейтрализации служат вещества, окраска которых меняется в зависимости от изменения величины рН. К
ним относятся лакмус, метиловый оранжевый, фенолфталеин и многие другие вещества. Окраска каждого из них изменяется внутри определенного узкого
интервала значений рН, причем этот интервал зависит только от свойств данного индикатора и совершенно не зависит от природы реагирующих между собой кислоты и
основания. Благодаря этому перемена окраски индикатора происходит, как правило, не строго в точке эквивалентности, а с известным отклонением от нее. Такое
отклонение влечет за собой некоторую ошибку, называемую индикаторной ошибкой титрования. Величина этой ошибки может колебаться в весьма широких пределах
в зависимости от того, какой взят индикатор и какие основание и кислота реагируют между собой. При правильном выборе индикатора ошибка не выходит за
обычные пределы аналитических погрешностей и может во внимание не приниматься. Наоборот, если индикатор взят
неподходящий, ошибка окажется весьма значительной.
Момент титрования, когда индикатор изменяет свою окраску, называется точкой конца
титрования. Необходимо выбирать индикатор и условия титрования так, чтобы точка конца титрования совпадала с точкой эквивалентности или была, возможно,
ближе к ней.
Кислотно-основное титрование
Расчеты рН
При вычислении рН исходят из уравнения константы диссоциации слабой кислоты:
В начальный момент бензойная кислота в растворе
частично диссоциирована по уравнению:
откуда видно, что на каждый образующийся ион Н+
в растворе приходится один ион С6Н5СОО—. Следовательно, концентрации их равны:
Т.к. степень диссоциации бензойной кислоты очень
мала, можно принять, что:
где Скисл есть общая концентрация
бензойной кислоты в растворе, равная 0,1 М.
Учитывая это, из уравнения (1) получим:
и
Чтобы от [H+] перейти
к рН, прологарифмируем уравнение (2) и переменим знаки логарифмов на обратные. При этом получим:
или
Здесь рКкисл=-lgKкисл
представляет собой показатель индикатора, который равен:
Отсюда по формуле (3) находим:
Такова величина рН 0,1 м раствора бензойной кислоты, соответствующая начальной точке
рассматриваемой кривой титрования.
Вывод формул для вычисления промежуточных точек кривой титрования. Эти точки соответствуют моментам, когда оттитрована, т.е.
превращена в соль, только та или иная часть общего количества титруемой кислоты. Следовательно, раствор здесь содержит свободную слабую кислоту (С6Н5СООН)
и ее соль (С6Н5СООNa). Чтобы вычислить рН для таких растворов, решим
уравнение константы диссоциации бензойной кислоты относительно [H+]. При этом получим:
Но С6Н5СООН – слабая кислота и присутствует почти исключительно в виде недиссоциированных молекул С6Н5СООН.
Поэтому концентрацию последних можно без заметной погрешности принять равной общей концентрации кислоты в растворе:
С другой стороны, поскольку соль С6Н5СООNa диссоциирована нацело, а бензойная кислота
диссоциирована очень слабо, почти все имеющиеся в растворе анионы С6Н5СОО—
получены в результате диссоциации соли, причем каждая продиссоциировавшая молекула соли дает один анион С6Н5СОО—. Отсюда
следует, что концентрацию анионов можно принять равной общей концентрации соли:
Из этого уравнения получим:
Логарифмируя это уравнение и переменив знаки на обратные, получим:
откуда
Расчет для точки, когда прибавлена титранта 90
мл. 0,1 м NaОН:
Состав раствора: 10 мл. 0,1 м С6Н5СООН
90 мл. 0,1 м С6Н5СООNa
По формуле С1V1=C2V2 получим:
Особый практический интерес представляет область
скачка на кривой титрования. Она лежит в пределах значений рН от момента, когда оставалось 0,1 мл неоттитрованной свободной бензойной кислоты, до момента,
когда прибавлена 0,1 мл избытка щелочи.
Расчет для точки, когда прибавлена титранта 99,9 мл. 0,1 м NaОН:
Состав раствора: 0,1 мл. 0,1 м С6Н5СООН
99,9 мл. 0,1 м С6Н5СООNa
По формуле С1V1=C2V2 получим:
Вывод формул для вычисления рН в точке эквивалентности. В растворе присутствует соль С6Н5СООNa, которая частично гидролизирована по уравнению:
Применяя к этой обратимой реакции закон действия масс,
напишем:
Концентрацию воды можно считать практически постоянной:
Произведение К[H2O] представляет собой также постоянную величину, называемую константой гидролиза. Из выражения:
получим:
Подставив полученную величину [OH—] в уравнение Кгидр, получим:
Но дробь [C6H5COOH]/[C6H5COO—][H+] представляет собой величину, обратную Ккисл
; она равна 1/Ккисл. Следовательно, можно написать:
и
Согласно ионному уравнению реакции, при гидролизе на каждый образующийся ион OH— в растворе появляется одна молекула С6Н5СООН,
откуда:
В то же время, поскольку диссоциация С6Н5СООН
дает мало ионов С6Н5СОО— , можно принять, что:
Учитывая это, получим:
и
Логарифмируя и меняя у логарифмов знаки на обратные, находим:
и
Но рН=14-рОН. Отсюда окончательно находим
формулу для вычисления величины рН в точке эквивалентности:
Расчет для точки, когда прибавлена титранта
100,0 мл. 0,1 м NaОН:
Состав раствора: 0 мл. 0,1 м С6Н5СООН
100,0 мл. 0,1 м С6Н5СООNa
Вычисления рН для тех моментов титрования, когда
к раствору прибавлен избыток NaOH.
Расчет для точки, когда прибавлена титранта 100,1 мл. 0,1 м NaОН:
Состав раствора: 0,1 мл. 0,1 м NaOH
100,0 мл. 0,1 м С6Н5СООNa
т.к. NaOH – сильная щелочь, то [OH—]=C(NaOH).
C1V1=C2V2
Расчет для точки, когда прибавлена титранта 110,0 мл. 0,1 м NaОН:
Состав раствора: 10 мл. 0,1 м NaOH
100,0 мл. 0,1 м С6Н5СООNa
C1V1=C2V2
Таблица
Расчет кривой титрования.
Кривая титрования
При титровании бензойной кислоты, из индикаторов может быть применен только фенолфталеин, т.к.
константа диссоциации его равна 10-9, область перехода должна лежать между рН=8 и рН=10, что и наблюдается в действительности. При этом вплоть до
рН=8 будет наблюдаться окраска кислотной формы индикатора, т.е. раствор будет бесцветным, а начиная рН=10 – окраска щелочной формы, т.е. красная.
Индикаторная ошибка титрования
Индикаторная ошибка титрования представляет собой ту погрешность, которая обусловлена несовпадением показателя титрования
примененного индикатора с величиной рН в точке эквивалентности. Избыточное основание является сильным, оно обуславливает возникновение «гидроксильной
ошибки».
Всего взято на титрование NV1/100 ионов ОН—. Заканчивается титрование
при рН=рТ индикатора. Следовательно, по окончании титрования:
и в V2 мл раствора содержится:
ионов ОН—.
Отсюда NV1/1000 – 100% и:
Следовательно ОН— ошибка равна:
Применяя фенолфталеин, заканчивают титрование при рН=9, т.е. раствор бензойной
кислоты будет несколько перетитрован.
Выводы
1. Точка эквивалентности находится в области рН>7, (рН=8,60).
2. Скачок рН на кривой титрования находится в области от рН=7,20 (при 0,1 мл избытка кислоты) до рН=10
(при 0,1 мл избытка щелочи).
3. При титровании бензойной кислоты гидроксидом натрия с фенолфталеином происходит легко уловимый переход
окраски от бесцветной к розовой. Поэтому порядок титрования здесь не имеет такого значения, как при употреблении метилоранжа.
4. Чем слабее титруемая кислота, тем меньше скачок рН на кривой титрования. Слабая кислота создает
малую концентрацию [H+].
5. На величину скачка влияет ряд факторов:
А. Константа равновесия реакции
Б. Температура
В. Концентрация веществ
Г. Ионная сила раствора
Использованная литература
1. Ю.Ю. Лурье, Справочник по аналитической химии.-М: химия, 1989.
2. В.Н. Алексеев, Количественный анализ. –М: химия, 1972
3. Н.Н. Ушакова, Е.Р. Николаева, С.А. Моросанова, Пособие по аналитической химии: Количественный
анализ. –М: Изд.МГУ, 1981
4. А.К.Бабко, И.В. Пятницкий, Количественный анализ. –М: 1962
5. А.Т Пилипенко, И.В. Пятницкий, Аналитическая химия, т. 1,2 – М: химия, 1990
6. Ю.А. Золотов Основы аналитической химии. – М: Высшая школа, 2000

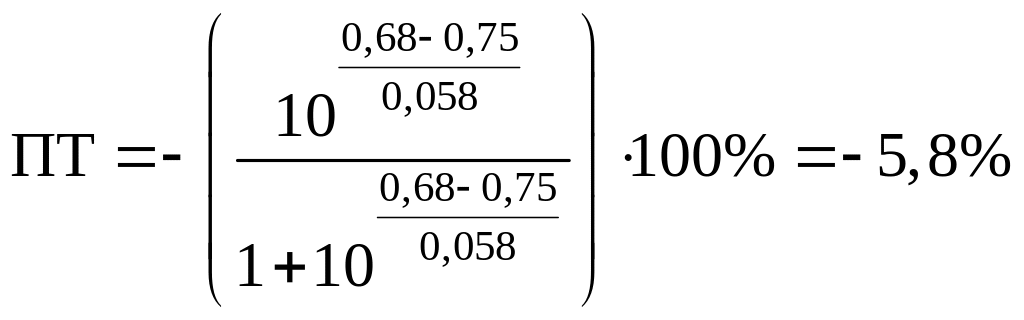
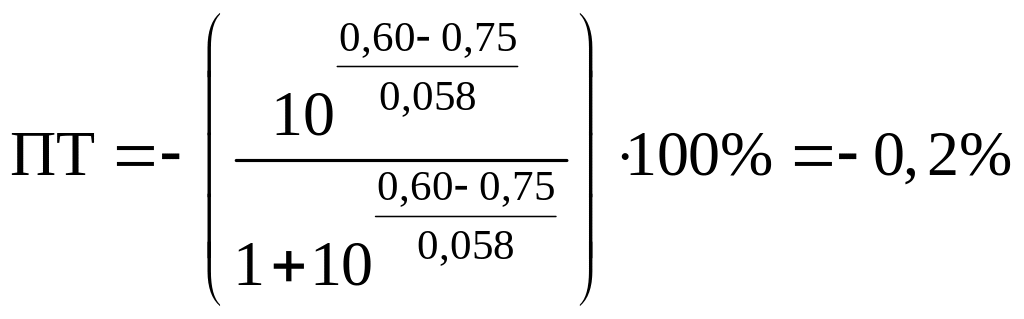
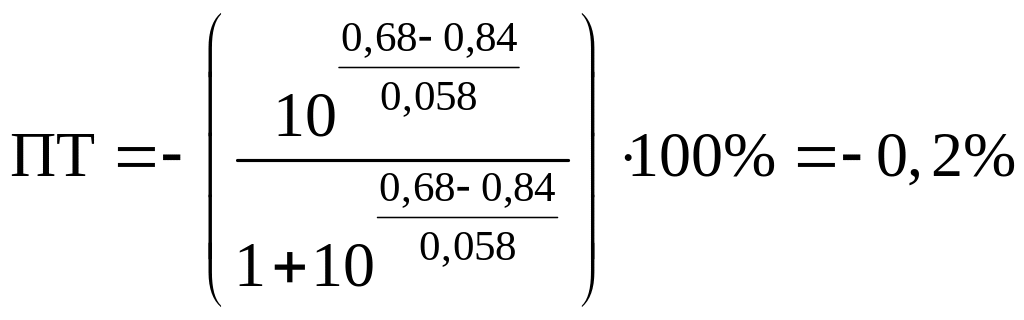
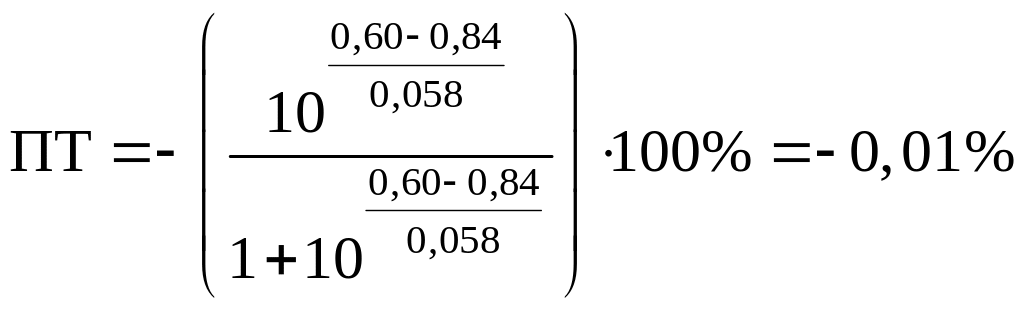


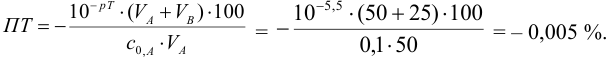
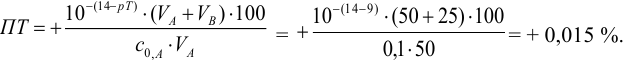
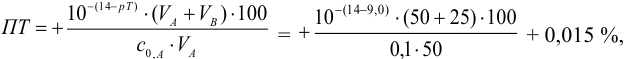
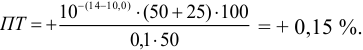
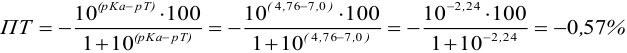
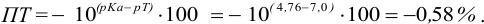
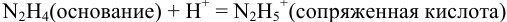
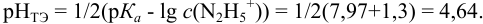
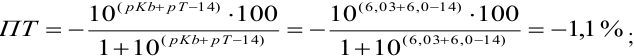
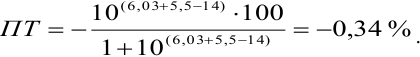

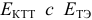 для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.
для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.