В протолитометрии
различают 4 вида индикаторных
ошибок: водородная, гидроксильная,
кислотная и основная.
-
Водородная
(Н+) ошибка
возникает при титровании сильных
электролитов (сильное – сильное)
и обусловлена избытком протонов в
растворе. Эта ошибка имеет место, если
сильная кислота
недотитрована, а сильное основание
– перетитровано. -
Гидроксильная
(ОН–) ошибка
также характерна для титрования
системы сильное – сильное и возникает
при избытке гидроксо—групп
в растворе. Сильная кислота при этом
будет перетитрована, а сильное
основание – недотитровано. -
Кислотная
ошибка проявляется при титровании
слабой кислоты сильным основанием,
в том случае, когда слабая кислота
недотитрована и в растворе избыток
протонов. -
Основная ошибка
характеризует систему слабое
основание
сильная кислота в момент, когда
слабое основание недотитровано, т.е.
при избытке в растворе гидроксо-групп.
Так как при
титровании слабых электролитов в
качестве титранта обычно используют
сильный электролит (щелочь или кислоту),
то в перетитрованном растворе
избыток титранта создает погрешность
1-го или 2-го типа: водородную или
гидроксильную ошибку.
Главным критерием
применимости того или иного индикатора
является значение индикаторной ошибки,
которая не должна превышать 0,5%. Если
погрешность выше, то такой индикатор
применять нельзя.
4.3. Методы и способы титрования. Титр, титр по определяемому веществу
Аналитическая
характеристика каждого титриметрического
метода включает наиболее существенные
его особенности: приготовление и свойства
рабочих растворов, виды кривых титрования,
погрешности определения, способы
индикации точки эквивалентности и
практическое применение. На основании
этого все методы титрования
классифицируют
по 2-м признакам: типу
реакции,
лежащей в основе
метода
и способу проведения анализа.
Каждый вид титрования имеет свои
особенности и закономерности и может
осуществляться различными способами.
Как видно из схемы (рис. 4.9), в зависимости
от типа
реакции,
лежащей в основе метода, различают 4-ре
вида
титрования:
-
кислотно-основное
или метод нейтрализации (протолитометрия); -
окислительно-восстановительное
(редоксиметрия); -
комплексометрическое;
-
осадительное
(метод седиментации).

Рисунок
4.9 – Классификация методов титрования
в соответствии с типом химической
реакции (где L
– комплексный ион; МеL
– образовавшийся комплекс; А – осаждаемое
вещество, В – титрант, АВ – осадок).
4.3.1 Способы титрования.
Так как напрямую,
реакцией с титрантом, можно анализировать
далеко не любое вещество, особенно, если
оно неустойчиво на воздухе, то для
решения подобных задач было разработано
несколько приемов
(способов)
проведения анализа. Они
позволяют заменять неустойчивые,
в данных условиях соединения,
на эквивалентное количество более
устойчивого, которое не подвергается
гидролизу или окислению. Известны
следующие основные способы
проведения титриметрического анализа:
-
прямое
титрование; -
реверсивное;
-
обратное титрование
или титрование по остатку; -
косвенное
титрование или по замещению (по
заместителю).
В таблице 4.1 показаны
области применения различных способов
в зависимости от вида титрования.
Таблица 4.1 –
Применение различных видов и способов
титрования.
|
название метода |
частное название метода; (рабочий раствор) |
вещества, |
||
|
прямым |
обратным |
косвенным |
||
|
Протолито-метрия |
Ацидиметрия
(кислоты: |
основания;
соли, образован-ные сильным |
соли слабых оснований и сильных кислот; органические соединения |
|
|
Алкалиметрия
(щелочи: |
кислоты;
соли, образован-ные слабым |
|
|
|
|
Редокси-метрия |
Перманганато-метрия |
восстановители |
окислители |
вещества, реагирующие с восстанови-телями |
|
Иодометрия
( и |
восстановители |
восстановители |
окислители; кислоты |
|
|
Комплексо-метрия |
Комплексоно- метрия (ЭДТА) |
катионы, образующие с ЭДТА комплексы |
катионы в водо-нерастворимых катионы,
для которых отсутствует |
катионы, образующие с ЭДТА |
|
Метод |
Аргентометрия
( |
Анионы, образую-щие с |
катионы, образующие |
|
Рассмотрим подробнее
суть различных способов титрования.
1. Прямое
титрование заключается в
непосредственном взаимодействии
титранта и титруемого вещества. В
процессе титрования к аликвоте или
навеске вещества постепенно добавляют
раствор титранта, объем которого точно
фиксируют в Т. Э. В качестве титранта
используют рабочий раствор известной
концентрации. Расчет содержания вещества
в образце выполняют по закону эквивалентов:
=
(4.1)
где
– количество моль-эквивалентов
анализируемого вещества в титруемом
образце; а
количество
моль-эквивалентов титранта, вступившего
в реакцию с определяемым компонентом
А.
Концентрацию
компонента А в растворе вычисляют
по формуле:
(4.2)
где
– молярная концентрация эквивалента
(нормальность) титруемого раствора
(определяемого компонента), моль-экв/л;
– объем аликвоты титруемого раствора,
мл;
–
концентрация и
объем титранта в
точке эквивалентности. При титровании
методом отдельных навесок формула
(4.2) преобразуется в выражение (4.3):
(4.3)
Метод применяется
во всех случаях, когда нет каких-либо
ограничений. Например, при анализе
кислот, определении жесткости воды.
2. Реверсивное
титрование – это разновидность
прямого титрования, когда рабочий и
титруемый растворы меняют местами. В
этом случае для анализа отбирают
аликвоты рабочего раствора, а в Т.Э.
измеряют израсходованный на
титрование объем анализируемого
раствора. Вычисления проводят также,
как и в прямом титровании, по формулам
(4.2) или (4.3). Метод позволяет ограничить
площадь поверхности раствора,
контактирующей с воздухом, при
стандартизации относительно неустойчивых
соединений, как например NaOH.
Титрование по
заместителю (косвенное) и титрование
по остатку (обратное) основаны
на использовании вспомогательного
раствора, взаимодействующего с
определяемым компонентом. Такой прием
позволяет выполнять анализ химически
нестойких объектов или же при отсутствии
подходящего индикатора.
В косвенном
титровании сначала осуществляют
реакцию определяемого вещества
А со вспомогательным раствором
В, а затем титруют
эквивалентное количество
образовавшегося продукта реакции
С (заместитель). Этот способ
можно представить в виде схемы: А + В
С + (т-т) , исходя из которой запишем
выражение для закона эквивалентов:
=
=
.
(4.4)
Из равенства (4.4)
следует, что
=
и расчет можно также выполнять по
формулам (4.2) и (4.3), используемых для
прямого титрования. Для полноты реакции
вспомогательный раствор всегда берут
с небольшим избытком. Такой метод
титрования реализуется в йодометрии.
В обратном
титровании также сначала протекает
реакция между определяемым
веществом А и
взятым в избытке вспомогательным
раствором В, но затем титруют
остаток не прореагировавшего
вспомогательного раствора. Поэтому
необходимо точно знать концентрацию
вспомогательного раствора В и его
объем, взятый для анализа. Определение
компонента А выполняется согласно
схеме: А + В
Вост + (т-т). Исходя из
условий титрования, закон эквивалентов
можно записать в виде:
–
=
.
(4.5)
Откуда имеем:
=
.
(4.6)
Если все вещества
взяты в виде растворов, то формула (4.6)
примет вид
(4.7)
Если хотя бы одно
из веществ взято в сухом виде (известна
его масса), то следует воспользоваться
выражением (4.6) и записать значение
для каждого из веществ индивидуально.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Гидроксильная ошибка титрования. ОН-ошибка тнтрования вызвана избытком ОН -ионов. Следовательно, для ее расчета нужно в выведенную формулу (1) вместо [Н 1 подставить [ОН ], т. е. формула примет вид [c.288]
Элементы постоянных и пропорциональных погрешностей в той или иной форме можно выделить почти в любом методе и на каждом отдельном этапе химического анализа. Так, в кислотно-основном индикаторном титровании при определении концентрации сильных кислот или оснований наблюдается протонная АСр + или гидроксильная ошибка, абсолютное значение кото- [c.34]
Гидроксильная ошибка титрования. Предположим, что для титрования сильного основания сильной кислотой выбран индикатор с рТ=10 концентрация титруемого основания Л ==[ОН ] = —0,1 г-ион/л-, начальный объем основания =25 мл-, объем в конце титрования 1 ,=50 мл. [c.113]
Гидроксильная ошибка титрования [c.77]
Аналогична ей и гидроксильная ошибка, если в конечной точке титрования имеется избыток сильного основания [c.106]
Водородную ошибку следует учитывать при употреблении индикаторов, рТ которых меньше 7. При индикаторах с рТ больше 7 водородная ошибка становится очень малой, но возрастает гидроксильная ошибка (Оон-). обусловленная избыточной концентрацией гидроксильных ионов. Эта ошибка пропорциональна концентрации ионов ОН в конце титрования раствора. Почти все сказанное о водородной ошибке относится и к гидроксильной ошибке. Эту ошибку вычисляют по формуле [c.132]
Гидроксильная ошибка тем меньше, чем меньше показатель титрования индикатора. При прочих равных условиях применение фенолфталеина (рТ 9) приводит к меньшей гидроксильной ошибке, чем применение тимолфталеина (рТ 10). [c.132]
Гидроксильную ошибку (в %) можно найти аналогичным путем, принимая во внимание, что [НзО+][ОН»]= 1,0-причем получается выражение, подобное (X. 29) [c.254]
Гидроксильная ошибка (0 -) обусловлена избыточной концентрацией ионов гидроксила, наблюдаемой при титровании в присутствии некоторых индикаторов. [c.151]
Поэтому при титровании в присутствии индикаторов с рТ < < 7 интересуются только водородной ошибкой, а в присутствии индикаторов с рТ > 7 — только гидроксильной ошибкой. [c.152]
Гидроксильная ошибка титрования. Положим, что титруют У1 мл N нормальной сильной щелочи сильной кислотой и что объем раствора в конце титрования равен 1 2 мл. [c.290]
Эта величина и составляет гидроксильную ошибку титрования, обусловливаемую пере-титрованием кислоты щелочью. [c.155]
Водородная ошибка титрования — ошибка, вызываемая наличием в титруемом растворе по окончании титрования избытка ионов водорода, остаю1дихся в растворе в результате недотитрования сильной кислоты сильным основанием, или перетитрования сильного основания сильной кислотой. См. также Ошибка индикаторная, Гидроксильная ошибка. [c.63]
Гидроксильная ошибка титрования — ошибка, вызываемая наличием избытка анионов ОН», остающихся в титруемом растворе вследствие недотитрования сильного основания сильной кислотой или перетит- [c.77]
При титровании сильных электролитов, если рГ < рНт. э, в конечной точке титрования получается избыток Н3О+, в силу чего подобная ошибка называется протонной водородной) ошибкой. Если рт > рНт. э, то в конечной точке будет избыток ОН и соответствующая ошибка будет называться гидроксильной ошибкой. При титровании слабых протолитов, когда в. конечной точке остается избыток слабой кислоты, находящейся практически в полностью недиссоциированной форме, говорят о кислотной ошибке, а не O протонной. Если по изложенным причинам в конечной точке остается избыток неоттитровднного слабого основания, это обусловливает наличие основной ошибки. [c.253]
В случае (а) гидроксильная ошибка будет в пределах точности ызмере1 11я и, следовательно, не отразится на полученных результатах. [c.254]
Если эта избыточная кислота является сильной и, следовательно, присутствует в растворе в виде свободных ионов Н , ошибку называют водородной , или H -ошибкой . Наоборот, если кислота является слабой и присутствует аочти исключительно в виде недиссоциированных молекул (НА), решающее значение имеет кислотная ошибка , или НА-ошибка . Точно так же, если избыточное основание является сильным, оно обусловливает возникновение гидроксильной ошибки , или ЮН -ошибки если это основание слабое—приходится считаться со щелочной ошибкой , или МеОН-ошибкой . Рассмотрим методику вычисления всех этих четырех типов индикаторных ошибок. [c.294]
Эта величина и составляет гидроксильную ошибку титрования, обусловленную недотитрованием ОН -ионов. [c.140]
Гидроксильная ошибка может быть двух видов ОНнед-ошибка и ОНпер-ошибка. [c.353]
Основы аналитической химии Часть 2 (1965) — [
c.111
,
c.113
]
Основы аналитической химии Книга 2 (1961) — [
c.137
]
Основы аналитической химии Издание 3 (1971) — [
c.154
,
c.156
]
Основы аналитической химии Кн 2 (1965) — [
c.111
,
c.113
]

Индикаторные ошибки кислотно-основного титрования 1

Водородная ошибка возникает, когда недотитрована сильная кислота, перетитровано сильное или слабое основание Водородная ошибка – отношение количества ионов водорода n(H+) в конце титрования к первоначально взятому количеству вещества n(X) n(H+)к. т. X(H+) = ———— · 100% n(X) 2

n(X) = С(1/z Х) · V(X) С(1/z Х) – молярная концентрация эквивалента первоначально взятого вещества V(X) – объем первоначально взятого вещества n(H+)к. т. = [H+]к. т. · Vк. т. – объем в конце титрования Vк. т. = V(X) + V(Т) 3
![[H+]к. т. · (V(X) + V(Т)) X(H+) = —————— · 100% С(1/z Х) · [H+]к. т. · (V(X) + V(Т)) X(H+) = —————— · 100% С(1/z Х) ·](https://present5.com/presentation/3/139200531_169966086.pdf-img/139200531_169966086.pdf-4.jpg)
[H+]к. т. · (V(X) + V(Т)) X(H+) = —————— · 100% С(1/z Х) · V(X) р. Нк. т. = р. ТInd [H+]к. т = 10–р. Н = 10–р. Т · (V(X) + V(Т)) X(H+) = ————— · 100% С(1/z Х) · V(X) 4

Гидроксильная ошибка обусловлена наличием гидроксид-ионов в конце титрования и возникает, когда недотитровано сильное основание, перетитрована сильная или слабая кислота n(OH–)к. т. X(OH–) = ———— · 100% n(X) n(OH–)к. т = [OH–]к. т. · (V(X) + V(Т)) n(X) = С(1/z Х) · V(X) [OH–]к. т. · (V(X) + V(Т)) X(OH–) = ————— · 100% С(1/z Х) · V(X) 5
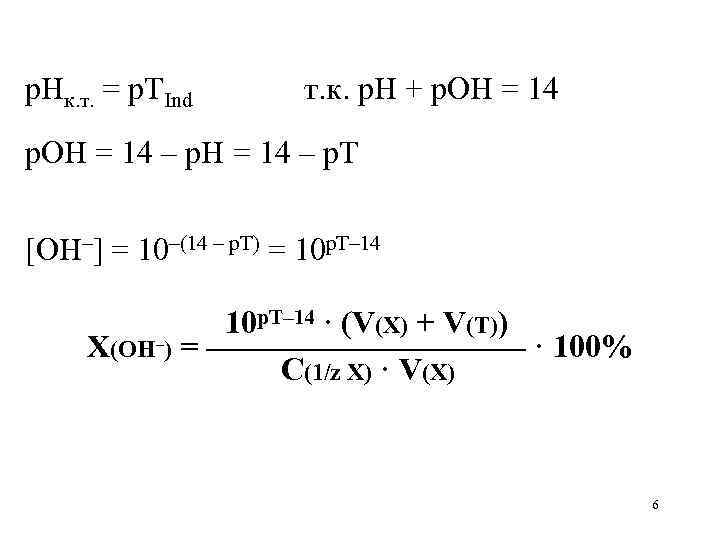
р. Нк. т. = р. ТInd т. к. р. Н + р. ОН = 14 – р. Т [OH–] = 10–(14 – р. Т) = 10 р. Т– 14 · (V(X) + V(Т)) X(OH–) = ————— · 100% С(1/z Х) · V(X) 6

Кислотная ошибка возникает, когда остается недотитрованной слабая кислота Кислотная ошибка – отношение концентрации недотитрованной кислоты в конце титрования к ее оттитрованной части HA + KOH H 2 O + KA [HA]к. т. X(HA) = ———— · 100% [A–]к. т. Оттитрованная часть кислоты будет определяться анионами соли 7
![HAк. т. H+к. т. + A–к. т. [H+]к. т. · [A–]к. т. Kк-ты = HAк. т. H+к. т. + A–к. т. [H+]к. т. · [A–]к. т. Kк-ты =](https://present5.com/presentation/3/139200531_169966086.pdf-img/139200531_169966086.pdf-8.jpg)
HAк. т. H+к. т. + A–к. т. [H+]к. т. · [A–]к. т. Kк-ты = ——————— [HA]к. т. [H+]к. т. ———= ——— [A–]к. т. Kк-ты [H+]к. т. X(HA) = ———— · 100% Kк-ты 8
![р. Нк. т. = р. ТInd [H+]к. т = 10–р. Н = 10–р. Т р. Нк. т. = р. ТInd [H+]к. т = 10–р. Н = 10–р. Т](https://present5.com/presentation/3/139200531_169966086.pdf-img/139200531_169966086.pdf-9.jpg)
р. Нк. т. = р. ТInd [H+]к. т = 10–р. Н = 10–р. Т Kк-ты = 10–р. К 10–р. Т X(HA) = ———— · 100% 10–р. Кк-ты X(HA) =10 р. Кк-ты–р. Т · 100% 9

Основная ошибка возникает, когда остается недотитрованным слабое основание Основная ошибка – отношение концентрации неоттитрованного основания в конце титрования к его оттитрованной части [BOH]к. т. X(BOH) = ———— · 100% [B+]к. т. 10
![Аналогично с кислотной ошибкой можно показать [BOH]к. т. [OH–]к. т. ————— = ————— [B+]к. Аналогично с кислотной ошибкой можно показать [BOH]к. т. [OH–]к. т. ————— = ————— [B+]к.](https://present5.com/presentation/3/139200531_169966086.pdf-img/139200531_169966086.pdf-11.jpg)
Аналогично с кислотной ошибкой можно показать [BOH]к. т. [OH–]к. т. ————— = ————— [B+]к. т. Kосн [OH–]к. т. X(BOH) = ———— · 100% Kосн Т. к. [OH–]к. т. = 10 р. Т– 14 Kосн = 10–р. Косн 11
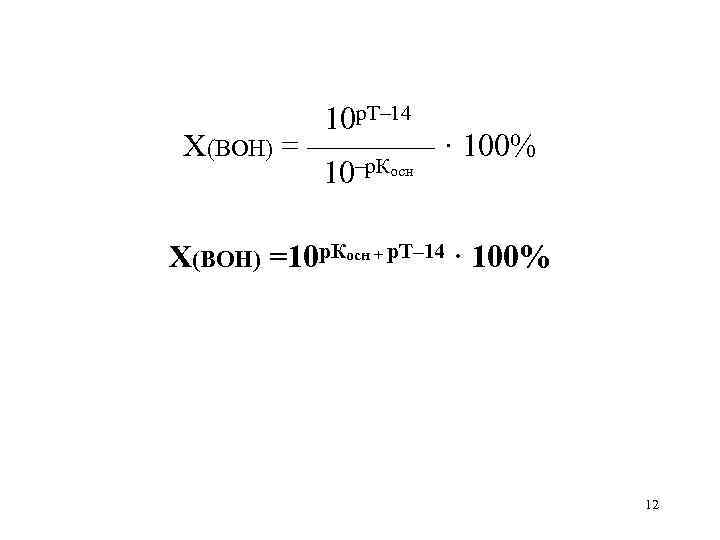
10 р. Т– 14 X(BOH) = ———— · 100% 10–р. Косн X(BOH) =10 р. Косн + р. Т– 14 · 100% 12

Вычислить ошибку титрования 0, 2 н. раствора HCl 0, 2 н. раствором Na. OH с индикатором метиловым оранжевым. р. Т(м/о) = 4 ошибка водородная 10–р. Т · (V(X) + V(Т)) X(H+) = ————— · 100% С(1/z Х) · V(X) 10– 4 · (10 + 10) X(H+) = ——————— · 100 = 0, 1% 0, 2 · 10 Индикаторная ошибка должна быть 0, 1% 13

Вычислить индикаторную ошибку титрования 0, 2 н. раствора HCl 0, 2 н. раствором Na. OH с индикатором фенолфталеином р. Т(ф/ф) = 9 ошибка гидроксильная 10 р. Т– 14 · (V(X) + V(Т)) X(OH–) = ————— · 100% С(1/z Х) · V(X) 109– 14 · (10 + 10) X(OH–) = ——————— · 100 = 0, 01 % 0, 2 · 10 14

Вычислить ошибку титрования 0, 1 н. раствора муравьиной кислоты 0, 1 н. раствором сильного основания с индикатором метиловым красным р. Т(м/к) = 5 р. К(HCOOH) = 3, 76 р. Нт. э. = 7 + ½ р. Кк-ты + ½ lg Cсоли = 8, 38 Раствор недотитрован ошибка кислотная 15

X(HA) =10 р. Кк-ты–р. Т · 100% X(HA) =103, 76– 5 · 100 = 5, 7 % Индикатор использовать нельзя. 16

Чему равна ошибка титрования 0, 1 н. раствора аммиака 0, 1 н. раствором HCl с индикатором крезоловым пурпуровым р. Т(к/п) = 8 р. К(NH 4 OH) = 4, 75 р. Нт. э. = 7 – ½ р. Косн – ½ lg Cсоли = 5, 10 Раствор недотитрован ошибка основная X(BOH) =10 р. Косн + р. Т– 14 · 100% X(BOH) =104, 75 + 8– 14 · 100 = 5, 6% 17
Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Содержание
-
1.
1
Индикаторные ошибки
кислотно-основного титрования -
2.
Водородная ошибка возникает, когда недотитрована сильная кислота, -
3.
n(X) = Сэкв(Х) · V(X)Сэкв(Х) – молярная -
4.
Слайд 4 -
5.
Гидроксильная ошибка обусловлена наличием гидроксид-ионов в конце -
6.
рНк.т. = рТInd -
7.
Кислотная ошибка возникает, когда остается недотитрованной слабая -
8.
HAк.т. H+к.т. + A–к.т. -
9.
рНк.т. = рТInd[H+]к.т = 10–рН = 10–рТ -
10.
Основная ошибка возникает, когда остается недотитрованным слабое -
11.
Аналогично с кислотной ошибкой можно показать -
12.
10рТ–14X(BOH) = ———— · 100% 10–рКосн X(BOH) =10рКосн + рТ–14 · 100% -
13.
Вычислить ошибку титрования 0,2 н. раствора HCl -
14.
Вычислить индикаторную ошибку титрования 0,2 н. раствора -
15.
Вычислить ошибку титрования 0,1 н. раствора муравьиной -
16.
X(HA) =10рКк-ты–рТ · 100%X(HA) =103,76–5 · 100 = 5,7 %Индикатор использовать нельзя. -
17.
Чему равна ошибка титрования 0,1 н. раствора -
18.
Скачать презентанцию
Водородная ошибка возникает, когда недотитрована сильная кислота, перетитровано сильное или слабое основаниеВодородная ошибка – отношение количества ионов водорода n(H+) в конце титрования к первоначально взятому количеству вещества n(X)
Слайды и текст этой презентации
Слайд 1
Индикаторные ошибки
кислотно-основного титрования

Слайд 2Водородная ошибка возникает, когда недотитрована сильная кислота, перетитровано сильное или
слабое основание
Водородная ошибка – отношение количества ионов водорода n(H+) в
конце титрования к первоначально взятому количеству вещества n(X)
n(H+)к.т.
X(H+) = ———— · 100%
n(X)

Слайд 3
n(X) = Сэкв(Х) · V(X)
Сэкв(Х) – молярная концентрация эквивалента первоначально
взятого вещества
V(X) – объем первоначально взятого вещества
n(H+)к.т. = [H+]к.т.· Vк.т.
Vк.т.
– объем в конце титрования
Vк.т. = V(X) + V(Т)

Слайд 4
[H+]к.т.· (V(X) + V(Т))
X(H+) = ——————————— ·
100%
С(1/z Х) · V(X)
рНк.т. = рТInd
[H+]к.т = 10–рН = 10–рТ
10–рТ · (V(X) + V(Т))
X(H+) = ————————— · 100%
Сэкв(Х) · V(X)
![1
Индикаторные ошибки
кислотно-основного титрования [H+]к.т.· (V(X) + V(Т))X(H+) [H+]к.т.· (V(X) + V(Т))X(H+)](https://theslide.ru/img/thumbs/c7a561334825ad0133c59cb97a9bd88f-800x.jpg)
Слайд 5Гидроксильная ошибка обусловлена наличием гидроксид-ионов в конце титрования и возни-кает,
когда недотитровано сильное основание, перетитрована сильная или слабая кислота
n(OH–)к.т.
X(OH–) = ———— · 100%
n(X)
n(OH–)к.т = [OH–]к.т. · (V(X) + V(Т))
n(X) = Сэкв(Х) · V(X)
[OH–]к.т. · (V(X) + V(Т))
X(OH–) = —————————— · 100%
Сэкв(Х) · V(X)

Слайд 6
рНк.т. = рТInd т.к.
рН + рОН = 14
рОН = 14 – рН =
14 – рТ
[OH–] = 10–(14 – рТ) = 10рТ–14
10рТ–14 · (V(X) + V(Т))
X(OH–) = —————————— · 100%
Сэкв(Х) · V(X)
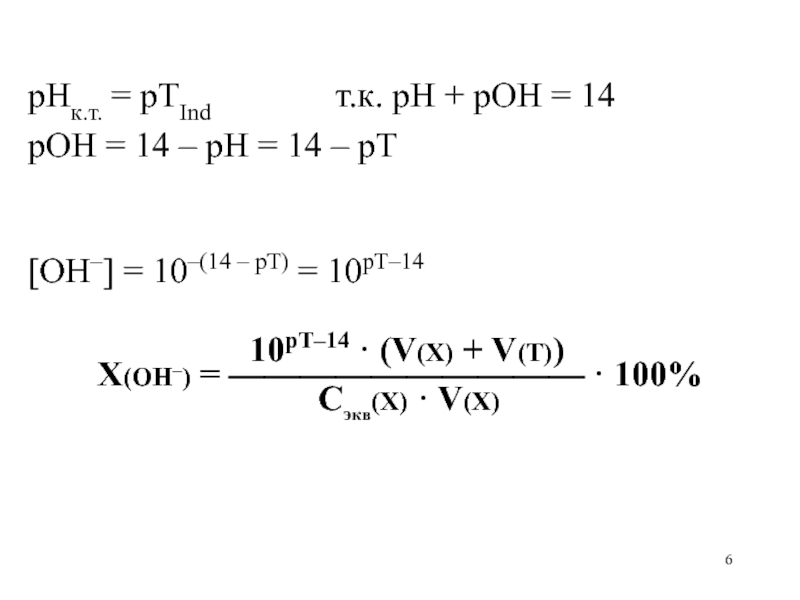
Слайд 7Кислотная ошибка возникает, когда остается недотитрованной слабая кислота
Кислотная ошибка –
отношение концентрации недотитрованной кислоты в конце титрования к ее оттитрованной
части
HA + KOH H2O + KA
[HA]к.т.
X(HA) = ———— · 100%
[A–]к.т.
Оттитрованная часть кислоты будет определяться анионами соли

Слайд 8 HAк.т. H+к.т. + A–к.т.
[H+]к.т. · [A–]к.т.
Kк-ты = ———————
[HA]к.т.
[HA]к.т. [H+]к.т.
———= ———
[A–]к.т. Kк-ты
[H+]к.т.
X(HA) = ———— · 100%
Kк-ты
![1
Индикаторные ошибки
кислотно-основного титрования HAк.т. H+к.т. + A–к.т. [H+]к.т. · HAк.т. H+к.т. + A–к.т. [H+]к.т. · [A–]к.т. Kк-ты](https://theslide.ru/img/thumbs/29a440cd54ab9c0d1df62fbcfe532cfd-800x.jpg)
Слайд 9
рНк.т. = рТInd
[H+]к.т = 10–рН = 10–рТ
Kк-ты = 10–рК
10–рТ
X(HA) = ———— · 100%
10–рКк-ты
X(HA) =10рКк-ты–рТ · 100%
![1
Индикаторные ошибки
кислотно-основного титрования рНк.т. = рТInd[H+]к.т = 10–рН = 10–рТ рНк.т. = рТInd[H+]к.т = 10–рН = 10–рТ Kк-ты =](https://theslide.ru/img/thumbs/df10b9003ac90e37aac1ea8c40d7717a-800x.jpg)
Слайд 10Основная ошибка возникает, когда остается недотитрованным слабое основание
Основная ошибка –
отношение концентрации неоттитрованного основания в конце титрования к его оттитрованной
части
[BOH]к.т.
X(BOH) = ———— · 100%
[B+]к.т.

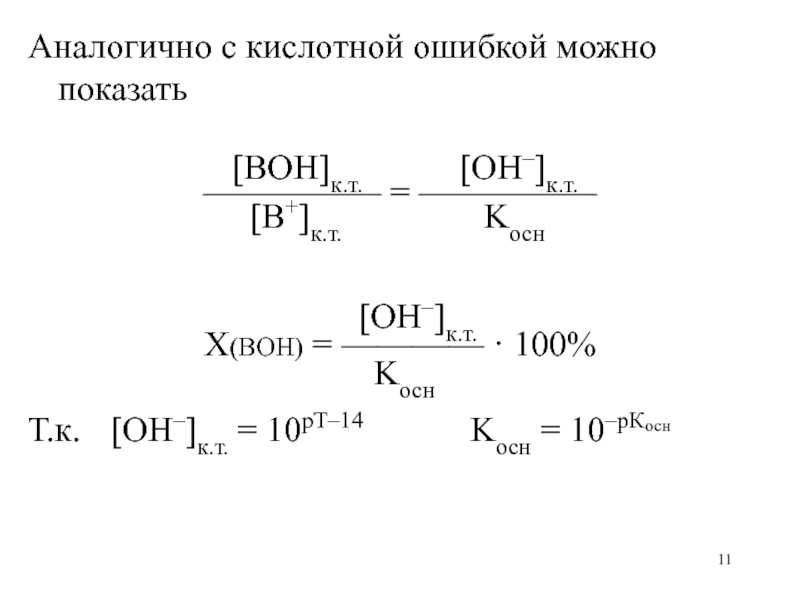
Слайд 11Аналогично с кислотной ошибкой можно показать
[BOH]к.т.
[OH–]к.т.
————— = —————
[B+]к.т. Kосн
[OH–]к.т.
X(BOH) = ———— · 100%
Kосн
Т.к. [OH–]к.т. = 10рТ–14 Kосн = 10–рКосн
Слайд 12
10рТ–14
X(BOH) = ———— · 100%
10–рКосн
X(BOH) =10рКосн +
рТ–14 · 100%

Слайд 13Вычислить ошибку титрования 0,2 н. раствора HCl 0,2 н. раствором
NaOH с индикатором метиловым оранжевым.
рТ(м/о) = 4
ошибка водородная
10–рТ · (V(X) + V(Т))
X(H+) = ————————— · 100%
Сэкв(Х) · V(X)
10–4 · (10 + 10)
X(H+) = ——————— · 100 = 0,1%
0,2 · 10
Индикаторная ошибка должна быть 0,1%

Слайд 14Вычислить индикаторную ошибку титрования 0,2 н. раствора HCl 0,2 н.
раствором NaOH с индикатором фенолфталеином
рТ(ф/ф) = 9
ошибка гидроксильная
10рТ–14 · (V(X) + V(Т))
X(OH–) = —————————— · 100%
Сэкв(Х) · V(X)
109–14 · (10 + 10)
X(OH–) = ——————— · 100 = 0,01 %
0,2 · 10

Слайд 15Вычислить ошибку титрования 0,1 н. раствора муравьиной кислоты 0,1 н.
раствором силь-ного основания с индикатором метиловым красным
рТ(м/к) = 5
рК(HCOOH) = 3,76
рНт.э. = 7 + ½ рКк-ты + ½ lg Cсоли = 8,38
Раствор недотитрован ошибка кислотная

Слайд 16
X(HA) =10рКк-ты–рТ · 100%
X(HA) =103,76–5 · 100 = 5,7 %
Индикатор
использовать нельзя.

Слайд 17Чему равна ошибка титрования 0,1 н. раствора аммиака 0,1 н.
раствором HCl с индикатором крезоловым пурпуровым
рТ(к/п) = 8
рК(NH4OH) = 4,75
рНт.э. = 7 – ½ рКосн – ½ lg Cсоли = 5,10
Раствор недотитрован ошибка основная
X(BOH) =10рКосн + рТ–14 · 100%
X(BOH) =104,75 + 8–14 · 100 = 5,6%

