Химические методы анализа
кислот как H3BO3 (pKa = 9,2) или NH4+ (pKa = 9,24) в водных растворах с удовлетворительной погрешностью невозможно и поэтому для их определения используют специальные приёмы.
Температура и ионная сила влияют на величину скачка титрования менее заметно, чем концентрация или сила титруемой кислоты или основания. При повышении температуры константа автопротолиза воды увеличивается, поэтому величина скачка кислотно-основного титрования в водном растворе уменьшается. Аналогичным образом влияет на величину скачка титрования ионная сила раствора.
Методика титриметрического анализа многостадийна, погрешности могут возникать на любой стадии её проведения: при измерении массы навески, объёма приготовленного раствора или аликвоты, при проведении титрования, обнаружении конечной точки титрования. В зависимости от причины возникновения погрешности в титриметрических методах анализа, как и погрешности вообще, могут быть:
случайные
ПОГРЕШНОСТИ

|
положительные |
отрицательные |
||||
|
определяемое вещество |
определяемое вещество |
||||
|
всё время перетитровывается |
всё время недотитровывается |
К появлению систематических погрешностей в титриметрических методах анализа может приводить:
•использование неверно градуированной посуды;
•неправильная техника титрования (слишком быстрое добав-
ление титранта);
•неточное считывание объёма титранта, израсходованного для титрования;

Погрешности, обусловленные несовпадением точки эквивалентности и рТ индикатора, называются индикаторными.
Индикаторные погрешности в кислотно-основном титровании удобно разделить на 4 вида:
161

|
Раздел 2 |
|||||||||||
|
в КТТ в растворе присутствует |
в КТТ в растворе остаётся |
||||||||||
|
избыток OH— по сравнению с ТЭ |
недотитрованная слабая кислота |
||||||||||
|
гидроксидная |
кислотная |
||||||||||
|
ИНДИКАТОРНАЯ |
|||||||||||
|
водородная |
ПОГРЕШНОСТЬ |
основная |
|||||||||
|
в КТТ в растворе присутствует |
в КТТ в растворе остаётся |
||||||||||
|
избыток H3O |
+ |
по сравнению с ТЭ |
недотитрованное слабое основание |
||||||||
Водородная индикаторная погрешность может возникнуть при недотитровании сильной кислоты (в таком случае погрешность отрицательная) либо когда сильная кислота используется в качестве титранта и добавлена в избытке (положительная погрешность).
|
n(H |
3 |
O+ ) |
конечн |
C |
V |
10 |
−pT V |
||||
|
∆ |
H |
+ = ± |
= ± |
2 конечн |
= ± |
конечн |
|||||
|
С0V0 |
|||||||||||
|
n(H3O+ )исх |
С0V0 |
Если концентрации титруемого вещества и титранта одинаковы, то Vконечн = 2V0, тогда
|
2 10−pT |
||||
|
∆ |
H |
+ = ± |
[ 100%] |
|
|
С0 |
||||
Гидроксидная погрешность может возникнуть при недотитровании сильного основания (отрицательная погрешность) либо в том случае, когда сильное основание используется в качестве титранта и добавлено в избытке (положительная погрешность).
|
10pT−pKW V |
10pT−pKW |
||||||
|
∆ |
OH |
− = ± |
конечн |
≈ ±2 |
[ 100%] |
||
|
C0 V0 |
C0 |
||||||
Кислотная и основная индикаторные погрешности могут быть только отрицательными (если, конечно, исключить гипотетический случай использования слабой кислоты или основания в качестве титранта).
Величина кислотной погрешности представляет собой молярную долю неоттитрованной кислоты.
|
[HA] |
[H |
3O+ ] |
||||||||
|
∆HA = − |
= − |
= |
− |
1 |
[ 100%] |
|||||
|
pT−pKa |
||||||||||
|
C(HA) |
+ |
+10 |
||||||||
|
[H3O |
] + K a |
1 |
||||||||
162

Химические методы анализа
Если 10pT−pKa >>1, то ∆HA = −10pKa −pH [ 100%]
Формула для расчёта основной погрешности выводится аналогичным образом и выглядит следующим образом
|
∆B = − |
1 |
[ 100%] |
||||
|
1 +10 |
pK |
BH |
+ −pT |
|||
или в упрощённом виде
∆B = −10pT−pKBH+ [100%]
Пример 13.1. Рассчитать систематическую индикаторную погрешность титрования 0,1 М HCl и 0,1 М HCOOH при использовании в качестве титранта 0,1 М NaOH и индикатора метилового оранжевого (рТ = 4).
В случае HCl титрование заканчивается при рН меньшем (4), чем рН в точке эквивалентности (7), поэтому имеет место водородная индикаторная погрешность. Поскольку в конечной точке титрования определяемое вещество будет недотитровано, величина систематической индикаторной погрешности будет отрицательной
∆H+ = −2 1 10−4 100% = −0,2% 0,1
При титровании HCOOH в конечной точке титрования будет оставаться неоттитрованная слабая кислота, поэтому в данном случае будет кислотная индикаторная погрешность.
|
∆HA = − |
1 |
100% |
= −36% |
|
|
+100,25 |
||||
|
1 |
Совершенно очевидно, что метиловый оранжевый не может быть использован для обнаружения конечной точки титрования раствора HCOOH раствором NaOH.
Даже в том случае, если систематическая индикаторная погрешность равна 0 (pHэкв = рТ), всё равно будет иметься случайная погрешность визуального обнаружения конечной точки титрования с помощью индикатора. Вследствие физиологических особенностей нашего зрения рТ индикатора можно определить лишь с неопределённостью примерно ± 0,4 ед. рН. Величина случайной индикаторной погрешности зависит от крутизны скачка титрования — чем она больше, тем случайная погрешность меньше. Индекс крутизны скачка титрования рассчитывается следующим образом:
163

Раздел 2
η = dpHdf ≈ ∆∆рНf
При титровании слабых кислот (оснований) крутизна скачка титрования меньше, следовательно, случайная индикаторная погрешность больше, чем при титровании сильных кислот (оснований) (рис 13.5). Для 0,1 М сильных кислот и оснований величина случайной индикаторной погрешности составляет ±2 10-7. По мере уменьшения силы кислоты (основания) и концентрации случайная погрешность увеличивается.
|
pH |
|||
|
10 |
|||
|
9 |
|||
|
8 |
|||
|
7 |
1 |
||
|
6 |
|||
|
5 |
|||
|
4 |
2 |
||
|
3 |
f |
||
|
0,99 |
1 |
1,01 |
Рис. 13.5. Влияние крутизны скачка титрования на случайную индикатор-
ную погрешность: 1 – 0,1 М HCOOH; 2 – 0,1 М HCl
В виде полосы показана область неопределённости обнаружения конечной точки титрования для индикатора, имеющего рТ 8
13.6. Некоторые случаи практического применения кислотно-основного титрования в водных растворах
Анализ смеси карбоната и гидроксида, карбоната и гидрокарбоната щелочного металла с применением двух индикаторов
При титровании смеси гидроксида и карбоната щелочного металла, например, NaOH и Na2CO3 и обнаружении конечной точки титрования с помощью фенолфталеина протекают реакции:
NaOH + HCl → NaCl + H2O
Na2CO3 + HCl → NaHCO3 + NaCl,
При обнаружении конечной точки титрования с помощью метилового оранжевого реакция взаимодействия гидроксида натрия с кислотой протекает точно также, а карбонат натрия титруется до уголь-
164

Химические методы анализа
ной кислоты. Разность между объёмами раствора титранта, израсходованного для титрования смеси в присутствии метилового оранжевого и фенолфталеина, будет соответствовать протеканию реакции:
NaHCO3 + HCl → H2CO3 + NaCl
Фактор эквивалентности NaHCO3 в данной реакции равен 1. Если принять, что NaHCO3 в исходной смеси не было, то n(NaHCO3) = n0(Na2CO3) и массу карбоната натрия можно рассчитать следующим образом
m(Na2CO3) = C(HCl) (VМО – VФ) 10-3 M(Na2CO3)
Для взаимодействия с NaOH, находящимся в анализируемой пробе, будет расходоваться объём стандартного раствора титранта
равный VФ – (VМО – VФ) = 2VФ — VМО, поэтому массу NaOH рассчитывают по следующей формуле
m(NaOH) = C(HCl) (2VФ – VМО) 10-3 M(NaOH)
Если на титрование смеси щелочи и карбоната с фенолфталеином и метиловым оранжевым затрачивается практически одинаковый объём стандартного раствора титранта, то содержание карбоната в смеси очень мало. Напротив, если объёмы раствора титранта, затраченные для титрования, значительно отличаются, то в анализируемой смеси содержится много карбоната
Анализ смеси гидрокарбоната и карбоната щелочного металла титрованием её раствором сильной кислоты в присутствии двух индикаторов основан на том же принципе, что и анализ смеси гидроксида и карбоната. При титровании смеси с фенолфталеином с титрантом взаимодействует лишь карбонат
Na2CO3 + HCl → NaHCO3 + NaCl
С метиловым оранжевым титруются и карбонат и гидрокарбонат. По объёму раствора HCl, затраченному для титрования с фенолфталеином, можно рассчитать содержание Na2CO3 (fэкв = 1), а по разности между объёмом раствора HCl, затраченным для титрования с метиловым оранжевым и удвоенным объёмом, затраченным для титрования с фенолфталеином — содержание NaHCO3:
m(Na2CO3) = C(HCl) VФ 10-3 M(Na2CO3) m(NaHCO3) = C(HCl) (VМО – 2VФ) 10-3 M(NaHCO3)
Чем больше титранта требуется для титрования с фенолфталеином, тем больше карбоната содержится в анализируемой пробе. Если при добавлении к титруемому раствору фенолфталеина последний окрашивается в слабо розовый цвет и для его обесцвечивания требуется лишь несколько капель раствора титранта, то содержание карбоната в пробе очень мало.
165

Раздел 2
Определение азота в органических соединениях по Кьельдалю и ионов аммония
Определение азота в органических соединениях методом Кьельдаля проводят следующим образом (устройство прибора показано на рис. 13.6). Точную навеску анализируемого образца помещают в колбу Кьедьдаля и подвергают минерализации с помощью концентрированной серной кислоты, к которой добавлены K2SO4 и СuSO4, а в некоторых случаях ещё и селен или HgO. В процессе окисления органической части молекулы азот восстанавливается до иона аммония. По-
|
сле окончания минерализации к раство- |
||||
|
ру добавляют NaOH. При этом образу- |
||||
|
ется NH3, который отгоняют и погло- |
||||
|
щают раствором H3BO3 или стандарт- |
||||
|
ным раствором сильной кислоты (H2SO4 |
||||
|
или HCl). В первом случае при взаимо- |
||||
|
действии борной кислоты с аммиаком |
||||
|
образуется эквивалентное NH3 количе- |
||||
|
ство иона BO2—, который затем титруют |
||||
|
стандартным раствором HCl (титрова- |
||||
|
ние заместителя). Во втором случае оп- |
||||
|
ределяют избыток сильной кислоты, не |
||||
|
вступивший в реакцию с NH3, титруя |
||||
|
Рис. 13.6. Прибор для определе- |
раствор стандартным раствором NaOH |
|||
|
ния азота в органических соеди- |
(обратное титрование). |
|||
|
нениях (по ГФ XI) |
Обычный метод Кьельдаля ис- |
|||
|
1 – парообразователь; 2 – колба |
пользуют для органических соединений, |
|||
|
Кьельдаля; 3 – воронка для вво- |
содержащих аминный азот (амины, |
|||
|
да щелочи; 4 – брызгоуловитель; |
аминокислоты и т.д.). Для определения |
|||
|
5 – холодильник; 6 — приёмник |
||||
|
азота в нитратах, нитритах, нитросоеди- |
нениях и т.п. необходимо ещё предварительное восстановление данных азотсодержащих групп до иона аммония или аминогруппы.
Методику, похожую на описанную выше, можно использовать также и для веществ, которые легко гидролизуются с образованием аммиака или аминов. Такие вещества не подвергают минерализации, а сразу проводят их щелочной гидролиз. Например, определение азота в соединении (1) требует обязательной минерализации, а для соединения (2) достаточно щелочного гидролиза.
|
O |
O |
||
|
C |
NH |
C |
NH2 |
|
(1) |
(2) |
||
|
OH |
OH |
166
Химические методы анализа
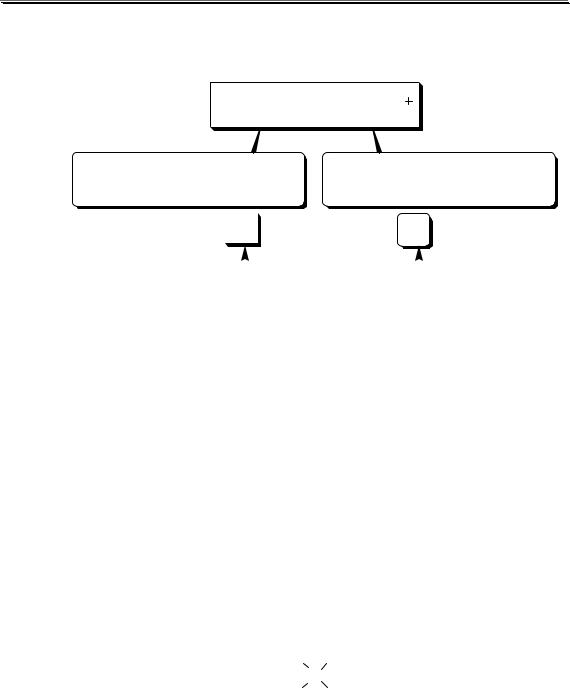
Ион аммония является достаточно слабой кислотой (pKa = 9,24), поэтому его прямое титриметрическое определение при концентрации в водном растворе, например, 0,1 моль/л, невозможно.
ОПРЕДЕЛЕНИЕ NH4
|
формальдегидный способ |
обратное титрование |
||||||||||
|
(титрование заместителя) |
|||||||||||
|
+ |
∆ |
||||||||||
|
+ 6CH2O → (CH2)6N4 + |
+ |
NH |
+ |
+ OH |
— |
↑ + H O |
|||||
|
4NH4 |
4H + 6H2O |
4 |
→ NH |
||||||||
|
3 |
2 |
||||||||||
|
титруют стандартным раствором |
избыток щелочи, не вступивший в |
||||||||||
|
щёлочи в присутствии фенолфталеина |
реакцию, титруют стандартным |
||||||||||
|
раствором сильной кислоты |
Определение борной кислоты
Борная кислота является слабой одноосновной кислотой (pKa ≈ 9,3). Её кислотные свойства обусловлены реакцией:
B(OH)3 + 2H2O î [B(OH)4]— + H3O+
Борная кислота является слишком слабой для того, чтобы её можно было с удовлетворительной погрешностью оттитровать щелочью в водном растворе. Однако, она может взаимодействовать с органическими веществами, в состав которых входит α-диольная группа (глицерин, глюкоза, фруктоза, маннит, сорбит и др.), с образованием более сильных комплексных кислот (например, у маннитборной кислоты pKa = 5,3). Последние могут быть оттитрованы раствором щёлочи в присутствии фенолфталеина.
|
C |
OH |
C |
O |
O |
C |
+ H |
O+ + 2H O |
|||||||||||||||||
|
2 |
+ B(OH) |
î |
B |
|||||||||||||||||||||
|
C |
OH |
3 |
3 |
2 |
||||||||||||||||||||
|
C |
O |
O |
C |
|||||||||||||||||||||
Наиболее часто используемым на практике комплексообразователем при определении борной кислоты является глицерин, хотя по сравнению, например, с маннитом или моносахаридами данное вещество является менее активным комплексообразующим реагентом. Кроме того, глицерин очень вязкий и работать с ним неудобно. Глицерин, используемый в лаборатории, может содержать примеси кислот. Перед применением его необходимо нейтрализовать раствором щёлочи до появления слабо-розового окрашивания фенолфталеина.
167
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Гидроксильная ошибка титрования. ОН-ошибка тнтрования вызвана избытком ОН -ионов. Следовательно, для ее расчета нужно в выведенную формулу (1) вместо [Н 1 подставить [ОН ], т. е. формула примет вид [c.288]
Элементы постоянных и пропорциональных погрешностей в той или иной форме можно выделить почти в любом методе и на каждом отдельном этапе химического анализа. Так, в кислотно-основном индикаторном титровании при определении концентрации сильных кислот или оснований наблюдается протонная АСр + или гидроксильная ошибка, абсолютное значение кото- [c.34]
Гидроксильная ошибка титрования. Предположим, что для титрования сильного основания сильной кислотой выбран индикатор с рТ=10 концентрация титруемого основания Л ==[ОН ] = —0,1 г-ион/л-, начальный объем основания =25 мл-, объем в конце титрования 1 ,=50 мл. [c.113]
Гидроксильная ошибка титрования [c.77]
Аналогична ей и гидроксильная ошибка, если в конечной точке титрования имеется избыток сильного основания [c.106]
Водородную ошибку следует учитывать при употреблении индикаторов, рТ которых меньше 7. При индикаторах с рТ больше 7 водородная ошибка становится очень малой, но возрастает гидроксильная ошибка (Оон-). обусловленная избыточной концентрацией гидроксильных ионов. Эта ошибка пропорциональна концентрации ионов ОН в конце титрования раствора. Почти все сказанное о водородной ошибке относится и к гидроксильной ошибке. Эту ошибку вычисляют по формуле [c.132]
Гидроксильная ошибка тем меньше, чем меньше показатель титрования индикатора. При прочих равных условиях применение фенолфталеина (рТ 9) приводит к меньшей гидроксильной ошибке, чем применение тимолфталеина (рТ 10). [c.132]
Гидроксильную ошибку (в %) можно найти аналогичным путем, принимая во внимание, что [НзО+][ОН»]= 1,0-причем получается выражение, подобное (X. 29) [c.254]
Гидроксильная ошибка (0 -) обусловлена избыточной концентрацией ионов гидроксила, наблюдаемой при титровании в присутствии некоторых индикаторов. [c.151]
Поэтому при титровании в присутствии индикаторов с рТ < < 7 интересуются только водородной ошибкой, а в присутствии индикаторов с рТ > 7 — только гидроксильной ошибкой. [c.152]
Гидроксильная ошибка титрования. Положим, что титруют У1 мл N нормальной сильной щелочи сильной кислотой и что объем раствора в конце титрования равен 1 2 мл. [c.290]
Эта величина и составляет гидроксильную ошибку титрования, обусловливаемую пере-титрованием кислоты щелочью. [c.155]
Водородная ошибка титрования — ошибка, вызываемая наличием в титруемом растворе по окончании титрования избытка ионов водорода, остаю1дихся в растворе в результате недотитрования сильной кислоты сильным основанием, или перетитрования сильного основания сильной кислотой. См. также Ошибка индикаторная, Гидроксильная ошибка. [c.63]
Гидроксильная ошибка титрования — ошибка, вызываемая наличием избытка анионов ОН», остающихся в титруемом растворе вследствие недотитрования сильного основания сильной кислотой или перетит- [c.77]
При титровании сильных электролитов, если рГ < рНт. э, в конечной точке титрования получается избыток Н3О+, в силу чего подобная ошибка называется протонной водородной) ошибкой. Если рт > рНт. э, то в конечной точке будет избыток ОН и соответствующая ошибка будет называться гидроксильной ошибкой. При титровании слабых протолитов, когда в. конечной точке остается избыток слабой кислоты, находящейся практически в полностью недиссоциированной форме, говорят о кислотной ошибке, а не O протонной. Если по изложенным причинам в конечной точке остается избыток неоттитровднного слабого основания, это обусловливает наличие основной ошибки. [c.253]
В случае (а) гидроксильная ошибка будет в пределах точности ызмере1 11я и, следовательно, не отразится на полученных результатах. [c.254]
Если эта избыточная кислота является сильной и, следовательно, присутствует в растворе в виде свободных ионов Н , ошибку называют водородной , или H -ошибкой . Наоборот, если кислота является слабой и присутствует аочти исключительно в виде недиссоциированных молекул (НА), решающее значение имеет кислотная ошибка , или НА-ошибка . Точно так же, если избыточное основание является сильным, оно обусловливает возникновение гидроксильной ошибки , или ЮН -ошибки если это основание слабое—приходится считаться со щелочной ошибкой , или МеОН-ошибкой . Рассмотрим методику вычисления всех этих четырех типов индикаторных ошибок. [c.294]
Эта величина и составляет гидроксильную ошибку титрования, обусловленную недотитрованием ОН -ионов. [c.140]
Гидроксильная ошибка может быть двух видов ОНнед-ошибка и ОНпер-ошибка. [c.353]
Основы аналитической химии Часть 2 (1965) — [
c.111
,
c.113
]
Основы аналитической химии Книга 2 (1961) — [
c.137
]
Основы аналитической химии Издание 3 (1971) — [
c.154
,
c.156
]
Основы аналитической химии Кн 2 (1965) — [
c.111
,
c.113
]
1.
Индикаторные ошибки
кислотно-основного титрования
1
2.
Водородная ошибка возникает, когда
недотитрована сильная кислота,
перетитровано сильное или слабое основание
Водородная ошибка – отношение количества
ионов водорода n(H+) в конце титрования к
первоначально взятому количеству вещества
n(X)
n
(H+)к.т.
X(H+) = ———— · 100%
n(X)
2
3.
n(X) = Сэкв(Х) · V(X)
Сэкв(Х) – молярная концентрация эквивалента
первоначально взятого вещества
V(X) – объем первоначально взятого вещества
n(H+)к.т. = [H+]к.т.· Vк.т.
Vк.т. – объем в конце титрования
Vк.т. = V(X) + V(Т)
3
4.
+] · (V(X) + V(Т))
[H
к.т.
+
X(H ) = ——————————— · 100%
С(1/z Х) · V(X)
рНк.т. = рТInd
[H+]к.т = 10–рН = 10–рТ
–рТ · (V(X) + V(Т))
10
X(H+) = ————————— · 100%
Сэкв(Х) · V(X)
4
5.
Гидроксильная ошибка обусловлена наличием
гидроксид-ионов в конце титрования и возникает, когда недотитровано сильное основание,
перетитрована сильная или слабая кислота
n(OH–)к.т.
X(OH–) = ———— · 100%
n(X)
n(OH–)к.т = [OH–]к.т. · (V(X) + V(Т))
n(X) = Сэкв(Х) · V(X)
–]
[OH
·
(V
(X) + V(Т))
к.т.
X(OH–) = —————————— · 100%
Сэкв(Х) · V(X)
5
6.
рНк.т. = рТInd
т.к. рН + рОН = 14
рОН = 14 – рН = 14 – рТ
[OH–] = 10–(14 – рТ) = 10рТ–14
рТ–14 · (V(X) + V(Т))
10
X(OH–) = —————————— · 100%
Сэкв(Х) · V(X)
6
7.
Кислотная ошибка возникает, когда остается
недотитрованной слабая кислота
Кислотная ошибка – отношение концентрации
недотитрованной кислоты в конце титрования
к ее оттитрованной части
HA + KOH H2O + KA
[HA]к.т.
X(HA) = ———— · 100%
[A–]к.т.
Оттитрованная часть кислоты будет
определяться анионами соли
7
8.
HAк.т. H+к.т. + A–к.т.
[H+]к.т. · [A–]к.т.
Kк-ты = ———————
[HA]к.т.
[HA]к.т. [H+]к.т.
———=
———
[A–]к.т.
Kк-ты
[H+]к.т.
X(HA) = ———— · 100%
Kк-ты
8
9.
рНк.т. = рТInd
[H+]к.т = 10–рН = 10–рТ
Kк-ты = 10–рК
10–рТ
X(HA) = ———— · 100%
10–рКк-ты
X(HA) =10рКк-ты–рТ · 100%
9
10.
Основная ошибка возникает, когда остается
недотитрованным слабое основание
Основная ошибка – отношение концентрации
неоттитрованного основания в конце
титрования к его оттитрованной части
[BOH]к.т.
X(BOH) = ———— · 100%
[B+]к.т.
10
11.
Аналогично с кислотной ошибкой можно
показать
[BOH]к.т.
[OH–]к.т.
—————
=
—————
[B+]к.т.
Kосн
[OH–]к.т.
X(BOH) = ———— · 100%
Kосн
Т.к. [OH–]к.т. = 10рТ–14
Kосн = 10–рКосн
11
12.
10рТ–14
X(BOH) = ———— · 100%
10–рКосн
X(BOH) =10рКосн + рТ–14 · 100%
12
13.
Вычислить ошибку титрования 0,2 н. раствора
HCl 0,2 н. раствором NaOH с индикатором
метиловым оранжевым.
рТ(м/о) = 4
ошибка водородная
–рТ · (V(X) + V(Т))
10
X(H+) = ————————— · 100%
Сэкв(Х) · V(X)
–4 · (10 + 10)
10
X(H+) = ——————— · 100 = 0,1%
0,2 · 10
Индикаторная ошибка должна быть 0,1%
13
14.
Вычислить индикаторную ошибку титрования
0,2 н. раствора HCl 0,2 н. раствором NaOH с
индикатором фенолфталеином
рТ(ф/ф) = 9
ошибка гидроксильная
рТ–14 · (V(X) + V(Т))
10
X(OH–) = —————————— · 100%
Сэкв(Х) · V(X)
9–14 · (10 + 10)
10
X(OH–) = ——————— · 100 = 0,01 %
0,2 · 10
14
15.
Вычислить ошибку титрования 0,1 н. раствора
муравьиной кислоты 0,1 н. раствором сильного основания с индикатором метиловым
красным
рТ(м/к) = 5
рК(HCOOH) = 3,76
рНт.э. = 7 + ½ рКк-ты + ½ lg Cсоли = 8,38
Раствор недотитрован ошибка кислотная
15
16.
X(HA) =10рКк-ты–рТ · 100%
X(HA) =103,76–5 · 100 = 5,7 %
Индикатор использовать нельзя.
16
17.
Чему равна ошибка титрования 0,1 н. раствора
аммиака 0,1 н. раствором HCl с индикатором
крезоловым пурпуровым
рТ(к/п) = 8
рК(NH4OH) = 4,75
рНт.э. = 7 – ½ рКосн – ½ lg Cсоли = 5,10
Раствор недотитрован ошибка основная
X(BOH) =10рКосн + рТ–14 · 100%
X(BOH) =104,75 + 8–14 · 100 = 5,6%
17
