Изменения в хромосомном наборе плода могут вызвать серьезные проблемы со здоровьем и спровоцировать образование врожденных дефектов у новорожденного ребенка. Существуют методы диагностики, которые позволяют выявить некоторые генетические заболевания ещё при беременности.
Примерно половину хромосомных и генетических патологий можно обнаружить на первых этапах беременности, когда ещё можно успеть сделать аборт, и даже до зачатия.
Что такое гены и хромосомы?
Гены и хромосомы хранят информацию о росте человека, цвете волос, глаз и других признаках. Ребенок получает их от своих родителей. Иногда происходит изменение хромосомы. Это может спровоцировать развитие таких опасных заболеваний, как муковисцидоз, серповидно-клеточная анемия и т.д..
Изменения на генном уровне становятся причиной врожденных внутренних или внешних пороков у ребенка. Происходят аномалии в развитии частей тела или внутренних органов. Одно из таких нарушений — порок сердца.
У каждого человека есть 23 пары хромосом, где в паре одна хромосома от отца, а другая от матери. Одно из наиболее распространенных хромосомных нарушений — синдром Дауна, когда в двадцать первой паре имеется лишняя третья хромосома.
Что такое генетическое консультирование?
Генетическое консультирование помогает понять, как возникают врожденные дефекты и другие заболевания в семьях. Врач выявляет причины развития генетических заболеваний, советует доступные виды тестирования, определяет шансы родить здорового ребенка.
Как узнать, подвержен ли ребенок генетическому заболеванию?
Ребенок может подвергаться повышенному риску на генетическом уровне, если:
- У одного из родителей имеется генетическое заболевание;
- В семье есть ребенок с генетическими отклонениями;
- Генетическое заболевание встречается в семье одного из родителей или этнической группе партнера. Этническая группа – это группа людей, которые разделяют язык и культуру.
Генетик изучает историю здоровья семей обоих родителей, чтобы узнать больше о генах и хромосомах, которые могут повлиять на здоровье будущего ребенка.
Какие тесты можно пройти до беременности, чтобы узнать о генетических отклонениях, способных в будущем повлиять на здоровье потомства?
При планировании беременности можно пройти скрининг-тесты, чтобы определить, является ли человек носителем определенных генетических заболеваний или нет. Обследование до беременности может помочь оценить все риски и принять решение.
Женщинам рекомендуются следующие виды обследования:
-
- На муковисцидоз (кистозный фиброз). Это состояние, которое влияет на работу дыхательной системы и органов пищеварения.
- На спинальную мышечную атрофию. Заболевание, которое поражает нервные клетки спинного мозга. Это ослабляет мышцы и влияет на способность человека передвигаться, дышать, глотать, держать голову, контролировать шею.
- На талассемию. Заболевание, которое влияет на работу органов кроветворения, замедляя выработку здоровых эритроцитов и гемоглобина.
- На гемоглобинопатию.
Консультант-генетик может порекомендовать пройти обследование на основе семейной истории здоровья:
- Синдром ломкой Х-хромосомы. Такое состояние возникает, когда организм не может вырабатывать достаточное количество белка, необходимого для роста и развития мозга.
- Болезнь Тея-Сакса. Это состояние, которое приводит к гибели нервных клеток мозга и позвоночника. Часто встречается у этнической группы евреев-ашкенази.
При экстракорпоральным оплодотворении супружеской паре может быть предложено предимплантационное тестирование, в ходе которого проверяются клетки эмбриона на предмет изменения генов, прежде чем он будет помещен в матку.
В этом случае повышается шанс родить здорового ребенка, у которого не будет нарушений на генном уровне.
Какие тесты проводятся во время беременности для выявления генетических аномалий, влияющих на развитие плода?
Диагностика, которая выполняется во время беременности:
- Скрининговые тесты, в том числе бесклеточное тестирование ДНК плода, скрининг в первом триместре и скрининг материнской крови. Они помогают определить, подвержен ли ребенок риску развития определенных генетических заболеваний, в том числе и синдром Дауна.
- Диагностические тесты, включая амниоцентез (также называемый амнио) и отбор проб ворсин хориона. Если скрининг-тест показывает, что ребенок может быть подвержен риску какого-либо заболевания, врач направляет женщину на диагностический тест, например, амнио, чтобы точно это выяснить.
Каковы преимущества и риски тестирования?
Преимущества своевременного тестирования в том, что семейная пара сможет узнать о состоянии здоровья будущего потомства следующее:
- Подвержен ли ребенок риску или не будет иметь генетическое заболевание.
- При выявлении рисков появляется возможность предотвращения развития патологии.
- При обнаружении серьезных отклонений у плода женщина может принять решение о прерывании беременности.
Риски тестирования:
- Результаты могут повлиять на эмоциональное состояние человека, лишить его надежды на возможность иметь детей.
- Тестирование может повлиять на взаимоотношения между членами семьи: не каждый захочет поделиться информацией о своем здоровье.
- Тестирование может не дать достаточно информации о состоянии будущего ребенка.
Физические риски тестирования минимальны. Во многих тестах используется только образец крови или слюны.
Исключение — амнио-обследование может спровоцировать выкидыш, потому что берется образец околоплодной жидкости.
Какие проблемы могут вызывать генетические заболевания во время и после беременности?
Генетические отклонения могут вызвать выкидыш или мертворождение. Более половины выкидышей вызваны именно хромосомными состояниями.
Мертворождение — это когда ребенок умирает в утробе матери до рождения, но после 20 недель беременности.
Каждый ребенок, родившийся с генетическим заболеванием, отличается от здоровых детей. Проблемы зависят от того, какие хромосомы затронуты. В большинстве случаев младенцы имеют интеллектуальные нарушения или врожденные дефекты.
Интеллектуальные нарушения — это проблемы с работой головного мозга, которые вызывают задержки в физическом развитии, обучении, общении, заботе о себе.
Всегда ли нарушение здоровья и врожденные дефекты бывают из-за нарушений на генном уровне?
Не всегда. Все причины неизвестны, но выявлены факторы, влияющие на здоровье и развитие малыша:
- курение;
- употребление алкоголя;
- использование наркотиков;
- злоупотребление медикаментозными препаратами;
- постоянное контактирование с вредными химическими веществами.
Поделиться ссылкой:
Каждая десятая беременность останавливается в развитии на ранних сроках [Gardner et al., 2012]. Около 50% случаев остановки развития плода на ранних сроках связано с генетическими причинами [Warburton, 2000].
И чем меньше срок остановки беременности, тем чаще мы находим различные хромосомные сбои со стороны плодного яйца. И получается, что судьба такого эмбриона закладывается не во время беременности, когда мы можем повлиять каким-то назначениями, гормональными препаратами и так далее, а до встречи яйцеклетки и сперматозоида или прямо в момент зачатия, либо на самых ранних стадиях, когда происходит дробление образовавшейся зиготы.
Анализ кариотипа материала плода позволяет выявить такие причины и оценить риск невынашивания беременности в дальнейшем.
С помощью современных методов исследований можно определить не только грубую численную патологию (изменение количества хромосом), но и структурные изменения, которые могли повлиять на течение беременности.
В большинстве случаев эта ситуация не повторяется, и следующая беременность протекает благополучно.
Поэтому большинство международных ассоциаций, занимающихся невынашиванием беременности, не рассматривают однократную остановку развития беременности на малом сроке как какую-то отдельную патологию: во многих случаях это бывает частью обычного, естественного отбора, когда женский организм сам не допускает развития сбойного эмбриона, образовавшегося в результате зачатия.
В этой статье мы разберем, как часто и какие происходят генетические поломки, как их выявить и что делать дальше.
Врачи центра иммунологии и репродукции имеют большой опыт работы в этой области, так как мы занимаемся сложными случаями невынашивания беременности. В этих случаях пару консультирует не только акушер-гинеколог, но и генетик, и андролог, и эндокринолог. Если семья находится в другом городе или даже стране, мы консультируем онлайн.
Для исследования кариотипа плода ( генетическое исследование материала абортуса) материал принимается как в клиниках, так и по почте из других городов России.
Оплодотворение и имплантация
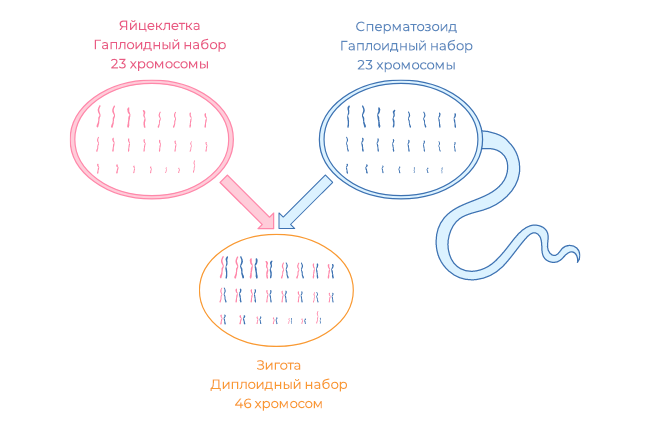
Яйцеклетки будущей мамы закладываются еще во внутриутробном периоде. После рождения часть из них гибнет, а часть проходит развитие и может быть оплодотворена сперматозоидом.
К моменту рождения количество яйцеклеток остается примерно 300-400 тыс. Но лишь небольшая часть фолликулов может пройти полный цикл своего развития – от примордиального до преовуляторного и достичь овуляции – высвобождения яйцеклетки для оплодотворения сперматозоидом.
Так происходит зачатие и образование зиготы и эмбриона.
Через 6 дней после оплодотворения (то есть в среднем на 20 день цикла) происходит имплантация плодного яйца в полость матки. Чуть позже, ближе к первому дню предполагаемой менструации беременность можно определить с помощью анализа на ХГЧ. А ультразвук сможет показать беременность ещё позже – на 5-6 неделях беременности, когда уровень ХГЧ становится больше 1000 МЕ/л.
Остановка развития беременности
Остановка развития беременности может быть связана с разными факторами.
Во многих случаях остановка в 1 триместре носит характер естественного отбора, который является частью биологии человека. Большое количество эмбрионов несет генетические сбои, при которых дальнейшее их развитие становится просто недопустимым. Исправить генетический материал уже образовавшейся зиготы или эмбриона невозможно и организм женщины не продолжает такую беременность. Это случается примерно в 10-15% случаев клинически подтверждённых беременностей и гораздо чаще на сроках, когда беременность еще не подтверждена.
Невынашивание беременности в очень большом проценте случаев является биологическим процессом, который обеспечивает недопущение развития эмбрионов с хромосомными сбоями.
Чтобы понять, почему это происходит, надо разобраться с биологическим разнообразием.
Гаметогенез (то есть образование яйцеклеток сперматозоидов) устроен так, чтобы яйцеклетки не были похожи друг на друга, были разнообразными. И сперматозоиды тоже. Для этого происходит процесс рекомбинации, то есть перегруппировки генетического материала между хромосомами. И это может приводить к возникновению ошибок.
В случае крупной поломки остановка развития такой беременности происходит ещё до имплантации — просто приходит очередная менструация. И женщина в данной ситуации не догадывается о происходящем в ее организме.
Если поломка не такая существенная, то имплантация может произойти, но, чаще всего такие беременности останавливаются в развитии до 8 недель.
В этом случае возможны следующие клинические ситуации:
- Биохимическая беременность — никак не проявлялась, кроме кратковременноего небольшого повышения уровня ХГЧ, субъективных признаков беременности, наступления очередной менструации с небольшой задержкой.
- Остановка развития беременности по УЗИ, анэмбриония (пустое плодное яйцо).
- Самопроизвольный выкидыш.
Тактика действий подробно разобрана в статье о невынашивании беременности.
Привычное невынашивание беременности
Под привычным невынашиванием беременности понимают два и более выкидыша подряд. Такая ситуация встречается гораздо реже — примерно у 3% пар, планирующих рождение ребёнка. В этом случае причины чаще всего другие. А факторами риска привычного невынашивания беременности является потеря плода с нормальным хромосомным набором, прерывание после 1 триместра беременности, предшествующее бесплодие и осложнения второй половины беременности. В этом случае показано глубокое обследование с исключением всех факторов риска, в том числе, кариотипирование. И при исключении родительских генетических причин ЭКО с ПГТ также не является способом лечения данного состояния. Однако, проведение генетического анализа материала абортуса и в этом случае может быть полезным для оценки ситуации с привычным невынашиванием беременности. Сдать такой анализ можно в нашей лаборатории ЦИР.
Хромосомы человека
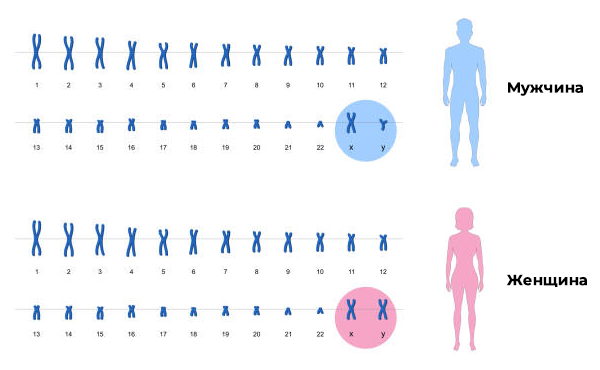
Практически весь генетический материал человека — ДНК — собран в структуры, называемые хромосомами. Они находятся в ядрах клеток.
В каждой клетке человека (кроме половых), находится 46 хромосом – 22 пары так называемых аутосом и 1 пара половых хромосом. У женщин половые хромосомы – ХХ, у мужчин – Х и Y. Одна из хромосом каждой пары получена от матери, а вторая от отца.
В половых клетках по 23 хромосомы. Соединившись, половые клетки мужчины и женщины снова дадут набор из 46 хромосом.
Каждая пара хромосом имеет свою структуру, размер и внешний вид. Существуют специальные методы окраски, которые позволяют отличать хромосомы друг от друга, а ещё оценивать правильность их структуры.
Первая хромосома — самая большая. Чем крупнее хромосома, тем больший эффект она оказывает на развитие организма. Самая маленькая аутосома – хромосома 21 пары.
По своим размерам и строению хромосомы объединяются в группы от A до G.
Кроме того, в каждой хромосоме находятся определенные гены. Поэтому в зависимости от места повреждения генетического материала проявления могут быть различными.
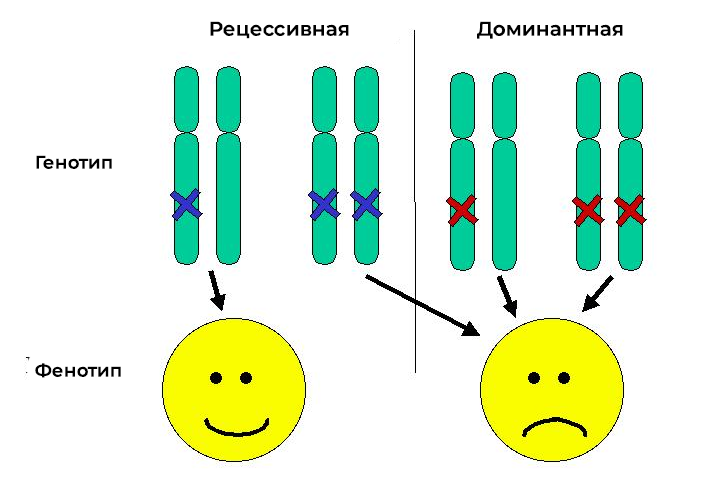
Так как все хромосомы, кроме половых, двойные, гены, содержащиеся в них, тоже двойные. Это тоже оказывает своё влияние на проявление ошибок. Есть состояния, которые проявляются только в том случае, если обе копии гена повреждены — рецессивные признаки. Но есть и такие, для которых достаточного одного повреждённого гена — они называются доминантные.
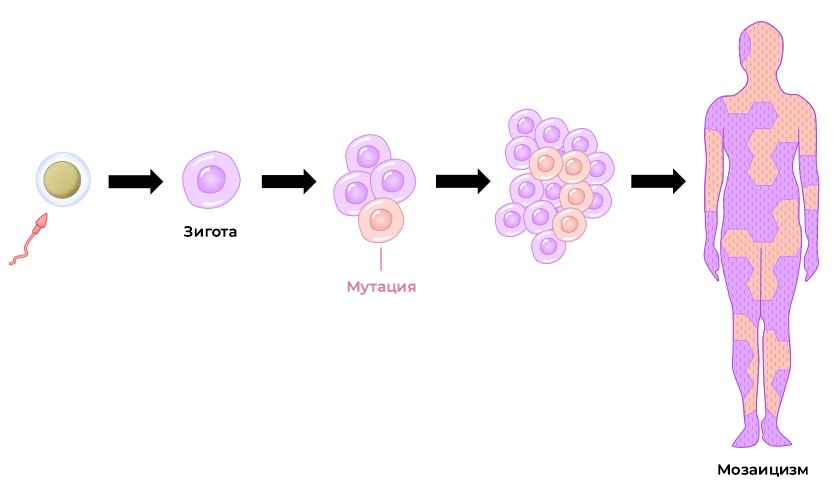
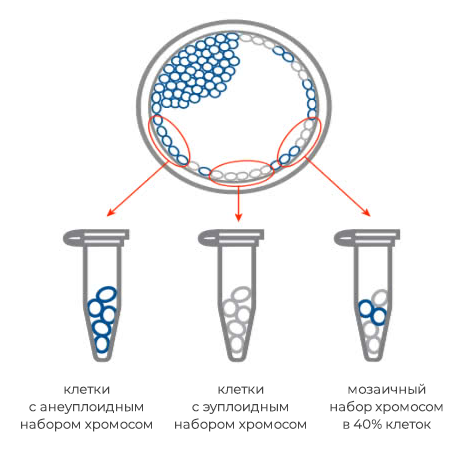
Мозаицизм — это состояние, при котором в организме присутствуют клетки с разными наборами хромосом: часть клеток характеризуется нормальным набором хромосом, а другая – наличием дефектной хромосомы. Есть низко- и высокоуровневый мозаицизм. Они отличаются количеством клеток с изменённым хромосомным набором и, соответственно, выраженностью клинической картины.
Чаще всего с мозаицизмом связаны трисомии. Мозаичная форма может наблюдаться при синдромах Дауна, Клайнфельтера, Шерешевского–Тёрнера, Эдвардса.
Генетические причины остановки развития беременности
Итак, в процессе созревания половых клеток и на ранних этапах после их слияния могут возникать повреждения генетического материала. Их условно разделяют на количественные и качественные. При количественных изменяется число хромосом или их участков, а при качественных меняется их структура.
Для выявления таких изменений используются различные генетические методы, а запись результата делается по специальному справочнику – цитогенетической номенклатуре (ISCN).
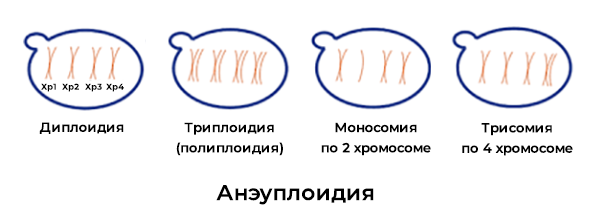
Количественные изменения
Количественные изменения могут быть представлены лишней или недостающей хромосомой или её участком, или кратным увеличением всего хромосомного набора.
Термин анеуплоидии означает лишнюю или недостающую копию хромосомы из пары. Термин полиплоидии говорит об увеличении всего хромосомного набора.
Существуют 4 типа числовых хромосомных аномалий, дающих начало беременности, которые может доходить до достаточно продвинутого срока в первом триместре и потом прерываться.
Это моносомии – одна хромосома в паре вместо двух, трисомии – три хромосомы вместо двух, триплоидии и тетраплоидии – умножение всего хромосомного материала в 3 и 4 раза соответственно.
В некоторых случаях присутствует не одно, а два или даже больше нарушений — например, трисомия по двум хромосомам.
Наиболее частыми аномалиями являются трисомии (61,2%), далее следуют триплоидии (12,4%), моносомии Х (10,5%), тетраплоидии (9,2%) и структурные хромосомные аномалии (около 5%) [Eiben et al., 1990]
Трисомии по аутосомам
Самая большая группа хромосомных аномалий – это различные трисомии, когда по какой-то паре хромосом у зародыша имеется не две одинаковые хромосомы, а три. Это связано с тем, что лишнюю хромосому принес либо сперматозоид, либо яйцеклетка в результате нарушения деления. Частота трисомий увеличивается с возрастом матери.
Практически все трисомии по аутосомам прерываются в первом триместре беременности.
- всегда прерываются на ранних сроках беременности трисомии по хромосомам 1, 2, 3, 4, 5, 6, 14, 15, 16;
- в 1% случаев продолжаются в клиническую беременность (трисомии по 13, 18 и 21 хромосомам, мозаичная форма трисомии по 22 хромосоме);
В ряде случаев трисомия сочетается с другими хромосомными аномалиями — другими трисомиями, моносомиями, полиплоидией, структурными хромосомными аномалиями.
Иногда речь идет о мозаицизме — когда кроме клеток с трисомией существует линия клеток с нормальными кариотипом. В целом такие эмбрионы являются более жизнеспособными.
Моносомия Х: синдром Шерешевского–Тёрнера
Единственная моносомия, которая развивается в клиническую беременность, это моносомия Х, то есть одна Х хромосома вместо двух. Запись кариотипа при этом состоянии: 45,X или arr(X)x1,(Y)x0 или sseq(X)x1,(Y)x0
47,ХXX или arr(X)x3, или sseq(X)x3
47,ХXY или arr(X)x2,(Y)х1, sseq(X)x2,(Y)х1
47,ХYY или arr(X)x1,(Y)х2, sseq(X)x1,(Y)х2
В случае такого кариотипа в 1% случаев беременность продолжает развиваться после 8 недель и может давать начало рождению девочки.
Девочки с кариотипом 45,X0 имеют чаще всего сохранное интеллектуальное развитие и особенности развития внутренних органов (низкий рост, короткая шея, избыточный вес, в некоторых случаях пороки развития внутренних органов, недоразвитие вторичных половых признаков). Количество фолликулов в яичниках резко уменьшено, или они полностью отсутствуют. И это приводит к недостаточности женских половых гормонов, половому недоразвитию, гипоплазии матки и яичников, что в итоге приводит к первичной аменорее и бесплодию.
Мозаицизм 45,X/46,XХ — наиболее распространенный мозаицизм половых хромосом. У таких девочек имеются более легкие черты синдрома Тёрнера, а многие женщины прошли половое созревание и смогли воспроизвести потомство.
Другие моносомии
Все остальные моносомии по любой, даже по самой маленькой 21-ой хромосоме, останавливаются в развитии или до имплантации, или на самых ранних сроках после имплантации, когда размеры эмбриона очень малы. В литературе при детектируемой на УЗИ беременности такие случаи описаны, но это крайне редкие варианты.
Немного чаще можно встретить мозаичный вариант, когда часть клеток организма имеют нормальный хромосомный набор, а часть клеток — моносомию по Х хромосоме.
Результат анализа при мозаицизме: mos 45,X0 [42]/46,XX.
Увеличение количества половых хромосом
Если говорить об изменении количества половых хромосом, то возможно несколько вариантов, самыми частыми из которых являются 47,XXX (трисомия по Х) и 47,XXY (синдром Кляйнфельтера). Кроме того, возможен XYY-синдром, также известен как дисомия Y хромосомы у мужчин или Синдром Джейкобс.
Записи кариотипов соответственно:
47,ХXX или sseq(X)x3.
47,ХXY или sseq(X)x2,(Y)х1.
47,ХYY или sseq(X)x1,(Y)х2.
В литературе сообщалось о случаях большего количества половых хромосом — 49,XXXXY, 49,XXXXX, 49,XYYYY. Увеличение числа половых хромосом утяжеляет проявления как физические, так и интеллектуальные.
Трисомия Х
47,XXX — женский кариотип при трисомии по Х хромосоме. Такой вариант трисомии может проявляться незначительными неспецифическими симптомами, а может и не проявлять вовсе, и носительницы лишней Х хромосомы чаще всего не подозревают о своей особенности. Данная трисомия может проявляться в раннем возрасте нарушением развития речи, моторики и координации. Репродуктивная функция чаще в норме, но может развиваться преждевременное истощение яичников.
Синдром Кляйнфельтера
Кариотип при синдроме Кляйнфельтера — 47,XXY.
Кариотип 47,XXY (мальчик с синдромом Кляйнфельтера) является результатом нерасхождения половых хромосом. Этот синдром также чаще всего остается нераспознанным, чаще всего его устанавливают у взрослого пациента в случае обследования по поводу бесплодия в браке. Проявляется в основном гинекомастией (увеличением грудных желез) и признаками гипогонадизма.
XYY-синдром
В процессе сперматогенеза происходит ситуация, когда сперматозоид несёт вторую Y-хромосому и в результате оплодотворения появляется эмбрион с 47 хромосомами. Большая часть носителей не подозревает о своей особенности. Дети с данной триплоидией развиваются нормально, иногда могут быть проблемы с чтением или письмом. Взрослые мужчины отличаются высоким ростом и в редких случаях повышенным уровнем половых гормонов, что нарушает сперматогенез и может приводить к бесплодию.
Полиплоидии
При исследовании генетического материала после остановки развития беременности, триплоидии (69 хромосом) и тетраплоидии (92 хромосомы) являются частыми находками.
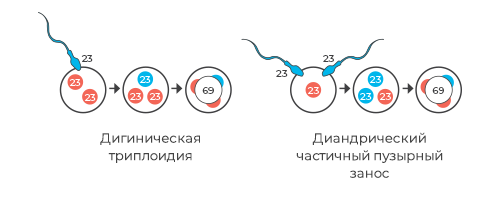
Триплоидии
Триплоидии – когда либо сперматозоид, либо яйцеклетка принесли двойной хромосомный набор вследствие нарушения деления; либо яйцеклетка нарушила механизм моноспермии и оплодотворилась сразу двумя сперматозоидами. В зависимости от того, что было источником лишнего хромосомного набора: сперматозоид или яйцеклетка, такая беременность будет развиваться по-разному.
Если лишний хромосомный набор пришел с яйцеклеткой, это может проявляться остановкой развития беременности до 12 недель или анэмбрионией (эмбрион не обнаруживается, или погибает на малых сроках).
Если же лишний хромосомный набор пришел со стороны сперматозоида, то это будет совершенно другая картина – это будет картина пузырного заноса, полного или частичного.
Пузырный занос
Возможные варианты кариотипа при триплоидии: 69,XXX, 69,XXY, 69,XYY.
Читайте также:
- Пузырный занос. Трофобластическая болезнь. Трофобластические опухоли беременности.
Тетраплоидии
Тетраплоидии — состояние, когда хромосомный набор составляет 46+46, то есть, 92 хромосомы. Такие зародыши также останавливаются в развитии в первом триместре беременности.
Возможные варианты кариотипа: 92,XXXX, 92,XXYY, 92,XXXY.
Хромосомные перестройки
Помимо количественных аномалий встречаются и такие мутации, при которых изменяется структура хромосом. Чаще всего они возникают спонтанно или под действием мутагенных факторов, а также могут передаваться от родителей.
Хромосомные перестройки подразделяют на сбалансированные и несбалансированные.
Несбалансированные хромосомные перестройки – это в т.ч. количественные хромосомные аномалии (делеции/дупликации).
Сбалансированные хромосомные перестройки — когда весь генетический материал сохранился, просто изменилось его расположение. К ним относятся сбалансированные транслокации, инверсии, инсерции.
Несбалансированные хромосомные перестройки — когда есть дополнительный или недостающий генетический материал – робертсоновские транслокации, делеции и дупликации.
Транслокация – перенос участка одной хромосомы на другую, они обнаруживаются у 5% пар после повторяющихся выкидышей.
Пациенты со сбалансированными транслокациями здоровы, однако, эмбриону (в силу особенностей развития половых клеток) может передаваться избыток и/или недостаток хромосомного материала и перестройка становится несбалансированной.
Среди пар с привычным невынашиванием беременности около 60% транслокаций реципрокные, и 40% — робертсоновские.
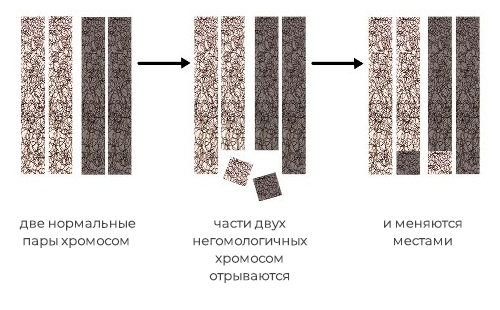
Существует два основных вида: робертсоновская и реципрокная транслокация.
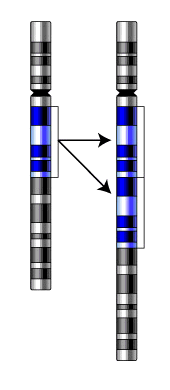
Реципрокные транслокации – характеризуются взаимным обменом участками между двумя хромосомами, при этом количество хромосомного материала не меняется, изменяется только его расположение.
При реципрокной транслокации два фрагмента разных негомологичных (не из одной пары) хромосом отрываются и меняются местами, при этом генетический материал не утрачивается. Однако, у носителей данной транслокации половина гамет (яйцеклеток или сперматозоидов) несёт несбалансированный генетический материал, что приводит к снижению фертильности, повышенной вероятности спонтанных выкидышей и рождения детей с врождёнными аномалиями.
Робертсоновские транслокации – характеризуются слиянием двух акроцентрических хромосом как гомо-, так и гетерологичных.
Робертсоновские транслокации являются одним из наиболее распространенных типов врождённых хромосомных аномалий у человека. Возникают тогда, когда одна хромосома соединяется с другой негомологичной хромосомой, при этом утрачивая генетический материал короткого плеча, но это не приводит к отклонениям в развитии носителя такой транслокации за счет функциональной незначимости потерянного материала.
Носители внешне абсолютно нормальны, однако у них также существует риск самопроизвольных выкидышей и рождения детей с несбалансированным кариотипом, который существенно варьирует в зависимости от хромосом, вовлеченных в слияние, а также от пола носителя.
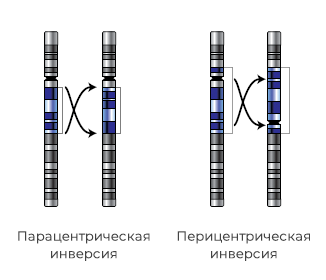
Инверсия – изменение порядка генов участка хромосомы на обратный, то есть поворот участка хромосомы на 180 градусов. Это не приводит к потере генетического материала и в большинстве случаев не влияет на здоровье носителя.
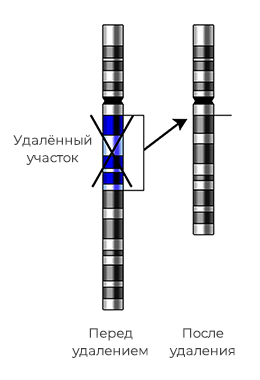
Делеции – утрата участка хромосомы. Крупные делеции (потеря значительного участка генетического материала) встречаются очень редко, так как в большинстве случаев это приводит к гибели эмбриона на ранних сроках. Однако, существует хорошо известное заболевание, причиной которого является делеция участка короткого плеча пятой хромосомы — болезнь кошачьего крика или синдром Лежена. Синдром проявляется недоразвитием гортани у детей (крик, напоминающий кошачье мяуканье), характерный внешний вид (лунообразное лицо с широко расставленными глазами), нарушением функций пищеварительной и сердечно-сосудистой систем.
Дупликации – удвоение участка хромосомы. Такие изменения влияют на развитие и здоровье человека в зависимости от количества и состава удвоенных генов, и у разных людей будут различные неспецифические проявления.
Несбалансированные транслокации (реципрокные и робертсоновские) – избыток или недостаток генетического материала вследствие несбалансированного обмена участками между двумя хромосомами.
Изохромосомы – представляют собой аномальную хромосому, у которой одно плечо утрачено, а второе «удвоилось», зеркально отобразилось относительно центромеры.
Методы определения кариотипа плода
В первом триместре беременности кариотип определяется в клетках ворсин хориона. На более поздних сроках — фрагменты органов (например, печени, в зависимости от метода).
Выделяют следущие методы определения кариотипа плода:
- стандартное цитогенетическое исследование — когда подготавливают стекло с препаратами окрашенных хромосом и смотрят их под микроскопом;
- молекулярно-генетические исследования — когда генетический материал исследуют с помощью специальных методов с использованием программного обеспечения;
- молекулярно-цитогенетический блок (FISH).
Мы рекомендуем проведение генетического исследования в случае остановки даже первой беременности, так как прогноз по будущим беременностям пока не определён, а провести такое исследование в дальнейшем будет уже практически невозможно.
Выбрать анализ, а также проконсультироваться по результатам можно со специалистами ЦИР.
Ограничения методов
Более половины образцов ранних самопроизвольных абортов не содержат частей эмбриона/плода. Второй проблемой диагностики является плацентарный мозаицизм.
Плацентарный мозаицизм
В 1-5% случаев (в зависимости от сроков беременности) возможны расхождения между кариотипом плода и кариотипом ворсин хориона. Эти расхождения связаны с особенностями развития плаценты: с высоким процентом так называемого плацентарного мозаицизма, нестабильностью деления клеток. Это плацентарный или метатический мозаицизм, который присутствует у клеток плаценты. То есть клетки плаценты обладают определенной хромосомной нестабильностью.
Стандартное цитогенетическое исследование материала абортуса
При данном исследовании проводят культивирование клеток ворсин хориона: клетки помещают на питательную среду для их размножения. В определённый момент деление клеток останавливают, готовят препараты содержащихся в клетках хромосом и окрашивают их. Хромосомы хорошо видны в световой микроскоп.
При этом исследовании мы имеем возможность посмотреть все хромосомы, указать точное количество, рассмотреть грубые нарушения структуры.
Ограничения метода
В некоторых случаях не удаётся получить рост клеток, тогда рекомендуются некультуральные методы исследования (молекулярно-генетический анализ кариотипа абортуса).
Вторая проблема — если возникает чрезмерный рост материнских клеток, которые могут исказить результат.
В нашей лаборатории мы проводим тщательный отбор материала именно ворсин хориона, что уменьшает риск загрязнения клетками матери.
Цитогенетическое исследование позволяет не все структурные изменения увидеть – некоторые слишком малы.
Кроме того, при сборе материла также попадают материнские ткани – они также могут вырасти в культуре и дать результат по материнскому кариотипу 46,XX.
Кроме того, во время исследования анализируется лишь десяток клеток, и этого может быть недостаточно, если есть мозаицизм, то есть разные хромосомные наборы в разных клетках.
Молекулярно-генетические исследования материала абортуса
Есть несколько вариантов проведения этих анализов. Мы остановимся на комплексном тмолекулярно-генетическом исследовании абортивного материла при неразвивающейся беременности.
Молекулярно-генетическое исследование абортивного материла – это комплекс молекулярно-генетических методов, включающих полногеномный анализ всех 23 пар хромосом методом NGS и таргетный STR-анализ, используемый для установления причин неразвивающейся беременности. Проведение молекулярно-генетического исследования абортивного материала возможно на любом сроке беременности, однако для выбора необходимого метода тестирования целесообразно получение предварительной консультации врача генетика.
Огромным плюсом метода является независимость от способности к росту полученных клеток. Кроме того, мы можем увидеть гораздо более мелкие нарушения генетического материала и мозаицизм (от 20%), провести дополнительный сравнительный анализ с кровью матери и убедиться, что нормальный женский кариотип принадлежит не ей.
Ограничения метода
Однако ограничения метода всё же есть. Так как анализируется не каждая конкретная хромосома, мы их не видим, как под микроскопом, а весь пул генетического материала, мы можем не увидеть кратное его умножение (полиплоидии): с большой вероятностью могут быть детектированы варианты XXY и XYY, но не вариант ХХХ.
За счет привлечения STR-анализа, часть триплоидий можем выявлять даже для ХХХ.
Кроме того, не определяются сбалансированные изменения, когда количество хромосомного материала остаётся прежним, но меняется его положение.
| Цитогенетическое исследование абортуса | Молекулярное кариотипирование материала абортуса |
| Замершая беременность (остановка развития беременности) на сроке до 14-15 недель | Замершая беременность (остановка развития беременности) на любом сроке |
| Необходимы только живые клетки материала абортуса | Может проводиться даже когда беременность остановилась давно и живых клеток не осталось |
| Выявляет грубые нарушения кариотипа: дополнительные и недостающие хромосомы (анеуплодии), мозаицизм более 50% | Выявляет не только грубые, но и мелкие нарушения генома в пределах разрешающей способности: (анеуплоидии, триплоидии, кроме ХХХ, дупликации и делеции, однородительская дисомия и др.), мозаицизм более 20% |
| Возможно выявление полиплоидии и крупных сбалансированных аберраций | Невозможно выявление полиплоидии и сбалансированных аберраций |
| Анализ всех 23 пар хромосом | Анализ всех 23 пар хромосом |
| Не определяет контаминацию материнскими клетками | Использование дополнительных методов параллельно позволяет выявлять контаминацию материнскими клетками |
| Относительно низкая стоимость | Высокая стоимость |
| Возможный плацентарный мозаицизм |
Цитогенетическая номенклатура
Для однозначной записи результатов исследований используются специальные справочники. В настоящее время основным является Международная Цитогенетическая номенклатура International System for Cytogenetic Nomenclature, ISCN.
Эта номенклатура позволяет указать кариотип и при необходимости подробно описать каждую хромосому: ее порядковый номер, плечо (p — короткое плечо, q — длинное плечо), район, полосу и даже субполосу.
Примеры записи результатов:
| Цитогенетическое заключение | Молекулярный кариотип | |
| Нормальный женский кариотип | 46,ХХ, т. е. нормальный женский кариотип | sseq(1-22,X)x2 |
| Нормальный мужской кариотип | 46,XY, т. е. нормальный мужской кариотип | sseq(1-22)x2,(X,Y)x1 |
| Инверсия | 46,XX,inv(2)(p13p23) | не детектирует инверсию, но и причиной остановки развития она быть не может |
| Делеция | 46,ХХ,del(5)(q13q34) | sseq(5q13q34)x1 |
| Реципрокная транслокация | 46,XX,t(2;5)(q21;q31) | не дектирует сблансированную перестройку, но и причиной остановки развития она быть не может |
| Робертсоновская транслокация | 45,XX,der(15;21)(q10q10) | не дектирует такую перестройку, но и причиной остановки развития она быть не может |
В некоторых случаях при цитогенетических исследованиях не удаётся чётко распознать, какая именно хромосома и как повреждена, тогда указывается группа хромосом (например, +G) или факт повреждения (der, дериват).
Хромосомные аномалии и срок беременности
По мере увеличения срока беременности процент эмбрионов с хромосомными аномалиями уменьшается. Это связано с тем, что большинство таких хромосомных поломок не совместимы с дальнейшим развитием эмбриона, и он просто погибает – происходит выкидыш.
На более позднем сроке обнаруживаются трисомия 13, 21, 18. Напротив, трисомии 15, 16 и 22 значительно чаще встречаются на более ранних сроках.
Что касается моносомии X, показатели в группе ранних сроков беременности статистически ниже.
Для двойных трисомий в ранние сроки наблюдалась статистически значимо более высокая частота по сравнению с другими группами в целом.
О чем говорят результаты кариотипа плода
Если у эмбриона выявляется аномальный хромосомный набор, не нужно считать, что муж или жена являются больными людьми и у них идут какие-то хромосомные сбои и все последующие беременности обречены. Безусловно, нужно, чтобы родители сдали анализ на кариотип для исключения сбалансированных транслокаций. Но, как правило, это не повторяющаяся ситуация, а случайные генетические ошибки репродуктивного процесса. Развитие такого эмбриона останавливается, что экономит биологический ресурс женщины, чтобы быть готовым к тому, что в одном из следующих циклов в полость матки придет нормальное плодное яйцо.
Сдать анализ на кариотип мужа и жены и кариотип абортуса можно в нашей лаборатории.
Смотрите также:
- Цитогенетическое исследование материала абортуса (исследование хориона)
- Молекулярное кариотипирование материала абортуса
- Определение кариотипа без аберраций экспертного уровня
- Хромосомный микроматричный анализ (ХМА)
Кариотип плода и возраст матери
Кариотип плода у женщин старше 35 лет чаще содержит хромосомные аномалии, более высокая частота трисомий по 15, 21, 22 хромосомам, а также по другим нежизнеспособным трисомиям. Триплоидии чаще встречаются у более молодых женщин (до 35 лет).
Показатели трисомии 13, 18, 16 и моносомии Х не зависят от возраста, как и случаи с двойной трисомией.
Может ли нормальный эмбрион АА нести измененную генетическую информацию?
Может.
Частота анеуплоидии составляет не менее 50% у морфологически нормальных эмбрионов, анеуплоидия присутствует в 6% сперматозоидов нормальных мужчин и в 30% доноров ооцитов.
Кроме того, необходимо помнить о плацентарном мозаицизме.
Может ли быть хромосомная аномалия после нормального ПГТ?
Может.
Это связано с плацентарным мозаицизмом, который может возникнуть в постзиготическом периоде.
ЭКО без ПГТ и плацентарный мозаицизм: «Дайте матке шанс!»
В случае малого количества эмбрионов мы не рекомендуем проведение ПГТ.
Во-первых, сама по себе ПГТ повышает риски нарушения развития зародыша. Во-вторых, существует так называемый митотический мозаицизм, который может дать сбои в кариотипе наружной трофэктодермы на совсем маленьких сроках беременности. И при проведении ПГТ мы можем получить результат хромосомного набора не самого плода, а совсем другой кариотип плаценты.
Если же возникнет патология, не совместимая с нормальным развитием плода, беременность остановится.
Если у Вас есть вопросы, задавайте их в комментариях к этой статье.
- Половые хромосомы: численные и структурные аномалии
- Генетические причины замершей беременности и виды хромосомных мутаций
- Причины замершей беременности. Почему происходит остановка развития беременности
- Невынашивание беременности в 1 триместре. Причины и биологическое значение невынашивания
- «Замершая» беременность и кариотип
В соответствии с данными Всемирной организации здравоохранения (World Health Organization, WHO), у 2,5–3% новорожденных уже при появлении на свет обнаруживаются различные врожденные пороки развития (ВПР). Около 1% из них являются проявлением моногенных болезней, около 0,5% — хромосомных болезней и 1,5–2% приходится на долю ВПР, обусловленных действием экзогенных и эндогенных факторов. Частота ВПР к концу первого года жизни ребенка достигает 7% за счет проявления невыявленных при рождении пороков развития органов зрения, слуха, нервной и эндокринной систем. В Российской Федерации ежегодно на каждую тысячу новорожденных рождается 40–50 детей с врожденными и наследственными заболеваниями. Не менее 30% перинатальной и неонатальной смертности обусловлено этими формами патологии, что свидетельствует о чрезвычайной значимости их профилактики не только для семьи, но и для общества в целом [1–3].
Решающая роль в комплексе мероприятий по профилактике наследственных и врожденных заболеваний принадлежит пренатальной диагностике (ПД) — разделу медицинской генетики, возникшему в 80-х годах XX века на стыке клинических дисциплин (акушерства, гинекологии, неонатологии) и фундаментальных наук (патофизиологии, биохимии, цитогенетики, молекулярной биологии, генетики человека) [1, 2].
В России ПД регламентирована Приказом Министерства здравоохранения № 457 от 28 ноября 2000 года «О совершенствовании пренатальной диагностики в профилактике наследственных и врожденных заболеваний у детей», который до настоящего времени является основополагающим и предусматривает двухуровневый порядок обследования беременных женщин. Первый уровень заключается в проведении массового скрининга беременных акушерско-гинекологическими учреждениями (женскими консультациями, кабинетами и другими родовспомогательными учреждениями) в I и II триместрах беременности на основе использования фетальных биохимических и ультразвуковых маркеров. Второй уровень включает мероприятия по диагностике конкретных форм поражения плода, оценке тяжести болезни и прогнозу состояния здоровья ребенка, а также решение вопросов о прерывании беременности в случаях тяжелого, не поддающегося лечению заболевания плода, которые осуществляются в региональных (межрегиональных) медико-генетических консультациях [4].
С генетической точки зрения проблемы, связанные с ПД, в настоящее время уже принципиально решены. Однако эффективность дородовых профилактических мероприятий все еще остается крайне низкой, несмотря на попытки кардинальных преобразований в организационной системе ПД, предпринятых в последние годы [3, 5–8].
Учитывая то обстоятельство, что главная роль в системе мероприятий по профилактике генетической патологии плода принадлежит врачам первого контакта с беременной женщиной — акушерам-гинекологам, нами было предпринято исследование, направленное на изучение потребности в совершенствовании деятельности амбулаторного звена акушерско-гинекологической службы как первого уровня ПД генетической патологии плода.
Материал и методы исследования
Исследование выполнено на ретроспективном материале одной из женских консультаций г. Москвы. Материал исследования представили амбулаторные карты 290 женщин, состоявших на учете по беременности с 2007 г. по 2011 г. Согласно приказам, регламентирующим ПД в эти годы [4, 8], обследование беременных на I уровне включало:
1. Трехкратное ультразвуковое исследование:
1) на 10–13 неделе (оценка копчико-теменного расстояния и толщины воротникового пространства плода);
2) 20–23 недели (выявление пороков развития и эхографических маркеров хромосомных болезней плода);
3) 30–33 недели (выявление пороков развития с поздним проявлением, функциональная оценка состояния плода).
2. Обязательное двукратное исследование уровня не менее двух биохимических маркеров врожденной патологии плода:
1) плазменного протеина-А, связанного с беременностью (PAPP-A) и β-субъединицы хорионического гонадотропина (β-ХГ) на сроке 10–13 недель;
2) α-фетопротеина (АФП) и β-субъединицы хорионического гонадотропина (β-ХГ) в сроке 16–20 недель (оптимально 16–18 недель).
Концентрацию β-ХГЧ и PAPP-A в материнской сыворотке в I триместре и АФП, свободного β-ХГЧ и E3 во II триместре беременности определяли на анализаторе 6000 Delfia Xpress (Perkin Elmer, Wallac) иммунофлюоресцентным методом с разрешением по времени. Значения сывороточных маркеров считали нормальными, если они находились в пределах от 0,5 до 2,0 МоМ.
Ультразвуковое исследование (УЗИ) выполнялось на аппарате Sonix RP, оснащенном всеми типами датчиков, использующихся в акушерских исследованиях. Во всех случаях измеряли копчико-теменное расстояние (КТР) и толщину воротникового пространства (ТВП). Все измерения проводились согласно существующим рекомендациям.
Окончательный расчет риска рождения ребенка с хромосомной патологией производили в лаборатории Московского городского центра неонатального скрининга на базе детской психиатрической больницы № 6 с помощью аппаратно-программного комплекса Life Cycle, основной функциональной задачей которого является пренатальный скрининг (ПС) плода на наличие синдрома Дауна (СД) и синдрома Эдвардса (СЭ). База данных программы формировалась из листов опроса, содержащего информацию о беременной женщине, включая возраст, вес, срок беременности, курение, этническую принадлежность, количество плодов, применение экстракорпорального оплодотворения, наличие/отсутствие сахарного диабета, данные УЗИ и показатели биохимических маркеров. На основании всего массива данных программа автоматически рассчитывает риск рождения ребенка с СД и СЭ, который указывается в цифрах. Пороговое значение риска составляет 1:250. Степень риска хромосомной патологии оценивали как высокую при соотношении 1:250 и ниже.
Для сбора материала исследования была разработана специальная анкета, которая содержала полную информацию о пациентке и плоде, включая репродуктивный и семейный анамнез, подробные сведения о проведении ультразвукового и биохимического скрининга в I и II триместрах беременности, данные об исходе беременности и состоянии новорожденного. Статистическая обработка данных выполнена на индивидуальном компьютере с помощью электронных таблиц Microsoft Excel и пакета прикладных программ Statistica for Windows 7.0. Для сравнения непрерывных данных использовали t-критерий Стьюдента, статистически значимыми считались отличия при p < 0,05 (95%-й уровень значимости).
Результаты исследования
Первоочередной задачей настоящего исследования явился ретроспективный анализ точности исполнения женской консультацией приказов, регламентировавших проведение ПС беременных с 2007 по 2011 год. Как можно видеть в табл. 1, из 290 женщин, состоявших на учете по беременности с 2007 года по 2011 год, в I триместре встали на учет 201 (69,3%) женщина, во II триместре — 79 (27,1%) женщин, в III триместре — 10 (3,4%) женщин.
Ультразвуковому скринингу в I триместре беременности в положенные сроки были подвергнуты 192 (66,2%) женщины, 96 (33,8%) женщинам УЗИ не проводилось (табл. 2).
Биохимическому скринингу в II триместре беременности были подвергнуты 176 (60,7%) женщин, 114 (39,3%) женщин не были обследованы (табл. 3).
Заключения об индивидуальном риске хромосомных аномалий (ХА) у плода, автоматически рассчитанные по данным биохимического и ультразвукового скрининга в I триместре беременности, имелись в амбулаторных картах только у 172 (59,3%) беременных женщин.
Во II триместре у 77 (26,6%) беременных сроки выполнения ультразвукового скрининга были нарушены, у 29 (10%) беременных УЗИ не проводилось вовсе, только у 184 (63,4%) женщин ультразвуковой скрининг был проведен в положенные сроки (табл. 4).
Что же касается биохимического скрининга, то образцы сыворотки крови были взяты своевременно только у 52 (18,0%) беременных, у 209 (72%) женщин сроки были нарушены, а у 29 (10,0%) не получены вовсе. Заключения лаборатории об индивидуальном риске ХА у плода имелись в амбулаторных картах только у 178 (61,4%) беременных, у 112 (38,6%) беременных заключение отсутствовало.
Таким образом, ретроспективный анализ показал, что регламент проведения ПС систематически нарушался и, поскольку им были охвачены только 59,3% и 61,4% беременных женщин в I и II триместрах беременности соответственно, его нельзя считать массовым.
Для оценки результатов ПС были использованы данные о 172 беременных женщинах, в чьих амбулаторных картах имелись заключения лаборатории об индивидуальном риске хромосомных аномалий у плода в I и II триместрах беременности. В табл. 5 представлены результаты УЗ-скрининга в I триместре беременности, из которой явствует, что КТР плода определен у 161 (93,6%) беременной (у всех в пределах нормальных значений), у 11 (6,4%) беременных достоверная информация в амбулаторных картах отсутствовала; толщина воротникового пространства ТВП плода определена у 164 (95,3%) беременных (у 3 (1,8%) женщин ТВП составляла 3 мм и более, что является маркером хромосомной патологии, у 1 (0,6%) беременной определен порок развития плода — анэнцефалия). У 8 (4,7%) женщин достоверная информация в амбулаторных картах отсутствовала.
Практически у всех женщин были получены образцы крови и своевременно определены уровни β-ХГЧ и PAPP-A. В результате комбинированного скрининга в I триместре беременности из 172 беременных 18 (10,4%) женщин были отнесены к группе риска: 9 (5,2%) с высоким риском ХА у плода и 9 (5,2%) — с пороговым риском (рис.).
Все 18 (100,0%) беременных женщин, отнесенные к группе риска, были направлены в медико-генетическую консультацию, однако в амбулаторных картах имелась информация только о 2 (11,1%) из них — тех, кому проводилась биопсия хориона (хромосомная патология ни у кого выявлена не была, обе беременности были пролонгированы). Одна беременность с пороком развития плода (анэнцефалией) в I триместре была обоснованно прервана. Что же касается других 16 (88,9%) женщин из группы риска, то сведения о посещении и результатах медико-генетического консультирования в их амбулаторных картах отсутствовали. Это обстоятельство свидетельствует о недостаточной взаимосвязи между первым и вторым уровнем ПД.
Во II триместре беременности ПС подвергались 177 беременных женщин, при этом УЗИ в положенные сроки было выполнено только 99 (55,9%) из них, у 71 (40,1%) женщины сроки проведения УЗИ были нарушены. В результате УЗИ у 31 (17,5%) беременной была выявлена патология плода: внутриутробная задержка развития — у 3 (1,7%) женщин, многоводие — у 3 (1,7%) женщин, патология плаценты — у 24 (13,6%) женщин и множественные пороки развития у 1 (0,6%) женщины.
Биохимический скрининг во втором триместре беременности был проведен 172 (97,2%) беременным в надлежащие сроки, у 5 (2,8%) женщин срок взятия образцов крови был нарушен. Фетальные маркеры АФП и β-ХГЧ были определены у всех беременных.
В табл. 6 представлены результаты комбинированного скрининга 177 беременных, выраженные в значениях индивидуального риска развития дефектов невральной трубки (ДНТ) и ХА (синдромов Эдвардса и Дауна) у плода, рассчитанных с помощью программы Life Cycle.
Как можно видеть в табл. 6, из 177 беременных, подвергавшихся комбинированному скринингу во II триместре, к группе риска были отнесены 22 (12,4%) женщины: 2 (1,1%) с высоким риском развития ДНТ, 6 (3,4%) со средним и 14 (7,9%) с высоким риском развития синдрома Дауна. При этом если общее количество женщин, отнесенных к группе риска (22 женщины), принять за 100%, то в амбулаторных картах имелась информация только о 6 (27,8%) из них — тех, кто подвергался инвазивной процедуре (амниоцентезу) с целью взятия околоплодных вод для цитогенетического исследования (ни у кого хромосомная патология плода выявлена не была). Информация о других 16 (72,7%) женщинах в амбулаторных картах отсутствовала. Во II триместре у 1 (0,6%) женщины беременность была обоснованно прервана, в связи с выявленными множественными пороками развития (МПР) у плода, у 1 (0,6%) произошла внутриутробная гибель плода по причине фетофетального синдрома 3-й степени, гестоза легкой степени и выраженного многоводия, 175 (98,9%) беременностей были пролонгированы.
Данные об исходах беременностей у женщин, подвергавшихся пренатальной диагностике, представлены в табл. 7, из которой явствует, что подавляющее большинство новорожденных 173 (98,9%) были оценены по шкале Апгар на 7–10 баллов, 2 (1,1%) новорожденных — на 5–6 баллов, из 175 новорожденных 1 (0,6%) ребенок родился с гипотрофией и еще 1 (0,6%) ребенок родился с пропущенным синдромом Дауна.
С целью оценки эффективности ПД проведен сравнительный анализ исходов беременностей в двух группах женщин: 1) первая группа — беременные, подвергавшиеся ПД; 2) вторая группа — беременные, не подвергавшиеся ПД (табл. 8). Из табл. 8 явствует, что в обеих группах все показатели не имеют статистически значимых различий. Так, состояние подавляющего количества новорожденных (около 99,0%) в той и другой группе было оценено по шкале Апгар на 7–10 баллов. В той и другой группе родилось по одному ребенку с синдромом Дауна. Полученные результаты свидетельствуют о низкой эффективности проводимой ПД.
Учитывая то обстоятельство, что ПД врожденных и наследственных болезней является областью медицинской генетики, реализация которой на первом уровне находится в компетенции акушеров-гинекологов, была предпринята попытка выяснить степень осознанности врачами акушерами-гинекологами сущности и принципов организации этого вида деятельности. С этой целью были использованы тестовые задания (31 вопрос) по основным разделам ПД, позаимствованные из сборника тестовых заданий по специальности «Генетика» [9]. В инкогнито-тестировании участвовали 7 врачей-гинекологов. В среднем количество правильных ответов составило 17,7 (56,2%), что свидетельствует о недостатке знаний у врачей акушеров-гинекологов, касающихся медико-генетических аспектов ПД.
Обсуждение полученных результатов
Во всех странах мира каждый 20-й ребенок рождается с врожденной патологией генетической природы. При этом 2–3 из 100 новорожденных, появляются на свет с несовместимыми с жизнью или тяжелыми пороками развития, которые можно было бы выявить в период беременности. Поскольку 95% ВПР, включая ХА, как правило, являются спорадическими, то в группе риска находится каждая беременная женщина. Поэтому ПД носит массовый характер [1, 2, 3, 6, 10]. Все большее распространение в практике работы медико-генетических учреждений в мире находит обследование беременных в I триместре. Выявление патологии во II триместре беременности сопряжено с моральными проблемами и рядом акушерских осложнений, связанных с прерыванием беременности в поздние сроки [7, 11–16].
Ретроспективный анализ нашего исследования показал, что как раз массовый характер скрининга беременных в I триместре женская консультация не обеспечивает. Из общего количества женщин, состоявших на учете по беременности с 2007 по 2011 год, в I триместре встали на учет 69,3%, а ПС подверглись 59,3% беременных женщин. Эти данные свидетельствуют, что организация исполнения приказа МЗ РФ № 457 и других приказов, регламентировавших ПД с 2007 по 2011 год, является неудовлетворительной и свидетельствуют о недостаточной готовности амбулаторного звена акушерско-гинекологической службы к переходу на ПС только в I триместре.
Практическая эффективность и целесообразность трехкратного ультразвукового скринингового обследования беременных на сроках 11–14, 20–22, 32–34 недели беременности научно доказана [1, 11, 13]. Судя по данным нашего исследования и, несмотря на то, что во II триместре беременности сроки проведения УЗИ у 47,5% женщин были нарушены, этот вид скрининга позволил выявить патологию плода у 17,5% беременных. Полученные данные подтверждают актуальность УЗ-скрининга во II триместре беременности, особенно для тех женщин, кто не проходили обследование в I триместре.
Однако сравнительный анализ исходов беременности у женщин, подвергавшихся и не подвергавшихся ПД, не выявил никаких достоверных различий по всем тестируемым параметрам. В той и другой группе родилось по одному ребенку с пропущенным синдромом Дауна, что свидетельствует о низкой эффективности ПД.
Проведенное тестирование врачей акушеров-гинекологов на знания основ ПД свидетельствует о недостатке их знаний. По-видимому, было бы целесообразно ввести в учебный процесс кафедр акушерства и гинекологии специальный курс ПД врожденных и наследственных болезней с основами медицинской генетики.
Выводы
- Главной причиной низкой эффективности ПД врожденных и наследственных заболеваний является систематическое несоблюдение регламента проведения пренатального скрининга на уровне амбулаторного звена акушерско-гинекологической службы, нарушающее его основные принципы — массовость, своевременность и полноценность.
- Для повышения эффективности ПД врожденных и наследственных болезней требуются меры по совершенствованию деятельности амбулаторного звена акушерско-гинекологической службы, направленные на: 1) повышение компетентности акушеров-гинекологов в проведении ПД согласно регламенту; 2) обеспечение информационной и мотивационной готовности беременных женщин к перинатальной профилактике; 3) оптимизацию взаимодействия между врачами акушерами-гинекологами и генетиками.
Литература
- Пренатальная диагностика наследственных и врожденных болезней / Под ред. Э. К. Айламазяна, В. С. Баранова. М.: МЕДпресс-информ, 2006. 415 с.
- Акуленко Л. В., Золотухина Т. В., Манухин И. Б. Дородовая профилактика генетической патологии плода. М.: ГЭОТАР-Медиа, 2013. 292 с.
- Жученко Л. А., Андреева Е. Н., Калашникова Е. А., Лагкуева Ф. К., Отарян К. К., Одегова Н. О., Степнова С. В., Юдина Е. В. Основные итоги и современное состояние программы комбинированного пренатального скрининга I триместра в Российской Федерации // Журнал акушерства и женских болезней. 2013. Т. LXI. Вып. 3. С. 20–25.
- Приказ Минздрава РФ от 28.12.2000 N 457 о совершенствовании пренатальной диагностики в профилактике наследственных и врожденных заболеваний у детей. http://www.bestpravo.ru/fed2000/data01/tex10191.htm.
- Жученко Л. А., Андреева Е. Н., Одегова Н. О., Степнова С. В., Лагкуева Ф. К., Леонова В. Ю. Современная концепция и инновационные алгоритмы пренатальной диагностики в рамках нового национального проекта Министерства здравоохранения и социального развития Российской Федерации «Дородовая (пренатальная) диагностика нарушений развития ребенка» // Российский вестник акушера-гинеколога. 2011, 1, с. 8–12.
- Жученко Л. А., Склянкина И. В., Мельникова Е. Н. Эффективность пренатальной диагностики в выявлении хромосомной патологии у плодов беременных — жительниц Московской области // Рос. вестн. акуш. гин. 2006; 6: 2: 31–34.
- Кащеева Т. К., Николаева Ю. А., Карпов К. П., Вохмянина Н. В., Романенко О. П., Баранов В. С. Ранний пренатальный скрининг — состояние, трудности, новые возможности // /Журнал акушерства и женских болезней. 2012. Т. 61. С. 69–74.
- Приказ Министерства здравоохранения и социального развития РФ от 02.10.2009 г. № 808 н «Об утверждении Порядка оказания акушерско-гинекологической помощи», зарегистрировано в Минюсте РФ 31.11.2009 г., http://www.garant.ru/products/ipo/prime/doc/12072455/#ixzz3GMRqj1J7.
- Гинтер Е. К., Козлова С. И., Прытков А. Н., Немцова М. В., Ермакова М. А., Жулева Л. Ю. Тестовые задания по специальности «Генетика». М., 2013.
- Манухин И. Б., Акуленко Л. В., Кузнецов М. И. Пропедевтика пренатальной медицины. М.: ГЭОТАР-Медиа, 2015, 319 с.
- Каретникова Н. А., Гончарова Е. А., Стыгар А. М., Гурьев С. О., Турсунова Д. Т., Бахарев В. А., Колодько В. Г. Современные возможности пренатальной диагностики генетической патологии в ранние сроки беременности // Проблемы репродукции. 2010. Т. 16. № 2. С. 82–86.
- Некрасова Е. С., Николаева Ю. А., Кащеева Т. К. и др. Внедрение алгоритма комбинированного скрининга хромосомной патологии плода в I триместре беременности. Опыт работы за 4 года // Журн. акушерства и женских болезней. 2007. Т. LVI, вып. 1. С. 28–34.
- Турсунова Д. Т. Сравнительный анализ скринирующих программ в I и II триместре беременности // Проблемы репродукции. 2011. № 2. С. 76–80.
- Evans M. I., Van Decruyes H., Nikolaides K. H. Nuchal translucency measurements for first trimester screening: the «price» of inaccuracy // Fetal Diag. Ther. 2007. Vol. 22. P. 401–404.
- Hernandez-Andrade E., Guzman Huerta N., Garcia Cavazos R., Ahued-Ahued J. R. Prenatal diagnosis in the first trimester, whom and how? // Gynecology Obstetric Mex. 2002. Vol. 70. P. 607– 612.
- Nicolaides K. H., Spencer K., Avgidou K. et al. Multicenter study of first-trimester screening for trisomy 21 in 75 821 pregnancies: results and estimation of the potential impact of individual risk-orientated two-stage first-trimester screening // Ultrasound Obstet Gynecol. 2005; 25: 221–226.
Л. В. Акуленко*, 1, доктор медицинских наук, профессор
И. Б. Манухин*, доктор медицинских наук, профессор
Т. К. Мачарашвили*
Э. О. Ибрагимова**
* ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
** ГБОУ ВПО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва
1 Контактная информация: Akular@list.ru
УЗИ плода на выявление генетических патологий — это выявление трисомий (дополнительной третьей хромосомы в генетическом наборе плода), приводящих к рождению малыша с серьёзными наследственными заболеваниями и физическими уродствами. Обнаружить пороки плода на УЗИ можно уже на первых этапах развития беременности.
Консультация врача по результатам анализов или УЗИ — 500 руб. (по желанию пациента)
Зачем нужно делать УЗИ для выявления пороков развития плода
На 1000 новорождённых приходится 5-7 младенцев с аномалиями половых (наследственных) или соматических (ненаследственных) клеток. Чаще всего эмбрион с хромосомным нарушением погибает на начальных сроках беременности, когда у женщины возникает выкидыш. С помощью УЗИ можно увидеть различные аномалии и патологии, поэтому ультразвуковое исследование на выявление пороков развития обязательно для каждой беременной женщины.
Когда и почему возникают генетические патологии плода: риски по возрастам
Аномалии развития плода закладываются уже в момент оплодотворения сперматозоидом яйцеклетки. Например, такая патология, как триплоидия (наличие трех хромосомом в ряду цепочки, а не двух, как положено), возникает в случае проникновения в яйцеклетку двух сперматозоидов, каждый из которых оставляет по одной хромосоме. Естественно, с таким набором живой организм не может выжить, поэтому на определённом этапе происходит выкидыш или замершая беременность.
Самопроизвольные выкидыши случаются в 50% аномальных оплодотворений. Так природа защищает человечество от полного вырождения.
В целом хромосомные патологии разделяются на 4 группы:
- Гаметопатия. Патология имеется ещё до зачатия в самом сперматозоиде или яйцеклетке, т.е. это генетическое заболевание — врожденная патология.
- Бластопатия. Аномалии возникают в первую неделю развития зиготы.
- Эмбриопатия. Повреждения эмбрион получает в период от 14 до 75 дней после зачатия.
- Фетопатия. Заключается в формировании патологии развития плода начиная с 75 дня после оплодотворения.
Никто не застрахован от рождения малыша с генетическими отклонениями. Если раньше к группе риска относили матерей старше 35 лет, диабетиков, женщин, имеющих хронические заболевания (почечная недостаточность, проблемы с щитовидкой), то в наши дни больные дети рождаются у молодых матерей в возрасте от 20 до 30 лет.
Данные статистики наводит на мрачные мысли. Так, риск рождения малыша с хромосомными аномалиями у 20-летних женщин составляет 1:1667, а у 35-летних уже 1:192. А на деле это означает, что в 99,5% случаев ребёнок у тридцатипятилетней матери родится здоровым.
Какие генетические заболевания плода можно увидеть на УЗИ, когда проходить
Нельзя говорить, что УЗИ показывает 100% всех отклонений, но с большой долей вероятности женщина будет знать о состоянии здоровья своего будущего малыша. За всю беременность женщина проходит минимум три УЗИ исследования: в 1, 2 и 3 семестрах. Их называют скрининговые УЗИ.
В 1 семестре на сроке от 10 до 14 недель (до 10 недели УЗИ неинформативно) беременная проходит исследование, именуемое скринингом. Он состоит из биохимического анализа крови и УЗИ исследования эмбриона. Результатом скрининга является выявление следующих патологий:
- синдром Дауна
- синдром Патау
- синдром Эдвардса
- синдром Шерешевского-Тернера
- синдром Карнелии де Ланге
- синдром Смита-Лемли-Опитца
- синдром Прадера-Вилли
- синдром Энжельмена
- синдром Лангера-Гидеона
- синдром Миллера-Диккера
- аномалия ДиДжорджи
- синдром Уильямса
- опухоль Вильмса
- триплоидия (когда хромосом не 46 по2 в каждой паре, а 69, т.е. по три, а не по две)
- дефект нервной трубки
На 20-24 неделе делается ещё одно УЗИ. Среди генетических заболеваний плода, видимых на ультразвуковом исследовании во 2 семестре, можно отметить:
- анэнцефалия (отсутствие головного мозга, точность диагностики 100%)
- патология брюшной стенки (86%)
- патология развития конечностей (90%)
- грыжа спинного мозга (87%)
- патология развития или отсутствие почек (85%)
- наличие отверстия в диафрагме, которая разделяет брюшную полость и грудную клетку (85%)
- гидроцефалия или водянка головного мозга (100%)
- аномалии сердца (48%)
На 3 семестре проводится допплерометрия — УЗИ исследование с определением сосудистой системы плода, плаценты и матери. Начиная с 23 недели беременности проверяются артерия пуповины, маточная артерия и средняя мозговая артерия. Исследуется систолический (при сокращении сердечной мышцы) и диастолический (при расслаблении сердечной мышцы) кровоток. У малыша с хромосомными нарушениями кровоток атипичен.
Также в 3 семестре обязательно делают фетометрию плода — измерение размеров с целью выявления аномалий развития.
Разновидности УЗИ исследований
Ультразвуковая диагностика представляет широкий спектр исследований. Существует несколько видов УЗИ, которые с предельной точностью определяют внутриутробные пороки развития малыша.
Стандартное УЗИ. Оно обычно совмещено с биохимическим анализом крови. Оно проводиться не раньше 10 недель беременности. В первую очередь у плода выявляют толщину воротниковой зоны, которая не должна превышать 3 мм, а также визуализацию носовой кости. У малыша с синдромом Дауна воротниковая зона толще нормы, а носовые кости не развиты. Также на увеличение толщины влияют следующие факторы:
- порок сердца
- застой крови в шейных венах
- нарушение лимфодренажа
- анемия
- внутриутробные инфекции
Допплерометрия — это необычное УЗИ исследование, которое оценивает кровоток плода. Разница между посылаемым и отражаемым сигналом указывает на норму или патологию цепочки «плод-плацента-мать».
- 3D УЗИ позволяет увидеть цветное изображение малыша, разглядеть конечности, отсутствие сросшихся пальчиков, недоразвитых стоп и пр. Точность диагностики воротникового пространства увеличивается на 30%. Врач может точно сказать, имеются ли патологии развития нервной трубки.
- 4D УЗИ по принципу работы не отличается от более простых вариантов, но обладает массой преимуществ. Врач видит трёхмерное изображение сердца, вид плода с разных ракурсов. Именно 4D диагностика окончательно расставляет все точки над «i», есть ли хромосомные аномалии или их нет. Со 100% точностью можно утверждать, имеются ли пороки развития нервной системы, скелетная дисплазия, заячья губа или волчья пасть.
Как выглядит УЗИ общих патологий плода: фото и расшифровка результатов УЗИ
Генетические патологии бывают как специфические (синдром Дауна, опухоль Вильмса), так и общие, когда внутренний орган развивается неправильно. Для выявления общих аномалий существует анатомическое исследование плода. Оно проводится на 2 семестре начиная с 20 недели беременности. В этот период можно увидеть личико малыша и определить его пол.
При анатомическом УЗИ все органы плода выводятся на экран в разрезе, и на снимке кости будут иметь белый цвет, а мягкие ткани различные оттенки серого. Специалисту хорошо видно строение головного мозга, он также в состоянии увидеть аномалии в развитии. Становится заметной расщепление верхнего нёба, именуемая заячьей губой.
Продольная и поперечная проекция позвоночника подтверждает или опровергает правильное расположение костей, можно убедиться в целостности брюшной стенки. Отсутствие патологий сердца подтверждают одинаковые размеры предсердий и желудочков. О нормальной работе желудка говорит его наполненность околоплодными водами. Почки должны располагаться на своём месте, а моча из них свободно поступать в мочевой пузырь. Врач чётко видит конечности плода, кроме пальчиков ног.
Генетические патологии плода: как они выглядят на УЗИ и прогноз патологии
|
Патология |
Как и когда выявляют |
В чём суть патологии |
Характерные черты |
Психическое и интеллектуальное развитие |
Синдром Дауна |
Проводится биопсия хориона, увеличенное воротниковое пространство у плода, недоразвитость костей носа, увеличенный мочевой пузырь, тахикардия у плода |
Хромосомы 21-й пары вместо положенных 2 представлены 3 в цепочке |
Раскосый монголоидный разрез глаз независимо от расы ребёнка, неразвитая переносица, неглубоко посаженные глаза, полукруглое плоское ухо, укороченный череп, плоский затылок, укороченный нос |
Задержка интеллектуального развития, маленький словарный запас, отсутствует абстрактное мышление, нет концентрации внимания, гиперактивность |
|
ПРОГНОЗ |
Доживают до 60 лет, в редкий случаях при условии постоянных занятий с ребёнком возможна его социализация. Такой ребёнок нуждается в постоянном присмотре | |||
Синдром Патау |
Маленькая голова на 12 неделе на УЗИ, несимметричные полушарии, лишние пальцы |
В 13-й хромосоме присутствует трисомия |
Дети рождаются с микроцефалией (неразвитость головного мозга), низкий лоб, скошенные глазные щели, расщелины губы и нёба, помутнение роговицы, дефекты сердца, увеличены почки, аномальные половые органы |
Глубокая умственная отсталость, отсутствие мышления и речи |
|
ПРОГНОЗ |
95% детей с синдромом Патау умирает до года, остальные редко доживают до 3-5 лет | |||
Синдром Эдвардса |
Биопсия хориона, внутриутробное взятие крови из пуповины, на УЗИ видна микроцефалия |
В 18-й хромосом есть трисомия |
Рождаются в основном девочки (3/4), а плод мужского пола погибает ещё в утробе. Низкий скошенный лоб, маленький рот, недоразвитость глазного яблока, расщелины верхней губы и нёба, узкий слуховой проход, врождённые вывихи, косолапость, тяжёлые аномалии сердца и ЖКТ, недоразвитость мозга |
Дети страдают олигофренией (органическим поражением головного мозга), умственной отсталостью, имбецильностью (средней умственной отсталостью), идиотией (отсутствием речи и умственной деятельности) |
|
ПРОГНОЗ |
В течение первого года жизни умирает 90% больных детей, до 10 лет — менее 1% | |||
Синдром Шерешевского-Тёрнера |
Рентген костных структур плода, МРТ миокарда |
Аномалия, встречающаяся в Х-хромосоме |
Встречается чаще у девочек. Укороченная шея со складками, отёчны кисти и ступни, тугоухость. Отвисшая нижняя губа, низкая линия роста волос, недоразвитая нижняя челюсть. Рост во взрослом возрасте не превышает 145 см. Дисплазия суставов. Аномальное развитие зубов. Половой инфантилизм (нет фолликул в яичниках), недоразвитость молочных желез |
Страдает речь, внимание. Интеллектуальные способности не нарушены |
|
ПРОГНОЗ |
Лечение проводится анаболическими стероидами, девушкам с 14 лет назначаютженские гормональные препараты. Внекоторых случаях удаётся победить недуг, и женщина может забеременеть методом ЭКО. Большинство больных остаются бесплодными | |||
Полисомия по Х-хромосоме |
Скрининг на 12 неделе беременности, биопсия хориона, анализ амниотической жидкости. Настораживает увеличение воротниковой зоны |
Вместо двух Х-хромосом встречается три и более |
Встречается у девочек и редко у мальчиков. Характерен половой инфантилизм (не развиваются вторичные половые признаки), высокий рост, искривление позвоночника, гиперпигментация кожи |
Антисоциальное поведение, агрессия, умственная отсталость у мужчин. |
|
ПРОГНОЗ |
При постоянных занятиях с педагогамии вовлечении в трудовую деятельность возможна социализация ребёнка | |||
Полисомия по Y-хромосоме |
Вместо ХY-хромосом есть лишняя Y-хромосома |
Встречается у мальчиков. Вырастают высокого роста от 186 см, тяжёлая массивная нижняя челюсть, выпуклые надбровные дуги, узкие плечи, широкий таз, сутулость, жир на животе |
Умственная отсталость, агрессия, эмоциональная неустойчивость |
|
|
ПРОГНОЗ |
С ребёнком нужно заниматься, направлять его на мирную деятельность, привлечь к спорту | |||
Синдром Карнелии де Ланге |
При анализе крови беременной женщины в сыворотке не обнаружено протеина-А плазмы (РАРР-А), которого обычно много |
мутациями в гене NIPBL или SMC1A |
Тонкие сросшиеся брови, укороченный череп, высокое нёбо, аномально прорезавшиеся зубы, недоразвитые конечности, мраморная кожа, врождённые пороки внутренних органов, отставание в росте |
Глубокая умственная отсталость, |
|
ПРОГНОЗ |
Средняя продолжительность жизни 12-13 лет | |||
Синдром Смита-Лемли-Опитца |
УЗИ показывает аномалии черепа у плода, не просматриваются рёберные кости |
мутация в гене DHCR7, отвечающий за выработку холестерина |
Узкий лоб, опущены веки, косоглазие, деформация черепа, короткий нос, низко расположенные уши, недоразвитые челюсти, аномалии половых органов, сращение пальцев |
Повышенная возбудимость, агрессия, понижение мышечного тонуса, нарушения сна, отставание в умственном развитии, аутизм |
|
ПРОГНОЗ |
Терапия с использованием пищевого холестерина | |||
Синдром Прадера-Вилли |
Отмечается низкая подвижность плода, неправильное положение, |
В 15-й хромосоме отсутствует отцовская часть хромосомы |
Ожирение при низком росте, плохая координация, слабый мышечный тонус, косоглазие, густая слюна, плохие зубы, бесплодие |
Задержка психического развития, речевое отставание, отсутствие навыков общения, слабая мелкая моторика. Половина больных имеет средний уровень интеллекта, умеют читать |
|
ПРОГНОЗ |
При постоянных занятиях ребёнок может научиться читать, считать,запоминает людей. Следует вести борьбу с перееданием |
|||
Синдром Ангельмана |
Начиная с 12-й недели наблюдается отставание развития плода в росте и массе |
Отсутствуют или мутирует ген UBE3A в 15-й хромосоме |
Частый необоснованный смех, мелкий тремор, много ненужных движений, широкий рот, язык вываливается наружу, ходьба на абсолютно прямых ногах |
«Синдром счастливой марионетки»: ребёнок часто и беспричинно смеётся. Задержка психического развития, гиперактивность, нарушение координации движения, хаотичное махание руками |
|
ПРОГНОЗ |
Проводится противоэпилептическая терапия, гипотонус мышц снижается массажем, в лучшем случае ребёнокнаучится невербальным навыкам общения и самообслуживания | |||
Синдром Лангера-Гидеона |
На 4D УЗИ заметна челюстно-лицевая аномалия |
трихоринофаланговый синдром, заключающийся в нарушении 8-й хромосомы |
Длинный нос грушевидной формы, недоразвитость нижней челюсти, очень оттопыренные уши, неравномерность конечностей, искривление позвоночника |
Задержка психического развития, умственная отсталость различной степени, отсутствие речи |
|
ПРОГНОЗ |
Плохо поддаётся коррекции, невысокая продолжительность жизни | |||
Синдром Миллера-Диккера |
На УЗИ заметно аномальное строение черепа, лицевые диспропорции |
Патология в 17-й хромосоме, вызывающая разглаживание мозговых извилин. Вызывается интоксикацией плода альдегидами при злоупотреблении матерью алкоголя |
Дизморфия (алкогольный синдром), пороки сердца, почек, судороги |
Лиссэнцефалия (гладкость извилин больших полушарий), недоразвитость головного мозга, умственная отсталость |
|
ПРОГНОЗ |
Выживаемость до 2 лет. Дети могут научиться только улыбаться и смотреть в глаза | |||
Аномалия ДиДжорджи |
В некоторых случаях на УЗИ выявляются различные пороки органов у малыша, особенно сердца (тетрада Фалло) |
Заболевание иммунной системы, нарушение участка 22-й хромосомы |
Гипоплазия тимуса (недоразвитость органа, отвечающего за выработку иммунных клеток), деформация лица и черепа, порок сердца. Отсутствуют паращитовидные железы, отвечающие за обмен кальция и фосфора |
Атрофия коры головного мозга и мозжечка, задержка умственного развития, сложности с моторикой и речью |
|
ПРОГНОЗ |
Лечение иммуностимуляторами,пересадка тимус, кальциевосполняемая терапия. Дети редко доживают до 10 лет, умирают от последствий иммунодефицита |
|||
Синдром Уильямса |
На УЗИ видны диспропорции в развитии скелета, эластичность суставов |
Генетическое заболевание, вызванное отсутствием звена в 7-й хромосоме |
Нарушен синтез белка эластина, у детей типично «лицо Эльфа»: припухшие веки, низко расположенные глаза, острый подбородок, короткий нос, широкий лоб |
Повышенная чувствительность к звуку, импульсивность, навязчивая общительность, эмоциональная неустойчивость, тревожность, экспрессивная речь |
|
ПРОГНОЗ |
Речь хорошо развита, даже лучше, чем у здоровых сверстников. Выраженныемузыкальные способности (абсолютный слух, музыкальная память). Сложности с решением математических задач | |||
Синдром Беквита-Видеманна |
На УЗИ заметны аномально непропорциональные конечности, превышение массы тела, патология почек |
Генетическое заболевание, вызванное отсутствием звена в 11-й хромосоме |
Бурный рост в раннем возрасте, аномально большие внутренние органы, склонность к раковым опухолям. У ребёнка пупочная грыжа, аномально большой язык, микроцефалия (недоразвитость мозга). |
Эмоциональное и психическое развитие в некоторых случаях не отстаёт от нормы. Иногда встречается выраженная умственная отсталость |
|
ПРОГНОЗ |
Продолжительность жизни как у обычныхлюдей, но существует склонность к раковым опухолям | |||
Синдром Тричера Коллинза |
На УЗИ видны ярко выраженная асимметрия черт лица |
Генетическая мутация в 5-й хромосоме, вызывающая нарушение костных структур |
У ребёнка практически нет лица, ярко выраженное физическое уродство |
Абсолютно нормальное психо-эмоциональное развитие |
ПРОГНОЗ |
Проводятся оперативные вмешательства с целью устранения уродств |
Причины патологий плода: что влияет на рождение детей с генетическими отклонениями
К фактором, способствующим рождению детей с генетическими аномалиями, относятся:
- Генетическая предрасположенность. Гены — это информация, закладываемая от обоих родителей. Определяются такие показатели, как рост, цвет глаз и волос. Точно также закладываются и различные отклонения, если у обоих или у одного из родителей имеется повреждённый ген. Вот почему запрещается вступать в брак близким родственникам. Ведь тогда возрастает вероятность вынашивания плода с генетической патологией. С партнером, имеющим противоположный генетический набор, больше шансов родить здорового малыша.
- Возраст родителей. К группе риска относятся мамы старше 35 лет и папы старше 40 лет. С возрастом снижается иммунитет, возникают хронические заболевания, и иммунная система женщины попросту «не заметит» генетически повреждённого сперматозоида. Произойдёт зачатие, и, если у молодой женщины организм сам отторгнет неполноценный плод, у возрастной мамы беременность будет проходить более спокойно.
- Вредные привычки мамы. Практически 90% патологических беременностей проходит при маловодии. У курящей женщины плод страдает от гипоксии, продукты распада альдегидов (спиртов) на начальных сроках беременности приводят к мутациям и отклонениям. У алкоголичек в 46% случаев дети рождаются с генетическими патологиями. Спирты также «ломают» генетические цепочки и у отцов, которые любят выпить.
- Инфекции. Особенно опасны такие заболевания, как грипп, краснуха, ветрянка. Наиболее уязвимым плод является до 18-й недели, пока не сформируется околоплодный пузырь. В некоторых случаях женщине предлагают сделать аборт.
- Приём медикаментов. Даже обычный ромашковый чай для беременной женщины является токсичным. Любой приём лекарств должен сопровождаться консультацией врача.
- Эмоциональные потрясения. Они вызывают гибель нервных клеток, что неизменно сказывается на развитии плода.
- Плохая экология и смена климата. Забеременев во время отдыха на Таиланде, есть вероятность вместе с беременностью привезти опасную инфекцию, которая в родных краях начнет медленно развиваться, сказываясь на здоровье малыша.
Как предотвратить пороки плода и где сделать УЗИ плода в СПБ
Предотвратить большинство проблем с вынашиванием и патологиями плода, можно заранее планируя беременность. Проходя обследование при планировании оба партнера сдают анализы, четко показывающие вероятность генетических отклонений. Также проводится спектр тестов на инфекции, способные вызвать уродства у малыша (ТОРЧ-комплекс) и другие исследования.
Приглашаем пройти УЗИ на патологии плода в Санкт-Петербурге в клинике Диана. У нас установлен новейший УЗИ аппарат с доплером. Обследование проводится в 3-Д и 4-Д фоматах. На руки выдается диск с записью.
Каждый из нас — носитель как минимум 10-15 рецессивных мутаций. И они могут передаваться по наследству. Именно поэтому даже у абсолютно здоровых родителей есть риск появления малыша с серьезными нарушениями. Вот почему еще на этапе планирования беременности, а лучше до вступления в брак стоит проверить свой генетический статус. О том, что это такое и кому может помочь специальное тестирование, рассказывает врач-генетик Светлана Голубева.
Светлана Голубева,
врач-генетик высшей категории центра вспомогательной репродукции «Эмбрио»
Что это такое?
— Молекулярно-генетическое исследование — это лабораторный метод, который позволяет определить структуру генов на молекулярном уровне. Тестирование дает возможность выявить особенности (полиморфизмы) либо мутации в строении генов.
Для чего нужно?
— У молекулярно-генетического исследования две основные задачи:
- выявить причину заболевания и предотвратить его повторение у будущих поколений.
- уточнить прогноз заболевания, провести контроль и коррекцию лечения.
Что представляет собой анализ?
— Материалом для исследования может служить как венозная кровь, так и буккальный эпителий (соскоб со щеки). Из этого материала специалисты выделяют ДНК человека и изучают ее. Ожидать результат анализа в среднем нужно около 2 недель.
Предрасположенность = болезнь?
— Нормальное строение гена обеспечивает определенную функцию или признак у человека. В этом случае речь идет о полном здоровье.
Однако бывают ситуации, когда у человека имеется предрасположенность к тем или иным нарушениям здоровья. Но это еще не значит, что он точно будет болеть. Речь идет о полиморфизме (варианте нормального строения гена). В этой ситуации болезнь проявится под воздействием факторов риска. Например, для гипертонической болезни это будет: ожирение, гиподинамия, курение и так далее.
Если же в структуре гена обнаруживается мутация, это приводит к изменению функции гена и, следовательно, к патологии. В генетике такие типы заболеваний называются «моногенными болезнями», среди них выделяют рецессивные.
Давайте разберемся, как это работает:
- если каждый из родителей «отдает» будущему потомству по здоровому гену, рождается здоровый малыш;
- если один из родителей отдает ген с мутацией, а второй — здоровый, на свет появляется здоровый рецессивный носитель. Это значит, что сам ребенок будет здоров на протяжении всей жизни, но останется носителем генетического заболевания и впоследствии может передать его своим детям;
- если оба гена от матери и отца имеют мутации, рождается ребенок с заболеванием.
Каждая пара находится в зоне риска, но еще на этапе планирования беременности может пройти молекулярно-генетическое исследование и уточнить свой генетический статус.
Современные молекулярно-генетические технологии позволяют определять полиморфизмы и (или) мутации разными способами:
- в одном конкретном месте гена;
- анализируя всю структуру гена;
- одномоментно тестируя группу генов (например, на выявление нервно-мышечных заболеваний).
Как паре, планирующей ребенка, понять, что нужно идти к врачу-генетику?
1 вариант. При отсутствии видимых причин дополнительные генетические исследования не требуются. Если терапевт, гинеколог или другой специалист выявляет какие-то особенности в родословной, состоянии здоровья или течении беременности, то женщину (или пару) отправляют на консультацию к врачу-генетику, который составляет индивидуальный план генетического тестирования.
2 вариант. Пары, у которых нет каких-либо нарушений в здоровье, могут самостоятельно пройти генетическое исследование по собственному решению. Например, предсказательное тестирование наследственной предрасположенности к тем или иным заболеваниям. То есть сделать так называемый «генетический паспорт». Благодаря этому скринингу люди могут узнать предрасположенность, например, к артериальной гипертензии, тромбозам, бронхиальной астме или нарушению физиологического течения беременности и заблаговременно провести профилактику этих заболеваний или осложнений.
Еще один вид исследования, который можно планировать самостоятельно, — преконцепционный скрининг носительства рецессивных мутаций. Тестирование позволяет оценить риск рождения ребенка с наследственным заболеванием у конкретной пары. В территориальных сообществах есть свои особенности генофонда. Каждое условно закрытое сообщество накапливает свои рецессивные мутации.
Естественно, вероятность встретиться двум партнерам (супругам) с патогенными мутациями в одних и тех же генах крайне мала. Однако хуже, если родители узнают об особенностях своего генотипа слишком поздно, когда у них рождается ребенок с тяжелым заболеванием. Для этого и нужен преконцепционный скрининг.
Если по результатам исследования оба потенциальных родителя — здоровые носители мутаций в одних и тех же генах, риск рождения больного ребенка будет высоким (25%). В таком случае во время беременности рекомендуют провести дородовую молекулярно-генетическую диагностику для уточнения того, благоприятный или неблагоприятный вариант унаследовал плод.
Тестирование позволяет понять, будет ли будущий ребенок больным, здоровым носителем или здоровым. И в зависимости от результатов врачами и будущими родителями принимается решение о продолжении или прерывании беременности больным плодом. Окончательное решение — за семьей.
Кстати, уточнить генетический статус плода можно до 18 недель беременности.
Когда возможно проведение молекулярно-генетического тестирования?
— Когда и кому проводить исследование, решает врач-генетик и дает рекомендации, какую лабораторную методику использовать:
1. преимплантационная диагностика (т. е. при ЭКО исследуется эмбрион до переноса в полость матки);
2. пренатальная диагностика (исследуется плод во время беременности);
3. постнатальная диагностика (исследуется ребенок после рождения или взрослый человек). Уточняется причина генетического заболевания, определяются риски для других членов семьи.
Какие рецессивные мутации распространены в Беларуси?
— В нашей стране, как и во всех остальных, есть условно свои, наиболее часто встречающиеся наследственные заболевания:
- Фенилкетонурия (наследственное заболевание обмена, которое сопровождается задержкой умственного и физического развития). По статистике, встречается 1 случай на 6 тысяч новорожденных.
- Муковисцидоз (наследственное заболевание обмена с серьезной патологией легких и кишечника) — 1 случай на 8 тысяч родившихся.
- Врожденная дисфункция коры надпочечников (нарушения функции гормонов и половой дифференциации) — 1 случай на 10/15 тысяч родившихся.
- Нервно-мышечные заболевания.
- Несиндромальная (изолированная) тугоухость.
Самые распространенные из них — первые два. В Беларуси проводится скрининг новорожденных на эти заболевания. Больные дети нуждаются в пожизненном дорогостоящем специфическом лечении. Преконцепционное молекулярно-генетическое тестирование позволяет определить проблему еще на этапе планирования ребенка, а также во время беременности.
Преконцепционный скрининг носительства рецессивных мутаций пациенты могут планировать самостоятельно. Но сориентировать пару в целесообразности проведения тех или иных видов генетического тестирования может только квалифицированный генетический консультант. Он определит, какие исследования необходимы в каждом конкретном случае.
Фото врача: Ирина Забирашко