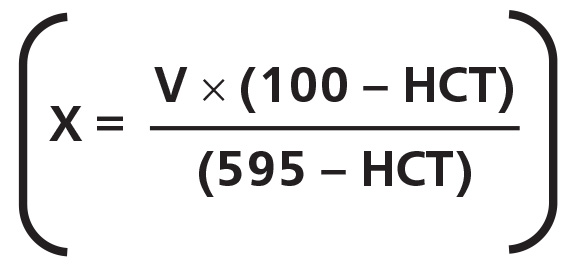УДК 618.2, ББК 57.16, С60
С60 Гемостаз: ошибки и неточности. Лабораторная оценка системы гемостаза в акушерстве и гинекологии : Информационный бюллетень / А.В. Соловьёва, С.А. Дьяконов, О.А. Быкова; под ред. В.Е. Радзинского — М. : Редакция журнала StatusPraesens, 2020. — 16 с.
ISBN 978-5-907218-32-1
Тесты лабораторной диагностики, отражающие физиологические и патологические сдвиги в системе гемостаза до и во время беременности, весьма многочисленны. Тем не менее использование этих новых инструментов привело к парадоксальной ситуации — гипер- и гиподиагностике многочисленных нарушений. В частности, изолированное повышение D-димера часто влечёт за собой «лечение анализов» без конкретного диагноза.
Специалисты выделяют необходимый минимум доступных диагностических методик, позволяющих своевременно и адекватно оценить состояние гемостазиологического баланса как на прегравидарном этапе, так и у беременных. Тем не менее без чёткого понимания врачом всех особенностей функционирования свёртывающей системы крови в различные периоды жизни женщины интерпретация результатов коагулограммы вряд ли будет точной и информативной.
Издание предназначено для акушеров-гинекологов и руководителей женских консультаций, родильных домов и перинатальных центров, гинекологических отделений многопрофильных стационаров, сотрудников и руководителей кафедр акушерства и гинекологии, слушателей всех форм непрерывного медицинского образования, аспирантов, клинических ординаторов и студентов медицинских вузов.
УДК 618.2, ББК 57.16, ISBN 978-5-907218-32-1
© Соловьёва А.В.
© ООО «Медиабюро Статус презенс»
Обязательный минимум
Тесты лабораторной диагностики, отражающие физиологические и патологические сдвиги в системе гемостаза до и во время беременности, весьма многочисленны1. Специалисты выделяют необходимый минимум доступных диагностических методик, позволяющих своевременно и адекватно оценить состояние гемостазиологического баланса с целью выполнения профилактических и/или лечебных мероприятий2.
Согласно действующим российским клиническим рекомендациям «Нормальная беременность» (2020), необходимо назначать беременной коагулограмму при первом визите и перед родами. Это исследование включает определение четырёх параметров3.
- Активированное частичное тромбопластиновое время (АЧТВ).
- Протромбиновое время (ПВ).
- Фибриноген.
- Количество тромбоцитов.
Строго говоря, последний из указанных параметров диагностики гемостатических нарушений — определение количества тромбоцитов — входит в рамки общего (клинического) анализа крови и служит основой оценки сосудисто-тромбоцитарного звена гемостаза4. Важно понимать, что на протяжении физиологической беременности медиана количества «кровяных пластинок» смещается незначительно. Тем не менее тромбоцитопении развиваются у 7–11% беременных, при этом в подавляющем большинстве случаев подобные эпизоды патогенетически связаны с самой гестацией5. Количество тромбоцитов, как правило, составляет не менее 100×109/л. Гестационную тромбоцитопению необходимо дифференцировать с неспецифичными для беременности причинами этого нарушения (идиопатическая тромбоцитопеническая пурпура, синдром Бернара–Сулье, системная красная волчанка, антифосфолипидный синдром [АФС] и др). Акушер-гинеколог должен наблюдать таких пациенток в тесном сотрудничестве с гематологом и (при необходимости) с ревматологом6.
Показаний для обязательного скринингового исследования агрегационной способности тромбоцитов с добавлением различных реагентов, чаще всего аденозиндифосфата, при физиологическом течении гестации у пациенток с отсутствием геморрагических проявлений в анамнезе нет. В противном случае рекомендовано выполнять оценку активации тромбоцитов при первой явке беременной (7–8 нед).
Рассмотрим подробнее другие обязательные параметры оценки гемостаза беременной. В течение физиологической беременности и в послеродовом периоде важнейшие скрининговые показатели коагуляционного гемостаза — АЧТВ и ПВ — обычно не претерпевают значимых изменений, хотя возможна и тенденция к их укорочению7.
- АЧТВ чутко реагирует на изменения уровней веществ, обеспечивающих работу каскада реакций внешней и общей систем свёртывания, — факторов II, V, VIII, IX, X, XI, XII и фибриногена. Этот показатель определяют в целях скрининга врождённых или приобретённых коагулопатий. В числе первых наиболее известны гемофилия A и B, а также болезнь Виллебранда; вторые включают нарушения функции печени и введение противосвёртывающих препаратов. Именно поэтому АЧТВ используют для мониторинга гепаринотерапии — между этим параметром и дозой нефракционированного гепарина существует линейная зависимость.
- ПВ — ещё один необходимый инструмент оценки показателей внешней и общей систем свёртывания. ПВ высокочувствительно к изменениям витамин-К-зависимых факторов (II, VII, X), поэтому его используют в мониторинге антитромботической терапии антагонистом этого соединения варфарином, а также для оценки течения заболеваний печени.
Несложное в лабораторной практике определение ПВ основано на добавлении к плазме крови тканевого фактора. Оно было внедрено американским врачом Армандом Квиком (ArmandJ. Quick) ещё в 1935 году, но до сих пор служит классическим анализом коагулирующей активности8. Тем не менее в 1980-х годах оценка ПВ была усовершенствована с помощью нового показателя — международного нормализованного отношения (МНО), позволяющего минимизировать зависимость результата от вариабельности реагента. МНО — это отношение ПВ пациента к нормальному ПВ, возведённое в значение международного индекса чувствительности, указанное производителем тканевого фактора на упаковке.
Фибриноген— один из важнейших белков гемостаза, и его определение незаменимо для выявления таких редких наследственных заболеваний, как а- или дисфибриногенемия. Его обязательно оценивают при тяжёлых травмах, синдроме диссеминированного внутрисосудистого свёртывания (ДВС) и заболеваниях печени. Сгусток фибриногена/фибрина стабилизирован фактором XIII, а его распад с образованием продуктов деградации характерен для таких тромботических состояний, как тромбоз глубоких вен или тромбоэмболия лёгочной артерии.
Перегрузка
Четыре вышеперечисленных показателя — основа лабораторного анализа гемостаза, но палитра оценки свёртывающей функции крови ими не исчерпывается9.
Так, упомянутые выше продукты деградации кровяного сгустка стали предметом самостоятельного углублённого исследования, при этом в последние десятилетия оценку растворимых комплексов мономеров фибрина потеснил D -димер. Его изолированное определение стало «бичом» российского акушерства и гинекологии.
Определение D-димера необходимо прежде всего для исключения венозных тромбоэмболических осложнений (ВТЭО) и оценки тяжести ДВС-синдрома (в последнем случае — обязательно в сочетании с иными параметрами гемостаза!). На «вторых ролях» сегодня — прогнозирование тромботических рисков, течения инфекционных и онкологических заболеваний.
Тенденция к неоправданному расширению «сферы ответственности» этого продукта фибринолиза — общемировое явление. Изолированное повышение D-димера часто влечёт за собой «лечение анализов» без конкретного диагноза, при этом зарубежные специалисты указывают на проблемы со стандартизацией, чувствительностью и специфичностью существующих диагностических тестов.
Тем не менее на «плечи» этого «атланта» нередко возлагают диагностику угрозы прерывания беременности на ранних сроках и даже бесплодия неясного генеза. Нужно отметить, что принятые в 2019 году российские клинические рекомендации «Вспомогательные репродуктивные технологии и искусственная инсеминация»10 и «Женское бесплодие (современные подходы к диагностике и лечению)»11 регламентируют лишь назначение коагулограммы при подготовке к программам ВРТ. Аналогичные указания содержит и обновлённый (вступает в силу с 1 января 2021 года) порядок использования ВРТ12. К сожалению, конкретный объём ориентировочного исследования системы гемостаза в этих документах не указан.
Таким образом, оценка гемостаза у бесплодных пациенток сейчас направлена на скринингперед назначением стимуляции овуляции, ассоциированной с повышением риска ВТЭО13. Ассоциация гиперкоагуляции с привычным невынашиванием неясного генеза наряду с применением антикоагулянтов в качестве эмпирической профилактики потери беременности служит предметом горячих научных дискуссий14 15.
В худшем случае при оценке результатов определения D-димера не принимают во внимание его «запрограммированный» рост в течение гестации, отражающий состояние физиологической гиперкоагуляции. Так, по данным испанских исследователей (2018), в III триместре его показатели превышают верхнюю границу для небеременных (500 мкг/л) у 99% пациенток16. Окончательная валидация параметров динамики этого продукта распада кровяного сгустка у беременных — задача на ближайшее будущее.
Знака равенства нет
Недооценка физиологических изменений системы гемостаза — распространённая ошибка медиков. Если такие скрининговые показатели, как АЧТВ, ПВ и количество тромбоцитов, обычно не претерпевают выраженных изменений, это не будет верным для остальных параметров при углублённом исследовании. В частности, для физиологического течения беременности характерны рост уровня фибриногена и снижение антикоагулянтной активности крови. Отмечают увеличение факторов свёртывания VII, VIII и IX и угнетение активности протеина S при незначительном снижении свободной фракции последнего (и стабильной концентрации общего белка)21.
С целью стратификации пациенток в группы риска по возможным геморрагическим, тромботическим и гестационным осложнениям необходимо акцентировать внимание на своевременном исследовании показателей системы гемостаза (на этапе планирования гестации или при первом обращении беременной в медицинскую организацию). Последующее обследование при физиологическом течении беременности должно быть обосновано22 23.
У пациенток группы низкого риска гестационных и тромбоэмболических осложнений при физиологическом течении беременности объём обследования должен быть минимизирован, что позволяет исключить в эти сроки необоснованное инвазивное вмешательство и снизить затраты.
В эту группу включают женщин при отсутствии:
- экстрагенитальных заболеваний;
- необходимости в лечебных мероприятиях по коррекции экстрагенитальных заболеваний;
- специфических осложнений гестационного процесса при данной беременности (отёки, протеинурия и гипертензивные расстройства, преждевременные роды, задержка роста плода [ЗРП]);
- анте-, интра- и ранней неонатальной гибели ребёнка в анамнезе женщины;
- осложнений при предыдущих родах, таких, как гипотоническое кровотечение.
С другой стороны, пациенткам групп риска гестационных и тромбоэмболических осложнений необходимо расширить объём исследования с целью своевременной профилактики возможного клинического неблагополучия.
Для физиологического течения беременности характерны перечисленные ниже изменения параметров гемостаза, определяемых при углублённом исследовании.
- Повышение уровня фактора Виллебранда.
- Снижение активности фермента ADAMTS13*.
- Снижение активности фактора XIII (фибринстабилизирующего) ко времени родов.
- Увеличение способности к образованию тромбина (по показателям теста генерации тромбина).
- Изменения показателей тромбоэластографии и тромбодинамики с тенденцией к усилению фибринообразования.
- Увеличение уровня тканевого фактора.
- Нарастание D-димера.
- Снижение антикоагулянтной активности крови за счёт изменений в системе протеина С при стабильной активности антитромбина III.
- Снижение уровня гомоцистеина на фоне приёма фолатов.
Отклонения от этих тенденций — повод для повышенного внимания к состоянию беременной, часто служащий основанием для назначения консультации гематолога.
Венозные тромбоэмболии: ищем мутации
Прокоагуляционные изменения при нормальной беременности повышают риск тромботических осложнений24 25. Однако это — не причина рассматривать гестацию как самостоятельный повод к углублённому исследованию гемостаза. Тем не менее в группу риска ВТЭО включают пациенток с широким спектром состояний.
- Предшествующие ВТЭО: рецидивирующие, неспровоцированные, спровоцированные, связанные с приёмом эстрогенсодержащих препаратов.
- Семейный тромботический анамнез (ВТЭО у родственников первой линии родства в возрасте до 50 лет).
- Искусственные клапаны сердца, кава-фильтр.
- Тяжёлая форма преэклампсии, внутриутробная гибель плода во время данной беременности.
- Носительство тромбофилических генотипов (подробнее о них — ниже): гомозиготное носительство фактора V Лейден FVL (G1691A), сочетание гетерозиготных полиморфизмов FVL и протромбина F2 (G20210A), гомозиготное носительство последнего, дефицит антитромбина III, протеина S и C.
- Экстрагенитальные заболевания (злокачественные опухоли, сахарный диабет 1-го типа, нефротический синдром, системная красная волчанка, серповидно-клеточная анемия).
У этих пациенток исследование гемостаза при беременности дополняют определением агрегации тромбоцитов с аденозиндифосфатом, D-димера, антитромбина III, а также скринингом нарушений в системе протеина С и оценкой резистентности фактора V к активированному протеину C. На прегравидарном этапе рекомендовано определение гомоцистеина, но его мониторинг в течение гестации не показан.
Рутинный скрининг для определения тромбофилических нарушений в рамках прегравидарной подготовки не назначают ввиду недоказанной целесообразности такого мероприятия. Определение концентрации гомоцистеина в крови также не обязательно. Генетическое обследование для выявления наследственных тромбофилий (полиморфизмов генов гемостаза) рекомендуют женщинам, имеющим родственников первой степени родства с тромбофилией высокого риска, а также при наличии в анамнезе нижеследующих состояний31.
- Идиопатический артериальный тромбоз (в молодом возрасте).
- Идиопатические ВТЭО необычной локализации (тромбозы вен ЖКТ, почек, головного мозга, венозного синуса).
- Эпизод ВТЭО, ассоциированный с воздействием факторов умеренного риска (операции небольшого объёма, непродолжительная иммобилизация или путешествия на незначительные расстояния, приём эстрогенсодержащих контрацептивов).
- Идиопатическая ВТЭО в сочетании с отнесением пациентки к группе риска по кровотечению или с наличием противопоказаний для антикоагулянтной терапии.
- Необъяснимые осложнения беременности (более трёх потерь на сроках до 10 нед или одна и более после 10 нед, преэклампсия, ЗРП, преждевременная отслойка нормально расположенной плаценты).
Тромбориски: не только беременность
Большую долю работы акушера-гинеколога занимает ведение пациенток вне беременности, а если говорить точнее, женщин, которым необходимо репродуктивное планирование. Несмотря на достаточно широкий выбор контрацептивов, их использование в нашей стране, как и во всём мире, до сих пор явно недостаточно. И одна из причин — гормонофобия. Множество публикаций StatusPraesens за 11 лет истории журнала было посвящено методичному и аргументированному считать риск тромбообразования, повышающийся на фоне приёма гормональных препаратов.
Действительно, вероятность ВТЭО у пользовательниц КОК в среднем в 3,5 раза выше в сравнении с теми, кто гормональные средства не применяет32 33. Однако указанная опасность, например, почти в 3 раза меньше, чем при гестации. Врач может использовать валидированный опросник для оценки риска ВТЭО, ответы на который могут стать достаточным основанием для расширения диагностического поиска и принятия верного решения
Ещё один документ, на который следует опираться в вопросах выбора средств и методов предотвращения нежеланной беременности, — Медицинские критерии приемлемости32, в которых чётко прописано, что наличие факторов риска ВТЭО — противопоказание для назначения любого КОК. В качестве важной ремарки эксперты ВОЗ отмечают, что все КОК в той или иной степени несут в себе тромбориски, однако для тех препаратов, в состав которых включены ЛНГ, норэтистерон и норгестимат, эти риски всё жеменее выражены32 34. Так, при использовании КОК с ЛНГ вероятность тромботических осложнений составляет 5–10 случаев на 10 тыс. женщино-лет[^35–37], практически столь же безопасным можно признать норэтистерон35, а норгестимат может увеличить вероятность ВТЭО на 14%36. Близким к эталонному трио сегодня можно считать КОК на основе гестагена хлормадинона ацетата 2,4 на 10 тыс. женщино-лет38.
В частности, крупная постмаркетинговая наблюдательная работа включила около 20 тыс. женщин, получавших КОК с 2 мг ХМА и 0,03 мг в течение 6 циклов. В ней был отмечен один эпизод тромбоза вен нижней конечности и один случай тромбоэмболии лёгочной артерии. Согласно оценкам авторов, частота ВТЭО составила 2,1 на 10 000 женщино-лет39.
Хорошие параметры безопасности КОК с ХМА подтвердило и исследование III фазы длительного применения препарата «Белара». В нём участвовала 781 женщина (23 033 цикла с КОК, до 45 у одной пациентки). В нём был описан единственный эпизод тромбоза глубоких вен нижней конечности у курильщицы старше 30 лет после обусловленной вывихом голеностопного сустава иммобилизации40.
Помимо эффективной контрацепции, использование средств на основе ХМА обеспечивает хороший контроль менструального цикла, уменьшение объёма кровопотери, снижение выраженности дисменореи, акне, себореи, гирсутизма.
Практикующему врачу также важно помнить, что в оценке тромботических рисков использования гормональной контрацепции необходимо учитывать фактор времени: абсолютно любой КОК на старте применения усиливает процессы коагуляции и фибринолиза (и это найдёт отражение в лабораторных анализах), однако уже через полгода показатели гемостаза выравниваются.
К тромбофилиям высокого риска относят гомозиготные полиморфизмы генов фактора V G1691A (лейденская мутация) и фактора II G20210A либо их сочетание, а также дефицит антитромбина. Тромбофилиями низкого риска признаны дефицит антитромбина, протеинов C и S, гипергомоцистеинемия, гетерозиготные мутации G1691A и G20210A41.
Объём рекомендуемого генетического обследования включает поиск мутаций в следующих генах:
- F5 G1691A;
- F2 G20210A;
- SERPINC1 (ген сериновой протеазы);
- PROC и PROS1 (гены протеинов С и S соответственно).
При обнаружении тромбофилии необходимо организовать консультацию пациентки у гематолога.
Антитромботическую терапию женщинам с наследственными тромбофилиями назначают только в рамках клинических исследований или в целях профилактики тромбоэмболических осложнений42. Медицинская общественность с большим интересом ожидает результаты крупного международного рандомизированного контролируемого исследования Anticoagulants for LIving FEtuses2 (ALIFE2), посвящённого оценке эффективности терапии препаратом низкомолекулярного гепарина у женщин с носительством тромбофилических мутаций и привычным невынашиванием беременности в анамнезе43.
Коагулопатические кровотечения: кто в группе риска?
О высоком риске коагулопатических кровотечений следует задуматься при появлении в поле зрения акушера-гинеколога пациентки с врождённым геморрагическим диатезом (болезнь Виллебранда, тромбоцитопатии). Для этого заболевания характерно появление с детского возраста кровоточивости микроциркуляторного типа (носовые, десневые кровотечения, повышенная склонность к образованию синяков, обильные менструальные кровотечения, продолжающееся кровотечение после малых хирургических вмешательств — экстракции зуба, тонзилэктомии).
При наступлении беременности таким пациенткам рекомендовано наблюдение и обследование на III этапе оказания специализированной медицинской помощи. У них дополнительно определяют агрегацию тромбоцитов с аденозиндифосфатом, уровень фактора Виллебранда (только до срока гестации 8 нед) и фактора XIII (фибринстабилизирующего). Назначение ТЭГ на прегравидарном этапе и во время гестации не рекомендовано (за исключением поздних сроков).
Рекомендуют консультацию гематолога при снижении:
- количества или функции тромбоцитов;
- уровня фактора Виллебранда;
- активности фактора XIII.
Система гемостаза тесно вовлечена в патогенетические изменения при преэклампсии44 45.
Группа риска преэклампсии включает беременных с такими состояниями, как:
- ранняя преэклампсия и преждевременные роды в сроке до 34 нед в анамнезе;
- преэклампсия больше чем в одной предшествующей беременности;
- хронические заболевания почек;
- аутоиммунные заболевания, и в первую очередь системная красная волчанка, и АФС;
- наследственная тромбофилия (мутации F5L G1691A; F2 G20210А; глубокий дефицит антитромбина III, протеина С или протеина S);
- сахарный диабет (1-го или 2-го типа);
- хроническая артериальная гипертензия;
- индекс массы тела 35 кг/м2 и более при первом посещении.
Необходимо отметить, что в настоящее время коагулограмма не служит скрининговым анализом для этого нарушения, хотя фибриноген предложен в качестве возможного маркёра преэклампсии, особенно тяжёлой, в III триместре беременности46. У таких пациенток желательно определять гомоцистеин, при этом такие методы, как исследование функции тромбоцитов, измерение уровня D-димера или выполнение ТЭГ, не предоставляют дополнительной диагностической информации.
Антифосфолипидный синдром
АФС — аутоиммунное заболевание, которому присуще сочетание неблагоприятных исходов беременности или тромбозов (венозных или артериальных) с повышением титра антифосфолипидных антител (волчаночного антикоагулянта, антител к кардиолипину и β2-гликопротеину-1). Многие исследователи считают АФС одной из наиболее важных корригируемых причин привычного невынашивания беременности.
Согласно международному консенсусному заявлению 2006 года, известному, как «Сиднейские диагностические критерии АФС», о наличии этого заболевания можно говорить только в случае комбинации по меньшей мере одного из клинических и одного из лабораторных критериев синдрома47.
К клиническим критериям АФС относят следующие.
- Сосудистый тромбоз. Один или более клинических эпизодов тромбоза артерий, вен или мелких сосудов в любых тканях или органах. Тромбоз должен быть объективно подтверждён бесспорными результатами визуализирующих методов исследования (или гистологически, в последнем случае в отсутствие выраженного воспаления сосудистой стенки).
- Потери беременности:
- один или более случаев внутриутробной гибели морфологически нормального плода на сроке 10 нед гестации и позднее (нормальное морфологическое строение документировано при УЗИ или непосредственном исследовании абортуса); или
- один или более случаев преждевременных родов морфологически нормальным плодом на сроке до 34 нед гестации вследствие тяжёлой преэклампсии, или эклампсии, или выраженной плацентарной недостаточности; или
- три или более последовательных случаев самопроизвольной потери беременности на сроке до 10 нед гестации после исключения анатомических дефектов матки, гормональных нарушений, материнских или отцовских хромосомных нарушений.
Лабораторные критерии АФС следующие.
- Волчаночный антикоагулянт, выявленный в плазме крови при двух исследованиях или более с промежутком не менее 12 нед, согласно рекомендациям ISTH.
- Антитела к кардиолипину изотипов IgG и/или IgM, выявленные в сыворотке или плазме крови в средних или высоких титрах при двух исследованиях или более с промежутком не менее 12 нед с помощью стандартизованного иммуноферментного метода.
- Антитела к β2-гликопротеину-1 изотипов IgG и/или IgM, выявленные в сыворотке или плазме крови в высоких титрах при двух исследованиях или более с промежутком не менее 12 нед с помощью стандартизованного иммуноферментного метода.
Между эпизодами, отвечающими условиям клинических и лабораторных критериев АФС, не должно пройти более 12 нед (но меньше 5 лет). Изолированного выявления антифосфолипидных антител для вынесения диагноза АФС недостаточно.
Квалифицированную медицинскую помощь при АФС оказывают совместно ревматолог, гематолог и акушер-гинеколог. При обнаружении антифосфолипидных антител пациентке с тремя эпизодами невынашивания и более на прегравидарном этапе назначают профилактические дозы ацетилсалициловой кислоты. После положительного теста на беременность дополнительно используют профилактические дозы нефракционированного или низкомолекулярного гепарина48. Глюкокортикоиды не улучшают исходы беременности при АФС и повышают вероятность артериальной гипертензии и гестационного сахарного диабета.
Опасно для жизни
К ведущим критическим состояниям, определяющим современную структуру материнской смертности во всём мире, относят ДВС-синдром и различные клинические формы тромботической микроангиопатии (ТМА). В основе этих патологических состояний лежит повреждение эндотелия сосудов микроциркуляторного русла, влекущее за собой диссеминированное тромбообразование[^49–51].
На фоне гестации спектр клинических вариантов ТМА включает ряд заболеваний: атипичный гемолитико-уремический синдром (аГУС), тромботическую тромбоцитопеническую пурпуру (ТТП), преэклампсию и эклампсию, HELLP-синдром и катастрофический АФС (КАФС)[^52–54].
В группу риска ДВС-синдрома следует включать пациенток со следующими состояниями:
- острой массивной кровопотерей;
- эмболией околоплодными водами;
- преждевременной отслойкой плаценты;
- антенатальной гибелью плода;
- хорионамнионитом.
В пользу развития ТМА будут свидетельствовать:
- органная дисфункция различной локализации;
- тромбоцитопения в сочетании с гемолитической анемией;
- шизоцитоз;
- повышение активности печёночных трансаминаз;
- повышение уровня лактатдегидрогеназы.
В клинической практике объём исследования системы гемостаза при жизнеугрожающих состояниях должен включать оценку следующих параметров:
- количество тромбоцитов;
- металлопротеиназа ADAMTS13;
- протромбиновое время;
- фибриноген;
- ТЭГ;
- D-димер;
- антитромбин III;
- волчаночный антикоагулянт.
В то же время назначение таких весьма распространённых диагностических процедур, как исследование времени свёртывания и времени кровотечения, оценка агрегации тромбоцитов, растворимых фибрин-мономерных комплексов (методом паракоагуляции), не помогает надёжной верификации диагноза жизнеугрожающих состояний. Именно поэтому их рутинное применение не показано. А вот консультация гематолога при возникновении любого из указанных выше нарушений на фоне гестации — мера исключительно важная.
Для определения тактики ведения больных в качестве первоочередной задачи следует провести дифференциальную диагностику между ДВС-синдромом, вторичными ТМА (преэклампсия, HELLP-синдром и КАФС) и её первичными формами, аГУС и ТТП55 56. Так, одним из определяющих критериев дифференциальной диагностики ТМА признана активность металлопротеиназы ADAMTS1355. Для наследственной формы ТТП характерен дефицит ADAMTS13 (активность менее 10%)57. В то же время для верификации аГУС следует учитывать не только снижение активности ADAMTS13, но и обнаружение антител к обсуждаемой металлопротеиназе.
«…Гемостаз — эволюционно сложившаяся защитная реакция организма, выражающаяся в остановке кровотечения при повреждении стенки сосуда». Такое определение можно найти в медицинских энциклопедиях и учебниках, однако оно не отражает всей сложности и значимости процесса. В акушерско-гинекологической практике эта проблема особенно актуальна, причём охватывает пациенток как в период гестации, так и вне её. Современная лабораторная диагностика предлагает достаточно широкий спектр исследований свёртывающей и противосвёртывающей систем крови, но без чёткого понимания врачом всех особенностей гемостаза в различные периоды жизни женщины, интерпретация результатов вряд ли окажется точной и информативной.
Научно-практическое издание
Соловьёва Алина Викторовна, Дьяконов Сергей Александрович, Быкова Ольга Александровна
ГЕМОСТАЗ: ОШИБКИ И НЕТОЧНОСТИ
Лабораторная оценка системы гемостаза в акушерстве и гинекологии
Информационный бюллетень
Под редакцией В.Е. Радзинского
Генеральный директор: Светлана Александровна Маклецова
Креативный директор: Виталий Кристал
Директор по развитию: Александр Васильевич Иванов
Заместители редакционного директора: Ольга Анатольевна Раевская, Хильда Юрьевна Симоновская
Аппарат ответственного секретаря редакции: Мария Кириченко, Надежда Васильева
Ответственные редакторы: Ольга Быкова, Сергей Дьяконов
Препресс-директор: Анастасия Пушкарь
Выпускающие редакторы:Нелли Демкова, Елена Давыдова
Вёрстка: Галина Калинина
Корректор: Елена Соседова
Художник: Юлия Крестьянинова
Подписано в печать 11.11.2020. Бумага мелованная. Печать офсетная.
Формат 60×90/16. Усл. печ. л. 1. Тираж 15 500 экз.
Ответственность за содержание рекламы и публикаций «На правах рекламы» несут рекламодатели.
ООО «Медиабюро Статус презенс».
105082, Москва, Спартаковский пер., д. 2, стр. 1. Бизнес-центр «Платформа», подъезд 9, этаж 3. Тел.: +7 (499) 346 3902.
E-mail: info@praesens.ru. Сайт: praesens.ru.
Группа ВКонтакте: vk.com/praesens.
Группа в Фейсбуке: facebook.com/stpraesens.
Профиль в Инстаграме: instagram.com/statuspraesens.
Отпечатано в типографии ООО «МИНИН». 603104, г. Нижний Новгород, ул. Краснозвёздная, д. 7А, оф. 3.
Самое слабое звено в диагностике патологии системы гемостаза — преаналитический этап, который включает как подготовку пациента к выполнению исследования, так и саму процедуру забора и транспортировки образца крови в лабораторию. 80–85 % диагностических ошибок вызваны погрешностями на этом этапе, что объясняется высокой лабильностью и многофакторностью системы гемостаза.

Обычная скрининговая коагулограмма для одного пациента обходится более 10 рублей, расширенная — порядка 40 рублей в государственных клиниках, в частных дороже. Каждый дополнительный показатель (D-димер, активность факторов свертывания и пр.) увеличивает стоимость исследования как минимум на 20 рублей.
Ошибки на преаналитическом этапе и доставка некачественных образцов в лабораторию приводят к недостоверным результатам и делают все затраты бесполезными.
Подготовка пациента
На результаты могут повлиять экзогенные «варьирующие» факторы.
Физическая активность: спустя несколько минут физической активности в 2–3 раза увеличивается концентрация FVIII и фактора Виллебранда (vWF); может сохраняться на протяжении 12 часов. Происходит активация тромбоцитов и фибринолиза, увеличивается уровень D-димеров.
Длительный психологический стресс ведет к снижению активности FV, FVIII, FIX (сохраняется на протяжении нескольких дней). Стрессовые условия во время взятия крови приводят к гиперагрегации тромбоцитов.
Физиологические гормональные изменения влияют на активность всей системы свертывания и фибринолиз. Классическим примером является беременность. При физиологическом течении беременности наблюдается постепенный рост FVII и FX. Уровень FVIII и vWF увеличивается в 2–3 раза и сохраняется даже после родов. Формируется резистентность к протеину С (РС), активность протеина S (РS) снижается на 30 %.
Увеличивается уровень маркеров активации свертывания крови и растворимого фибрина. Изменения в системе фибринолиза связаны с ростом ингибиторов РАI-1, РАI-2 (плацентарного), постепенным ростом D-димеров.
При исследовании системы гемостаза у женщин приходится учитывать фазы месячного цикла и влияние гормональных препаратов. Уровни FVIII и vWF наименьшие в фолликулярной и наибольшие в лютеиновой фазе цикла. В период менопаузы наблюдается постепенный рост фибриногена и FVIII. Применение гормонозаместительной терапии (ГЗТ) вызывает АРС-резистентность и снижение PS.
Недостаточная стандартизация так называемых варьирующих долабораторных факторов приводит к диагностическим ошибкам и в итоге увеличивает продолжительность и стоимость диагностики и лечения пациента.
Памятка для пациента
- Кровь следует сдавать утром натощак, не менее чем через 8 ч после последнего приема пищи в условиях, которые не вызывают стресса.
- На протяжении 24 ч перед обследованием необходимо избегать физических нагрузок, употребления жирной пищи и приема алкоголя.
- В день обследования запрещается курить.
- Перед сдачей крови необходимо посидеть в течение 20–30 мин.
- При приеме варфарина рекомендуется с 17:00 до 19:00 принять всю дозу препарата с интервалом не менее 2 ч до или после приема пищи, с последующей сдачей анализа на МНО с 8:00 до 10:00.
Кстати, терминалы электронной очереди позволяют снизить влияние стрессового фактора на пациента, ожидающего взятия крови.
Что должен знать врач, направляющий пациента на обследование гемостаза
1. При назначении даты исследования врачу необходимо учитывать влияние лекарственных препаратов, принимаемых пациентом, на агрегацию тромбоцитов или параметры коагуляции (антикоагулянтов, тромболитиков, ингибиторов фибринолиза, антиагрегантов, оральных контрацептивов, НПВС, венотоников и др.). Эта информация вместе с диагнозом пациента должна быть отражена в бланке направления на исследование.
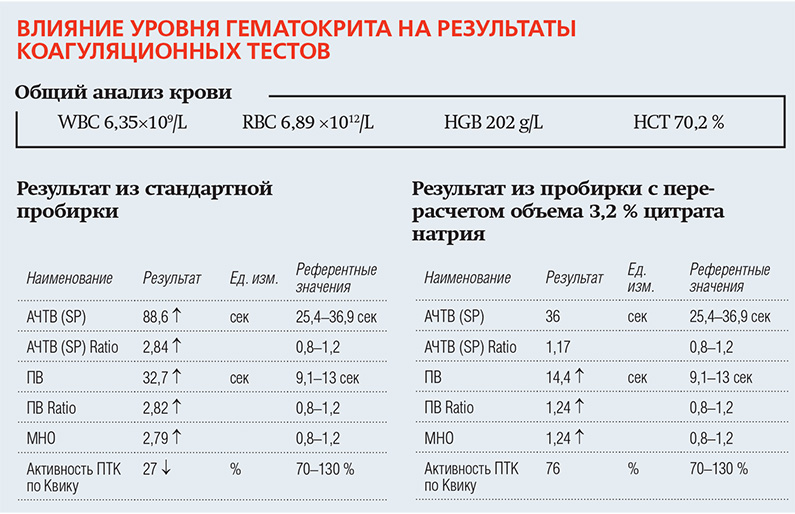
2. При высоком значении гематокрита стандартное количество цитрата в вакуумных пробирках оказывается избыточным для уменьшенного объема плазмы, что приводит к «ложной» гипокоагуляции. При значении гематокрита ниже 35 % возникает дефицит антикоагулянта в пробе, что может привести к «ложной» гиперкоагуляции в результатах и кровь может свернуться в пробирке еще до исследования. Для стабилизации образцов крови при нормальном значении гематокрита (35–50 %) рекомендуемое соотношение кровь/антикоагулянт 9:1. При отклонениях гематокрита от указанных величин следует изменить это соотношение в соответствии с формулой Ingram:
X — добавляемый объем 3,2 % цитрата, мл; V — конечный объем пробирки для крови, мл; HCT — показатель гематокрита у пациента, %.
3. Особенности подготовки к исследованиям системы гемостаза у женщин:
- С целью диагностики болезни Виллебранда у женщин детородного возраста следует брать кровь на исследование в 1–4-й дни месячного цикла (в дни максимальной кровопотери).
- С целью диагностики снижения РS и АРС-резистентности следует отменить прием оральных контрацептивов за 2 месяца перед обследованием.
- С целью диагностики врожденных нарушений свертывания крови у беременных (особенно болезни Виллебранда и недостатка РS) кровь необходимо брать не ранее, чем через 2 месяца после родов.
4. Диагностику волчаночного антикоагулянта (ВА) в остром периоде заболевания (до 3 месяцев) при приеме НОАК, прямых ингибиторов фактора Ха и тромбина проводить не рекомендуется во избежание получения ложноположительных результатов.
- при применении варфарина проводить исследование после того, как МНО опустится ниже 1,5, или через 1–2 недели после прекращения приема препарата; в случае необходимости продолжения АКТ препаратом выбора, который может быть назначен перед лабораторным исследованием на ВА, являются НМГ;
- последнее введение дозы НМГ должно проводиться за 12 и более часов до анализа крови на ВА. В случае применения НФГ следует отменить препарат за 2 дня до исследования ВА;
- при применении ривароксабана и дабигатрана проводить исследование через 3 дня после отмены препаратов или при переводе пациента на НМГ.
5. Мониторинг АКТ предполагает подбор дозы антикоагулянта, основанный на результатах лабораторных тестов. Крайне важно добиться от пациента правильного приема АК и следования графику.
Прием варфарина с 17:00 до 19:00 всей дозы одновременно с интервалом не менее 2 ч до или после приема пищи, с последующей сдачей анализа на МНО с 8:00 до 10:00.
Рекомендуемые уровни гипокоагуляции:
- высокий уровень МНО — от 3 до 4,5;
- средний уровень МНО — от 2 до 3;
- низкий уровень МНО — от 1,8 до 2,3.
Введение НМГ (далтепарина натрия, надропарина кальция, эноксапарина натрия) с 6:00 до 7:00 утра, сдача крови для исследования анти-Ха активности (НМГ) + антитромбина III (АТ) через 3–4 часа после введения с 10:00 до 11:00.
Целевой диапазон анти-Ха активности:
- для профилактических доз НМГ (п/к) 0,2–0,5 анти-Ха МЕ/мл;
- для лечебных (п/к) 0,5–1,5 анти-Ха МЕ/мл.
Прием ривароксабана (ксарелто) утром натощак с последующей сдачей крови для ис- следования анти-Ха активности (ривароксабан) + АТ через 1,5–2 ч после приема до 11:00.
Лабораторный контроль терапии НМГ и прямыми ингибиторами Ха-фактора рекомендован с учетом клинической ситуации в следующих случаях:
- при геморрагических проявлениях на фоне терапии;
- ОПН, ХПН;
- массе тела менее 50 и более 100 кг;
- длительной терапии (более 10 дней);
- риске кровотечений из-за сопутствующих заболеваний;
- терапии у беременных.

7. С целью диагностики наследственных и приобретенных тромбоцитопатий рекомендуется проводить исследование индуцированной агрегации тромбоцитов дважды:
- на момент обращения с геморрагическими проявлениями;
- повторно не ранее, чем через 14 дней после отмены приема всех препаратов, влияющих на агрегацию тромбоцитов, в т. ч. витаминов и БАДов.
Основные требования, обеспечивающие правильность тестирования показателей гемостаза:
- атравматическая флеботомия;
- полное заполнение пробирки кровью в соответствии с объемом антикоагулянта (9:1);
- использование 3,2 % (0,109 М) трехзамещенного двухводного цитрата натрия;
- полное и осторожное смешивание крови и антикоагулянта;
- транспортировка и хранение проб крови при комнатной температуре (18–25 °С);
- получение бестромбоцитарной плазмы центрифугированием крови в течение 1 ч после взятия;
- быстрое тестирование плазмы после центрифугирования.
Кровь следует брать утром натощак из локтевой вены иглой с широким просветом (0,8 мм). Преимущество имеют вакуумные пробирки, предназначенные для получения венозной крови, стабилизированной цитратом натрия в соотношении 9:1. Использование шприца не рекомендуется из-за активации тромбоцитов и факторов свертывания турбулентным движением крови и ее смешивания с воздухом во время заполнения.
Наложение манжеты при пункции локтевой вены оптимально в течение 1 минуты.
В ходе эксперимента при 3-минутном стазе, вызванном манжетой, ПВ укорачивалось на 3,1 %, содержание фибриногена повышалось на 10,1 %, D-димеров — на 13,4 %, активность FVII и FVIII увеличивалась на 10,6 % и 10,2 % соответственно.
Недостаточное перемешивание венозной крови и антикоагулянта может вызвать образование частичных сгустков небольшого размера, которые не видны в первичных пробирках. Проба запускается в работу, на исследования расходуются дорогостоящие реагенты и только по результатам исследования врач КДЛ может заподозрить наличие в пробе сгустков. В таких случаях выбраковка проводится на постаналитическом этапе лабораторного исследования.
Чем быстрее кровь доставлена в лабораторию, тем достовернее будет результат. Не нужно ждать 30 минут, как при получении сыворотки, чтобы сформировался сгусток. Работа ведется с плазмой, в которой, в отличие от сыворотки, есть фибриноген. Благодаря добавленному в пробирку антикоагулянту кровь не сворачивается.
По рекомендации CLSI, для тестирования плазменного звена гемостаза предпочтительным является 3,2 % (0,109 М) цитрат натрия. Применение именно этой концентрации дает меньшую частоту преаналитических ошибок, т. к. вызывает большую устойчивость лабильных факторов свертывания крови.
Для тестирования агрегационной способности тромбоцитов рекомендуется применение прямых ингибиторов тромбина и НФГ. Они оказывают наименьшее интерферирующее действие на агрегацию тромбоцитов. Очень важно сократить до минимума время между взятием крови и центрифугированием. До центрифугирования кровь необходимо хранить в закрытых пробирках только при комнатной температуре. Нарушение температурного режима может привести к гемолизу эритроцитов и активации тромбоцитов.
Врачи, направляющие пациентов на контроль эффективности антикоагулянтной терапии, должны помнить о необходимости соблюдения пациентами графика приема АК и мониторинга с помощью лабораторных исследований. Ведь последствиями пренебрежения правилами подготовки пациента могут быть такие угрозы, как ятрогенные (лекарственные) тромбозы и кровотечения, ложные суждения о наличии коагулопатии и в целом увеличение расходов на повторные исследования.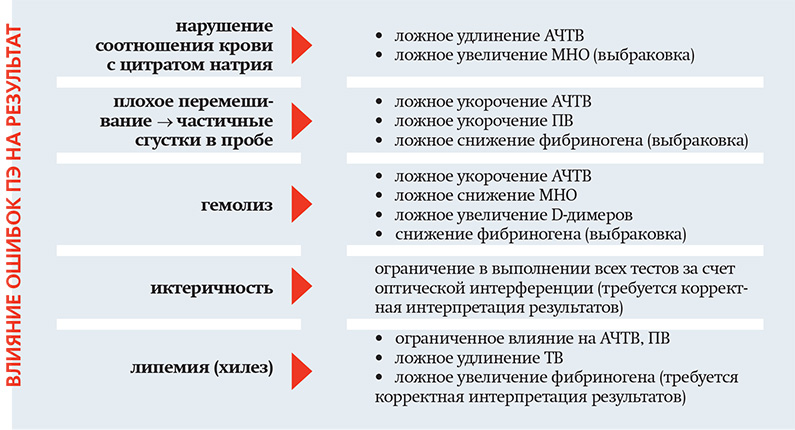
Гемостаз: ошибки и неточности лабораторная оценка системы гемостаза в акушерстве и гинекологии : информационный бюллетень
Гемостаз: ошибки и неточности лабораторная оценка системы гемостаза в акушерстве и гинекологии : информационный бюллетень
Электронная копия документа недоступна
14, 1 с.
Количество страниц
О произведении
Серия
Проект информационно-образовательный № 1
Общее примечание
Без тит. л. Описано по обл.
Еще
Ближайшая библиотека с бумажным экземпляром издания
Вы находитесь на новой версии портала Национальной Электронной Библиотеки. Если вы хотите воспользоваться старой версией,
перейдите по ссылке .
Гемостаз: ошибки и неточности. Лабораторная оценка системы гемостаза в акушерстве и гинекологии : информационный бюллетень
Издательство: Медиабюро «Статус презенс»
Год: 2020
Страниц: 14, [1]
Соловьева, Анна Викторовна.
Гемостаз: ошибки и неточности. Лабораторная оценка системы гемостаза в акушерстве и гинекологии : информационный бюллетень / А. В. Соловьева, С. А. Дьяконов, О. А. Быкова. – Москва : Медиабюро «Статус презенс», 2020 — (Информационно-образовательный проект N 1).Библиогр.: с. 14-15 (57 назв.).
Дополнительная информация
-
ISBN
978-5-907218-32-1
-
Город
Москва
-
Общие примечания
Описано по обл.
-
Место хранения
Ч/з1
-
Индекс ГРНТИ
76.29
Дополнительные изображения
Лекция в Федеральном научно-клиническом центре специализированных видов медицинской помощи и медицинских технологий ФМБА России 26.08.2022
Лектор — Главный врач НКЦПГ им. Шмидта, к.м.н., врач высшей квалификационной категории Альтшулер Б.Ю.

Содержание:
Вступление, общие сведения.
Обзор лабораторных методов диагностики гемостаза
Система протеина С и факторы свертывания
Исследование фибринолитической системы
D-димеры и РФМК. Маркеры АФС
Исследование сосудисто-тромбоцитарного гемостаза
Интегральные (глобальные) исследования
Плюсы и минусы различных методов исследования
В заключение
Использованная на лекции презентация
Аудиозапись лекции
Вступление, общие сведения
Добрый день, уважаемые коллеги!
Благодарю за возможность выступить в таком серьезном и авторитетном медицинском учреждении как ФМБА.
Свое выступление я хочу посвятить не какой-то одной патологии или методу диагностики, а исследованию гемостаза в целом. С точки зрения практической работы: на что стоит обращать внимание, какие технологии работают, а какие не работают, какие сложности и «подводные камни» существуют.
Напомню основы.

В системе гемостаза можно выделить три основных звена. Это плазменное звено, тромбоцитарное звено и стенка сосудов. Работают они вместе, но исследуются по-отдельности, хотя существуют и методы их интегральной оценки.
Выделяют два основных нарушения гемостаза: это тромбофилия, то есть повышение риска тромбоза, и геморрагический синдром или повышенный риск кровоточивости. И те, и другие могут быть как врожденными, так и приобретенными.
Тромбофилии встречаются чаще, составляя более 90% всех нарушений гемостаза. С точки зрения риска для здоровья они намного опаснее. В отличие от геморрагического синдрома, никогда не возникающего внезапно и формирующегося постепенно, тромбозы развиваются быстро, зачастую на фоне предшествующего благополучия и хорошего самочувствия. В результате ни пациент, ни врачи среагировать своевременно не успевают, имея дело уже с последствиями.
Поэтому превентивная диагностика и превентивная коррекция нарушений гемостаза так важны.
Нарушения гемостаза, в том числе серьезные, могут развиваться при самых разных заболеваниях. Также они могут вызываться и проводимой терапией. Ни один из врачей, в какой бы области медицины он не работал, не застрахован от столкновения с такими нарушениями на практике. У каждого десятого человека можно обнаружить то или иное нарушение гемостаза. И у каждого двадцатого нарушения эти столь серьезны, что требуют терапевтической коррекции. В качестве примера напомню, что только в США с их медициной, финансированием и отношением к здоровью только от ТЭЛА каждый год умирает свыше 350 тыс. человек. Это не частота встречаемости тромботических состояний или общее количество тех, у кого они диагностируются, – это количество летальных исходов и только от ТЭЛА и до пандемии COVID-19!
Обзор лабораторных методов диагностики гемостаза
Какие способы диагностики свертывающей системы крови и контроля направленной на неё терапии существуют? Они могут быть лабораторными и клиническими. Лабораторные считаются важнейшими с точки зрения объема и объективности получаемой информации.
Перед тем, как перейти собственно к лабораторным методам, хочу обратить ваше внимание на важнейший их этап. Он называется преаналитическим и касается всего, что происходит с образцами биологического материала до их поступления в лабораторию. Почему он так важен?
Дело в том, что многие компоненты свертывающей системы крови крайне нестабильны и подвержены быстрой деградации. Концентрация и активность многих из них уже через 2-3 часа после забора крови может снизиться наполовину, что значительно затрудняет их определение. Руководства по лабораторной диагностике, методические указания, ГОСТы требуют выполнения всех исследований свертывающей системы крови в течение 4-х часов после венопункции.
В связи с этим возникают вопросы к практике централизации лабораторных исследований. В ее основе лежит забор крови с последующей транспортировкой в отдаленную лабораторию и отсроченное выполнение исследований. Причина централизации лабораторных исследований только одна – стремление к удешевлению за счет снижения себестоимости. Платой за это становится принципиальная невозможность выполнения многих исследований, риск получения неправильных результатов, сомнение в их достоверности.

Какие исследования гемостаза существуют?
Их можно разделить на определение отдельных компонентов и так называемые интегральные или глобальные исследования. Интегральные исследования отличаются тем, что охватывают целые блоки и регуляторные звенья гемостаза. Существуют интегральные исследования, характеризующие и всю систему гемостаза в целом.
Также исследования можно разделить на скриниговые, дающие обзорную информацию, и углубленные, позволяющие оценить состояние гемостаза детально.
К скринингу традиционно относится определение протромбина, АЧТВ, тромбинового времени и фибриногена. Определение протромбина и АЧТВ тоже можно считать интегральными исследованиями, так как они характеризуют состояние соответственно внешнего и внутреннего путей свертывания крови.
Напомню, что внешний путь свертывания обеспечивает остановку кровотечения при повреждении тканей, нарушении целостности сосудистого русла и попадания в кровь тканевого тромбопластина. Внутренний путь свертывания обеспечивается контактной активацией факторов свертывания без повреждения сосудистой стенки.
Удлинение АЧТВ говорит о дефиците одного или нескольких факторов внутреннего пути свертывания. Укорочение АЧТВ, наоборот, свидетельствует об активизации свертывания крови по внутреннему пути, с большой вероятностью обусловленном повышенным содержанием факторов внутреннего пути. Напомню – это XII-й, XI-й, IX-й и VIII-й факторы.
Удлинение протромбинового времени говорит о замедлении свертывания крови по внешнему пути, зависящем от содержания не только самого протромбина (он же II-й фактор свертывания), но и VII-го фактора свертывания.
Также на результаты этих исследований влияет содержание V-го и Х-го факторов свертывания, лежащих на пересечении внешнего и внутреннего путей, концентрация фибриногена и стабилизирующего фибриновый сгусток XIII-го фактора.
Тромбиновое время – это скрининговый тест на полимеризацию фибрина и антикоагулянтную активность плазмы крови.
Определение протромбина, АЧТВ, тромбинового времени и фибриногена входит в базовую коагулограмму. Коагулограмма может быть и развернутой. Что может в нее входить? Во-первых, это исследование естественных антикоагулянтов, к которым относятся антитромбин-III и система протеина С.
Система протеина С и факторы свертывания
Система протеина C сложно организована, и значение имеет ее итоговый антикоагулянтный потенциал. Зависит он главным образом от концентрации самого протеина С и активирующего его кофактора – протеина S. Определение антикоагулянтного потенциала системы протеина можно рассматривать как интегральное исследование.

Что еще важно исследовать? Это резистентность Vа фактора свертывания крови к активированному протеину С (РАПС). Ее обнаруживают у 40% всех больных тромбофилией.
Чаще всего такое нарушение, приводящее к неконтролируемой коагуляции, – результат дефекта V-го фактора вследствие генетических аномалий. Из них чаще всего встречается мутация Лейдена, которая может быть гетеро- или гомозиготной. В случае гетерозиготной мутации Лейдена риск тромбоза повышается в 5-10 раз, в случае гомозиготной мутации – в 80 раз.
Мутация Лейдена — наиболее распространенный в европейской популяции протромботический дефект. Частота его гетерозиготного наследования среди европейцев колеблется от 3 до 16%. Гомозиготный вариант мутации встречается только у одного из тысячи (в 0,1%).
Раз уж я упомянул факторы свертывания. Их определение безусловно важно! Во-первых, для диагностики тромбофилии. Повышенное содержание факторов свертывания можно сравнить с массой снега, лежащего на крыше, и который рано или поздно свалится на стоящего внизу человека.
Известно, например, что повышение активности VIII-го фактора свертывания в 1,5 раза по сравнению со средним для популяции сопровождается 5-кратным риском развития тромбоза. Сниженное содержание факторов свертывания, напротив, может стать причиной геморрагического синдрома. Для этого изолированный дефицит одного фактора свертывания должен быть достаточно глубоким, со снижением активности ниже 10%. Однако, если дефицит касается не одного, а нескольких факторов одновременно, то для развития гемофилии достаточно снижения активности до 25-40%. Также имеет значение объем оперативного вмешательства: чем он больше, тем меньший дефицит прокоагулянтного потенциала станет критическим.
Как известно, задачей протеина С является инактивация V-го и VIII-го факторов свертывания. При чрезмерной активности этих факторов или сниженном содержании протеинов С и S, антикоагулянтной «емкости» протеина С может не хватать. В результате развивается РАПС, обусловленная не генетической аномалией. Такое встречается часто и об этом следует помнить.
Еще одно обстоятельство, о котором нужно знать – это влияние фактора Виллебранда на активность VIII-го фактора свертывания. Одна из функций фактора Виллебранда – защита VIII-го фактора от инактивации протеином С. В норме практически все молекулы VIII-го фактора связаны с фактором Виллебранда. Поэтому изменение содержания фактора Виллебранда всегда отражается на содержании в крови VIII-го фактора свертывания. Именно из-за VIII-го фактора 1,5-кратное повышение содержания фактора Виллебранда сопровождается 2-кратным увеличением риска тромбозов.
Раз уж я заговорил о факторе Виллебранда: болезнь Виллебранда – это самое распространенное геморрагическое заболевание. Дефектный ген фактора Виллебранда встречается 1:100 в популяции, из которых у каждого третьего имеются клинические проявления.
Встречаясь с повышенным содержанием VIII-го и V-го факторов свертывания, фактора Виллебранда, резистентностью к активированному протеину С – помните об их взаимосвязях.

Дефицит XII-го фактора свертывания, наоборот, может приводить не к повышенному риску кровотечений, а к риску тромбозов (болезнь Хагемана). Это обусловлено тем, что XII-й фактор – основной активатор фибринолитической системы. Вклад XII-го фактора в активацию фибринолиза намного больше, чем в свертывание крови.
В целом как протромботическое, так и геморрагическое влияние факторов свертывания нужно расценивать по суммарному изменению их активности.
Исследование фибринолитической системы
Для понимания гемостатического баланса важно знать и состояние фибринолитической системы крови. Снижение ее активности – фактор риска тромбозов, а повышение способствует развитию кровотечений. Какое изменение считать клинически важным? В 4-5 раз относительно средних популяционных значений.
Фибринолитическая система устроена сложно и определение ее отдельных компонентов может быть дорогостоящим и длительным. Для интегральной оценки целесообразно определять время XIIа-зависимого лизиса эуглобулинов (XIIа-зависимый фибринолиз) Эту методику многие считают устаревшей, но по простоте и доступности ей до сих пор нет адекватной замены. Она включена в Национальное руководство по лабораторной диагностике и в Приказ МЗ РФ №804н.
При исследовании фибринолитической системы важно понимать, что привело к снижению или повышению ее активности. О роли XII-го фактора свертывания как активатора фибринолиза я говорил.
Важнейшими ингибиторами фибринолиза считаются ингибиторы активатора плазминогена 1-го и 2-го типа (PAI-1 и PAI-2).
PAI-1 синтезируется в эндотелиальных клетках. Это острофазовый белок. Поэтому на фоне выраженной воспалительной реакции активность фибринолиза может снижаться в несколько раз. Повышение продукции PAI-1 и PAI-2 происходит и при беременности. Подавление фибринолиза при беременности – основная причина сдвига гемостатического баланса и формирования предтромботического состояния.
Определение плазминогена, предшественника лизирующего фибрин фермента плазмина, или альфа-2-антиплазмина, подавляющего плазминовую активность, имеет меньшую ценность, чем исследование XIIа-зависимого фибринолиза.
D-димеры и РФМК. Маркеры АФС
Что еще исследуют? Это определение D-димеров и РФМК.
D-димеры образуются при разрушении фибрина – основного структурного компонента тромба – фибринолитической системой или фибринолитиками. Концентрация Д-димера, таким образом, отражает активность фибринолиза и количество лизируемого фибрина. Повышение Д-димера определяется не только при тромбозах, но и после операций, особенно при большом операционном поле. D-димеры долго циркулируют в крови и после острого тромбоза могут персистировать до нескольких недель. Поэтому большее диагностическое значение имеет отрицательный результат этого теста (D-димер в пределах нормы).
РФМК – это растворимый фибрин, то есть его мономеры и олигомерные нити, еще не сшитые XIII-м фактором свертывания в плотную, нерастворимую структуру. Концентрация РФМК, зависящая от превращения фибриногена в фибрин, характеризует тромбиновую активность крови. РФМК появляются, когда состояние гемостаза угрожает развитием тромбоза. В отличие от Д-димера технология определения РФМК менее точна. Эффективный способом повысить точность определения РФМК – это одновременная постановка нескольких исследований с одним образцом крови и расчетом среднего значения.
Какие еще исследования важны? Это определение маркеров антифосфолипидного синдрома – важной причины тромбофилии. АФС на порядок повышает риск возникновения тромбоза. У женщин АФС встречается в 10 раз чаще, чем у мужчин. Для диагностики АФС клинические рекомендации предполагают определение волчаночного антикоагулянта (ВА), антител к кардиолипину и антител к бета-2-гликопротеину. Значение имеет только многократное повышение антифосфолипидных антител, причем подтвержденное спустя 12 недель. Незначительное повышение не рассматривается как диагностический критерий АФС.
Исследование сосудисто-тромбоцитарного гемостаза
Отдельным направлением является исследование сосудисто-тромбоцитарного гемостаза. Для этого необходимо исследовать тромбоциты в условиях, максимально близких к физиологическим.
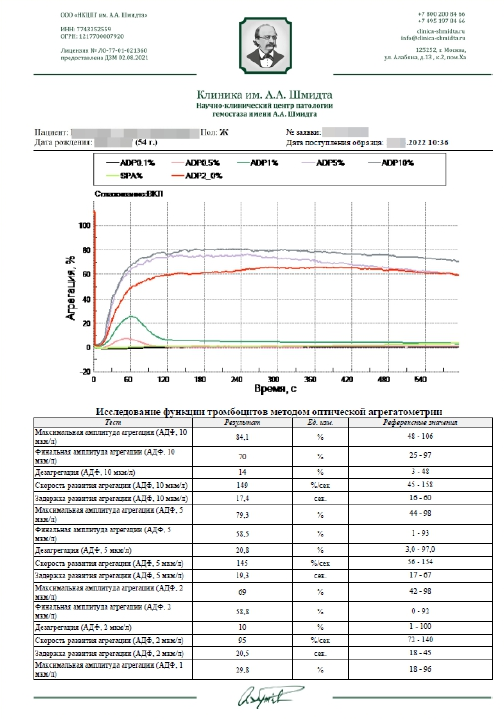
Затем происходит запись агрегатограммы – графика, иллюстрирующего динамику формирования тромбоцитарных агрегатов. Диагностическое значение имеет задержка развития агрегации, скорость ее развития, амплитуда агрегации, скорость и амплитуда дезагрегации и характер агрегатограммы (одноволновая / двухволновая, обратимая / частично обратимая / необратимая). Все эти параметры зависят от концентрации индуктора.
Упрощенное исследование тромбоцитарной агрегации лишает врача важной диагностической информации. Как это может происходить?
Например, вместо записи агрегатограммы может фиксироваться лишь одно цифровое значение, отражающее интенсивность агрегации в какой-то момент, по сути характеризуя только одну точку на агрегатограмме. К этому же приводит использование какой-то одной концентрации индуктора или одного «универсального» индуктора.
Такой подход лишает врача 3/4 информации, которую можно получить и которая нужна для оценки риска тромбоза, нарушения сосудистой микроциркуляции и дозировки антиагрегантов.
Разновидностью оптической агрегатометрии является исследование спонтанной агрегации тромбоцитов без химической активации. Используется только механическая активация, имитирующая нарушение нормального кровотока. Такое исследование важно, поскольку нарушение ламинарной гемодинамики, турбуленция в токе крови – важный фактор активации тромбоцитов. Но оно не заменяет использование индукторов, которые в организме служат основным механизмом активации тромбоцитов.
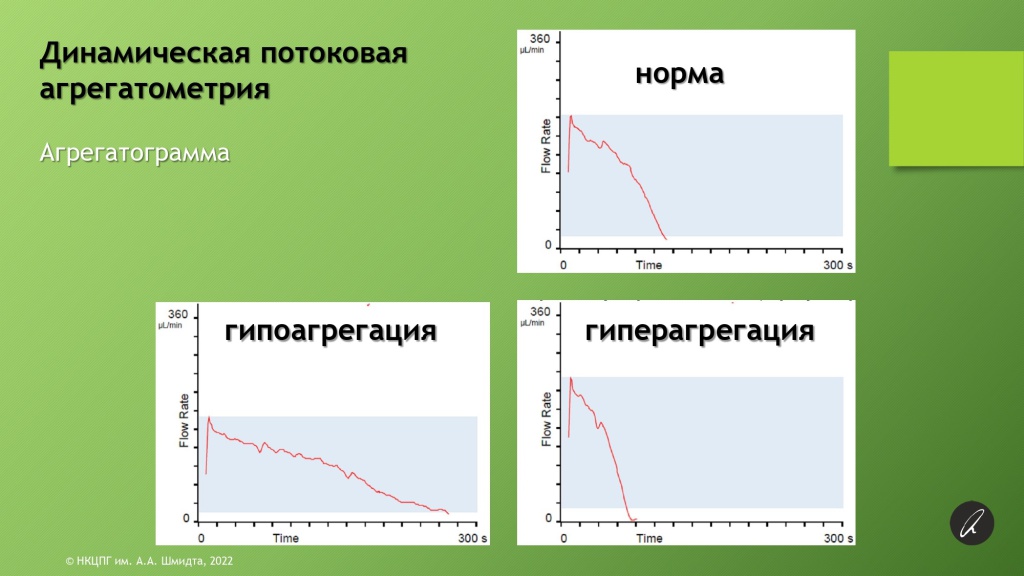
Второй метод исследования, еще более приближенный к физиологическим условиям – потоковая (проточная) динамическая агрегатометрия.
Для нее используется не плазма, а цельная кровь. Кровь пропускается через специальный картридж, в котором есть микроскопическое отверстие. На это отверстие, имитирующее просвет сосуда или участок его повреждения, нанесены индукторы агрегации.
В ходе исследования определяется время окклюзии, развивающейся за счет постепенного накопления в отверстии тромбоцитарных агрегатов, что ведет к уменьшению его просвета. В результате скорость протекания крови постепенно снижается вплоть до полной остановки потока. Изменение скорости потока, объем прошедшей через отверстие крови, время окончательной окклюзии с учетом типа индуктора и концентрации тромбоцитов имеют диагностическое значение.

По чувствительности этот метод значительно уступает оптической агрегатометрии и не обеспечивает того же приближения к физиологическим условиям, которое достижимо с использованием проточной технологии (динамической потоковой агрегатометрии).
Исходя из собственного опыта работы, мы пришли к выводу, что для получения максимума диагностической информации оптимально сочетание оптической и проточной агрегатометрии.
Интегральные (глобальные) исследования
Теперь перейдем к уже упоминавшимся интегральным исследованиям. Их три: это исследование тромбодинамики, тромбоэластография и тест генерации тромбина.
Исследование тромбодинамики — это российская разработка. Для исследования тромбодинамики из крови пациента центрифугированием получают бедную тромбоцитами плазму.
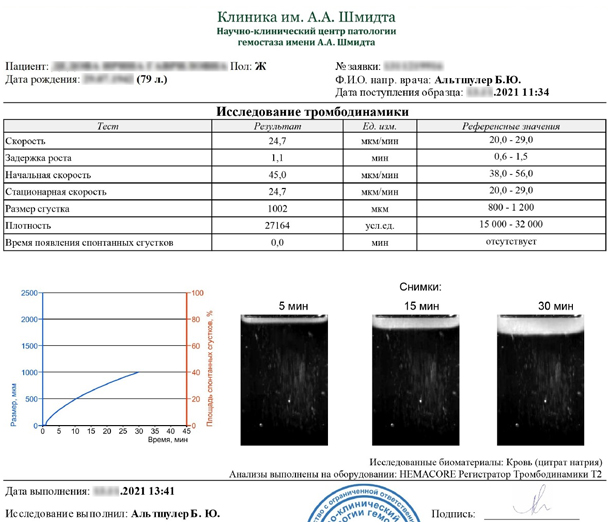
Плазма вносится в специальную измерительную кювету, размещенную в приборе – регистраторе тромбодинамики.
В измерительную кювету вводится вставка, покрытая активатором свертывания – тканевым фактором. Она имитирует участок повреждения сосуда, в области которого плазма крови контактирует со структурами сосудистой стенки, также содержащими тканевый фактор. Как только вставка-активатор оказывается в измерительной кювете, запускается процесс свертывания, при котором на поверхности вставки постепенно образуется фибриновый сгусток.
Анализатор тромбодинамики с помощью фото- и видеофиксации регистрирует рост фибринового сгустка. Параметры роста имеют диагностическое значение и для них определены референсные интервалы, соответствующие состоянию нормы.
Видеозапись теста, помимо его визуализации, помогает выявить аналитические ошибки и оценить нарушения гемостаза. Основные преимущества метода — наглядность, простота, быстрота восприятия и легкость понимания результатов. Исследование тромбодинамики включено в Приказ МЗ РФ №804н под названием «динамическая тромбофотометрия».
Старейшим из интегральных методов исследования гемостаза считается тромбоэластография.
Тромбоэластограф измеряет вязкостно-эластические свойства формирующегося кровяного сгустка. Для этого в измерительную кювету последовательно вносятся активирующие свертывание реактивы и исследуемая кровь. Затем в кювету погружают вращающийся цилиндр. Когда в кювете начинается свертывание крови и образуются нити фибрина, возникает сопротивление вращению цилиндра. По мере формирования, полимеризации и уплотнения сгустка крови сопротивление вращению цилиндра увеличивается. Вращательное движение преобразуется в электрический сигнал, который обрабатывается прибором. Таким образом измеряется время образования первых нитей фибрина, время формирования стабильного сгустка, механическая прочность сгустка и процесс его постепенного растворения.
И, наконец, тест генерации тромбина. Способность генерировать тромбин определяет коагуляционный потенциал крови и может быть интегральным показателем состояния гемостаза. Метод основан на инкубации исследуемой крови с активатором и флюорогенным субстратом. Интенсивность флуоресценции пропорциональна концентрации образующегося тромбина.
Плюсы и минусы различных методов исследования
Сравним интегральные исследования между собой и с другими методами исследования гемостаза.
По сравнению со стандартной коагулограммой, исходно предназначенной для обнаружения склонности к кровотечениям и малочувствительной к гиперкоагуляции, исследование тромбодинамики и тромбоэластография обладают равной чувствительностью к гипо-и гиперкоагуляционным состояниям. Кроме того, дефицит или избыток отдельных компонентов не позволяет судить об итоговой интенсивности свертывания крови и фибринолиза.
Определение D-димеров, появляющихся уже после образования фибрина или состоявшегося тромбоза, в отличие от интегральных исследований, ничего не говорит о предрасположенности к тромбообразованию, что нужно для его своевременного предотвращения.
Наконец, изменения в содержании отдельных компонентов могут быть разнонаправленными, затрудняя понимание происходящего и итогового результата.
В сравнении с тромбоэластографией тромбодинамика отличается намного большей чувствительностью. Основные недостатки тромбоэластографии – это широкие диапазоны норм, на фоне которых не всегда видны патологические изменения, и недостаточная разделяемость вкладов в процесс свертывания плазменного и тромбоцитарного звеньев гемостаза.
Еще одно преимущество тромбодинамики перед всеми другими методами исследования гемостаза – это моделирование локального запуска свертывания крови, что имитирует образование тромба в области поврежденной сосудистой стенки. С другой стороны, использование в тесте тромбодинамики бедной тромбоцитами плазмы исключает возможность оценки этим методом тромбоцитарного звена гемостаза. Также исследование тромбодинамики не позволяет оценить состояние фибринолитической системы крови.
Основной недостаток теста генерации тромбина — его высокая стоимость, отсутствие стандартизации и общепризнанных референсных интервалов нормальных значений. По этим причинам ТГТ до сих пор относится к научным, а не клиническим лабораторным исследованиям. В нашей стране он практически нигде не выполняется. Это делает тромбодинамику и тромбоэластографию единственными доступными интегральными методами исследований.
Главный недостаток всех интегральных тестов в том, что они не дают информации об отдельных компонентах системы гемостаза. Наглядность результата исследования и простота для понимания оборачиваются упущенной информацией о деталях.
В заключение
Я рассказал далеко не обо всех методах исследований гемостаза. В заключение хочу обратить ваше внимание на желательность его углубленного исследования даже в простых клинических ситуациях.
Очень часто причиной тромбофилии или геморрагического синдрома становится недостаток или избыток только одного компонента или сбой в одном регуляторном звене. Обнаружить такое изолированное нарушение возможно лишь при расширенном обследовании.
Каждый пациент, страдающий нарушениями в свертывающей системы крови, очень индивидуален. Это исключает шаблонный, опирающийся только на неоспоримую доказательную базу, основанный на технологической доступности и финансовой экономии подход к диагностике нарушений гемостаза. К сожалению, именно он лежит в основе большинства современных клинических рекомендаций и медико-экономических стандартов.
Однако, как показывает опыт, эффективная превентивная диагностика нарушений гемостаза возможна только при углубленном и всестороннем его исследовании.