Мифы о ДЦП, в которые пора перестать верить: разбираем популярные заблуждения
Содержимое
- 1 Мифы о ДЦП, в которые пора перестать верить: разбираем популярные заблуждения
- 1.1 Факты и споры с мифами о ДЦП
- 1.2 ДЦП — это непоправимое заболевание?
- 1.3 Миф: ДЦП возникает только у детей с патологиями внутриутробного развития
- 1.4 Разбор мифов о ДЦП: ДЦП обязательно сопровождается умственной отсталостью?
- 1.5 Миф о возможности полного излечения дцп
- 1.6 ДЦП вызывается неправильным воспитанием и дисциплиной?
- 1.7 Миф о ДЦП: ограниченность проявлений нарушений движений конечностей
- 1.8 Почему дцп не всегда является наследственным заболеванием?
- 1.9 Миф: дети с ДЦП не могут заниматься спортом
- 1.10 Дети с ДЦП могут получать образование
- 1.11 Видео по теме:
- 1.12 Вопрос-ответ:
-
- 1.12.0.1 Что такое ДЦП и это жизненно угрожающее заболевание?
- 1.12.0.2 Можно ли излечить ДЦП?
- 1.12.0.3 Дети с ДЦП не могут учиться в нормальных школах?
- 1.12.0.4 Можно ли заниматься спортом, если у тебя ДЦП?
- 1.12.0.5 Дети с ДЦП всегда умственно отсталые?
- 1.12.0.6 Обязательно ли детям с ДЦП нужна специальная обувь и другие устройства помощи?
-
- 1.13 Миф о зависимости детей с ДЦП от помощи взрослых
- 1.14 ДЦП нельзя предотвратить? Разберемся в мифах
Что на самом деле знают люди о детском церебральном параличе? Мы разбираем самые распространенные мифы и рассказываем правду, во что стоит перестать верить. Ознакомьтесь с нашей статьей и получите полезную информацию!
Детский церебральный паралич (ДЦП) – это одно из самых распространенных нарушений в развитии движений, возникающее у детей в раннем возрасте. Несмотря на то, что ДЦП является достаточно изученной болезнью, круг мифов и заблуждений вокруг нее все еще остается обширным. Многие люди и те, кто имеет отношение к рождению и воспитанию ребенка, загадочно смотрят на ДЦП, представляя себе некоторые вещи неправильно.
Некоторые из этих мифов интерпретируют ДЦП как несчастную случайность, тогда как другие говорят о невозможности лечения. Может показаться, что вера в эти мифы помогает родителям справиться с диагнозом, но на самом деле это только мешает им понимать действительность и выбирать оптимальные решения для своего ребенка.
В этой статье мы разберем несколько общих мифов о ДЦП и докажем, что на самом деле они являются ложными. После прочтения статьи вы узнаете, какие мифы и заблуждения нужно забыть, а какие факты нужно помнить, чтобы помочь ребенку с ДЦП.
Факты и споры с мифами о ДЦП
Миф: ДЦП — это «детская болезнь», которая проходит со временем.
Факт: ДЦП (детский церебральный паралич) — это невосполняемое ограничение движения, которое может сопровождать человека на протяжении всей его жизни. Однако, с помощью регулярных занятий физической терапией, лечения и реабилитации, дети с ДЦП могут значительно улучшить свои двигательные навыки и жить активной жизнью.
Миф: ДЦП вызвано неправильным уходом за ребенком или недостатком внимания к нему.
Факт: ДЦП вызвано повреждением мозга в результате недостатка кислорода более чем на несколько минут во время беременности, родов или в первые годы жизни. Никакой уход и внимание не могут предотвратить развитие ДЦП.
Миф: Дети с ДЦП не могут обучаться и жить полноценной жизнью.
Факт: В зависимости от тяжести ДЦП, дети могут получать образование, работать, заниматься различными видами спорта и участвовать в жизни общества. Подходящее лечение и реабилитация, а также поддержка со стороны семьи и общества могут помочь детям с ДЦП достигать своих целей и реализовывать свой потенциал.
Миф: ДЦП распространено только в развивающихся странах или среди бедных семей.
Факт: ДЦП может возникнуть у кого угодно, независимо от социального статуса, положения в обществе или места проживания. В США один из 323 ребенка имеет ДЦП, а в мире около 17 миллионов людей живут с этим состоянием.
ДЦП — это непоправимое заболевание?
Многие считают, что детский церебральный паралич (ДЦП) является непоправимым заболеванием, которое не поддается лечению и обреченным детям неизбежно предстоит жить на всю жизнь с ограничениями.
Однако это не совсем верно. Хотя ДЦП является хроническим заболеванием нервной системы, то при своевременном и комплексном вмешательстве может произойти улучшение состояния пациента, что в свою очередь может улучшить его качество жизни.
Основным лечением для детей с ДЦП является реабилитация, включающая в себя физиотерапию, массаж, лечебную гимнастику и другие методы. Эти методы помогают улучшить мышечный тонус и координацию движений, что позволяет детям с ДЦП более полноценно включаться в жизнь общества.
Кроме того, в некоторых случаях показано хирургическое лечение, которое также может значительно улучшить качество жизни пациента.
Таким образом, можно сделать вывод, что ДЦП не является непоправимым заболеванием, однако требует систематического и комплексного лечения для улучшения качества жизни пациентов с этим заболеванием.
Миф: ДЦП возникает только у детей с патологиями внутриутробного развития
Этот миф связан с ошибочной идеей о том, что ДЦП происходит только вследствие патологии внутриутробного развития. На самом деле, есть множество других факторов, которые могут привести к ДЦП у ребенка.
Например, травма головы, инфекционные заболевания или кровоизлияние в мозг могут стать причиной развития ДЦП у ребенка. Некоторые случаи ДЦП связаны с факторами риска, такими как ранний возраст матери, низкий вес при рождении и затруднения при родах.
Патологии внутриутробного развития все же могут быть причиной развития ДЦП, но это не единственная возможность. Важно понимать, что ДЦП может произойти у любого ребенка, независимо от причины.
Разбор мифов о ДЦП: ДЦП обязательно сопровождается умственной отсталостью?
Один из распространенных мифов о детском церебральном параличе (ДЦП) — это то, что все дети с ДЦП имеют умственную отсталость. Однако, это не соответствует действительности.
Различные типы ДЦП могут привести к различным умственным возможностям. Для некоторых детей, ДЦП может не иметь никакого эффекта на уровень их интеллектуальных способностей. Для других детей, ДЦП может привести к таким нарушениям, как задержка речи или обучения.
Следует заметить, что для детей с ДЦП, как и для любого другого ребенка, наличие дополнительной поддержки и помощи со стороны учителей, родителей и терапевтов может помочь развиваться и достигать своих потенциальных возможностей.
Поэтому, не следует считать, что все дети с ДЦП имеют умственную отсталость. Каждый ребенок уникален и мого добиться больших результатов при правильной поддержке и заботе со стороны окружающих людей.
Миф о возможности полного излечения дцп
Некоторые люди считают, что дети с ДЦП могут полностью излечиться и жить как все здоровые люди. Однако это не соответствует действительности.
ДЦП — это неврастеническое заболевание, которое возникает вследствие повреждения мозга в начальном периоде развития. Поскольку поврежденные нервные цепочки не могут восстановиться сами, на данный момент не существует методов для полного излечения дцп.
Тем не менее, ранняя диагностика и комплексное лечение могут значительно улучшить качество жизни пациента.Физическая терапия, эрготерапия, массаж и другие методы помогают улучшить координацию движений, укреплять мышцы и уменьшать спастичность.
Важно понимать, что каждый случай уникален и каждый ребенок развивается по-разному. Поэтому важно уделить внимание индивидуальным потребностям ребенка и работать над его развитием каждый день. Это поможет ему достигнуть максимального потенциала и жить наиболее полной жизнью, несмотря на наличие заболевания.
ДЦП вызывается неправильным воспитанием и дисциплиной?
Миф о том, что детский церебральный паралич (ДЦП) является последствием неправильного воспитания и дисциплины, давно уже опровергнут. Основной причиной возникновения ДЦП являются проблемы в развитии мозга еще в период беременности, в родах или в начальном периоде жизни.
Естественно, воспитание и дисциплина влияют на развитие ребенка и его поведение, но они не могут вызвать ДЦП. Способствовать здоровому развитию ребенка могут правильное питание, физические упражнения, общение и полноценный сон.
Родители детей с ДЦП не должны обвинять себя в происшедшем и стараться находить виновных во всем, а сконцентрироваться на том, чтобы помочь своему ребенку в развитии и повышении качества жизни.
Миф о ДЦП: ограниченность проявлений нарушений движений конечностей
Многие люди думают, что детский церебральный паралич (ДЦП) проявляется только в нарушениях движений конечностей. Однако это мнение неверное и недостаточно подробное. ДЦП — это комплексное заболевание, которое может вызывать различные нарушения в работе многих систем организма.
Помимо нарушений движений конечностей, при ДЦП могут наблюдаться проблемы со зрением, слухом, речью и дыханием. Кроме того, у детей с ДЦП часто возникают нарушения эмоционально-волевой сферы, что может приводить к проблемам с адаптацией в обществе и развитию личности.
Так что, если Вы думаете, что ДЦП проявляется только в нарушениях движений конечностей, стоит пересмотреть свое мнение и изучить более подробно этот сложный и многогранный синдром.
Почему дцп не всегда является наследственным заболеванием?
ДЦП (детский церебральный паралич) — это комплексная группа заболеваний, связанных с нарушением функционирования мозга. Некоторые исследования свидетельствуют о том, что ДЦП может быть вызвано нарушениями внутриутробного развития, а не только генетическими факторами.
Также, даже в случае наличия генетических факторов, не всегда появляется дцп. Существует риск, что наследственность может повлиять на возникновение заболевания, но этот риск мал. Чаще дцп связан с различными внешними факторами, такими как травмы головы, инфекции, кислородное голодание или другие неблагоприятные условия рождения.
Поэтому говорить о том, что дцп — это всегда наследственное заболевание — является ошибочным мнением и вызывает множество ложных представлений о заболевании.
- Важно знать, что:
| Миф | Действительность |
| Дцп — это только наследственное заболевание. | Дцп может быть вызвано различными факторами, включая нарушения внутриутробного развития и другие неблагоприятные условия. |
| Родители с дцп обязательно передают заболевание своим детям | Дцп не всегда является генетическим заболеванием и риск передачи заболевания от родителей к детям невелик. |
| Дцп — это непризнанное заболевание. | Дцп является признанным медицинским заболеванием. |
Миф: дети с ДЦП не могут заниматься спортом
Одним из распространенных мифов о детях с ДЦП (детским церебральным параличом) является то, что они не могут заниматься спортом и физическими упражнениями. Это мнение, однако, не соответствует действительности. Конечно, у каждого пациента возможны свои физические ограничения, однако это не обязательно означает, что ребенок с ДЦП не может заниматься спортом.
Правильно организованное занятие спортом может иметь положительный эффект на здоровье ребенка с ДЦП и даже способствовать улучшению его двигательных функций. Существует много видов спорта, таких как гимнастика, плавание, езда на велосипеде, которые могут быть безопасными для детей с ДЦП при правильном подходе и контроле со стороны медицинского персонала и тренера.
Также следует помнить, что спорт может помочь детям с ДЦП укрепить их самооценку и уверенность в себе, что является важным аспектом в ходе их развития и социальной адаптации.
- Итак, вместо того, чтобы ограничивать детей с ДЦП, нужно поощрять их заниматься спортом, а также обеспечивать им поддержку и необходимую помощь в этом процессе.
Дети с ДЦП могут получать образование
Одним из распространенных мифов о ДЦП является идея, что дети с этим расстройством не могут учиться в школе. Однако это далеко не так. В большинстве случаев дети с ДЦП могут получить образование, даже если нужна индивидуальная поддержка и адаптация программы обучения.
Преподаватели и школьные педагоги могут работать с каждым учеником индивидуально, чтобы помочь им учиться с тех же стандартов, что и все остальные ученики. Более того, существуют специальные школы и образовательные центры, приспособленные для детей с различными нетипичными условиями обучения, включая ДЦП.
Ограниченные возможности для образования также не являются правдой для детей с ДЦП. Многие из них могут успешно завершить классы, получить диплом и даже продолжить свое образование в колледже или университете, если им это интересно и они мотивированы.
Важно помнить, что возможности для образования тесно связаны с поддержкой и пониманием со стороны общества. Дети с ДЦП заслуживают тех же возможностей, что и все остальные дети, и у них есть потенциал для успешного обучения и достижения.
Видео по теме:
Вопрос-ответ:
Что такое ДЦП и это жизненно угрожающее заболевание?
ДЦП (детский церебральный паралич) — это не заболевание, а нарушение движения, вызванное повреждением головного мозга в раннем детстве. Это не жизненно угрожающее состояние, но может сильно ограничить детей в их движении и повседневных делах.
Можно ли излечить ДЦП?
Нет, ДЦП — неизлечимое заболевание, но лечение может помочь улучшить качество жизни ребенка и сделать его более независимым в ежедневной жизни.
Дети с ДЦП не могут учиться в нормальных школах?
Это неправда. Многие дети с ДЦП учатся в нормальных школах. Однако, могут понадобится дополнительные услуги, такие как физическая терапия или индивидуальное обучение.
Можно ли заниматься спортом, если у тебя ДЦП?
Да, дети с ДЦП могут заниматься спортом. Многие занимаются водными видами спорта, а также летними и зимними видами спорта. Важно, чтобы спорт был подходящим для возможностей ребенка и осуществлялся под контролем специалистов.
Дети с ДЦП всегда умственно отсталые?
Нет, ДЦП не означает умственную отсталость. Большинство детей с ДЦП имеют обычный интеллект. Однако, у некоторых детей могут быть проблемы с когнитивными функциями, такими как внимание и память.
Обязательно ли детям с ДЦП нужна специальная обувь и другие устройства помощи?
Не всегда. Некоторым детям с ДЦП необходимы устройства помощи, такие как ортезы и специальная обувь, чтобы помочь им двигаться. Однако, это зависит от степени нарушения движений и индивидуальных потребностей каждого ребенка.
Миф о зависимости детей с ДЦП от помощи взрослых
Миф: Родителям детей с ДЦП нужно смириться с тем, что их ребенок будет зависим от помощи взрослых на всю жизнь.
Несмотря на распространенное мнение, что дети с ДЦП всегда зависят от помощи взрослых, это не так. Да, возможно, в некоторых ситуациях их потребуется поддержка, но это не означает, что они будут зависеть от нее на всю жизнь. Важно помнить, что каждый человек – индивидуальность со своими способностями и возможностями.
Факт: Дети с ДЦП могут достигать успехов и независимости в жизни, если получают необходимые условия и поддержку. Специальные техники реабилитации и физические упражнения могут помочь развить силу мышц и улучшить координацию. Кроме того, социальная интеграция и образование в общеобразовательных школах также могут помочь детям с ДЦП достигнуть своих целей и стать независимыми взрослыми.
Важно помнить, что каждый ребенок с ДЦП уникален и имеет свой собственный путь к успеху. Родители должны стремиться помочь своим детям развиваться и раскрывать свой потенциал, а не сбрасывать все на «зависимость» от помощи взрослых.
ДЦП нельзя предотвратить? Разберемся в мифах
Детский церебральный паралич (ДЦП) — это диагноз, который родители боятся больше всего. Вероятно, вы слышали множество мифов о том, что ДЦП нельзя предотвратить и защитить своего ребенка от этого. Но на самом деле, это не так.
Миф 1: ДЦП возникает только из-за травмы во время родов
Факт: На самом деле, ДЦП может быть вызван различными факторами, включая генетические нарушения, инфекции матери во время беременности, врожденные дефекты, преждевременное рождение и другие проблемы, связанные со здоровьем ребенка. То есть, скорее всего, вы не сможете предотвратить ДЦП, но можете уменьшить риски, связанные со здоровьем вашего ребенка.
Миф 2: ДЦП не имеет лечения
Факт: Хоть ДЦП и является хронической болезнью, лечение может эффективно уменьшить симптомы и повысить качество жизни ребенка. Ранняя интервенция, специализированные программы физической терапии и речевой терапии могут помочь детям с ДЦП развиваться и достигать своих потенциалов.
Миф 3: Ничто не может защитить моего ребенка от ДЦП
Факт: Хоть никто не может гарантировать защиту от ДЦП, есть много мер, которые можно предпринять, чтобы уменьшить риски. Это включает в себя заботу о здоровье матери во время беременности (посещение врача, правильное питание и др.), а также меры предосторожности при родах (например, своевременное обращение в родовой дом и правильное выполнение всех рекомендаций врачей).
-
- Заботьтесь о здоровье матери во время беременности
- Следуйте всем мерам предосторожности при родах
- Остановитесь на ранней интервенции и специализированных программах физической терапии и речевой терапии
ДЦП или детский церебральный паралич хотя и развивается в раннем детстве, но этим возрастом не ограничивается. Это один из первых мифов, который мы хотим развенчать – миф о «детской» болезни. С таким заболеванием живут и взрослые – и сталкиваются с еще большим количеством предубеждений, чем дети.
В России диагноз ДЦП есть у 0,28% детей, то есть почти у трех из тысячи. Это немало: например, в каждой средней школе Москвы могут учиться три таких ребёнка. Но такого не происходит, и часто не по вине болезни. Дети и взрослые с ДЦП достойны понимания их особенностей, так что начнем разрушать заблуждения и расскажем правду.
ДЦП – следствие врачебных ошибок

Чаще всего приходится слышать, что в развитии детского церебрального паралича виноваты врачи, допустившие родовую травму. Однако родовая травма (причиной могут быть врачебные ошибки, но чаще всего она возникает вследствие самопроизвольных некупируемых осложнений, где медицина бессильна) — только одна из спектра причин ДЦП, и далеко не самая основная.
Церебральный паралич развивается из-за повреждения ЦНС, центральной нервной системы на ранних этапах развития – внутриутробных или в первые месяцы после рождения ребёнка. В повреждении могут быть повинны разнообразные факторы:
- Генетические нарушения;
- Черепно-мозговая травма;
- Метаболические патологии, в частности ядерная желтуха новорожденного;
- Инфекционные заболевания во время беременности у матери или у новорожденного.
Но самый распространенная причина ДЦП – недоношенность (International Journal of Nutrition, Pharmacology, Neurological Diseases). Есть явная связь между сроком преждевременных родов, массой ребёнка при рождении и риском развития ДЦП. В особенности часто страдают дети, появившиеся на свет до 28 недель гестации с массой менее 1 500 г.
Важно!
Профилактикой развития ДЦП у недоношенного ребёнка занимаются перинатальные центры и роддомы с отделениями реанимации для недоношенных. Риск церебрального паралича возрастает, если ребёнка транспортируют из роддома в специальную клинику.
По данным Минздрава, количество выживших недоношенных детей в РФ на сегодня – более 98%, и перинатальные центры играют огромную роль в предотвращении ДЦП у таких малышей.
В отделениях реанимации применяют методы профилактики, основанные на доказательной медицине, и они приводят к успеху. Так в последние годы в Австралии удалось снизить количество ДЦП до 0,15% (Current Neurology and Neuroscience Reports).
ДЦП может пройти сам или ухудшиться
Церебральный паралич – состояние пожизненное. Чаще всего он сопровождается повышенным тонусом мышц, но может быть и наоборот, когда мышечный тонус ослаблен. ДЦП может дополняться нарушением координации или непроизвольными, неконтролируемыми движениями.
Все это не прогрессирует, но и не проходит самостоятельно. Программы симптоматической терапии, реабилитации и адаптации помогают уменьшить контрактуру мышечных тканей, обучить тело новым паттернам движения – но не излечить.
ДЦП – это «временная трудность» и его можно вылечить

Вышедший в 2018 году фильм «Временные трудности» – яркая иллюстрация этого предубеждения. В нем страдающего ДЦП ребёнка отец заставляет вести себя, как здорового, и для «полного излечения» оставляет выживать в лесу. Мальчик справляется – и это оказывается основным посылом фильма: надо не жалеть ребёнка, проявляя жестокость и насилие, и болезнь отступит.
Факт!
В основе фильма – история Александра Цукера. Однако там множество вымыслов, и основной: у самого Александра ДЦП был в нетяжелой форме, практически незаметной окружающим. Он действительно адаптировался и стал бизнес-тренером, как герой «Временных трудностей». Однако другой ценой – и с другими условиями.
Сам Александр после выхода фильма сказал, что картина – это вымысел, которые не имеет никакого отношения к его реальной истории. Кроме того, она насаждает ценности и отношения, противоречащие его личной позиции и ценностям его родных. Фильм не должен быть руководством к воспитанию и реабилитации детей с ДЦП.
Детский церебральный паралич неизлечим. Существуют способы реабилитации, которые облегчают жизнь человеку. Однако важно выбирать не те, что обещают успех, а те, которые основаны на научно доказанных результатах и не калечат ребёнка физически или психически, а действительно помогают, и делают это бережно.
Систематический обзор таких методов за 2019 год опубликован в журнале Current Neurology and Neuroscience Reports. На русском языке его можно прочитать на странице благотворительного фонда «Обнаженные сердца».
Единственная известная на сегодня методика специфического лечения ДЦП с компенсацией дефицитов – генетико-ферментозаместительная терапия, когда ребёнку вводят участок гена, активизирующий синтез дефицитного белка. Это лечение подходит не всем и на данный момент в России методика не зарегистрирована. Но есть надежда, что в ближайшие годы эти разработки станут более точными, всеобъёмлющими, распространенными и не такими дорогими.
Еще раз: ДЦП – это не «временные трудности», не лень, не особенность, с которой можно справиться жестокими усилиями, через боль и насилие над ребёнком.
Церебральный паралич означает неумение общаться
Так как при церебральном параличе часто страдают артикуляционные мышцы, то речь может быть невнятной и сложно распознаваемой окружающими. Однако это не означает неспособность к общению.
Вербальная речь – не единственный способ коммуницировать. Ребёнок с ДЦП может общаться при помощи коммуникативных досок, карточек, специальных компьютерных программ – от ввода текстовых сообщений до таких, которые трансформируют тексты, картинки в голосовые.
ДЦП означает умственную отсталость

Нарушения интеллектуального развития отмечаются примерно в половине случаев – однако фактически их меньше (исследование в Developmental Medicine & Child Neurology). Проблема еще и в диагностических методиках оценки интеллекта, так как ребёнок с проблемной речью и движениями не сможет выражать себя так же, как типичный сверстник.
Внедрение доступных образовательных программ, применение оборудования, в котором ребёнок может находиться в подходящей для него позе, сопровождение тьюторов и подготовка помещений позволяет детям с ДЦП посещать общеобразовательные школы, развиваться и реализовывать свои способности. Это непросто – но в большинстве случаев не из-за особенностей детей с ДЦП, а из-за отсутствия доступной среды.
Факт!
Можно по-разному относиться к истории с директором хосписа «Дом с маяком» Лидией Мониавой и ее воспитанником Колей, но их ситуация подчеркивает необходимость улучшения программ инклюзии для детей с ДЦП и отношения к ним в обществе.
Все люди с ДЦП не могут ходить или ходят с трудом
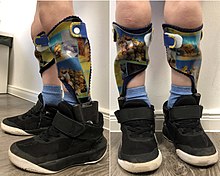
Крупная и мелкая моторика действительно часто страдает при церебральном параличе. Однако не обязательно приводит к невозможности передвигаться – или сидеть дома взаперти. Многие способны ходить самостоятельно или с приспособлениями – ходунками, ортезами, креслами, а также благодаря реабилитационным программам.
Развитием двигательных навыков занимаются родители с помощью специалистов – врачей, инструкторов ЛФК, реабилитологов, специальных педагогов, ортопедов. В РФ в последнее десятилетие развиваются вспомогательные направления физической терапии и эрготерапии.
Основная сложность – не способность к передвижению, а отсутствие или недостаточность доступной среды, от которой страдают не только дети и взрослые с ДЦП, но и мамы с маленькими детьми в колясках, инвалиды и временно нездоровые люди – например, после переломов. Эта проблема может коснуться каждого.
Дети с ДЦП не будут полноценными членами общества
Многие дети с таким диагнозом при оказании помощи – личной или современных технологий – могут передвигаться, учиться, общаться с друзьями, а впоследствии работать.
Есть известные спортсмены с ДЦП, в том числе и российские. Среди наиболее ярких сценических звезд последних лет – Ар-Джей Митт из сериала «Во все тяжкие», Кристи Браун, романист и художник, по роману которого снят фильм «Моя левая нога», получивший два «Оскара».
Иван Бакаидов, один из известнейших россиян с ДЦП, работает программистом. По данным Forbes он в топ-30 среди самых перспективных молодых россиян, создатель специальной программы коммуникаций для людей с церебральным параличом LINKa.
Люди с ДЦП не могут иметь здоровых детей
Эксперты утверждают, что этот диагноз не означает повышенный риск во время вынашивания. Кроме того, он редко передается по наследству ребёнку (вероятность 1,17%). Семейные случаи с рождением двух и более детей с таким диагнозом – редчайшие отклонения: в публикации Developmental Medicine & Child Neurology описано менее 10 семей во всем мире.
Примерно 2% случаев могут (риск 1 к 4) наследоваться по аутосомно-рецессивному типу. Это означает, что болезнь проявится в третьем поколении, и только в том случае, если затем ребёнок создаст семью с носителем такого же гена, что встречается крайне редко (Online Mendelian Inheritance in Man).
Генетические нарушения, которые среди прочих факторов могут стать причиной ДЦП, в основном новые. Вероятность структурных изменений в ДНК плода зависит от множества факторов. Одним из важнейших считают возраст матери и отца при зачатии. И такие новые нарушения, которые встречаются при ДЦП, не наследуются.
The genetic basis of cerebral palsy. / Fahey MC, Maclennan AH, Kretzschmar D, et al. // Dev Med Child Neurol – 2017 May – 59(5)
De novo and rare inherited copy-number variations in the hemiplegic form of cerebral palsy. / Zarrei M, Fehlings DL, Mawjee K, et al. // Genet Med – 2018 Feb – 20(2)
A Systematic Review on Etiology, Epidemiology, and Treatment of Cerebral Palsy / Rana Mahendra, Upadhyay Jyoti, Rana Amita, et al. // International Journal of Nutrition, Pharmacology, Neurological Diseases (IJNPND) – 2017 – Volume 7
Intellectual disability in cerebral palsy: a population-based retrospective study. / Reid SM, Meehan EM, Arnup SJ, et al. // Dev Med Child Neurol. – 2018 Jul – 60(7)
State of the Evidence Traffic Lights 2019: Systematic Review of Interventions for Preventing and Treating Children with Cerebral Palsy / Iona Novak, Catherine Morgan, Michael Fahey, et al. // Current Neurology and Neuroscience Reports – 2020 – 20: 3
| Cerebral palsy | |
|---|---|
 |
|
| A child with cerebral palsy being assessed by a physician | |
| Specialty |
|
| Symptoms |
|
| Complications |
|
| Usual onset | Prenatal to early childhood[1] |
| Duration | Lifelong[1] |
| Causes | Often unknown[1] or brain injury |
| Risk factors |
|
| Diagnostic method | Based on child’s development[1] |
| Treatment |
|
| Medication |
|
| Frequency | 2.1 per 1,000[2] |
Cerebral palsy (CP) is a group of movement disorders that appear in early childhood.[1] Signs and symptoms vary among people and over time,[1][3] but include poor coordination, stiff muscles, weak muscles, and tremors.[1] There may be problems with sensation, vision, hearing, and speaking.[1] Often, babies with cerebral palsy do not roll over, sit, crawl or walk as early as other children of their age.[1] Other symptoms include seizures and problems with thinking or reasoning, each of which occur in about one-third of people with CP.[1] While symptoms may get more noticeable over the first few years of life, underlying problems do not worsen over time.[1]
Cerebral palsy is caused by abnormal development or damage to the parts of the brain that control movement, balance, and posture.[1][4] Most often, the problems occur during pregnancy, but they may also occur during childbirth or shortly after birth.[1] Often, the cause is unknown.[1] Risk factors include preterm birth, being a twin, certain infections during pregnancy, such as toxoplasmosis or rubella, exposure to methylmercury during pregnancy, a difficult delivery, and head trauma during the first few years of life, among others.[1] About 2% of cases are believed to be due to an inherited genetic cause.[5] A number of sub-types are classified, based on the specific problems present.[1] For example, those with stiff muscles have spastic cerebral palsy, those with poor coordination in locomotion have ataxic cerebral palsy, and those with writhing movements have dyskinetic cerebral palsy.[6] Diagnosis is based on the child’s development over time.[1] Blood tests and medical imaging may be used to rule out other possible causes.[1]
Some of the causes of CP are preventable through immunization of the mother, and through efforts to prevent head injuries in children such as through improved safety.[1] There is no known cure for CP, but supportive treatments, medication and surgery may help many individuals.[1] This may include physical therapy, occupational therapy and speech therapy.[1] Medications such as diazepam, baclofen and botulinum toxin may help relax stiff muscles.[1][7][8] Surgery may include lengthening muscles and cutting overly active nerves.[1] Often, external braces and Lycra splints and other assistive technology are helpful with mobility.[9][1] Some affected children can achieve near normal adult lives with appropriate treatment.[1] While alternative medicines are frequently used, there is no evidence to support their use.[1]
Cerebral palsy is the most common movement disorder in children.[10] It occurs in about 2.1 per 1,000 live births.[2] Cerebral palsy has been documented throughout history, with the first known descriptions occurring in the work of Hippocrates in the 5th century BCE.[11] Extensive study of the condition began in the 19th century by William John Little, after whom spastic diplegia was called «Little’s disease».[11] William Osler first named it «cerebral palsy» from the German zerebrale Kinderlähmung (cerebral child-paralysis).[12] A number of potential treatments are being examined, including stem cell therapy.[1] However, more research is required to determine if it is effective and safe.[1]
Signs and symptoms[edit]
Cerebral palsy is defined as «a group of permanent disorders of the development of movement and posture, causing activity limitation, that are attributed to non-progressive disturbances that occurred in the developing fetal or infant brain.»[13] While movement problems are the central feature of CP, difficulties with thinking, learning, feeling, communication and behavior often co-occur,[13] with 28% having epilepsy, 58% having difficulties with communication, at least 42% having problems with their vision, and 23–56% having learning disabilities.[14] Muscle contractions in people with cerebral palsy are commonly thought to arise from overactivation.[15]
Cerebral palsy is characterized by abnormal muscle tone, reflexes, or motor development and coordination. The neurological lesion is primary and permanent while orthopedic manifestations are secondary and progressive. In cerebral palsy unequal growth between muscle-tendon units and bone eventually leads to bone and joint deformities. At first, deformities are dynamic. Over time, deformities tend to become static, and joint contractures develop. Deformities in general and static deformities in specific (joint contractures) cause increasing gait difficulties in the form of tip-toeing gait, due to tightness of the Achilles tendon, and scissoring gait, due to tightness of the hip adductors. These gait patterns are among the most common gait abnormalities in children with cerebral palsy. However, orthopaedic manifestations of cerebral palsy are diverse.[16][17] Additionally, crouch gait (also described as knee flexion gait)[18] is prevalent among children who possess the ability to walk.[19] The effects of cerebral palsy fall on a continuum of motor dysfunction, which may range from slight clumsiness at the mild end of the spectrum to impairments so severe that they render coordinated movement virtually impossible at the other end of the spectrum.[20] Although most people with CP have problems with increased muscle tone, some have normal or low muscle tone. High muscle tone can either be due to spasticity or dystonia.[21]
Babies born with severe cerebral palsy often have irregular posture; their bodies may be either very floppy or very stiff. Birth defects, such as spinal curvature, a small jawbone, or a small head sometimes occur along with CP. Symptoms may appear or change as a child gets older. Babies born with cerebral palsy do not immediately present with symptoms.[22] Classically, CP becomes evident when the baby reaches the developmental stage at 6 to 9 months and is starting to mobilise, where preferential use of limbs, asymmetry, or gross motor developmental delay is seen.[17]
Drooling is common among children with cerebral palsy, which can have a variety of impacts including social rejection, impaired speaking, damage to clothing and books, and mouth infections.[23] It can additionally cause choking.[24]
An average of 55.5% of people with cerebral palsy experience lower urinary tract symptoms, more commonly excessive storage issues than voiding issues. Those with voiding issues and pelvic floor overactivity can deteriorate as adults and experience upper urinary tract dysfunction.[25]
Children with CP may also have sensory processing issues.[26] Adults with cerebral palsy have a higher risk of respiratory failure.[27]
Skeleton[edit]
For bones to attain their normal shape and size, they require the stresses from normal musculature.[28] People with cerebral palsy are at risk of low bone mineral density.[29] The shafts of the bones are often thin (gracile),[28] and become thinner during growth. When compared to these thin shafts (diaphyses), the centres (metaphyses) often appear quite enlarged (ballooning).[30] Due to more than normal joint compression caused by muscular imbalances, articular cartilage may atrophy,[31]: 46 leading to narrowed joint spaces. Depending on the degree of spasticity, a person with CP may exhibit a variety of angular joint deformities. Because vertebral bodies need vertical gravitational loading forces to develop properly, spasticity and an abnormal gait can hinder proper or full bone and skeletal development. People with CP tend to be shorter in height than the average person because their bones are not allowed to grow to their full potential. Sometimes bones grow to different lengths, so the person may have one leg longer than the other.[32]
Children with CP are prone to low trauma fractures, particularly children with higher Gross Motor Function Classification System (GMFCS) levels who cannot walk. This further affects a child’s mobility, strength, and experience of pain, and can lead to missed schooling or child abuse suspicions.[28] These children generally have fractures in the legs, whereas non-affected children mostly fracture their arms in the context of sporting activities.[33]
Hip dislocation and ankle equinus or plantar flexion deformity are the two most common deformities among children with cerebral palsy. Additionally, flexion deformity of the hip and knee can occur. Torsional deformities of long bones such as the femur and tibia are also encountered, among others.[16][34] Children may develop scoliosis before the age of 10 – estimated prevalence of scoliosis in children with CP is between 21% and 64%.[35] Higher levels of impairment on the GMFCS are associated with scoliosis and hip dislocation.[16][36] Scoliosis can be corrected with surgery, but CP makes surgical complications more likely, even with improved techniques.[35] Hip migration can be managed by soft tissue procedures such as adductor musculature release. Advanced degrees of hip migration or dislocation can be managed by more extensive procedures such as femoral and pelvic corrective osteotomies. Both soft tissue and bony procedures aim at prevention of hip dislocation in the early phases or aim at hip containment and restoration of anatomy in the late phases of disease.[16] Equinus deformity is managed by conservative methods especially when dynamic. If fixed/static deformity ensues surgery may become mandatory.[34]
Growth spurts during puberty can make walking more difficult for people with CP.[37]
Eating[edit]
Due to sensory and motor impairments, those with CP may have difficulty preparing food, holding utensils, or chewing and swallowing. An infant with CP may not be able to suck, swallow or chew.[38] Gastro-oesophageal reflux is common in children with CP.[24] Children with CP may have too little or too much sensitivity around and in the mouth.[38] Poor balance when sitting, lack of control of the head, mouth, and trunk, not being able to bend the hips enough to allow the arms to stretch forward to reach and grasp food or utensils, and lack of hand-eye coordination can make self-feeding difficult.[39] Feeding difficulties are related to higher GMFCS levels.[24] Dental problems can also contribute to difficulties with eating.[39] Pneumonia is also common where eating difficulties exist, caused by undetected aspiration of food or liquids.[24] Fine finger dexterity, like that needed for picking up a utensil, is more frequently impaired than gross manual dexterity, like that needed for spooning food onto a plate.[40][non-primary source needed] Grip strength impairments are less common.[40][non-primary source needed]
Children with severe cerebral palsy, particularly with oropharyngeal issues, are at risk of undernutrition.[41] Triceps skin fold tests have been found to be a very reliable indicator of malnutrition in children with cerebral palsy.[39]
Language[edit]
Speech and language disorders are common in people with cerebral palsy. The incidence of dysarthria is estimated to range from 31% to 88%,[42] and around a quarter of people with CP are non-verbal.[43] Speech problems are associated with poor respiratory control, laryngeal and velopharyngeal dysfunction, and oral articulation disorders that are due to restricted movement in the oral-facial muscles. There are three major types of dysarthria in cerebral palsy: spastic, dyskinetic (athetotic), and ataxic.[44]
Early use of augmentative and alternative communication systems may assist the child in developing spoken language skills.[43] Overall language delay is associated with problems of cognition, deafness, and learned helplessness.[45] Children with cerebral palsy are at risk of learned helplessness and becoming passive communicators, initiating little communication.[45][46] Early intervention with this clientele, and their parents, often targets situations in which children communicate with others so that they learn that they can control people and objects in their environment through this communication, including making choices, decisions, and mistakes.[45]
Pain and sleep[edit]
Pain is common and may result from the inherent deficits associated with the condition, along with the numerous procedures children typically face.[47] When children with cerebral palsy are in pain, they experience worse muscle spasms.[48] Pain is associated with tight or shortened muscles, abnormal posture, stiff joints, unsuitable orthosis, etc. Hip migration or dislocation is a recognizable source of pain in CP children and especially in the adolescent population. Nevertheless, the adequate scoring and scaling of pain in CP children remains challenging.[16] Pain in CP has a number of different causes, and different pains respond to different treatments.[49]
There is also a high likelihood of chronic sleep disorders secondary to both physical and environmental factors.[50] Children with cerebral palsy have significantly higher rates of sleep disturbance than typically developing children.[51] Babies with cerebral palsy who have stiffness issues might cry more and be harder to put to sleep than non-disabled babies, or «floppy» babies might be lethargic.[52] Chronic pain is under-recognized in children with cerebral palsy,[53] even though three out of four children with cerebral palsy experience pain.[54] Adults with CP also experience more pain than the general population.[55]
Associated disorders[edit]
Associated disorders include intellectual disabilities, seizures, muscle contractures, abnormal gait, osteoporosis, communication disorders, malnutrition, sleep disorders, and mental health disorders, such as depression and anxiety.[56] In addition to these, functional gastrointestinal abnormalities contributing to bowel obstruction, vomiting, and constipation may also arise. Adults with cerebral palsy may have ischemic heart disease, cerebrovascular disease, cancer, and trauma more often.[57] Obesity in people with cerebral palsy or a more severe Gross Motor Function Classification System assessment in particular are considered risk factors for multimorbidity.[58] Other medical issues can be mistaken for being symptoms of cerebral palsy, and so may not be treated correctly.[59]
Related conditions can include apraxia, sensory impairments, urinary incontinence, fecal incontinence, or behavioural disorders.[citation needed]
Seizure management is more difficult in people with CP as seizures often last longer.[60] Epilepsy and asthma are common co-occurring diseases in adults with CP.[61] The associated disorders that co-occur with cerebral palsy may be more disabling than the motor function problems.[24]
Causes[edit]
Cerebral palsy is due to abnormal development or damage occurring to the developing brain.[62] This damage can occur during pregnancy, delivery, the first month of life, or less commonly in early childhood.[62] Structural problems in the brain are seen in 80% of cases, most commonly within the white matter.[62]
More than three-quarters of cases are believed to result from issues that occur during pregnancy.[62] Most children who are born with cerebral palsy have more than one risk factor associated with CP.[63] Cerebral palsy is not contagious. In no way can you contract it as an adult. CP is almost always developed en utero, or prior to birth.
While in certain cases there is no identifiable cause, typical causes include problems in intrauterine development (e.g. exposure to radiation, infection, fetal growth restriction), hypoxia of the brain (thrombotic events, placental insufficiency, umbilical cord prolapse), birth trauma during labor and delivery, and complications around birth or during childhood.[45][64][65]
In Africa birth asphyxia, high bilirubin levels, and infections in newborns of the central nervous system are main cause. Many cases of CP in Africa could be prevented with better resources available.[66]
Preterm birth[edit]
Between 40% and 50% of all children who develop cerebral palsy were born prematurely.[67] Most of these cases (75–90%) are believed to be due to issues that occur around the time of birth, often just after birth.[62] Multiple-birth infants are also more likely than single-birth infants to have CP.[68] They are also more likely to be born with a low birth weight.[citation needed]
In those who are born with a weight between 1 kg (2.2 lbs) and 1.5 kg (3.3 lbs) CP occurs in 6%.[2] Among those born before 28 weeks of gestation it occurs in 8%.[69][a] Genetic factors are believed to play an important role in prematurity and cerebral palsy generally.[70] In those who are born between 34 and 37 weeks the risk is 0.4% (three times normal).[71]
Term infants[edit]
In babies who are born at term risk factors include problems with the placenta, birth defects, low birth weight, breathing meconium into the lungs, a delivery requiring either the use of instruments or an emergency Caesarean section, birth asphyxia, seizures just after birth, respiratory distress syndrome, low blood sugar, and infections in the baby.[72]
As of 2013, it was unclear how much of a role birth asphyxia plays as a cause.[73] It is unclear if the size of the placenta plays a role.[74] As of 2015 it is evident that in advanced countries, most cases of cerebral palsy in term or near-term neonates have explanations other than asphyxia.[65]
Genetics[edit]
Cerebral palsy is not commonly considered a genetic disease. About 2% of all CP cases are expected to be inherited, with glutamate decarboxylase-1 being one of the possible enzymes involved.[5] Most inherited cases are autosomal recessive.[5] However, the vast majority of CP cases are connected to brain damage during birth and in infancy. There is a small percentage of CP cases caused by brain damage that stemmed from the prenatal period, which is estimated to be less than 5% of CP cases overall.[75] Moreover, there is no one reason why some CP cases come from prenatal brain damage, and it is not known if those cases have a genetic basis.[75]
Cerebellar hypoplasia is sometimes genetic[76] and can cause ataxic cerebral palsy.[77]
Early childhood[edit]
After birth, other causes include toxins, severe jaundice,[78] lead poisoning, physical brain injury, stroke,[79] abusive head trauma, incidents involving hypoxia to the brain (such as near drowning), and encephalitis or meningitis.[78]
Others[edit]
Infections in the mother, even those not easily detected, can triple the risk of the child developing cerebral palsy.[80] Infection of the fetal membranes known as chorioamnionitis increases the risk.[81]
Intrauterine and neonatal insults (many of which are infectious) increase the risk.[82]
Rh blood type incompatibility can cause the mother’s immune system to attack the baby’s red blood cells.[1]
It has been hypothesised that some cases of cerebral palsy are caused by the death in very early pregnancy of an identical twin.[83]
Diagnosis[edit]
The diagnosis of cerebral palsy has historically rested on the person’s history and physical examination and is generally assessed at a young age. A general movements assessment, which involves measuring movements that occur spontaneously among those less than four months of age, appears most accurate.[84][85] Children who are more severely affected are more likely to be noticed and diagnosed earlier. Abnormal muscle tone, delayed motor development and persistence of primitive reflexes are the main early symptoms of CP.[39] Symptoms and diagnosis typically occur by the age of two,[86] although depending on factors like malformations and congenital issues,[87] persons with milder forms of cerebral palsy may be over the age of five, if not in adulthood, when finally diagnosed.[88] Cognitive assessments and medical observations are also useful to help confirm a diagnosis. Additionally, evaluations of the child’s mobility, speech and language, hearing, vision, gait, feeding and digestion are also useful to determine the extent of the disorder.[87] Early diagnosis and intervention are seen as being a key part of managing cerebral palsy.[89] Machine learning algorithms facilitate automatic early diagnosis, with methods such as deep neural network[90] and geometric feature fusion[91] producing high accuracy in predicting cerebral palsy from short videos. It is a developmental disability.[84]
Once a person is diagnosed with cerebral palsy, further diagnostic tests are optional. Neuroimaging with CT or MRI is warranted when the cause of a person’s cerebral palsy has not been established. An MRI is preferred over CT, due to diagnostic yield and safety. When abnormal, evidence from neuroimaging may suggest the timing of the initial damage. The CT or MRI is also capable of revealing treatable conditions, such as hydrocephalus, porencephaly, arteriovenous malformation, subdural hematomas and hygromas, and a vermian tumour[92] (which a few studies suggest are present 5–22% of the time). Furthermore, abnormalities detected by neuroimaging may indicate a high likelihood of associated conditions, such as epilepsy and intellectual disability.[93] There is a small risk associated with sedating children to facilitate a clear MRI.[88]
The age when CP is diagnosed is important, but medical professionals disagree over the best age to make the diagnosis.[85] The earlier CP is diagnosed correctly, the better the opportunities are to provide the child with physical and educational help, but there might be a greater chance of confusing CP with another problem, especially if the child is 18 months of age or younger.[85] Infants may have temporary problems with muscle tone or control that can be confused with CP, which is permanent.[85] A metabolism disorder or tumors in the nervous system may appear to be CP; metabolic disorders, in particular, can produce brain problems that look like CP on an MRI.[1] Disorders that deteriorate the white matter in the brain and problems that cause spasms and weakness in the legs, may be mistaken for CP if they first appear early in life.[85] However, these disorders get worse over time, and CP does not[85] (although it may change in character).[1] In infancy it may not be possible to tell the difference between them.[85] In the UK, not being able to sit independently by the age of 8 months is regarded as a clinical sign for further monitoring.[88] Fragile X syndrome (a cause of autism and intellectual disability) and general intellectual disability must also be ruled out.[85] Cerebral palsy specialist John McLaughlin recommends waiting until the child is 36 months of age before making a diagnosis because, by that age, motor capacity is easier to assess.[85]
Classification[edit]
CP is classified by the types of motor impairment of the limbs or organs, and by restrictions to the activities an affected person may perform.[94] The Gross Motor Function Classification System-Expanded and Revised and the Manual Ability Classification System are used to describe mobility and manual dexterity in people with cerebral palsy, and recently the Communication Function Classification System, and the Eating and Drinking Ability Classification System have been proposed to describe those functions.[95] There are three main CP classifications by motor impairment: spastic, ataxic, and dyskinetic. Additionally, there is a mixed type that shows a combination of features of the other types. These classifications reflect the areas of the brain that are damaged.[96]
Cerebral palsy is also classified according to the topographic distribution of muscle spasticity.[97] This method classifies children as diplegic, (bilateral involvement with leg involvement greater than arm involvement), hemiplegic (unilateral involvement), or quadriplegic (bilateral involvement with arm involvement equal to or greater than leg involvement).[98][97]
Spastic[edit]
Spastic cerebral palsy is the type of cerebral palsy characterized by spasticity or high muscle tone often resulting in stiff, jerky movements.[99] Itself an umbrella term encompassing spastic hemiplegia, spastic diplegia, spastic quadriplegia and – where solely one limb or one specific area of the body is affected – spastic monoplegia. Spastic cerebral palsy affects the motor cortex[99] of the brain, a specific portion of the cerebral cortex responsible for the planning and completion of voluntary movement.[100] Spastic CP is the most common type of overall cerebral palsy, representing about 80% of cases.[101] Botulinum toxin is effective in decreasing spasticity.[7] It can help increase range of motion which could help mitigate CPs effects on the growing bones of children.[7] There may be an improvement in motor functions in the children and ability to walk. however, the main benefit derived from botulinum toxin A comes from its ability to reduce muscle tone and spasticity and thus prevent or delay the development of fixed muscle contractures.[7][102]
Ataxic[edit]
Ataxic cerebral palsy is observed in approximately 5–10% of all cases of cerebral palsy, making it the least frequent form of cerebral palsy.[103] Ataxic cerebral palsy is caused by damage to cerebellar structures.[104] Because of the damage to the cerebellum, which is essential for coordinating muscle movements and balance, patients with ataxic cerebral palsy experience problems in coordination, specifically in their arms, legs, and trunk. Ataxic cerebral palsy is known to decrease muscle tone.[105] The most common manifestation of ataxic cerebral palsy is intention (action) tremor, which is especially apparent when carrying out precise movements, such as tying shoe laces or writing with a pencil. This symptom gets progressively worse as the movement persists, making the hand shake. As the hand gets closer to accomplishing the intended task, the trembling intensifies, which makes it even more difficult to complete.[98]
Dyskinetic[edit]
Dyskinetic cerebral palsy (sometimes abbreviated DCP) is primarily associated with damage to the basal ganglia and the substantia nigra in the form of lesions that occur during brain development due to bilirubin encephalopathy and hypoxic-ischemic brain injury.[106] DCP is characterized by both hypertonia and hypotonia, due to the affected individual’s inability to control muscle tone.[98] Clinical diagnosis of DCP typically occurs within 18 months of birth and is primarily based upon motor function and neuroimaging techniques.[107][108]
Dyskinetic cerebral palsy is an extrapyramidal form of cerebral palsy.[109] Dyskinetic cerebral palsy can be divided into two different groups; choreoathetosis and dystonia.[98] Choreo-athetotic CP is characterized by involuntary movements, whereas dystonic CP is characterized by slow, strong contractions, which may occur locally or encompass the whole body.[97]
Mixed[edit]
Mixed cerebral palsy has symptoms of dyskinetic, ataxic and spastic CP appearing simultaneously, each to varying degrees, and both with and without symptoms of each. Mixed CP is the most difficult to treat as it is extremely heterogeneous and sometimes unpredictable in its symptoms and development over the lifespan.[citation needed]
Gait Classification[edit]
In patients with spastic hemiplegia or diplegia, various gait patterns can be observed, the exact form of which can only be described with the help of complex gait analysis systems. In order to facilitate interdisciplinary communication in the interdisciplinary team between those affected, doctors, physiotherapists and orthotists, a simple description of the gait pattern is useful. J. Rodda and H. K. Graham already described in 2001 how gait patterns of CP patients can be more easily recognized and defined gait types which they compared in a classification. They also described that gait patterns can vary with age.[110] Building on this, the Amsterdam Gait Classification was developed at the free university in Amsterdam, the VU medisch centrum. A special feature of this classification is that it makes different gait patterns very easy to recognize and can be used in CP patients in whom only one leg and both legs are affected. According to the Amsterdam Gait Classification, five gait types are described. To assess the gait pattern, the patient is viewed visually or via a video recording from the side of the leg to be assessed. At the point in time at which the leg to be viewed is in mid stance and the leg not to be viewed is in mid swing, the knee angle and the contact of the foot with the ground are assessed on the one hand.[111]
Classification of the gait pattern according to the Amsterdam Gait Classification: In gait type 1, the knee angle is normal and the foot contact is complete. In gait type 2, the knee angle is hyperextended and the foot contact is complete. In gait type 3, the knee angle is hyperextended and foot contact is incomplete (only on the forefoot). In gait type 4, the knee angle is bent and foot contact is incomplete (only on the forefoot). With gait type 5, the knee angle is bent and the foot contact is complete.[111]
Gait types 5 is also known as crouch gait.[112]
Prevention[edit]
Because the causes of CP are varied, a broad range of preventive interventions have been investigated.[113]
Electronic fetal monitoring has not helped to prevent CP, and in 2014 the American College of Obstetricians and Gynecologists, the Royal Australian and New Zealand College of Obstetricians and Gynaecologists, and the Society of Obstetricians and Gynaecologists of Canada have acknowledged that there are no long-term benefits of electronic fetal monitoring.[65] Before this, electronic fetal monitoring was widely used to prop up obstetric litigation.[114]
In those at risk of an early delivery, magnesium sulphate appears to decrease the risk of cerebral palsy.[115] It is unclear if it helps those who are born at term.[116] In those at high risk of preterm labor a review found that moderate to severe CP was reduced by the administration of magnesium sulphate, and that adverse effects on the babies from the magnesium sulphate were not significant. Mothers who received magnesium sulphate could experience side effects such as respiratory depression and nausea.[117] However, guidelines for the use of magnesium sulfate in mothers at risk of preterm labour are not strongly adhered to;[118] in 2017 only 2 in 3 eligible women in the UK received the medication despite it being recommended by NICE guidelines.[119] An NHS quality improvement programme increased its usage in England from 71% in 2018 to 83% in 2020.[120][121]
Caffeine is used to treat apnea of prematurity and reduces the risk of cerebral palsy in premature babies, but there are also concerns of long term negative effects.[122] A moderate quality level of evidence indicates that giving women antibiotics during preterm labor before her membranes have ruptured (water is not yet not broken) may increase the risk of cerebral palsy for the child.[123] Additionally, for preterm babies for whom there is a chance of fetal compromise, allowing the birth to proceed rather than trying to delay the birth may lead to an increased risk of cerebral palsy in the child.[123] Corticosteroids are sometimes taken by pregnant women expecting a preterm birth to provide neuroprotection to their baby.[124] Taking corticosteroids during pregnancy is shown to have no significant correlation with developing cerebral palsy in preterm births.[123]
Cooling high-risk full-term babies shortly after birth may reduce disability,[125] but this may only be useful for some forms of the brain damage that causes CP.[86]
Management[edit]
Over time, the approach to CP management has shifted away from narrow attempts to fix individual physical problems – such as spasticity in a particular limb – to making such treatments part of a larger goal of maximizing the person’s independence and community engagement.[126]: 886 However, the evidence base for the effectiveness of intervention programs reflecting the philosophy of independence has not yet caught up: effective interventions for body structures and functions have a strong evidence base, but evidence is lacking for effective interventions targeted toward participation, environment, or personal factors.[126] There is also no good evidence to show that an intervention that is effective at the body-specific level will result in an improvement at the activity level or vice versa.[126] Although such cross-over benefit might happen, not enough high-quality studies have been done to demonstrate it.[126]
Because cerebral palsy has «varying severity and complexity» across the lifespan,[95] it can be considered a collection of conditions for management purposes.[86] A multidisciplinary approach for cerebral palsy management is recommended,[95] focusing on «maximising individual function, choice and independence» in line with the International Classification of Functioning, Disability and Health’s goals.[88] The team may include a paediatrician, a health visitor, a social worker, a physiotherapist, an orthotist, a speech and language therapist, an occupational therapist, a teacher specialising in helping children with visual impairment, an educational psychologist, an orthopaedic surgeon, a neurologist and a neurosurgeon.[127]
Various forms of therapy are available to people living with cerebral palsy as well as caregivers and parents. Treatment may include one or more of the following: physical therapy; occupational therapy; speech therapy; water therapy; drugs to control seizures, alleviate pain, or relax muscle spasms (e.g. benzodiazepines); surgery to correct anatomical abnormalities or release tight muscles; braces and other orthotic devices; rolling walkers; and communication aids such as computers with attached voice synthesisers.[citation needed] Intensive rehabilitation is practiced in certain countries, but obtaining reliable data on its medium and long-term effectiveness is challenging.[128]
Surgical intervention in CP children may include various orthopaedic or neurological surgeries to improve quality of life, such as tendon releases, hip rotation, spinal fusion, (selective dorsal rhizotomy) or placement of an intrathecal baclofen pump.[19][126][129]
A Cochrane review published in 2004 found a trend toward the benefit of speech and language therapy for children with cerebral palsy but noted the need for high-quality research.[130] A 2013 systematic review found that many of the therapies used to treat CP have no good evidence base; the treatments with the best evidence are medications (anticonvulsants, botulinum toxin, bisphosphonates, diazepam), therapy (bimanual training, casting, constraint-induced movement therapy, context-focused therapy, fitness training, goal-directed training, hip surveillance, home programmes, occupational therapy after botulinum toxin, pressure care) and surgery. There is also research on whether the sleeping position might improve hip migration, but there are not yet high-quality evidence studies to support that theory.[131] Research papers also call for an agreed consensus on outcome measures which will allow researchers to cross-reference research. Also, the terminology used to describe orthoses[132] needs to be standardised to ensure studies can be reproduced and readily compared and evaluated.
Orthotics in the concept of therapy[edit]
To improve the gait pattern, orthotics can be included in the therapy concept. An orthosis can support physiotherapeutic treatment in setting the right motor impulses in order to create new cerebral connections.[133] The orthosis must meet the requirements of the medical prescription. In addition, the orthosis must be designed by the orthotist in such a way that it achieves the effectiveness of the necessary levers, matching the gait pattern, in order to support the proprioceptive approaches of physiotherapy. The characteristics of the stiffness of the orthosis shells and the adjustable dynamics in the ankle joint are important elements of the orthosis to be considered.[134] Due to these requirements, the development of orthoses has changed significantly in recent years, especially since around 2010. At about the same time, care concepts were developed that deal intensively with the orthotic treatment of the lower extremities in cerebral palsy.[135] Modern materials and new functional elements enable the rigidity to be specifically adapted to the requirements that fits to the gait pattern of the CP patient.[136] The adjustment of the stiffness has a decisive influence on the gait pattern and on the energy cost of walking.[137][138][139] It is of great advantage if the stiffness of the orthosis can be adjusted separately from one another via resistances of the two functional elements in the two directions of movement, dorsiflexion and plantar flexion.[140]
Prognosis[edit]
CP is not a progressive disorder (meaning the brain damage does not worsen), but the symptoms can become more severe over time. A person with the disorder may improve somewhat during childhood if he or she receives extensive care, but once bones and musculature become more established, orthopedic surgery may be required. People with CP can have varying degrees of cognitive impairment or none whatsoever. The full intellectual potential of a child born with CP is often not known until the child starts school. People with CP are more likely to have learning disorders but have normal intelligence. Intellectual level among people with CP varies from genius to intellectually disabled, as it does in the general population, and experts have stated that it is important not to underestimate the capabilities of a person with CP and to give them every opportunity to learn.[141]
The ability to live independently with CP varies widely, depending partly on the severity of each person’s impairment and partly on the capability of each person to self-manage the logistics of life. Some individuals with CP require personal assistant services for all activities of daily living. Others only need assistance with certain activities, and still others do not require any physical assistance. But regardless of the severity of a person’s physical impairment, a person’s ability to live independently often depends primarily on the person’s capacity to manage the physical realities of his or her life autonomously. In some cases, people with CP recruit, hire, and manage a staff of personal care assistants (PCAs). PCAs facilitate the independence of their employers by assisting them with their daily personal needs in a way that allows them to maintain control over their lives.[citation needed]
Puberty in young adults with cerebral palsy may be precocious or delayed. Delayed puberty is thought to be a consequence of nutritional deficiencies.[142] There is currently no evidence that CP affects fertility, although some of the secondary symptoms have been shown to affect sexual desire and performance.[143] Adults with CP were less likely to get routine reproductive health screening as of 2005. Gynecological examinations may have to be performed under anesthesia due to spasticity, and equipment is often not accessible. Breast self-examination may be difficult, so partners or carers may have to perform it. Men with CP have higher levels of cryptorchidism at the age of 21.[142]
CP can significantly reduce a person’s life expectancy, depending on the severity of their condition and the quality of care they receive.[62][144] 5–10% of children with CP die in childhood, particularly where seizures and intellectual disability also affect the child.[95] The ability to ambulate, roll, and self-feed has been associated with increased life expectancy.[145] While there is a lot of variation in how CP affects people, it has been found that «independent gross motor functional ability is a very strong determinant of life expectancy».[146] According to the Australian Bureau of Statistics, in 2014, 104 Australians died of cerebral palsy.[147] The most common causes of death in CP are related to respiratory causes, but in middle age cardiovascular issues and neoplastic disorders become more prominent.[148]
Self-care[edit]
For many children with CP, parents are heavily involved in self-care activities. Self-care activities, such as bathing, dressing, and grooming, can be difficult for children with CP, as self-care depends primarily on the use of the upper limbs.[149] For those living with CP, impaired upper limb function affects almost 50% of children and is considered the main factor contributing to decreased activity and participation.[150] As the hands are used for many self-care tasks, sensory and motor impairments of the hands make daily self-care more difficult.[40][non-primary source needed][151] Motor impairments cause more problems than sensory impairments.[40] The most common impairment is that of finger dexterity, which is the ability to manipulate small objects with the fingers.[40] Compared to other disabilities, people with cerebral palsy generally need more help in performing daily tasks.[152] Occupational therapists are healthcare professionals that help individuals with disabilities gain or regain their independence through the use of meaningful activities.[153]
Productivity[edit]
The effects of sensory, motor, and cognitive impairments affect self-care occupations in children with CP and productivity occupations. Productivity can include but is not limited to, school, work, household chores, or contributing to the community.[154]
Play is included as a productive occupation as it is often the primary activity for children.[155] If play becomes difficult due to a disability, like CP, this can cause problems for the child.[156] These difficulties can affect a child’s self-esteem.[156] In addition, the sensory and motor problems experienced by children with CP affect how the child interacts with their surroundings, including the environment and other people.[156] Not only do physical limitations affect a child’s ability to play, the limitations perceived by the child’s caregivers and playmates also affect the child’s play activities.[157] Some children with disabilities spend more time playing by themselves.[158] When a disability prevents a child from playing, there may be social, emotional and psychological problems,[159] which can lead to increased dependence on others, less motivation, and poor social skills.[160]
In school, students are asked to complete many tasks and activities, many of which involve handwriting. Many children with CP have the capacity to learn and write in the school environment.[161] However, students with CP may find it difficult to keep up with the handwriting demands of school and their writing may be difficult to read.[161] In addition, writing may take longer and require greater effort on the student’s part.[161] Factors linked to handwriting include postural stability, sensory and perceptual abilities of the hand, and writing tool pressure.[161]
Speech impairments may be seen in children with CP depending on the severity of brain damage.[162] Communication in a school setting is important because communicating with peers and teachers is very much a part of the «school experience» and enhances social interaction. Problems with language or motor dysfunction can lead to underestimating a student’s intelligence.[163] In summary, children with CP may experience difficulties in school, such as difficulty with handwriting, carrying out school activities, communicating verbally, and interacting socially.[citation needed]
Leisure[edit]
Leisure activities can have several positive effects on physical health, mental health, life satisfaction, and psychological growth for people with physical disabilities like CP.[164] Common benefits identified are stress reduction, development of coping skills, companionship, enjoyment, relaxation and a positive effect on life satisfaction.[165] In addition, for children with CP, leisure appears to enhance adjustment to living with a disability.[165]
Leisure can be divided into structured (formal) and unstructured (informal) activities.[166] Children and teens with CP engage in less habitual physical activity than their peers.[167] Children with CP primarily engage in physical activity through therapies aimed at managing their CP, or through organized sport for people with disabilities.[168] It is difficult to sustain behavioural change in terms of increasing physical activity of children with CP.[169] Gender, manual dexterity, the child’s preferences, cognitive impairment and epilepsy were found to affect children’s leisure activities, with manual dexterity associated with more leisure activity.[170] Although leisure is important for children with CP, they may have difficulties carrying out leisure activities due to social and physical barriers.[citation needed]
Children with cerebral palsy may face challenges when it comes to participating in sports. This comes with being discouraged from physical activity because of these perceived limitations imposed by their medical condition.[171]
Participation and barriers[edit]
Participation is involvement in life situations and everyday activities.[172] Participation includes self-care, productivity, and leisure. In fact, communication, mobility, education, home life, leisure, and social relationships require participation, and indicate the extent to which children function in their environment.[172] Barriers can exist on three levels: micro, meso, and macro.[173] First, the barriers at the micro level involve the person.[173] Barriers at the micro level include the child’s physical limitations (motor, sensory and cognitive impairments) or their subjective feelings regarding their ability to participate.[174] For example, the child may not participate in group activities due to lack of confidence. Second, barriers at the meso level include the family and community.[173] These may include negative attitudes of people toward disability or lack of support within the family or in the community.[175] One of the main reasons for this limited support appears to be the result of a lack of awareness and knowledge regarding the child’s ability to engage in activities despite his or her disability.[175] Third, barriers at the macro level incorporate the systems and policies that are not in place or hinder children with CP. These may be environmental barriers to participation such as architectural barriers, lack of relevant assistive technology, and transportation difficulties due to limited wheelchair access or public transit that can accommodate children with CP.[175] For example, a building without an elevator can prevent the child from accessing higher floors.[citation needed]
A 2013 review stated that outcomes for adults with cerebral palsy without intellectual disability in the 2000s were that «60–80% completed high school, 14–25% completed college, up to 61% were living independently in the community, 25–55% were competitively employed, and 14–28% were involved in long term relationships with partners or had established families».[176] Adults with cerebral palsy may not seek physical therapy due to transport issues, financial restrictions and practitioners not feeling like they know enough about cerebral palsy to take people with CP on as clients.[177]
Aging[edit]
Children with CP may not successfully transition into using adult services because they are not referred to one upon turning 18, and may decrease their use of services.[148] Quality of life outcomes tend to decline for adults with cerebral palsy.[178] Because children with cerebral palsy are often told that it is a non-progressive disease, they may be unprepared for the greater effects of the aging process as they head into their 30s.[179] Young adults with cerebral palsy experience problems with aging that non-disabled adults experience «much later in life».[31]: 42 25% or more adults with cerebral palsy who can walk experience increasing difficulties walking with age.[180] Hand function does not seem to have similar declines.[61] Chronic disease risk, such as obesity, is also higher among adults with cerebral palsy than the general population.[181] Common problems include increased pain, reduced flexibility, increased spasms and contractures, post-impairment syndrome[182] and increasing problems with balance.[42] Increased fatigue is also a problem.[183] When adulthood and cerebral palsy is discussed, as of 2011, it is not discussed in terms of the different stages of adulthood.[183]
Like they did in childhood, adults with cerebral palsy experience psychosocial issues related to their CP, chiefly the need for social support, self-acceptance, and acceptance by others. Workplace accommodations may be needed to enhance continued employment for adults with CP as they age. Rehabilitation or social programs that include salutogenesis may improve the coping potential of adults with CP as they age.[184]
Epidemiology[edit]
Cerebral palsy occurs in about 2.1 per 1000 live births.[2] In those born at term rates are lower at 1 per 1000 live births.[62] Within a population it may occur more often in poorer people.[185] The rate is higher in males than in females; in Europe it is 1.3 times more common in males.[186]
There was a «moderate, but significant» rise in the prevalence of CP between the 1970s and 1990s. This is thought to be due to a rise in low birth weight of infants and the increased survival rate of these infants. The increased survival rate of infants with CP in the 1970s and 80s may be indirectly due to the disability rights movement challenging perspectives around the worth of infants with a disability, as well as the Baby Doe Law.[187] Between 1990 and 2003, rates of cerebral palsy remained the same.[188]
As of 2005, advances in the care of pregnant mothers and their babies did not result in a noticeable decrease in CP. This is generally attributed to medical advances in areas related to the care of premature babies (which results in a greater survival rate). Only the introduction of quality medical care to locations with less-than-adequate medical care has shown any decreases. The incidence of CP increases with premature or very low-weight babies regardless of the quality of care.[189] As of 2016, there is a suggestion that both incidence and severity are slightly decreasing – more research is needed to find out if this is significant, and if so, which interventions are effective.[113] It has been found that high-income countries have lower rates of children born with cerebral palsy than low or middle-income countries.[190]
Prevalence of cerebral palsy is best calculated around the school entry age of about six years; the prevalence in the U.S. is estimated to be 2.4 out of 1000 children.[191]
History[edit]
Cerebral palsy has affected humans since antiquity. A decorated grave marker dating from around the 15th to 14th century BCE shows a figure with one small leg and using a crutch, possibly due to cerebral palsy. The oldest likely physical evidence of the condition comes from the mummy of Siptah, an Egyptian Pharaoh who ruled from about 1196 to 1190 BCE and died at about 20 years of age. The presence of cerebral palsy has been suspected due to his deformed foot and hands.[11]
The medical literature of the ancient Greeks discusses paralysis and weakness of the arms and legs; the modern word palsy comes from the Ancient Greek words παράλυση or πάρεση, meaning paralysis or paresis respectively. The works of the school of Hippocrates (460–c. 370 BCE), and the manuscript On the Sacred Disease in particular, describe a group of problems that matches up very well with the modern understanding of cerebral palsy. The Roman Emperor Claudius (10 BCE–54 CE) is suspected of having CP, as historical records describe him as having several physical problems in line with the condition. Medical historians have begun to suspect and find depictions of CP in much later art. Several paintings from the 16th century and later show individuals with problems consistent with it, such as Jusepe de Ribera’s 1642 painting The Clubfoot.[11]
The modern understanding of CP as resulting from problems within the brain began in the early decades of the 1800s with a number of publications on brain abnormalities by Johann Christian Reil, Claude François Lallemand and Philippe Pinel. Later physicians used this research to connect problems in the brain with specific symptoms. The English surgeon William John Little (1810–1894) was the first person to study CP extensively. In his doctoral thesis he stated that CP was a result of a problem around the time of birth. He later identified a difficult delivery, a preterm birth and perinatal asphyxia in particular as risk factors. The spastic diplegia form of CP came to be known as Little’s disease.[11] At around this time, a German surgeon was also working on cerebral palsy, and distinguished it from polio.[192] In the 1880s British neurologist William Gowers built on Little’s work by linking paralysis in newborns to difficult births. He named the problem «birth palsy» and classified birth palsies into two types: peripheral and cerebral.[11]
Working in the US in the 1880s, Canadian-born physician William Osler (1849–1919) reviewed dozens of CP cases to further classify the disorders by the site of the problems on the body and by the underlying cause. Osler made further observations tying problems around the time of delivery with CP, and concluded that problems causing bleeding inside the brain were likely the root cause. Osler also suspected polioencephalitis as an infectious cause. Through the 1890s, scientists commonly confused CP with polio.[11]
Before moving to psychiatry, Austrian neurologist Sigmund Freud (1856–1939) made further refinements to the classification of the disorder. He produced the system still being used today. Freud’s system divides the causes of the disorder into problems present at birth, problems that develop during birth, and problems after birth. Freud also made a rough correlation between the location of the problem inside the brain and the location of the affected limbs on the body and documented the many kinds of movement disorders.[11]
In the early 20th century, the attention of the medical community generally turned away from CP until orthopedic surgeon Winthrop Phelps became the first physician to treat the disorder. He viewed CP from a musculoskeletal perspective instead of a neurological one. Phelps developed surgical techniques for operating on the muscles to address issues such as spasticity and muscle rigidity. Hungarian physical rehabilitation practitioner András Pető developed a system to teach children with CP how to walk and perform other basic movements. Pető’s system became the foundation for conductive education, widely used for children with CP today. Through the remaining decades, physical therapy for CP has evolved, and has become a core component of the CP management program.[11]
In 1997, Robert Palisano et al. introduced the Gross Motor Function Classification System (GMFCS) as an improvement over the previous rough assessment of limitation as either mild, moderate, or severe.[94] The GMFCS grades limitation based on observed proficiency in specific basic mobility skills such as sitting, standing, and walking, and takes into account the level of dependency on aids such as wheelchairs or walkers. The GMFCS was further revised and expanded in 2007.[94]
Society and culture[edit]
Economic impact[edit]
It is difficult to directly compare the cost and cost-effectiveness of interventions to prevent cerebral palsy or the cost of interventions to manage CP.[118] Access Economics has released a report on the economic impact of cerebral palsy in Australia. The report found that, in 2007, the financial cost of cerebral palsy (CP) in Australia was A$1.47 billion or 0.14% of GDP.[193] Of this:
- A$1.03 billion (69.9%) was productivity lost due to lower employment, absenteeism, and premature death of Australians with CP
- A$141 million (9.6%) was the DWL from transfers including welfare payments and taxation forgone
- A$131 million (9.0%) was other indirect costs such as direct program services, aides and home modifications, and the bringing-forward of funeral costs
- A$129 million (8.8%) was the value of the informal care for people with CP
- A$40 million (2.8%) was direct health system expenditure
The value of lost well-being (disability and premature death) was a further A$2.4 billion.[citation needed]
In per capita terms, this amounts to a financial cost of A$43,431 per person with CP per annum. Including the value of lost well-being, the cost is over $115,000 per person per annum.[citation needed]
Individuals with CP bear 37% of the financial costs, and their families and friends bear a further 6%. The federal government bears around one-third (33%) of the financial costs (mainly through taxation revenues forgone and welfare payments). State governments bear under 1% of the costs, while employers bear 5% and the rest of society bears the remaining 19%. If the burden of disease (lost well-being) is included, individuals bear 76% of the costs.[citation needed]
The average lifetime cost for people with CP in the US is US$921,000 per individual, including lost income.[194]
In the United States, many states allow Medicaid beneficiaries to use their Medicaid funds to hire their own PCAs, instead of forcing them to use institutional or managed care.[195]
In India, the government-sponsored program called «NIRAMAYA» for the medical care of children with neurological and muscular deformities has proved to be an ameliorating economic measure for persons with such disabilities.[196] It has shown that persons with mental or physically debilitating congenital disabilities can lead better lives if they have financial independence.[197]
Use of the term[edit]
«Cerebral» means «of, or pertaining to, the cerebrum or the brain»[198] and «palsy» means «paralysis, generally partial, whereby a local body area is incapable of voluntary movement».[199] It has been proposed to change the name to «cerebral palsy spectrum disorder» to reflect the diversity of presentations of CP.[200]
Many people would rather be referred to as a person with a disability (people-first language) instead of as «handicapped».[citation needed] «Cerebral Palsy: A Guide for Care» at the University of Delaware offers the following guidelines:
Impairment is the correct term to use to define a deviation from normal, such as not being able to make a muscle move or not being able to control an unwanted movement. Disability is the term used to define a restriction in the ability to perform a normal activity of daily living which someone of the same age can perform. For example, a three-year-old child who is not able to walk has a disability because a normal three-year-old can walk independently. A handicapped child or adult is one who, because of the disability, is unable to achieve the normal role in society commensurate with his age and socio-cultural milieu. As an example, a sixteen-year-old who is unable to prepare his own meal or care for his own toilet or hygiene needs is handicapped. On the other hand, a sixteen-year-old who can walk only with the assistance of crutches but who attends a regular school and is fully independent in activities of daily living is disabled but not handicapped. All disabled people are impaired, and all handicapped people are disabled, but a person can be impaired and not necessarily be disabled, and a person can be disabled without being handicapped.[201]
The term «spastic» denotes the attribute of spasticity in types of spastic CP. In 1952 a UK charity called The Spastics Society was formed.[202] The term «spastics» was used by the charity as a term for people with CP. The word «spastic» has since been used extensively as a general insult to disabled people, which some see as extremely offensive. They are also frequently used to insult non-disabled people when they seem overly uncoordinated, anxious, or unskilled in sports. The charity changed its name to Scope in 1994.[202] In the United States the word spaz has the same usage as an insult but is not generally associated with CP.[203]
Media[edit]
Maverick documentary filmmaker Kazuo Hara criticises the mores and customs of Japanese society in an unsentimental portrait of adults with cerebral palsy in his 1972 film Goodbye CP (Sayonara CP). Focusing on how people with cerebral palsy are generally ignored or disregarded in Japan, Hara challenges his society’s taboos about physical handicaps. Using a deliberately harsh style, with grainy black-and-white photography and out-of-sync sound, Hara brings a stark realism to his subject.[204]
Spandan (2012), a film by Vegitha Reddy and Aman Tripathi, delves into the dilemma of parents whose child has cerebral palsy. While films made with children with special needs as central characters have been attempted before, the predicament of parents dealing with the stigma associated with the condition and beyond is dealt in Spandan. In one of the songs of Spandan «Chal chaal chaal tu bala» more than 50 CP kids have acted. The famous classical singer Devaki Pandit has given her voice to the song penned by Prof. Jayant Dhupkar and composed by National Film Awards winner Isaac Thomas Kottukapally.[205][206][207][208]
My Left Foot (1989) is a drama film directed by Jim Sheridan and starring Daniel Day-Lewis. It tells the true story of Christy Brown, an Irishman born with cerebral palsy, who could control only his left foot. Christy Brown grew up in a poor, working-class family, and became a writer and artist. It won the Academy Award for Best Actor (Daniel Day-Lewis) and Best Actress in a Supporting Role (Brenda Fricker). It was also nominated for Best Director, Best Picture and Best Writing, Screenplay Based on Material from Another Medium. It also won the New York Film Critics Circle Award for Best Film for 1989.[209]
Call the Midwife (2012–) has featured two episodes with actor Colin Young, who himself has cerebral palsy, playing a character with the same disability. His storylines have focused on the segregation of those with disabilities in the UK in the 1950s, and also romantic relationships between people with disabilities.[210]
Micah Fowler, an American actor with CP, stars in the ABC sitcom Speechless (2016–2019), which explores both the serious and humorous challenges a family faces with a teenager with CP.[211]
9-1-1 (2018–) is a procedural drama series on Fox. From season 2 onwards, it features Gavin McHugh (who himself has cerebral palsy) in the recurring role as Christopher Diaz – a young child who has cerebral palsy.
Special (2019) is a comedy series that premiered on Netflix on 12 April 2019. It was written, produced and stars Ryan O’Connell as a young gay man with mild cerebral palsy. It is based on O’Connell’s book I’m Special: And Other Lies We Tell Ourselves.[212]
Australian drama serial The Heights (2019–) features a character with mild cerebral palsy, teenage girl Sabine Rosso, depicted by an actor who herself has mild cerebral palsy, Bridie McKim.[213]
6,000 Waiting (2021) is a documentary by Michael Joseph McDonald. It is the first film to depict a person with cerebral palsy parachuting. It tells the story of three men with cerebral palsy seeking to live in their communities instead of institutions.[214] Upon seeing the film, American politician Stacey Abrams interviewed one of the film’s protagonists and publicly stated that her top priority was deinstitutionalization through medicaid expansion.[215]
Notable cases[edit]
- Christy Brown was the basis for the Academy Award-winning film, My Left Foot.
- Two sons of Canadian rock musician Neil Young, Zeke and Ben.[216] In 1986, Young helped found the Bridge School, an educational organization for children with severe verbal and physical disabilities, and its annual supporting Bridge School Benefit concerts, together with his wife Pegi.[217][218]
- Nicolas Hamilton, a British racing driver competing in BTCC. He is the half-brother of Formula 1 driver Lewis Hamilton.[219]
- Geri Jewell, who had a regular role in the prime-time series The Facts of Life.[220]
- Josh Blue, winner of the fourth season of NBC’s Last Comic Standing, whose act revolves around his CP.[221] Blue was also on the 2004 U.S. Paralympic soccer team.[222]
- Jason Benetti, play-by-play broadcaster for ESPN, Fox Sports, Westwood One, and Time Warner covering football, baseball, lacrosse, hockey, and basketball. Since 2016, he is also the television play-by-play announcer for Chicago White Sox home games.[223]
- Jack Carroll, British comedian and runner-up in the seventh season of Britain’s Got Talent.[224]
- Abbey Curran, an American beauty queen who represented Iowa at Miss USA 2008 and was the first contestant with a disability to compete.[225]
- Robert Griswold, swimmer
- Francesca Martinez, British stand-up comedian and actress.[226]
- Evan O’Hanlon, Australian Paralympian, the fastest athlete with cerebral palsy in the world.[227]
- Arun Shourie’s son Aditya, about whom he has written a book Does He Know a Mother’s Heart[228]
- Maysoon Zayid, the self-described «Palestinian Muslim virgin with cerebral palsy, from New Jersey», who is an actress, stand-up comedian, and activist.[229] Zayid has been a resident of Cliffside Park, New Jersey.[230] She is considered one of America’s first Muslim women comedians and the first person ever to perform standup in Palestine and Jordan.[231]
- RJ Mitte, an American actor best known for his role as Walter White Jr. in Breaking Bad. He is also a celebrity ambassador for United Cerebral Palsy.[232]
- Zach Anner, an American comedian, actor, and writer. He had a television series on Oprah Winfrey’s OWN called Rollin’ With Zach and is the author of If at Birth You Don’t Succeed.[233]
- Kaine, a member of the American hip-hop duo The Ying Yang Twins, has a mild form of cerebral palsy that causes him to limp.[234][unreliable source?]
- Hannah Cockroft, is a British wheelchair athlete specialising in sprint distances in the T34 classification. She holds the Paralympic and world records for the 100 metres, 200 metres and 400 metres in her classification.[235][236][237]
- Keah Brown, American disability rights activist, author and journalist.[238]
- Kuli Kohli, Indian-British writer, poet, activist.[239]
- Simon James Stevens, a British disability issues consultant and activist, who starred in I’m Spazticus and founded Wheelies virtual nightclub [240]
- The Roman Emperor Claudius is hypothesized to have had cerebral palsy on the basis of his reported symptoms.[241]
- Rosie Jones, a British comedian and actress, is incorporating her cerebral palsy into her comedic style.
- Christopher Nolan, an Irish Poet and Author, he wrote Damn-Burst of Dreams, The Banyan Tree, and Under The Eye Of The Clock. He passed away in 2009.
- Lost Voice Guy British Comedian
Litigation[edit]
Because of the perception that cerebral palsy is mostly caused by trauma during birth, as of 2005, 60% of obstetric litigation was about cerebral palsy, which Alastair MacLennan, Professor of Obstetrics and Gynaecology at the University of Adelaide, regards as causing an exodus from the profession.[242] In the latter half of the 20th century, obstetric litigation about the cause of cerebral palsy became more common, leading to the practice of defensive medicine.[114]
See also[edit]
- Cerebral palsy sport classification – describes the disability sport classification for cerebral palsy.
- Inclusive recreation
- World Cerebral Palsy Day
Notes[edit]
- ^ Incorrectly stated as 11% in 2013 [2]
References[edit]
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj «Cerebral Palsy: Hope Through Research». National Institute of Neurological Disorders and Stroke. July 2013. Archived from the original on 21 February 2017. Retrieved 21 February 2017.
- ^ a b c d e Oskoui M, Coutinho F, Dykeman J, Jetté N, Pringsheim T (June 2013). «An update on the prevalence of cerebral palsy: a systematic review and meta-analysis». Developmental Medicine and Child Neurology. 55 (6): 509–519. doi:10.1111/dmcn.12080. PMID 23346889. S2CID 22053074.
- ^ Haak P, Lenski M, Hidecker MJ, Li M, Paneth N (October 2009). «Cerebral palsy and aging». Developmental Medicine and Child Neurology. 51 (4): 16–23. doi:10.1111/j.1469-8749.2009.03428.x. PMC 4183123. PMID 19740206.
- ^ «Cerebral Palsy: Overview». National Institutes of Health. Archived from the original on 15 February 2017. Retrieved 21 February 2017.
- ^ a b c «CEREBRAL PALSY, SPASTIC QUADRIPLEGIC, 1; CPSQ1». Online Mendelian Inheritance in Man. 28 June 2016. Retrieved 26 January 2018.
- ^ Rosenbaum P, Paneth N, Leviton A, Goldstein M, Bax M, Damiano D, et al. (February 2007). «A report: the definition and classification of cerebral palsy April 2006». Developmental Medicine and Child Neurology. Supplement. 109: 8–14. doi:10.1111/j.1469-8749.2007.tb12610.x. PMID 17370477. S2CID 24504486.
- ^ a b c d Farag SM, Mohammed MO, El-Sobky TA, ElKadery NA, ElZohiery AK (March 2020). «Botulinum Toxin A Injection in Treatment of Upper Limb Spasticity in Children with Cerebral Palsy: A Systematic Review of Randomized Controlled Trials». JBJS Reviews. 8 (3): e0119. doi:10.2106/JBJS.RVW.19.00119. PMC 7161716. PMID 32224633.
- ^ Blumetti FC, Belloti JC, Tamaoki MJ, Pinto JA (October 2019). «Botulinum toxin type A in the treatment of lower limb spasticity in children with cerebral palsy». The Cochrane Database of Systematic Reviews. 2019 (10): CD001408. doi:10.1002/14651858.CD001408.pub2. PMC 6779591. PMID 31591703.
- ^ Elliott, Catherine M.; Reid, Siobhan L.; Alderson, Jacqueline A.; Elliott, Bruce C. (1 February 2011). «Lycra arm splints in conjunction with goal-directed training can improve movement in children with cerebral palsy». NeuroRehabilitation. 28 (1): 47–54. doi:10.3233/nre-2011-0631. ISSN 1878-6448. PMID 21335677.
- ^ «How many people are affected?». National Institutes of Health. 5 September 2014. Archived from the original on 2 April 2015. Retrieved 4 March 2015.
- ^ a b c d e f g h i Panteliadis C, Panteliadis P, Vassilyadi F (April 2013). «Hallmarks in the history of cerebral palsy: from antiquity to mid-20th century». Brain & Development. 35 (4): 285–292. doi:10.1016/j.braindev.2012.05.003. PMID 22658818. S2CID 11851579.
- ^ «What is cerebral palsy?». The Cerebral Palsied Association of the Philippines Inc. Archived from the original on 20 December 2016. Retrieved 4 December 2016.
- ^ a b Rosenbaum P, Paneth N, Leviton A, Goldstein M, Bax M, Damiano D, et al. (February 2007). «A report: the definition and classification of cerebral palsy April 2006». Developmental Medicine and Child Neurology. Supplement. 109 (s109): 8–14. doi:10.1111/j.1469-8749.2007.tb12610.x. PMID 17370477. S2CID 24504486.; Corrected in Rosenbaum P, Paneth N, Leviton A, Goldstein M, Bax M, Damiano D, et al. (February 2007). «A report: the definition and classification of cerebral palsy April 2006». Developmental Medicine and Child Neurology. Supplement. 109 (6): 8–14. doi:10.1111/j.1469-8749.2007.00480.x. PMID 17370477. S2CID 221647898.
- ^ Kent R (2013). «Chapter 38: Cerebral Palsy». In Barnes MP, Good DC (eds.). Handbook of Clinical Neurology. 3. Vol. 110. Elsevier. pp. 443–459. ISBN 978-0444529015.
- ^ Mathewson MA, Lieber RL (February 2015). «Pathophysiology of muscle contractures in cerebral palsy». Physical Medicine and Rehabilitation Clinics of North America. 26 (1): 57–67. doi:10.1016/j.pmr.2014.09.005. PMC 4258234. PMID 25479779.
- ^ a b c d e El-Sobky TA, Fayyad TA, Kotb AM, Kaldas B (May 2018). «Bony reconstruction of hip in cerebral palsy children Gross Motor Function Classification System levels III to V: a systematic review». Journal of Pediatric Orthopedics. Part B. 27 (3): 221–230. doi:10.1097/BPB.0000000000000503. PMID 28953164. S2CID 4204446.
- ^ a b Agarwal A, Verma I (December 2012). «Cerebral palsy in children: An overview». Journal of Clinical Orthopaedics and Trauma. 3 (2): 77–81. doi:10.1016/j.jcot.2012.09.001. PMC 3872805. PMID 26403442.
- ^ «Volume 1997. No. 20 October 31, 1997». Clin-Alert. 35 (1): 153–160. January 1997. doi:10.1177/006947709703500120. ISSN 0069-4770. S2CID 208256249.
- ^ a b Amen J, ElGebeily M, El-Mikkawy DM, Yousry AH, El-Sobky TA (2018). «Single-event multilevel surgery for crouching cerebral palsy children: Correlations with quality of life and functional mobility». Journal of Musculoskeletal Surgery and Research. 2 (4): 148. doi:10.4103/jmsr.jmsr_48_18. S2CID 81725776.
- ^ Singh A (8 March 2021). Children With Diverse Needs (1st ed.). Psycho Information Technologies. pp. 159–165. ISBN 9788193922774. Retrieved 21 March 2021.
- ^ Smith M, Kurian MA (September 2016). «The medical management of cerebral palsy». Paediatrics and Child Health. 26 (9): 378–382. doi:10.1016/j.paed.2016.04.013.
- ^ «Symptoms of Cerebral palsy». NHS Choices. NHS Gov.UK. 15 March 2017. Archived from the original on 7 April 2017. Retrieved 6 April 2017.
- ^ Walshe M, Smith M, Pennington L (November 2012). Walshe M (ed.). «Interventions for drooling in children with cerebral palsy». The Cochrane Database of Systematic Reviews. 11: CD008624. doi:10.1002/14651858.CD008624.pub3. PMID 23152263.
- ^ a b c d e Sewell MD, Eastwood DM, Wimalasundera N (September 2014). «Managing common symptoms of cerebral palsy in children». BMJ. 349 (sep25 7): g5474. doi:10.1136/bmj.g5474. PMID 25255910. S2CID 45300547.
- ^ Samijn B, Van Laecke E, Renson C, Hoebeke P, Plasschaert F, Vande Walle J, Van den Broeck C (March 2017). «Lower urinary tract symptoms and urodynamic findings in children and adults with cerebral palsy: A systematic review». Neurourology and Urodynamics (Submitted manuscript). 36 (3): 541–549. doi:10.1002/nau.22982. PMID 26894322. S2CID 34807855.
- ^ Hinchcliffe A, Rogers C (2007). «Sensory integration problems in children with cerebral palsy». Children with Cerebral Palsy: a manual for therapists, parents and community workers (2nd ed., rev. ed.). New Delhi: SAGE Publications. ISBN 9788178299655.
- ^ Alliance (UK), National Guideline (2019). Rationale and impact. National Institute for Health and Care Excellence (UK).
- ^ a b c Mughal MZ (September 2014). «Fractures in children with cerebral palsy». Current Osteoporosis Reports. 12 (3): 313–318. doi:10.1007/s11914-014-0224-1. PMID 24964775. S2CID 32791951.
- ^ Ozel S, Switzer L, Macintosh A, Fehlings D (September 2016). «Informing evidence-based clinical practice guidelines for children with cerebral palsy at risk of osteoporosis: an update». Developmental Medicine and Child Neurology. 58 (9): 918–923. doi:10.1111/dmcn.13196. PMID 27435427.
- ^ Dewar, Rosalee Maree (2020). Postural control in children with cerebral palsy: a comprehensive definition, framework and reproducible assessment (Thesis). University of Queensland Library. doi:10.14264/90c2cf3.
- ^ a b Kerkovich, D, & Aisen, M 2009, ‘Chapter 4: Cerebral Palsy’, Medical Management of Adults with Neurologic Disabilities pp. 41–53 n.p.: Demos Medical Publishing, LLC. ISBN 9781933864457
- ^ Riad J, Finnbogason T, Broström E (December 2010). «Leg length discrepancy in spastic hemiplegic cerebral palsy: a magnetic resonance imaging study». Journal of Pediatric Orthopedics. 30 (8): 846–850. doi:10.1097/BPO.0b013e3181fc35dd. hdl:10616/40477. PMID 21102211. S2CID 46608602.
- ^ Veilleux LN, Rauch F (October 2017). «Muscle-Bone Interactions in Pediatric Bone Diseases». Current Osteoporosis Reports. 15 (5): 425–432. doi:10.1007/s11914-017-0396-6. PMID 28856575. S2CID 39445049.
- ^ a b Shore BJ, White N, Kerr Graham H (August 2010). «Surgical correction of equinus deformity in children with cerebral palsy: a systematic review». Journal of Children’s Orthopaedics. 4 (4): 277–290. doi:10.1007/s11832-010-0268-4. PMC 2908346. PMID 21804889.
- ^ a b Cloake T, Gardner A (December 2016). «The management of scoliosis in children with cerebral palsy: a review». Journal of Spine Surgery. 2 (4): 299–309. doi:10.21037/jss.2016.09.05. PMC 5233861. PMID 28097247.
- ^ Rutz E, Brunner R (November 2013). «Management of spinal deformity in cerebral palsy: conservative treatment». Journal of Children’s Orthopaedics. 7 (5): 415–418. doi:10.1007/s11832-013-0516-5. PMC 3838520. PMID 24432104.
- ^ Roberts A (September 2012). «The surgical treatment of cerebral palsy». Paediatrics and Child Health. 22 (9): 377–383. doi:10.1016/j.paed.2012.03.004.
- ^ a b Klingels K, De Cock P, Molenaers G, Desloovere K, Huenaerts C, Jaspers E, Feys H (2010). «Upper limb motor and sensory impairments in children with hemiplegic cerebral palsy. Can they be measured reliably?». Disability and Rehabilitation. 32 (5): 409–416. doi:10.3109/09638280903171469. PMID 20095955. S2CID 19704908.
- ^ a b c d Meyers RC, Bachrach SJ, Stallings VA (2017). «Cerebral Palsy». In Ekvall SW, Ekvall VK (eds.). Pediatric and Adult Nutrition in Chronic Diseases, Developmental Disabilities, and Hereditary Metabolic Disorders: Prevention, Assessment, and Treatment. Oxford Scholarship Online. pp. 86–90. doi:10.1093/acprof:oso/9780199398911.003.0009. ISBN 9780199398911.
- ^ a b c d e Donkervoort M, Roebroeck M, Wiegerink D, van der Heijden-Maessen H, Stam H (March 2007). «Determinants of functioning of adolescents and young adults with cerebral palsy». Disability and Rehabilitation. 29 (6): 453–463. doi:10.1080/09638280600836018. PMID 17364800. S2CID 20066607.
- ^ Bell KL, Samson-Fang L (December 2013). «Nutritional management of children with cerebral palsy». European Journal of Clinical Nutrition. 67 (Suppl 2): S13–S16. doi:10.1038/ejcn.2013.225. PMID 24301003.
- ^ a b Hirsh AT, Gallegos JC, Gertz KJ, Engel JM, Jensen MP (2010). «Symptom burden in individuals with cerebral palsy». Journal of Rehabilitation Research and Development. 47 (9): 863–876. doi:10.1682/jrrd.2010.03.0024. PMC 3158669. PMID 21174251.
- ^ a b Myrden A, Schudlo L, Weyand S, Zeyl T, Chau T (August 2014). «Trends in communicative access solutions for children with cerebral palsy». Journal of Child Neurology. 29 (8): 1108–1118. doi:10.1177/0883073814534320. PMID 24820337. S2CID 28508184.
- ^ Love RJ, Webb WG (2013). Neurology for the Speech-Language Pathologist (2nd ed.). Butterworth-Heinemann. p. 250. ISBN 9781483141992.
- ^ a b c d Beukelman DR, Mirenda P (1999). Augmentative and Alternative Communication: Management of severe communication disorders in children and adults (2nd ed.). Baltimore: Paul H Brookes Publishing Co. pp. 246–249. doi:10.1080/07434619912331278735. ISBN 978-1-55766-333-7.
- ^ Pennington, Lindsay (1 September 2008). «Cerebral palsy and communication». Paediatrics and Child Health. 18 (9): 405–409. doi:10.1016/j.paed.2008.05.013. ISSN 1751-7222.
- ^ McKearnan KA, Kieckhefer GM, Engel JM, Jensen MP, Labyak S (October 2004). «Pain in children with cerebral palsy: a review». The Journal of Neuroscience Nursing. 36 (5): 252–259. doi:10.1097/01376517-200410000-00004. PMID 15524243. S2CID 33568994.
- ^ Hauer J, Houtrow AJ (June 2017). «Pain Assessment and Treatment in Children With Significant Impairment of the Central Nervous System». Pediatrics. 139 (6): e20171002. doi:10.1542/peds.2017-1002. PMID 28562301.
- ^ Blackman JA, Svensson CI, Marchand S (September 2018). «Pathophysiology of chronic pain in cerebral palsy: implications for pharmacological treatment and research». Developmental Medicine and Child Neurology. 60 (9): 861–865. doi:10.1111/dmcn.13930. PMID 29882358.
- ^ Newman CJ, O’Regan M, Hensey O (July 2006). «Sleep disorders in children with cerebral palsy». Developmental Medicine and Child Neurology. 48 (7): 564–568. doi:10.1017/S0012162206001198. PMID 16780625.
- ^ Dutt R, Roduta-Roberts M, Brown CA (February 2015). «Sleep and Children with Cerebral Palsy: A Review of Current Evidence and Environmental Non-Pharmacological Interventions». Children. 2 (1): 78–88. doi:10.3390/children2010078. PMC 4928749. PMID 27417351.
- ^ Stanton M (2012). «Special Considerations». Understanding cerebral palsy : a guide for parents and professionals. London: Jessica Kingsley Publishers. p. 70. ISBN 9781849050609.
- ^ Kingsnorth S, Orava T, Provvidenza C, Adler E, Ami N, Gresley-Jones T, et al. (October 2015). «Chronic Pain Assessment Tools for Cerebral Palsy: A Systematic Review». Pediatrics. 136 (4): e947–e960. doi:10.1542/peds.2015-0273. PMID 26416940.
- ^ Novak I, Hines M, Goldsmith S, Barclay R (November 2012). «Clinical prognostic messages from a systematic review on cerebral palsy». Pediatrics. 130 (5): e1285–e1312. doi:10.1542/peds.2012-0924. PMID 23045562.
- ^ van der Slot WM, Benner JL, Brunton L, Engel JM, Gallien P, Hilberink SR, et al. (May 2021). «Pain in adults with cerebral palsy: A systematic review and meta-analysis of individual participant data». Annals of Physical and Rehabilitation Medicine. 64 (3): 101359. doi:10.1016/j.rehab.2019.12.011. hdl:10852/83636. PMID 32061920. S2CID 211134380.
- ^ Jones KB, Wilson B, Weedon D, Bilder D (December 2015). «Care of Adults With Intellectual and Developmental Disabilities: Cerebral Palsy». FP Essentials. 439: 26–30. PMID 26669212.
- ^ Krigger KW (January 2006). «Cerebral palsy: an overview». American Family Physician. 73 (1): 91–100. PMID 16417071.
- ^ Cremer N, Hurvitz EA, Peterson MD (June 2017). «Multimorbidity in Middle-Aged Adults with Cerebral Palsy». The American Journal of Medicine. 130 (6): 744.e9–744.e15. doi:10.1016/j.amjmed.2016.11.044. PMC 5502778. PMID 28065772.
- ^ «Women’s Health Initiative – Cerebral Palsy Foundation». Cerebral Palsy Foundation. 10 July 2015. Archived from the original on 24 December 2016. Retrieved 23 December 2016.
- ^ Wimalasundera N, Stevenson VL (June 2016). «Cerebral palsy». Practical Neurology. 16 (3): 184–194. doi:10.1136/practneurol-2015-001184. PMID 26837375. S2CID 4488035.
- ^ a b van Gorp M, Hilberink SR, Noten S, Benner JL, Stam HJ, van der Slot WM, Roebroeck ME (June 2020). «Epidemiology of Cerebral Palsy in Adulthood: A Systematic Review and Meta-analysis of the Most Frequently Studied Outcomes». Archives of Physical Medicine and Rehabilitation. 101 (6): 1041–1052. doi:10.1016/j.apmr.2020.01.009. hdl:1765/126053. PMID 32059945. S2CID 211122403.
- ^ a b c d e f g Yarnell J (2013). Epidemiology and Disease Prevention: A Global Approach (2nd ed.). Oxford University Press. p. 190. ISBN 9780199660537.
- ^ Eunson P (September 2016). «Aetiology and epidemiology of cerebral palsy». Paediatrics and Child Health. 26 (9): 367–372. doi:10.1016/j.paed.2016.04.011.
- ^ Sayed Ahmed WA, Hamdy MA (21 August 2018). «Optimal management of umbilical cord prolapse». International Journal of Women’s Health. 10: 459–465. doi:10.2147/IJWH.S130879. PMC 6109652. PMID 30174462.
- ^ a b c Nelson KB, Blair E (September 2015). «Prenatal Factors in Singletons with Cerebral Palsy Born at or near Term». The New England Journal of Medicine. 373 (10): 946–953. doi:10.1056/NEJMra1505261. PMID 26332549.
- ^ Burton A (September 2015). «Fighting cerebral palsy in Africa». The Lancet. Neurology. 14 (9): 876–877. doi:10.1016/S1474-4422(15)00189-1. PMID 26293560.
- ^ William B. Carey, ed. (2009). Developmental-behavioral pediatrics (4th ed.). Philadelphia, PA: Saunders/Elsevier. p. 264. ISBN 9781416033707.
- ^ Saunders NR, Hellmann J, Farine D (October 2011). «Cerebral palsy and assisted conception». Journal of Obstetrics and Gynaecology Canada. 33 (10): 1038–1043. doi:10.1016/s1701-2163(16)35053-8. PMID 22014781.
- ^ «Erratum». Developmental Medicine and Child Neurology. 58 (3): 316. March 2016. doi:10.1111/dmcn.12662. PMID 26890023. S2CID 221682193.
- ^ Hallman M (April 2012). «Premature birth and diseases in premature infants: common genetic background?». The Journal of Maternal-Fetal & Neonatal Medicine. 25 (Suppl 1): 21–24. doi:10.3109/14767058.2012.667600. PMID 22385349. S2CID 43101375.
- ^ Poets CF, Wallwiener D, Vetter K (October 2012). «Risks associated with delivering infants 2 to 6 weeks before term—a review of recent data». Deutsches Ärzteblatt International. 109 (43): 721–726. doi:10.3238/arztebl.2012.0721. PMC 3498472. PMID 23181136.
- ^ McIntyre S, Taitz D, Keogh J, Goldsmith S, Badawi N, Blair E (June 2013). «A systematic review of risk factors for cerebral palsy in children born at term in developed countries». Developmental Medicine and Child Neurology. 55 (6): 499–508. doi:10.1111/dmcn.12017. PMID 23181910. S2CID 3302180.
- ^ Ellenberg JH, Nelson KB (March 2013). «The association of cerebral palsy with birth asphyxia: a definitional quagmire». Developmental Medicine and Child Neurology. 55 (3): 210–216. doi:10.1111/dmcn.12016. PMID 23121164. S2CID 27475345.
- ^ Teng J, Chang T, Reyes C, Nelson KB (October 2012). «Placental weight and neurologic outcome in the infant: a review». The Journal of Maternal-Fetal & Neonatal Medicine. 25 (10): 2082–2087. doi:10.3109/14767058.2012.671871. PMID 22394270. S2CID 26933806.
- ^ a b «Causes and Risk Factors of Cerebral Palsy | CDC». 15 December 2020.
- ^ Parolin Schnekenberg R, Perkins EM, Miller JW, Davies WI, D’Adamo MC, Pessia M, et al. (July 2015). «De novo point mutations in patients diagnosed with ataxic cerebral palsy». Brain. 138 (Pt 7): 1817–1832. doi:10.1093/brain/awv117. PMC 4572487. PMID 25981959.
[…]a putative new gene had been found in Case 7, which is currently under investigation and will be presented elsewhere.
- ^ Parolin Schnekenberg R, Perkins EM, Miller JW, Davies WI, D’Adamo MC, Pessia M, et al. (July 2015). «De novo point mutations in patients diagnosed with ataxic cerebral palsy». Brain. 138 (Pt 7): 1817–1832. doi:10.1093/brain/awv117. PMC 4572487. PMID 25981959.
Case 6 had cerebellar vermis hypoplasia and Case 7 had global cerebellar hypoplasia (vermis and cerebellar hemispheres), both these cases were clinically stable.
- ^ a b «Cerebral Palsy | NCBDDD | CDC». Cerebral Palsy Home | NCBDDD | CDC. Archived from the original on 21 April 2017. Retrieved 20 April 2017.
- ^ Kieffer S. «Cerebral Palsy». Johns Hopkins Pediatric Neurosurgery. Archived from the original on 30 September 2015. Retrieved 18 September 2015.
- ^ «Infection in the Newborn as a Cause of Cerebral Palsy, 12/2004». United Cerebral Palsy Research and Education Foundation (U.S.). Archived from the original on 29 July 2007. Retrieved 5 July 2007.
- ^ Bersani I, Thomas W, Speer CP (April 2012). «Chorioamnionitis—the good or the evil for neonatal outcome?». The Journal of Maternal-Fetal & Neonatal Medicine. 25 (Suppl 1): 12–16. doi:10.3109/14767058.2012.663161. PMID 22309119. S2CID 11109172.
- ^ Mwaniki MK, Atieno M, Lawn JE, Newton CR (February 2012). «Long-term neurodevelopmental outcomes after intrauterine and neonatal insults: a systematic review». Lancet. 379 (9814): 445–452. doi:10.1016/s0140-6736(11)61577-8. PMC 3273721. PMID 22244654.
- ^ Pharoah PO (December 2005). «Causal hypothesis for some congenital anomalies». Twin Research and Human Genetics. 8 (6): 543–550. doi:10.1375/183242705774860141. PMID 16354495.
- ^ a b McIntyre S, Morgan C, Walker K, Novak I (November 2011). «Cerebral palsy—don’t delay». Developmental Disabilities Research Reviews. 17 (2): 114–129. doi:10.1002/ddrr.1106. PMID 23362031.
- ^ a b c d e f g h i Bosanquet M, Copeland L, Ware R, Boyd R (May 2013). «A systematic review of tests to predict cerebral palsy in young children». Developmental Medicine and Child Neurology. 55 (5): 418–426. doi:10.1111/dmcn.12140. PMID 23574478. S2CID 205066858.
- ^ a b c Lungu C, Hirtz D, Damiano D, Gross P, Mink JW (September 2016). «Report of a workshop on research gaps in the treatment of cerebral palsy». Neurology. 87 (12): 1293–1298. doi:10.1212/WNL.0000000000003116. PMC 5035982. PMID 27558377.
- ^ a b «Cerebral Palsy from Birth Injury». Birth Injury Guide. 3 January 2022. Retrieved 4 January 2022.
- ^ a b c d National Guideline Alliance (UK) (January 2017). Cerebral Palsy in Under 25s: Assessment and Management (PDF). London: National Institute for Health and Care Excellence (UK). ISBN 978-1-4731-2272-7. Archived (PDF) from the original on 10 September 2017. Retrieved 5 February 2017.
- ^ Graham D, Paget SP, Wimalasundera N (February 2019). «Current thinking in the health care management of children with cerebral palsy». The Medical Journal of Australia. 210 (3): 129–135. doi:10.5694/mja2.12106. PMID 30739332. S2CID 73424991.
- ^ McCay KD, Ho ES, Shum HP, Fehringer G, Marcroft C, Embleton ND (2020). «Unifying Person and Vehicle Re-identification». IEEE Access. 8 (1): 2169-3536. doi:10.1109/ACCESS.2020.2980269. S2CID 214623895.
- ^ McCay KD, Hu P, Shum HP, Woo WL, Marcroft C, Embleton ND, et al. (2022). «A Pose-Based Feature Fusion and Classification Framework for the Early Prediction of Cerebral Palsy in Infants». IEEE Transactions on Neural Systems and Rehabilitation Engineering. 30: 8–19. doi:10.1109/TNSRE.2021.3138185. PMID 34941512. S2CID 245457921.
- ^ Kolawole TM, Patel PJ, Mahdi AH (1989). «Computed tomographic (CT) scans in cerebral palsy (CP)». Pediatric Radiology. 20 (1–2): 23–27. doi:10.1007/BF02010628. PMID 2602010. S2CID 23604047.
- ^ Ashwal S, Russman BS, Blasco PA, Miller G, Sandler A, Shevell M, Stevenson R, et al. (Quality Standards Subcommittee of the American Academy of Neurology; Practice Committee of the Child Neurology Society) (March 2004). «Practice parameter: diagnostic assessment of the child with cerebral palsy: report of the Quality Standards Subcommittee of the American Academy of Neurology and the Practice Committee of the Child Neurology Society». Neurology. 62 (6): 851–863. doi:10.1212/01.WNL.0000117981.35364.1B. PMID 15037681.
- ^ a b c Rethlefsen SA, Ryan DD, Kay RM (October 2010). «Classification systems in cerebral palsy». The Orthopedic Clinics of North America. 41 (4): 457–467. doi:10.1016/j.ocl.2010.06.005. PMID 20868878.
- ^ a b c d Trabacca A, Vespino T, Di Liddo A, Russo L (September 2016). «Multidisciplinary rehabilitation for patients with cerebral palsy: improving long-term care». Journal of Multidisciplinary Healthcare. 9: 455–462. doi:10.2147/JMDH.S88782. PMC 5036581. PMID 27703369.
- ^ Ogoke C (2018). Clinical Classification of Cerebral Palsy. Retrieved 21 March 2021.
- ^ a b c Becher JG (2002). «Pediatric rehabilitation in children with cerebral palsy: general management, classification of motor disorders». Journal of Prosthetics and Orthotics. 14 (4): 143–149. doi:10.1097/00008526-200212000-00004. S2CID 71684103. Archived from the original on 2 February 2017. Retrieved 29 January 2017.
- ^ a b c d O’Shea TM (December 2008). «Diagnosis, treatment, and prevention of cerebral palsy». Clinical Obstetrics and Gynecology. 51 (4): 816–828. doi:10.1097/GRF.0b013e3181870ba7. PMC 3051278. PMID 18981805.
- ^ a b «Spastic cerebral palsy». Cerebral Palsy Alliance. 18 November 2015. Retrieved 4 March 2020.
- ^ Knierim J (2020). «Chapter 3: The motor cortex». Neuroscience online: An electronic textbook of the neurosciences from the University of Texas at Houston. Archived from the original on 17 December 2019. Retrieved 4 March 2020.
- ^ CDC (18 April 2018). «What is Cerebral Palsy? | CDC». Centers for Disease Control and Prevention. Retrieved 5 March 2020.
- ^ Nolan KW, Cole LL, Liptak GS (April 2006). «Use of botulinum toxin type A in children with cerebral palsy». Physical Therapy. 86 (4): 573–584. doi:10.1093/ptj/86.4.573. PMID 16579673.
- ^ McHale DP, Jackson AP, Levene MI, Corry P, Woods CG, Lench NJ, et al. (April 2000). «A gene for ataxic cerebral palsy maps to chromosome 9p12-q12». European Journal of Human Genetics. 8 (4): 267–272. doi:10.1038/sj.ejhg.5200445. PMID 10854109.
- ^ Cheney PD (1997). «Pathophysiology of the corticospinal system and basal ganglia in cerebral palsy». Mental Retardation and Developmental Disabilities Research Reviews. 3 (2): 153–167. doi:10.1002/(SICI)1098-2779(1997)3:2<153::AID-MRDD7>3.0.CO;2-S.
- ^ Straub K, Obrzut JE (2009). «Effects of cerebral palsy on neurophsyological function». Journal of Developmental and Physical Disabilities. 21 (2): 153–167. doi:10.1007/s10882-009-9130-3. S2CID 144152618.
- ^ Hou M, Zhao J, Yu R (2006). «Recent advances in dyskinetic cerebral palsy» (PDF). World J Pediatr. 2 (1): 23–28. Archived (PDF) from the original on 4 March 2016.
- ^ «Athetoid Dyskinetic». Swope, Rodante P.A. Archived from the original on 2 July 2013. Retrieved 31 October 2012.
- ^ Krägeloh-Mann I, Horber V (February 2007). «The role of magnetic resonance imaging in elucidating the pathogenesis of cerebral palsy: a systematic review». Developmental Medicine and Child Neurology. 49 (2): 144–151. doi:10.1111/j.1469-8749.2007.00144.x. PMID 17254004. S2CID 6967370.
- ^ Jones MW, Morgan E, Shelton JE, Thorogood C (2007). «Cerebral palsy: introduction and diagnosis (part I)». Journal of Pediatric Health Care. 21 (3): 146–152. doi:10.1016/j.pedhc.2006.06.007. PMID 17478303.
- ^ Rodda J, Graham HK (November 2001). «Classification of gait patterns in spastic hemiplegia and spastic diplegia: a basis for a management algorithm». European Journal of Neurology. 8 (Suppl 5): 98–108. doi:10.1046/j.1468-1331.2001.00042.x. PMID 11851738. S2CID 45860264.
- ^ a b Grunt S. «Geh-Orthesen bei Kindern mit Cerebralparese». Pediatrica. 18: 30–34.
- ^ Armand, Stephan (December 2016). «Gait analysis in children with cerebral palsy». Paediatrics and Child Health. 18 (9): 405–409. doi:10.1016/j.paed.2008.05.013. ISSN 1751-7222. PMC 5489760. PMID 28698802.
- ^ a b Shepherd E, Salam RA, Middleton P, Han S, Makrides M, McIntyre S, et al. (June 2018). «Neonatal interventions for preventing cerebral palsy: an overview of Cochrane Systematic Reviews». The Cochrane Database of Systematic Reviews. 6 (6): CD012409. doi:10.1002/14651858.CD012409. PMC 6457912. PMID 29926474.
- ^ a b Sartwelle TP, Johnston JC (June 2015). «Cerebral palsy litigation: change course or abandon ship». Journal of Child Neurology. 30 (7): 828–841. doi:10.1177/0883073814543306. PMC 4431995. PMID 25183322.
- ^ Crowther CA, Middleton PF, Voysey M, Askie L, Duley L, Pryde PG, et al. (October 2017). «Assessing the neuroprotective benefits for babies of antenatal magnesium sulphate: An individual participant data meta-analysis». PLOS Medicine. 14 (10): e1002398. doi:10.1371/journal.pmed.1002398. PMC 5627896. PMID 28976987.
- ^ Nguyen TM, Crowther CA, Wilkinson D, Bain E (February 2013). «Magnesium sulphate for women at term for neuroprotection of the fetus». The Cochrane Database of Systematic Reviews. 2 (2): CD009395. doi:10.1002/14651858.cd009395.pub2. PMID 23450601.
- ^ Zeng X, Xue Y, Tian Q, Sun R, An R (January 2016). «Effects and Safety of Magnesium Sulfate on Neuroprotection: A Meta-analysis Based on PRISMA Guidelines». Medicine. 95 (1): e2451. doi:10.1097/MD.0000000000002451. PMC 4706271. PMID 26735551.
- ^ a b Shih ST, Tonmukayakul U, Imms C, Reddihough D, Graham HK, Cox L, Carter R (June 2018). «Economic evaluation and cost of interventions for cerebral palsy: a systematic review». Developmental Medicine and Child Neurology. 60 (6): 543–558. doi:10.1111/dmcn.13653. PMID 29319155.
- ^ Edwards, Hannah B; Redaniel, Maria Theresa; Sillero-Rejon, Carlos; Margelyte, Ruta; Peters, Tim J; Tilling, Kate; Hollingworth, William; McLeod, Hugh; Craggs, Pippa; Hill, Elizabeth; Redwood, Sabi; Donovan, Jenny; Treloar, Emma; Wetz, Ellie; Swinscoe, Natasha (July 2023). «National PReCePT Programme: a before-and-after evaluation of the implementation of a national quality improvement programme to increase the uptake of magnesium sulfate in preterm deliveries». Archives of Disease in Childhood — Fetal and Neonatal Edition. 108 (4): 342–347. doi:10.1136/archdischild-2022-324579. ISSN 1359-2998. PMC 10314002. PMID 36617442.
- ^ Edwards, Hannah B; Redaniel, Maria Theresa; Sillero-Rejon, Carlos; Margelyte, Ruta; Peters, Tim J; Tilling, Kate; Hollingworth, William; McLeod, Hugh; Craggs, Pippa; Hill, Elizabeth; Redwood, Sabi; Donovan, Jenny; Treloar, Emma; Wetz, Ellie; Swinscoe, Natasha (July 2023). «National PReCePT Programme: a before-and-after evaluation of the implementation of a national quality improvement programme to increase the uptake of magnesium sulfate in preterm deliveries». Archives of Disease in Childhood — Fetal and Neonatal Edition. 108 (4): 342–347. doi:10.1136/archdischild-2022-324579. ISSN 1359-2998. PMC 10314002. PMID 36617442.
- ^ «NHS quality improvement programme reduces the risk of cerebral palsy in newborns». NIHR Evidence. 30 May 2023. doi:10.3310/nihrevidence_58371.
- ^ Atik A, Harding R, De Matteo R, Kondos-Devcic D, Cheong J, Doyle LW, Tolcos M (January 2017). «Caffeine for apnea of prematurity: Effects on the developing brain». Neurotoxicology. 58: 94–102. doi:10.1016/j.neuro.2016.11.012. PMID 27899304. S2CID 46761491.
- ^ a b c Shepherd E, Salam RA, Middleton P, Makrides M, McIntyre S, Badawi N, Crowther CA (August 2017). «Antenatal and intrapartum interventions for preventing cerebral palsy: an overview of Cochrane systematic reviews». The Cochrane Database of Systematic Reviews. 2017 (8): CD012077. doi:10.1002/14651858.CD012077.pub2. PMC 6483544. PMID 28786098.
- ^ Chang E (January 2015). «Preterm birth and the role of neuroprotection». BMJ. 350: g6661. doi:10.1136/bmj.g6661. PMID 25646630. S2CID 46429378.
- ^ Jacobs SE, Berg M, Hunt R, Tarnow-Mordi WO, Inder TE, Davis PG (January 2013). «Cooling for newborns with hypoxic ischaemic encephalopathy». The Cochrane Database of Systematic Reviews. 2013 (1): CD003311. doi:10.1002/14651858.CD003311.pub3. PMC 7003568. PMID 23440789.
- ^ a b c d e Novak I, McIntyre S, Morgan C, Campbell L, Dark L, Morton N, et al. (October 2013). «A systematic review of interventions for children with cerebral palsy: state of the evidence». Developmental Medicine and Child Neurology. 55 (10): 885–910. doi:10.1111/dmcn.12246. PMID 23962350. S2CID 1658072.
- ^ «Cerebral palsy – Treatment». www.nhs.uk. NHS Choices. Archived from the original on 6 February 2017. Retrieved 6 February 2017.
- ^ Ravault, Lucas; Darbois, Nelly; Pinsault, Nicolas (3 July 2020). «Methodological Considerations to Investigate Dosage Parameters of Intensive Upper Limb Rehabilitation in Children with Unilateral Spastic Cerebral Palsy: A Scoping Review of RCTs». Developmental Neurorehabilitation. 23 (5): 309–320. doi:10.1080/17518423.2019.1687599. ISSN 1751-8423. PMID 31710245. S2CID 207966055.
- ^ Hallman-Cooper JL, Rocha Cabrero F. Cerebral Palsy. [Updated 2022 Oct 10]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK538147/
- ^ Pennington L, Goldbart J, Marshall J (2004). «Speech and language therapy to improve the communication skills of children with cerebral palsy». The Cochrane Database of Systematic Reviews. 2004 (2): CD003466. doi:10.1002/14651858.CD003466.pub2. PMC 8407241. PMID 15106204.
- ^ Blake SF, Logan S, Humphreys G, Matthews J, Rogers M, Thompson-Coon J, et al. (2015). «Sleep positioning systems for children with cerebral palsy». The Cochrane Database of Systematic Reviews. 2015 (11): CD009257. doi:10.1002/14651858.CD009257.pub2. PMC 8761500. PMID 26524348.
- ^ Eddison N, Mulholland M, Chockalingam N (August 2017). «Do research papers provide enough information on design and material used in ankle foot orthoses for children with cerebral palsy? A systematic review». Journal of Children’s Orthopaedics. 11 (4): 263–271. doi:10.1302/1863-2548.11.160256. PMC 5584494. PMID 28904631.
- ^ Horst R (2005). Motorisches Strategietraining und PNF. Renata Horst. ISBN 978-3-13-151351-9.
- ^ Novacheck TF (2008). Orthoses for cerebral palsy. AAOS Atlas of Orthoses and Assistive Devices. Philadelphia: John D. Hsu, John W. Michael, John R. Fisk. pp. 487–500. ISBN 978-0-323-03931-4.
- ^ Muñoz S (2018). «The new generation of AFOs». The O&P EDGE. 11. Archived from the original on 6 June 2021. Retrieved 16 July 2021.
- ^ Kerkum YL, Harlaar J, Buizer AI, van den Noort JC, Becher JG, Brehm MA (May 2016). «An individual approach for optimizing ankle-foot orthoses to improve mobility in children with spastic cerebral palsy walking with excessive knee flexion». Gait & Posture. 46: 104–111. doi:10.1016/j.gaitpost.2016.03.001. PMID 27131186.
- ^ Kerkum YL (2016). «The effect of ankle foot orthosis stiffness on trunk movement and walking energy cost in cerebral palsy». Gait & Posture. 49: 2. doi:10.1016/j.gaitpost.2016.07.070. ISSN 0966-6362.
- ^ Meyns P, Kerkum YL, Brehm MA, Becher JG, Buizer AI, Harlaar J (May 2020). «Ankle foot orthoses in cerebral palsy: Effects of ankle stiffness on trunk kinematics, gait stability and energy cost of walking». European Journal of Paediatric Neurology. 26: 68–74. doi:10.1016/j.ejpn.2020.02.009. PMID 32147412. S2CID 212641072.
- ^ Waterval NF, Nollet F, Harlaar J, Brehm MA (October 2019). «Modifying ankle foot orthosis stiffness in patients with calf muscle weakness: gait responses on group and individual level». Journal of Neuroengineering and Rehabilitation. 16 (1): 120. doi:10.1186/s12984-019-0600-2. PMC 6798503. PMID 31623670.
- ^ Ploeger HE, Waterval NF, Nollet F, Bus SA, Brehm MA (2019). «Stiffness modification of two ankle-foot orthosis types to optimize gait in individuals with non-spastic calf muscle weakness — a proof-of-concept study». Journal of Foot and Ankle Research (in German). 12: 41. doi:10.1186/s13047-019-0348-8. PMC 6686412. PMID 31406508.
- ^ Jenks KM, de Moor J, van Lieshout EC, Maathuis KG, Keus I, Gorter JW (2007). «The effect of cerebral palsy on arithmetic accuracy is mediated by working memory, intelligence, early numeracy, and instruction time». Developmental Neuropsychology. 32 (3): 861–879. doi:10.1080/87565640701539758. hdl:1871/34092. PMID 17956186. S2CID 17795628.
- ^ a b Zaffuto-Sforza CD (February 2005). «Aging with cerebral palsy». Physical Medicine and Rehabilitation Clinics of North America. 16 (1): 235–249. doi:10.1016/j.pmr.2004.06.014. PMID 15561553.
- ^ Wiegerink D, Roebroeck M, Bender J, Stam H, Cohen-Kettenis P (June 2011). «Sexuality of Young Adults with Cerebral Palsy: Experienced Limitations and Needs». Sexuality and Disability. 29 (2): 119–128. doi:10.1007/s11195-010-9180-6. PMC 3093545. PMID 21660090.
- ^ Hutton JL (June 2006). «Cerebral palsy life expectancy». Clinics in Perinatology. 33 (2): 545–555. doi:10.1016/j.clp.2006.03.016. PMID 16765736.
- ^ Strauss D, Brooks J, Rosenbloom L, Shavelle R (July 2008). «Life expectancy in cerebral palsy: an update». Developmental Medicine and Child Neurology. 50 (7): 487–493. doi:10.1111/j.1469-8749.2008.03000.x. PMID 18611196. S2CID 18315945.
- ^ Day SM, Reynolds RJ, Kush SJ (December 2015). «Extrapolating published survival curves to obtain evidence-based estimates of life expectancy in cerebral palsy». Developmental Medicine and Child Neurology. 57 (12): 1105–1118. doi:10.1111/dmcn.12849. PMID 26174088. S2CID 8895402.
- ^ «Australian Bureau of Statistics 2014, 3303.0 — Causes of Death, Australia — 1. Underlying causes of death (Australia), 2014, data cube: Excel spreadsheet». abs.gov.au/AUSSTATS. Archived from the original on 12 September 2016. Retrieved 14 August 2016.
- ^ a b Kent RM (2012). «Cerebral palsy». In Barnes M, Good D (eds.). Neurological Rehabilitation Handbook of Clinical Neurology. Oxford: Elsevier Science. pp. 443–459. ISBN 9780444595843.
- ^ Van Zelst BR, Miller MD, Russo R, Murchland S, Crotty M (September 2006). «Activities of daily living in children with hemiplegic cerebral palsy: a cross-sectional evaluation using the Assessment of Motor and Process Skills». Developmental Medicine and Child Neurology. 48 (9): 723–727. doi:10.1017/S0012162206001551. PMID 16904017.
- ^ Nieuwenhuijsen C, Donkervoort M, Nieuwstraten W, Stam HJ, Roebroeck ME (November 2009). «Experienced problems of young adults with cerebral palsy: targets for rehabilitation care». Archives of Physical Medicine and Rehabilitation. 90 (11): 1891–1897. doi:10.1016/j.apmr.2009.06.014. PMID 19887214.
- ^ Arnould C, Penta M, Thonnard JL (November 2007). «Hand impairments and their relationship with manual ability in children with cerebral palsy». Journal of Rehabilitation Medicine. 39 (9): 708–714. doi:10.2340/16501977-0111. PMID 17999009.
- ^ «Therapy and equipment needs of people with cerebral palsy and like disabilities in Australia». Australian Institute of Health and Welfare AIHW. 2006. Archived from the original on 30 March 2015. Disability Series. Cat. no. DIS 49. Canberra: AIHW.
- ^ «Patients & Clients: Learn About Occupational Therapy». The American Occupational Therapy Association, Inc. Retrieved 3 September 2019.
- ^ Fedrizzi E, Pagliano E, Andreucci E, Oleari G (February 2003). «Hand function in children with hemiplegic cerebral palsy: prospective follow-up and functional outcome in adolescence». Developmental Medicine and Child Neurology. 45 (2): 85–91. doi:10.1017/s0012162203000173. PMID 12578233.
- ^ Blesedell CE, Cohn ES, Schell AB. Willard and Spackman’s occupational therapy. Philadelphia, PA: Lippincott Williams & Wilkins; 2003. p. 705-709.
- ^ a b c Townsend E, Stanton S, Law M. Enabling occupation: An occupational therapy perspective. Canadian Association of Occupational Therapists Ottawa, ON, Canada; 1997/2002. p. 34.
- ^ Parham LD, Primeau LA (2008). «Play and occupational therapy». In Parham LD, Fazio LS (eds.). Play in occupational therapy for children (2nd ed.). St. Louis, Mo.: Mosby Elsevier. ISBN 978-0-323-02954-4. Archived from the original on 15 April 2015.
- ^ Miller S, Reid D (December 2003). «Doing play: competency, control, and expression». Cyberpsychology & Behavior. 6 (6): 623–632. doi:10.1089/109493103322725397. PMID 14756927.
- ^ Okimoto AM, Bundy A, Hanzlik J (2000). «Playfulness in children with and without disability: measurement and intervention». The American Journal of Occupational Therapy. 54 (1): 73–82. doi:10.5014/ajot.54.1.73. PMID 10686630.
- ^ Hestenes LL, Carroll DE (2000). «The play interactions of young children with and without disabilities: Individual and environmental influences». Early Childhood Research Quarterly. 15 (2): 229–246. doi:10.1016/s0885-2006(00)00052-1.
- ^ a b c d Missiuna C, Pollock N (October 1991). «Play deprivation in children with physical disabilities: the role of the occupational therapist in preventing secondary disability». The American Journal of Occupational Therapy. 45 (10): 882–888. doi:10.5014/ajot.45.10.882. PMID 1835302.
- ^ Howard L (December 1996). «A Comparison of Leisure-Time Activities between Able-Bodied Children and Children with Physical Disabilities». British Journal of Occupational Therapy. 59 (12): 570–574. doi:10.1177/030802269605901208. S2CID 147128197.
- ^ Rigby P, Schwellnus H (January 1999). «Occupational Therapy Decision Making Guidelines for Problems in Written Productivity». Physical & Occupational Therapy in Pediatrics. 19 (1): 5–27. doi:10.1080/J006v19n01_02.
- ^ Smith M, Sandberg AD, Larsson M (2009). «Reading and spelling in children with severe speech and physical impairments: a comparative study». International Journal of Language & Communication Disorders. 44 (6): 864–882. doi:10.1080/13682820802389873. PMID 19105069.
- ^ a b Pruitt DW, Tsai T (August 2009). «Common medical comorbidities associated with cerebral palsy». Physical Medicine and Rehabilitation Clinics of North America. 20 (3): 453–467. doi:10.1016/j.pmr.2009.06.002. PMID 19643347.
- ^ Cassidy T (March 1996). «All work and no play: A focus on leisure time as a means for promoting health». Counselling Psychology Quarterly. 9 (1): 77–90. doi:10.1080/09515079608256354.
- ^ Carlon SL, Taylor NF, Dodd KJ, Shields N (April 2013). «Differences in habitual physical activity levels of young people with cerebral palsy and their typically developing peers: a systematic review». Disability and Rehabilitation. 35 (8): 647–655. doi:10.3109/09638288.2012.715721. PMID 23072296. S2CID 14115837.
- ^ Verschuren O, Peterson MD, Balemans AC, Hurvitz EA (August 2016). «Exercise and physical activity recommendations for people with cerebral palsy». Developmental Medicine and Child Neurology. 58 (8): 798–808. doi:10.1111/dmcn.13053. PMC 4942358. PMID 26853808.
- ^ Bloemen M, Van Wely L, Mollema J, Dallmeijer A, de Groot J (October 2017). «Evidence for increasing physical activity in children with physical disabilities: a systematic review». Developmental Medicine and Child Neurology. 59 (10): 1004–1010. doi:10.1111/dmcn.13422. PMID 28374442.
- ^ Bult MK, Verschuren O, Jongmans MJ, Lindeman E, Ketelaar M (September 2011). «What influences participation in leisure activities of children and youth with physical disabilities? A systematic review». Research in Developmental Disabilities. 32 (5): 1521–1529. doi:10.1016/j.ridd.2011.01.045. PMID 21388783.
- ^ Coleman N, Nemeth BA, LeBlanc CM (December 2018). «Increasing Wellness Through Physical Activity in Children With Chronic Disease and Disability». Current Sports Medicine Reports. 17 (12): 425–432. doi:10.1249/JSR.0000000000000548. PMID 30531459. S2CID 54473147.
- ^ a b King G, Law M, King S, Rosenbaum P, Kertoy MK, Young NL (2003). «A conceptual model of the factors affecting the recreation and leisure participation of children with disabilities». Physical & Occupational Therapy in Pediatrics. 23 (1): 63–90. doi:10.1080/J006v23n01_05. PMID 12703385. S2CID 25399342.
- ^ a b c Aitchison C (December 2003). «From leisure and disability to disability leisure: developing data, definitions and discourses». Disability & Society. 18 (7): 955–969. doi:10.1080/0968759032000127353. S2CID 145317559.
- ^ Imms C (2008). «Children with cerebral palsy participate: a review of the literature». Disability and Rehabilitation. 30 (24): 1867–1884. doi:10.1080/09638280701673542. PMID 19037780. S2CID 20859782.
- ^ a b c Specht J, King G, Brown E, Foris C (2002). «The importance of leisure in the lives of persons with congenital physical disabilities». The American Journal of Occupational Therapy. 56 (4): 436–445. doi:10.5014/ajot.56.4.436. PMID 12125833.
- ^ Frisch D, Msall ME (August 2013). «Health, functioning, and participation of adolescents and adults with cerebral palsy: a review of outcomes research». Developmental Disabilities Research Reviews. 18 (1): 84–94. doi:10.1002/ddrr.1131. PMID 23949832.
- ^ Lawrence H, Hills S, Kline N, Weems K, Doty A (November 2016). «Effectiveness of Exercise on Functional Mobility in Adults with Cerebral Palsy: A Systematic Review». Physiotherapy Canada. Physiotherapie Canada. 68 (4): 398–407. doi:10.3138/ptc.2015-38LHC. PMC 5125497. PMID 27904240.
- ^ Alves-Nogueira AC, Silva N, McConachie H, Carona C (January 2020). «A systematic review on quality of life assessment in adults with cerebral palsy: Challenging issues and a call for research». Research in Developmental Disabilities. 96: 103514. doi:10.1016/j.ridd.2019.103514. PMID 31706133. S2CID 207936522.
- ^ Turk MA, Overeynder JC, Janicki MP, eds. (1995). Uncertain Future – Aging and Cerebral Palsy: Clinical Concerns (PDF) (Report). Albany: New York State Developmental Disabilities Planning Council. Archived from the original (PDF) on 3 August 2016.
- ^ Morgan P, McGinley J (17 April 2013). «Gait function and decline in adults with cerebral palsy: a systematic review». Disability and Rehabilitation. 36 (1): 1–9. doi:10.3109/09638288.2013.775359. PMID 23594053. S2CID 9709075.
- ^ Peterson MD, Gordon PM, Hurvitz EA (February 2013). «Chronic disease risk among adults with cerebral palsy: the role of premature sarcopoenia, obesity and sedentary behaviour». Obesity Reviews. 14 (2): 171–182. doi:10.1111/j.1467-789X.2012.01052.x. hdl:2027.42/96337. PMID 23094988. S2CID 26998110.
- ^ «CP and ageing». Scope. Archived from the original on 6 May 2016. Retrieved 24 December 2016.
- ^ a b Kembhavi G, Darrah J, Payne K, Plesuk D (July 2011). «Adults with a diagnosis of cerebral palsy: a mapping review of long-term outcomes». Developmental Medicine and Child Neurology. 53 (7): 610–614. doi:10.1111/j.1469-8749.2011.03914.x. PMID 21418196. S2CID 36859403.
- ^ Horsman M, Suto M, Dudgeon B, Harris SR (May 2010). «Ageing with cerebral palsy: psychosocial issues». Age and Ageing. 39 (3): 294–299. doi:10.1093/ageing/afq018. PMID 20178997.
- ^ Odding E, Roebroeck ME, Stam HJ (February 2006). «The epidemiology of cerebral palsy: incidence, impairments and risk factors». Disability and Rehabilitation. 28 (4): 183–191. doi:10.1080/09638280500158422. PMID 16467053. S2CID 45640254.
- ^ Johnson, Ann (September 2002). «Prevalence and characteristics of children with cerebral palsy in Europe». Developmental Medicine and Child Neurology. 44 (9): 633–640. doi:10.1111/j.1469-8749.2002.tb00848.x. PMID 12227618. S2CID 221649047.
- ^ Dalembert G, Brosco JP (June 2013). «Do politics affect prevalence? An overview and the case of cerebral palsy». Journal of Developmental and Behavioral Pediatrics. 34 (5): 369–374. doi:10.1097/DBP.0b013e31829455d8. PMID 23751888. S2CID 41883040.
- ^ Paul, Sudip; Nahar, Anjuman; Bhagawati, Mrinalini; Kunwar, Ajaya Jang (30 July 2022). «A Review on Recent Advances of Cerebral Palsy». Oxidative Medicine and Cellular Longevity. 2022: e2622310. doi:10.1155/2022/2622310. ISSN 1942-0900. PMC 9356840. PMID 35941906.
- ^ «Proposed definition and classification of cerebral palsy, April 2005». Developmental Medicine & Child Neurology. 47 (8): 571. 2007. doi:10.1111/j.1469-8749.2005.tb01195.x. S2CID 221650919.[dead link]
- ^ McIntyre S, Goldsmith S, Webb A, Ehlinger V, Hollung SJ, McConnell K, et al. (December 2022). «Global prevalence of cerebral palsy: A systematic analysis». Developmental Medicine and Child Neurology. 64 (12): 1494–1506. doi:10.1111/dmcn.15346. PMC 9804547. PMID 35952356. S2CID 251516376.
- ^ Hirtz D, Thurman DJ, Gwinn-Hardy K, Mohamed M, Chaudhuri AR, Zalutsky R (January 2007). «How common are the «common» neurologic disorders?». Neurology. 68 (5): 326–337. doi:10.1212/01.wnl.0000252807.38124.a3. PMID 17261678. S2CID 208246679.
- ^ «The Definition and Classification of Cerebral Palsy». Developmental Medicine & Child Neurology. 49: 1–44. 28 June 2008. doi:10.1111/j.1469-8749.2007.00201.x. S2CID 221645066.
- ^ «Access Economics (2008) The Economic Impact of Cerebral Palsy in Australia in 2007. Access Economics, Canberra, ACT». Archived from the original on 21 November 2008.
- ^ Centers for Disease Control Prevention (CDC) (January 2004). «Economic costs associated with mental retardation, cerebral palsy, hearing loss, and vision impairment—United States, 2003». MMWR. Morbidity and Mortality Weekly Report. 53 (3): 57–59. PMID 14749614. Archived from the original on 19 September 2007. Retrieved 12 August 2007.
- ^ «Medicaid.gov: Self Directed Services». Medicaid. Archived from the original on 19 June 2017. Retrieved 19 June 2017.
- ^ «NIRAMAYA Ministry of Social Justice and Empowerment (MSJE)». thenationaltrust.gov.in. Archived from the original on 27 February 2017. Retrieved 27 February 2017.
- ^ Siva M, Nalinakanthi V (29 November 2015). «The Big Story. Financially able». The Hindu Business Line.
- ^ «Definition of Cerebral». 2021.
- ^ «Bell’s Palsy & Other Facial Nerve Problems». 2020.
- ^ Shevell M (December 2018). «Cerebral palsy to cerebral palsy spectrum disorder: Time for a name change?». Neurology: 10.1212/WNL.0000000000006747. doi:10.1212/WNL.0000000000006747. PMID 30568002. S2CID 58605985.
- ^ «Cerebral Palsy: a Guide for Care». Archived from the original on 17 July 2007. Retrieved 29 July 2007.
- ^ a b Brindle D (22 May 2002). «A very telling tale». The Guardian. London. Archived from the original on 29 July 2016. Retrieved 6 December 2016.
- ^ Zimmer B (5 February 2007). «A brief history of «spaz»«. Language Log. University of Pennsylvania. Archived from the original on 9 August 2007. Retrieved 29 July 2007.
- ^ Erickson G (22 May 2007). «DVD Savant Review: Goodbye CP». DVDtalk. Archived from the original on 30 April 2011.
- ^ Borah P (28 June 2011). «Movie with a twist». The Hindu. Chennai, India. Archived from the original on 27 September 2013.
- ^ Alawadhi N (26 March 2011). «Charting unexplored territory in Indian cinema». The Hindu. Chennai, India. Archived from the original on 27 September 2013.
- ^ Rai A (3 January 2012). «spandan» «Review of Marathi Film «SPANDAN»«. The Newsleak.in.[dead link]
- ^ «Vegitha, carving a niche for herself». The Deccan Chronicle. 7 June 2011. Archived from the original on 9 June 2011.
- ^ Champlin C (21 December 1989). «My Left Foot». Los Angeles Times.
- ^ «Being on Call the Midwife gave me the sense of being an actor in my own right». 16 February 2014. Archived from the original on 5 September 2015. Retrieved 12 August 2015.
- ^ Rovenstine D (20 September 2016). «Micah Fowler is the breakout star of Speechless». EntertainmentWeekly. Archived from the original on 24 September 2016. Retrieved 3 October 2016.
- ^ Kacala A (12 April 2019). «‘Special’: Groundbreaking new Netflix series stars gay man with cerebral palsy». NBC News. Retrieved 22 April 2019.
- ^ Houston M (12 February 2019). «‘I don’t think I’ve ever seen a disabled character written like that before’«. Sydney Morning Herald. Archived from the original on 16 October 2020. Retrieved 17 October 2020.
- ^ «6,000 Waiting». ReelAbilities International. Retrieved 25 May 2023.
- ^ «VOICES: Southern legislatures must dismantle poverty traps for disabled people | Facing South». www.facingsouth.org. Retrieved 25 May 2023.
- ^ «Neil Young». Biography. Retrieved 17 October 2019.
- ^ «Neil Young Files for Divorce From Pegi Young». Rolling Stone. 26 August 2014. Retrieved 17 October 2019.
- ^ Michaels S (27 August 2014). «Neil Young files for divorce from Pegi, his wife of 36 years». The Guardian. ISSN 0261-3077. Retrieved 17 October 2019.
- ^ «The Driver — Nicolas Hamilton». nicolashamilton. Archived from the original on 3 June 2020. Retrieved 3 June 2020.
- ^ «Comedian Geri Jewell headlines diversity event». WMU News. 16 May 2002. Archived from the original on 7 March 2012. Retrieved 6 December 2010.
- ^ «Josh Blue wins «Last Comic Standing»«. Archived from the original on 28 June 2010. Retrieved 6 December 2010.
- ^ ««Last Comic Standing» biography». Archived from the original on 13 September 2010. Retrieved 6 December 2010.
- ^ «Jason Benetti Is Voice of Hope in Face of Cerebral Palsy». Archived from the original on 17 March 2013.
- ^ «Britain’s Got Talent: Jack Carroll to coin it with TV show, DVD and book deals». The Mirror. 8 June 2013. Archived from the original on 2 August 2013. Retrieved 1 August 2013.
- ^ «Pageant Is Her Crowning Achievement: Miss Iowa, In Las Vegas For Miss USA Pageant, Was Born With Cerebral Palsy». Las Vegas: CBS. 10 April 2008. Archived from the original on 6 November 2008. Retrieved 5 June 2010.
- ^ Lewis T (7 August 2011). «Comedian Francesca Martinez: «Surely I can’t be more unfunny than Patsy Palmer»«. The Guardian. London. Archived from the original on 3 February 2013.
- ^ «O’Hanlon heads to Melbourne in career-best form». Athletics Australia. 1 March 2012. Archived from the original on 24 April 2012. Retrieved 18 April 2012.
- ^ «HarperCollins Publishers India Ltd». Archived from the original on 11 June 2011.
- ^ Franks T (7 July 2008). «Jerusalem Diary: Monday 7 July». BBC News. Archived from the original on 11 May 2009.
- ^ Heydarpour R (21 November 2006). «The Comic Is Palestinian, the Jokes Bawdy». The New York Times. Archived from the original on 21 November 2012. Retrieved 22 March 2011.
Ms. Zayid, who has a home in Cliffside Park, N.J., recently returned from Hollywood, where she lived while working on developing her one-woman show.
- ^ IMEU (18 October 2013). «Maysoon Zayid: Actor and Comedian». Institute for Middle East Understanding. Archived from the original on 23 December 2016. Retrieved 8 December 2016.
- ^ «Celebrity Ambassadors». Archived from the original on 9 June 2015. Retrieved 18 June 2015.
- ^ «REVIEW: Zach Anner’s If at Birth You Don’t Succeed Is an Inspiring, Hilarious Memoir About One Man’s Life with Cerebral Palsy». People. 11 March 2016. Retrieved 6 December 2016.
- ^ ABS Staff (4 June 2014). «10 Celebrities With Physical Deformities You May Have Never Noticed». Atlanta Black Star. Archived from the original on 21 December 2016. Retrieved 8 December 2016.
- ^ «IPC Athletics Records». www.paralympic.org. Archived from the original on 10 September 2012. Retrieved 10 September 2012.
- ^ «Paralympics 2012: Cockroft wins first GB track gold». BBC Sport. 31 August 2012. Archived from the original on 1 September 2012. Retrieved 1 September 2012.
- ^ «Paralympics 2012: Hannah Cockroft wins second sprint gold». BBC Sport. 6 September 2012. Archived from the original on 8 September 2012. Retrieved 6 September 2012.
- ^ «Perspectives on Disability». Library Journal. Retrieved 29 April 2020.
- ^ «‘They wanted to drown me at birth — now I’m a poet’«. BBC News. 29 August 2020. Retrieved 4 November 2020.
- ^ «Lord of Glencoe Simon Stevens». simonstevens.com. Archived from the original on 19 May 2001. Retrieved 1 July 2021.
- ^ Leon, E.F. (1948). «The Imbecillitas of the Emperor Claudius», Transactions and Proceedings of the American Philological Association, 79 79–86.JSTOR 283354
- ^ «Cerebral Palsy Litigation». Radio National. 10 October 2005. Archived from the original on 22 February 2017. Retrieved 21 February 2017.
External links[edit]
- Cerebral palsy at Curlie
- Cerebral Palsy Information Page at NINDS
Разбираем наиболее популярные предрассудки, которые сильно усложняют жизнь детей с ДЦП и их родителей
Миф 1: «Церебральный паралич – это прогрессирующее заболевание»
Этот миф берет начало в некоторой схожести между ДЦП и другими неврологическими заболеваниями, которые имеют прогрессирующее течение. Например, болезнь Тея-Сакса. Но при ДЦП симптомы и состояние не ухудшаются, и более того, в некоторых случаях даже наступает некоторое улучшение. Современные международные протоколы по реабилитации, значительно способствуют повышению качества жизни пациентов с этим диагнозом.
Миф 2: «Все люди с ДЦП очень зависимы от других»
Действительно, при тяжелых формах ДЦП нужен постоянный уход и помощь. Но это относится только к четвертому и пятому типу по шкале больших моторных функций (GMFCS). Это примерно 30% от всех, кому диагностирован церебральный паралич. 7 из 10 людей с ДЦП могут вести самостоятельный и независимый образ жизни, особенно если уже с детства с ними занимались специалисты по реабилитации и ставили именно цель. Чтобы организовать независимую от окружающих жизнь, и во взрослом возрасте жить самостоятельно, помимо регулярной физической реабилитации, нужно следующее:
· технические приспособления для ходьбы и мелкой моторики;
· адаптация пространства дома и на работе;
· помощь для решения разных бытовых проблем, таких как уборка, глажка белья итд;
Миф 3: «Дети с церебральным параличом не умеют общаться»
В некоторых случаях ДЦП сопровождается нарушениями речи и слуха, однако у многих пациентов таких проблем нет — считается, что 3/4 людей с этим диагнозом могут неплохо говорить, те же у кого есть такие затруднения, могут частично или полностью преодолеть их с помощью логопеда. В случае серьезных нарушений речи специалист по альтернативной и дополнительной коммуникации (АДК) сможет подобрать и научить разным стратегиям общения с помощью жестов, карточек, компьютерных программ и др.
Миф 4: «У детей с ДЦП всегда нарушен интеллект»
Очень важно не забывать, что ДЦП — это, в первую очередь, неврологическое заболевание, которое затрагивает двигательные функции. Примерно половина детей с этим диагнозом не имеют нарушения интеллекта, причем иногда ребенок может испытывать сложности с речью, но иметь нормальный интеллект. Тем не менее, у половины детей с ДЦП такие нарушения имеются — от незначительных до глубокой умственной отсталости. И также у детей с церебральным параличом чаще наблюдается нарушение обучаемости без нарушения интеллекта.
Миф 5: «Церебральный паралич протекает у всех одинаково»
Церебральный паралич — это собирательный термин для целой группы неврологических заболеваний с самыми разнообразными симптомами.
Существуют четыре основных вида ДЦП:
· спастический (пирамидальный )- 70-80%
· атетоидный (экстрапирамидный или дискинитический) — 6%
· атаксический — 6%
· смешанный
при этом поражения могут касаться разных частей тела:
· квадриплегия- поражены все четыре конечности. Работа мышц корпуса тела, лица и рта тоже может быть нарушена;
· диплелгия- поражены обе ноги, иногда руки тоже могут быть задеты, но в значительно меньшей степени;
· гемиплегия- поражена одна сторона тела (правая или левая);
У одного ребенка со спастической формой могут быть нарушения функции одной конечности, в то время как у другого ребенка с той же формой паралича может быть квардиплегия с поражением всех четырех конечностей. Потребности и трудности на пути каждого ребенка уникальны.
Миф 6: «Учебные заведения совершенно не приспособлены для детей с ДЦП»
Пока это еще остается серьезной проблемой для России, но процесс адаптации образовательных учреждений уже идет. Помимо среды, в школах в штатном расписании появилась позиция тьютора — это специальный сопровождающий для ребенка, с нарушением движения, который работает с каждым ребенком индивидуально.
Миф 7: «Церебральный паралич всегда является следствием врачебной ошибки»
Заболевание возникает в результате повреждения головного мозга — до, во время или после рождения. По характеру это может быть механическая травма, воспаление или кислородное голодание.
Основные причины ДЦП:
1. Серьезная инфекция у матери в период беременности.
2. Инфекции головного мозга после рождения, такие как менингит.
3. Осложнения при родах.
4. Травмы головы.
5. Врожденные заболевания — пороки сердца и нарушения свертываемости крови.
6. Врачебные ошибки.
7. Злоупотребление алкоголем или наркотиками со стороны матери.
Основные факторы риска ДЦП:
1. Преждевременные роды.
2. Низкая масса головного мозга.
3. Многоплодные роды (близнецы или тройняшки).
4. Некоторые средства борьбы с бесплодием, увеличивающие шанс многоплодной беременности.
5. Нарушения здоровья матери, такие как судороги или патологии щитовидной железы.
Миф 8: «Люди с церебральным параличом никогда не будут иметь своих детей»
Многие родители детей с ДЦП сильно переживают из-за возможности никогда не увидеть внуков. На самом же деле, у многих взрослых с этим диагнозом есть свои дети. Церебральный паралич, как правило никак не оказывает влияние на фертильность. Кроме того, лишь в некоторых случаях ДЦП имеет генетическую этиологию, и далеко не все генетические заболевания передаются по наследству. В целом, взрослым людям с ДЦП не надо бояться передачи заболевания по наследству своим детям. Несмотря на более высокий риск осложнений, многие женщины с тяжелыми формами ДЦП могут успешно выносить беременность и родить здорового ребенка.
Миф 9: «Все дети с ДЦП никогда не научатся ходить»
Многие дети с ДЦП пожизненно нуждаются в вспомогательных средствах передвижения, таких как инвалидные коляски. Тем не менее, это относится не ко всем, а только к самым тяжелым типам — IV и V типу по шкале больших моторных функций. Все остальные люди с этим диагнозом могут ходить или самостоятельно или с помощью тростей или ходунков. В некоторых случаях церебральный паралич не затрагивает нижние конечности и тогда ходьба не представляет никаких проблем.
Миф 10: «Люди с ДЦП всегда сидят дома»
Отсутствие возможности ходить не должно привязывать человека к дому. Разные вспомогательные средства дают людям с инвалидностью возможность оставаться независимыми и активными. Например, инвалидные кресла с электродвигателем позволят детям с квадриплегией передвигаться свободно по достижении подросткового возраста. Конечно, это доступно пока еще далеко не всем в нашей стране, но изменения пусть медленно, но происходят. Кроме того, сейчас во многих странах, в том числе, в России, идет процесс адаптации общественных пространств для людей с ограниченными возможностями в движении.
Миф 11: «Церебральный паралич не поддается коррекции»
Долгое время научное медицинское сообщество считало ДЦП неизлечимым заболеванием. Тем не менее, в течение последних десятилетий это мнение подвергается критике. Сегодня детям с ДЦП предлагается целый спектр мероприятий — от физической терапии до лекарственной терапии сопутствующих заболеваний.
В результате, родители своими глазами могут наблюдать существенные улучшения симптомов. Конечно, невозможно «выпрыгнуть» из своего уровня по GMFCS, но при правильной реабилитации можно добиться очень многого.
Миф 12: «ДЦП можно вылечить»
И все-таки окончательного лечения заболевания пока не существует. Однако это вовсе не означает, что ДЦП навсегда останется неизлечимым заболеванием! Самые новые исследования регенерации и нейропластичности уже показали многообещающие результаты, которые найдут свое применение в лечении неврологических заболеваний. Ученые очень надеются, что сегодняшние дети с ДЦП смогут увидеть лечение своими глазами и испытать что-то на себе.
Миф 13: «ДЦП встречается редко»
ДЦП является самой частой причиной двигательных нарушений у детей и одной из наиболее частых причин хронической инвалидности в детском возрасте. По данным международной организации Autism and Developmental Disabilities Monitoring (ADDM) Network, церебральный паралич встречается у 1 из 323 детей. Если вам кажется, будто вы никогда не встречали человека с ДЦП, это вполне может быть заблуждением: у многих людей с мягкими формами заболевание во взрослом возрасте протекает практически незаметно.
Детский церебральный паралич (ДЦП) — это понятие, объединяющее группу двигательных расстройств, возникающих вследствие повреждения различных мозговых структур в перинатальном периоде. Детский церебральный паралич может включать моно-, геми-, пара-, тетра- параличи и парезы, патологические изменения мышечного тонуса, гиперкинезы, нарушения речи, шаткость походки, расстройства координации движений, частые падения, отставание ребенка в моторном и психическом развитии. При ДЦП могут наблюдаться нарушения интеллекта, психические расстройства, эпилепсия, нарушения слуха и зрения. Диагностируется детский церебральный паралич преимущественно по клиническим и анамнестическим данным. Алгоритм обследования ребенка с ДЦП направлен на выявление сопутствующей патологии и исключение другой врожденной или послеродовой патологии. Люди, имеющие детский церебральный паралич, должны пожизненно проходить реабилитационную терапию, по мере необходимости получать медикаментозное, хирургическое и физиотерапевтическое лечение.
Общие сведения
Согласно мировой статистике детский церебральный паралич встречается с частотой 1,7-7 случаев на 1000 детей до года. В России этот показатель по различным данным составляет 2,5-6 случаев на 1000 детей. Среди недоношенных детей заболеваемость ДЦП в 10 раз выше среднестатистической. По данным последних исследований около 40-50% детей с ДЦП появились на свет в результате преждевременных родов.
Если говорить о хронических заболеваниях детского возраста, то в современной педиатрии детский церебральный паралич является одной из ведущих проблем. Среди причин увеличения числа больных ДЦП совершенно справедливо называют не только ухудшение экологии, но и прогрессивное развитие неонатологии, позволяющее сейчас выхаживать младенцев с различной патологией, в том числе и недоношенных новорожденных с весом от 500г.
Детский церебральный паралич (ДЦП)
Причины возникновения ДЦП
Согласно современным представлениям детский церебральный паралич возникает в результате воздействия на ЦНС ребенка различных повреждающих факторов, обуславливающих неправильное развитие или гибель отдельных участков головного мозга. Причем действие этих факторов происходит в перинатальном периоде, т. е. до, во время и непосредственно после рождения ребенка (первые 4 недели жизни). Основное патогенетическое звено в формировании детского церебрального паралича — это гипоксия, к развитию которой и приводят различные причинные факторы ДЦП. В первую очередь при гипоксии страдают те участки головного мозга, которые отвечают за поддержание равновесия и обеспечение двигательных рефлекторных механизмов. В результате возникают типичные для ДЦП расстройства мышечного тонуса, парезы и параличи, патологические двигательные акты.
Этиологическим фактором ДЦП, действующим в период внутриутробного развития, является различная патология беременности:
- фетоплацентарная недостаточность
- преждевременная отслойка плаценты
- токсикозы
- нефропатия беременных
- резус-конфликт
- угроза прерывания беременности
а также инфекции:
- цитомегаловирус
- краснуха
- токсоплазмоз
- герпес
- сифилис.
Соматические заболевания матери (сахарный диабет, гипотиреоз, врожденные и приобретенные пороки сердца, артериальная гипертензия) и перенесенные женщиной в период беременности травмы также могут обусловить развитие детского церебрального паралича.
Факторы риска
К факторам риска развития ДЦП, влияющим на ребенка в период родов, относятся:
- тазовое предлежание плода
- стремительные роды
- преждевременные роды
- узкий таз
- крупный плод
- чрезмерно сильная родовая деятельность
- затяжные роды
- дискоординированная родовая деятельность
- длительный безводный период перед родами.
Лишь в некоторых случаях родовая травма является единственной причиной возникновения детского церебрального паралича. Зачастую тяжелые роды, приводящие к возникновению ДЦП, становятся следствием уже имеющейся внутриутробной патологии.
Основными факторами риска появления ДЦП в послеродовом периоде являются асфиксия и гемолитическая болезнь новорожденного. Приводящая к ДЦП асфиксия новорожденного может быть связана с аспирацией околоплодных вод, различными пороками развития легких, патологией беременности. Более частая послеродовая причина возникновения ДЦП состоит в токсическом поражении мозга при гемолитической болезни, развивающейся в результате несовместимости крови или иммунологического конфликта плода и матери.
Классификация ДЦП
В соответствии с местонахождением пораженного участка головного мозга в неврологии ДЦП классифицируют на 5 видов. Самой распространенной формой ДЦП является спастическая диплегия. По различным данным детский церебральный паралич этой формы составляет от 40 до 80% от общего числа случаев ДЦП. В основе этой формы ДЦП лежит поражение двигательных центров, ведущее к развитию парезов, в большей степени выраженных в ногах. При повреждении двигательных центров только одного полушария возникает гемипаретическая форма ДЦП, проявляющаяся парезом руки и ноги на стороне, противоположной пораженному полушарию.
Примерно в четверти случаев детский церебральный паралич имеет гиперкинетическую форму, связанную с повреждением подкорковых структур. Клинически данная форма ДЦП проявляется непроизвольными движениями — гиперкинезами, усиливающимися при волнении или усталости ребенка. При нарушениях в области мозжечка развивается атонически-астатическая форма детского церебрального паралича. Эта форма ДЦП проявляется нарушениями статики и координации, мышечной атонией. На ее долю приходится около 10% случаев ДЦП.
Наиболее тяжелая форма ДЦП носит название двойная гемиплегия. В этом варианте детский церебральный паралич является следствием тотального поражения обоих полушарий мозга, приводящего к мышечной ригидности, из-за которой дети не в состоянии не только стоять и сидеть, а даже самостоятельно держать голову. Встречаются также смешанные варианты детского церебрального паралича, включающие клинические симптомы, характерные для разных форм ДЦП. Например, часто наблюдается сочетание гиперкинетической формы ДЦП со спастической диплегией.
Симптомы ДЦП
Детский церебральный паралич может иметь разнообразные проявления с различной степенью выраженности. Клиническая картина ДЦП и его тяжесть зависят от локализации и глубины поражения мозговых структур. В отдельных случаях детский церебральный паралич заметен уже в первые часы жизни ребенка. Но чаще симптомы ДЦП становятся очевидными спустя несколько месяцев, когда ребенок начинает существенно отставать в нервно-психическом развитии от принятых в педиатрии норм. Первым симптомом ДЦП может быть задержка в формировании двигательных навыков. Ребенок с детским церебральным параличом долго не держит голову, не переворачивается, не интересуется игрушками, не может осознанно двигать конечностями, не удерживает игрушки. При попытке поставить ребенка с ДЦП на ноги он не ставит ногу на полную стопу, а встает на цыпочки.
Парезы при детском церебральном параличе могут быть только в одной конечности, иметь односторонний характер (рука и нога на стороне, противоположной пораженному участку мозга), охватывать все конечности. Недостаточность иннервации речевого аппарата обусловливает нарушение произносительной стороны речи (дизартрию) у ребенка с ДЦП. Если ДЦП сопровождается парезом мышц глотки и гортани, то возникают проблемы с глотанием (дисфагия). Зачастую детский церебральный паралич сопровождается значительным повышением мышечного тонуса. Выраженная спастика при ДЦП может приводить к полной обездвиженности конечности.
В дальнейшем у детей, имеющих детский церебральный паралич, происходит отставание паретичных конечностей в физическом развитии, в результате чего они становится тоньше и короче здоровых. В следствие этого формируются типичные для ДЦП деформации скелета (сколиоз, деформации грудной клетки). Кроме того, детский церебральный паралич протекает с развитием контрактур суставов в паретичных конечностях, что усугубляет двигательные нарушения. Расстройства моторики и деформации скелета у детей с ДЦП приводят к появлению хронического болевого синдрома с локализацией болей в плечах, шее, спине и ступнях.
Детский церебральный паралич гиперкинетической формы проявляется внезапно возникающими непроизвольными двигательными актами: поворотами или кивками головой, подергиваниями, появлением гримас на лице, вычурными позами или движениями. Для атонически-астатической формы ДЦП характерны дискоординированные движения, неустойчивость при ходьбе и в положении стоя, частые падения, мышечная слабость и тремор.
При детском церебральном параличе может наблюдаться косоглазие, функциональные нарушения ЖКТ, расстройства дыхательной функции, недержание мочи. Примерно в 20-40% случаев детский церебральный паралич протекает с эпилепсией. До 60% детей с ДЦП имеют проблемы со зрением. Возможна тугоухость или полная глухота. В половине случаев детский церебральный паралич сочетается с эндокринной патологией (ожирением, гипотиреозом, задержкой роста и др.).
Часто детский церебральный паралич сопровождается различной степенью олигофрении, задержкой психического развития, расстройством восприятия, нарушениями способности к обучению, отклонениями в поведении и т. п. Однако до 35% детей с ДЦП имеют нормальный интеллект, а в 33% случаев ДЦП нарушения интеллекта выражены в легкой степени.
Детский церебральный паралич является хроническим, но не прогрессирующим заболеванием. По мере роста ребенка и развития его ЦНС могут выявляться ранее скрытые патологические проявления, которые создают ощущение так называемой «ложной прогрессии» заболевания. Ухудшение состояния ребенка с ДЦП также может быть обусловлено вторичными осложнениями: эпилепсией, инсультом, кровоизлиянием, применением наркоза или тяжелым соматическим заболеванием.
Диагностика ДЦП
Пока не существует специальных диагностических критериев детского церебрального паралича. Однако некоторые типичные для ДЦП симптомы сразу обращают на себя внимание педиатра. К ним относятся: низкий бал, выставляемый по шкале Апгар сразу же после рождения ребенка, аномальная двигательная активность, нарушения мышечного тонуса, отставание ребенка в психофизическом развитии, отсутствие контакта с матерью. Подобные признаки всегда настораживают врачей в отношении ДЦП и являются показанием к обязательной консультации ребенка детским неврологом.
При подозрении на детский церебральный паралич необходим тщательный неврологический осмотр ребенка. В диагностике ДЦП также используются электрофизиологические методы обследования:
- электроэнцефалография
- электромиография и электронейрография
- исследование вызванных потенциалов
- транскраниальная магнитная стимуляция.
Они помогают дифференцировать ДЦП от наследственных неврологических заболеваний, проявляющихся на 1-ом году жизни (врожденной миопатии, атаксии Фредрейха, синдрома Луи-Бар и др). Использование в диагностике ДЦП нейросонографии и МРТ головного мозга позволяют выявить сопутствующие ДЦП органические изменения (например, атрофию зрительных нервов, очаги кровоизлияний или ишемии, перивентрикулярную лейкомаляцию) и диагностировать пороки развития головного мозга (микроцефалию, врожденную гидроцефалию и пр.).
Полная диагностика ДЦП может потребовать участия детского офтальмолога, детского отоларинголога, эпилептолога, детского ортопеда, логопеда и психиатра. При необходимости дифференцировать ДЦП от различных наследственных и обменных заболеваний применяются соответствующие генетические исследования и биохимические анализы.
Реабилитационное лечение ДЦП
К сожалению, пока детский церебральный паралич относится к неизлечимой патологии. Однако своевременно начатые, комплексно и беспрерывно проводимые реабилитационные мероприятия могут значительно развить доступные ребенку с ДЦП моторные, интеллектуальные и речевые навыки. Благодаря реабилитационному лечению можно максимально компенсировать имеющийся при ДЦП неврологический дефицит, уменьшить вероятность появления контрактур и скелетных деформаций, научить ребенка навыкам самообслуживания и улучшить его адаптацию. Наиболее активно развитие мозга, познавательный процесс, приобретение навыков и обучение происходят в возрасте до 8 лет. Именно в этот период при ДЦП необходимо прилагать максимальные усилия по реабилитации.
Программа комплексной реабилитационной терапии разрабатывается индивидуально для каждого больного ДЦП. Она учитывает локализацию и тяжесть поражения мозга; наличие сопутствующих ДЦП нарушений слуха и зрения, расстройств интеллекта, эпилептических припадков; индивидуальные возможности и проблемы больного ДЦП ребенка. Наиболее затруднительно проведение реабилитационных мероприятий при сочетании ДЦП с нарушениями познавательной деятельности (в том числе в следствие слепоты или глухоты) и интеллекта. Для таких случаев ДЦП разработаны специальные методики, позволяющие инструктору наладить контакт с ребенком. Дополнительные сложности в лечении ДЦП возникают у пациентов с эпилепсией, при которой активная стимулирующая терапия ДЦП может вызывать развитие осложнений. По этой причине дети с ДЦП и эпилепсией должны проходить реабилитацию с применением специальных «мягких» методов.
Основу реабилитационного лечения при детском церебральном параличе составляют ЛФК и массаж. Важно, чтобы детям с ДЦП они проводились ежедневно. По этой причине родителям ребенка с детским церебральным параличом следует овладеть навыками массажа и проведения ЛФК. В таком случае они смогут самостоятельно заниматься с ребенком в период между курсами профессиональной реабилитации ДЦП.
Для более эффективных занятий ЛФК и механотерапии с детьми, страдающими детским церебральным параличом, в соответствующих реабилитационных центрах имеются специальные аппараты и приспособления. Из последних разработок в этой области в лечении ДЦП нашли применение пневмокомбинизоны, фиксирующие суставы и обеспечивающие растяжение мышц, а также специальные костюмы, позволяющие при некоторых формах ДЦП выработать правильный двигательный стереотип и уменьшить спастику мышц. Подобные средства помогают максимально задействовать компенсаторные механизмы нервной системы, что зачастую приводит к освоению больным ДЦП ребенком новых, ранее не доступных для него, движений.
К реабилитационным мероприятиям при ДЦП относятся также так называемые технические средства реабилитации: ортодезы, вставки в обувь, костыли, ходунки, инвалидные коляски и т. п. Они позволяют компенсировать имеющиеся при ДЦП двигательные нарушения, укорочения конечностей и деформации скелета. Важное значение имеет индивидуальный подбор таких средств и обучение ребенка, имеющего детский церебральный паралич, навыкам их использования.
В рамках реабилитационного лечения детского церебрального паралича ребенку с дизартрией требуются логопедические занятия по коррекции ФФН или ОНР.
Медикаментозное и хирургическое лечение ДЦП
Лечение ДЦП при помощи лекарственных препаратов является в основном симптоматическим и направлено на купирование конкретного симптома ДЦП или возникших осложнений. Так, при сочетании ДЦП с эпилептическими припадками назначаются антиконвульсанты, при повышении мышечного тонуса — антиспастические препараты, при ДЦП с хроническим болевым синдромом — обезболивающие и спазмолитические средства. В медикаментозную терапию ДЦП могут входить ноотропы, метаболические препараты (АТФ, аминокислоты, глицин), неостигмин, антидепрессанты, транквилизаторы, нейролептики, сосудистые препараты.
Показанием к хирургическому лечению детского церебрального паралича являются контрактуры, образовавшиеся в результате длительной спастичности мышц и ограничивающие двигательную активность больного. Чаще всего при ДЦП применяются тенотомии, направленные на создание опорного положения парализованной конечности. Для стабилизации скелета при детском церебральном параличе может применяться удлинение костей, пересадка сухожилий и др. операции. Если детский церебральный паралич проявляется грубой симметричной мышечной спастичностью, ведущей к развитию контрактур и болевого синдрома, то для прерывания исходящей из спинного мозга патологической импульсации пациенту с ДЦП может быть проведена спинальная ризотомия.
Физиотерапевтическое лечение и анималотерапия ДЦП
Применяемые в лечении детского церебрального паралича методы физиотерапевтического воздействия прекрасно сочетаются с ЛФК и массажем. Хорошо зарекомендовали себя при ДЦП
- оксигенобаротерапия
- электростимуляция нервов и мышц
- лекарственный электрофорез
- грязелечение
- тепловые процедуры
- водолечение.
Применение при детском церебральном параличе общих ванн с теплой водой уменьшает выраженность гиперкинезов и снижает мышечный тонус при спастике. Из водных процедур при ДЦП назначаются хвойные, кислородные, радоновые, скипидарные и йодобромные ванны, фитованны с валерианой.
Относительно новым способом терапии детского церебрального паралича является анималотерапия — лечение посредством общения больного с животным. К наиболее распространенным методикам анималотерапии ДЦП на сегодняшний день относятся иппотерапия ДЦП (лечение с использованием лошадей) и дельфинотерапия ДЦП. Во время проведения подобных лечебных сеансов с имеющим детский церебральный паралич ребенком одновременно работают инструктор и психотерапевт. В основе терапевтического воздействия указанных методик лежат:
- благоприятная эмоциональная атмосфера
- установление особого контакта между больным ДЦП и животным
- стимуляция мозговых структур через насыщенные тактильные ощущения
- постепенное расширение речевых и двигательных навыков.
Социальная адаптация при ДЦП
Не смотря на значительные двигательные нарушения, многие имеющие детский церебральный паралич дети могут быть успешно адаптированы в обществе. Огромную роль в этом играют родители и родные ребенка с ДЦП. Но для эффективного решения этой задачи им необходима помощь специалистов: реабилитологов, психологов и коррекционных педагогов, непосредственно занимающихся детьми с ДЦП. Они работают над тем, чтобы ребенок с ДЦП максимально освоил доступные для него навыки самообслуживания, приобрел соответствующие его возможностям знания и умения, постоянно получал психологическую поддержку.
Социальной адаптации при диагнозе детский церебральный паралич в большой степени способствует занятия в специализированных детсадах и школах, а в дальнейшем в специально созданных обществах. Их посещение расширяют познавательные возможности, дают ребенку и взрослому с ДЦП возможность общаться и вести активную жизнь. При отсутствии нарушений, значительно ограничивающих двигательную активность и интеллектуальные возможности, взрослые люди с ДЦП могут вести самостоятельную жизнь. Такие пациенты с ДЦП успешно трудятся и могут создать свою семью.
Прогноз и профилактика ДЦП
Прогноз в отношении детского церебрального паралича прямо зависит от формы ДЦП, своевременности и беспрерывности проводимого реабилитационного лечения. В некоторых случаях ДЦП приводит к глубокой инвалидности. Но чаще стараниями медиков и родителей ребенка с ДЦП удается до определенной степени компенсировать имеющиеся нарушения, поскольку растущий и развивающийся головной мозг детей, в том числе и ребенка с ДЦП, обладает значительным потенциалом и гибкостью, благодаря которым здоровые участки мозговой ткани могут брать на себя функции поврежденных структур.
Профилактика ДЦП в дородовом периоде состоит в корректном ведении беременности, позволяющем вовремя диагностировать угрожающие плоду состояния и предупредить развитие гипоксии плода. В последующем важное значение для профилактики ДЦП имеет выбор оптимального способа родоразрешения и правильное ведение родов.