Наиболее специфичная реакция на нативный белок основана на явлении белковой ошибки индикатора . [c.509]
Белковая ошибка индикатора [c.42]
Присутствие в растворе белковых веществ и коллоидов, а также нейтральных солей обычно тоже влияет на интервал перехода индикаторов и хотя для титрования применяют лишь те индикаторы, у которых так называемые белковая и солевая ошибки невелики, все же при высоких концентрациях белковых веществ или солей в растворах эти ошибки могут стать значительными. Чтобы исключить влияние всех указанных выше факторов на окончательный результат анализа, каждый раз, когда приходится вести титрование при нагревании или в присутствии неэлектролитов, большого количества солей и т. д., следует устанавливать титр рабочего раствора в тех же самых условиях. Это правило является вообще одним из основных в титриметрическом анализе. [c.253]
Цвет испытуемого и контрольного растворов при открытии белка методом белковой ошибки индикатора [c.510]
При выборе индикаторов следует руководствоваться не только подходящими интервалами перехода окраски, но и тем, что индикатор должен давать стойкую окраску и быть по возможности малочувствительным к изменению ионной силы раствора (солевая ошибка) и к содержанию белков н других коллоидов (белковая ошибка). [c.495]
Метод Гамметта чрезвычайно прост. Поэтому он нашел широкое применение, несмотря на сравнительно малую точность. Следует учитывать, что, с одной стороны, функции диссоциации оснований все же несколько зависят от природы растворителя с другой стороны, индикаторный метод имеет ряд ограничений, а именно окраска индикатора и ее интенсивность зависят не только от pH раствора, но и от присутствия окислителей или восстановителей, от ионной силы раствора, от наличия в растворе белков (белковая ошибка). Уже само введение индикатора влияет на значение pH. При больших [c.498]
В-четвертых, многие индикаторы реагируют с белками, поэтому в белковых системах, в биологических средах индикаторный метод может привести к так называемым белковым ошибкам. [c.413]
Белковые (коллоидные) ошибки. Специфические химические реакции между растворенным веществом (как, например, ионами тяжелых металлов) и индикатором могут привести к заметным ошибкам при определении pH. Влияние, оказываемое белками и коллоидами на результаты измерений pH с помощью индикаторов, обусловлено амфотерностью белковых молекул или зарядом коллоидных частиц. Вероятно, связывание индикаторных красителей сильно зависит от заряда белка оно является наименьшим вблизи изоэлектрической точки. Кларк [9, стр. 185, 186] приводит для некоторых индикаторов значения белковой ошибки, выраженной в единицах pH. [c.152]
Белковая ошибка. В присутствии белков ошибка в определении становится значительной вследствие адсорбции индикатора белками. [c.167]
Очень большие ошибки могут возникнуть также в присутствии белковых веществ, которые связывают индикаторы. При этом окраска индикатора изменяется. Это и есть так называемая белковая ошибка . [c.44]
Оказывается, что в присутствии многих нейтральных солей и белков область перехода окраски индикатора часто меняется, что приводит к большому искажению результатов (солевая ошибка и белковая ошибка). Белковая ошибка обусловлена тем, что белок, присутствующий в исследуемом растворе, адсорбирует индикатор. Искажение результатов получается и вследствие изменения температуры. С повышением температуры изменяется константа диссоциации индикатора. Кроме того, при работе по этому методу возникают затруднения, если исследуемые растворы окрашены или мутны. [c.168]
Оказывается, что в присутствии многих нейтральных солей и белков область перехода окраски индикатора часто меняется, что приводит к большому искажению результатов ( солевая ошибка и белковая ошибка ). [c.206]
Белковая ошибка обусловлена тем, что белок, присутствующий в исследуемом растворе, адсорбирует индикатор. Большое искажение результатов получается вследствие изменения температуры. С повышением температуры изменяется константа диссоциации индикатора. Кроме того, при работе по этому методу возникают [c.206]
Белковая ошибка вызывается наличием в испытуемом растворе белковых веществ, которые, обладая амфотерными свойствами, вступают в реакцию как с кислотными, так и с основными индикаторами и, таким образом, изменяют их свойства. Ввиду этого колориметрический метод определения pH является ненадежным при исследовании концентрированных растворов солей, а также растворов, содержащих белковые вещества в этих случаях пользуются электрометрическим методом, изложенным. в следующей главе. . [c.98]
Неточности определения pH могут зависеть от солевой ошибки, обусловленной высокой концентрацией солей в растворе, изменяющей растворимость и диссоциацию индикатора белковой ошибки, связанной с наличием в растворах белковых веществ (кровь, плазма и др.). Белки, обладающие амфотерными свойствами, могут взаимодействовать как с кислотными, так и с основными индикаторами, а также адсорбировать индикатор, в результате чего произойдет изменение общей концентрации его в испытуемом растворе индикаторной ошибки, обусловленной добавлением значительных количеств индикаторов, которые, являясь хотя и [c.93]
Кислотная ошибка может иметь суш,ественное значение в слабо забуференных и небуферных растворах. В таких растворах более или менее достоверные результаты могут быть получены, если сильно уменьшать количество добавляемого индикатора или частично нейтрализовать его. Причина влияния нейтральных солей заключается в том, что они смеш,аюг равновесие между диссоциированной и недиссоциированной формами индикаторов в связи с изменением коэффициентов активности его ионов. Для устранения солевой ошибки необходимо иметь одинаковую ионную силу в стандартных смесях и в исследуемом растворе. Белковая ошибка возникает главным образом при определении pH в физиологических жидкостях, содержащих белки, которые могут адсорбировать индикаторы. [c.89]
Присутствие в растворе белковых веществ и коллоидов, а также нейтральных солей обычно тоже влияет на показания индикаторов. И хотя для титрования применяют лишь те индикаторы, у которых так называемые белковая и солевая ошибки невелики, все же при высоких концентрациях белковых веществ или солей в растворах эти ошибки могут стать значительными. [c.311]
Чувствительность открытия беака методом белковой ошибки индикатора [c.510]
Белковая ошибка индикатора обусловливается наличием в растворах белковых веществ, которые, обладая амфотерными свойствами, могут взаимодействовать с кислотными и основными индикаторами, а также адсорбировать индиха-тор, изменяя его общую концентрацию в растворе. [c.267]
Возможные ошибки при определении pH колориметрическим методом. Неточности определения pH могут зависеть от солевой ошибки, обусловленной высокой концентрацией солей в растворе, изменяющей растворимость и диссоциацию индикатора от белковой ошибки, связанной с наличием в растворах белковых веществ (кровь, плазма и др.) от индикаторной ошибки, так как белки, обладающие амфотерными свойствами, взаимодействуют с кислотными и основными индикаторами, а также адсорбируют индикатор при этом происходит изменение общей концентрации его в испытуемом растворе таким образо.м, добавление значительных количеств индикаторов, которые, являясь слабыми кислотами и основаниями, могут, особенно в незабуференных растворах, изменять значение pH от температурной ошибки, зависящей от изменения константы диссоциации индикатора при колебаниях температуры так, -нитрофенол имеет при 0 С р/С = 7,30, а при 50° С рК = 6,81 с изменением температуры изменяется и pH стандартных растворов. [c.67]
Большинство индикаторов, принадлежащих к классу азокрасителей, а также конго красный, совершенно неприменимы для измерения pH в белковых растворах. В то же время метил-виолет, родственные ему по составу соединения и соединения группы нитрофенола совершенно не реагируют с белками и потому могут быть использованы при определении pH. Фталеины и сульфофталеины реагируют с нерасщепленными белками, но е реагируют с продуктами их распада и поэтому могут быть употреблены для определения концентрации ионов водорода, обусловленной продуктами распада белков. Для определения pH с индикаторами в белковых средах существует следующее правило чем проще состав индикатора, тем меньше его белковая ошибка, тем более он пригоден для работы. [c.42]
В табл. 6 приведено несколько примеров белковых ошибок индикаторов. Ошибка ДрН при измерении pH белкового раствора с индикатором (рН/п) определяется путем сравнения со значением pH того же раствора, полученного потенциометри-чески (рНэ). [c.42]
Метод Гаммета чрезвычайно прост. Поэтому он нашел широкое применение, несмотря на сравнительно малую точность. Следует учитывать, что, с одной стороны, функции диссоциации оснований все же несколько зависят от природы ] растворителя с другой стороны, индикаторный метод имеет ряд ограничений, а именно окраска индикатора и ее интенсивность зависят не только от pH раствора, но и от присутствия окислителей или восстановителей, от ионной силы раствора, от наличия в растворе белков (белковая ошибка). Уже само введение индикатора влияет на значение pH. При больших интервалах значений pH необходимо пользоваться несколькими индикаторами, что осложняет сопоосавление результатов измерений и, кроме того, серия индикаторов, подобранная для одного растворителя, не будет равноценной в другом растворителе. [c.470]
К сожалению, индикаторные методы не всегда безупречны. Они сомнительны, когда присутствуют в значительном количестве белковые веше-, ства или нейтральные соли (белковая и солевая ошибки) или когда можно опасаться изменения значения р от прибавленного индикатора, что особенно легко может произойти в плохо забуференных растворах в пределе Pj 5—9 (кислотная ошибка). [c.316]
Следует иметь в виду, что определение pH с помощью индикаторов, которое вообще не является особенно точным (до 0,1), в некоторых случаях становится еще менее точным в силу ряда ошибок, свойственных данному методу наиболее важными из этих ошибок являются кислотная, солевая и белковая. Кислотная ошибка обусловлена тем, что сам индикатор, являющийся слабой кислотой или слабым бснованием, изменяет реакцию того раствора, к которому он добавлен. В растворах, обладающих буферными свойствами, кислотная ошибка не проявляется. Для уменьшения кислотной ошибки в небуферных растворах следует добавлять к ним возможно малые количества индикатора. [c.98]
Зайцев Александр Сергеевич, генеральный директор
ООО «Дельта хим-тэк», Москва
Вода является слабым электролитом и диссоциирует по уравнению: H2O ↔ H + + OH – . В чистой воде при 25 °C концентрации [H+] и [OH–] равны. В этом случае раствор имеет нейтральную реакцию. При добавлении к воде кислоты концентрация ионов водорода увеличивается, а концентрация гидроксид – ионов, соответственно, уменьшается, т.е. [H+] > [OH–]. Такой раствор имеет кислую реакцию. При добавлении основания – наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает, т.е. [OH–] > [H+], и такой раствор имеет щелочную реакцию.
Для удобства выражения реакции среды водных растворов была введена специальная величина – рН. Водородным показателем (рН) называют десятичный логарифм концентрации водородных ионов, взятый с обратным знаком:
рН = –lg[H+],
где [Н+] – концентрация ионов водорода, моль/л.
Характер среды определяют качественно – с помощью кислотно-основных индикаторов, полуколичественно – с помощью индикаторных полосок и количественно – потенциометрическим методом.
Кислотно-основные индикаторы представляют собой органические вещества, слабые электролиты, обладающие кислыми или основными свойствами:
HInd ↔ H+ + Ind–,
где HInd – молекулярная форма индикатора,
Ind– – ионная форма индикатора.
Чем больше концентрация Н+-ионов, тем меньше степень ионизации индикатора. Молекулярная HInd и ионная Ind– формы индикатора имеют разные окраски. Если равновесие реакции сдвинуто вправо, в растворе преобладает окраска, характерная для ионной формы индикатора. Если же равновесие сдвинуто влево, в растворе преобладает окраска, характерная для молекулярной формы индикатора. Например, индикатор метиловый оранжевый при рН = 3,1 находится в молекулярной форме, имеющей красный цвет. При изменении рН раствора до 4,4 превалирует ионная форма индикатора, имеющая желтое окрашивание. При определенном соотношении молекулярной и ионной форм индикатора, раствор может иметь промежуточную (переходную) окраску, обусловленную смешением двух различных цветов молекулярной и ионной форм индикатора. Так, при рН = 3,8 раствор метилового оранжевого имеет промежуточную оранжево-красную окраску. Вот почему индикаторы изменяют свою окраску не скачкообразно, а плавно, в определенном интервале значений рН. Исследования показали, что область значений рН, в которой происходит изменение цвета индивидуальных индикаторов, приближенно равна 2 логарифмическим единицам.
Наряду с индивидуальными индикаторами применяют смешанные и универсальные индикаторы, позволяющими измерять рН растворов в более широких интервалах логарифмической шкалы.
ООО «Дельта хим-тэк» производит и реализует индикаторные полоски для определения рН водных растворов в различных интервалах логарифмической шкалы. Индикаторные полоски изготавливаются в виде полимерных полос с закрепленными на них тестовыми зонами, содержащими смесь кислотно-основных индикаторов. При погружении индикаторной зоны полоски в раствор с неизвестным значением pH, индикаторная зона приобретает ту или иную окраску. Сравнивая окраску тестовой зоны с цветовой шкалой, устанавливают pH анализируемого раствора.
Индикаторные полоски производства ООО «Дельта хим-тэк» являются простейшим средством быстрой оценки рН водных растворов, обеспечивают высокую точность исследования по сравнению с бумажными полосками, имеют относительно низкую стоимость, не требуют наличия дорогостоящих приборов, специального оборудования, а также высокой квалификации исполнителя анализа. Кроме того, конструкция индикаторных полосок, включающая гидрофобный пластиковый держатель, позволяет проводить безопасное тестирование агрессивных и токсичных растворов.
При измерении рН индикаторными методами следует учитывать возможные ошибки, приводящие к получению неверного результата анализа.
При измерении небуферных растворов также могут возникать так называемые «кислотные» или «щелочные» ошибки, обусловленные тем, что сам индикатор, являющийся слабой кислотой или слабым основанием, изменяет реакцию анализируемого раствора. Величина данных ошибок может достигать значительных размеров. Так, для чистой воды величина кислотной ошибки может быть свыше 1 единицы рН. В растворах, обладающих буферными свойствами, кислотные и щелочные ошибки не проявляются.
Точность измерения pH зависит от концентрации солей в исследуемом растворе. При концентрации солей порядка 2М возникает так называемая «солевая ошибка», вызванная влиянием солевого фона на растворимость и диссоциацию индикаторов. Абсолютная величина солевых ошибок обычно не превышает 0,2 единиц рН.
При наличии в исследуемом растворе веществ белковой природы, истинное значение рН может быть искажено «белковой ошибкой», обусловленной адсорбцией индикаторов протеинами. Как правило, белковая ошибка возникает при измерении рН физиологических жидкостей. При небольшом содержании протеинов белковая ошибка невелика и, как правило, не превышает 0,2-0,3 единиц рН.
Наличие в исследуемом растворе спиртов приводит при измерении рН колориметрическим методом к так называемой «спиртовой ошибке». Спирт оказывает существенное влияние на величину констант диссоциации индикаторов, вследствие чего интервал перехода окраски индикатора сдвигается. Величина спиртовой ошибки индикаторов в водно-спиртовых растворах может достигать значительных размеров. Например, для фенолфталеина спиртовая ошибка достигает 2,2 единиц рН при содержании спирта 70 об.%.
Искажение результатов анализа может получиться вследствие возникновения температурной ошибки. С изменением температуры изменяется и константа диссоциации индикатора, что приводит к неверному результату анализа. Так, п-нитрофенол при 0°С имеет рК = 7,3, а при 50°С рК = 6,81.
Кроме того иногда происходят ошибки технического порядка, связанные с плохим освещением рабочего места, субъективными возможностями человеческого глаза к восприятию оттенков окраски и т.п.
Однако, несмотря на все эти ограничения, существенным преимуществом колориметрического метода измерения рН с помощью индикаторных полосок является его простота, доступность и отсутствие необходимости в приобретении специальной аппаратуры.
Опубликовано на правах рекламы
Принцип метода:
Относительная
плотность мочи составляет в норме
1,015-1,025 г/см3.
Определение относительной плотности
мочи производят с помощью специальных
ареометров небольшого размера, называемых
урометрами. Урометры бывают двух типов:
первый — для мочи с низкой и нормальной
относительной плотностью (с делениями
от 1,000 до 1,030 г/см3),
второй — для мочи с высокой относительной
плотностью (с делениями от 1,030 до 1,060
г/см3).
ХОД РАБОТЫ
В
небольшой цилиндр с таким диаметром,
чтобы урометр свободно плавал в нем,
наливают по стенке исследуемую мочу и
осторожно погружают в нее урометр.
Производят отсчет, беря ту линию на
шкале урометра, которая соответствует
нижнему мениску жидкости. Все определения
производят при температуре 200С,
поскольку шкала урометра проградуирована
в соответствии с этой температурой.
Если моча имеет другую температуру, то
на каждые 30С
свыше этой температуры нужно прибавить,
а на каждые 30С
ниже – убавить по 0,001 от показания шкалы
урометра.
Обнаружение патологических компонентов мочи
1. Качественные реакции на обнаружение белка в моче – а) проба Геллера с концентрированной азотной кислотой
Принцип метода:
Концентрированная
минеральная кислота НNO3
вызывает денатурацию белка и образует
комплексные соли белка с кислотой. На
границе двух слоев жидкостей образуется
осадок в виде небольшого белого кольца.
Ход работы
В пробирку наливают
1 мл концентрированной НNO3,
наклоняют пробирку под углом 450
и осторожно по стенке пипеткой наслаивают
1мл мочи.
б) проба с
концентрированной сульфосалициловой
кислотой
Принцип метода:
Концентрированная
органическая сульфосалициловая кислота
вызывает денатурацию белка. Выпадение
белка в виде осадка или мути связано с
дегидратацией белковых частиц и
образованием комплексных солей белка
с кислотами.
Ход работы
К 1 мл мочи приливают
3 капли 20% сульфосалициловой кислоты.
При наличии белка в моче образуется
белый осадок.
2. Количественное определение белка в моче с помощью
тест – полоски
«Альбуфан».
Принцип метода:
Тест основан на
принципе «белковой ошибки индикатора».
Реактивная зона содержит кислородный
буфер и специальный индикатор, который
в присутствии белков меняет цвет с
желтого через зеленый до синего.
Тест высокочувствителен
к альбумину и реагирует на его присутствие
в моче при концентрации 0,10-0,15 г/л.
Высокомолекулярные белки, такие как
иммуноглобулины, измеряются с меньшей
чувствительностью, чем альбумины.
Низкомолекулярные белки, такие как
бета-2 микроглобулин, белок Бенс -Джонса
практически не выявляется этим тестом.
Оценка теста:
положительным тест считается в том
случае, если меняется цвет реактивной
зоны. В зависимости от концентрации
альбумина в моче реактивная зона может
приобретать оттенок от зеленого до
синего. Эти оттенки сравниваются с
цветной шкалой, зоны которой соответствуют
концентрации белка 0,3, 1, 3, 10 г/л.
ХОД РАБОТЫ
Тест-полоску, не
касаясь реактивной зоны руками, опустить
на 1-2 секунды в исследуемую мочу так,
чтобы зона была смочена. Затем удалить
излишки мочи с полоски и приблизительно
через 1 минуту сравнить окраску зоны
индикации с цветной шкалой на наборе и
определить количество белка, которое
выражено в г/л.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Белковая ошибка
Cтраница 1
Белковая ошибка обусловлена тем, что белок, присутствующий в исследуемом растворе, адсорбирует индикатор. Искажение результатов получается и вследствие изменения температуры. С повышением температуры изменяется константа диссоциации индикатора. Кроме того, при работе по этому методу возникают затруднения, если исследуемые растворы окрашены или мутны.
[1]
Белковая ошибка обусловлена тем, что белок, присутствующий в исследуемом растворе, адсорбирует индикатор. Большое искажение результатов получается вследствие изменения температуры. С повышением температуры изменяется константа диссоциации индикатора. Кроме того, при работе по этому методу возникают затруднения, если исследуемые растворы окрашены или мутны.
[2]
Белковая ошибка вызывается наличием в испытуемом растворе белковых веществ, которые, обладая амфотерными свойствами, вступают в реакцию как с кислотными, так и с основными индикаторами и, таким образом, изменяют их свойства. Ввиду этого колориметрический метод определения рН является ненадежным при исследовании концентрированных растворов солей, а также растворов, содержащих белковые вещества; в этих случаях пользуются электрометрическим методом, изложенным.
[3]
Белковая ошибка индикатора обусловливается наличием в растворах белковых веществ, которые, обладая амфотерными свойствами, могут взаимодействовать с кислотными и основными индикаторами, а также адсорбировать индикатор, изменяя его общую концентрацию в растворе.
[5]
В табл. 6 приведено несколько примеров белковых ошибок индикаторов.
[6]
Погрешность за счет присутствия коллоидных систем называют белковой ошибкой титрования.
[7]
Кроме того, хингидронному электроду присущи так называемые солевые и белковые ошибки.
[8]
В растворах со значительной концентрацией солей или при наличии в растворах белка наблюдается солевая или белковая ошибка и результаты измерения рН поэтому отклоняются от истинного его значения.
[9]
В-четвертых, многие индикаторы реагируют с белками, поэтому в белковых системах, в биологических средах индикаторный метод может привести к так называемым белковым ошибкам.
[10]
В-четвертых, многие индикаторы реагируют с белками, поэтому в белковых системах, в биологических средах индикаторный метод может привести к так называемым белковым ошибкам.
[11]
Достоинства стеклянного электрода: почти не отравляется; применим в присутствии любого газа; не подвергается влиянию окислителей, восстановителей, коллоидных растворов; применим в мутных и окрашенных растворах, эмульсиях и суспензиях; не имеет белковой ошибки; обеспечивает быстрое определение рН; применим в слабобуферированных растворах.
[12]
Неточности определения рН могут зависеть от солевой ошибки, обусловленной высокой концентрацией солей в растворе, изменяющей растворимость и диссоциацию индикатора; от белковой ошибки, связанной с наличием в растворах белковых веществ ( кровь, плазма и др.); от индикаторной ошибки, так как белки, обладающие амфотерными свойствами, взаимодействуют с кислотными и основными индикаторами, а также адсорбируют индикатор; при этом происходит изменение общей концентрации его в испытуемом растворе; таким образом, добавление значительных количеств индикаторов, которые, являясь слабыми кислотами и основаниями, могут, особенно в незабуференных растворах, изменять значение рН; от температурной ошибки, зависящей от изменения константы диссоциации индикатора при колебаниях температуры; так, — нитрофенол имеет при 0е С рК — 7 30, а при 50 С р / С 6 81; с изменением температуры изменяется и рН стандартных растворов.
[13]
Знак плюс берется, если испытуемый раствор более щелочной, а минус, когда он более кислый по отношению к сравнительному электроду. Область применения хингидронного электрода ограничивается кислой и слабощелочной средами. Кроме того, хингидрон-ному электроду присущи так называемые солевые и белковые ошибки.
[14]
Знак плюс берется, если испытуемый раствор более щелочньш, а минус, когда он более кислый по отношению к сравнительному электроду. Область применения хингидронного электрода ограничивается кислой и слабощелочной средами. Кроме того, хин-гидронному электроду присущи так называемые солевые и белковые ошибки.
[15]
Страницы:
1
2
ИССЛЕДОВАНИЕ КАЛА
Кал — конечный продукт, образующийся в результате сложных биохимических процессов и всасывания конечных продуктов расщепления в кишечнике. Анализ кала является важной диагностической областью, позволяющей поставить диагноз, следить за развитием заболевания и лечения, первично выявить патологические процессы. Исследование кишечного отдела необходимо при обследовании больных, страдающих заболеваниями пищеварительной системы, позволяет судить о некоторых патологических процессах в органах пищеварения и в определенной степени дает возможность оценить состояние ферментативной функции.
ПРАВИЛА СБОРА МАТЕРИАЛА
Предварительная подготовка обследуемого для проведения общего анализа кала (макроскопическое, химическое и микроскопическое исследования) состоит из употребления пищи с дозированным содержанием белков, жиров и углеводов в течение 3-4 дней (3-4 дефекации). Этим требованиям отвечает диета Шмидта и диета Певзнера.
Диета Шмидта — щадящая, включает 1-1,5 л молока, 2-3 яйца всмятку, 125 г слабо прожаренного рубленого мяса, 200-250 г картофельного пюре, слизистый отвар (40 г овсяной крупы), 100 г белого хлеба или сухарей, 50 г масла, общая калорийность 2250 ккал. После ее употребления при нормальном пищеварении остатки пищи в кале не обнаруживаются.
Диета Певзнера основана на принципе максимальной пищевой нагрузки для здорового человека. Она является обычным пищевым рационом здоровых людей, что удобно в поликлинических условиях. В ее состав входит 400 г белого и черного хлеба, 250 г мяса жареного куском, 100 г масла, 40 г сахара, гречневая и рисовая каши, жаренный картофель, салат, квашенная капуста, компот из сухих фруктов и свежие яблоки. Калорийность достигает 3250 ккал. После ее назначения у здоровых людей при микроскопическом исследовании обнаруживаются лишь единичные в редких полях зрения измененные мышечные волокна. Эта диета позволяет выявить даже небольшую степень нарушения переваривающей и эвакуаторной способности желудочно-кишечной системы.
При подготовке больного для исследования на скрытое кровотечение из диеты исключается рыба, мясо, все виды зеленых овощей, помидоры, яйца, лекарственные препараты, содержащие железо (то есть катализаторы, обуславливающие ложно-положительную реакцию на кровь).
Кал собирается после самопроизвольной дефекации в специально предназначенную посуду. Нельзя направлять материал для исследования после клизмы, приема медикаментов, влияющих на перистальтику (беладона, пилокарпин и др.), после приема касторового или вазелинового масла, после введения свечей, препаратов, влияющих на окраску кала (железо, висмут, сернокислый барий). Кал не должен содержать мочи. Доставляется в клинико-диагностическую лабораторию сразу или не позднее 10-12 час после дефекации при условии хранения в холодильнике.
В лаборатории кал подвергается химическому анализу, макроскопическому и микроскопическому исследованию.
ХИМИЧЕСКИЙ АНАЛИЗ КАЛА С ПОМОЩЬЮ ДИАГНОСТИЧЕСКИХ ТЕСТ-ПОЛОСОК НПК «БИОСЕНСОР АН»
Химическое исследование фекалий складывается из определения рН, выявления скрытого воспалительного процесса (слизи, воспалительного экссудата), обнаружения скрытого кровотечения, диагностики обтурации желчевыделительной системы, исследования на дисбактериоз. Для проведения этих исследований возможно применение реагентных тест-полосок, позволяющих определить рН фекалий, наличие белка, крови, стеркобилина, билирубина, лейкоцитов.
Для проведения химического анализа с помощью реагентных полосок и микроскопического исследования кала необходимо приготовить каловую эмульсию.
ПРИГОТОВЛЕНИЕ КАЛОВОЙ ЭМУЛЬСИИ
Небольшое количество фекалий (размером с лесной орех) поместите в центрифужную пробирку и, постепенно добавляя дистиллированную воду, разотрите стеклянной палочкой до консистенции «густого сиропа» (разведение 1:6 — 1:10).
Для химического анализа кала целесообразно использовать реагентные полоски: Уриполиан — для определения рН и белка; Уригем — для определения эритроцитов и гемоглобина; Уриполиан-2 — для обнаружения билирубина и уробилиногена. Для химического анализа кала можно использовать полифункциональные полоски Уриполиан-7 (кровь, кетоны, билирубин, уробилиноген, глюкоза, белок, рН). При этом тест на кетоны при проведении химического исследования кала не используется.
ПРАВИЛА РАБОТЫ С РЕАГЕНТНЫМИ ТЕСТ-ПОЛОСКАМИ
1. Тщательно размещайте каловую эмульсию
2. Стеклянной палочкой нанесите эмульсию на уголок реагентного поля. Нельзя замазывать каловой эмульсией всё реагентное сенсорное поле;
3. Сразу включите секундомер;
4. Наблюдайте изменение или появление окраски реагентного сенсорного поля около каловой эмульсии;
5. По истечении времени, указанного в инструкции к данному тесту, сравните окраску реагентной сенсорной зоны со значением на этикетке упаковки.
рН
Клинические аспекты
В норме у практически здоровых людей, находящихся на смешанной пище, реакция кала нейтральная или слабощелочная (рН 6,8-7,6) и обусловлена жизнедеятельностью нормальной бактериальной флоры толстой кишки.
Кислая реакция (рН 5,5-6,7) отмечается при нарушении всасывания в тонкой кишке жирных кислот.
Резко-кислая (рН менее 5,5) имеет место при бродильной диспепсии, при которой в результате активации бродильной флоры (нормальной и патологической) образуются углекислый газ и органические кислоты.
Щелочная реакция (рН 8,0-8,5) наблюдается при гниении белков пищи (не переваренных в желудке и тонкой кишке) и воспалительного экссудата в результате активации гнилостной флоры и образования аммиака и других щелочных компонентов в толстой кишке.
Резкощелочная (рН более 8,5) — при гнилостной диспепсии (колите).
Принцип метода
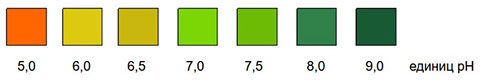
Реагентная сенсорная зона, пропитанная индикатором бромтимоловым синим, меняет окраску в зависимости от концентрации водородных ионов в фекалиях в диапазоне рН от 5 до 9.
Чувствительность
При сравнении с цветом индикаторной шкалы на контейнере значение рН пробы можно определить с точностью до 0,5 единиц рН.
Оценка теста
Цвет реактивной зоны полоски меняется в зависимости от рН исследуемой каловой эмульсии. Цвет реактивной зоны сопоставляется с цветной шкалой сразу же после нанесения пробы на полоску. Цвет отдельных квадратов шкалы соответствует значениям рН 5-6-7-8-9. Если цвет реактивной зоны оказывается между двумя цветными квадратами, то результаты могут быть приведены к целым значениям или к промежуточным значениям с диапазоном 0,5 единиц.
БЕЛОК
Клинические аспекты
В каловых массах здорового человека белка нет. Положительная реакция на белок свидетельствует о наличии воспалительного экссудата, слизи, непереваренного пищевого белка, кровотечения.
Белок в каловых массах обнаруживается при:
— поражении желудка (гастрит, язва, рак);
— поражении двенадцатиперстной кишки (дуоденит, рак фатерова соска, язва);
— поражении тонкой кишки (энтерит, целиакия);
— поражении толстой кишки (колит бродильный, гнилостный, язвенный, полипоз, рак, дисбактериоз, повышенная секреторная функция толстой кишки);
— поражении прямой кишки (геморрой, трещина, рак, проктит).
Принцип теста
Тест основан на принципе «белковой ошибки индикатора». Реактивная сенсорная зона содержит кислотный буфер и специальный индикатор (бромфеноловый синий), который в присутствии белков меняет цвет с желтого через зеленый до синего.
Чувствительность и специфичность
Тест высокочувствителен на белок и реагирует на его присутствие в кале при такой низкой концентрации, как 0.10-0,15 мг/мл каловой эмульсии.
Если реакция каловых масс щелочная или резко щелочная (рН 8,0-10,0), во избежании ложно-положительной реакции необходимо подкислить эмульсию кала несколькими каплями 30 % СНзСООН до рН 7,0-7,5.
Оценка теста
Изменение окраски реагентного сенсорного поля наступает сразу после нанесения исследуемого материала и сравнивается с цветом окрашенных зон на контейнере через 60 секунд.
Окраска реагентного поля:
светло – зеленая – реакция на белок слабоположительная;
зеленая – положительная;
темно – зеленая или зелено-синяя – резкоположительная.
КРОВЬ
Клинические аспекты
Положительная реакция на кровь (гемоглобин) указывает на кровотечение из любого отдела пищеварительного тракта (десен, варикозных вен пищевода и прямой кишки, пораженных воспалительным процессом или злокачественным новообразованием слизистой желудка и кишечника). Кровь в кале появляется при геморрагическом диатезе, язве, полипозе, геморрое. С помощью диагностических полосок выявляется так называемая «скрытая кровь», которая не определяется при макроскопическом исследовании.
Принцип теста
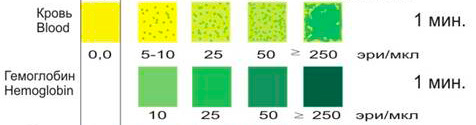
Реагентная зона пропитана кумилгидропероксидом, лимоннокислым буфером и реактивами, усиливающими цветную реакцию. Кумилгидропероксид обеспечивает положительную реакцию с гемоглобином и миоглобином. Тест основан на псевдопероксидазном эффекте гемоглобина, который катализирует окисление хромогена стабилизированной органической гидроперекисью.
Чувствительность и специфичность
Тест специфичен, дает положительный результат в присутствии гемоглобина и миоглобина, обладает очень высокой чувствительностью к гемоглобину. Реакция выпадает положительно при наличии 4000-5000 эритроцитов в 1 мл каловой эмульсии. Реакция может быть положительной в присутствии пероксидаз бактерий, грибов.
Оценка теста
Необходимо обращать особое внимание на скорость появления окраски. Положительная быстрая, возникающая в первые секунды зеленая или темно-зеленая окраска свидетельствует о присутствии эритроцитов или гемоглобина. Появление положительной окраски через 30 секунд и более наблюдается при наличии большого количества мышечных волокон (непереваренная белковая пища), что обычно подтверждается при микроскопическом исследовании кала. Сочетание положительной реакции на белок с быстрой положительной реакцией на кровь (гемоглобин) подтверждает наличие поражения слизистой желудочно-кишечной системы.
УРОБИЛИНОГЕН (СТЕРКОБИЛИНОГЕН)
Клинические аспекты
Стеркобилиноген и уробилиноген являются конечными продуктами катаболизма гемоглобина в кишечнике. Аналитически различить уробилиноген и стеркобилиноген весьма трудно, поэтому термин «уробилиноген» объединяет оба эти вещества. Уробилиноген в значительном количестве всасывается в тонкой кишке. Стеркобилиноген образуется из билирубина в толстой кишке в результате жизнедеятельности нормальной бактериальной флоры (рисунок № 5). В каловых массах здорового человека содержится стеркобилиноген и стеркобилин, в сутки с калом их выделяется 40 — 280 мг Стеркобилиноген бесцветен. Стеркобилин окрашивает фекалии в коричневый цвет.
Отсутствуют стеркобилин и стеркобилиноген в кале при обтурации желчевыводящих путей. Кал становится бесцветным.
Уменьшается содержание стеркобилина в кале при паренхиматозных гепатитах, холангитах; в период внутрипеченочного застоя кал также бесцветен. При остром панкреатите с калом выделяется стеркобилиноген (кал светло-серого цвета).
Содержание стеркобилиногена снижено и определяется билирубин при скрытом дисбактериозе, так как патологическая бактериальная флора толстой кишки не способна восстановить весь билирубин до стеркобилиногена.
Повышается содержание стеркобилина в кале при гемолитических анемиях.
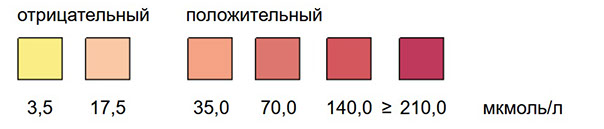
Принцип теста
Определение уровня стеркобилиногена основано на принципе реакции Эрлиха азосочетания стабилизированной диазониевой соли с стеркобилиногеном в кислой среде. Бесцветная реакционная зона в присутствии стеркобилиногена становится розовой или красной.
Чувствительность и специфичность
Тест специфичен для уробилиногена и стеркобилиногена. Положительная реакция отмечается при концентрации стеркобилиногена 3-4 мкг/мл каловой эмульсии.
Реагентная сенсорная зона в присутствии большого количества билирубина становится желтой не ранее чем через 60 секунд, а затем зеленеет. Это практически не влияет на определение содержания стеркобилиногена, так как розовое окрашивание при наличии стеркобилиногена появляется в первые 60 секунд.
Оценка теста
В присутствии стеркобилиногена положительная розовая или малиновая окраска появляется сразу или в течение первых 60 секунд. Отсутствие окраски указывает на обтурацию желчевыделительной системы, розовая или бледно-розовая окраска — на неполную обтурацию, ярко-розовая, малиновая окраска — на норму.
БИЛИРУБИН
Клинические аспекты
В норме билирубин содержится в меконии и фекалиях ребенка, находящегося на грудном вскармливании, примерно до 3-х месячного возраста. К этому времени в желудочно-кишечном тракте появляется нормальная бактериальная флора, которая частично восстанавливает билирубин до стеркобилиногена. К 7-8 месяцу жизни билирубин полностью окисляется кишечной флорой до стеркобилиногена-стеркобилина. У здорового ребенка в 9 месяцев и старше в кале присутствует только стеркобилиноген-стеркобилин.
Обнаружение в кале билирубина указывает на патологию: быстрая эвакуация пищи по кишечнику, тяжелый дисбактериоз (отсутствие нормальной бактериальной флоры в толстой кишке, подавление микрофлоры кишечника при длительном приеме антибиотиков и сульфаниламидных препаратов).
Сочетание стеркобилина с билирубином указывает на появление в толстой кишке патологической флоры и вытеснение ею нормальной (скрытый, вялотекущий дисбактериоз) или быструю эвакуацию химуса по кишечнику.
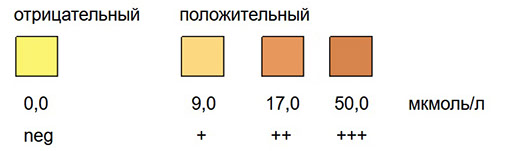
Принцип теста
Метод основан на реакции азосочетания в кислой среде. Реактивная зона содержит р-нитрофенилдиазониевый-р-толуолсульфонат, натриевый бикарбонат и сульфосалициловую кислоту. При контакте с билирубином через 30 секунд появляется пурпурно-красная окраска, интенсивность которой зависит от количества определяемого билирубина.
Специфичность и чувствительность
Тест является специфичным для конъюгированного билирубина. Окраска реактивной сенсорной зоны появляется уже при концентрации билирубина 2,5 – 3,0 мкг/мл каловой эмульсии.
Аскорбиновая кислота в очень высоких концентрациях (примерно 500 мг/л) вызывает слабое розовое окрашивание, которое можно принять за положительный тест. В присутствии стеркобилиногена в очень высокой концентрации (свыше 60 мкг/мл) цвет реагирующей на билирубин реактивной зоны принимает бледно-оранжевый оттенок. В этом случае рекомендуется считывать тест через 90-120 секунд после смачивания реактивной зоны, когда появляется пурпурно-красная окраска, характерная для билирубина.
Оценка теста
В присутствии билирубина реагентная сенсорная зона или в течение 30-60 секунд окрашивается в сиреневатый, сиреневато-розовый или пурпурно-красный цвета в зависимости от количества конъюгированного билирубина. Результат оценивается соответственно как слабоположительный, положительный или резкоположительный.
МАКРОСКОПИЧЕСКОЕ ИССЛЕДОВАНИЕ КАЛА
Количество
Здоровый человек за 24 часа выделяет 100-200 г каловых масс. Преобладание в рационе питания белковой пищи сопровождается уменьшением, растительной — увеличением количества фекалий.
Меньше нормы — при запорах
Больше нормы — при нарушении поступления желчи, недостаточном переваривании в тонкой кишке (бродильная и гнилостная диспепсия, воспалительные процессы), при колите с поносом, колите с изъязвлениями, ускоренной эвакуации из тонкой и толстой кишок.
До 1 кг и более — при недостаточности поджелудочной железы.
Консистенция
Консистенция кала зависит от содержания в нем воды, слизи и жира. Содержание воды в норме составляет 80-85 % и зависит от времени пребывания каловых масс в дистальном отделе толстой кишки, где происходит ее всасывание. При запорах содержание воды снижается до 70- 75 %, при поносах увеличивается до 90-95 %. Гиперсекреция слизи в толстой кишке, воспалительный экссудат придают калу жидкую консистенцию. В присутствии большого количества неизмененного или расщепленного жира кал становится мазевидным или тестообразным.
Плотный, оформленный — кроме нормы бывает при недостаточности желудочного пищеварения.
Мазевидный — характерен для нарушения секреции поджелудочной железы и отсутствия поступления желчи.
Жидкий — при недостаточном переваривании в тонкой кишке (энтерит, ускоренная эвакуация) и толстой кишке (колит с изъязвлением, гнилостный колит или повышенная секреторная функция).
Кашицеобразный — при бродильной диспепсии, колите с поносом и ускоренной эвакуации из толстой кишки, хроническом энтерите.
Пенистый — при бродильном колите.
Овечий — при колите с запором.
Лентовидный, карандашеобразный — при спазме сфинктера, геморроидальных узлах, опухоли сигмовидной или прямой кишки.
Цвет нормальных каловых масс коричневый, обусловлен наличием стеркобилина. При молочной пище окраска кала менее интенсивная, желтая, при мясной пище – темно-коричневая. На окраску кала влияют пигменты растительной пищи, лекарственные препараты. Цвет фекалий меняется при патологических процессах в желудочно-кишечной системе.
Черный или дегтеобразный — при желудочно-кишечных кровотечениях.
Темно-коричневый — при недостаточности желудочного пищеварения, гнилостной диспепсии, колите с запором, колите с изъязвлением, повышенной секреторной функции толстой кишки, запорах.
Светло-коричневый — при ускоренной эвакуации из толстой кишки.
Красноватый — при колите с изъязвлениями.
Желтый — при недостаточности переваривания в тонкой кишке и бродильной диспепсии, двигательных расстройствах.
Серый, светло-желтый — при недостаточности поджелудочной железы. Белый — при интрагепатальном застое или полной обтурации общего желчного протока.
Запах
Запах каловых масс в норме обусловлен присутствием продуктов распада белков (индола, скатола, фенола, орто- и паракрезолов). При обилии белков в пище запах усиливается, при запорах — почти полностью исчезает, так как часть ароматических веществ всасывается.
Гнилостный — при недостаточности желудочного пищеварения гнилостной диспепсии, язвенном колите за счет образования сероводорода и метилмеркаптанов.
Зловонный (запах прогорклого масла) — при нарушении секреции поджелудочной железы, отсутствии поступления желчи (бактериальном разложении жира и жирных кислот).
Слабый — при недостаточности переваривания в толстой кишке, запорах, ускоренной эвакуации по кишечнику.
Кислый — при бродильной диспепсии за счет летучих органических кислот (масляная, уксусная, валериановая).
Масляной кислоты — при нарушении всасывания в тонкой кишке и ускоренной эвакуации.
Остатки не переваренной пищи
Не переваренная белковая, растительная и жировая пища выявляются в каловой эмульсии в чашке Петри на темном и светлом фоне. Мякотная часть растительной пищи видна в виде прозрачных, бесцветных, напоминающих слизь округлых комочков, иногда окрашенных в тот или иной цвет. Обнаружение переваренной клетчатки указывает на быструю эвакуацию пищи или на отсутствие в желудочном соке соляной кислоты. Не переваренная клетчатка диагностического значения не имеет. Не переваренное мясо представлено в виде белесоватых клочков волокнистого строения (мышечные волокна, связки, хрящи, фасции, сосуды).
МИКРОСКОПИЧЕСКОЕ ИССЛЕДОВАНИЕ КАЛА
Приготовление препаратов для микроскопии
1. Препарат
Каплю каловой эмульсии наносят на предметное стекло и покрывают покровным. В этом препарате дифференцируют при микроскопическом исследовании на фоне калового детрита остатки не переваренной белковой пищи — соединительную ткань (рис. № 14), мышечные волокна с исчерченностью и без исчерченности (рис. № 15), остатки не переваренной углеводной пищи (переваренную клетчатку), остатки нерасщепленного и расщепленного жира — капли, иглы, глыбки (рис. № 16). В этом же препарате исследуют слизь и заключенные в ней лейкоциты, эритроциты, цилиндрический эпителий, яйца гельминтов, цисты простейших и вегетативные особи.
2. Препарат
На предметное стекло наносят каплю каловой эмульсии и такую же каплю раствора Люголя (1 г йода, 2 г йодистого калия и 50 мл воды), смешивают и покрывают покровным стеклом. Этот препарат предназначен для выявления нерасщепленного (черный, темно-синий) или частично расщепленного (синий или голубой — амилодекстрин; розовый, красноватый или фиолетовый эритродекстрин) внеклеточного или внутриклеточного крахмала и йодофильной флоры, которая окрашивается йодом в черный и коричневый цвет (рис 17).
3. Препарат
На предметное стекло наносят каплю каловой эмульсии и каплю 20-30 % уксусной кислоты, смешивают, покрывают покровным стеклом. Препарат предназначен для диагностики игл и глыбок солей жирных кислот (мыл). Если в нативном препарате иглы и глыбки при подогревании не превратились в капли (жирные кислоты), то III препарат доводят до кипения над пламенем спиртовки и микроскопируют под большим увеличением. Образование капель после кипячения указывает на наличие в кале солей жирных кислот (мыл).
4. Препарат
Наносят на предметное стекло каплю каловой эмульсии и каплю 0,5 % водного раствора метиленовой сини, смешивают и покрывают покровным стеклом. Этот препарат предназначен для дифференцировки капель нейтрального жира от капель жирных кислот. Капли жирных кислот окрашиваются метиленовой синью в интенсивно синий цвет, а капли нейтрального жира остаются бесцветными (рис. № 18).
5. Препарат
Готовят при наличии слизи, слизисто-кровянистых, гнойных масс, либо тканевых клочков. Отобранные тканевые клочки и слизь промывают в физиологическом растворе, наносят на предметное стекло и покрывают покровным. Этот препарат предназначен для обнаружения лейкоцитов (нейтрофилы, эозинофилы), эритроцитов, цилиндрического эпителия, элементов злокачественных новообразований, простейших и др.
Рис. № 14. Нативный препарат каловой эмульсии: соединительная ткань остатки сосудов, связок, фасций, хрящей, съеденного мяса
Увеличение в 400 раз.
Рис. № 15. Нативный препарат: Мышечные волокна, покрытые соединительной тканью — сарколеммой (с исчерченностью) и без исчерченности.
Увеличение в 400 раз.
Рис. № 16. Нативный препарат: расщепленный жир, представленный глыбками и иглами (соли жирных кислот и жирные кислоты).
Увеличение в 400 раз.
Рис. 17. Препарат: с растровом Люголя: крахмал нерасщепленный доамилодекстрина (голубой) ирасщепленный до эритродекстрина (розовый), расположенный внутриклеток переваримой клетчатки. Йодофильная флора нормальная (клостридии) и патологическаяпалочки и кокки, окрашенные раствором Люголя в черный цвет.
Увеличение в 400 раз.
Рис. 18. Нативный препарат: капли нейтрального жира и жирных кислот). Препарат с метиленовой синью: капли непйтрального жира бесцветные, капли жирных кислот окрашены в синий цвет.
Увеличение в 400 раз.
КОПРОЛОГИЧЕСКИЕ СИНДРОМЫ (МИКРОСКОПИЧЕСКОЕ ИССЛЕДОВАНИЕ)
Нормальный кал
На фоне большого количества детрита встречаются единичные в редких полях зрения лишенные исчерченности (сарколеммы) мышечные волокна и скудное количество солей жирных кислот (мыл).
Недостаточность желудочного пищеварения
Ахилия (ахлоргидрия) — большое количество мышечных волокон, покрытых сарколеммой (с исчерченностью) и расположенных преимущественно пластами (креаторрея), соединительная ткань, пласты переваренной клетчатки и кристаллы оксалата кальция.
Гиперхлоргидрия — большое количество покрытых сарколеммой, разрозненно лежащих мышечных волокон (креаторрея) и соединительная ткань.
Быстрая эвакуация пищи из желудка — разрозненно лежащие мышечные волокна с исчерченностью и без нее.
Недостаточность поджелудочной железы.
Большое количество нейтрального жира (стеаторрея), переваренные (без исчерченности) мышечные волокна (креаторрея).
Нарушение желчеотделения (ахолия).
При быстрой эвакуации химуса по кишечнику выявляется большое количество жирных кислот (стеаторрея).
При запорах — стеаторрея представлена мылами (жирные кислоты реагируют с ионами К, Са, Мg, Na, Рнеорг., образуя соли жирных кислот — мыла). Стеаторрея при ахолии объясняется отсутствием желчных кислот, способствующих всасыванию жирных кислот.
Нарушение всасывания в тонкой кишке.
Нарушение всасывания в тонкой кишке любой этиологии характеризуется стеаторреей, выраженной в большей или меньшей степени, и представленной жирными кислотами при поносах или солями жирных кислот при нормальной эвакуации химуса по кишечнику или запорах.
Недостаточность пищеварения в толстой кишке.
Бродильный дисбиоз (передозировка углеводов) — большое количество переваренной клетчатки. В препарате с раствором Люголя выявляется крахмал, расположенный внутри- и внеклеточно, и нормальная иодофильная флора (клостридии). Переход бродильного дисбиоза в дисбактериоз (колит) характеризуется появлением слизи с лейкоцитами и цилиндрическим эпителием, при этом слизь обычно смешана с каловым детритом и появлением патологической йодофильной флоры (мелкие кокки, мелкая и крупная палочковая флора).
Гнилостная диспепсия (колит) — кристаллы триппельфосфатов указывают на сдвиг рН в щелочную сторону и усиленный процесс гниения в толстой кишке.
Язвенный колит.
В свежевыделенных слизисто-гнойно-кровянистых массах на фоне нейтрофилов, эритроцитов и цилиндрического эпителия можно обнаружить вегетативные формы патогенных простейших (Еnt. histolytica, Bal. coli), иногда эозинофилы и кристаллы Шарко-Лейдена (аллергический неспецифический колит или аллергическая реакция на простейшие).
Замедленная эвакуация из толстой кишки (запор, спастический колит).
Запор и спастический колит характеризуется при микроскопии большим количеством детрита и непереваренной клетчатки. Обнаружение слизи, содержащей дистрофически измененные клеточные элементы (лейкоциты и цилиндрический эпителий), указывает на наличие воспалительного процесса.
ОСОБЕННОСТИ ПИЩЕВАРЕНИЯ И КОПРОГРАММЫ ДЕТЕЙ ГРУДНОГО ВОЗРАСТА В НОРМЕ И ПРИ ПАТОЛОГИИ
Пищеварительный тракт плода начинает функционировать на 16-20 неделях внутриутробного развития. В этот период хорошо выражен глотательный рефлекс, слюнные железы вырабатывают амилазу, желудок — пепсиноген. Развивающийся плод заглатывает амниотическую жидкость, близкую по химическому составу к интерстициальной (тканевой и спинномозговой), содержащую белок и глюкозу.
рН желудка новорожденного составляет 6,0, снижается до 1,0 — 2,0 в первые 6-12 часов жизни, к концу первой недели повышается до 4,0, затем постепенно снижается до 3,0. Пепсин не играет существенной роли в переваривании белка у новорожденного. Энзиматическая обработка белка грудного молока происходит в двенадцатиперстной и тонкой кишке.
Кишечник грудного ребенка в 8 раз превышает длину его тела. В результате последовательного подключения ферментов поджелудочной железы (трипсина, хемотрипсина) и протеолитических ферментов тонкой кишки происходит почти полная утилизация молочного белка. Ребенок при грудном вскармливании усваивает до 98 % аминокислот.
Липолиз при грудном вскармливании в первую неделю жизни осуществляется в полости желудка за счет липазы материнского молока. Максимум действия молочной липазы достигается при рН 6,0 — 7,0. Дальнейший липолиз происходит в двенадцатиперстной кишке под действием липазы поджелудочной железы. Уже в первые недели и месяцы жизни ребенка в тонкой кишке всасывается 90 — 95 % расщепленного жира.
Гидролиз углеводов в полости рта и желудка новорожденного незначительный и в основном сосредоточен в тонкой кишке, где на поверхности микроворсинок щеточной каймы энтероцитов расщепляются лактоза, сахароза и мальтоза.
Первородный кал (меконий)
Выделение мекония наступает через 8-10 час после рождения и продолжается в течение 2-3 дней в количестве 70-100 г. Консистенция мекония клейкая, вязкая, густая, цвет темно-зеленый, запаха нет; рН 5,0-6,0;
реакция на билирубин положительная.
Первая порция мекония выполняет роль пробки, состоит из слизи, на фоне которой видны пласты ороговевшего плоского эпителия, единичные клетки цилиндрического эпителия прямой кишки, капли нейтрального жира, представляющие первородную смазку, кристаллы холестерина и билирубина.
Бактериальная флора появляется в фекалиях новорожденного только при последующих дефекациях.
Меконий рекомендуется исследовать в родильных домах для диагностики у новорожденных кишечной формы муковисцедоза. Для этого можно использовать диагностическую полоску АЛЬБУ-ФАН. Постановка диагноза основана на повышенном количестве альбумина при муковисцедозе. Бесцветное реагентное поле через 1 мин после опускания в меконий принимает зеленую или темно-зеленую окраску. Диагностическая ценность невелика, ложно-положительные результаты составляют около 90 %, подтверждение диагноза требует микроскопического анализа кала у грудных детей.
Кал здорового ребенка при грудном вскармливании
Количество кала в первый месяц жизни — 15 г, а затем постепенно увеличивается до 40-50 г за 1-3 дефекации в сутки. Это гомогенная, неоформленная масса полувязкая или полужидкая, золотисто-желтого, желтого или желто-зеленого цвета со слегка кисловатым запахом, рН 4,8-5,8
Кислая среда фекалий объясняется жизнедеятельностью обильной сахаролитической флоры, выраженными ферментативными процессами и большим содержанием лактозы.
Реакция на билирубин остается положительной до 5-месячного возраста, затем параллельно с билирубином начинает определяться стеркобилин в результате восстанавливающего действия нормальной бактериальной флоры толстой кишки. К 6-8 месячному возрасту в кале определяется только стеркобилин.
При микроскопическом исследовании кала на фоне детрита обнаруживаются единичные капли нейтрального жира и скудное количество солей жирных кислот. Слизь в незначительном количестве присутствует в кале грудного ребенка, перемешана с ним и содержит не более 8-10 лейкоцитов в поле зрения.
Кал здорового ребенка при искусственном вскармливании
Количество кала 30-40 г в сутки. Цвет светло- или бледно-желтый, при стоянии на воздухе становится серым или бесцветным, но может принимать коричневые или желтовато-коричневые оттенки в зависимости о характера пищи, рН 6,8-7,5 (нейтральная или слабощелочная реакция). Запах неприятный, слегка гнилостный за счет гниения казеина коровьего молока.
При микроскопическом исследовании выявляется несколько увеличенное количество солей жирных кислот. В скудном количестве слизи, смешанной с фекалиями, встречаются единичные лейкоциты.
Острый энтерит у ребенка грудного возраста сопровождается сдвигом рН в щелочную или резко щелочную сторону и положительной реакцией на кровь. Кал становится жидким или полужидким с большим количеством слизи. Комки слизи в жидких фекалиях указывают на возникновение фолликулярного энтерита. При микроскопическом исследовании выявляются жирные кислоты и тяжи слизи, содержащие лейкоциты.
Появление капель нейтрального жира свидетельствует о недостаточном поступлении липазы из-за отека слизистой двенадцатиперстной кишки.
Если явления острого энтерита ликвидированы, характер каловых масс грудного ребенка нормализовался, но при микроскопическом исследовании выявляется большое количество солей жирных кислот (мыл), — это свидетельствует о продолжающемся нарушении кишечного всасывания (хронический энтерит). При этом из организма выводятся ионы калия, кальция, фосфора, натрия и др., что может быстро привести к рахиту.
Нарушение кишечного всасывания, вызванное врожденной несостоятельностью энтероцитов и энзиматической недостаточностью
Глютеновая энтеропатия (целиакия или целиакическая болезнь). Развивается при врожденной недостаточности 1-глютамилпептидазы, характеризуется нарушением расщепления глютена. В процессе расщепления глютена образуется глютамин, который вызывает аллергическую реакцию и тормозит регенерацию эпителия тонкой кишки.
Целиакия проявляется у детей с момента прикорма мучнистыми веществами, содержащими глютен (пшеничная и ржаная мука, рис, овес).
Жидкие каловые массы стеаторрейного характера выделяются до 5-10 раз в сутки цвета «мастики» с отвратительным затхлым запахом. Реакция кала слабокислая или нейтральная (рН 6,5 — 7,0).
Билирубин и стеркобилин определяются соответственно возрасту ребенка. При микроскопическом исследовании — жирные кислоты (стеаторрея) свидетельствуют о нарушении всасывания в тонкой кишке.
Синдром дисахарозной недостаточности (непереносимость углеводов)
Синдром обусловлен отсутствием в тонкой кишке новорожденного лактозы, реже сахаразы. Лактозная недостаточность (непереносимость лактозы грудного молока) определяется в первые дни жизни новорожденного. У грудного ребенка 8-10 раз в сутки выделяется кал водянистый или жидкий, желтого цвета с кислым запахом. рН кала 5,0-6,0, реакция на билирубин положительная.
При микроскопическом исследовании — жирные кислоты (стеаторрея). Невсосавшаяся лактоза поступает в толстую кишку, подвергается ферментации сахаролитической флорой, в результате чего образуется огромное количество молочной кислоты, которая раздражает слизистую оболочку толстой кишки и повышает ее проницаемость, вследствие чего лактоза частично всасывается с водой и обнаруживается в моче.
А-бета-липопротеинемия (акантоцитоз)
Наследственная неспособность синтезировать бета-липопротеины, выявляется в раннем детском возрасте. В периферической крови больных обнаруживаются акантоциты и отсутствие бета-липопротеинов. Кал жидкий, светло-желтого и золотисто-желтого цвета с кислой реакцией (рН 5,0-6,0) и наличием билирубина. На поверхности жидких фекалий хорошо виден налет жира. При микроскопическом исследовании — жирные кислоты (стеаторрея).
Муковисцедоз или кистозный фиброз (кишечная форма)
Наследственное заболевание, характеризуется нарушением секреторной функции поджелудочной железы, желез желудка и кишечника. Дети грудного возраста страдают полифекалией: частый, обильный, кашицеобразный стул с резким зловонным запахом, серого цвета, блестящий, жирный, реакция нейтральная или слабо-кислая (рН 6,5-7,0). На пеленках образуются жирные пятна, которые плохо отстирываются. У детей старшего возраста (6-7 месяцев)возможна наклонность к запорам — кал плотный, оформленный, иногда «овечий», но всегда бледно окрашенный, жирный, со зловонным запахом. Жир иногда выделяется каплями в конце дефекации. Возможна кишечная непроходимость.
При микроскопическом исследовании — капли нейтрального жира (стеаторрея), что подтверждает кистозное перерождение поджелудочной железы (отсутствие липазы) в 80-88 % случаев заболевания. Кистозное перерождение пищеварительных желез желудка и тонкой кишки проявляется в период перехода с грудного на смешанное кормление и подтверждается при микроскопическом исследовании большим количеством непереваренных мышечных волокон, соединительной ткани, переваренной клетчатки, крахмала и каплями нейтрального жира. Это свидетельствует о нарушении гидролиза, протеолиза и липолиза.
Экссудативная энтеропатия
Заболевание характеризуется потерей белков плазмы желудочно-кишечным трактом и сопровождается нарушением кишечного всасывания.